Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
GBUZ Inter-District Medical Rehabilitation Center, St. Petersburg
Summary
The aim of the study: a comparative analysis of the effectiveness of the use of pregabalin in the integrated therapy of nonsicidal autoaggressive behavior in patients with paranoid schizophrenia. It was established that the positive clinical effect of pregabalin within the framework of complex therapy is due to the polymodal action of the drug in relation to leading psychopathological manifestations in this group of patients.
Keywords: pregabalin, antipsychotics, paranoid schizophrenia, non-sicidal autoaggression.
For citation: I.V. Kravchenko. Experience in the use of Pregabalin in the complex therapy of nonsuicidal autoaggressive behavior in patients with paranoid schizophrenia. Psychiatry and psychopharmacotherapy. 2021; 1: 20–24.
Одним из способов оптимизации проводимой терапии является присоединение адъювантных лекарственных средств к базовым препаратам нейролептического ряда.
В качестве одного из вариантов усиления нейролептической терапии является дополнительное назначение противосудорожных препаратов. Обладая полимодальным действием, такие препараты оказывают нормотимический и анксиолитический эффекты, снижают уровень агрессивных и суицидальных побуждений у данной группы больных [1, 10, 13, 16, 17, 22, 27, 28, 32].
Продолжением стратегии по использованию комбинированной лекарственной терапии у больных с параноидной шизофренией явилось использование у данной группы лиц противосудорожного препарата последней генерации – прегабалина. Теоретическими предпосылками к успешному использованию данного препарата у больных шизофренией послужил выявленный эффект при лечении им широкого круга психо-неврологических расстройств, протекающих с тревогой. И кроме того, особенность фармакокинетического профиля прегабалина в виде отсутствия клинически значимого взаимодействия его с системой цитохрома P-450 – в частности, с семейством CYP2D6. Это позволяет избежать колебаний концентрации применяемых нейролептических препаратов, метаболизм которых, напротив, тесно связан с данной ферментной системой [23, 25].
Также клинически значимым является фармакодинамический профиль прегабалина, предусматривающий снижение высвобождения некоторых нейротрансмиттеров, таких как глутамат, норадреналин и дофамин; и, напротив, способность повышать уровень гамма-аминомасляной кислоты (ГАМК), опосредуя cобственно анксиолитический эффект [14].
Однако, несмотря на имеющиеся теоретические обоснования к его применению у больных, страдающих шизофренией, в ряду исследователей не сформировалось единое мнение по его использованию в качестве адьювантного препарата у данной группы лиц [18,26].
В мировой литературе описан результат по краткосрочному применению прегабалина у больных шизофренией в суточной дозе 100 мг [29]. Также несомненный интерес представляют следующие три исследования, результаты которых должны быть приняты во внимание при дальнейших попытках использования прегабалина у больных шизофренией. В одном из них описан случай психоз-индуцированного действия прегабалина, при его отмене [19]. Второй случай связан с усилением аутоагрессивной активности на фоне приема прегабалина [12, 30]. Наконец, в третьем исследовании заявлен риск формирования аддиктивного поведения, связанный с препаратом [24]. К сожалению, подобные сообщения носят разрозненный характер, без глубокого клинико-катамнестического анализа, что не позволяет сделать однозначные выводы относительно клинического потенциала данного препарата.
Вместе с тем клиническая целесообразность диктует необходимость поиска новых схем медикаментозной коррекции в поисках эффективных схем терапии больных параноидной шизофренией, в том числе с несуицидальным аутоагрессивным поведением (НААП). И препарат прегабалин является одним из перспективных препаратов в терапии данной группы больных, что и обуславливает актуальность данного исследования.
Цель исследования: сравнительный анализ эффективности применения прегабалина в комплексной терапии НААП у больных параноидной шизофренией.
 Всего обследовано 53 больных с параноидной шизофренией, проходивших лечение в период 2016-2020 гг. в Межрайонном центре Медицинской Реабилитации г. Санкт-Петербурга и многопрофильном медицинском центре «Профимед». Из них 44 – мужчины и 9 – женщины, все в возрасте от 25 до 45 лет. Средний возраст обследуемых составил 33,2 года. Средняя длительность заболевания – 11,2 года. Тип течения заболевания – непрерывно-прогредиентный.
Всего обследовано 53 больных с параноидной шизофренией, проходивших лечение в период 2016-2020 гг. в Межрайонном центре Медицинской Реабилитации г. Санкт-Петербурга и многопрофильном медицинском центре «Профимед». Из них 44 – мужчины и 9 – женщины, все в возрасте от 25 до 45 лет. Средний возраст обследуемых составил 33,2 года. Средняя длительность заболевания – 11,2 года. Тип течения заболевания – непрерывно-прогредиентный.
Критериями включения в исследование служили:
1) Наличие несуицидальных самоповреждений;
2) Неэффективность проводимой комбинированной фармакотерапии не менее чем двумя нейролептиками, назначаемыми поочередно, в рекомендованных дозировках, согласно инструкции по применению препаратов, и продолжительностью не менее 3 месяцев;
3) Не менее 6 месяцев суммарного пребывания в психиатрическом стационаре за последние три года.
Критерии невключения:
1) Психотический уровень переживания;
2) Аутоагрессивные действия суицидальной направленности или в рамках асфиксиофилии.
Все больные находились в состоянии медикаментозной ремиссии с признаками нарастающего процессуального дефекта личности.
Под ремиссией подразумевалось «ослабление и смягчение всей симптоматики, обеспечивающее в той или иной степени социальное и трудовое приспособление больного, и обнимающее широкий диапазон состояний от граничащих с практическим восстановлением до тех, при которых уже отчетливо выступают симптомы дефекта» [3, 4, 5, 7].
Под шизофреническим дефектом понимались «последствия психического заболевания, которые наступают в условиях полной остановки процесса, приводят к стойкому (и не прогрессирующему) выпадению или диссоциации психических функций с изменением личности и сопровождаются снижением ее функционирования» [7].
Под определение «несуицидальные аутоагрессивные действия» или «НААД» попадали самые разные действия, направленные против своего здоровья и сопровождавшиеся нарушением целостности (функций) органов или систем органов. При этом отсутствовала любая демонстрация намеренья покончить жизнь самоубийством [6].
Учитывая отсутствие официальных показаний к назначению прегабалина для коррекции НААП, у всех принимавших участие в исследовании было получено информированное согласие (принцип off-label).
Обследуемые соответствовали следующей клинической характеристике. Наследственность психопатологически была отягощена у 46 % больных. Раннее развитие без задержки. У 78 % больных отмечались девиантные черты в премордибной структуре личности. Среди них доминировали шизоидные и истеро-возбудимые черты. У 36 % воспитание протекало в неполных семьях, в условиях гипоопеки. Ретроспективно можно утверждать, что продромальный период возникал в среднем в возрасте 11-13 лет, в виде усиления неврозо- и психопатоподобной симптоматики. У 27% были выявлены тревожно-боязливые черты, ипохондрические явления, склонность к непреодолимо навязчивым действиям, ритуалам; нарастание замкнутости, социальной отгороженности. У 73% отмечалось формирование конфликтного стиля общения. Больные легко вступали в непродуктивные споры, не терпя возражений; отмечалось карикатурно-утрированное стремление к независимости, манкирование своими обязанностями, пропуски школы, совершение делинквентных поступков. Также этот период характеризовался началом массивного потребления психоактивных веществ. Отсутствие иных способов совладания с тревожностью либо отсутствие условий для реализации агрессивных побуждений приводили к осуществлению и последующему закреплению НААП. Самоповреждения наносились в виде поверхностных порезов в области предплечий, внутренней поверхности бедра, голени. Первый психотический эпизод состоял из признаков психического автоматизма, открытости мыслей окружающим, ощущения воздействия и преследования, слуховых галлюцинаций. После купирования психотических переживаний заболевание носило непрерывно-прогредиентный характер.
Эпизоды психотической симптоматики отличались наличием психомоторного возбуждения, агрессивностью, проявлениями галлюцинаторно-бредовой симптоматики на фоне отсутствия критики к своему состоянию. Выраженность психопатологических переживаний обусловливала частоту госпитализаций в психиатрические стационары, в среднем, 1,6 госпитализации на человека в год. Медикаментозная ремиссия была крайне неустойчивой и сопровождалась неуклонным нарастанием процессуального дефекта. В динамике последнего отмечались выделенные Д. Е. Мелеховым (1963) т.н. «эпизодические периоды кратковременных, неадекватных ситуации колебаний настроения и активности». Больные оставались эмоционально неустойчивые, конфликтные, демонстрировали неспособность к целенаправленной волевой деятельности, находясь на иждивении ближайших родственников. Усиливалось эмоциональное огрубление, сужение круга интересов до уровня удовлетворения простейших бытовых потребностей (потребление чая, кофе, курение). Со стороны мышления отмечалась его непоследовательность, элементы резонерства, ментизма.
 Участие в психотерапии и прием медикаментов происходило только при активном контроле со стороны ближайших родственников. Собственно НААД носили неоднократный характер, реализуясь без борьбы мотивов, по принципу наибольшей доступности метода и локализации самоповреждений. После их нанесения большинство обследуемых отмечало сохранение высокого уровня протопатической тревоги, раздражительности, гневливости (36 больных).
Участие в психотерапии и прием медикаментов происходило только при активном контроле со стороны ближайших родственников. Собственно НААД носили неоднократный характер, реализуясь без борьбы мотивов, по принципу наибольшей доступности метода и локализации самоповреждений. После их нанесения большинство обследуемых отмечало сохранение высокого уровня протопатической тревоги, раздражительности, гневливости (36 больных).
Выбор конкретных лекарственных препаратов для исследования был обусловлен принципом их наибольшей встречаемости в практической работе с данными пациентами. На момент включения в исследование обследуемые получали монотерапию палиперидоном и галоперидолом не менее трех месяцев – в средних дозах 6,8 и 18,4 мг в сутки соответственно. Назначению антиконвульсантов предшествовала смена терапии нейролептиками, назначение на срок в три недели рисперидона в сочетании с хлорпротиксеном в средних дозах 6,6 мг и 78,8 мг соответственно. В случае сохранения субъективных жалоб на тревожность, раздражительность, нарушения сна, декларированное стремление или попытки совершения НААД больным назначались прегабалин, карбамазепин и вальпроевая кислота в произвольном порядке, с выходом на предполагаемо-эффективные дозы в течение трех дней. Уровень последних определялся эмпирическим путем. Параллельно все пациенты проходили идентичный курс эмоционально-стрессовой психотерапии.
Таким образом больные были разделены на три группы. В основную группу вошли больные, находившиеся на комбинированной терапии рисперидоном, хлорпротиксеном и прегабалином (18 чел.). Средняя суточная дозировка препаратов составила 6,4 мг / 86,8 мг / 450 мг в сутки соответственно. Контрольные группы N1 и N2 составили больные, принимавшие препараты в следующих сочетаниях: рисперидон+ хлорпротиксен + вальпроевая кислота (20 чел.), а также рисперидон+хлорпротиксен+ карбамазепин (14 чел.). Cредняя суточная дозировка препаратов в первой контрольной группе составила 6,5 мг / 87,8 мг / 1240,0 мг в сутки, и во второй контрольной группе – 6,8 мг / 87,4 мг / 1180 мг в сутки соответственно. Роль гендерного фактора в структуре эффективности проводимой терапии не оценивалась в силу статистически малого числа респондентов женского пола. Если больные прерывали прием препаратов менее чем на 7 дней подряд и не более двух раз, то считались продолжающими участие в исследовании.
Для оценки результатов исследования использовался клинико-катамнестический, психометрический и статистический методы. В рамках психометрической оценки использовались шкалы: Плучека, Юдовского, шкала Краткой Психиатрической Оценки и шкала Социального функционирования [8]. Оценка клинико-психопатологического состояния производилась на момент включения в исследование, на 30 и 90 дни исследования. Частота НААД оценивалась в течение 3 месяцев после включения в исследование соответственно. Статистические различия определялись с помощью критерия Фишера. Статистически значимыми признавались различия при p=0,05.
Среди последних были выделены два клинических варианта:
• Первый вариант характеризовался спонтанно возникающим состоянием психомоторной заторможенности, чувства тревоги, тоски, вялости, проходящих в течение
5-7 дней.
• Второй вариант отличался диаметрально противоположным вектором психомоторной активности в виде раздражительности, суетливости, моторного возбуждения.
Общим для обоих вариантов было ухудшение когнитивных функций в форме ментизма, шперрунга, ухудшения функции запоминания и воспроизведения ранее полученной информации, слабости внимания, негативизма в отношении проводимой терапии. Такие больные становились дезорганизованные, не могли и не хотели участвовать в психотерапевтических мероприятиях.
У 3 больных первой группы сравнения и у 8 больных второй группы сравнения отмечались случаи краткосрочного отказа от приема базовой терапии. Среди обследуемых основной группы случаев временного отказа от терапии зафиксировано не было. Собственно, несуицидальные самоповреждения, с целью снижения выраженности психопатологических переживаний, наносились при любом упомянутом варианте течения процессуального дефекта.
В ходе присоединения позитивной психопатологической продукции суицидальной активности не происходило. Подобные эпизоды течения процессуального дефекта субъективно легче переносились больными, принимавшими прегабалин (12 чел.) и вальпроевую кислоту (13 чел.), нежели больными, принимавшимикарбамазепин (5 чел.). Это уменьшало необходимость прибегать к т.н. «терапии прикрытия», роль которой выполнял феназепам «per os», в среднесуточной дозе 2 мг, в течение 7 дней. Его назначение потребовалось трем больным основной группы, 6-ти и 11-ти больным первой и второй группы сравнения соответственно. Количество случаев НААД составило за весь период наблюдения 1,3 случая в основной группе, 1,2 и 2,6 случая – в первой и второй группах сравнения соответственно.
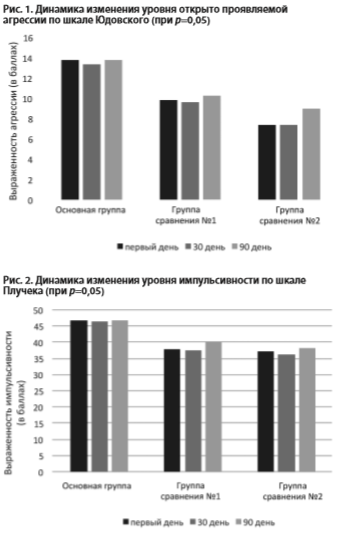
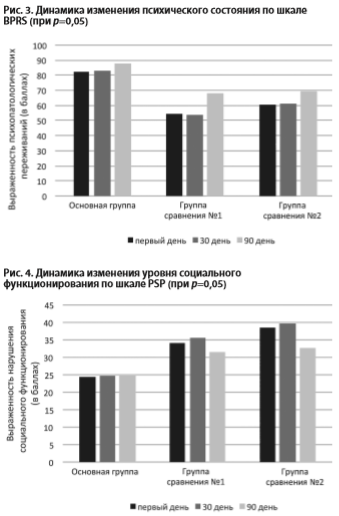
Приведенные выше данные клинического наблюдения подтверждались с помощью психометрических шкал Юдовского и Плучека, а также шкалы краткой психиатрической оценки BPRS (рис. 1, 2, 3).
Обследуемые основной и первой группы сравнения демонстрировали более выраженное улучшение навыков социального функционирования, нежели больные второй группы сравнения (рис. 4).
Полученные результаты демонстрируют, что прием прегабалина в рамках комплексной терапии у исследуемых лиц способствует реализации анксиолитического эффекта в более ранние сроки, носящего устойчивый характер. Механизмом реализации заявленного эффекта, по-видимому, служит большая тропность прегабалина к ГАМК-ергической системе, по сравнению с заявленными протисудорожными препаратами из групп сравнения. Также различия в реализуемом клиническом эффекте прегабалина и препаратов сравнения могут быть обусловлены их фармакокинетическими различиями.
В рамках рабочей гипотезы можно предположить, что прегабалин в большей степени потенцирует общий успокоительный эффект нейролептических препаратов за счет отсутствия клинически значимого взаимодействия его с системой цитохрома p-450 – в частности его изоферментной группой CYP2D6. Важную роль в прогнозировании клинического эффекта играет всесторонняя оценка процессуального дефекта, представляющего собой неуклонно-прогредиентную и малообратимую психопатологическую конструкцию.
Полноценная оценка эффективности терапии в отношении последней может происходить лишь при последовательной реализации интегрированных психо-фармакологических схем лечения, превышающих сроки данного исследования [11]. Следует учитывать и этнические и расовые различия в метаболизме психотропных препаратов, что может ухудшить переносимость и эффективность проводимого лечения, которые не были рассмотрены в данном исследовании в силу отсутствия материальных условий для их проведения [15].
Поскольку уточнение побочных эффектов от приема прегабалина не было заявленной целью исследования, данный вопрос требует дальнейшего изучения. По косвенным признакам – по отсутствию случаев отказа от лечения по причине плохой переносимости, а также более активному участию их в психотерапевтических мероприятиях, прегабалин обладает более сбалансированными фармакологическими характеристиками, по сравнению с группами сравнения. Также требует уточнения вопрос парадоксального усиления несуицидальной аутоагрессивной активности и риск формирования зависимости при длительном приеме прегабалина, упомянутых рядом авторов [20]. По результатам настоящего исследования подобные психопатологические явления выявлены не были.
Сведения об авторе:
Кравченко Игорь Владимирович, кандидат медицинских наук, врач высшей категории, врач-психиатр, психотерапевт, психиатр-нарколог, клинический фармаколог, терапевт. Межрайонный центр медицинской реабилитации ГБУЗ “Поликлиника N38”, СПб., Россия Е-mail: igorkravchenk@mail.ru
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2021
Опыт применения прегабалина в комплексной терапии несуицидального аутоагрессивного поведения у больных параноидной шизофренией №01 2021
Номера страниц в выпуске:20-24
Резюме
Цель работы заключалась в проведении сравнительного анализа эффективности применения прегабалина в комплексной терапии несуицидального аутоагрессивного поведения у больных параноидной шизофренией. Установлено, что положительный клинический эффект прегабалина в рамках комплексной терапии обусловлен полимодальным действием препарата в отношении ведущих психопатологических проявлений у данной группы больных.
Ключевые слова: прегабалин, нейролептики, параноидная шизофрения, несуицидальная аутоагрессия.
Для цитирования: И.В. Кравченко. Опыт применения прегабалина в комплексной терапии несуицидального аутоагрессивного поведения у больных параноидной шизофренией. Психиатрия и психофармакотерапия. 2021; 1: 20–24.
Цель работы заключалась в проведении сравнительного анализа эффективности применения прегабалина в комплексной терапии несуицидального аутоагрессивного поведения у больных параноидной шизофренией. Установлено, что положительный клинический эффект прегабалина в рамках комплексной терапии обусловлен полимодальным действием препарата в отношении ведущих психопатологических проявлений у данной группы больных.
Ключевые слова: прегабалин, нейролептики, параноидная шизофрения, несуицидальная аутоагрессия.
Для цитирования: И.В. Кравченко. Опыт применения прегабалина в комплексной терапии несуицидального аутоагрессивного поведения у больных параноидной шизофренией. Психиатрия и психофармакотерапия. 2021; 1: 20–24.
Experience in the use of Pregabalin in the complex therapy of nonsuicidal autoaggressive behavior in patients with paranoid schizophrenia
I.V. KravchenkoGBUZ Inter-District Medical Rehabilitation Center, St. Petersburg
Summary
The aim of the study: a comparative analysis of the effectiveness of the use of pregabalin in the integrated therapy of nonsicidal autoaggressive behavior in patients with paranoid schizophrenia. It was established that the positive clinical effect of pregabalin within the framework of complex therapy is due to the polymodal action of the drug in relation to leading psychopathological manifestations in this group of patients.
Keywords: pregabalin, antipsychotics, paranoid schizophrenia, non-sicidal autoaggression.
For citation: I.V. Kravchenko. Experience in the use of Pregabalin in the complex therapy of nonsuicidal autoaggressive behavior in patients with paranoid schizophrenia. Psychiatry and psychopharmacotherapy. 2021; 1: 20–24.
Введение
Поиск новых схем терапии больных шизофренией по-прежнему остается одной из наиболее актуальных проблем практической психиатрии [21,31]. При этом исследователи сталкиваются с явлением непрерывного патоморфоза как самого заболевания, так и его терапевтической составляющей [2]. Результатом служит формирование состояния резистентности к проводимой терапии, встречающейся, по разным данным, у 20-40% пациентов [9].Одним из способов оптимизации проводимой терапии является присоединение адъювантных лекарственных средств к базовым препаратам нейролептического ряда.
В качестве одного из вариантов усиления нейролептической терапии является дополнительное назначение противосудорожных препаратов. Обладая полимодальным действием, такие препараты оказывают нормотимический и анксиолитический эффекты, снижают уровень агрессивных и суицидальных побуждений у данной группы больных [1, 10, 13, 16, 17, 22, 27, 28, 32].
Продолжением стратегии по использованию комбинированной лекарственной терапии у больных с параноидной шизофренией явилось использование у данной группы лиц противосудорожного препарата последней генерации – прегабалина. Теоретическими предпосылками к успешному использованию данного препарата у больных шизофренией послужил выявленный эффект при лечении им широкого круга психо-неврологических расстройств, протекающих с тревогой. И кроме того, особенность фармакокинетического профиля прегабалина в виде отсутствия клинически значимого взаимодействия его с системой цитохрома P-450 – в частности, с семейством CYP2D6. Это позволяет избежать колебаний концентрации применяемых нейролептических препаратов, метаболизм которых, напротив, тесно связан с данной ферментной системой [23, 25].
Также клинически значимым является фармакодинамический профиль прегабалина, предусматривающий снижение высвобождения некоторых нейротрансмиттеров, таких как глутамат, норадреналин и дофамин; и, напротив, способность повышать уровень гамма-аминомасляной кислоты (ГАМК), опосредуя cобственно анксиолитический эффект [14].
Однако, несмотря на имеющиеся теоретические обоснования к его применению у больных, страдающих шизофренией, в ряду исследователей не сформировалось единое мнение по его использованию в качестве адьювантного препарата у данной группы лиц [18,26].
В мировой литературе описан результат по краткосрочному применению прегабалина у больных шизофренией в суточной дозе 100 мг [29]. Также несомненный интерес представляют следующие три исследования, результаты которых должны быть приняты во внимание при дальнейших попытках использования прегабалина у больных шизофренией. В одном из них описан случай психоз-индуцированного действия прегабалина, при его отмене [19]. Второй случай связан с усилением аутоагрессивной активности на фоне приема прегабалина [12, 30]. Наконец, в третьем исследовании заявлен риск формирования аддиктивного поведения, связанный с препаратом [24]. К сожалению, подобные сообщения носят разрозненный характер, без глубокого клинико-катамнестического анализа, что не позволяет сделать однозначные выводы относительно клинического потенциала данного препарата.
Вместе с тем клиническая целесообразность диктует необходимость поиска новых схем медикаментозной коррекции в поисках эффективных схем терапии больных параноидной шизофренией, в том числе с несуицидальным аутоагрессивным поведением (НААП). И препарат прегабалин является одним из перспективных препаратов в терапии данной группы больных, что и обуславливает актуальность данного исследования.
Цель исследования: сравнительный анализ эффективности применения прегабалина в комплексной терапии НААП у больных параноидной шизофренией.
Материал и методы иcследования
 Всего обследовано 53 больных с параноидной шизофренией, проходивших лечение в период 2016-2020 гг. в Межрайонном центре Медицинской Реабилитации г. Санкт-Петербурга и многопрофильном медицинском центре «Профимед». Из них 44 – мужчины и 9 – женщины, все в возрасте от 25 до 45 лет. Средний возраст обследуемых составил 33,2 года. Средняя длительность заболевания – 11,2 года. Тип течения заболевания – непрерывно-прогредиентный.
Всего обследовано 53 больных с параноидной шизофренией, проходивших лечение в период 2016-2020 гг. в Межрайонном центре Медицинской Реабилитации г. Санкт-Петербурга и многопрофильном медицинском центре «Профимед». Из них 44 – мужчины и 9 – женщины, все в возрасте от 25 до 45 лет. Средний возраст обследуемых составил 33,2 года. Средняя длительность заболевания – 11,2 года. Тип течения заболевания – непрерывно-прогредиентный.Критериями включения в исследование служили:
1) Наличие несуицидальных самоповреждений;
2) Неэффективность проводимой комбинированной фармакотерапии не менее чем двумя нейролептиками, назначаемыми поочередно, в рекомендованных дозировках, согласно инструкции по применению препаратов, и продолжительностью не менее 3 месяцев;
3) Не менее 6 месяцев суммарного пребывания в психиатрическом стационаре за последние три года.
Критерии невключения:
1) Психотический уровень переживания;
2) Аутоагрессивные действия суицидальной направленности или в рамках асфиксиофилии.
Все больные находились в состоянии медикаментозной ремиссии с признаками нарастающего процессуального дефекта личности.
Под ремиссией подразумевалось «ослабление и смягчение всей симптоматики, обеспечивающее в той или иной степени социальное и трудовое приспособление больного, и обнимающее широкий диапазон состояний от граничащих с практическим восстановлением до тех, при которых уже отчетливо выступают симптомы дефекта» [3, 4, 5, 7].
Под шизофреническим дефектом понимались «последствия психического заболевания, которые наступают в условиях полной остановки процесса, приводят к стойкому (и не прогрессирующему) выпадению или диссоциации психических функций с изменением личности и сопровождаются снижением ее функционирования» [7].
Под определение «несуицидальные аутоагрессивные действия» или «НААД» попадали самые разные действия, направленные против своего здоровья и сопровождавшиеся нарушением целостности (функций) органов или систем органов. При этом отсутствовала любая демонстрация намеренья покончить жизнь самоубийством [6].
Учитывая отсутствие официальных показаний к назначению прегабалина для коррекции НААП, у всех принимавших участие в исследовании было получено информированное согласие (принцип off-label).
Обследуемые соответствовали следующей клинической характеристике. Наследственность психопатологически была отягощена у 46 % больных. Раннее развитие без задержки. У 78 % больных отмечались девиантные черты в премордибной структуре личности. Среди них доминировали шизоидные и истеро-возбудимые черты. У 36 % воспитание протекало в неполных семьях, в условиях гипоопеки. Ретроспективно можно утверждать, что продромальный период возникал в среднем в возрасте 11-13 лет, в виде усиления неврозо- и психопатоподобной симптоматики. У 27% были выявлены тревожно-боязливые черты, ипохондрические явления, склонность к непреодолимо навязчивым действиям, ритуалам; нарастание замкнутости, социальной отгороженности. У 73% отмечалось формирование конфликтного стиля общения. Больные легко вступали в непродуктивные споры, не терпя возражений; отмечалось карикатурно-утрированное стремление к независимости, манкирование своими обязанностями, пропуски школы, совершение делинквентных поступков. Также этот период характеризовался началом массивного потребления психоактивных веществ. Отсутствие иных способов совладания с тревожностью либо отсутствие условий для реализации агрессивных побуждений приводили к осуществлению и последующему закреплению НААП. Самоповреждения наносились в виде поверхностных порезов в области предплечий, внутренней поверхности бедра, голени. Первый психотический эпизод состоял из признаков психического автоматизма, открытости мыслей окружающим, ощущения воздействия и преследования, слуховых галлюцинаций. После купирования психотических переживаний заболевание носило непрерывно-прогредиентный характер.
Эпизоды психотической симптоматики отличались наличием психомоторного возбуждения, агрессивностью, проявлениями галлюцинаторно-бредовой симптоматики на фоне отсутствия критики к своему состоянию. Выраженность психопатологических переживаний обусловливала частоту госпитализаций в психиатрические стационары, в среднем, 1,6 госпитализации на человека в год. Медикаментозная ремиссия была крайне неустойчивой и сопровождалась неуклонным нарастанием процессуального дефекта. В динамике последнего отмечались выделенные Д. Е. Мелеховым (1963) т.н. «эпизодические периоды кратковременных, неадекватных ситуации колебаний настроения и активности». Больные оставались эмоционально неустойчивые, конфликтные, демонстрировали неспособность к целенаправленной волевой деятельности, находясь на иждивении ближайших родственников. Усиливалось эмоциональное огрубление, сужение круга интересов до уровня удовлетворения простейших бытовых потребностей (потребление чая, кофе, курение). Со стороны мышления отмечалась его непоследовательность, элементы резонерства, ментизма.
 Участие в психотерапии и прием медикаментов происходило только при активном контроле со стороны ближайших родственников. Собственно НААД носили неоднократный характер, реализуясь без борьбы мотивов, по принципу наибольшей доступности метода и локализации самоповреждений. После их нанесения большинство обследуемых отмечало сохранение высокого уровня протопатической тревоги, раздражительности, гневливости (36 больных).
Участие в психотерапии и прием медикаментов происходило только при активном контроле со стороны ближайших родственников. Собственно НААД носили неоднократный характер, реализуясь без борьбы мотивов, по принципу наибольшей доступности метода и локализации самоповреждений. После их нанесения большинство обследуемых отмечало сохранение высокого уровня протопатической тревоги, раздражительности, гневливости (36 больных).Выбор конкретных лекарственных препаратов для исследования был обусловлен принципом их наибольшей встречаемости в практической работе с данными пациентами. На момент включения в исследование обследуемые получали монотерапию палиперидоном и галоперидолом не менее трех месяцев – в средних дозах 6,8 и 18,4 мг в сутки соответственно. Назначению антиконвульсантов предшествовала смена терапии нейролептиками, назначение на срок в три недели рисперидона в сочетании с хлорпротиксеном в средних дозах 6,6 мг и 78,8 мг соответственно. В случае сохранения субъективных жалоб на тревожность, раздражительность, нарушения сна, декларированное стремление или попытки совершения НААД больным назначались прегабалин, карбамазепин и вальпроевая кислота в произвольном порядке, с выходом на предполагаемо-эффективные дозы в течение трех дней. Уровень последних определялся эмпирическим путем. Параллельно все пациенты проходили идентичный курс эмоционально-стрессовой психотерапии.
Таким образом больные были разделены на три группы. В основную группу вошли больные, находившиеся на комбинированной терапии рисперидоном, хлорпротиксеном и прегабалином (18 чел.). Средняя суточная дозировка препаратов составила 6,4 мг / 86,8 мг / 450 мг в сутки соответственно. Контрольные группы N1 и N2 составили больные, принимавшие препараты в следующих сочетаниях: рисперидон+ хлорпротиксен + вальпроевая кислота (20 чел.), а также рисперидон+хлорпротиксен+ карбамазепин (14 чел.). Cредняя суточная дозировка препаратов в первой контрольной группе составила 6,5 мг / 87,8 мг / 1240,0 мг в сутки, и во второй контрольной группе – 6,8 мг / 87,4 мг / 1180 мг в сутки соответственно. Роль гендерного фактора в структуре эффективности проводимой терапии не оценивалась в силу статистически малого числа респондентов женского пола. Если больные прерывали прием препаратов менее чем на 7 дней подряд и не более двух раз, то считались продолжающими участие в исследовании.
Для оценки результатов исследования использовался клинико-катамнестический, психометрический и статистический методы. В рамках психометрической оценки использовались шкалы: Плучека, Юдовского, шкала Краткой Психиатрической Оценки и шкала Социального функционирования [8]. Оценка клинико-психопатологического состояния производилась на момент включения в исследование, на 30 и 90 дни исследования. Частота НААД оценивалась в течение 3 месяцев после включения в исследование соответственно. Статистические различия определялись с помощью критерия Фишера. Статистически значимыми признавались различия при p=0,05.
Результаты и их обсуждение
Участие в исследовании закончили все пациенты основной группы. В группах сравнения отказались от участия 2 пациента из первой и 3 пациента из второй группы сравнения соответственно. Вместе с этим были выявлены следующие различия. В первые дни применения новых схем терапии обследуемые основной группы, по сравнению с контрольными группами, субъективно раньше отмечали уменьшение таких неспецифических психопатологических переживаний, как протопатическая тревога, нарушения ночного сна, уменьшение чувства внутреннего напряжения. В среднем заявленное улучшение больные основной группы испытывали на 8-й день, больные первой и второй групп сравнения – на 12 и 17-й дни с начала исследования. В дальнейшем заболевание протекало с признаками процессуального дефекта, в структуре которого отмечались т.н. «эпизодические периоды кратковременных, неадекватных ситуации колебаний настроения и активности» (по Д.Е. Мелихову, 1963).Среди последних были выделены два клинических варианта:
• Первый вариант характеризовался спонтанно возникающим состоянием психомоторной заторможенности, чувства тревоги, тоски, вялости, проходящих в течение
5-7 дней.
• Второй вариант отличался диаметрально противоположным вектором психомоторной активности в виде раздражительности, суетливости, моторного возбуждения.
Общим для обоих вариантов было ухудшение когнитивных функций в форме ментизма, шперрунга, ухудшения функции запоминания и воспроизведения ранее полученной информации, слабости внимания, негативизма в отношении проводимой терапии. Такие больные становились дезорганизованные, не могли и не хотели участвовать в психотерапевтических мероприятиях.
У 3 больных первой группы сравнения и у 8 больных второй группы сравнения отмечались случаи краткосрочного отказа от приема базовой терапии. Среди обследуемых основной группы случаев временного отказа от терапии зафиксировано не было. Собственно, несуицидальные самоповреждения, с целью снижения выраженности психопатологических переживаний, наносились при любом упомянутом варианте течения процессуального дефекта.
В ходе присоединения позитивной психопатологической продукции суицидальной активности не происходило. Подобные эпизоды течения процессуального дефекта субъективно легче переносились больными, принимавшими прегабалин (12 чел.) и вальпроевую кислоту (13 чел.), нежели больными, принимавшимикарбамазепин (5 чел.). Это уменьшало необходимость прибегать к т.н. «терапии прикрытия», роль которой выполнял феназепам «per os», в среднесуточной дозе 2 мг, в течение 7 дней. Его назначение потребовалось трем больным основной группы, 6-ти и 11-ти больным первой и второй группы сравнения соответственно. Количество случаев НААД составило за весь период наблюдения 1,3 случая в основной группе, 1,2 и 2,6 случая – в первой и второй группах сравнения соответственно.
Приведенные выше данные клинического наблюдения подтверждались с помощью психометрических шкал Юдовского и Плучека, а также шкалы краткой психиатрической оценки BPRS (рис. 1, 2, 3).
Обследуемые основной и первой группы сравнения демонстрировали более выраженное улучшение навыков социального функционирования, нежели больные второй группы сравнения (рис. 4).
Полученные результаты демонстрируют, что прием прегабалина в рамках комплексной терапии у исследуемых лиц способствует реализации анксиолитического эффекта в более ранние сроки, носящего устойчивый характер. Механизмом реализации заявленного эффекта, по-видимому, служит большая тропность прегабалина к ГАМК-ергической системе, по сравнению с заявленными протисудорожными препаратами из групп сравнения. Также различия в реализуемом клиническом эффекте прегабалина и препаратов сравнения могут быть обусловлены их фармакокинетическими различиями.
В рамках рабочей гипотезы можно предположить, что прегабалин в большей степени потенцирует общий успокоительный эффект нейролептических препаратов за счет отсутствия клинически значимого взаимодействия его с системой цитохрома p-450 – в частности его изоферментной группой CYP2D6. Важную роль в прогнозировании клинического эффекта играет всесторонняя оценка процессуального дефекта, представляющего собой неуклонно-прогредиентную и малообратимую психопатологическую конструкцию.
Полноценная оценка эффективности терапии в отношении последней может происходить лишь при последовательной реализации интегрированных психо-фармакологических схем лечения, превышающих сроки данного исследования [11]. Следует учитывать и этнические и расовые различия в метаболизме психотропных препаратов, что может ухудшить переносимость и эффективность проводимого лечения, которые не были рассмотрены в данном исследовании в силу отсутствия материальных условий для их проведения [15].
Поскольку уточнение побочных эффектов от приема прегабалина не было заявленной целью исследования, данный вопрос требует дальнейшего изучения. По косвенным признакам – по отсутствию случаев отказа от лечения по причине плохой переносимости, а также более активному участию их в психотерапевтических мероприятиях, прегабалин обладает более сбалансированными фармакологическими характеристиками, по сравнению с группами сравнения. Также требует уточнения вопрос парадоксального усиления несуицидальной аутоагрессивной активности и риск формирования зависимости при длительном приеме прегабалина, упомянутых рядом авторов [20]. По результатам настоящего исследования подобные психопатологические явления выявлены не были.
Выводы
Препарат прегабалин подтвердил свою клиническую эффективность в отношении больных параноидной шизофренией с НААД, в рамках комбинированной терапии, включавшей обязательное назначение нейролептических препаратов. Реализация положительного терапевтического эффекта прегабалина достигается за счет влияния на ГАМК-ергическую систему и потенцирования действия нейролептических препаратов. Также клинически значимым является фармакокинетический профиль прегабалина, позволяющий избежать изменений метаболизма всех лекарственных агентов, задействованных в рамках комплексной терапии. Тем самым повышается уровень соответствия и эффективности проводимых психотерапевтических мероприятий, что повышает уровень социальной активности данной группы больных.Сведения об авторе:
Кравченко Игорь Владимирович, кандидат медицинских наук, врач высшей категории, врач-психиатр, психотерапевт, психиатр-нарколог, клинический фармаколог, терапевт. Межрайонный центр медицинской реабилитации ГБУЗ “Поликлиника N38”, СПб., Россия Е-mail: igorkravchenk@mail.ru
Список исп. литературыСкрыть список1. Авруцкий Г. Я., Недува А. А. Лечение психически больных: (Руководство для врачей). М.: Медицина, 1981, 496 с.
2. Вильянов В.Б. Клинико-терапевтический патоморфоз параноидной шизофрении: Автореф. дис. … докт. мед. наук. Саратов. 2005. 43 с.
3. Иванов М.В., Незнанов Н.Г. Негативные и когнитивные расстройства при эндогенных психозах: диагностика, клиника, терапия / М.В.Иванов, М.В. Иванов, Н.Г. Незнанов – СПб.: Изд. НИПНИ им. В.М. Бехтерева, 2008.- 288 с.
4. Зеневич Г.В. Ремиссии при шизофрении. – Л., 1964. – 216 с.
5. Коцюбинский, А.П., Скорик, А.И., Аксенова, И.О., Шейнина, Н.С., Зайцев, В.В.Шизофрения: уязвимость-диатез-стресс-заболевание /А.П.Коцюбинский, А.И.Скорик, И.О.Аксенова, Н.С.Шейнина, В.В.Зайцев – СПб.: Изд. Гиппократ. - 2004. - 335 с.
6. Кравченко И.В. Несуицидальная аутоагрессия у больных параноидной шизофренией, находящихся на принудительном лечении// Автореф. дис. … канд. мед. наук. Cанкт-Петербург. 2011. 24 с.
7. Мелехов Д.Е. Клиническая основа оценки работоспособности при шизофрении / Д.Е. Мелехов. — М.: Медгиз, 1963. — 193с.
8. ФГБНУ Научный центр психического здоровья. Для исследователей. Психометрические шкалы: эл.адрес http://ncpz.ru/stat/99.
9. Фурса О.О., Козловский В.Л. Фармакогенетические особенности активности системы цитохромов Р450 в метаболизме антипсихотических препаратов Журн. невролог. психиатр. 2014; 4: 111–122.
10. Afaq I, Riaz J, Sedky K, et al. Divalproex as a calmative adjunct for aggressive schizophrenic patient. Journal of the Kentucky Medical Association. 2002;100(1): 17-22.
11. Andreasen N.C., Carpenter W.T. et.al. Remission in schizophrenia: proposed criteria and rational for consensus Journ. Psychiat., 2005;162: 441–449.
12. Ashwini S, Amit DR, Ivan NS, , et al.. Pregabalin dependence with pregabalin induced intentional self-harm behavior: A case report. Indian J Psychiatry 2015;57:110-1
13. Bertoldo M. Valproic acid and risperidone. J Am Acad Child Adolesc Psychiatry 2002; 41:632.
14. Bockbrader HN, Wesche D, Miller R, et al. A comparison of the pharmacokinetics and pharmacodynamics of pregabalin and gabapentin. Clin Pharmacokinet. 2010;49:661–669.
15. Bradford LD. CYP2D6 allele frequency in European Caucasians, Asians, Africans and their descendants. Pharmacogenomics. 2002; 3: 229–243.
16. Chong SA, Tan CH, Lee EL, et al. Augmentation of risperidone with valproic acid. J Clin Psychiatry 1998; 59 :430.
17. Dose M, Hellweg R, Yassouridis A, et al. Combined treatment of schizophrenic psychoses with haloperidol and valproate. Pharmacopsychiatry 1998; 31 :122–125;
18. Englisch, S, Esser A, Enning F, Hohmann, et al. Augmentation with pregabalin in schizophrenia. Journal of Clinical Psychopharmacology.2012; 30:437–440.
19. Gundogvus I , Karagöz A, , et al. First-episode psychosis induced by pregabalin withdrawal: a case report. J Psychiatry and Clinical Psychopharмacology. 2018; 28( 4): 461–463.
20. Kalinin VV. Suicidality and antiepileptic drugs: Is there a link? Drug Saf. 2007; 30 :123–42.
21. Krakowski MI, Czobor P, Nolan KA. Atypical antipsychotics, neurocognitive deficits, and aggression in schizophrenic patients. J Clin Psychopharmacol. 2008;28:485–493.
22. Leucht S, McGrath J, White P, Kissling W. Carbamazepine augmentation for schizophrenia: how good is the evidence?. Journal of Clinical Psychiatry 2002;63(3):218‐224.
23. Liana U., Trevor I. Prior, Serdar Dursun,Metabolism of Atypical Antipsychotics: Involvement of Cytochrome P450 Enzymes and Relevance for Drug-Drug Interactions Journal Name: Current Drug Metabolism. 2008;9(5):410-418.
24. Loftus H, Wright A. Potential misuse of pregabalin and gabapentin. BMJ. 2014;348: 1290.
25. Maekawa K., Yoshimura T., Saito Y. et al. Functional characterization of CYP3A4.16: catalytic activities toward midazolam and carbamazepine. Xenobiotica. 2009; 39(2):140-147.
26. Nunes, A. E., Canver, L., Oliveira, L. D. (2012). Effects of pregabalin on behavioral alterationsinduced by ketamine in rats. Journal of the Brazilian Psychiatric Association.2012; 34: 329-333.
27. Ohlmeier MD, Jahn K, Wilhelm‐Gossling C, Godecke‐Koch T, et al. Perazine and carbamazepine in comparison to olanzapine in schizophrenia. Neuropsychobiology 2007;55(2):81‐83.
28. Omrani V., et. Al. Sodium Valproate as an Adjunctive Drug in Treatment of Schizophrenia Iranian Journal of Psychiatry and Behavioral Sciences. 2007;1 (1):12.
29. Talat J, Afshin T, Mohamad R , et al. The effect of adding Pregabalin to Conventional Treatment in schizophrenia Patients, for improving Positive, negative and general symptoms of These PatientInternational. Journal of Medical Research & Health Sciences, 2016; 5(9):282-287.
30. Tandon VR, Mahajan V, Gillani ZH, Mahajan A. Pregabalin-induced self-harm behavior. Indian J Pharmacol.2013;45:638.
31. Topiwala A, Fazel S. The pharmacological management of violence in schizophrenia: a structured review. Expert Rev Neurother. 2011;11:53–63.
32. Wassef AA, Hafiz NG, Hampton D, et al. Divalproex sodium augmentation of haloperidol in hospitalized patients with schizophrenia: clinical and economic implications . J Clin Psychopharmacol. 2001; 21:21–26.
29 марта 2021
Количество просмотров: 1291


