Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№02 2022
Количественная ЭЭГ у детей с комбинированным вариантом синдрома дефицита внимания с гиперактивностью №02 2022
Абстракт
Резюме. Синдром дефицита внимания с гиперактивностью (СДВГ) диагностируется у 3-5% детей во всем мире. Исследования электроэнцефалографии (ЭЭГ) у детей с СДВГ позволяют получить данные о различных аспектах функции мозга.
Цель исследования: выявление нейрофизиологических коррелятов клинических симптомов данного расстройства и их связи с состоянием обмена моноаминов у детей с синдромом дефицита внимания с гиперактивностью.
Материал и методы. Было обследовано 404 ребенка в возрасте 6-8 лет с комбинированным вариантом СДВГ. Контрольную группу составляло 90 детей (54 мальчика и 36 девочек). Проводилось электроэнцефалографическое исследование, где дифференцировались следующие диапазоны: тета-ритм (4–8 Гц) и альфа-ритм (8–14 Гц). Рассчитывались отношения мощности тета- и альфа-ритмов (тета/альфа). Определялись содержание мо-ноаминов, их предшественников и продуктов метаболизма в суточной моче. Клинические симптомы СДВГ (показатели невнимательности, гиперактивности и импульсивности) измерялись с помощью шкалы SNAP-IV.
Результаты. Обнаружено, что показатель импульсивности у детей с СДВГ обратно коррелирует с отношением тета/альфа в левых центрально-париетальных отведениях. И чем ниже уровень триптофана, тем выше показатель отношения тета/альфа в этих отведениях. С другой стороны, повышение содержания продукта метаболизма катехоламинов, ванилилминдальной кислоты, приводит к повышению импульсивности и снижению показателя тета/альфа.
Заключение: Полученные данные позволяют утверждать, что электроэнцефалографический показатель тета/альфа может служить маркером импульсивности у детей с СДВГ и отражает устанавливающееся состояние дисбаланса моноаминовых систем.
Ключевые слова: синдром дефицита внимания с гиперактивностью, норадренергическая система, серотониновая система, электроэнцефалографические маркеры СДВГ.
Для цитирования: Р.Ф. Гасанов, И.В. Макаров, Д.А. Емелина. Количественная ЭЭГ у детей с комбинированным вариантом синдрома дефицита внимания с гиперактивностью. Психиатрия и психофармакотерапия. 2022; 2: 40–45.
Резюме. Синдром дефицита внимания с гиперактивностью (СДВГ) диагностируется у 3-5% детей во всем мире. Исследования электроэнцефалографии (ЭЭГ) у детей с СДВГ позволяют получить данные о различных аспектах функции мозга.
Цель исследования: выявление нейрофизиологических коррелятов клинических симптомов данного расстройства и их связи с состоянием обмена моноаминов у детей с синдромом дефицита внимания с гиперактивностью.
Материал и методы. Было обследовано 404 ребенка в возрасте 6-8 лет с комбинированным вариантом СДВГ. Контрольную группу составляло 90 детей (54 мальчика и 36 девочек). Проводилось электроэнцефалографическое исследование, где дифференцировались следующие диапазоны: тета-ритм (4–8 Гц) и альфа-ритм (8–14 Гц). Рассчитывались отношения мощности тета- и альфа-ритмов (тета/альфа). Определялись содержание мо-ноаминов, их предшественников и продуктов метаболизма в суточной моче. Клинические симптомы СДВГ (показатели невнимательности, гиперактивности и импульсивности) измерялись с помощью шкалы SNAP-IV.
Результаты. Обнаружено, что показатель импульсивности у детей с СДВГ обратно коррелирует с отношением тета/альфа в левых центрально-париетальных отведениях. И чем ниже уровень триптофана, тем выше показатель отношения тета/альфа в этих отведениях. С другой стороны, повышение содержания продукта метаболизма катехоламинов, ванилилминдальной кислоты, приводит к повышению импульсивности и снижению показателя тета/альфа.
Заключение: Полученные данные позволяют утверждать, что электроэнцефалографический показатель тета/альфа может служить маркером импульсивности у детей с СДВГ и отражает устанавливающееся состояние дисбаланса моноаминовых систем.
Ключевые слова: синдром дефицита внимания с гиперактивностью, норадренергическая система, серотониновая система, электроэнцефалографические маркеры СДВГ.
Для цитирования: Р.Ф. Гасанов, И.В. Макаров, Д.А. Емелина. Количественная ЭЭГ у детей с комбинированным вариантом синдрома дефицита внимания с гиперактивностью. Психиатрия и психофармакотерапия. 2022; 2: 40–45.
Quantitative EEG in children with a combined variant attention deficit hy-peractivity disorder
R.F. Gasanov1, I.V. Makarov1,2, D.A. Emelina1
Abstract
Attention deficit hyperactivity disorder (ADHD) is diagnosed in 3-5% of children worldwide. Electroencephalography (EEG) studies in children with ADHD provide data on various aspects of brain function.
Aims: identification of neurophysiological correlates of clinical symptoms of this disorder and their relationship with the state of monoamine metabolism in children with attention deficit hyperactivity disorder.
Material and methods. The test group comprised 404 patients aged 6-8 years diagnosed with ADHD combined type; the control group included 90 typically developing peers. All participants underwent EEG recording, and the power ratios of theta and alpha rhythms (theta/alpha) were calculated. We determined the content of monoamines, their precursors, and metabolic products in daily urine and measured clinical symptoms of ADHD (inattention, hyperactivity, and impulsivity) using the SNAP-IV scale.
Results. The study revealed that impulsivity indicator and urine content of tryptophan inversely correlate with theta/alpha ratio in left central parietal sites. On the other hand, an in-creased level of vanillylmandelic acid leads to a higher indicator of impulsivity and a lower the-ta/alpha ratio.
Conclusion: The obtained data suggest that the theta / alpha electroencephalographic in-dex can serve as a marker of impulsivity in children with ADHD and reflects the established state of imbalance in monoamine systems.
Key words: attention deficit hyperactivity disorder, noradrenergic system, serotonin sys-tem, electroencephalographic markers of ADHD.
For citation: R.F. Gasanov, I.V. Makarov, D.A. Emelina. Quantitative EEG in children with a combined variant attention deficit hy-peractivity disorder. Psychiatry and psychopharmacotherapy. 2022; 2: 40–45.
Вступление
Синдром дефицита внимания с гиперактивностью (СДВГ) – это расстройство поведения и психического развития, характеризующееся невнимательностью, гиперактивностью и импульсивностью, влияющие на когнитивную функцию человека и определяющие нарушение адаптации в обществе [1]. СДВГ – одно из наиболее часто встречающихся расстройств детского возраста, распространенность которого оценивается примерно в 3–5% среди школьников, причем мальчики страдают в 2–4 раза чаще, чем девочки [2]. СДВГ относится к многофакторным нейрокогнитивным расстройствам, в патогенезе которого ключевую роль играют нарушения обмена моноаминов [3–5]. Основная дисфункция мозга, которая приводит к нарушениям поведения, не совсем понятна, хотя известно, что включает в себя некоторую форму аномальной функциональной связи, варьирующей в разных областях мозга [6].
В последнее время в работах, посвященных количественной ЭЭГ у детей с СДВГ, выделяют Mu-волны с частотным диапазоном 8–13 Гц, представляющие функциональную активность сенсомоторной коры [7, 8]. Подавление Mu-волн может указывать на работу моторных зеркальных нейронов и дефицит подавления Mu и может играть вероятную роль в патогенезе дефицита внимания с гиперактивностью [9]. Спектральный анализ мощности позволяет топографическое представление и статистический анализ ЭЭГ с использованием цифровой ЭЭГ, как было рекомендовано Американской академией неврологии [10]. Расчет абсолютной и относительной оценки мощности – наиболее часто используемая форма количественной ЭЭГ при СДВГ. Повышение активности медленных волн и недостаток альфа-активности наблюдались у детей с СДВГ [11].
Особый интерес вызывают исследования R. Chabot и G. Serfonstein [12], которые выделили два основных типа изменений у детей с СДВГ: первый тип характеризуется усилением тета-ритма при нормальной средней частоте альфа-ритма; второй характеризуется усилением тета-ритма, сопровождающимся снижением средней частоты альфа-ритма. Эти находки, по мнению авторов статьи, могут свидетельствовать о разнонаправленных изменениях функционального состояния головного мозга. ЭЭГ-исследования детей с синдромом дефицита внимания выявляют повышенную мощность тета-активности [10, 12–16], увеличение в задних отделах дельта-активности [17] и снижение мощности альфа-ритма [18].
Согласно литературным данным, отношение мощностей тета/альфа признано одним из наиболее чувствительных показателей количественной ЭЭГ у детей с СДВГ [13, 19, 20]. Этот показатель считается маркером для идентификации данного расстройства и весьма информативен для отражения взаимоотношений альфа- и тета-активности [21]. Повышение отношения тета/альфа (в затылочных областях) может свидетельствовать о дефиците альфа-активности, вызванном дисфункцией корковых и таламо-кортикальных систем, и некоторыми авторами рассматриваться как задержка в созревании сетей, формирующих основной ритм спокойного расслабленного бодрствования [21].
Однако среди многочисленных исследований количественной ЭЭГ у детей с СДВГ отсутствуют данных об их связи с особенностями обмена моноаминов, хотя полученные данные могли бы быть полезны в построении тактики терапевтического вмешательства в ходе подбора персонализированной терапии. Кроме того, в большинстве статей результаты исследований основаны на малом количестве обследованных. В связи с этим настоящее исследование было предпринято с целью не только оценки нейрофизиологических коррелятов клинических симптомов данного расстройства, но и их связи с состоянием обмена моноаминов у детей с синдромом дефицита внимания с гиперактивностью.
Материалы и методы
Основную группу детей с СДВГ составили 404 ребенка с комбинированным вариантом синдрома дефицита внимания с гиперактивностью в возрасте 6–8 лет, находящиеся на лечении в НМИЦ ПН им. В.М. Бехтерева. Контрольную группу составляло 90 детей (54 мальчика и 36 девочек) без признаков гиперактивности и прогредиентных нервно-психических расстройств, преимущественно с расстройством поведения по причине нарушения детско-родительских отношений.
Определялись биохимические параметры в суточной моче: содержание дофамина (ДА), норадреналина (НА), адреналина (А) и серотонина (Сер), их метаболитов – гомованилиновой кислоты (ГВК – метаболит ДА), ванилилминдальной кислоты (ВМК – метаболит НА), 5-гидрокситриптофана (5-HTP – метаболит триптофана) и 5-оксииндолуксусной кислоты (5-ОУИК – метаболит серотонина), а также их предшественников – триптофана и тирозина. Перечисленные биохимические параметры изучались в суточной моче в Независимых лабораториях Северо-Западного центра доказательной медицины методом высо-коэффективной жидкостной хроматографии с электрохимической детекцией с учетом возраста пациента и анализом соответствию референтных значений [22, 23].
Регистрация и анализ ЭЭГ осуществлялись по общепринятой методике с помощью компьютерного телеметрического электроэнцефалографа («Телепат 104-Д», г. Санкт-Петербург). ЭЭГ – потенциалы отводили монополярно от локусов F1, F2, F3, F4, С3, С4, P3, P4, O1, O2 в соответствии с международной системой «10–20». Отведения Т3–Т6 ис-ключены из анализа в связи с обилием двигательных артефактов, связанных с особенностью изучаемого расстройства. У детей регистрировали ЭЭГ при закрытых и открытых глазах в состоянии двигательного покоя. В составе ЭЭГ дифференцировались следующие диапазоны: тета-ритм (4–8 Гц) и альфа-ритм (8–13 Гц). Рассчитывалось также отношение мощности тета- и альфа-ритмов (тета/альфа).
Для балльной оценки тяжести симптомов СДВГ использовалась шкала SNAP-IV. Шкала предназначена для родителей детей с СДВГ и состоит из 43 вопросов, позволяющих в баллах оценить степень невнимательности, гиперактивности и импульсивности [24].
Статистический анализ данных проводился с помощью стандартного пакета прикладных программ IBM SPSS Statistics (версия 19). При сравнении нескольких независимых выборок количественных данных, имеющих распределение отличное от нормального, использовался критерий Краскела–Уоллиса ANOVA с процедурой множественного сравнения. Для сопоставления частот использован критерий χ2 Пирсона и корреляционный коэффициент Спирмена.
Все этапы исследования соответствовали принципам, заложенным в Хельсинкской декларации Всемирной медицинской ассоциации (2013), что было подтверждено Независимым этическим комитетом при НМИЦ ПН им. В.М. Бехтерева.
Результаты
В ходе анализа данных ЭЭГ было установлено, что характеристики мощности ритмов у обследованных детей отличаются в широком диапазоне. При этом устанавливается пропорциональное изменение мощности диапазонов тета- и альфа-активности. В связи с этим, а также учитывая указания многих авторов на чувствительность показателей тета/альфа, был проведен сравнительный анализ данных. Результаты исследования представлены в в табл. 1.
Как видно из таблицы 1, мощности тета- и альфа-ритмов в основной и контрольной группах значимо отличаются во всех отведениях, а их отношения преобладают в группе контроля во всех отведениях правой гемисферы и билатерально в центрально-теменных отведениях.
У детей с СДВГ изучалось содержание моноаминов, их предшественников и продуктов метаболизма с целью дальнейшего выявления связей с нейрофизиологическими показателями (табл. 2). Как видно из табл. 2, основная группа детей с СДВГ значимо отличалась от контрольной по всем биохимическим параметрам за исключением показателя серотонина.
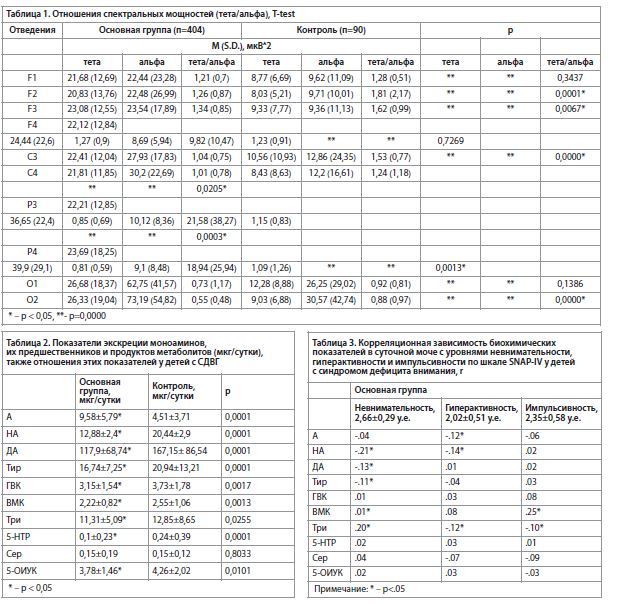
С целью установления связи между биохимическими параметрами и показателями невнимательности, гиперактивности и импульсивности у детей основной группы был проведен корреляционный анализ. Результаты анализа обнаружили значимые корреляционные связи только со звеньями обмена катехоламинов с показателями невнимательности, гиперактивности импульсивности, и не обнаружилась взаимосвязь основных клинических показателей СДВГ со звеньями индоламиновой системы, за исключением их предшественника, триптофана. Причем уровень триптофана образует корреляционные зависимо-сти со всеми клиническими показателями. Однако если с показателем невнимательности уровень триптофана образует положительную корреляционную связь, то с показателями гиперактивности и импульсивности – отрицательную (табл. 3).
 Полученные результаты отчасти согласуются с данными V.A. Russell, который на модели животных выдвинул гипотезу дисбаланса дофаминовой и норадренергической систем [25]. Он писал, что «…поведенческие нарушения СДВГ являются результатом дисбаланса между норадренергической и дофаминергической системами в префронтальной коре, со снижением дофаминергической активности на фоне активизации норадренергиче-ской…» [25, Р. 191].
Полученные результаты отчасти согласуются с данными V.A. Russell, который на модели животных выдвинул гипотезу дисбаланса дофаминовой и норадренергической систем [25]. Он писал, что «…поведенческие нарушения СДВГ являются результатом дисбаланса между норадренергической и дофаминергической системами в префронтальной коре, со снижением дофаминергической активности на фоне активизации норадренергиче-ской…» [25, Р. 191].
Наибольшее количество значимых корреляционных связей уровней моноаминов у детей с СДВГ обнаружено с показателями невнимательности, наименьшее – с показателями импульсивности. Но во всех случаях отмечается вовлечение разных звеньев обмена моноаминов. Это согласуется с точкой зрения F. Aboitiz с соавт. [26], которые объясняли развитие симптомокомплекса синдрома дефицита внимания у детей с нарушением регуляции базального тонизирующего уровня катехоламинергических систем через расстройства фазической сигнализации в сетях базового режима, выявления значимости и исполнительного управления.С целью установления связей между показателем тета/альфа с основными симптомами СДВГ (невнимательностью, гиперактивностью, импульсивностью) и звеньями обмена моноаминов проводился корреляционный анализ, результаты которого представлены в таблицах 4 и 5. Между показателями тета/альфа и уровнем моноаминов были получены многочисленные, в основном отрицательные, корреляции во всех отведениях (табл. 4). Однако с показателями клинических симптомов СДВГ, напротив, значимыми оказались лишь единичные отрицательные корреляции отношения тета/альфа. И только с показателями гиперактивности и импульсивности (табл. 5). Полученные результаты складываются в схему, в которой можно рассматривать корреляционные связи с симптомами гиперактивности и импульсивности с показателем отношения тета/альфа в правых заднелобных и левых центрально-теменных отведениях. Причем показатель гиперактивности отрицательно коррелирует с отношением тета/альфа только в правых заднелобных отведениях (табл. 5), хотя и не отличается от группы контроля (табл. 1). Напротив, показатель импульсивности, кроме отрицательной корреляции с отношением тета/альфа в правых заднелобных отведениях, образует значимые корреляционные связи с показателем тета/альфа в левых центральных и теменных отведениях, где он значимо уступает группе контроля (табл. 1, 5). Следовательно, на наш взгляд, взаимосвязь нейрофизиологической характеристики (отношение тета/альфа), биохимических параметров (уровни экскреции моноаминов) и клинических симптомов СДВГ целесообразно производить только в отношении показателя импульсивности.
Оценивая показатель импульсивности, необходимо отметить, что он отрицательно коррелирует со сниженным относительно группы контроля показателем тета/альфа (табл. 1) в левых центрально-теменных отведениях (табл. 5). В свою очередь, более низкий по сравнению с группой контроля уровень триптофана (табл. 2) отрицательно связан как с отношением тета/альфа в левых центрально-париетальных отведениях (табл. 4), так и с показателем импульсивности (табл. 3). С другой стороны, содержание продукта обмена катехоламинов, ванилилминдальной кислоты (также значимо уступающее группе контроля), положительно коррелирует только с показателем импульсивности и связано с отношением тета/альфа в левых центрально-париетальных отведениях. Таким образом, чем выше показатель импульсивности у детей с СДВГ, тем ниже отношение тета/альфа в левых центрально-париетальных отведениях. И чем ниже уровень триптофана, тем выше показатель отношения тета/альфа в левых центрально-теменных отведениях. С другой стороны, повышение уровня продукта метаболизма катехоламинов, ванилилминдальной кислоты, связано с повышением импульсивности и снижением показателя тета/альфа.
Обсуждение
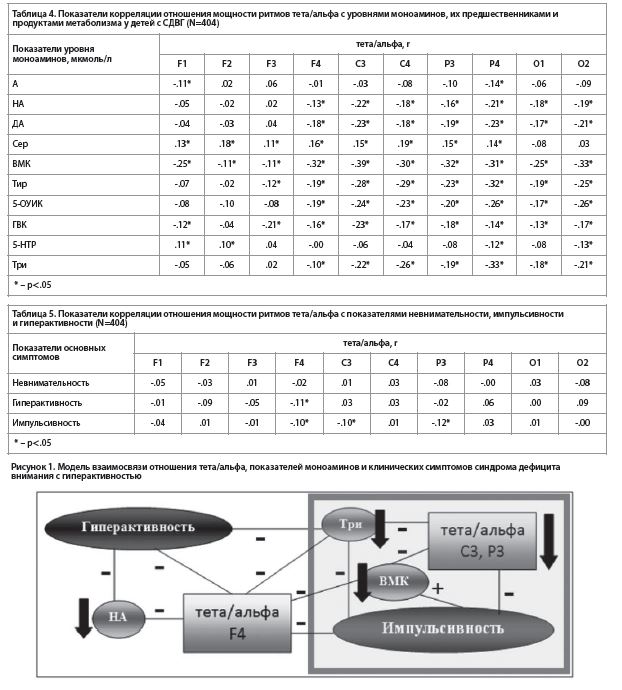 Данное исследование выделяет связь импульсивности с левыми центрально-париетальными отделами головного мозга, которые методом ЭЭГ отражаются на динамике отношения тета/альфа. Ранее, в работах M.I. Posner с соавторами [27–29] обсуждалось, что теменные зоны, расположенные вокруг внутритеменной борозды, включаются в звенья системы переключения зрительного внимания. Совместно с фронтальными, они активизируются в ситуациях, требующих реализации механизмов избирательного внимания, составляя так называемую «фронтопариетальную систему внимания» [30].
Данное исследование выделяет связь импульсивности с левыми центрально-париетальными отделами головного мозга, которые методом ЭЭГ отражаются на динамике отношения тета/альфа. Ранее, в работах M.I. Posner с соавторами [27–29] обсуждалось, что теменные зоны, расположенные вокруг внутритеменной борозды, включаются в звенья системы переключения зрительного внимания. Совместно с фронтальными, они активизируются в ситуациях, требующих реализации механизмов избирательного внимания, составляя так называемую «фронтопариетальную систему внимания» [30].
Фронтопариетальная система внимания, по мнению R. Ptak [31], опирается на результаты интегрированной информации о сенсорных событиях (главным образом, зрительных) и нисходящих влияний от дорзолатерального префронтального кортекса, которые инициированы целями поведенческих актов с учетом ожидаемых результатов этого действия. Это создает карту приоритетов. Сформированная карта приоритетов, по мнению автора, позволяет обеспечить как обработку сенсорных карт, так и оперативно их корректировать в зависимости от целей поведения. В эти сложные акты включаются нейронные сети внутритеменной борозды, нижнетеменной коры и фронтальной зрительной зоны. Созданная R. Ptak нейрокогнитивная модель описывает роль дорзолатерального префронтального кортекса в удерживании целей поведения в рабочей памяти, а нижней теменной коры – в инициации переключения внимания с созданием условий для устойчивости процесса внимания на значимых стимулах. Эти данные во многом объясняют обнаруженную взаимосвязь показателя тета/альфа с клиническими симптомами у детей с СДВГ именно в центрально-теменных отведениях. Однако данная модель не позволяет ответить на вопрос, почему значимые корреляции образованы с показателем импульсивности, а не невнимательности. Механизмы формирования импульсивности оказались гораздо сложнее расстройства функции внимания, поскольку, с одной стороны, обеспечиваются несостоятельностью системы внимания, а с другой – формируют нарушения поведения в широком спектре психопатологических синдромов. Согласно теории гиперактивных, детерминантных системных расстройств центральной нервной системы Г.Н. Крыжановского [32], в основе патологического процесса лежит дисфункция, вызванная повреждением одного из участков ЦНС. Это ведет к ослаблению тормозных механизмов и гиперактивации нейронных структур с образованием так называемого «генератора патологически усиленного возбуждения» (ГПУВ). Формирование ГПУВ при синдроме дефицита внимания обусловлено ослаблением тормозного влияния фронто-орбитальной коры на отдельные участки кортекса. Действительно, в литературе описываются разнообразные морфологические изменения у детей с синдромом дефицита внимания, среди которых преобладают данные о страдании лобного вещества головного мозга [33–36]. Вероятнее всего, описанная R. Ptak теория фронто-париетальной системы внимания [31] может быть расширена не только функцией удержания целей когнитивного акта лобно-теменной сетью, но и торможением не относящихся к цели опережающих двигательных актов. И чем слабее ее тормозное влияние, тем более выражены характеристики импульсивности. Известно, что серотониновая и норадренергическая системы тесно связаны. Так, норадреналин может оказывать как прямое, активирующее влияние на функции серотониновых рецепторов, так и обратное, тормозящее [37].
В свою очередь, серотонин подавляет активность норадреналина [38]. Возможно, по этой причине в нашем исследовании повышение уровня импульсивности положительно коррелирует с содержанием продукта обмена катехоламинов, ванилилминдальной кислотой, которая, в свою очередь, обратно коррелирует с отношением тета/альфа. Некоторые исследователи также отмечали роль серотониновой гипофункции в модуляции импульсивного акта [39–41], что согласуется с результатами нашего исследования, где повышение уровня импульсивности обратно коррелирует с содержанием триптофана, предшественника серотонина. Полученные результаты согласуются и с данными недавнего исследования Meade C.S. с соавт. [42], в котором клиническими методами и методами нейровизуализации доказывается дисфункция лобно-теменной коры, связанная с повышением импульсивности.
Заключение
Поиск нейрофизиологических маркеров поведения моноаминовых систем у детей с синдромом дефицита внимания с гиперактивностью обусловлен, прежде всего, заинтересованностью практических врачей в подборе схем эффективной и персонализированной терапии в связи с тем, что электроэнцефалографическое исследование относится к неинвазивным методикам обследования, рутинным методам диагностики, внесенным в стандарты диагностики. Поэтому данные о зависимости отношения мощности тета- и альфа-ритмов в ЭЭГ от уровня активности серотониновой и норадренергической систем в перспективных исследованиях могут служить ориентиром терапевтической эффективности в комплексной реабилитации детей с СДВГ.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Информация об авторах:
Гасанов Рауф Фаикович – e-mail: raufgasanov@mail.ru; http://orcid.org/0000-0002-3045-333X
Макаров Игорь Владимирович - e-mail: ppsy@list.ru; http://orcid.org/0000-0003-0176-3846
Емелина Дарья Андреевна - e-mail: dashaberkos@mail.ru; http://orcid.org/ 0000-0002-8189-1479
Как цитировать: Гасанов Р.Ф., Макаров И.В., Емелина Д.А. Количественная ЭЭГ у детей с комбинированным вариантом синдрома дефицита внимания с гиперактивностью. Психиатрия и психофармакотерапия. 2022.
Information about the authors:
Rauf F. Gasanov – e-mail: raufgasanov@mail.ru; http://orcid.org/0000-0002-3045-333X
Igor V. Makarov - e-mail: ppsy@list.ru; http://orcid.org/0000-0003-0176-3846
Daria A. Emelina - e-mail: dashaberkos@mail.ru; http://orcid.org/0000-0002-8189-1479
R.F. Gasanov1, I.V. Makarov1,2, D.A. Emelina1
Abstract
Attention deficit hyperactivity disorder (ADHD) is diagnosed in 3-5% of children worldwide. Electroencephalography (EEG) studies in children with ADHD provide data on various aspects of brain function.
Aims: identification of neurophysiological correlates of clinical symptoms of this disorder and their relationship with the state of monoamine metabolism in children with attention deficit hyperactivity disorder.
Material and methods. The test group comprised 404 patients aged 6-8 years diagnosed with ADHD combined type; the control group included 90 typically developing peers. All participants underwent EEG recording, and the power ratios of theta and alpha rhythms (theta/alpha) were calculated. We determined the content of monoamines, their precursors, and metabolic products in daily urine and measured clinical symptoms of ADHD (inattention, hyperactivity, and impulsivity) using the SNAP-IV scale.
Results. The study revealed that impulsivity indicator and urine content of tryptophan inversely correlate with theta/alpha ratio in left central parietal sites. On the other hand, an in-creased level of vanillylmandelic acid leads to a higher indicator of impulsivity and a lower the-ta/alpha ratio.
Conclusion: The obtained data suggest that the theta / alpha electroencephalographic in-dex can serve as a marker of impulsivity in children with ADHD and reflects the established state of imbalance in monoamine systems.
Key words: attention deficit hyperactivity disorder, noradrenergic system, serotonin sys-tem, electroencephalographic markers of ADHD.
For citation: R.F. Gasanov, I.V. Makarov, D.A. Emelina. Quantitative EEG in children with a combined variant attention deficit hy-peractivity disorder. Psychiatry and psychopharmacotherapy. 2022; 2: 40–45.
Вступление
Синдром дефицита внимания с гиперактивностью (СДВГ) – это расстройство поведения и психического развития, характеризующееся невнимательностью, гиперактивностью и импульсивностью, влияющие на когнитивную функцию человека и определяющие нарушение адаптации в обществе [1]. СДВГ – одно из наиболее часто встречающихся расстройств детского возраста, распространенность которого оценивается примерно в 3–5% среди школьников, причем мальчики страдают в 2–4 раза чаще, чем девочки [2]. СДВГ относится к многофакторным нейрокогнитивным расстройствам, в патогенезе которого ключевую роль играют нарушения обмена моноаминов [3–5]. Основная дисфункция мозга, которая приводит к нарушениям поведения, не совсем понятна, хотя известно, что включает в себя некоторую форму аномальной функциональной связи, варьирующей в разных областях мозга [6].
В последнее время в работах, посвященных количественной ЭЭГ у детей с СДВГ, выделяют Mu-волны с частотным диапазоном 8–13 Гц, представляющие функциональную активность сенсомоторной коры [7, 8]. Подавление Mu-волн может указывать на работу моторных зеркальных нейронов и дефицит подавления Mu и может играть вероятную роль в патогенезе дефицита внимания с гиперактивностью [9]. Спектральный анализ мощности позволяет топографическое представление и статистический анализ ЭЭГ с использованием цифровой ЭЭГ, как было рекомендовано Американской академией неврологии [10]. Расчет абсолютной и относительной оценки мощности – наиболее часто используемая форма количественной ЭЭГ при СДВГ. Повышение активности медленных волн и недостаток альфа-активности наблюдались у детей с СДВГ [11].
Особый интерес вызывают исследования R. Chabot и G. Serfonstein [12], которые выделили два основных типа изменений у детей с СДВГ: первый тип характеризуется усилением тета-ритма при нормальной средней частоте альфа-ритма; второй характеризуется усилением тета-ритма, сопровождающимся снижением средней частоты альфа-ритма. Эти находки, по мнению авторов статьи, могут свидетельствовать о разнонаправленных изменениях функционального состояния головного мозга. ЭЭГ-исследования детей с синдромом дефицита внимания выявляют повышенную мощность тета-активности [10, 12–16], увеличение в задних отделах дельта-активности [17] и снижение мощности альфа-ритма [18].
Согласно литературным данным, отношение мощностей тета/альфа признано одним из наиболее чувствительных показателей количественной ЭЭГ у детей с СДВГ [13, 19, 20]. Этот показатель считается маркером для идентификации данного расстройства и весьма информативен для отражения взаимоотношений альфа- и тета-активности [21]. Повышение отношения тета/альфа (в затылочных областях) может свидетельствовать о дефиците альфа-активности, вызванном дисфункцией корковых и таламо-кортикальных систем, и некоторыми авторами рассматриваться как задержка в созревании сетей, формирующих основной ритм спокойного расслабленного бодрствования [21].
Однако среди многочисленных исследований количественной ЭЭГ у детей с СДВГ отсутствуют данных об их связи с особенностями обмена моноаминов, хотя полученные данные могли бы быть полезны в построении тактики терапевтического вмешательства в ходе подбора персонализированной терапии. Кроме того, в большинстве статей результаты исследований основаны на малом количестве обследованных. В связи с этим настоящее исследование было предпринято с целью не только оценки нейрофизиологических коррелятов клинических симптомов данного расстройства, но и их связи с состоянием обмена моноаминов у детей с синдромом дефицита внимания с гиперактивностью.
Материалы и методы
Основную группу детей с СДВГ составили 404 ребенка с комбинированным вариантом синдрома дефицита внимания с гиперактивностью в возрасте 6–8 лет, находящиеся на лечении в НМИЦ ПН им. В.М. Бехтерева. Контрольную группу составляло 90 детей (54 мальчика и 36 девочек) без признаков гиперактивности и прогредиентных нервно-психических расстройств, преимущественно с расстройством поведения по причине нарушения детско-родительских отношений.
Определялись биохимические параметры в суточной моче: содержание дофамина (ДА), норадреналина (НА), адреналина (А) и серотонина (Сер), их метаболитов – гомованилиновой кислоты (ГВК – метаболит ДА), ванилилминдальной кислоты (ВМК – метаболит НА), 5-гидрокситриптофана (5-HTP – метаболит триптофана) и 5-оксииндолуксусной кислоты (5-ОУИК – метаболит серотонина), а также их предшественников – триптофана и тирозина. Перечисленные биохимические параметры изучались в суточной моче в Независимых лабораториях Северо-Западного центра доказательной медицины методом высо-коэффективной жидкостной хроматографии с электрохимической детекцией с учетом возраста пациента и анализом соответствию референтных значений [22, 23].
Регистрация и анализ ЭЭГ осуществлялись по общепринятой методике с помощью компьютерного телеметрического электроэнцефалографа («Телепат 104-Д», г. Санкт-Петербург). ЭЭГ – потенциалы отводили монополярно от локусов F1, F2, F3, F4, С3, С4, P3, P4, O1, O2 в соответствии с международной системой «10–20». Отведения Т3–Т6 ис-ключены из анализа в связи с обилием двигательных артефактов, связанных с особенностью изучаемого расстройства. У детей регистрировали ЭЭГ при закрытых и открытых глазах в состоянии двигательного покоя. В составе ЭЭГ дифференцировались следующие диапазоны: тета-ритм (4–8 Гц) и альфа-ритм (8–13 Гц). Рассчитывалось также отношение мощности тета- и альфа-ритмов (тета/альфа).
Для балльной оценки тяжести симптомов СДВГ использовалась шкала SNAP-IV. Шкала предназначена для родителей детей с СДВГ и состоит из 43 вопросов, позволяющих в баллах оценить степень невнимательности, гиперактивности и импульсивности [24].
Статистический анализ данных проводился с помощью стандартного пакета прикладных программ IBM SPSS Statistics (версия 19). При сравнении нескольких независимых выборок количественных данных, имеющих распределение отличное от нормального, использовался критерий Краскела–Уоллиса ANOVA с процедурой множественного сравнения. Для сопоставления частот использован критерий χ2 Пирсона и корреляционный коэффициент Спирмена.
Все этапы исследования соответствовали принципам, заложенным в Хельсинкской декларации Всемирной медицинской ассоциации (2013), что было подтверждено Независимым этическим комитетом при НМИЦ ПН им. В.М. Бехтерева.
Результаты
В ходе анализа данных ЭЭГ было установлено, что характеристики мощности ритмов у обследованных детей отличаются в широком диапазоне. При этом устанавливается пропорциональное изменение мощности диапазонов тета- и альфа-активности. В связи с этим, а также учитывая указания многих авторов на чувствительность показателей тета/альфа, был проведен сравнительный анализ данных. Результаты исследования представлены в в табл. 1.
Как видно из таблицы 1, мощности тета- и альфа-ритмов в основной и контрольной группах значимо отличаются во всех отведениях, а их отношения преобладают в группе контроля во всех отведениях правой гемисферы и билатерально в центрально-теменных отведениях.
У детей с СДВГ изучалось содержание моноаминов, их предшественников и продуктов метаболизма с целью дальнейшего выявления связей с нейрофизиологическими показателями (табл. 2). Как видно из табл. 2, основная группа детей с СДВГ значимо отличалась от контрольной по всем биохимическим параметрам за исключением показателя серотонина.
С целью установления связи между биохимическими параметрами и показателями невнимательности, гиперактивности и импульсивности у детей основной группы был проведен корреляционный анализ. Результаты анализа обнаружили значимые корреляционные связи только со звеньями обмена катехоламинов с показателями невнимательности, гиперактивности импульсивности, и не обнаружилась взаимосвязь основных клинических показателей СДВГ со звеньями индоламиновой системы, за исключением их предшественника, триптофана. Причем уровень триптофана образует корреляционные зависимо-сти со всеми клиническими показателями. Однако если с показателем невнимательности уровень триптофана образует положительную корреляционную связь, то с показателями гиперактивности и импульсивности – отрицательную (табл. 3).
Наибольшее количество значимых корреляционных связей уровней моноаминов у детей с СДВГ обнаружено с показателями невнимательности, наименьшее – с показателями импульсивности. Но во всех случаях отмечается вовлечение разных звеньев обмена моноаминов. Это согласуется с точкой зрения F. Aboitiz с соавт. [26], которые объясняли развитие симптомокомплекса синдрома дефицита внимания у детей с нарушением регуляции базального тонизирующего уровня катехоламинергических систем через расстройства фазической сигнализации в сетях базового режима, выявления значимости и исполнительного управления.С целью установления связей между показателем тета/альфа с основными симптомами СДВГ (невнимательностью, гиперактивностью, импульсивностью) и звеньями обмена моноаминов проводился корреляционный анализ, результаты которого представлены в таблицах 4 и 5. Между показателями тета/альфа и уровнем моноаминов были получены многочисленные, в основном отрицательные, корреляции во всех отведениях (табл. 4). Однако с показателями клинических симптомов СДВГ, напротив, значимыми оказались лишь единичные отрицательные корреляции отношения тета/альфа. И только с показателями гиперактивности и импульсивности (табл. 5). Полученные результаты складываются в схему, в которой можно рассматривать корреляционные связи с симптомами гиперактивности и импульсивности с показателем отношения тета/альфа в правых заднелобных и левых центрально-теменных отведениях. Причем показатель гиперактивности отрицательно коррелирует с отношением тета/альфа только в правых заднелобных отведениях (табл. 5), хотя и не отличается от группы контроля (табл. 1). Напротив, показатель импульсивности, кроме отрицательной корреляции с отношением тета/альфа в правых заднелобных отведениях, образует значимые корреляционные связи с показателем тета/альфа в левых центральных и теменных отведениях, где он значимо уступает группе контроля (табл. 1, 5). Следовательно, на наш взгляд, взаимосвязь нейрофизиологической характеристики (отношение тета/альфа), биохимических параметров (уровни экскреции моноаминов) и клинических симптомов СДВГ целесообразно производить только в отношении показателя импульсивности.
Оценивая показатель импульсивности, необходимо отметить, что он отрицательно коррелирует со сниженным относительно группы контроля показателем тета/альфа (табл. 1) в левых центрально-теменных отведениях (табл. 5). В свою очередь, более низкий по сравнению с группой контроля уровень триптофана (табл. 2) отрицательно связан как с отношением тета/альфа в левых центрально-париетальных отведениях (табл. 4), так и с показателем импульсивности (табл. 3). С другой стороны, содержание продукта обмена катехоламинов, ванилилминдальной кислоты (также значимо уступающее группе контроля), положительно коррелирует только с показателем импульсивности и связано с отношением тета/альфа в левых центрально-париетальных отведениях. Таким образом, чем выше показатель импульсивности у детей с СДВГ, тем ниже отношение тета/альфа в левых центрально-париетальных отведениях. И чем ниже уровень триптофана, тем выше показатель отношения тета/альфа в левых центрально-теменных отведениях. С другой стороны, повышение уровня продукта метаболизма катехоламинов, ванилилминдальной кислоты, связано с повышением импульсивности и снижением показателя тета/альфа.
Обсуждение
Фронтопариетальная система внимания, по мнению R. Ptak [31], опирается на результаты интегрированной информации о сенсорных событиях (главным образом, зрительных) и нисходящих влияний от дорзолатерального префронтального кортекса, которые инициированы целями поведенческих актов с учетом ожидаемых результатов этого действия. Это создает карту приоритетов. Сформированная карта приоритетов, по мнению автора, позволяет обеспечить как обработку сенсорных карт, так и оперативно их корректировать в зависимости от целей поведения. В эти сложные акты включаются нейронные сети внутритеменной борозды, нижнетеменной коры и фронтальной зрительной зоны. Созданная R. Ptak нейрокогнитивная модель описывает роль дорзолатерального префронтального кортекса в удерживании целей поведения в рабочей памяти, а нижней теменной коры – в инициации переключения внимания с созданием условий для устойчивости процесса внимания на значимых стимулах. Эти данные во многом объясняют обнаруженную взаимосвязь показателя тета/альфа с клиническими симптомами у детей с СДВГ именно в центрально-теменных отведениях. Однако данная модель не позволяет ответить на вопрос, почему значимые корреляции образованы с показателем импульсивности, а не невнимательности. Механизмы формирования импульсивности оказались гораздо сложнее расстройства функции внимания, поскольку, с одной стороны, обеспечиваются несостоятельностью системы внимания, а с другой – формируют нарушения поведения в широком спектре психопатологических синдромов. Согласно теории гиперактивных, детерминантных системных расстройств центральной нервной системы Г.Н. Крыжановского [32], в основе патологического процесса лежит дисфункция, вызванная повреждением одного из участков ЦНС. Это ведет к ослаблению тормозных механизмов и гиперактивации нейронных структур с образованием так называемого «генератора патологически усиленного возбуждения» (ГПУВ). Формирование ГПУВ при синдроме дефицита внимания обусловлено ослаблением тормозного влияния фронто-орбитальной коры на отдельные участки кортекса. Действительно, в литературе описываются разнообразные морфологические изменения у детей с синдромом дефицита внимания, среди которых преобладают данные о страдании лобного вещества головного мозга [33–36]. Вероятнее всего, описанная R. Ptak теория фронто-париетальной системы внимания [31] может быть расширена не только функцией удержания целей когнитивного акта лобно-теменной сетью, но и торможением не относящихся к цели опережающих двигательных актов. И чем слабее ее тормозное влияние, тем более выражены характеристики импульсивности. Известно, что серотониновая и норадренергическая системы тесно связаны. Так, норадреналин может оказывать как прямое, активирующее влияние на функции серотониновых рецепторов, так и обратное, тормозящее [37].
В свою очередь, серотонин подавляет активность норадреналина [38]. Возможно, по этой причине в нашем исследовании повышение уровня импульсивности положительно коррелирует с содержанием продукта обмена катехоламинов, ванилилминдальной кислотой, которая, в свою очередь, обратно коррелирует с отношением тета/альфа. Некоторые исследователи также отмечали роль серотониновой гипофункции в модуляции импульсивного акта [39–41], что согласуется с результатами нашего исследования, где повышение уровня импульсивности обратно коррелирует с содержанием триптофана, предшественника серотонина. Полученные результаты согласуются и с данными недавнего исследования Meade C.S. с соавт. [42], в котором клиническими методами и методами нейровизуализации доказывается дисфункция лобно-теменной коры, связанная с повышением импульсивности.
Заключение
Поиск нейрофизиологических маркеров поведения моноаминовых систем у детей с синдромом дефицита внимания с гиперактивностью обусловлен, прежде всего, заинтересованностью практических врачей в подборе схем эффективной и персонализированной терапии в связи с тем, что электроэнцефалографическое исследование относится к неинвазивным методикам обследования, рутинным методам диагностики, внесенным в стандарты диагностики. Поэтому данные о зависимости отношения мощности тета- и альфа-ритмов в ЭЭГ от уровня активности серотониновой и норадренергической систем в перспективных исследованиях могут служить ориентиром терапевтической эффективности в комплексной реабилитации детей с СДВГ.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Информация об авторах:
Гасанов Рауф Фаикович – e-mail: raufgasanov@mail.ru; http://orcid.org/0000-0002-3045-333X
Макаров Игорь Владимирович - e-mail: ppsy@list.ru; http://orcid.org/0000-0003-0176-3846
Емелина Дарья Андреевна - e-mail: dashaberkos@mail.ru; http://orcid.org/ 0000-0002-8189-1479
Как цитировать: Гасанов Р.Ф., Макаров И.В., Емелина Д.А. Количественная ЭЭГ у детей с комбинированным вариантом синдрома дефицита внимания с гиперактивностью. Психиатрия и психофармакотерапия. 2022.
Information about the authors:
Rauf F. Gasanov – e-mail: raufgasanov@mail.ru; http://orcid.org/0000-0002-3045-333X
Igor V. Makarov - e-mail: ppsy@list.ru; http://orcid.org/0000-0003-0176-3846
Daria A. Emelina - e-mail: dashaberkos@mail.ru; http://orcid.org/0000-0002-8189-1479
Список исп. литературыСкрыть список1. Beheshti A., Chavanon M.L., Christiansen H. Emotion dysregulation in adults with atten-tion deficit hyperactivity disorder: a meta-analysis // BMC psychiatry. 2020. 20(1), 120. https://doi.org/10.1186/s12888-020-2442-7.
2. Geffen J., Forster K. Treatment of adult ADHD: a clinical perspective // Therapeutic ad-vances in psychopharmacology. 2018. 8(1). 25–32. https://doi.org/10.1177/2045125317734977.
3. Castellanos F.X., Rapoport J.L. Etiology of attention deficit hyperactivity disorder // Child Adolesc. Psychiat. Clin. N. Am. 1992. 1. 373–384.
4. Oades R.D. The role of norepinephrine and serotonin in ADHD // Attention Deficit Hy-peractivity Disorder: From Genes to Animal Models to Patients / D. Gozal, D.L.Molfese (Eds.). 2005. 97– 130.
5. Oades R.D., Sadile A.G., Sagvolden T. et al. The control of responsiveness in ADHD by catecholamines: evidence for dopaminergic, noradrenergic, and interactive roles // De-velopmental Science. 2005. 8. 122–131.
6. Noonan S.K., Haist F., Muller R.A. Aberrant functional connectivity in autism: evidence from low-frequency BOLD signal fluctuations // Brain Res. 2009. 1262. 48-63.
7. Риццолатти Д., Синигалья К. Зеркала в мозге: о механизмах совместного действия и сопереживания / Пер. с англ. О. А. Кураковой, М. В. Фаликман. М.: Языки сла-вянских культур, 2012.
8. Gastaut H. Etude electrocorticographique de al reactivite des rhytmes rolandiques // Rev. Neurol. 1952. 87 (2). 176–182.
9. Oberman L.M., Hubbard E.M., McCleery J.P. et al. EEG Evidence for mirror neuron dysfunction in autism spectrum disorders // Cognitive Brain Research. 2005. 24 (2). 190-198.
10. Janzen T., Graap K., Stephanson S., Marshall W., Fitzsimmons G. Differences in base-line EEG measures for ADD and normally achieving preadolescent males // Biofeedback Self-Regul. 1995. 20. 65–82.
11. Jensen P.S., Garcia J.A., Glied S. Cost effectiveness of ADHD treatment: finding from the multimodal treatment study of children with ADHD // The American Journal of Psy-chiatry. 2000. 162. 1628-36.
12. Chabot R.J., Serfontein G. Quantitative electroencephalographic profiles of children with attention deficit disorder // Biol. Psychiatry.1996. 40(10). 951-963.
13. Clarke A., Barry R., McCarthy R., Selikowitz M. Age and sex effects in the EEG: differ-ences in two subtypes of attention-deficit/hyperactivity disorder // Clin Neurophysiol. 2001. 112. 815–826.
14. Clarke A.R., Barry R.J., McCarthy R., Selikowitz M. EEG analysis of children with at-tention-deficit/hyperactivity disorder and comorbid reading disabilities // J Learn Disabil. 2002. 35(3). 276-285.
15. Lazzaro I., Gordon E., Whitmont S., Plahn M., Li W., Clarke S., Dosen A., Meares R. Quantified EEG activity in adolescent attention deficit hyperactivity disorder // Clin Elec-troenceph. 1998. 29. 37–42.
16. Mann C., Lubar J., Zimmerman A., Miller C., Muenchen R. Quantitative analysis of EEG in boys with attention deficit hyperactivity disorder: controlled study with clinical impli-cations // Pediatr Neurol. 1992. 8. 30–36.
17. Matousek M., Rasmussen P., Gilberg C. EEG frequency analysis in children with so-called minimal brain dysfunction and related disorders // Adv Biol Psychiatry. 1984. 15. 102–108.
18. Callaway E., Halliday R., Naylor H. Hyperactive children's event-related potentials fail to support underarousal and maturational-lag theories // Arch Gen Psychiatry. 1983. 40. 1243–1248.
19. Barry R.J., Clarke A.R., Johnstone S.J. A review of electrophysiology in attention-deficit hyperactivity disorder: I. Qualitative and quantitative electroencephalography // Clinical Neurophysiology. 2003. 114. 171–183.
20. Loo S.K., Barkley R.A. Clinical utility of EEG in attention deficit hyperactivity disorder // Applied Neuropsychology. 2005. 12. 64–76.
21. Ucles P., Lorente S. Electrophysiologic measures of delayed maturation in attention-deficit hyperactivity disorder // Clinical Neurophysiology. 1996. 11. 155–156.
22. Энциклопедия клинических лабораторных тестов. М.: ЮНИМЕД–пресс, 2003.
23. Textbook of Clinical Chemistry and Molecular Diagnostics, 6 ed. Elsevier-Health Sciences Division, 2017.
24. Swanson J.M. School-based assessments and interventions for ADD students. Irvine: K.C.Publishing, 1992.
25. Russell V.A. Hypodopaminergic and hypernoradrenergic activity in prefrontal cortex slices of an animal model for attention-deficit hyperactivity disorder--the spontaneously hypertensive rat // Behav Brain Res. 2002. 130(1-2). 191 – 196.
26. Aboitiz F., Ossandón T., Zamorano F., Palma B., Carrasco X. Irrelevant stimulus pro-cessing in ADHD: catecholamine dynamics and attentional networks // Front. Psychol. 2014. 175 – 183.
27. Fan J., Gu X., Guise K.G., Liu X., Fossella J., Wang H., Posner M.I. Testing the behav-ioral interaction and integration of attentional networks // Brain Cogn. 2009. 70(2). 209–220.
28. Posner M.I., Fan J. Attention as an organ system. Topics in integrative neuroscience: From cells to cognition / Ed. Pomerantz J.R. Cambridge: Cambridge University Press, 2008. 31–62.
29. Posner M.I., Petersen S.E. The attention system of the human brain // Annu. Rev. Neuro-sci. 1990. 13. 25–42.
30. Corbetta M. Frontoparietal cortical networks for directing attention and the eye to visual locations: Identical, independent, or overlapping neural systems? // Proc. Natl. Acad. Sci. USA. 1998. 95(3). 831–838.
31. Ptak R. The frontoparietal attention network of the human brain: Action, saliency, and a priority map of the environment // The Neuroscientist. 2011. 18(5). 502–515.
32. Крыжановский Г. Н. Детерминантные структуры в патологии нервной системы: ге-нераторные механизмы нейропатологических синдромов. М.,1980.
33. Barkley R.A., Grodzinsky G., DuPaul G.J. Frontal lobe functions in attention deficit dis-order with and without hyperactivity: A review and research report // Journal of Abnor-mal Child Psychology. 1992. 20(2). 163–188.
34. Baving L., Laucht M., Schmidt M.H. Atypical frontal brain activation in ADHD: pre-school and elementary school boys and girls // J Am Acad Child Adolesc Psychiatry 1999. 38. 1363–1371.
35. Ernst M., Liebenauer L., King A. et al. Reduced brain metabolism in hyperactive girls // J Am Acad Child Adolesc Psychiatry. 1994. 33. 858–868.
36. Magara F., Ricceri L., Wolfer D.P. et al. The acallosal mouse strain I/LnJ: a putative model of ADHD? // Neurosci Biobehav Rev. 2000. 24. 45–50.
37. Бобров А.Е., Краснослободцева Л.А., Мутных Е.М. Психофармакология адренер-гической системы мозга и возможности применения пирроксана // Психиатрия и психофармакотерапия им. П.Б. Ганнушкина. 2019. 21. № 2. С. 16–30.
38. Lucki I., O’Leary O.F. Distinguishing roles for norepinephrine and serotonin in the be-havioral effects of antidepressant drugs // J Clin Psychiatry 2004. 65 (Suppl. 4). 11–24.
39. Гасанов Р.Ф. Роль серотониновой системы в патогенезе синдрома дефицита внима-ния с учетом гетерогенности расстройства // Обозрение психиатрии и мед. психо-логии им. В.М. Бехтерева. 2015. 4. С. 39-50.
40. Seo D., Patrick C.J., Kennealy P.J. Role of serotonin and dopamine system inter-actions in the neurobiology of impulsive aggression and its comorbidity with other clinical disor-ders // Aggression and violent behavior. 2008. 13(5). 383–395.
41. Wolff M.C., Leander J.D. Selective serotonin reuptake inhibitors decrease impulsive be-havior as measured by an adjusting delay procedure in the pigeon // Neuropsychophar-macology. 2002. 27(3). 421-429.
42. Meade C.S., Bell R.P., Towe S.L., Hall S.A. Cocaine-related alterations in fronto-parietal gray matter volume correlate with trait and behavioral impulsivity // Drug Alcohol De-pend. 2020 Jan 1;206:107757. doi: 10.1016/j.drugalcdep.2019.107757.


