Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№06 2008
Индивидуальный выбор современной психофармакотерапии шизофрении (основные принципы, обсуждение результатов клинических исследований и некоторые практические рекомендации) №06 2008
Номера страниц в выпуске:50-57
Индивидуальный выбор психофармакотерапии является важной задачей организации лечебного процесса у больных шизофренией, решение которой ложится на практикующих врачей. В настоящее время осуществить такой выбор на практике довольно непросто, поскольку арсенал нейролептиков, доступных для применения, насчитывает около четырех десятков различных средств и продолжает расширяться. В этих условиях большое значение для рационального выбора терапии имеет разработка научно обоснованной схемы дифференцированного подхода к применению современных антипсихотических средств.
Индивидуальный выбор психофармакотерапии является важной задачей организации лечебного процесса у больных шизофренией, решение которой ложится на практикующих врачей. В настоящее время осуществить такой выбор на практике довольно непросто, поскольку арсенал нейролептиков, доступных для применения, насчитывает около четырех десятков различных средств и продолжает расширяться (табл. 1). В этих условиях большое значение для рационального выбора терапии имеет разработка научно обоснованной схемы дифференцированного подхода к применению современных антипсихотических средств.

Традиционно дифференцированный выбор терапии шизофрении основывался на позиции различия спектра психотропной активности разных нейролептиков. Было показано, что антипсихотические средства могут различаться по выраженности общего антипсихотического эффекта (высокопотентные и низкопотентные нейролептики), стимулирующего и первичного седативного эффектов (активирующие и седативные нейролептики), профилю селективного антипсихотического действия (нейролептики преимущественно с антигаллюцинаторной, антибредовой, антиманиакальной, антикататонической и другими видами активности). Индивидуальный выбор терапии предлагалось осуществлять при помощи сопоставления клинических особенностей состояния больного и профилей психотропной активности нейролептиков. На этом основании были разработаны рекомендации применения различных традиционных нейролептиков, которые значительно упрощали выбор терапии в условиях клинической практики. Например, основными показаниями к назначению галоперидола и трифлуоперазина считались галлюцинаторно-бредовые состояния при приступообразной и непрерывной шизофрении; тиопроперазина – кататоно-гебефренические расстройства при ее злокачественном течении; перициазина и тиоридазина – психопатоподобная симптоматика в рамках вялотекущей шизофрении; сульпирида и карбидина – депрессивно-параноидные расстройства при периодической шизофрении, субдепрессия и апатия при ее вялом течении.
В настоящее время принципы дифференцированного подхода к применению антипсихотических средств при лечении шизофрении значительно дополнены. Большое внимание при выборе терапии предлагается уделять не только такому важному клиническому фактору, как эффективность лечения, но и другим клиническим (переносимость терапии), психологическим (качество жизни, соблюдение режима приема лекарств, риск стигматизации), социальным (социальная адаптация и функционирование) и экономическим характеристикам (затраты на лечение). Показано, что негативное влияние терапии на эти показатели может значительно ухудшать эффективность лечебного вмешательства и, напротив, их оптимизация способствует повышению эффективности лечебного процесса. Например, субъективная тягостность лечения или изменение внешнего вида больного из-за развития побочных эффектов, низкая социальная адаптация из-за недостаточной эффективности терапии, экономические потери из-за высоких затрат на приобретение лекарств могут стать причиной отказа больных от приема антипсихотических средств и, таким образом, привести к неэффективности медицинского вмешательства.
Одновременно с уточнением принципов дифференцированного подхода к применению нейролептиков большое распространение получила точка зрения о равной эффективности всех антипсихотических средств, отсутствии в профиле их психотропной активности избирательного антипсихотического действия и различии нейролептиков только в спектре побочных эффектов [35, 61, 65, 77, 93]. Поэтому многие авторы современных стандартов лечения шизофрении указывают на то, что основным критерием выбора терапии должна являться ее переносимость. При выборе лечения в первую очередь предлагается применять нейролептики с хорошей переносимостью, а средства, вызывающие выраженные побочные эффекты, рекомендуется использовать в последнюю очередь. Необходимо отметить, что по сравнению со многими другими лекарственными средствами, используемыми в медицине, нейролептические препараты считаются относительно безопасными для здоровья, однако их применение может приводить к ухудшению качества жизни и стигматизации.
Эффективность современных антипсихотических
средств
Высокая эффективность традиционных нейролептиков и клозапина не вызывает сомнений. Она доказана результатами многочисленных исследований и длительным опытом их применения в клинической практике [4, 25, 32, 59, 60, 93]. В последние годы была проведена повторная систематизация данных об эффективности этих средств при лечении шизофрении с учетом принципов доказательной медицины. Она вновь подтвердила способность типичных нейролептиков (хлорпромазин, трифлуоперазин, тиоридазин, перфеназин, галоперидол, пимозид, пенфлюридол, флуфеназин) сглаживать основные проявления психоза [46, 80, 87, 95, 108, 109, 118, 123]. Спорными остаются данные об эффективности лишь нескольких средств этой группы – промазина, мепазина и прохлорперазина [61, 93]. К сожалению, традиционные нейролептики малоэффективны при лечении дефицитарных расстройств. Однако их регулярный прием сдерживает прогрессирование болезни и тем самым позволяет замедлить формирование шизофренического дефекта. Клозапин является единственным средством, антипсихотическое действие которого более выражено, чем у других нейролептиков. Поэтому его применение рекомендовано в резистентных случаях заболевания [34, 41, 62, 65, 67, 93, 132]. Назначение клозапина приводит к улучшению состояния у 30–60% таких больных. Получены данные об эффективности длительного применения клозапина при лечении дефицитарных расстройств, но они нуждаются в дальнейшем подтверждении. В то же время существуют определенные разногласия в оценке скорости наступления терапевтического эффекта при использовании клозапина в резистентных случаях заболевания. По некоторым данным, состояние больных улучшается уже через несколько недель после начала лечения [119]. Результаты других исследований свидетельствуют об эффекте при более длительной терапии [124]. Разногласие в вопросе скорости наступления терапевтического эффекта при применении клозапина, вероятно, связано с различием тяжести состояния обследованных больных.
Результаты строго спланированных исследований свидетельствуют, что атипичные нейролептики нового поколения по эффективности значительно превосходят плацебо и сопоставимы с традиционными средствами [28, 38, 55, 65, 77, 78]. Некоторые данные даже указывают на их превосходство над препаратами типичного ряда [19, 23, 70, 82, 103]. Обобщающие систематические обзоры в целом подтверждают результаты отдельных клинических исследований эффективности рисперидона, оланзапина, зипразидона, амисульприда, арипипразола, палиперидона и зотепина (табл. 2).
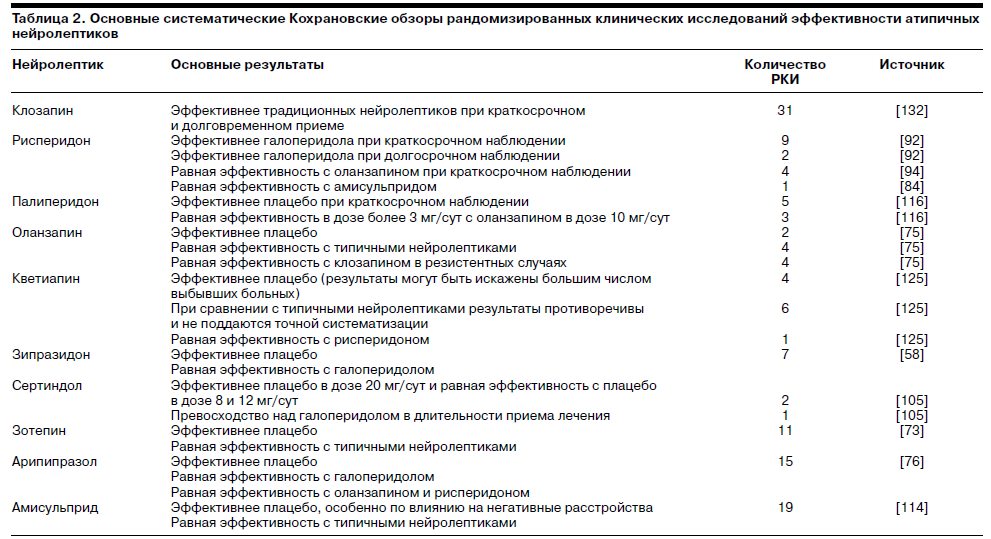
Считается, что пока не получено убедительных доказательств высокой эффективности кветиапина и сертиндола. Например, эффективность сертиндола в дозе 8 и 12 мг/сут сопоставима с плацебо, хотя в дозе 20 мг/сут превосходит его [105]. Данные об эффективности кветиапина довольно противоречивы и не поддаются точной систематизации [125].
В последнее время высказывается мнение, что высокая эффективность атипичных нейролептиков нового поколения не всегда подтверждается при их применении в повседневной клинической практике [1, 2, 21, 39, 43, 47, 89]. Довольно часто врачи сталкиваются с ситуацией, при которой назначение атипичных средств незначительно улучшает состояние больных, в то время как применение других нейролептиков оказывается довольно эффективным. Интересно мнение клинических фармакологов, которые указывают на нередко возникающую проблему несоответствия результатов клинических испытаний и данных, полученных на практике [79, 115].
Различие результатов клинических исследований эффективности атипичных нейролептиков и данных, полученных на практике, связывается с несколькими факторами. Оно может быть обусловлено нерепрезентативностью выборок больных в строго спланированных исследованиях из-за жестких критериев включения и исключения [2, 88]. При проведении клинических исследований обычно формируются однородные группы больных, в которые могут не войти пациенты с клиническими характеристиками, отличающимися от заданного “стандарта”. В них обычно не включают больных с сопутствующими заболеваниями. Во время исследования пациенты, как правило, принимают только один “изучаемый” нейролептик. Многие исследования непродолжительны, поэтому больные лучше соблюдают режим лечения по сравнению с обычными условиями. Авторы некоторых систематических обзоров, проведенных с учетом принципов доказательной медицины, указывают на предварительность вывода о высокой эффективности атипичных средств из-за недостаточной длительности наблюдений, небольшого числа обследованных больных или неизученности влияния терапии на ряд клинических характеристик [101].
В исследованиях часто используется различная методика (несопоставимые дозы нейролептиков, разная длительность наблюдения, неоднородные методы оценки динамики состояния). Это приводит к трудности сопоставления полученных результатов и их экстраполяции на всю популяцию больных. Например, показательна развернувшаяся недавно на страницах печати дискуссия о возможном искажении данных об эффективности атипичных нейролептиков в связи с применением слишком высоких доз традиционных средств, использовавшихся в качестве препаратов сравнения [70, 82]. Это могло привести к переоценке эффективности атипичных средств при лечении негативных расстройств и “завышению” данных об их хорошей переносимости. Напротив, в некоторых исследованиях терапевтические дозы атипичных нейролептиков сравниваются с субтерапевтическими дозировками препаратов типичного ряда. Например, авторы одного из таких исследований пришли к выводу, что невысокие дозы галоперидола сопоставимы по эффективности со стандартными дозами рисперидона и оланзапина [54].
При планировании строго организованных исследований существует высокая вероятность того, что в исследуемую группу включают пациентов с фактически несопоставимыми, а лишь формально сходными расстройствами. Это связано с тем, что для демонстрации сопоставимости основной и контрольной групп в начале исследования чаще всего используют оценку по стандартизированным шкалам без сравнения клинических характеристик, которые не поддаются количественному измерению. Например, часто не проводится синдромальная оценка состояния больных или не учитывается темп прогрессирования болезни. Показателен пример изучения эффективности атипичных нейролептиков в отношении негативных расстройств. Многие исследования демонстрируют, что их применение способствует оживлению эмоций и активизации длительно болеющих пациентов. Такое наблюдение привело к представлению о высокой эффективности атипичных средств в отношении симптомов шизофренического дефекта. Однако результаты дальнейших более тщательно спланированных исследований показали, что активизация больных связана с влиянием терапии на вторичные негативные расстройства, а не на дефицитарную симптоматику [52, 61, 99]. Подобная “изолированная” количественная оценка также может привести к тому, что в одну группу попадают пациенты с фактически несопоставимыми продуктивными расстройствами, при которых эффективность терапии значительно различается, например острым и хроническим параноидом.
При проведении строго спланированных исследований эффективность нейролептиков, как правило, оценивают количественно на основании сопоставления динамики психопатологической симптоматики по стандартизированным шкалам без детальной оценки изменения различных клинических характеристик. В качестве критерия эффективности терапии берут “различие среднего балла” по сравнению с группой контроля или исходным уровнем. При этом не учитывают важные клинико-описательные характеристики, например тип и качество сформированной ремиссии или число больных со сформированной критикой. Формальнj равная эффективность терапии, выявленная количественно, не всегда означает, что лечение одинаково полезно. Поэтому ряд авторов отмечают, что стандартизированные шкалы могут применяться лишь как дополнение к традиционному клиническому обследованию, а не наоборот [33]. Парадокс заключается в том, что использование клинико-описательных характеристик также часто приводит к искажению результатов исследования из-за отсутствия единого понимания их значения. Возможным решением этой проблемы может быть комплексная оценка состояния больных по стандартизированным шкалам и унифицированным глоссариям психопатологических синдромов. Например, такой глоссарий был предложен Н.М.Жариковым и соавт. [12].
Сравнительная оценка эффективности атипичных нейролептиков и анализ данных о спектре их антипсихотического действия
В настоящее время предполагается, что эффективность всех нейролептиков при лечении шизофрении примерно сопоставима [35, 61, 65, 83, 93, 122]. Тем не менее большое количество исследований посвящено сравнительному изучению эффективности различных атипичных средств на продуктивные расстройства. Полученные данные довольно противоречивы. Выше был приведен пример различия результатов слепых рандомизированных исследований эффективности оланзапина и рисперидона [69, 91, 128]. Подобные примеры можно привести и для других атипичных средств. Результаты проведенных недавно обобщающих метаанализов показывают, что клозапин, оланзапин, рисперидон и амисульприд, возможно, более эффективны, чем кветиапин, зипразидон и арипипразол [70, 110]. Этот вывод заслуживает особого доверия, поскольку авторы специально отбирали исследования, которые исключали возможность наличия конфликта интересов. Наши собственные данные свидетельствуют, что при купирующей терапии шубообразной шизофрении клозапин более эффективен, чем другие атипичные нейролептики, эффективность рисперидона и оланзапина примерно сопоставима, а терапия кветиапином в рекомендуемых дозировках наименее эффективна [10]. Сходные данные получены при изучении эффективности различных антипсихотических средств при лечении обострений параноидной шизофрении с непрерывным течением, они будут опубликованы в ближайшее время.
Авторы некоторых современных стандартов лечения шизофрении указывают, что при выборе терапии не следует ориентироваться на клинические особенности состояния больного [35, 61, 65, 77, 93]. Такая точка зрения основана на традиционной для зарубежной психиатрии позиции об отсутствии различий спектров психотропной активности нейролептиков и их равной эффективности при различных проявлениях болезни. Однако отечественная и некоторые европейские психиатрические школы всегда рассматривали клинические особенности заболевания в качестве основного фактора, определяющего дифференцированный выбор лечения [4, 7, 25, 36, 71]. В частности, было показано отличие эффективности антипсихотических средств при различном темпе прогрессирования болезни. При высокопрогредиентных активно текущих вариантах эндогенного процесса рекомендовано использовать наиболее мощные антипсихотические средства, например галоперидол, трифлуоперидол или трифлуоперазин. При вялом течении заболевания или на стадии “затихания” его активности указывалось на возможность использования нейролептиков меньшей мощности, например перфеназина, флюпентиксола или сульпирида. В этом случае эффективность такой терапии возрастала в связи с более широким спектром антипсихотической активности низкопотентных и среднепотентных средств с преимущественным влиянием на симптоматику субпсихотических регистров. Также было выявлено отличие профилей избирательного антипсихотического действия различных типичных нейролептиков. На этом основании, например, рекомендовано применять галоперидол при синдроме психического автоматизма, тиопроперазин при кататонии и гебефрении, перфеназин при вербальном галлюцинозе, перициазин при нарушениях поведения, прохлорперазин при паранойяльном бреде [4, 9, 18, 25, 32, 40]. Такие рекомендации не исключали возможности улучшения состояния при применении других нейролептиков, но указывали на высокую вероятность положительной динамики при назначении рекомендуемых средств.
Позиция об отсутствии различия спектров психотропной активности антипсихотических средств привела к тому, что в клинических исследованиях в последнее время изучается лишь “общая” эффективность терапии без оценки ее влияния на отдельные симптомокомплексы и “симптомы-мишени”. Часто не проводится тщательный анализ связи эффективности лечения с другими клиническими особенностями заболевания, например с его длительностью, темпом прогрессирования или формой течения. Профили избирательного антипсихотического эффекта, сила инцизивного антипсихотического действия большинства атипичных средств до сих пор не определены, поскольку в лучшем случае априорно предполагается, что они могут различаться только по выраженности неспецифического седативного или стимулирующего эффектов. Это значительно затрудняет возможность дифференцированного выбора терапии. Некоторые авторы указывают, что при назначении лечения может быть выбран любой атипичный нейролептик нового поколения, а определить его индивидуальную эффективность можно лишь “методом проб и ошибок” [61, 93, 122]. В рекомендациях использования атипичных нейролептиков нового поколения чаще всего перечисляются общие показания: “острые и хронические психозы”, “острая и хроническая шизофрения, сопровождающаяся продуктивными и негативными расстройствами”, “шизофрения, в том числе в фазе обострения, профилактика обострений” и т.п. Таким образом, на практике выбор терапии приходится осуществлять эмпирически, например на основании личных предпочтений практикующих врачей. При неэффективности одного из атипичных средств рекомендуется переход к лечению другим препаратом этой группы, прием которого может быть полезен из-за большей индивидуальной чувствительности. Такой подход часто приводит к длительному “перебору” различных нейролептиков без достижения необходимого терапевтического эффекта.
Немногочисленные данные о “специфичности” действия атипичных нейролептиков противоречивы. Например, по мнению С.Н.Мосолова [25] и B.Hesslinger и соавт. [90], рисперидон обладает выраженной антикататонической и умеренной антигаллюцинаторной и антибредовой активностью. Напротив, по данным В.Г.Каледы [13, 14], профиль избирательного действия этого нейролептика определяется мощным антигаллюцинаторным и антибредовым эффектом и умеренным влиянием на симптомы кататонии и мании. По нашим наблюдениям, рисперидон недостаточно эффективен при острых и длительно текущих хронических галлюцинаторно-бредовых расстройствах, кататоническом синдроме, однако его применение полезно у больных с паранойяльным бредом, особенно в рамках приступообразных форм болезни [10]. В последние годы интерес к изучению профиля избирательного антипсихотического действия атипичных нейролептиков возрастает и у зарубежных исследователей. Например, детально изучается возможность их избирательного влияния на аффективные и кататонические расстройства [131, 138]. Для более точного определения профиля избирательного действия различных атипичных нейролептиков необходимо проведение дальнейших исследований с тщательным анализом влияния терапии на клинические особенности болезни. Также важно проведение длительных проспективных исследований и изучение отдаленного катамнеза для оценки способности атипичных антипсихотических средств замедлять прогрессирование заболевания.
Поскольку предполагается, что все нейролептики одинаково эффективны при различных проявлениях шизофрении, до сих пор не проведено сопоставление выраженности инцизивного и специфического антипсихотического действия атипичных и типичных средств. Считается, что они различаются лишь по выраженности антинегативного эффекта. Результаты многочисленных строго спланированных исследований свидетельствуют, что применение атипичных нейролептиков приводит к большему ослаблению негативных расстройств, чем традиционная терапия [6, 16, 22, 64]. Первоначально эти данные привели к появлению представления о высокой эффективности атипичных средств при лечении апатии и абулии. Однако тщательный анализ клинических факторов в дальнейших исследованиях показал, что атипичные нейролептики, по-видимому, уменьшают выраженность лишь вторичных негативных расстройств [28, 55, 61, 112], например, из-за редкости развития неврологических нарушений, затормаживающего действия и нейролептической депрессии. Примечательно, что опыт лечения шизофрении традиционными нейролептиками первоначально также свидетельствовал об их эффективности в отношении дефицитарных расстройств [4, 30, 31, 42, 135]. Однако дальнейшие исследования показали, что активизация, ресоциализация некоторых больных при такой терапии связана с уменьшением выраженности продуктивной симптоматики, а не проявлений “первичного” дефекта. Активирующий эффект небольших доз традиционных средств, часто описываемый в литературе [4, 5, 15, 17, 20, 25, 72], также может быть связан с воздействием на вторичные негативные расстройства из-за небольшой выраженности неврологических нарушений и затормаживающего действия, а не только с активацией дофаминергической системы. Немногочисленность сравнительных исследований и погрешности их методики пока не позволяют определить различия эффективности атипичных нейролептиков нового поколения в отношении негативных расстройств. Недавно было высказано мнение, что у таких больных наиболее эффективно применение амисульприда, однако оно нуждается в дальнейшем подтверждении.
Двигательные расстройства, часто развивающиеся при приеме традиционных нейролептиков, обычно не представляют опасности для здоровья. Однако они субъективно тяжело переносятся больными, ухудшают качество жизни, являются одной из причин стигматизации и нарушения режима лечения. Поэтому в качестве альтернативы такой терапии многие авторы предлагают использовать атипичные нейролептики, редко вызывающие неврологические нарушения [14, 28, 37, 52, 61, 65, 78]. Результаты исследований с небольшим периодом наблюдения свидетельствуют, что больные охотнее принимают атипичные средства, чем традиционную терапию, улучшается их качество жизни [26]. Однако накопленный к настоящему времени длительный опыт применения атипичных нейролептиков показывает, что они не так безопасны, как это предполагалось ранее. При их приеме часто развиваются “поздние” метаболические и эндокринные побочные эффекты, которые ограничивают возможность широкого использования этих средств.
При приеме атипичных нейролептиков чаще, чем при лечении традиционными средствами, развивается ожирение [8, 24, 55, 126]. Повышение массы тела наиболее характерно для лечения оланзапином и клозапином [3, 29, 49, 75, 130]. Кветиапин и рисперидон влияют на массу тела в меньшей степени. Предполагается, что терапия зипразидоном и амисульпридом увеличивает массу тела незначительно. Нейролептическое ожирение повышает риск развития соматической патологии, угрожающей жизни больного: сердечно-сосудистых заболеваний, сахарного диабета типа 2, синдрома ночного апноэ. Молодые пациенты часто расценивают ожирение как недопустимый косметический дефект, приводящий к стигматизации [11, 48]. Показателен пример нескольких наблюдаемых нами больных, которые для уменьшения массы тела самостоятельно принимали незарегистрированные биологически активные добавки, содержащие фенфлурамины. При повышении массы тела многие больные прекращают прием антипсихотических средств или настаивают на изменении схемы лечения. Возможность применения атипичных нейролептиков в этих случаях значительно ограничивается отсутствием эффективных методов профилактики и коррекции избыточной массы тела. Чаще всего больным шизофренией рекомендуют низкокалорийную диету с ограничением легкодоступных углеводов и жиров в сочетании с повышением физической нагрузки [55, 93, 136]. Однако на практике такая тактика редко приводит к ожидаемому эффекту. Для уменьшения массы тела у больных шизофренией предложено использовать лекарственные препараты различных фармакологических групп периферического (ранитидин, низатидин, метформин, орлистат) или центрального (топиромат, амантадин, флувоксамин, ребоксетин) действия [53, 57, 66, 68, 81, 85, 98, 104, 106, 107, 113, 117]. Эффективность перечисленных средств подтверждена в строго спланированных исследованиях, однако небольшая численность обследованных больных не позволяет считать их результаты вполне убедительными. Кроме того, применение такой терапии ограничивается развитием специфических побочных эффектов. Интересны данные об использовании для коррекции нейролептического ожирения в период ремиссии у больных шубообразной шизофренией небольших доз типичных нейролептиков. Такая терапия достаточно эффективна для поддержания устойчивости ремиссии, приводит к значительному снижению массы тела и не сопровождается выраженными неврологическими нарушениями [11].
Эпидемиологические исследования показали, что прием атипичных нейролептиков чаще, чем лечение традиционными средствами, может провоцировать развитие сахарного диабета типа 2 у предрасположенных к нему пациентов [86]. Обычно заболевание манифестирует в течение полугода после начала лечения, но описаны случаи его развития через несколько лет непрерывной терапии. Неясно, насколько различные атипичные нейролептики различаются между собой по способности провоцировать развитие диабета [63, 86, 100]. Предполагается, что риск диабета выше при лечении оланзапином, чем при приеме арипипразола, амисульприда и зипразидона [51, 121]. Терапия некоторыми атипичными нейролептиками также способствует повышению содержания в крови атерогенных липидов [102] и как следствие атеросклероза и сердечно-сосудистых заболеваний. Предполагается, что гиперлипидемия чаще всего развивается при приеме оланзапина [100, 111].
Лечение некоторыми атипичными нейролептиками, особенно рисперидоном и амисульпридом, часто приводит к развитию гиперпролактинемии. При терапии оланзапином и зипразидоном риск этого побочного эффекта, вероятно, меньше. Есть сообщения, что клозапин и кветиапин почти не влияют на уровень пролактина [56, 120]. Традиционные нейролептики реже вызывают тяжелую гиперпролактинемию. Нарушения менструального цикла, галакторея, гинекомастия и сексуальные расстройства, вызванные повышением концентрации пролактина, особенно нежелательны у молодых больных с ремиссиями высокого качества из-за значительного ухудшения качества жизни и стигматизации. Известно, что качественные терапевтические ремиссии чаще всего формируются при небольшой длительности эндогенного процесса. Однако многие авторы не учитывают проблему риска развития гиперпролактинемии и указывают на предпочтительность использования атипичных нейролептиков при “первом эпизоде” болезни [14, 26, 44, 45, 55, 65]. Есть сообщения, что нейролептическая гиперпролактинемия является фактором риска развития рака молочной железы. Некоторые авторы опровергают возможность такой связи, однако результаты последних исследований выглядят довольно убедительно [74, 134]. В современных стандартах лечения указывается, что назначение нейролептиков противопоказано больным с опухолями молочной железы [61]. Предполагается, что нейролептическая гиперпролактинемия повышает риск развития остеопороза из-за уменьшения концентрации эстрогенов [137]. Однако такая связь нуждается в дальнейшем подтверждении. Повышение концентрации пролактина при приеме нейролептиков также приводит к развитию атрофических изменений в нижних отделах урогениталъного тракта, акне, себореи и гирсутизма.
При приеме атипичных нейролептиков могут развиваться сердечно-сосудистые нарушения, опасные высоким риском смертельного исхода. После внедрения этих средств в клиническую практику были описаны наблюдения пируэтной тахикардии, которая в каждом десятом случае приводит к внезапной смерти. Это осложнение связано со способностью нейролептиков удлинять интервал QT из-за их влияния на проницаемость калиевых каналов клеточных мембран. Считается, что при применении некоторых атипичных нейролептиков это нарушение наблюдается чаще, чем при лечении традиционными средствами. Удлинение интервала QT наиболее характерно для зипразидона. В целом риск удлинения интервала QT возрастает в следующем порядке: амисульприд, клозапин, флупентиксол, флуфеназин, галоперидол, оланзапин, перфеназин, пимозид, кветиапин, рисперидон, сульпирид, тиоридазин и зипразидон [127].
Особого обсуждения заслуживает вопрос безопасности терапии клозапином. Клозапин является наиболее эффективным антипсихотическими средством, однако неоднократно отмечалось, что возможность его широкого использования ограничивается плохой переносимостью. При приеме клозапина редко возникают неврологические расстройства, однако часто наблюдаются нежелательные реакции в соматической сфере и седативное действие. Выраженность лекарственной седации, гипотензивного эффекта и гиперсаливации обычно значительно уменьшается в первые недели после начала приема терапии. Эти нежелательные реакции не опасны для здоровья больных при условии тщательного динамического наблюдения за их состоянием. Рациональный подбор схемы лечения позволяет избежать значительного ухудшения качества жизни больных, а активное использование методов формирования терапевтического сотрудничества и высокая эффективность лечения предотвращают их отказ от приема лекарств. Терапия клозапином может приводить к развитию метаболических нарушений, что, однако, довольно характерно для всей группы атипичных средств. Указывается, что главным ограничением широкого использования клозапина является возможность развития агранулоцитоза. Ранее считалось, что его риск составляет около 1–2% [55, 61, 77]. Данные последних лет свидетельствуют, что тщательное наблюдение за соматическим состоянием больного позволяет рассматривать терапию клозапином как относительно безопасную. Рекомендация обязательного динамического исследования клинического анализа крови позволила снизить риск развития агранулоцитоза до 0,25–0,5% [52, 65]. Риск развития агранулоцитоза наиболее высок у пожилых женщин, азиатов, евреев-ашкенази и финнов, что предположительно связано с фактором генетической предрасположенности, поэтому в этих группах соматическое состояние нужно исследовать особенно тщательно. Важно, что прием некоторых традиционных нейролептиков, например хлорпромазина, промазина и хлорпротиксена, также может сопровождаться развитием агранулоцитоза примерно в 0,3% случаев [4, 52, 61, 77, 78, 93, 97]. Необходимо отметить и возможность “завышенности” современных оценок распространенности агранулоцитоза у больных, принимающих клозапин. Агранулоцитоз относится к редким побочным эффектам, поэтому точно оценить риск этого осложнения можно только при проведении проспективных популяционных исследований. Эта проблема отчасти была решена при помощи создания специальных баз данных пациентов, принимающих клозапин. Однако методика таких популяционных наблюдений сопряжена с высокой вероятностью погрешности полученных данных. Известно, что лейкопения и агранулоцитоз могут развиваться вследствие повышенной индивидуальной чувствительности больных к большой группе лекарственных средств. Таким образом, существует вероятность того, что некоторые случаи агранулоцитоза, приписываемые клозапину, могут быть связаны с приемом других лекарств, часто используемых в клинической практике. В целом эпидемиологические данные указывают, что использование клозапина не повышает риск смертельного исхода, а значительно снижает его, в первую очередь за счет уменьшения вероятности суицида. Среди причин смерти пациентов, принимающих клозапин, преобладает тромбоэмболия легочной артерии и дыхательная недостаточность [133]. В заключение важно отметить, что применение других антипсихотических средств также может сопровождаться развитием смертельно опасных осложнений. Например, традиционные нейролептики в 0,5–1% случаев вызывают развитие злокачественного нейролептического синдрома, а применение атипичных средств нового поколения повышает риск смерти от острой и хронической сердечно-сосудистой патологии. Поэтому необходимо проведение повторной оценки значения риска агранулоцитоза для ограничения широкого использования клозапина.
Данные литературы свидетельствуют, что основным итогом применения атипичных нейролептиков нового поколения стал вывод о редкости возникновения при такой терапии неврологических нарушений и затормаживающего действия. Данные об их высокой эффективности в отношении продуктивных расстройств нуждаются в дальнейшем подтверждении. Первоначальные ожидания пользы применения атипичных средств при лечении шизофренического дефекта и возможности их использования в резистентных случаях болезни в целом не оправдались. Также оказалось, что такая терапия не так безопасна, как это предполагалось ранее. Тем не менее значение появления группы атипичных нейролептиков нового поколения в арсенале антипсихотических средств трудно переоценить. Их внедрение в клиническую практику значительно расширило возможность выбора лекарственной терапии шизофрении. У многих больных применение атипичных нейролептиков более целесообразно, чем использование других антипсихотических препаратов.
Ряд авторов, подводя итоги последним достижениям в лечении шизофрении, высказывают мнение о завершенности этапа внедрения в клиническую практику атипичных нейролептиков с дофамин-серотониновым механизмом действия [61, 96, 126]. Однако представленные данные литературы свидетельствуют о недостаточной изученности многих вопросов, связанных с применением этих средств, что значительно затрудняет возможность выбора рациональной психофармакотерапии в практических условиях. Прежде всего необходимо продолжение сравнительного изучения эффективности атипичных нейролептиков. Важной задачей является определение клинических предикторов эффективности терапии различными атипичными средствами. Необходимо изучение профиля психотропной активности этих препаратов. Важно проведение сравнения эффективности современных нейролептиков с традиционными средствами и клозапином у различных групп больных, поскольку форма течения заболевания, темп его прогредиентности, ведущий симптомокомплекс, длительность болезни могут определять значительное различие эффективности терапии. Наконец, важно дополнительно оценить значение побочных эффектов атипичных нейролептиков для ограничения возможности проведения эффективного лечения (риск для жизни и здоровья, влияние на качество жизни, значение для формирования терапевтического сотрудничества) и провести сравнение этого показателя при терапии различными атипичными и традиционными антипсихотическими средствами.
На основании дальнейшего детального анализа эффективности и переносимости атипичных нейролептиков может быть предложен дифференцированный подход применения различных антипсихотических средств при лечении шизофрении. Как показывают данные литературы, предложенную в настоящее время схему лечения можно считать лишь предварительной. Вероятно, у ряда больных применение атипичных нейролептиков действительно является предпочтительным. Однако в некоторых случаях, например при необходимости достижения быстрого улучшения состояния или серьезном риске, которыq могут представлять для здоровья больного соматические побочные эффекты, лечение целесообразно начинать с традиционных средств или клозапина. Необходима разработка дифференцированной схемы применения различных атипичных нейролептиков нового поколения, например с учетом их синдромальной специфичности действия. Хотя некоторые авторы указывают на невозможность прогнозирования индивидуальной эффективности лечения нейролептиками [61], позиция отечественной психиатрической школы предполагает, что клинические особенности состояния больного заранее позволяют предсказать индивидуальную эффективность выбранного лечения [4].
Важно отметить необходимость уточнения принципов, которые должны стать основой для разработки дифференцированного подхода применения различных нейролептиков при лечении шизофрении. В настоящее время указывается на предпочтительность выбора средств с оптимальным соотношением эффективности и переносимости. Такая терапия не всегда является наиболее эффективной, но ее применение часто способствует улучшению качества жизни больных и лучшему соблюдению ими медицинских назначений. Поэтому ряд авторов рекомендуют начинать лечение с атипичных нейролептиков нового поколения, а наиболее эффективные, но плохо переносимые средства, использовать в последнюю очередь. Однако, на наш взгляд, у некоторых групп больных применение высокоэффективных средств, например клозапина, может быть оправдано уже с самого начала лечения даже в ущерб хорошей переносимости. Известно, что эндогенный процесс наиболее активно прогрессирует в первые годы после манифестации, в это время происходит наибольшее усиления тяжести продуктивных расстройств и формирование основных проявлений шизофренического дефекта. Поэтому на раннем этапе заболевания у ряда больных рационально применять наиболее эффективные антипсихотические средства (при тщательном динамическом наблюдении и активном использовании различных методов формирования терапевтического сотрудничества) для достижения максимально возможного улучшения состояния и наибольшего сдерживаниz прогредиентности болезни. Наши наблюдения свидетельствуют, что такая терапия значительно улучшает отдаленный прогноз.
В заключение необходимо отметить, что нами на основании анализа результатов собственного материала и данных литературы была разработана собственная схема дифференцированного применения различных антипсихотических средств при лечении шизофрении. В ближайшее время она будет опубликована в руководстве для врачей “Лечение шизофрении” (Д.С.Данилов, Ю.Г.Тюльпин, 2008). Фрагмент этой схемы приведен в табл. 3.
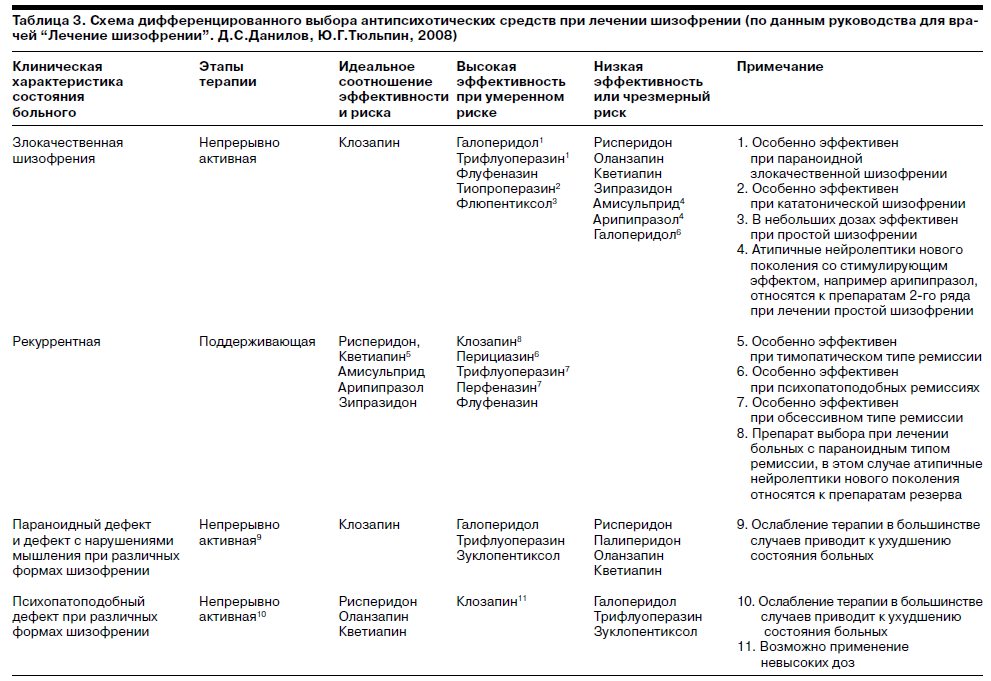
Мы допускаем, что предложенная схема не является окончательной и может быть изменена или дополнена в результате дальнейшего изучения рассматриваемой проблемы.

Традиционно дифференцированный выбор терапии шизофрении основывался на позиции различия спектра психотропной активности разных нейролептиков. Было показано, что антипсихотические средства могут различаться по выраженности общего антипсихотического эффекта (высокопотентные и низкопотентные нейролептики), стимулирующего и первичного седативного эффектов (активирующие и седативные нейролептики), профилю селективного антипсихотического действия (нейролептики преимущественно с антигаллюцинаторной, антибредовой, антиманиакальной, антикататонической и другими видами активности). Индивидуальный выбор терапии предлагалось осуществлять при помощи сопоставления клинических особенностей состояния больного и профилей психотропной активности нейролептиков. На этом основании были разработаны рекомендации применения различных традиционных нейролептиков, которые значительно упрощали выбор терапии в условиях клинической практики. Например, основными показаниями к назначению галоперидола и трифлуоперазина считались галлюцинаторно-бредовые состояния при приступообразной и непрерывной шизофрении; тиопроперазина – кататоно-гебефренические расстройства при ее злокачественном течении; перициазина и тиоридазина – психопатоподобная симптоматика в рамках вялотекущей шизофрении; сульпирида и карбидина – депрессивно-параноидные расстройства при периодической шизофрении, субдепрессия и апатия при ее вялом течении.
В настоящее время принципы дифференцированного подхода к применению антипсихотических средств при лечении шизофрении значительно дополнены. Большое внимание при выборе терапии предлагается уделять не только такому важному клиническому фактору, как эффективность лечения, но и другим клиническим (переносимость терапии), психологическим (качество жизни, соблюдение режима приема лекарств, риск стигматизации), социальным (социальная адаптация и функционирование) и экономическим характеристикам (затраты на лечение). Показано, что негативное влияние терапии на эти показатели может значительно ухудшать эффективность лечебного вмешательства и, напротив, их оптимизация способствует повышению эффективности лечебного процесса. Например, субъективная тягостность лечения или изменение внешнего вида больного из-за развития побочных эффектов, низкая социальная адаптация из-за недостаточной эффективности терапии, экономические потери из-за высоких затрат на приобретение лекарств могут стать причиной отказа больных от приема антипсихотических средств и, таким образом, привести к неэффективности медицинского вмешательства.
Одновременно с уточнением принципов дифференцированного подхода к применению нейролептиков большое распространение получила точка зрения о равной эффективности всех антипсихотических средств, отсутствии в профиле их психотропной активности избирательного антипсихотического действия и различии нейролептиков только в спектре побочных эффектов [35, 61, 65, 77, 93]. Поэтому многие авторы современных стандартов лечения шизофрении указывают на то, что основным критерием выбора терапии должна являться ее переносимость. При выборе лечения в первую очередь предлагается применять нейролептики с хорошей переносимостью, а средства, вызывающие выраженные побочные эффекты, рекомендуется использовать в последнюю очередь. Необходимо отметить, что по сравнению со многими другими лекарственными средствами, используемыми в медицине, нейролептические препараты считаются относительно безопасными для здоровья, однако их применение может приводить к ухудшению качества жизни и стигматизации.
Эффективность современных антипсихотических
средств
Высокая эффективность традиционных нейролептиков и клозапина не вызывает сомнений. Она доказана результатами многочисленных исследований и длительным опытом их применения в клинической практике [4, 25, 32, 59, 60, 93]. В последние годы была проведена повторная систематизация данных об эффективности этих средств при лечении шизофрении с учетом принципов доказательной медицины. Она вновь подтвердила способность типичных нейролептиков (хлорпромазин, трифлуоперазин, тиоридазин, перфеназин, галоперидол, пимозид, пенфлюридол, флуфеназин) сглаживать основные проявления психоза [46, 80, 87, 95, 108, 109, 118, 123]. Спорными остаются данные об эффективности лишь нескольких средств этой группы – промазина, мепазина и прохлорперазина [61, 93]. К сожалению, традиционные нейролептики малоэффективны при лечении дефицитарных расстройств. Однако их регулярный прием сдерживает прогрессирование болезни и тем самым позволяет замедлить формирование шизофренического дефекта. Клозапин является единственным средством, антипсихотическое действие которого более выражено, чем у других нейролептиков. Поэтому его применение рекомендовано в резистентных случаях заболевания [34, 41, 62, 65, 67, 93, 132]. Назначение клозапина приводит к улучшению состояния у 30–60% таких больных. Получены данные об эффективности длительного применения клозапина при лечении дефицитарных расстройств, но они нуждаются в дальнейшем подтверждении. В то же время существуют определенные разногласия в оценке скорости наступления терапевтического эффекта при использовании клозапина в резистентных случаях заболевания. По некоторым данным, состояние больных улучшается уже через несколько недель после начала лечения [119]. Результаты других исследований свидетельствуют об эффекте при более длительной терапии [124]. Разногласие в вопросе скорости наступления терапевтического эффекта при применении клозапина, вероятно, связано с различием тяжести состояния обследованных больных.
Результаты строго спланированных исследований свидетельствуют, что атипичные нейролептики нового поколения по эффективности значительно превосходят плацебо и сопоставимы с традиционными средствами [28, 38, 55, 65, 77, 78]. Некоторые данные даже указывают на их превосходство над препаратами типичного ряда [19, 23, 70, 82, 103]. Обобщающие систематические обзоры в целом подтверждают результаты отдельных клинических исследований эффективности рисперидона, оланзапина, зипразидона, амисульприда, арипипразола, палиперидона и зотепина (табл. 2).

Считается, что пока не получено убедительных доказательств высокой эффективности кветиапина и сертиндола. Например, эффективность сертиндола в дозе 8 и 12 мг/сут сопоставима с плацебо, хотя в дозе 20 мг/сут превосходит его [105]. Данные об эффективности кветиапина довольно противоречивы и не поддаются точной систематизации [125].
В последнее время высказывается мнение, что высокая эффективность атипичных нейролептиков нового поколения не всегда подтверждается при их применении в повседневной клинической практике [1, 2, 21, 39, 43, 47, 89]. Довольно часто врачи сталкиваются с ситуацией, при которой назначение атипичных средств незначительно улучшает состояние больных, в то время как применение других нейролептиков оказывается довольно эффективным. Интересно мнение клинических фармакологов, которые указывают на нередко возникающую проблему несоответствия результатов клинических испытаний и данных, полученных на практике [79, 115].
Различие результатов клинических исследований эффективности атипичных нейролептиков и данных, полученных на практике, связывается с несколькими факторами. Оно может быть обусловлено нерепрезентативностью выборок больных в строго спланированных исследованиях из-за жестких критериев включения и исключения [2, 88]. При проведении клинических исследований обычно формируются однородные группы больных, в которые могут не войти пациенты с клиническими характеристиками, отличающимися от заданного “стандарта”. В них обычно не включают больных с сопутствующими заболеваниями. Во время исследования пациенты, как правило, принимают только один “изучаемый” нейролептик. Многие исследования непродолжительны, поэтому больные лучше соблюдают режим лечения по сравнению с обычными условиями. Авторы некоторых систематических обзоров, проведенных с учетом принципов доказательной медицины, указывают на предварительность вывода о высокой эффективности атипичных средств из-за недостаточной длительности наблюдений, небольшого числа обследованных больных или неизученности влияния терапии на ряд клинических характеристик [101].
В исследованиях часто используется различная методика (несопоставимые дозы нейролептиков, разная длительность наблюдения, неоднородные методы оценки динамики состояния). Это приводит к трудности сопоставления полученных результатов и их экстраполяции на всю популяцию больных. Например, показательна развернувшаяся недавно на страницах печати дискуссия о возможном искажении данных об эффективности атипичных нейролептиков в связи с применением слишком высоких доз традиционных средств, использовавшихся в качестве препаратов сравнения [70, 82]. Это могло привести к переоценке эффективности атипичных средств при лечении негативных расстройств и “завышению” данных об их хорошей переносимости. Напротив, в некоторых исследованиях терапевтические дозы атипичных нейролептиков сравниваются с субтерапевтическими дозировками препаратов типичного ряда. Например, авторы одного из таких исследований пришли к выводу, что невысокие дозы галоперидола сопоставимы по эффективности со стандартными дозами рисперидона и оланзапина [54].
При планировании строго организованных исследований существует высокая вероятность того, что в исследуемую группу включают пациентов с фактически несопоставимыми, а лишь формально сходными расстройствами. Это связано с тем, что для демонстрации сопоставимости основной и контрольной групп в начале исследования чаще всего используют оценку по стандартизированным шкалам без сравнения клинических характеристик, которые не поддаются количественному измерению. Например, часто не проводится синдромальная оценка состояния больных или не учитывается темп прогрессирования болезни. Показателен пример изучения эффективности атипичных нейролептиков в отношении негативных расстройств. Многие исследования демонстрируют, что их применение способствует оживлению эмоций и активизации длительно болеющих пациентов. Такое наблюдение привело к представлению о высокой эффективности атипичных средств в отношении симптомов шизофренического дефекта. Однако результаты дальнейших более тщательно спланированных исследований показали, что активизация больных связана с влиянием терапии на вторичные негативные расстройства, а не на дефицитарную симптоматику [52, 61, 99]. Подобная “изолированная” количественная оценка также может привести к тому, что в одну группу попадают пациенты с фактически несопоставимыми продуктивными расстройствами, при которых эффективность терапии значительно различается, например острым и хроническим параноидом.
При проведении строго спланированных исследований эффективность нейролептиков, как правило, оценивают количественно на основании сопоставления динамики психопатологической симптоматики по стандартизированным шкалам без детальной оценки изменения различных клинических характеристик. В качестве критерия эффективности терапии берут “различие среднего балла” по сравнению с группой контроля или исходным уровнем. При этом не учитывают важные клинико-описательные характеристики, например тип и качество сформированной ремиссии или число больных со сформированной критикой. Формальнj равная эффективность терапии, выявленная количественно, не всегда означает, что лечение одинаково полезно. Поэтому ряд авторов отмечают, что стандартизированные шкалы могут применяться лишь как дополнение к традиционному клиническому обследованию, а не наоборот [33]. Парадокс заключается в том, что использование клинико-описательных характеристик также часто приводит к искажению результатов исследования из-за отсутствия единого понимания их значения. Возможным решением этой проблемы может быть комплексная оценка состояния больных по стандартизированным шкалам и унифицированным глоссариям психопатологических синдромов. Например, такой глоссарий был предложен Н.М.Жариковым и соавт. [12].
Сравнительная оценка эффективности атипичных нейролептиков и анализ данных о спектре их антипсихотического действия
В настоящее время предполагается, что эффективность всех нейролептиков при лечении шизофрении примерно сопоставима [35, 61, 65, 83, 93, 122]. Тем не менее большое количество исследований посвящено сравнительному изучению эффективности различных атипичных средств на продуктивные расстройства. Полученные данные довольно противоречивы. Выше был приведен пример различия результатов слепых рандомизированных исследований эффективности оланзапина и рисперидона [69, 91, 128]. Подобные примеры можно привести и для других атипичных средств. Результаты проведенных недавно обобщающих метаанализов показывают, что клозапин, оланзапин, рисперидон и амисульприд, возможно, более эффективны, чем кветиапин, зипразидон и арипипразол [70, 110]. Этот вывод заслуживает особого доверия, поскольку авторы специально отбирали исследования, которые исключали возможность наличия конфликта интересов. Наши собственные данные свидетельствуют, что при купирующей терапии шубообразной шизофрении клозапин более эффективен, чем другие атипичные нейролептики, эффективность рисперидона и оланзапина примерно сопоставима, а терапия кветиапином в рекомендуемых дозировках наименее эффективна [10]. Сходные данные получены при изучении эффективности различных антипсихотических средств при лечении обострений параноидной шизофрении с непрерывным течением, они будут опубликованы в ближайшее время.
Авторы некоторых современных стандартов лечения шизофрении указывают, что при выборе терапии не следует ориентироваться на клинические особенности состояния больного [35, 61, 65, 77, 93]. Такая точка зрения основана на традиционной для зарубежной психиатрии позиции об отсутствии различий спектров психотропной активности нейролептиков и их равной эффективности при различных проявлениях болезни. Однако отечественная и некоторые европейские психиатрические школы всегда рассматривали клинические особенности заболевания в качестве основного фактора, определяющего дифференцированный выбор лечения [4, 7, 25, 36, 71]. В частности, было показано отличие эффективности антипсихотических средств при различном темпе прогрессирования болезни. При высокопрогредиентных активно текущих вариантах эндогенного процесса рекомендовано использовать наиболее мощные антипсихотические средства, например галоперидол, трифлуоперидол или трифлуоперазин. При вялом течении заболевания или на стадии “затихания” его активности указывалось на возможность использования нейролептиков меньшей мощности, например перфеназина, флюпентиксола или сульпирида. В этом случае эффективность такой терапии возрастала в связи с более широким спектром антипсихотической активности низкопотентных и среднепотентных средств с преимущественным влиянием на симптоматику субпсихотических регистров. Также было выявлено отличие профилей избирательного антипсихотического действия различных типичных нейролептиков. На этом основании, например, рекомендовано применять галоперидол при синдроме психического автоматизма, тиопроперазин при кататонии и гебефрении, перфеназин при вербальном галлюцинозе, перициазин при нарушениях поведения, прохлорперазин при паранойяльном бреде [4, 9, 18, 25, 32, 40]. Такие рекомендации не исключали возможности улучшения состояния при применении других нейролептиков, но указывали на высокую вероятность положительной динамики при назначении рекомендуемых средств.
Позиция об отсутствии различия спектров психотропной активности антипсихотических средств привела к тому, что в клинических исследованиях в последнее время изучается лишь “общая” эффективность терапии без оценки ее влияния на отдельные симптомокомплексы и “симптомы-мишени”. Часто не проводится тщательный анализ связи эффективности лечения с другими клиническими особенностями заболевания, например с его длительностью, темпом прогрессирования или формой течения. Профили избирательного антипсихотического эффекта, сила инцизивного антипсихотического действия большинства атипичных средств до сих пор не определены, поскольку в лучшем случае априорно предполагается, что они могут различаться только по выраженности неспецифического седативного или стимулирующего эффектов. Это значительно затрудняет возможность дифференцированного выбора терапии. Некоторые авторы указывают, что при назначении лечения может быть выбран любой атипичный нейролептик нового поколения, а определить его индивидуальную эффективность можно лишь “методом проб и ошибок” [61, 93, 122]. В рекомендациях использования атипичных нейролептиков нового поколения чаще всего перечисляются общие показания: “острые и хронические психозы”, “острая и хроническая шизофрения, сопровождающаяся продуктивными и негативными расстройствами”, “шизофрения, в том числе в фазе обострения, профилактика обострений” и т.п. Таким образом, на практике выбор терапии приходится осуществлять эмпирически, например на основании личных предпочтений практикующих врачей. При неэффективности одного из атипичных средств рекомендуется переход к лечению другим препаратом этой группы, прием которого может быть полезен из-за большей индивидуальной чувствительности. Такой подход часто приводит к длительному “перебору” различных нейролептиков без достижения необходимого терапевтического эффекта.
Немногочисленные данные о “специфичности” действия атипичных нейролептиков противоречивы. Например, по мнению С.Н.Мосолова [25] и B.Hesslinger и соавт. [90], рисперидон обладает выраженной антикататонической и умеренной антигаллюцинаторной и антибредовой активностью. Напротив, по данным В.Г.Каледы [13, 14], профиль избирательного действия этого нейролептика определяется мощным антигаллюцинаторным и антибредовым эффектом и умеренным влиянием на симптомы кататонии и мании. По нашим наблюдениям, рисперидон недостаточно эффективен при острых и длительно текущих хронических галлюцинаторно-бредовых расстройствах, кататоническом синдроме, однако его применение полезно у больных с паранойяльным бредом, особенно в рамках приступообразных форм болезни [10]. В последние годы интерес к изучению профиля избирательного антипсихотического действия атипичных нейролептиков возрастает и у зарубежных исследователей. Например, детально изучается возможность их избирательного влияния на аффективные и кататонические расстройства [131, 138]. Для более точного определения профиля избирательного действия различных атипичных нейролептиков необходимо проведение дальнейших исследований с тщательным анализом влияния терапии на клинические особенности болезни. Также важно проведение длительных проспективных исследований и изучение отдаленного катамнеза для оценки способности атипичных антипсихотических средств замедлять прогрессирование заболевания.
Поскольку предполагается, что все нейролептики одинаково эффективны при различных проявлениях шизофрении, до сих пор не проведено сопоставление выраженности инцизивного и специфического антипсихотического действия атипичных и типичных средств. Считается, что они различаются лишь по выраженности антинегативного эффекта. Результаты многочисленных строго спланированных исследований свидетельствуют, что применение атипичных нейролептиков приводит к большему ослаблению негативных расстройств, чем традиционная терапия [6, 16, 22, 64]. Первоначально эти данные привели к появлению представления о высокой эффективности атипичных средств при лечении апатии и абулии. Однако тщательный анализ клинических факторов в дальнейших исследованиях показал, что атипичные нейролептики, по-видимому, уменьшают выраженность лишь вторичных негативных расстройств [28, 55, 61, 112], например, из-за редкости развития неврологических нарушений, затормаживающего действия и нейролептической депрессии. Примечательно, что опыт лечения шизофрении традиционными нейролептиками первоначально также свидетельствовал об их эффективности в отношении дефицитарных расстройств [4, 30, 31, 42, 135]. Однако дальнейшие исследования показали, что активизация, ресоциализация некоторых больных при такой терапии связана с уменьшением выраженности продуктивной симптоматики, а не проявлений “первичного” дефекта. Активирующий эффект небольших доз традиционных средств, часто описываемый в литературе [4, 5, 15, 17, 20, 25, 72], также может быть связан с воздействием на вторичные негативные расстройства из-за небольшой выраженности неврологических нарушений и затормаживающего действия, а не только с активацией дофаминергической системы. Немногочисленность сравнительных исследований и погрешности их методики пока не позволяют определить различия эффективности атипичных нейролептиков нового поколения в отношении негативных расстройств. Недавно было высказано мнение, что у таких больных наиболее эффективно применение амисульприда, однако оно нуждается в дальнейшем подтверждении.
Двигательные расстройства, часто развивающиеся при приеме традиционных нейролептиков, обычно не представляют опасности для здоровья. Однако они субъективно тяжело переносятся больными, ухудшают качество жизни, являются одной из причин стигматизации и нарушения режима лечения. Поэтому в качестве альтернативы такой терапии многие авторы предлагают использовать атипичные нейролептики, редко вызывающие неврологические нарушения [14, 28, 37, 52, 61, 65, 78]. Результаты исследований с небольшим периодом наблюдения свидетельствуют, что больные охотнее принимают атипичные средства, чем традиционную терапию, улучшается их качество жизни [26]. Однако накопленный к настоящему времени длительный опыт применения атипичных нейролептиков показывает, что они не так безопасны, как это предполагалось ранее. При их приеме часто развиваются “поздние” метаболические и эндокринные побочные эффекты, которые ограничивают возможность широкого использования этих средств.
При приеме атипичных нейролептиков чаще, чем при лечении традиционными средствами, развивается ожирение [8, 24, 55, 126]. Повышение массы тела наиболее характерно для лечения оланзапином и клозапином [3, 29, 49, 75, 130]. Кветиапин и рисперидон влияют на массу тела в меньшей степени. Предполагается, что терапия зипразидоном и амисульпридом увеличивает массу тела незначительно. Нейролептическое ожирение повышает риск развития соматической патологии, угрожающей жизни больного: сердечно-сосудистых заболеваний, сахарного диабета типа 2, синдрома ночного апноэ. Молодые пациенты часто расценивают ожирение как недопустимый косметический дефект, приводящий к стигматизации [11, 48]. Показателен пример нескольких наблюдаемых нами больных, которые для уменьшения массы тела самостоятельно принимали незарегистрированные биологически активные добавки, содержащие фенфлурамины. При повышении массы тела многие больные прекращают прием антипсихотических средств или настаивают на изменении схемы лечения. Возможность применения атипичных нейролептиков в этих случаях значительно ограничивается отсутствием эффективных методов профилактики и коррекции избыточной массы тела. Чаще всего больным шизофренией рекомендуют низкокалорийную диету с ограничением легкодоступных углеводов и жиров в сочетании с повышением физической нагрузки [55, 93, 136]. Однако на практике такая тактика редко приводит к ожидаемому эффекту. Для уменьшения массы тела у больных шизофренией предложено использовать лекарственные препараты различных фармакологических групп периферического (ранитидин, низатидин, метформин, орлистат) или центрального (топиромат, амантадин, флувоксамин, ребоксетин) действия [53, 57, 66, 68, 81, 85, 98, 104, 106, 107, 113, 117]. Эффективность перечисленных средств подтверждена в строго спланированных исследованиях, однако небольшая численность обследованных больных не позволяет считать их результаты вполне убедительными. Кроме того, применение такой терапии ограничивается развитием специфических побочных эффектов. Интересны данные об использовании для коррекции нейролептического ожирения в период ремиссии у больных шубообразной шизофренией небольших доз типичных нейролептиков. Такая терапия достаточно эффективна для поддержания устойчивости ремиссии, приводит к значительному снижению массы тела и не сопровождается выраженными неврологическими нарушениями [11].
Эпидемиологические исследования показали, что прием атипичных нейролептиков чаще, чем лечение традиционными средствами, может провоцировать развитие сахарного диабета типа 2 у предрасположенных к нему пациентов [86]. Обычно заболевание манифестирует в течение полугода после начала лечения, но описаны случаи его развития через несколько лет непрерывной терапии. Неясно, насколько различные атипичные нейролептики различаются между собой по способности провоцировать развитие диабета [63, 86, 100]. Предполагается, что риск диабета выше при лечении оланзапином, чем при приеме арипипразола, амисульприда и зипразидона [51, 121]. Терапия некоторыми атипичными нейролептиками также способствует повышению содержания в крови атерогенных липидов [102] и как следствие атеросклероза и сердечно-сосудистых заболеваний. Предполагается, что гиперлипидемия чаще всего развивается при приеме оланзапина [100, 111].
Лечение некоторыми атипичными нейролептиками, особенно рисперидоном и амисульпридом, часто приводит к развитию гиперпролактинемии. При терапии оланзапином и зипразидоном риск этого побочного эффекта, вероятно, меньше. Есть сообщения, что клозапин и кветиапин почти не влияют на уровень пролактина [56, 120]. Традиционные нейролептики реже вызывают тяжелую гиперпролактинемию. Нарушения менструального цикла, галакторея, гинекомастия и сексуальные расстройства, вызванные повышением концентрации пролактина, особенно нежелательны у молодых больных с ремиссиями высокого качества из-за значительного ухудшения качества жизни и стигматизации. Известно, что качественные терапевтические ремиссии чаще всего формируются при небольшой длительности эндогенного процесса. Однако многие авторы не учитывают проблему риска развития гиперпролактинемии и указывают на предпочтительность использования атипичных нейролептиков при “первом эпизоде” болезни [14, 26, 44, 45, 55, 65]. Есть сообщения, что нейролептическая гиперпролактинемия является фактором риска развития рака молочной железы. Некоторые авторы опровергают возможность такой связи, однако результаты последних исследований выглядят довольно убедительно [74, 134]. В современных стандартах лечения указывается, что назначение нейролептиков противопоказано больным с опухолями молочной железы [61]. Предполагается, что нейролептическая гиперпролактинемия повышает риск развития остеопороза из-за уменьшения концентрации эстрогенов [137]. Однако такая связь нуждается в дальнейшем подтверждении. Повышение концентрации пролактина при приеме нейролептиков также приводит к развитию атрофических изменений в нижних отделах урогениталъного тракта, акне, себореи и гирсутизма.
При приеме атипичных нейролептиков могут развиваться сердечно-сосудистые нарушения, опасные высоким риском смертельного исхода. После внедрения этих средств в клиническую практику были описаны наблюдения пируэтной тахикардии, которая в каждом десятом случае приводит к внезапной смерти. Это осложнение связано со способностью нейролептиков удлинять интервал QT из-за их влияния на проницаемость калиевых каналов клеточных мембран. Считается, что при применении некоторых атипичных нейролептиков это нарушение наблюдается чаще, чем при лечении традиционными средствами. Удлинение интервала QT наиболее характерно для зипразидона. В целом риск удлинения интервала QT возрастает в следующем порядке: амисульприд, клозапин, флупентиксол, флуфеназин, галоперидол, оланзапин, перфеназин, пимозид, кветиапин, рисперидон, сульпирид, тиоридазин и зипразидон [127].
Особого обсуждения заслуживает вопрос безопасности терапии клозапином. Клозапин является наиболее эффективным антипсихотическими средством, однако неоднократно отмечалось, что возможность его широкого использования ограничивается плохой переносимостью. При приеме клозапина редко возникают неврологические расстройства, однако часто наблюдаются нежелательные реакции в соматической сфере и седативное действие. Выраженность лекарственной седации, гипотензивного эффекта и гиперсаливации обычно значительно уменьшается в первые недели после начала приема терапии. Эти нежелательные реакции не опасны для здоровья больных при условии тщательного динамического наблюдения за их состоянием. Рациональный подбор схемы лечения позволяет избежать значительного ухудшения качества жизни больных, а активное использование методов формирования терапевтического сотрудничества и высокая эффективность лечения предотвращают их отказ от приема лекарств. Терапия клозапином может приводить к развитию метаболических нарушений, что, однако, довольно характерно для всей группы атипичных средств. Указывается, что главным ограничением широкого использования клозапина является возможность развития агранулоцитоза. Ранее считалось, что его риск составляет около 1–2% [55, 61, 77]. Данные последних лет свидетельствуют, что тщательное наблюдение за соматическим состоянием больного позволяет рассматривать терапию клозапином как относительно безопасную. Рекомендация обязательного динамического исследования клинического анализа крови позволила снизить риск развития агранулоцитоза до 0,25–0,5% [52, 65]. Риск развития агранулоцитоза наиболее высок у пожилых женщин, азиатов, евреев-ашкенази и финнов, что предположительно связано с фактором генетической предрасположенности, поэтому в этих группах соматическое состояние нужно исследовать особенно тщательно. Важно, что прием некоторых традиционных нейролептиков, например хлорпромазина, промазина и хлорпротиксена, также может сопровождаться развитием агранулоцитоза примерно в 0,3% случаев [4, 52, 61, 77, 78, 93, 97]. Необходимо отметить и возможность “завышенности” современных оценок распространенности агранулоцитоза у больных, принимающих клозапин. Агранулоцитоз относится к редким побочным эффектам, поэтому точно оценить риск этого осложнения можно только при проведении проспективных популяционных исследований. Эта проблема отчасти была решена при помощи создания специальных баз данных пациентов, принимающих клозапин. Однако методика таких популяционных наблюдений сопряжена с высокой вероятностью погрешности полученных данных. Известно, что лейкопения и агранулоцитоз могут развиваться вследствие повышенной индивидуальной чувствительности больных к большой группе лекарственных средств. Таким образом, существует вероятность того, что некоторые случаи агранулоцитоза, приписываемые клозапину, могут быть связаны с приемом других лекарств, часто используемых в клинической практике. В целом эпидемиологические данные указывают, что использование клозапина не повышает риск смертельного исхода, а значительно снижает его, в первую очередь за счет уменьшения вероятности суицида. Среди причин смерти пациентов, принимающих клозапин, преобладает тромбоэмболия легочной артерии и дыхательная недостаточность [133]. В заключение важно отметить, что применение других антипсихотических средств также может сопровождаться развитием смертельно опасных осложнений. Например, традиционные нейролептики в 0,5–1% случаев вызывают развитие злокачественного нейролептического синдрома, а применение атипичных средств нового поколения повышает риск смерти от острой и хронической сердечно-сосудистой патологии. Поэтому необходимо проведение повторной оценки значения риска агранулоцитоза для ограничения широкого использования клозапина.
Данные литературы свидетельствуют, что основным итогом применения атипичных нейролептиков нового поколения стал вывод о редкости возникновения при такой терапии неврологических нарушений и затормаживающего действия. Данные об их высокой эффективности в отношении продуктивных расстройств нуждаются в дальнейшем подтверждении. Первоначальные ожидания пользы применения атипичных средств при лечении шизофренического дефекта и возможности их использования в резистентных случаях болезни в целом не оправдались. Также оказалось, что такая терапия не так безопасна, как это предполагалось ранее. Тем не менее значение появления группы атипичных нейролептиков нового поколения в арсенале антипсихотических средств трудно переоценить. Их внедрение в клиническую практику значительно расширило возможность выбора лекарственной терапии шизофрении. У многих больных применение атипичных нейролептиков более целесообразно, чем использование других антипсихотических препаратов.
Ряд авторов, подводя итоги последним достижениям в лечении шизофрении, высказывают мнение о завершенности этапа внедрения в клиническую практику атипичных нейролептиков с дофамин-серотониновым механизмом действия [61, 96, 126]. Однако представленные данные литературы свидетельствуют о недостаточной изученности многих вопросов, связанных с применением этих средств, что значительно затрудняет возможность выбора рациональной психофармакотерапии в практических условиях. Прежде всего необходимо продолжение сравнительного изучения эффективности атипичных нейролептиков. Важной задачей является определение клинических предикторов эффективности терапии различными атипичными средствами. Необходимо изучение профиля психотропной активности этих препаратов. Важно проведение сравнения эффективности современных нейролептиков с традиционными средствами и клозапином у различных групп больных, поскольку форма течения заболевания, темп его прогредиентности, ведущий симптомокомплекс, длительность болезни могут определять значительное различие эффективности терапии. Наконец, важно дополнительно оценить значение побочных эффектов атипичных нейролептиков для ограничения возможности проведения эффективного лечения (риск для жизни и здоровья, влияние на качество жизни, значение для формирования терапевтического сотрудничества) и провести сравнение этого показателя при терапии различными атипичными и традиционными антипсихотическими средствами.
На основании дальнейшего детального анализа эффективности и переносимости атипичных нейролептиков может быть предложен дифференцированный подход применения различных антипсихотических средств при лечении шизофрении. Как показывают данные литературы, предложенную в настоящее время схему лечения можно считать лишь предварительной. Вероятно, у ряда больных применение атипичных нейролептиков действительно является предпочтительным. Однако в некоторых случаях, например при необходимости достижения быстрого улучшения состояния или серьезном риске, которыq могут представлять для здоровья больного соматические побочные эффекты, лечение целесообразно начинать с традиционных средств или клозапина. Необходима разработка дифференцированной схемы применения различных атипичных нейролептиков нового поколения, например с учетом их синдромальной специфичности действия. Хотя некоторые авторы указывают на невозможность прогнозирования индивидуальной эффективности лечения нейролептиками [61], позиция отечественной психиатрической школы предполагает, что клинические особенности состояния больного заранее позволяют предсказать индивидуальную эффективность выбранного лечения [4].
Важно отметить необходимость уточнения принципов, которые должны стать основой для разработки дифференцированного подхода применения различных нейролептиков при лечении шизофрении. В настоящее время указывается на предпочтительность выбора средств с оптимальным соотношением эффективности и переносимости. Такая терапия не всегда является наиболее эффективной, но ее применение часто способствует улучшению качества жизни больных и лучшему соблюдению ими медицинских назначений. Поэтому ряд авторов рекомендуют начинать лечение с атипичных нейролептиков нового поколения, а наиболее эффективные, но плохо переносимые средства, использовать в последнюю очередь. Однако, на наш взгляд, у некоторых групп больных применение высокоэффективных средств, например клозапина, может быть оправдано уже с самого начала лечения даже в ущерб хорошей переносимости. Известно, что эндогенный процесс наиболее активно прогрессирует в первые годы после манифестации, в это время происходит наибольшее усиления тяжести продуктивных расстройств и формирование основных проявлений шизофренического дефекта. Поэтому на раннем этапе заболевания у ряда больных рационально применять наиболее эффективные антипсихотические средства (при тщательном динамическом наблюдении и активном использовании различных методов формирования терапевтического сотрудничества) для достижения максимально возможного улучшения состояния и наибольшего сдерживаниz прогредиентности болезни. Наши наблюдения свидетельствуют, что такая терапия значительно улучшает отдаленный прогноз.
В заключение необходимо отметить, что нами на основании анализа результатов собственного материала и данных литературы была разработана собственная схема дифференцированного применения различных антипсихотических средств при лечении шизофрении. В ближайшее время она будет опубликована в руководстве для врачей “Лечение шизофрении” (Д.С.Данилов, Ю.Г.Тюльпин, 2008). Фрагмент этой схемы приведен в табл. 3.

Мы допускаем, что предложенная схема не является окончательной и может быть изменена или дополнена в результате дальнейшего изучения рассматриваемой проблемы.
16 декабря 2008
Количество просмотров: 3492


