Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№04 2009
Психоэндокринологические аспекты терапии Кветиапином (Сероквель) больных шизофренией (коррекция проявлений гиперпролактинемии препаратом Сероквель) №04 2009
Номера страниц в выпуске:42-46
Оптимизация психофармакотерапии шизофрении остается сложной задачей, поскольку современные данные, использующиеся врачом при выборе препарата для повышения качества терапевтических воздействий у больных шизофренией, продолжают сохранять дискуссионный характер. Наглядным подтверждением тому служит факт, что внедрение в клиническую практику атипичных антипсихотиков не привело к их однозначному предпочтению при определении тактики терапии.
Оптимизация психофармакотерапии шизофрении остается сложной задачей, поскольку современные данные, использующиеся врачом при выборе препарата для повышения качества терапевтических воздействий у больных шизофренией, продолжают сохранять дискуссионный характер. Наглядным подтверждением тому служит факт, что внедрение в клиническую практику атипичных антипсихотиков не привело к их однозначному предпочтению при определении тактики терапии. Вероятно, это объясняется тем, что согласно исследованиям, внимание в которых уделялось не только показателям большей эффективности II поколения антипсихотиков в отношении коррекции ряда психопатологических расстройств, но и безопасности, было отмечено частое появление у больных нейроэндокринных дисфункций (НЭД) [1–6].
Согласно клиническим проявлениям описано два основных симптомокомплекса НЭД: синдром гиперпролактинемии (ГП) с комплексом гиперпролактинассоциированных эффектов и метаболический синдром (МС). Синдром ГП у женщин преимущественно характеризуется нарушениями менструального цикла – НМЦ (аменорея, олигоменорея, гиперменорея и др.), галактореей, часто сопровождающейся нагрубанием и болезненностью молочных желез, а также снижением либидо. У мужчин при ГП в основном регистрируются снижение либидо, нарушение эрекции и эякуляции; реже развиваются гинекомастия и галакторея. К ведущим проявлениям МС относятся увеличение массы тела, нарушения пищевого поведения, развитие гипергликемии, повышенная жажда и полиурия. Л.Н.Горобец (2007 г.) [2] выделен также третий тип, так называемый полиморфный синдром (ПС), в структуре которого мозаично представлены нейроэндокринные расстройства, характерные для двух первых синдромов.
Из приведенного спектра нейроэндокринных дисфункций развитие ГП и ассоцированных с ней нарушений у больных шизофренией в литературе рассматривается как фактор риска, оказывающий отчетливое влияние на ход терапевтического процесса. Внимание именно к этой группе расстройств объясняется выделением общего патогенетического звена в виде нарушений обмена дофамина как при их развитии, так и в генезе шизофрении. С одной стороны, оценка дисбаланса в обмене дофамина при шизофрении как приоритетного нейрохимического механизма является признанной [7]. При этом имеются попытки выделения дофаминзависимых и дофаминнезависимых симптомов [8]. Более того, в работах, целью которых являлся поиск связи между уровнем пролактина и клинической картиной, было установлено, что длительное повышение уровня пролактина ведет к гипогонадизму (снижение уровня тестостерона и эстрадиола). Это позволило U.Halbreich, L.Kahn (2003 г.) [9] рассматривать данный феномен в качестве предиктора нарастания негативных расстройств. С другой стороны, как известно, дофамин является главным пролактинингибирующим фактором за счет воздействия на лактофоры передней доли гипофиза, в которых происходит синтез пролактина. Дофамин и его агонисты стимулируют D2-рецепторы с соответствующим снижением высвобождения и секреции пролактина. Напротив, назначение антагонистов D2-структур (препараты–блокаторы рецепторов дофамина) приводит к повышению концентации пролактина в крови. Тем самым в числе разнообразных причин, приводящих к ГП, рассматривается фармакологическое воздействие [10, 11]. Уместно отметить, что в последние годы особое внимание было уделено изучению показателей функционирования у больных шизофренией серотонинергической системы ввиду большей способности атипичных антипсихотиков блокировать 5НТ2-, чем D2-рецепторы. Известно, что серотонинергическая система оказывает модулирующее влияние на дофаминовые структуры. Предполагают, что сам серотонин угнетает высвобождение дофамина, тогда как блокада постсинаптических серотониновых окончаний ведет к увеличению его содержания. По-видимому, такой механизм взаимодействия медиаторов в тубероинфундибулярной области ведет к уменьшению выраженности ГП, и наоборот, блокада серотониновых рецепторов за счет опосредованного действия на концентрацию дофамина сопровождает ее формирование [12].
Вместе с тем следует признать, что если суждения о механизмах развития ГП у большинства современных авторов совпадают, то в отношении причин возникновения у больных дисфункций со стороны гипофизарно-гонадной оси с выделением роли нейролептической терапии как ведущей причины единообразие во взглядах отсутствует.
В ряде работ основное значение в возникновении НЭД отводится фактору длительности шизофрении и ее клиническим проявлениям [13–16]. Получены данные, что в первые 5 лет у больных развиваются реакции адаптации как на само заболевание, так и на медикаментозное лечение, а в последующем преобладает гипофункция эндокринных желез, связанная с истощением механизмов адаптации [13, 16]. Так, в исследовании Н.А.Архиповой (1981 г.) [13] отмечено отсутствие связи между нарушениями менструальной функции у женщин и обнаруженной дисфункцией гипоталамо-гипофизарно-гонадной оси с применением длительной психофармакотерапии, но с установлением зависимости таких нарушений от типа течения шизофрении. Согласно полученным ею результатам при непрерывно-прогредиентной форме проявления аменореи встречались до 70% случаев; при приступопрогредиентном течении преимущественно наблюдали полное сохранение менструальной функции (до 90% случаев). Эти данные о развитии менструальных нарушений вне антипсихотической терапии подтверждаются также работой H.Ripley и соавт. (1941 г.) [14], проведенной в допсихофармакологическую эру. Так, при сравнении женщин, страдавших шизофренией, никогда не получавших антипсихотических препаратов, они обнаружили наличие аменореи примерно у 18% пациенток, что было значительно выше, чем в контрольной группе женщин без психических отклонений. Д.Д.Орловская (1966 г.) [15] установила частоту возникновения аменореи в 50% случаев параноидной шизофрении у женщин.
Согласно позиции других авторов ГП относится главным образом к клинически важным побочным эффектам антипсихотиков в период поддерживающей терапии. По современным оценкам, ее проявления могут развиваться при терапии любым нейролептиком, однако при использовании рисперидона и амисульприда установлен более высокий риск возникновения этого нежелательного явления, чем при терапии другими препаратами из группы атипичных антипсихотиков [17–21]. К числу потенциальных неблагоприятных последствий ГП, помимо приведенных выше, исследователи, в частности A.Szarfman, J.Tonning, J.Levine, P.Doraiswamy [22], реферат обзора которых был ранее опубликован в настоящем журнале, относят также повышенный риск развития опухолей гипофиза вследствие блокады дофаминовых D2-рецепторов под действием антипсихотиков. Согласно приведенным в нем данным, полученным в терапевтических исследованиях, микроаденомы гипофиза при использовании рисперидона были выявлены в 10 раз чаще, чем при терапии галоперидолом, оланзапином, и в 25 раз чаще, чем при лечении клозапином, зипрасидоном, кветиапином, арипипразолом. Однако методами нейроинструментальной диагностики было установлено, что примерно в половине всех случаев опухоли были квалифицированы как доброкачественные. Также нельзя не обратить внимание, что невыясненным остался сам факт того, была ли опухоль спровоцирована приемом препаратов или ее наличие уже предшествовало их назначению. В конечном счете остается только согласиться с заключительным суждением самих авторов цитируемого обзора, что, учитывая спонтанный характер проанализированных отчетов, полученные ими результаты не следует рассматривать как достоверное сравнение терапевтических групп или экстраполировать их при оценки рисков применения препаратов. Лишь дальнейшие исследования с использованием других медицинских баз данных (база данных ВОЗ и др.) позволят получить дополнительную информацию по рассматриваемой проблеме.
Необходимо отметить, что в отношении адекватности (эффективности и безопасности) существующих на сегодняшний день рекомендаций к проведению корректирующих мероприятий у пациентов с фармакогенной ГП единого мнения нет. Так, в ряде работ указывается на высокую эффективность (до 85% респондеров) использования препаратов группы агонистов дофаминовых рецепторов, в частности бромокриптина, на фоне проводимой антипсихотической терапии [2, 23]. Вместе с тем данные этих исследований были получены на выборке больных шизофренией и шизоаффективным расстройством, находившихся на момент начала коррекции в стабильном состоянии. Использование же агонистов дофамина у пациентов с выраженными остаточными симптомами самими авторами расценивается как шаг, способный привести к экзацербации психоза. В литературе имеются и указания на адекватность замены антипсихотиков с высокой пролактогенной активностью на препараты той же группы, но с меньшим сродством к дофаминовым рецепторам 2-го типа тубероинфундибулярной области.
Материал работы включал 134 больных (62 мужчин, 72 женщины; средний возраст 31,2±1,9 года) шизофренией, получавших лечение в отделении биологической терапии психически больных НИПНИ им. В.М.Бехтерева. В соответствии с правилами ICH GCP включение пациента в исследование проводили после его письменного согласия. Основными критериями отбора больных являлись: диагноз параноидной шизофрении с приступообразным или непрерывным типом течения согласно МКБ-10; минимальная сумма баллов по шкале PANSS при начале исследования не менее 60 баллов, что соответствовало наличию актуальной психотической симптоматики в рамках обострения или дебюта психоза; отсутствие указаний в анамнезе на наличие эндокринных, хронических соматических и неврологических заболеваний в стадии декомпенсации в течение последних 6 мес; отсутствие психофармакологического лечения в течение 3 мес до момента включения в исследование.
Дизайн работы предусматривал выделение двух этапов проведения антипсихотической терапии больным с обострениями шизофрении. Первый этап, исключительно стационарный, состоял в купировании психотических расстройств; второй этап (преимущественно стационарный, реже амбулаторный) приходился на начальный период формирования терапевтических ремиссий. Предусматривалось, что при выборе антипсихотического средства для проведения профилактической терапии, т.е. перед включением больных во второй этап исследования, наряду с оценкой антипсихотического эффекта препарата акцент при рассмотрении результатов первого этапа будет сделан на показателях безопасности лечения.
На первом этапе сформированы три группы в зависимости от вида монотерапии: группа 1 (37 человек) включала случаи применения рисперидона, 2 (34 человек) – оланзапина, 3 (35 человек) – кветиапина. Антипсихотики применяли в таблетированной форме и назначали в терапевтических дозах, рекомендуемых фирмами-изготовителями. Рисперидон использовали в дозах от 2 до 6 мг/сут (средняя доза 4,7±1,4 мг/сут), оланзапин – от 5 до 30 мг/сут (средняя доза 19,3±5,9 мг/сут), кветиапин – от 50 до 700 мг/сут (средняя доза 480±142,4 мг/сут). Продолжительность курса монотерапии на первом этапе во всех группах составляла 12 нед. Критерием положительного терапевтического эффекта считали редукцию первоначального рейтинга по шкале PANSS более чем на 20%. Пациенты, отвечающие этим требованиям, были отнесены к категории «респондеров». К числу «нонреспондеров» были отненесены случаи с редукцией первоначального рейтинга по этой шкале менее чем на 20%. При условии роста суммарной оценки по шкале PANSS, зарегистрированной на момент включения больных в исследование, использовали показатель «клиническое ухудшение».
На втором этапе был произведен перевод пациентов первой и второй терапевтических групп со значительной степенью выраженности нейроэндокринных побочных эффектов, ассоциированных с гиперпролактинемией, на 8-недельный курс монотерапии кветиапином в гибком режиме дозирования. В качестве критериев, отражавших наличие ГП, рассматривали: уровень пролактина к окончанию 12-й недели не менее 2000 мкМЕ/мл, т.е. примерно в 3 раза превышавший верхнюю границу нормы (показатели нормы для мужчин 96–456 мкМЕ/мл и для женщин 127–637 мкМЕ/мл) [2]; наличие стойких нарушений нейроэндокринного спектра (НМЦ, половые дисфункции, галакторея и др.).
Основные клинико-демографические показатели изученных групп больных представлены в табл. 1.
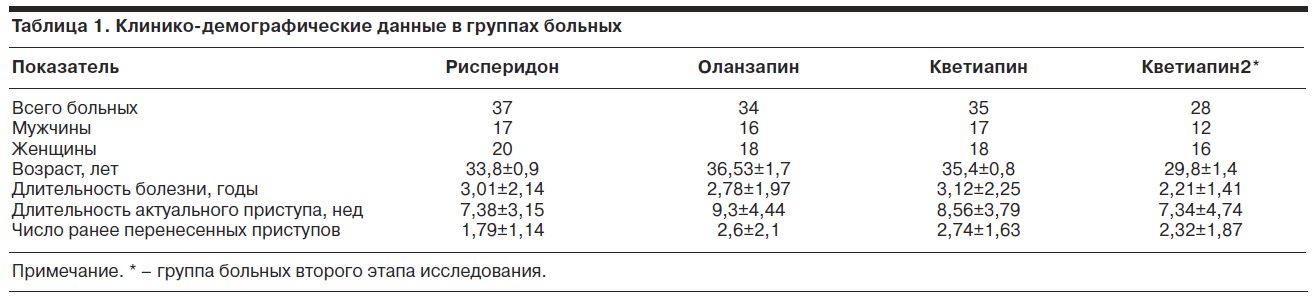
Как следует из табл. 1, все терапевтические группы, включая группу второго этапа исследования, были сопоставимы по основным клинико-демографическим показателям.
В работе были применены клинико-терапевтический, клинико-эндокринологический (антропометрический, лабораторный) и медико-статистический методы. Для объективизации клинических данных использовали: шкалу оценки позитивных и негативных синдромов – PANSS [24] и ее подшкалы, характеризующие позитивные, негативные, общепсихотические расстройства, симптомы подшкалы тревога/депрессия [25]; шкалу общих клинических впечатлений – CGI-S и глобальной оценки динамики психического состояния – CGI-I (National Institute of Menthal Health, 1970); шкалу Калгари для оценки депрессии при шизофрении – CDSS [26]; шкалу оценки побочного действия – UKU [27]; шкалу оценки лекарственно-вызванной акатизии – BARS (Barnes TRE, 1989). Совместное использование этих шкал отвечало условиям исследования при изучении клинических преобразований в ходе терапии.
Оценку уровня пролактина в сыворотке крови проводили иммуноферментным методом с использованием моноклональных антител в лаборатории «Максилаб» на базе Городской поликлиники №16 С.-Петербурга с использованием реактивов фирмы «Рош-Диагностика». Математико-статистическую обработку данных проводили с использованием программы «SPSS», версия 14.0.
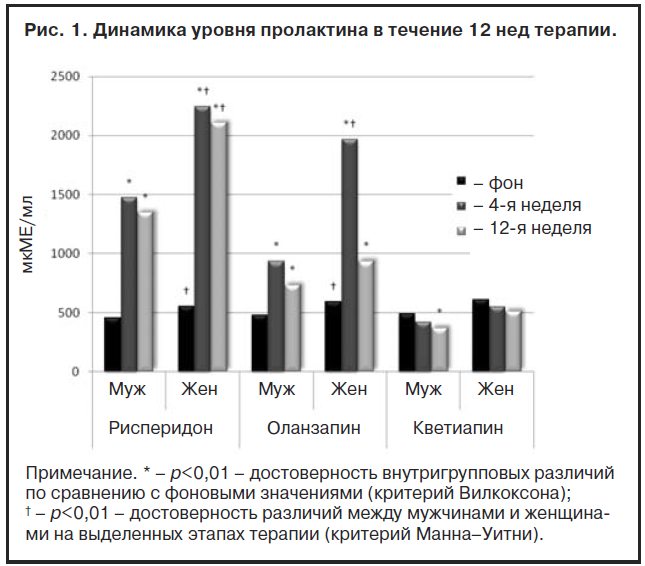
Как следует из рис. 1, по фоновым значениям среднего уровня пролактина достоверные различия между группами отсутствовали. У женщин из всех групп на момент начала терапии значения этого показателя были несколько выше, но, как и у мужчин, не выходили за пределы показателей нормы, что, вероятно, только демонстрирует межполовые физиологические особенности секреции этого гормона. К 4-й неделе лечения в группах рисперидона и оланзапина статистически значимо увеличивалась секреция этого гормона (p<0,01). Так, при приеме рисперидона у мужчин средние значения уровня пролактина составили 1471,6±203,4 мкМЕ/мл и у женщин – 2245,2±183,5 мкМЕ/мл. При использовании оланзапина элевация уровня пролактина была менее выраженной. В этой группе среднее значение этого показателя у мужчин составило 935,1±137,3 мкМЕ/мл и у женщин – 1967,2±171,2 мкМЕ/мл. К окончанию 12 нед терапии в группах рисперидона и оланзапина вне зависимости от половой принадлежности пациентов происходила частичная редукция уровня пролактина, однако его значения не достигали границ нормы. Наряду с тем у больных, принимавших кветиапин, средние значения показателей уровня пролактина за весь период 12 нед терапии не превышали границ нормы, обнаруживая тенденцию к снижению как у мужчин, так и у женщин при окончании этого периода терапии. Причем у мужчин на фоне приема этого препарата редукция уровня пролактина была статистически достоверной по сравнению с фоновыми значениями (p<0,01).
Обнаруженные различия в уровнях пролактина при терапии антипсихотиками между женщинами и мужчинами на всех этапах исследования свидетельствуют об участии в развитии ГП фактора полового диморфизма, связанного с определенной гендерной спецификой гипоталамо-гипофизарно-гонадных взаимодействий у женщин, что согласуется с данными, приводимыми в исследованиях G.Grunder (1999 г.) [28], C.Canuso (2002 г.) [29], D.Perkins (2003 г.) [30].
При анализе скорости формирования ГП у пациентов в зависимости от характера терапевтического ответа в отношении воздействия препаратов на психопатологические расстройства статистически значимых различий между «респондерами» и «нонреспондерами» не получено.
Специальному рассмотрению в ходе антипсихотической терапии была подвергнута совокупность гиперпролактинассоциированных симптомов [2, 10,] приведенная в табл. 2.
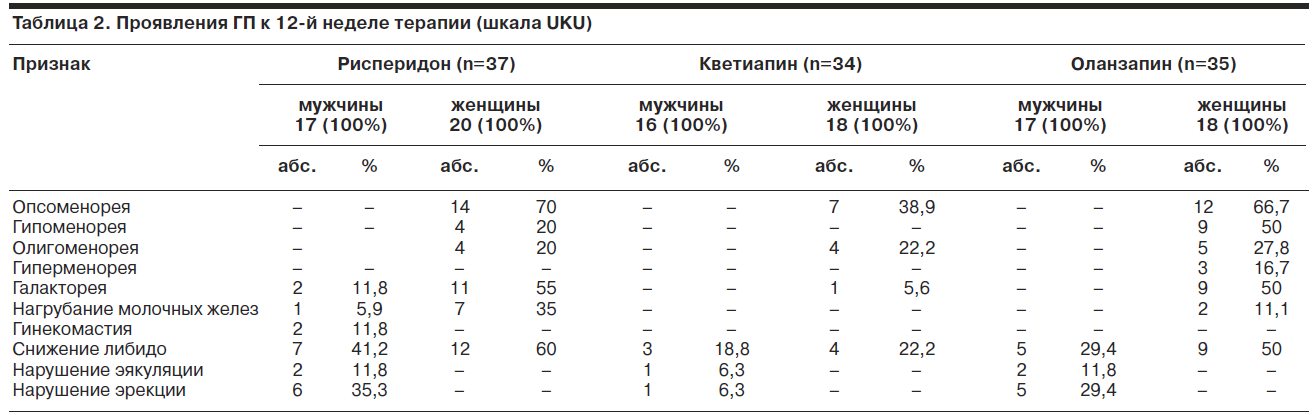
Как видно из табл. 2, структура синдрома ГП у женщин при купирующей терапии всеми препаратами характеризовалась НМЦ, галактореей, снижением либидо, а также нагрубанием молочных желез. Из общего числа наблюдений исключение составили пациентки, получавшие терапию кветиапином, у которых изменений молочных желез не наблюдали. У мужчин клиническая структура синдрома включала снижение либидо, нарушения эректильной и эякуляторной функций при терапии всеми атипиками, а также галакторею и гинекомастию при терапии рисперидоном.
Частота возникновения НМЦ в ходе исследования у женщин при терапии рисперидоном и оланзапином была сопоставимой и значительно превышала частоту регистрации НМЦ у больных при терапии кветиапином. Нарушения эректильной и эякуляторной функций также преобладали у мужчин при терапии рисперидоном и оланзапином.
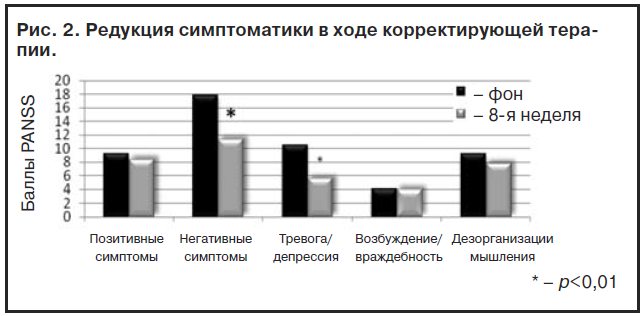
Психопатологическая симптоматика и нейроэндокринные показатели на втором этапе (стабилизация ремиссии) в ходе корректирующей терапии, а также психотропная активность кветиапина были проанализированы по подшкалам шкалы PANSS (рис. 2).
Согласно данным, приведенным на рис. 2, в ходе терапии кветиапином происходила статистически значимая редукция средних значений кластеров «негативная симптоматика» и «тревога/депрессия». Основные клинические преобразования в рамках аффективной симптоматики у больных в ходе корректирующей терапии реализовались в течение 1-го месяца использования кветиапина. Суммарное значение по шкале CDSS к 4-й неделе было ниже пороговой оценки в 6 баллов, подчеркивая статистически значимую динамику (p<0,05). По трем другим подшкалам, включая продуктивные расстройства, достоверных различий не получено ввиду небольшой выраженности составлявших их симптомов уже в начале этого этапа терапии. Принимая во внимание приведенные выше данные литературы о возможном параллелизме между проявлениями негативного и депрессивного ряда с показателями выраженности ГП у больных шизофренией, специальный интерес вызывали изменения уровня пролактина при монотерапии кветиапином. Полученные лабораторные данные приведены на рис. 3.
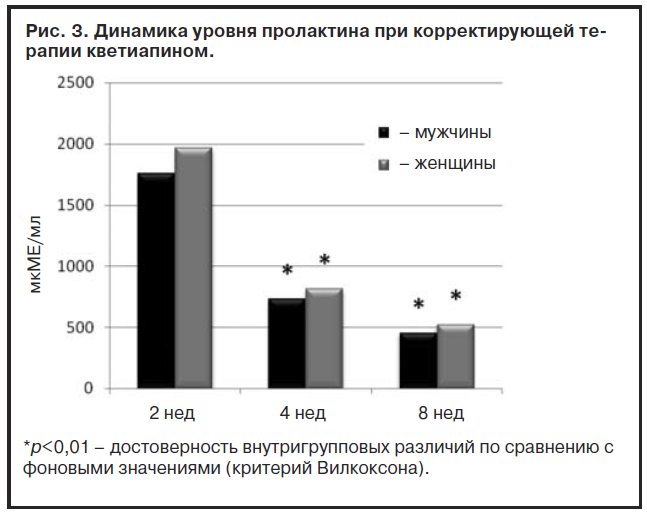
Как следует из рис. 3, при терапии кветиапином происходило отчетливое снижение уровня пролактина от 2 к 4-й и от 4 к 8-й неделям терапии, а также прослеживается роль фактора полового диморфизма. У больных женского пола уровень этого гормона на всех выделенных интервалах этого этапа терапии преобладал над показателями его секреции у пациентов мужского пола. Таким образом, к окончанию 8-й недели терапии кветиапином происходила нормализация уровня пролактина как у мужчин, так и у женщин. Дополнительно в отношении эффективности корректирующей терапии кветиапином комплекса нейроэндокринных расстройств были получены следующие данные (табл. 3).
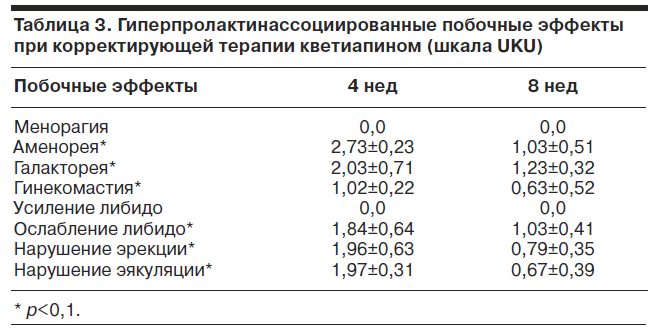
Согласно показателям табл. 3 на фоне приема кветиапина у больных с явно представленными побочными эффектами нейроэндокринного спектра в начале второго этапа терапии происходило уменьшение их выраженности (достоверная редукция оценок по большинству показателей шкалы UKU к окончанию этапа 2).
Таким образом, на основании данных, полученных при монотерапии кветиапином шизофрении в период стабилизации ремиссии, был установлен определенный параллелизм между уменьшением выраженности у больных ряда остаточных психопатологических расстройств (симптомы негативного и депрессивного полюса) и устранением проявлений как ГП, так и гиперпролактинассоциированных побочных эффектов, вызванных приемом других исследовавшихся атипичных антипсихотиков.
Результаты современных исследований дают основание их авторам считать, что характер побочных эффектов антипсихотической терапии тесно связан с особенностями клинической динамики основных психопатологических симптомов шизофрении [4, 8–12]. В ряду этих эффектов группа нейроэндокринных расстройств, наличие которых, как сказано выше, наиболее часто регистрируется у больных шизофренией, получающих атипичные антипсихотики, является, по-видимому, отражением как отмеченного дисбаланса функционального состояния желез внутренней секреции, возникающего в результате патогенетических механизмов самого заболевания, факторов «почвы» – с одной стороны [16], так и побочных эффектов психофармакотерапии – с другой.
Актуальность нашей работы объясняется существующей неоднозначностью оценок эффективности при коррекции нейроэндокринных нарушений и отсутствием систематизированных сведений об их взаимосвязи с кластерами психопатологической симптоматики шизофрении. Полученные в ней данные о характере этих нарушений и возможностях их коррекции, равно как и установленные связи между ними и показателями терапевтического процесса, позволяют обсудить вопросы, несомненно, имеющие практическую важность. Обнаруженные нами сопряженности негативной и депрессивной симптоматики с выраженностью ГП у основного числа больных подтверждают гипотезу о связи указанных психопатологических явлений с дисбалансом гормонального статуса [2]. Наиболее обоснованным механизмом реализации этих сопряженностей представляется влияние антипсихотиков на активность гипоталамо-гипофизарно-гонадной оси. Полученные особенности влияния нейроэндокринных побочных эффектов на компоненты психотического состояния позволили выделить из общего числа больных по итогам этапа 1 когорту случаев с отчетливыми проявлениями депрессивного и негативного характера и стойкими НЭД. Данные ретроспективного анализа показателей клинической динамики и характера побочных эффектов выявили, что как на момент начала, так и на всех последующих интервалах 12-недельной терапии рисперидоном и оланзапином преобладание в таких случаях отмеченных двух разновидностей психопатологической симптоматики было статистически достоверно по сравнению с основным числом наблюдений. В этих же случаях выраженность ГП достоверно превосходила таковую у респондеров уже к 4-й неделе терапии и сохранялась на всем протяжении этапа 1. Примечательно и то, что средние дозы препаратов не имели достоверных различий с дозами рисперидона и оланзапина, которые использовались у респондеров. Это дает основание предположить наличие у таких пациентов особого рода предиспозиции в виде повышенной чувствительности к развитию побочных эффектов, склонности к формированию у них более выраженной ГП в ответ на прием уже средних доз препаратов и как следствие устойчивости негативной и депрессивной симптоматики к воздействию антипсихотических средств. Одной из причин подобного рода реагирования может быть генетический механизм, связанный с полиморфизмом 1-го типа гена DRD2, ответственного за синтез постсинаптических D2-рецепторов.
Выделенные особенности формирования НЭД позволили сформулировать показания к приведению корректирующих мероприятий как в отношении указанных остаточных психопатологических феноменов, так и применительно к нейроэндокринному статусу. Для оптимизации терапии остаточной психопатологической симптоматики, ассоциированной с НЭД, мы использовали кветиапин. Выбор именно этой тактики был связан с отсутствием пролактогенного эффекта у этого препарата, что было показано в результате нашего исследования, а также с наличием в литературе указаний на его способность снижать исходно повышенный уровень пролактина [16]. Результаты 2-го этапа работы подтвердили эффективность и безопасность коррекции остаточной психопатологической симптоматики, ассоциированной с комплексом ГП у больных вне зависимости от фактора пола.
Таким образом, согласно полученным в работе данным контроль за показателями переносимости купирующей терапии обострений шизофрении препаратами атипичного ряда и коррекция нейроэндокринных побочных эффектов позволяют оптимизировать методы лекарственного воздействия.
Согласно клиническим проявлениям описано два основных симптомокомплекса НЭД: синдром гиперпролактинемии (ГП) с комплексом гиперпролактинассоциированных эффектов и метаболический синдром (МС). Синдром ГП у женщин преимущественно характеризуется нарушениями менструального цикла – НМЦ (аменорея, олигоменорея, гиперменорея и др.), галактореей, часто сопровождающейся нагрубанием и болезненностью молочных желез, а также снижением либидо. У мужчин при ГП в основном регистрируются снижение либидо, нарушение эрекции и эякуляции; реже развиваются гинекомастия и галакторея. К ведущим проявлениям МС относятся увеличение массы тела, нарушения пищевого поведения, развитие гипергликемии, повышенная жажда и полиурия. Л.Н.Горобец (2007 г.) [2] выделен также третий тип, так называемый полиморфный синдром (ПС), в структуре которого мозаично представлены нейроэндокринные расстройства, характерные для двух первых синдромов.
Из приведенного спектра нейроэндокринных дисфункций развитие ГП и ассоцированных с ней нарушений у больных шизофренией в литературе рассматривается как фактор риска, оказывающий отчетливое влияние на ход терапевтического процесса. Внимание именно к этой группе расстройств объясняется выделением общего патогенетического звена в виде нарушений обмена дофамина как при их развитии, так и в генезе шизофрении. С одной стороны, оценка дисбаланса в обмене дофамина при шизофрении как приоритетного нейрохимического механизма является признанной [7]. При этом имеются попытки выделения дофаминзависимых и дофаминнезависимых симптомов [8]. Более того, в работах, целью которых являлся поиск связи между уровнем пролактина и клинической картиной, было установлено, что длительное повышение уровня пролактина ведет к гипогонадизму (снижение уровня тестостерона и эстрадиола). Это позволило U.Halbreich, L.Kahn (2003 г.) [9] рассматривать данный феномен в качестве предиктора нарастания негативных расстройств. С другой стороны, как известно, дофамин является главным пролактинингибирующим фактором за счет воздействия на лактофоры передней доли гипофиза, в которых происходит синтез пролактина. Дофамин и его агонисты стимулируют D2-рецепторы с соответствующим снижением высвобождения и секреции пролактина. Напротив, назначение антагонистов D2-структур (препараты–блокаторы рецепторов дофамина) приводит к повышению концентации пролактина в крови. Тем самым в числе разнообразных причин, приводящих к ГП, рассматривается фармакологическое воздействие [10, 11]. Уместно отметить, что в последние годы особое внимание было уделено изучению показателей функционирования у больных шизофренией серотонинергической системы ввиду большей способности атипичных антипсихотиков блокировать 5НТ2-, чем D2-рецепторы. Известно, что серотонинергическая система оказывает модулирующее влияние на дофаминовые структуры. Предполагают, что сам серотонин угнетает высвобождение дофамина, тогда как блокада постсинаптических серотониновых окончаний ведет к увеличению его содержания. По-видимому, такой механизм взаимодействия медиаторов в тубероинфундибулярной области ведет к уменьшению выраженности ГП, и наоборот, блокада серотониновых рецепторов за счет опосредованного действия на концентрацию дофамина сопровождает ее формирование [12].
Вместе с тем следует признать, что если суждения о механизмах развития ГП у большинства современных авторов совпадают, то в отношении причин возникновения у больных дисфункций со стороны гипофизарно-гонадной оси с выделением роли нейролептической терапии как ведущей причины единообразие во взглядах отсутствует.
В ряде работ основное значение в возникновении НЭД отводится фактору длительности шизофрении и ее клиническим проявлениям [13–16]. Получены данные, что в первые 5 лет у больных развиваются реакции адаптации как на само заболевание, так и на медикаментозное лечение, а в последующем преобладает гипофункция эндокринных желез, связанная с истощением механизмов адаптации [13, 16]. Так, в исследовании Н.А.Архиповой (1981 г.) [13] отмечено отсутствие связи между нарушениями менструальной функции у женщин и обнаруженной дисфункцией гипоталамо-гипофизарно-гонадной оси с применением длительной психофармакотерапии, но с установлением зависимости таких нарушений от типа течения шизофрении. Согласно полученным ею результатам при непрерывно-прогредиентной форме проявления аменореи встречались до 70% случаев; при приступопрогредиентном течении преимущественно наблюдали полное сохранение менструальной функции (до 90% случаев). Эти данные о развитии менструальных нарушений вне антипсихотической терапии подтверждаются также работой H.Ripley и соавт. (1941 г.) [14], проведенной в допсихофармакологическую эру. Так, при сравнении женщин, страдавших шизофренией, никогда не получавших антипсихотических препаратов, они обнаружили наличие аменореи примерно у 18% пациенток, что было значительно выше, чем в контрольной группе женщин без психических отклонений. Д.Д.Орловская (1966 г.) [15] установила частоту возникновения аменореи в 50% случаев параноидной шизофрении у женщин.
Согласно позиции других авторов ГП относится главным образом к клинически важным побочным эффектам антипсихотиков в период поддерживающей терапии. По современным оценкам, ее проявления могут развиваться при терапии любым нейролептиком, однако при использовании рисперидона и амисульприда установлен более высокий риск возникновения этого нежелательного явления, чем при терапии другими препаратами из группы атипичных антипсихотиков [17–21]. К числу потенциальных неблагоприятных последствий ГП, помимо приведенных выше, исследователи, в частности A.Szarfman, J.Tonning, J.Levine, P.Doraiswamy [22], реферат обзора которых был ранее опубликован в настоящем журнале, относят также повышенный риск развития опухолей гипофиза вследствие блокады дофаминовых D2-рецепторов под действием антипсихотиков. Согласно приведенным в нем данным, полученным в терапевтических исследованиях, микроаденомы гипофиза при использовании рисперидона были выявлены в 10 раз чаще, чем при терапии галоперидолом, оланзапином, и в 25 раз чаще, чем при лечении клозапином, зипрасидоном, кветиапином, арипипразолом. Однако методами нейроинструментальной диагностики было установлено, что примерно в половине всех случаев опухоли были квалифицированы как доброкачественные. Также нельзя не обратить внимание, что невыясненным остался сам факт того, была ли опухоль спровоцирована приемом препаратов или ее наличие уже предшествовало их назначению. В конечном счете остается только согласиться с заключительным суждением самих авторов цитируемого обзора, что, учитывая спонтанный характер проанализированных отчетов, полученные ими результаты не следует рассматривать как достоверное сравнение терапевтических групп или экстраполировать их при оценки рисков применения препаратов. Лишь дальнейшие исследования с использованием других медицинских баз данных (база данных ВОЗ и др.) позволят получить дополнительную информацию по рассматриваемой проблеме.
Необходимо отметить, что в отношении адекватности (эффективности и безопасности) существующих на сегодняшний день рекомендаций к проведению корректирующих мероприятий у пациентов с фармакогенной ГП единого мнения нет. Так, в ряде работ указывается на высокую эффективность (до 85% респондеров) использования препаратов группы агонистов дофаминовых рецепторов, в частности бромокриптина, на фоне проводимой антипсихотической терапии [2, 23]. Вместе с тем данные этих исследований были получены на выборке больных шизофренией и шизоаффективным расстройством, находившихся на момент начала коррекции в стабильном состоянии. Использование же агонистов дофамина у пациентов с выраженными остаточными симптомами самими авторами расценивается как шаг, способный привести к экзацербации психоза. В литературе имеются и указания на адекватность замены антипсихотиков с высокой пролактогенной активностью на препараты той же группы, но с меньшим сродством к дофаминовым рецепторам 2-го типа тубероинфундибулярной области.
Материал работы включал 134 больных (62 мужчин, 72 женщины; средний возраст 31,2±1,9 года) шизофренией, получавших лечение в отделении биологической терапии психически больных НИПНИ им. В.М.Бехтерева. В соответствии с правилами ICH GCP включение пациента в исследование проводили после его письменного согласия. Основными критериями отбора больных являлись: диагноз параноидной шизофрении с приступообразным или непрерывным типом течения согласно МКБ-10; минимальная сумма баллов по шкале PANSS при начале исследования не менее 60 баллов, что соответствовало наличию актуальной психотической симптоматики в рамках обострения или дебюта психоза; отсутствие указаний в анамнезе на наличие эндокринных, хронических соматических и неврологических заболеваний в стадии декомпенсации в течение последних 6 мес; отсутствие психофармакологического лечения в течение 3 мес до момента включения в исследование.
Дизайн работы предусматривал выделение двух этапов проведения антипсихотической терапии больным с обострениями шизофрении. Первый этап, исключительно стационарный, состоял в купировании психотических расстройств; второй этап (преимущественно стационарный, реже амбулаторный) приходился на начальный период формирования терапевтических ремиссий. Предусматривалось, что при выборе антипсихотического средства для проведения профилактической терапии, т.е. перед включением больных во второй этап исследования, наряду с оценкой антипсихотического эффекта препарата акцент при рассмотрении результатов первого этапа будет сделан на показателях безопасности лечения.
На первом этапе сформированы три группы в зависимости от вида монотерапии: группа 1 (37 человек) включала случаи применения рисперидона, 2 (34 человек) – оланзапина, 3 (35 человек) – кветиапина. Антипсихотики применяли в таблетированной форме и назначали в терапевтических дозах, рекомендуемых фирмами-изготовителями. Рисперидон использовали в дозах от 2 до 6 мг/сут (средняя доза 4,7±1,4 мг/сут), оланзапин – от 5 до 30 мг/сут (средняя доза 19,3±5,9 мг/сут), кветиапин – от 50 до 700 мг/сут (средняя доза 480±142,4 мг/сут). Продолжительность курса монотерапии на первом этапе во всех группах составляла 12 нед. Критерием положительного терапевтического эффекта считали редукцию первоначального рейтинга по шкале PANSS более чем на 20%. Пациенты, отвечающие этим требованиям, были отнесены к категории «респондеров». К числу «нонреспондеров» были отненесены случаи с редукцией первоначального рейтинга по этой шкале менее чем на 20%. При условии роста суммарной оценки по шкале PANSS, зарегистрированной на момент включения больных в исследование, использовали показатель «клиническое ухудшение».
На втором этапе был произведен перевод пациентов первой и второй терапевтических групп со значительной степенью выраженности нейроэндокринных побочных эффектов, ассоциированных с гиперпролактинемией, на 8-недельный курс монотерапии кветиапином в гибком режиме дозирования. В качестве критериев, отражавших наличие ГП, рассматривали: уровень пролактина к окончанию 12-й недели не менее 2000 мкМЕ/мл, т.е. примерно в 3 раза превышавший верхнюю границу нормы (показатели нормы для мужчин 96–456 мкМЕ/мл и для женщин 127–637 мкМЕ/мл) [2]; наличие стойких нарушений нейроэндокринного спектра (НМЦ, половые дисфункции, галакторея и др.).
Основные клинико-демографические показатели изученных групп больных представлены в табл. 1.

Как следует из табл. 1, все терапевтические группы, включая группу второго этапа исследования, были сопоставимы по основным клинико-демографическим показателям.
В работе были применены клинико-терапевтический, клинико-эндокринологический (антропометрический, лабораторный) и медико-статистический методы. Для объективизации клинических данных использовали: шкалу оценки позитивных и негативных синдромов – PANSS [24] и ее подшкалы, характеризующие позитивные, негативные, общепсихотические расстройства, симптомы подшкалы тревога/депрессия [25]; шкалу общих клинических впечатлений – CGI-S и глобальной оценки динамики психического состояния – CGI-I (National Institute of Menthal Health, 1970); шкалу Калгари для оценки депрессии при шизофрении – CDSS [26]; шкалу оценки побочного действия – UKU [27]; шкалу оценки лекарственно-вызванной акатизии – BARS (Barnes TRE, 1989). Совместное использование этих шкал отвечало условиям исследования при изучении клинических преобразований в ходе терапии.
Оценку уровня пролактина в сыворотке крови проводили иммуноферментным методом с использованием моноклональных антител в лаборатории «Максилаб» на базе Городской поликлиники №16 С.-Петербурга с использованием реактивов фирмы «Рош-Диагностика». Математико-статистическую обработку данных проводили с использованием программы «SPSS», версия 14.0.

Как следует из рис. 1, по фоновым значениям среднего уровня пролактина достоверные различия между группами отсутствовали. У женщин из всех групп на момент начала терапии значения этого показателя были несколько выше, но, как и у мужчин, не выходили за пределы показателей нормы, что, вероятно, только демонстрирует межполовые физиологические особенности секреции этого гормона. К 4-й неделе лечения в группах рисперидона и оланзапина статистически значимо увеличивалась секреция этого гормона (p<0,01). Так, при приеме рисперидона у мужчин средние значения уровня пролактина составили 1471,6±203,4 мкМЕ/мл и у женщин – 2245,2±183,5 мкМЕ/мл. При использовании оланзапина элевация уровня пролактина была менее выраженной. В этой группе среднее значение этого показателя у мужчин составило 935,1±137,3 мкМЕ/мл и у женщин – 1967,2±171,2 мкМЕ/мл. К окончанию 12 нед терапии в группах рисперидона и оланзапина вне зависимости от половой принадлежности пациентов происходила частичная редукция уровня пролактина, однако его значения не достигали границ нормы. Наряду с тем у больных, принимавших кветиапин, средние значения показателей уровня пролактина за весь период 12 нед терапии не превышали границ нормы, обнаруживая тенденцию к снижению как у мужчин, так и у женщин при окончании этого периода терапии. Причем у мужчин на фоне приема этого препарата редукция уровня пролактина была статистически достоверной по сравнению с фоновыми значениями (p<0,01).
Обнаруженные различия в уровнях пролактина при терапии антипсихотиками между женщинами и мужчинами на всех этапах исследования свидетельствуют об участии в развитии ГП фактора полового диморфизма, связанного с определенной гендерной спецификой гипоталамо-гипофизарно-гонадных взаимодействий у женщин, что согласуется с данными, приводимыми в исследованиях G.Grunder (1999 г.) [28], C.Canuso (2002 г.) [29], D.Perkins (2003 г.) [30].
При анализе скорости формирования ГП у пациентов в зависимости от характера терапевтического ответа в отношении воздействия препаратов на психопатологические расстройства статистически значимых различий между «респондерами» и «нонреспондерами» не получено.
Специальному рассмотрению в ходе антипсихотической терапии была подвергнута совокупность гиперпролактинассоциированных симптомов [2, 10,] приведенная в табл. 2.

Как видно из табл. 2, структура синдрома ГП у женщин при купирующей терапии всеми препаратами характеризовалась НМЦ, галактореей, снижением либидо, а также нагрубанием молочных желез. Из общего числа наблюдений исключение составили пациентки, получавшие терапию кветиапином, у которых изменений молочных желез не наблюдали. У мужчин клиническая структура синдрома включала снижение либидо, нарушения эректильной и эякуляторной функций при терапии всеми атипиками, а также галакторею и гинекомастию при терапии рисперидоном.
Частота возникновения НМЦ в ходе исследования у женщин при терапии рисперидоном и оланзапином была сопоставимой и значительно превышала частоту регистрации НМЦ у больных при терапии кветиапином. Нарушения эректильной и эякуляторной функций также преобладали у мужчин при терапии рисперидоном и оланзапином.

Психопатологическая симптоматика и нейроэндокринные показатели на втором этапе (стабилизация ремиссии) в ходе корректирующей терапии, а также психотропная активность кветиапина были проанализированы по подшкалам шкалы PANSS (рис. 2).
Согласно данным, приведенным на рис. 2, в ходе терапии кветиапином происходила статистически значимая редукция средних значений кластеров «негативная симптоматика» и «тревога/депрессия». Основные клинические преобразования в рамках аффективной симптоматики у больных в ходе корректирующей терапии реализовались в течение 1-го месяца использования кветиапина. Суммарное значение по шкале CDSS к 4-й неделе было ниже пороговой оценки в 6 баллов, подчеркивая статистически значимую динамику (p<0,05). По трем другим подшкалам, включая продуктивные расстройства, достоверных различий не получено ввиду небольшой выраженности составлявших их симптомов уже в начале этого этапа терапии. Принимая во внимание приведенные выше данные литературы о возможном параллелизме между проявлениями негативного и депрессивного ряда с показателями выраженности ГП у больных шизофренией, специальный интерес вызывали изменения уровня пролактина при монотерапии кветиапином. Полученные лабораторные данные приведены на рис. 3.

Как следует из рис. 3, при терапии кветиапином происходило отчетливое снижение уровня пролактина от 2 к 4-й и от 4 к 8-й неделям терапии, а также прослеживается роль фактора полового диморфизма. У больных женского пола уровень этого гормона на всех выделенных интервалах этого этапа терапии преобладал над показателями его секреции у пациентов мужского пола. Таким образом, к окончанию 8-й недели терапии кветиапином происходила нормализация уровня пролактина как у мужчин, так и у женщин. Дополнительно в отношении эффективности корректирующей терапии кветиапином комплекса нейроэндокринных расстройств были получены следующие данные (табл. 3).

Согласно показателям табл. 3 на фоне приема кветиапина у больных с явно представленными побочными эффектами нейроэндокринного спектра в начале второго этапа терапии происходило уменьшение их выраженности (достоверная редукция оценок по большинству показателей шкалы UKU к окончанию этапа 2).
Таким образом, на основании данных, полученных при монотерапии кветиапином шизофрении в период стабилизации ремиссии, был установлен определенный параллелизм между уменьшением выраженности у больных ряда остаточных психопатологических расстройств (симптомы негативного и депрессивного полюса) и устранением проявлений как ГП, так и гиперпролактинассоциированных побочных эффектов, вызванных приемом других исследовавшихся атипичных антипсихотиков.
Результаты современных исследований дают основание их авторам считать, что характер побочных эффектов антипсихотической терапии тесно связан с особенностями клинической динамики основных психопатологических симптомов шизофрении [4, 8–12]. В ряду этих эффектов группа нейроэндокринных расстройств, наличие которых, как сказано выше, наиболее часто регистрируется у больных шизофренией, получающих атипичные антипсихотики, является, по-видимому, отражением как отмеченного дисбаланса функционального состояния желез внутренней секреции, возникающего в результате патогенетических механизмов самого заболевания, факторов «почвы» – с одной стороны [16], так и побочных эффектов психофармакотерапии – с другой.
Актуальность нашей работы объясняется существующей неоднозначностью оценок эффективности при коррекции нейроэндокринных нарушений и отсутствием систематизированных сведений об их взаимосвязи с кластерами психопатологической симптоматики шизофрении. Полученные в ней данные о характере этих нарушений и возможностях их коррекции, равно как и установленные связи между ними и показателями терапевтического процесса, позволяют обсудить вопросы, несомненно, имеющие практическую важность. Обнаруженные нами сопряженности негативной и депрессивной симптоматики с выраженностью ГП у основного числа больных подтверждают гипотезу о связи указанных психопатологических явлений с дисбалансом гормонального статуса [2]. Наиболее обоснованным механизмом реализации этих сопряженностей представляется влияние антипсихотиков на активность гипоталамо-гипофизарно-гонадной оси. Полученные особенности влияния нейроэндокринных побочных эффектов на компоненты психотического состояния позволили выделить из общего числа больных по итогам этапа 1 когорту случаев с отчетливыми проявлениями депрессивного и негативного характера и стойкими НЭД. Данные ретроспективного анализа показателей клинической динамики и характера побочных эффектов выявили, что как на момент начала, так и на всех последующих интервалах 12-недельной терапии рисперидоном и оланзапином преобладание в таких случаях отмеченных двух разновидностей психопатологической симптоматики было статистически достоверно по сравнению с основным числом наблюдений. В этих же случаях выраженность ГП достоверно превосходила таковую у респондеров уже к 4-й неделе терапии и сохранялась на всем протяжении этапа 1. Примечательно и то, что средние дозы препаратов не имели достоверных различий с дозами рисперидона и оланзапина, которые использовались у респондеров. Это дает основание предположить наличие у таких пациентов особого рода предиспозиции в виде повышенной чувствительности к развитию побочных эффектов, склонности к формированию у них более выраженной ГП в ответ на прием уже средних доз препаратов и как следствие устойчивости негативной и депрессивной симптоматики к воздействию антипсихотических средств. Одной из причин подобного рода реагирования может быть генетический механизм, связанный с полиморфизмом 1-го типа гена DRD2, ответственного за синтез постсинаптических D2-рецепторов.
Выделенные особенности формирования НЭД позволили сформулировать показания к приведению корректирующих мероприятий как в отношении указанных остаточных психопатологических феноменов, так и применительно к нейроэндокринному статусу. Для оптимизации терапии остаточной психопатологической симптоматики, ассоциированной с НЭД, мы использовали кветиапин. Выбор именно этой тактики был связан с отсутствием пролактогенного эффекта у этого препарата, что было показано в результате нашего исследования, а также с наличием в литературе указаний на его способность снижать исходно повышенный уровень пролактина [16]. Результаты 2-го этапа работы подтвердили эффективность и безопасность коррекции остаточной психопатологической симптоматики, ассоциированной с комплексом ГП у больных вне зависимости от фактора пола.
Таким образом, согласно полученным в работе данным контроль за показателями переносимости купирующей терапии обострений шизофрении препаратами атипичного ряда и коррекция нейроэндокринных побочных эффектов позволяют оптимизировать методы лекарственного воздействия.
27 августа 2009
Количество просмотров: 2829

