Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03 2014
Сравнительная динамика уровней кортизола и дегидроэпиандростерон-сульфата у больных с первым психотическим эпизодом и хронической шизофренией в процессе терапии оланзапином с учетом оценки терапевтического эффекта №03 2014
Номера страниц в выпуске:19-24
Оценивались уровни кортизола и дегидроэпиандростерон-сульфата (ДГЭА-С) у 33 пациентов (17 мужчин, 16 женщин) с первым психотическим эпизодом (ППЭ) в процессе терапии оланзапином. Группу сравнения составили 34 пациента (16 мужчин, 18 женщин) со средней длительностью психического заболевания 12,5 года. Контрольную группу психически и соматически здоровых составили 34 человека (14 женщин, 20 мужчин), средний возраст 34,6±6,8 года. Оценка гормональных показателей проводилась динамически (фон, 3–4 и 6–8 нед терапии) в зависимости от гендерного фактора и эффективности лечения.
Резюме. Оценивались уровни кортизола и дегидроэпиандростерон-сульфата (ДГЭА-С) у 33 пациентов (17 мужчин, 16 женщин) с первым психотическим эпизодом (ППЭ) в процессе терапии оланзапином. Группу сравнения составили 34 пациента (16 мужчин, 18 женщин) со средней длительностью психического заболевания 12,5 года. Контрольную группу психически и соматически здоровых составили 34 человека (14 женщин, 20 мужчин), средний возраст 34,6±6,8 года. Оценка гормональных показателей проводилась динамически (фон, 3–4 и 6–8 нед терапии) в зависимости от гендерного фактора и эффективности лечения. Выявлены особенности динамики гормональных параметров: фоновые значения уровней кортизола и ДГЭА-С у мужчин и кортизола у женщин в 2 исследуемых группах достоверно превышают показатели контроля и референтные значения; более физиологически гармоничная (однонаправленность изменений кортизола и ДГЭА-С) динамика отмечена у больных-респондеров с ППЭ независимо от гендерного фактора; гормональным биомаркером отсутствия терапевтического эффекта у больных с ППЭ является разнонаправленность динамических изменений указанных гормонов и наличие фоновой отрицательной корреляционной связи между кортизолом и ДГЭА-С у мужчин.
Ключевые слова: первый психотический эпизод, кортизол, дегидроэпиандростерон-сульфат, оланзапин.
Comparative dynamics of serum cortisol and dehydroepiandrosterone sulphate levels
in patients with first-episode psychosis and chronic schizophrenia in the process of olanzapine therapy based on an assessment of the therapeutic effect (R/NR)
L.N.Gorobets1, A.G.Lorikyan1, N.M.Kutuzova2
1Moscow Research Institute of Psychiatry Russian Ministry of Health;
2Moscow State Pedagogical University
Summary. Serum cortisol and dehydroepiandrosterone sulphate levels have been assessed in 33 patients (17 men, 16 women) with first psychotic episode (FPE) during olazapine treatment. The comparison group included 34 patients (16 men, 18 women) with 12,5 years of average duration course of illness. The control group included 34 patients (20 men, 14 women) with average age 34,6±6,8 years. Assessment of levels of these hormones was dynamically (background, 3–4 weeks and 6–8 weeks of therapy) depending on gender. There were found the features of the dynamics of hormonal parameters: background values cortisol levels and DHEA-S in men and cortisol in women in the two treatment groups was significantly higher than those of control and reference values; physiologically more harmonious (unidirectional change of cortisol and DHEA-S) dynamics observed in patients – responders with FEP regardless of gender; hormonal biomarker lack therapeutic effect in patients with FEP is different dynamic changes in these hormones and the presence of a background of negative correlation between cortisol and DHEA-S in men.
Key words: first-episode psychosis, cortisol, dehydroepiandrosterone sulphate.
В контексте обсуждаемых вопросов несомненный интерес представляет эндокринологический подход (исследование гормональных показателей) к изучению проблемы терапии больных с ППЭ, что будет способствовать определению гормональных предикторов (биологических маркеров) эффективности терапии и даст возможность минимизировать развитие нейроэндокринных побочных эффектов у больных с ППЭ при проведении антипсихотической терапии. К настоящему времени в научной литературе имеется крайне мало исследований, освещающих эту проблему. Большинство из них связано с изучением таких гормональных показателей у больных шизофренией при антипсихотической терапии, как уровни пролактина, эстрадиола, тестостерона, прегненолона и др. [1, 6, 11, 16, 22]. В отечественной литературе данные об изучении гормонов гипоталамо-гипофизарно-адреналовой оси (ГГА-оси) у указанного контингента больных отсутствуют.
В этой связи представляется актуальным проведение сравнительных исследований по изучению особенностей гормонального дисбаланса ГГА-оси у больных шизофренией с учетом длительности заболевания, гендерного и фармакогенного факторов.
Цель исследования – сравнительное изучение динамики уровней кортизола и дегидроэпиандростерон-сульфата (ДГЭА-С) у больных с ППЭ и хронической шизофренией в процессе терапии оланзапином.
Критерии включения: возраст от 18 до 55 лет; психотический эпизод – баллы по шкале PANSS>60; верифицированный диагноз шизофрении в соответствии с МКБ-10; отсутствие органической патологии центральной нервной системы; отсутствие эндокринных, соматических и гинекологических заболеваний; отсутствие беременности и лактации; отсутствие предшествующей психофармакотерапии; информированное согласие пациента на участие в исследовании.
Для группы сравнения дополнительными критериями включения являлись: длительность заболевания не менее 10 лет; период отмывки (wash out) в течение 7–10 дней перед назначением оланзапина в тех случаях, когда больные, длительно страдающие шизофренией, до начала исследования получали антипсихотическую терапию; в этот период при необходимости назначались транквилизаторы. В качестве контрольной группы обследованы 34 психически и соматически здоровых лица (14 женщин, 20 мужчин), средний возраст 34,6±6,8 года.
В исследовании применялись: клинико-психопатологический, биохимический и статистический методы исследования.
Исследование пациентов проводилось динамически на определенных этапах терапевтического процесса: фон
(I этап) – до назначения психофармакотерапии (пациенты с ППЭ) или сразу после периода отмены до назначения антипсихотического препарата (хронические пациенты), II этап – 3–4-я неделя терапии и III этап – 6–8-я неделя терапии.
На всех этапах работы была произведена оценка психического состояния по валидизированной русскоязычной версии шкалы позитивных и негативных синдромов PANSS (Positive and Negative Syndrome Scale) [3]. Редукция общего балла по шкале PANSS более чем на 25% к 6-й неделе терапии оланзапином давала возможность регистрировать положительный результат и расценивать данных пациентов как респондеров. Все остальные пациенты являлись нонреспондерами. Сравнительный анализ изучаемых параметров проводился как между группами, так и внутри групп с учетом гендерного фактора и эффективности терапии.
Определение содержания гормонов кортизола и ДГЭА-С проводилось натощак в утренние часы в сыворотке крови иммуноферментным методом на фотометре вертикального сканирования Multiscan Agent («Labsystems», Финляндия) с использованием реактивов фирмы «АлкорБио».
Референтные значения гормонов: кортизол 150–660 нмоль/л; ДГЭА-C: мужчины – 1,0–4,2, женщины – 0,8–3,9 мгк/мл. Статистическая обработка результатов осуществлялась с использованием компьютерной статистической программы Statistica (версия 7.0) с вычислением средних значений (М) и ошибки средней (±SE). Для сравнения показателей применялись непараметрические методы статистической оценки: для сравнения двух зависимых переменных – критерий Вилкоксона, анализ межгрупповых различий проводился с помощью теста Манна–Уитни. Для исследования взаимосвязи между переменными использовался ранговый коэффициент корреляции Спирмена (r). Различия считались достоверными при р<0,05.
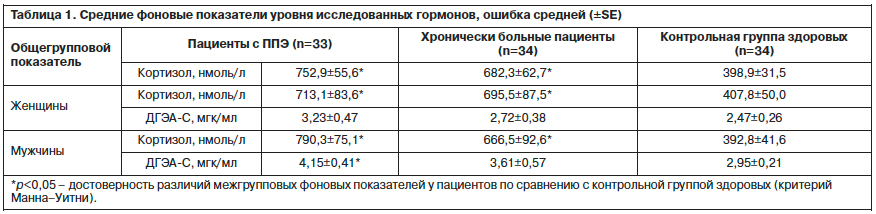
Как следует из табл. 1, фоновые значения уровней кортизола и ДГЭА-С у мужчин и кортизола у женщин в 2 исследуемых группах были достоверно выше по сравнению с контрольной группой. Следует отметить, что средние общегрупповые показатели кортизола у женщин обеих групп и у мужчин с ППЭ были выше нормативных значений.
Данные исследования динамики уровня кортизола у пациентов обеих групп в процессе терапии оланзапином в зависимости от эффективности терапии приведены на рисунке.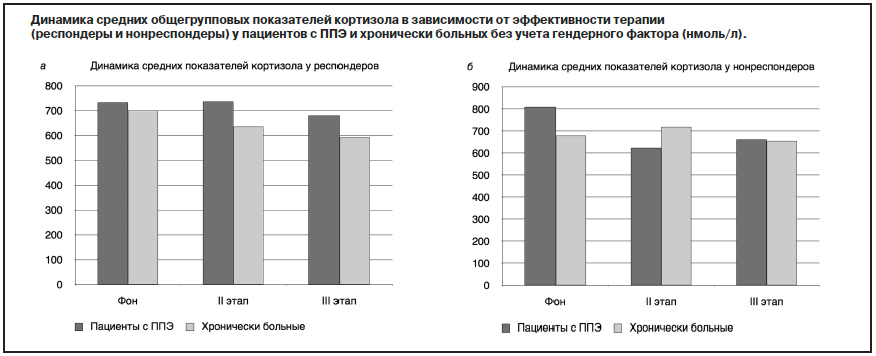
Как видно из рисунка, средние уровни кортизола у пациентов с ППЭ при положительной терапевтической динамике превышали нормативные показатели на всех этапах исследования (фон – 732,8±64,0 нмоль/л; II этап – 735,6±61,9 нмоль/л; III этап – 680,4±62,7 нмоль/л). На II этапе исследования уровни кортизола практически не изменялись, а на III этапе происходило их снижение. Средние уровни кортизола у пациентов с ППЭ без терапевтического эффекта превышали нормативные показатели только до терапии (806,5±115,8 нмоль/л). На II и III этапах исследования показатели находились в пределах нормы (II этап – 622,6±63,7 нмоль/л; III этап – 660,7±67,2 нмоль/л). В дальнейшем отмечались разнонаправленные изменения уровня гормона: на II этапе исследования отмечено снижение, а на III этапе – повышение. Изменение показателей не было статистически значимым.
Средние уровни кортизола у хронически больных пациентов с положительным терапевтически эффектом превышали нормативные показатели только до начала терапии (695,7±122,1 нмоль/л). На II и III этапах исследования показатели находились в нормативных пределах (II этап – 635,1±82,1 нмоль/л; III этап – 588,9±71,0 нмоль/л). На всех этапах терапии отмечалось снижение уровней кортизола по сравнению с фоном. Средние уровни кортизола у больных хронической шизофренией без терапевтического эффекта превышали нормативные показатели до начала и на 3–4-й неделе лечения (674,7±72,0 нмоль/л и 718,6±50,4 нмоль/л соответственно). На III этапе терапии показатели находились в пределах нормы (653,3±36,5 нмоль/л). На II этапе терапии отмечалось повышение уровней кортизола по сравнению с фоном, а на III этапе – снижение. Изменения средних показателей кортизола у хронически больных, так же как и у больных с ППЭ, не были статистически достоверными.
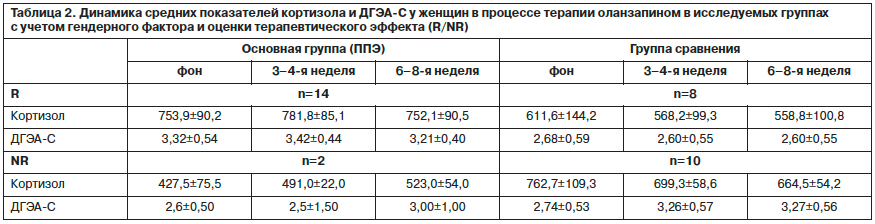
Как видно из данных табл. 2, у респондеров и нонреспондеров женского пола основной группы отмечалась сходная динамика уровней кортизола – повышение показателей на II этапе и снижение к 6–8-й неделе терапии. Вместе с тем у респондеров этой группы средние показатели уровней кортизола превышали нормативные значения на всех этапах исследования, тогда как у нонреспондеров все изменения происходили в референтных пределах. Динамика уровней ДГЭА-С у пациенток-респондеров основной группы была сопоставима с динамикой уровней кортизола – повышение значений на II этапе и снижение к концу терапии. У нонреспондеров превышение уровней ДГЭА-С отмечено только к концу терапии на фоне снижения уровней кортизола. В связи с малочисленностью группы нонреспондеров анализ достоверности различий между респондерами и нонреспондерами провести не удалось. В то же время следует обратить внимание на более гармоничную в физиологическом плане сочетанную динамику обоих гормонов у пациенток-респондеров.
У женщин в группе сравнения, так же как и в основной группе, динамика уровней кортизола не зависела от эффекта терапии. Вместе с тем выявлялись межгрупповые (по сравнению с основной группой) различия: и у респондеров, и у нонреспондеров происходило снижение показателей гормона от этапа к этапу, а превышение нормативных показателей наблюдалось только у нонреспондеров на всех этапах исследования. У женщин-респондеров группы сравнения динамика уровней ДГЭА-С соотносилась с динамикой уровней кортизола только между фоном и II этапом (снижение значений), тогда как у нонреспондеров она была противоположной – на фоне снижения уровней кортизола отмечалось повышение уровней ДГЭА-С. Показатели ДГЭА-С у женщин обеих изучаемых групп находились в нормативных пределах.
Достоверных отличий в средних показателях уровней кортизола между R и NR, а также внутригрупповых показателях по сравнению с фоном (критерий Вилкоксона) у хронически больных пациенток выявлено не было. Изменения как межгрупповые, так и внутригрупповые можно оценить на уровне тенденций, так как из-за малочисленности групп выявить достоверность изменений с применением непараметрических статистических методов не удалось.
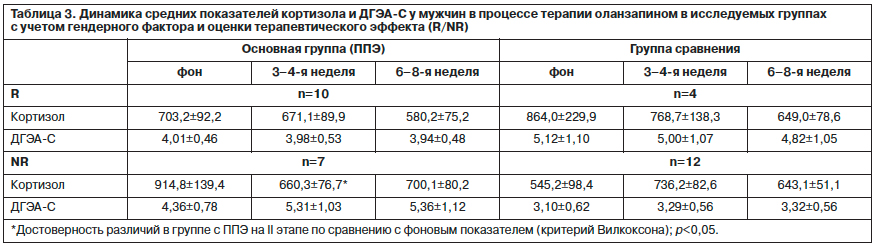
Данные о динамике исследуемых показателей у пациентов мужского пола приведены в табл. 3.
Как видно из табл. 3, динамика уровней кортизола у мужчин-респондеров основной группы отличалась от таковой у женщин – средние показатели гормона снижались от этапа к этапу. У нонреспондеров мужчин с ППЭ динамика уровней кортизола также была иной: на II этапе терапии уровень кортизола достоверно снижался по сравнению с фоном (p<0,03) до нормативных пределов, а на III этапе отмечалось его повышение. Показательно, что в отличие от женщин основной группы у мужчин NR отмечается самый высокий фоновый уровень кортизола.
Выявленная достоверная положительная корреляционная связь между уровнями кортизола на II и III этапах терапии (r=0,78 при p<0,036) у пациентов-нонреспондеров может свидетельствовать о том, что снижение уровней гормона на II этапе приводит к его повышению по окончании терапии, что в свою очередь косвенным образом подтверждает неустойчивость состояния ГГА-оси у больных с ППЭ при отсутствии положительной терапевтической динамики.
Как и у пациенток, динамика уровней ДГЭА-С у мужчин-респондеров была сопоставима с динамикой показателей кортизола (снижение от этапа к этапу в нормативных пределах). Интерес представляет динамика уровней ДГЭА-С у нонреспондеров мужского пола: при снижении уровней кортизола отмечается повышение ДГЭА-С, причем на II и III этапах оба показателя превышают нормативные. Найденная достоверная отрицательная корреляционная взаимосвязь между фоновыми значениями кортизола и ДГЭА-С (r=-0,75; p<0,05) может свидетельствовать о том, что у больных нонреспондеров отмечается патологическое функционирование ГГА-оси, что в свою очередь может служить гормональным биомаркером отсутствия положительной терапевтической динамики.
В группе сравнения у мужчин-респондеров, как и у женщин, происходило снижение уровней кортизола и ДГЭА-С от этапа к этапу, но в отличие от пациенток уровни гормонов превышали нормативные пределы (исключение составил нормативный показатель уровня кортизола к 6–8-й неделе терапии). Динамика уровней кортизола у нонреспондеров-мужчин (волнообразный характер): повышение (выше нормативных значений) отмечено в середине исследования и снижение – к окончанию терапии. Уровень ДГЭА-С незначительно повышался к концу терапии, но показатели находились в референсном диапазоне.
Таким образом, полученные данные позволяют сделать следующие выводы.
Многие исследователи подтверждают мнение о том, что зачастую динамические исследования ГГА-оси у больных шизофренией, и в частности с ППЭ, дают противоречивые результаты, которые могут быть связаны с диагностическими ошибками при формировании исследуемых групп, наличием психофармакотерапии в анамнезе, а также с различиями в дизайне исследования при проведении антипсихотической терапии разными антипсихотиками [4, 8–10, 13, 17, 18, 24, 26].
В ряде исследований показано, что у пациентов с ППЭ и хронической шизофренией базовый уровень кортизола достоверно превышает нормативные пределы. Более противоречивые данные получены в отношение уровней ДГЭА и ДГЭА-С. Так, в работе M.Bicikova и соавт. (2011 г.) при исследовании 22 пациентов (13 мужчин, 9 женщин) с диагнозом шизофрении в соответствии с критериями МКБ-10 до и после 6-месячного лечения оланзапином в сравнении с антипсихотиком другой группы была выявлена гиперкортизолемия у женщин и низкие показатели ДГЭА-С и ДГЭА у мужчин как до, так и после окончания антипсихотической терапии в сравнении с группой контроля (здоровые участники эксперимента) независимо от применяемого препарата.
Авторы пришли к заключению, что более низкие уровни ДГЭА, присутствующие в большем количестве в мозге, определяемые у больных шизофренией, находятся в согласии с мнением об их нейропротективной роли, а гиперкортизолемия может свидетельствовать о стресс-реакции организма при обострении психоза. В другом исследовании [14] образцов слюны для измерения кортизола в разные моменты времени в течение дня (при пробуждении, через 15, 30, 60 мин после пробуждения, в полдень, в 8 ч вечера) у 65 пациентов с ППЭ при терапии антипсихотиками (нонреспондеры – 36 человек, респондеры – 29) у нонреспондеров отмечался существенно низкий уровень кортизола во время пробуждения по сравнению с респондерами (p=0,02).
В то же время не отмечено существенных различий в суточных уровнях кортизола между R и NR (p=1,0). G.Venkatasubramanian и соавт. (2010 г.) при исследовании уровней кортизола у больных шизофренией (33 пациента, из них 13 мужчин) до назначения и после 3 мес лечения антипсихотиками в сравнении со здоровыми участниками эксперимента (33 человека) обнаружили более высокие фоновые уровни кортизола (Т=3,9; р=0,0002) по сравнению с группой контроля и достоверное снижение показателей гормона после проведения антипсихотической терапии (T=2,5; р=0,02) у пациентов.
В 22-недельном рандомизированном двойном слепом исследовании 12 пациентов при терапии оланзапином (5–20 мг/сут) и 10 пациентов – флуфеназином (6–21 мг в день) было проведено определение уровней кортизола, которое показало, что при терапии оланзапином происходит умеренное снижение показателей гормона, в то время как лечение флуфеназином значительно повышает уровень кортизола в плазме [11]. Данные работы M.Ryan
и соавт. (2004 г.) по исследованию уровней кортизола у 19 пациентов с шизофренией при проведении терапии оланзапином или рисперидоном в сравнении с контролем подтверждают результаты предыдущего исследования о том, что терапия атипичными антипсихотиками оказывает более «гармоничное» влияние на ГГА-ось. Так, пациенты с шизофренией имели значительно более высокие фоновые уровни плазмы кортизола (360,2±49,6 нмоль/л против 192,7±19,7 нмоль/л соответственно; Т=3,13, DF=18, р<0,003), чем соответствующим образом подобранный контроль, а затем отмечалось достоверное снижение уровня гормона после 6 мес лечения (360,2±49,6 нмоль/л против 316,2±48,4 нмоль/л; р<0,05) при терапии как оланзапином, так и рисперидоном.
Интересные данные получены в исследовании влияния терапии оланзапином на плазменные уровни гормонов, регулирующих потребление пищи и энергетический гомеостаз у больных шизофренией. Оланзапин вводили
28 пациентам (японцы) в течение 16 нед после переключения с типичных антипсихотических препаратов или рисперидона. В конечной точке не найдено никаких существенных изменений в массе тела или в индексе массы тела. При этом выявлено увеличение уровней лептина и значимое снижение уровня кортизола в плазме. Кроме того, уровни сахара в крови натощак, а также свободных жирных кислот были значительно снижены. Авторы приходят к заключению, что для уточнения роли кортизола в метаболических процессах у больных шизофренией требуются дополнительные исследования [25].
S.Cohrs и соавт. (2006 г.) исследовали влияние атипичных антипсихотиков кветиапина и оланзапина по сравнению с галоперидолом и плацебо на плазменные уровни (АКТГ) кортизола и пролактина у 11 здоровых мужчин-добровольцев. Образцы сыворотки крови были изучены во время 4 сессий в течение 1 нед у получавших плацебо, кветиапин (50 мг), оланзапин (5 мг) или галоперидол
(3 мг). По сравнению с плацебо кветиапин и оланзапин значительно снижали АКТГ (р<0,002 и р<0,05 соответственно) и кортизол (р<0,005 и р<0,03 соответственно). Не наблюдалось эффекта галоперидола на уровни АКТГ или кортизола.
По мнению авторов, значительное влияние атипичных антипсихотиков на функциональную деятельность ГГА-оси возможно связано с атипичной блокадой серотонинергических рецепторов. Блокада адренергических или гистаминергических рецепторов может также играть определенную роль в этих процессах. Свои выводы авторы базируют на данных, приводимых в более ранних исследованиях. Так, R.Owen Jr, и соавт. (1993 г.) исследовали функцию серотонина у пациентов с шизофренией во время приема типичных и атипичных нейролептиков в соответствии с рабочей гипотезой о том, что клинически значимые дозы атипичного нейролептика клозапина ослабили бы ответ на введение агониста м-chlorophenylpiperazine (м-CPP) серотонина. М-CPP или плацебо вводили внутривенно в течение 90 с пациентам, которые не получали клозапин по крайней мере 3 нед. М-CPP также вводили во время лечения типичным нейролептиком флуфеназином и клозапином. Группа состояла из 15 пациентов
(2 женщины, 13 мужчин), которые соответствовали критериям DSM-III-R для хронической шизофрении (n=13) или шизоаффективного расстройства (n=2), средний возраст составил 33,8±8,0 года. Инъекции м-CPP значительно увеличивали уровни кортизола и пролактина у пациентов без терапии. Лечение клозапином существенно блокировало нейроэндокринные ответы на м-CPP, в то время как флуфеназин не оказывал подобного эффекта.
Результаты исследования показывают, что лечение клозапином обладает мощными серотониновыми антагонистическими эффектами у пациентов с шизофренией. Эти данные отчасти подтверждены в экспериментальной работе A.Nechmad и соавт. (2003 г.), в которой исследовалось влияние клозапина в сравнении с галоперидолом на уровни ДГЭА и ДГЭА-С, эфира дегидроэпиандростерона (аналог
g-аминомасляной кислоты) на (GABA-A) в коре головного мозга крыс. Обнаружено, что инъекции клозапина (5 и 15 мг/кг), но не галоперидола (1 мг/кг) в течение 8 дней уменьшали мозговые корковые уровни ДГЭА и ДГЭА-С. Эти данные подтверждают роль нейростероидов и возможно модуляции ГАМК-А-рецепторов в механизме действия клозапина.
Полученные в нашем исследовании данные отчасти сопоставимы с данными литературы. Это касается высоких фоновых уровней кортизола у больных с ППЭ и хронической шизофренией. Вместе с тем получен ряд новых данных, характеризующий особенности сочетанной динамики показателей кортизола и ДГЭА-С в зависимости от гендерного фактора, эффективности терапии оланзапином и длительности заболевания у указанной категории пациентов.
Сведения об авторах
Горобец Людмила Николаевна – д-р мед. наук, проф., зав. отд. психиатрической эндокринологии ФГБУ МНИИП Минздрава России. E-mail: gorobetsln@mail.ru
Лорикян Ани Гагиковна – мл. науч. сотр. отд. психиатрической эндокринологии ФГБУ МНИИП Минздрава России.
E-mail: anilori@yandex.ru
Кутузова Нина Михайловна – д-р биол. наук, проф., зав. каф. биоорганической химии и биотехнологии ФГБОУ ВПО МПГУ. E-mail: biochem_mpgu@mail.ru
Ключевые слова: первый психотический эпизод, кортизол, дегидроэпиандростерон-сульфат, оланзапин.
Comparative dynamics of serum cortisol and dehydroepiandrosterone sulphate levels
in patients with first-episode psychosis and chronic schizophrenia in the process of olanzapine therapy based on an assessment of the therapeutic effect (R/NR)
L.N.Gorobets1, A.G.Lorikyan1, N.M.Kutuzova2
1Moscow Research Institute of Psychiatry Russian Ministry of Health;
2Moscow State Pedagogical University
Summary. Serum cortisol and dehydroepiandrosterone sulphate levels have been assessed in 33 patients (17 men, 16 women) with first psychotic episode (FPE) during olazapine treatment. The comparison group included 34 patients (16 men, 18 women) with 12,5 years of average duration course of illness. The control group included 34 patients (20 men, 14 women) with average age 34,6±6,8 years. Assessment of levels of these hormones was dynamically (background, 3–4 weeks and 6–8 weeks of therapy) depending on gender. There were found the features of the dynamics of hormonal parameters: background values cortisol levels and DHEA-S in men and cortisol in women in the two treatment groups was significantly higher than those of control and reference values; physiologically more harmonious (unidirectional change of cortisol and DHEA-S) dynamics observed in patients – responders with FEP regardless of gender; hormonal biomarker lack therapeutic effect in patients with FEP is different dynamic changes in these hormones and the presence of a background of negative correlation between cortisol and DHEA-S in men.
Key words: first-episode psychosis, cortisol, dehydroepiandrosterone sulphate.
Введение
На сегодняшний день первый психотический эпизод (ППЭ) представляет критическую стадию болезни, в течение которой эффективность терапевтических мероприятий может повлиять на долгосрочный результат [2]. Актуальность изучения начального этапа шизофрении сводится к возможности изучения нейробиологической природы заболевания, и пациенты с ППЭ в этом отношении представляют уникальную модель для исследования, так как они интактны в отношении терапии. Биологический компонент терапии представляет собой в основном медикаментозную коррекцию психотических расстройств. Основной группой психофармакологических средств, применяемых для лечения шизофрении, являются антипсихотики, которые помимо основного антипсихотического действия обладают широким спектром побочных эффектов, включая эндокринные [1, 2]. В ряде исследований, проведенных на указанном контингенте больных, отмечен ряд особенностей терапевтического значения антипсихотиков II поколения, обосновывающих их использование в качестве препаратов 1-й линии у больных с ППЭ [2, 12, 23]. Так, в работе И.Я.Гуровича и соавт. (2004 г.) продемонстрированы преимущества оланзапина в сравнении с классическими нейролептиками, в первую очередь его более гармоничное действие на сложные психопатологические образования.В контексте обсуждаемых вопросов несомненный интерес представляет эндокринологический подход (исследование гормональных показателей) к изучению проблемы терапии больных с ППЭ, что будет способствовать определению гормональных предикторов (биологических маркеров) эффективности терапии и даст возможность минимизировать развитие нейроэндокринных побочных эффектов у больных с ППЭ при проведении антипсихотической терапии. К настоящему времени в научной литературе имеется крайне мало исследований, освещающих эту проблему. Большинство из них связано с изучением таких гормональных показателей у больных шизофренией при антипсихотической терапии, как уровни пролактина, эстрадиола, тестостерона, прегненолона и др. [1, 6, 11, 16, 22]. В отечественной литературе данные об изучении гормонов гипоталамо-гипофизарно-адреналовой оси (ГГА-оси) у указанного контингента больных отсутствуют.
В этой связи представляется актуальным проведение сравнительных исследований по изучению особенностей гормонального дисбаланса ГГА-оси у больных шизофренией с учетом длительности заболевания, гендерного и фармакогенного факторов.
Цель исследования – сравнительное изучение динамики уровней кортизола и дегидроэпиандростерон-сульфата (ДГЭА-С) у больных с ППЭ и хронической шизофренией в процессе терапии оланзапином.
Материал и методы исследования
Объектом изучения (основная группа) стали 33 пациента с ППЭ (16 женщин, 17 мужчин) в возрасте от 18 до 50 лет (средний возраст 28,6±1,5 года) и длительностью заболевания в среднем 1,5 года, которым проводилась монотерапия оланзапином в дозе 5–20 мг/сут (средняя суточная доза составила 14,6±6,6 мг). В качестве группы сравнения обследованы 34 хронически больных (18 женщин, 16 мужчин), средний возраст которых составил 35,4±6,8 года. Больные получали терапию оланзапином в дозе от 10 до 20 мг/сут, инъекционно или в таблетированной форме (средняя суточная доза – 16,3±3,5 мг). У всех больных диагностирована параноидная шизофрения (F-20.0) в соответствии с критериями Международной классификации болезней 10-го пересмотра (МКБ-10). Сравниваемые выборки были сопоставимы по основным клинико-демографическим характеристикам.Критерии включения: возраст от 18 до 55 лет; психотический эпизод – баллы по шкале PANSS>60; верифицированный диагноз шизофрении в соответствии с МКБ-10; отсутствие органической патологии центральной нервной системы; отсутствие эндокринных, соматических и гинекологических заболеваний; отсутствие беременности и лактации; отсутствие предшествующей психофармакотерапии; информированное согласие пациента на участие в исследовании.
Для группы сравнения дополнительными критериями включения являлись: длительность заболевания не менее 10 лет; период отмывки (wash out) в течение 7–10 дней перед назначением оланзапина в тех случаях, когда больные, длительно страдающие шизофренией, до начала исследования получали антипсихотическую терапию; в этот период при необходимости назначались транквилизаторы. В качестве контрольной группы обследованы 34 психически и соматически здоровых лица (14 женщин, 20 мужчин), средний возраст 34,6±6,8 года.
В исследовании применялись: клинико-психопатологический, биохимический и статистический методы исследования.
Исследование пациентов проводилось динамически на определенных этапах терапевтического процесса: фон
(I этап) – до назначения психофармакотерапии (пациенты с ППЭ) или сразу после периода отмены до назначения антипсихотического препарата (хронические пациенты), II этап – 3–4-я неделя терапии и III этап – 6–8-я неделя терапии.
На всех этапах работы была произведена оценка психического состояния по валидизированной русскоязычной версии шкалы позитивных и негативных синдромов PANSS (Positive and Negative Syndrome Scale) [3]. Редукция общего балла по шкале PANSS более чем на 25% к 6-й неделе терапии оланзапином давала возможность регистрировать положительный результат и расценивать данных пациентов как респондеров. Все остальные пациенты являлись нонреспондерами. Сравнительный анализ изучаемых параметров проводился как между группами, так и внутри групп с учетом гендерного фактора и эффективности терапии.
Определение содержания гормонов кортизола и ДГЭА-С проводилось натощак в утренние часы в сыворотке крови иммуноферментным методом на фотометре вертикального сканирования Multiscan Agent («Labsystems», Финляндия) с использованием реактивов фирмы «АлкорБио».
Референтные значения гормонов: кортизол 150–660 нмоль/л; ДГЭА-C: мужчины – 1,0–4,2, женщины – 0,8–3,9 мгк/мл. Статистическая обработка результатов осуществлялась с использованием компьютерной статистической программы Statistica (версия 7.0) с вычислением средних значений (М) и ошибки средней (±SE). Для сравнения показателей применялись непараметрические методы статистической оценки: для сравнения двух зависимых переменных – критерий Вилкоксона, анализ межгрупповых различий проводился с помощью теста Манна–Уитни. Для исследования взаимосвязи между переменными использовался ранговый коэффициент корреляции Спирмена (r). Различия считались достоверными при р<0,05.
Результаты
Фоновые показатели уровней кортизола и ДГЭА-С у больных основной группы и группы сравнения с учетом гендерного фактора в сопоставлении с контролем приведены в табл. 1.
Как следует из табл. 1, фоновые значения уровней кортизола и ДГЭА-С у мужчин и кортизола у женщин в 2 исследуемых группах были достоверно выше по сравнению с контрольной группой. Следует отметить, что средние общегрупповые показатели кортизола у женщин обеих групп и у мужчин с ППЭ были выше нормативных значений.
Данные исследования динамики уровня кортизола у пациентов обеих групп в процессе терапии оланзапином в зависимости от эффективности терапии приведены на рисунке.

Как видно из рисунка, средние уровни кортизола у пациентов с ППЭ при положительной терапевтической динамике превышали нормативные показатели на всех этапах исследования (фон – 732,8±64,0 нмоль/л; II этап – 735,6±61,9 нмоль/л; III этап – 680,4±62,7 нмоль/л). На II этапе исследования уровни кортизола практически не изменялись, а на III этапе происходило их снижение. Средние уровни кортизола у пациентов с ППЭ без терапевтического эффекта превышали нормативные показатели только до терапии (806,5±115,8 нмоль/л). На II и III этапах исследования показатели находились в пределах нормы (II этап – 622,6±63,7 нмоль/л; III этап – 660,7±67,2 нмоль/л). В дальнейшем отмечались разнонаправленные изменения уровня гормона: на II этапе исследования отмечено снижение, а на III этапе – повышение. Изменение показателей не было статистически значимым.
Средние уровни кортизола у хронически больных пациентов с положительным терапевтически эффектом превышали нормативные показатели только до начала терапии (695,7±122,1 нмоль/л). На II и III этапах исследования показатели находились в нормативных пределах (II этап – 635,1±82,1 нмоль/л; III этап – 588,9±71,0 нмоль/л). На всех этапах терапии отмечалось снижение уровней кортизола по сравнению с фоном. Средние уровни кортизола у больных хронической шизофренией без терапевтического эффекта превышали нормативные показатели до начала и на 3–4-й неделе лечения (674,7±72,0 нмоль/л и 718,6±50,4 нмоль/л соответственно). На III этапе терапии показатели находились в пределах нормы (653,3±36,5 нмоль/л). На II этапе терапии отмечалось повышение уровней кортизола по сравнению с фоном, а на III этапе – снижение. Изменения средних показателей кортизола у хронически больных, так же как и у больных с ППЭ, не были статистически достоверными.


Как видно из данных табл. 2, у респондеров и нонреспондеров женского пола основной группы отмечалась сходная динамика уровней кортизола – повышение показателей на II этапе и снижение к 6–8-й неделе терапии. Вместе с тем у респондеров этой группы средние показатели уровней кортизола превышали нормативные значения на всех этапах исследования, тогда как у нонреспондеров все изменения происходили в референтных пределах. Динамика уровней ДГЭА-С у пациенток-респондеров основной группы была сопоставима с динамикой уровней кортизола – повышение значений на II этапе и снижение к концу терапии. У нонреспондеров превышение уровней ДГЭА-С отмечено только к концу терапии на фоне снижения уровней кортизола. В связи с малочисленностью группы нонреспондеров анализ достоверности различий между респондерами и нонреспондерами провести не удалось. В то же время следует обратить внимание на более гармоничную в физиологическом плане сочетанную динамику обоих гормонов у пациенток-респондеров.
У женщин в группе сравнения, так же как и в основной группе, динамика уровней кортизола не зависела от эффекта терапии. Вместе с тем выявлялись межгрупповые (по сравнению с основной группой) различия: и у респондеров, и у нонреспондеров происходило снижение показателей гормона от этапа к этапу, а превышение нормативных показателей наблюдалось только у нонреспондеров на всех этапах исследования. У женщин-респондеров группы сравнения динамика уровней ДГЭА-С соотносилась с динамикой уровней кортизола только между фоном и II этапом (снижение значений), тогда как у нонреспондеров она была противоположной – на фоне снижения уровней кортизола отмечалось повышение уровней ДГЭА-С. Показатели ДГЭА-С у женщин обеих изучаемых групп находились в нормативных пределах.
Достоверных отличий в средних показателях уровней кортизола между R и NR, а также внутригрупповых показателях по сравнению с фоном (критерий Вилкоксона) у хронически больных пациенток выявлено не было. Изменения как межгрупповые, так и внутригрупповые можно оценить на уровне тенденций, так как из-за малочисленности групп выявить достоверность изменений с применением непараметрических статистических методов не удалось.
Данные о динамике исследуемых показателей у пациентов мужского пола приведены в табл. 3.
Как видно из табл. 3, динамика уровней кортизола у мужчин-респондеров основной группы отличалась от таковой у женщин – средние показатели гормона снижались от этапа к этапу. У нонреспондеров мужчин с ППЭ динамика уровней кортизола также была иной: на II этапе терапии уровень кортизола достоверно снижался по сравнению с фоном (p<0,03) до нормативных пределов, а на III этапе отмечалось его повышение. Показательно, что в отличие от женщин основной группы у мужчин NR отмечается самый высокий фоновый уровень кортизола.
Выявленная достоверная положительная корреляционная связь между уровнями кортизола на II и III этапах терапии (r=0,78 при p<0,036) у пациентов-нонреспондеров может свидетельствовать о том, что снижение уровней гормона на II этапе приводит к его повышению по окончании терапии, что в свою очередь косвенным образом подтверждает неустойчивость состояния ГГА-оси у больных с ППЭ при отсутствии положительной терапевтической динамики.
Как и у пациенток, динамика уровней ДГЭА-С у мужчин-респондеров была сопоставима с динамикой показателей кортизола (снижение от этапа к этапу в нормативных пределах). Интерес представляет динамика уровней ДГЭА-С у нонреспондеров мужского пола: при снижении уровней кортизола отмечается повышение ДГЭА-С, причем на II и III этапах оба показателя превышают нормативные. Найденная достоверная отрицательная корреляционная взаимосвязь между фоновыми значениями кортизола и ДГЭА-С (r=-0,75; p<0,05) может свидетельствовать о том, что у больных нонреспондеров отмечается патологическое функционирование ГГА-оси, что в свою очередь может служить гормональным биомаркером отсутствия положительной терапевтической динамики.
В группе сравнения у мужчин-респондеров, как и у женщин, происходило снижение уровней кортизола и ДГЭА-С от этапа к этапу, но в отличие от пациенток уровни гормонов превышали нормативные пределы (исключение составил нормативный показатель уровня кортизола к 6–8-й неделе терапии). Динамика уровней кортизола у нонреспондеров-мужчин (волнообразный характер): повышение (выше нормативных значений) отмечено в середине исследования и снижение – к окончанию терапии. Уровень ДГЭА-С незначительно повышался к концу терапии, но показатели находились в референсном диапазоне.
Таким образом, полученные данные позволяют сделать следующие выводы.
- Общегрупповые фоновые уровни кортизола достоверно превышают показатели контроля и референтные значения независимо от длительности терапии и гендерного фактора.
- Более физиологически гармоничная (однонаправленность изменений кортизола и ДГЭА-С) динамика отмечена у больных-респондеров с ППЭ независимо от гендерного фактора.
- Гормональным биомаркером отсутствия терапевтического эффекта у больных с ППЭ является разнонаправленность динамических изменений кортизола и ДГЭА-С и наличие фоновой отрицательной корреляционной связи между кортизолом и ДГЭА-С у мужчин.
Обсуждение
Адренокортикотропный гормон (АКТГ), кортизол, ДГЭА и ДГЭА-С играют важную роль в функционировании и развитии мозга. Несмотря на прогресс исследований, касающихся биологии гормонов ГГА-оси, остается много неясных вопросов о механизмах их действия, нейробиологических свойствах, потенциальной вовлеченности в развитие нервно-психических болезней и изменений их уровней в процессе психофармакотерапии. Область этих исследований в последние годы быстро расширяется.Многие исследователи подтверждают мнение о том, что зачастую динамические исследования ГГА-оси у больных шизофренией, и в частности с ППЭ, дают противоречивые результаты, которые могут быть связаны с диагностическими ошибками при формировании исследуемых групп, наличием психофармакотерапии в анамнезе, а также с различиями в дизайне исследования при проведении антипсихотической терапии разными антипсихотиками [4, 8–10, 13, 17, 18, 24, 26].
В ряде исследований показано, что у пациентов с ППЭ и хронической шизофренией базовый уровень кортизола достоверно превышает нормативные пределы. Более противоречивые данные получены в отношение уровней ДГЭА и ДГЭА-С. Так, в работе M.Bicikova и соавт. (2011 г.) при исследовании 22 пациентов (13 мужчин, 9 женщин) с диагнозом шизофрении в соответствии с критериями МКБ-10 до и после 6-месячного лечения оланзапином в сравнении с антипсихотиком другой группы была выявлена гиперкортизолемия у женщин и низкие показатели ДГЭА-С и ДГЭА у мужчин как до, так и после окончания антипсихотической терапии в сравнении с группой контроля (здоровые участники эксперимента) независимо от применяемого препарата.
Авторы пришли к заключению, что более низкие уровни ДГЭА, присутствующие в большем количестве в мозге, определяемые у больных шизофренией, находятся в согласии с мнением об их нейропротективной роли, а гиперкортизолемия может свидетельствовать о стресс-реакции организма при обострении психоза. В другом исследовании [14] образцов слюны для измерения кортизола в разные моменты времени в течение дня (при пробуждении, через 15, 30, 60 мин после пробуждения, в полдень, в 8 ч вечера) у 65 пациентов с ППЭ при терапии антипсихотиками (нонреспондеры – 36 человек, респондеры – 29) у нонреспондеров отмечался существенно низкий уровень кортизола во время пробуждения по сравнению с респондерами (p=0,02).
В то же время не отмечено существенных различий в суточных уровнях кортизола между R и NR (p=1,0). G.Venkatasubramanian и соавт. (2010 г.) при исследовании уровней кортизола у больных шизофренией (33 пациента, из них 13 мужчин) до назначения и после 3 мес лечения антипсихотиками в сравнении со здоровыми участниками эксперимента (33 человека) обнаружили более высокие фоновые уровни кортизола (Т=3,9; р=0,0002) по сравнению с группой контроля и достоверное снижение показателей гормона после проведения антипсихотической терапии (T=2,5; р=0,02) у пациентов.
В 22-недельном рандомизированном двойном слепом исследовании 12 пациентов при терапии оланзапином (5–20 мг/сут) и 10 пациентов – флуфеназином (6–21 мг в день) было проведено определение уровней кортизола, которое показало, что при терапии оланзапином происходит умеренное снижение показателей гормона, в то время как лечение флуфеназином значительно повышает уровень кортизола в плазме [11]. Данные работы M.Ryan
и соавт. (2004 г.) по исследованию уровней кортизола у 19 пациентов с шизофренией при проведении терапии оланзапином или рисперидоном в сравнении с контролем подтверждают результаты предыдущего исследования о том, что терапия атипичными антипсихотиками оказывает более «гармоничное» влияние на ГГА-ось. Так, пациенты с шизофренией имели значительно более высокие фоновые уровни плазмы кортизола (360,2±49,6 нмоль/л против 192,7±19,7 нмоль/л соответственно; Т=3,13, DF=18, р<0,003), чем соответствующим образом подобранный контроль, а затем отмечалось достоверное снижение уровня гормона после 6 мес лечения (360,2±49,6 нмоль/л против 316,2±48,4 нмоль/л; р<0,05) при терапии как оланзапином, так и рисперидоном.
Интересные данные получены в исследовании влияния терапии оланзапином на плазменные уровни гормонов, регулирующих потребление пищи и энергетический гомеостаз у больных шизофренией. Оланзапин вводили
28 пациентам (японцы) в течение 16 нед после переключения с типичных антипсихотических препаратов или рисперидона. В конечной точке не найдено никаких существенных изменений в массе тела или в индексе массы тела. При этом выявлено увеличение уровней лептина и значимое снижение уровня кортизола в плазме. Кроме того, уровни сахара в крови натощак, а также свободных жирных кислот были значительно снижены. Авторы приходят к заключению, что для уточнения роли кортизола в метаболических процессах у больных шизофренией требуются дополнительные исследования [25].
S.Cohrs и соавт. (2006 г.) исследовали влияние атипичных антипсихотиков кветиапина и оланзапина по сравнению с галоперидолом и плацебо на плазменные уровни (АКТГ) кортизола и пролактина у 11 здоровых мужчин-добровольцев. Образцы сыворотки крови были изучены во время 4 сессий в течение 1 нед у получавших плацебо, кветиапин (50 мг), оланзапин (5 мг) или галоперидол
(3 мг). По сравнению с плацебо кветиапин и оланзапин значительно снижали АКТГ (р<0,002 и р<0,05 соответственно) и кортизол (р<0,005 и р<0,03 соответственно). Не наблюдалось эффекта галоперидола на уровни АКТГ или кортизола.
По мнению авторов, значительное влияние атипичных антипсихотиков на функциональную деятельность ГГА-оси возможно связано с атипичной блокадой серотонинергических рецепторов. Блокада адренергических или гистаминергических рецепторов может также играть определенную роль в этих процессах. Свои выводы авторы базируют на данных, приводимых в более ранних исследованиях. Так, R.Owen Jr, и соавт. (1993 г.) исследовали функцию серотонина у пациентов с шизофренией во время приема типичных и атипичных нейролептиков в соответствии с рабочей гипотезой о том, что клинически значимые дозы атипичного нейролептика клозапина ослабили бы ответ на введение агониста м-chlorophenylpiperazine (м-CPP) серотонина. М-CPP или плацебо вводили внутривенно в течение 90 с пациентам, которые не получали клозапин по крайней мере 3 нед. М-CPP также вводили во время лечения типичным нейролептиком флуфеназином и клозапином. Группа состояла из 15 пациентов
(2 женщины, 13 мужчин), которые соответствовали критериям DSM-III-R для хронической шизофрении (n=13) или шизоаффективного расстройства (n=2), средний возраст составил 33,8±8,0 года. Инъекции м-CPP значительно увеличивали уровни кортизола и пролактина у пациентов без терапии. Лечение клозапином существенно блокировало нейроэндокринные ответы на м-CPP, в то время как флуфеназин не оказывал подобного эффекта.
Результаты исследования показывают, что лечение клозапином обладает мощными серотониновыми антагонистическими эффектами у пациентов с шизофренией. Эти данные отчасти подтверждены в экспериментальной работе A.Nechmad и соавт. (2003 г.), в которой исследовалось влияние клозапина в сравнении с галоперидолом на уровни ДГЭА и ДГЭА-С, эфира дегидроэпиандростерона (аналог
g-аминомасляной кислоты) на (GABA-A) в коре головного мозга крыс. Обнаружено, что инъекции клозапина (5 и 15 мг/кг), но не галоперидола (1 мг/кг) в течение 8 дней уменьшали мозговые корковые уровни ДГЭА и ДГЭА-С. Эти данные подтверждают роль нейростероидов и возможно модуляции ГАМК-А-рецепторов в механизме действия клозапина.
Полученные в нашем исследовании данные отчасти сопоставимы с данными литературы. Это касается высоких фоновых уровней кортизола у больных с ППЭ и хронической шизофренией. Вместе с тем получен ряд новых данных, характеризующий особенности сочетанной динамики показателей кортизола и ДГЭА-С в зависимости от гендерного фактора, эффективности терапии оланзапином и длительности заболевания у указанной категории пациентов.
Заключение
Результаты проведенного исследования, а также анализ научной литературы по изучаемой проблеме свидетельствуют о важности нейробиологического подхода в изучении различных аспектов ППЭ и подтверждают целесообразность проведения дальнейших комплексных клинико-психопатологических, гормональных и клинико-эндокринологических исследований у пациентов с ППЭ до назначения и в процессе психофармакотерапии с целью уточнения состояния ГГА-оси, а также поиска биологических (в частности, гормональных) маркеров эффективности терапии, что имеет большое значение для уточнения патофизиологических механизмов шизофрении и выбора оптимальной терапевтической тактики у больных на начальной стадии развития психического заболевания.Сведения об авторах
Горобец Людмила Николаевна – д-р мед. наук, проф., зав. отд. психиатрической эндокринологии ФГБУ МНИИП Минздрава России. E-mail: gorobetsln@mail.ru
Лорикян Ани Гагиковна – мл. науч. сотр. отд. психиатрической эндокринологии ФГБУ МНИИП Минздрава России.
E-mail: anilori@yandex.ru
Кутузова Нина Михайловна – д-р биол. наук, проф., зав. каф. биоорганической химии и биотехнологии ФГБОУ ВПО МПГУ. E-mail: biochem_mpgu@mail.ru
Список исп. литературыСкрыть список1. Горобец Л.Н., Матросова М.И. Сравнительная динамика уровней пролактина и эндокринных показателей у больных с первым психотическим эпизодом и хронической шизофренией в процессе терапии оланзапином. Уральский журн. психиатрии, наркологии и психотерапии. Екатеринбург, 2013; 1 (3): 29–36.
2. Гурович И.Я., Шмуклер А.Б., Магомедова М.В. и др. Первый психотический эпизод: особенности терапии оланзапином. Соц. и клин. психиатрия. 2004; 14 (2): 62–7.
3. Мосолов С.Н. Шкалы психометрической оценки симптоматики шизофрении и концепция негативных и позитивных расстройств. М.: Новый цвет, 2001.
4. Основы нейроэндокринологии. Под ред. В.Г.Шаляпиной и П.Д.Шабанова. СПб.: ЭЛБИ-СПб., 2005; с. 472.
5. Bicikova M, Hampl R, Hill M et al. Neuro- and immunomodulatory steroids and other biochemical markers in drug-naive schizophrenia patients and the effect of treatment with atypical antipsychotics. Neuro Endocrinol Lett 2011; 32 (2): 141–7.
6. Brophy MH, Rush AJ, Crowley G. Cortisol, estradiol, and androgens in acutely ill paranoid schizophrenics. Biol Psychiat 1983; 18: 583–90.
7. Cohrs S, Röher C, Jordan W et al. The atypical antipsychotics olanzapine and quetiapine, but not haloperidol, reduce ACTH and cortisol secretion in healthy subjects. Psychopharmacol (Berl) 2006; 185 (1): 11–8.
8. di Michele F, Caltagirone C, Bonaviri G et al. Plasma dehydroepiandrosterone levels are strongly increased in schizophrenia. J Psychiat Res 2005; p. 267–73.
9. Erb JL, Kadane JB, Tourney G et al. Discrimination between schizophrenic and control subjects by means of plasma dehydroepiandrosterone measurements. J Clin Endocrinol Metab 1981; 52: 181–6.
10. Gallagher P, Watson S, Smith MS et al. Plasma cortisol-dehydroepiandrosterone (DHEA) ratios in schizophrenia and bipolar disorder. Schizophr Res 2007; 90: 258–65.
11. Jakovljevic M, Pivac N, Mihaljevic-Peles A et al. The effects of olanzapine and fluphenazine on plasma cortisol, prolactin and muscle rigidity in schizophrenic patients: a double blind study. Prog Neuropsychopharmacol Biol Psychiat 2007; 30; 31 (2): 399–402.
12. Kapur S, Remington G. Atypical antipsychotics: new directions and new challenges in the treatment of schizophrenia. Ann Rev Med 2001; 52: 503–17.
13. Marx CE, Stevens RD, Shampine LJ et al. Neuroactive steroids are altered in schizophrenia and bipolar disorder: relevance to pathophysiology and therapeutics. Neuropsychopharmacol 2006; 31: 1249–63.
14. Mondelli V. The effect of stress and its biological mediators on the onset and clinical outcome of psychosis. Eur Arch Psychiat Clin Neuroscience 2013; 263: 7.
15. Nechmad A, Maayan R, Ramadan E et al. Clozapine decreases rat brain dehydroepiandrosterone and dehydroepiandrosterone sulfate levels. Eur Neuropsychopharmacol 2003; 13 (1): 29–31.
16. Oades RD, Schepker R. Serum gonadal steroid hormones in young schizophrenic patients. Psychoneuroendocrinol 1994; 19: 373–85.
17. Oertel GW, Benes P, Schirazi M et al. Interaction between dehydroepiandrosterone, cyclic adenosine-3’,5’-monophosphate and glucose-6-phosphatedehydrogenase in normal and diseased subjects. Experiential 1974; 30: 872–3.
18. Orentreich N, Brind JL, Rizer RL et al. Age changes and sex differences in serum dehydroepiandrosterone sulfate concentrations throughout adulthood. J Clin Endocrinol Metab 1984; 59 (3): 551–5.
19. Owen M, Wolkowitz HD, Antony J. Psychoneuroendocrinology: the scientific basis of clinical practice 2003; p. 588.
20. Owen RR Jr, Gutierrez-Esteinou R, Hsiao J et al. Effects of clozapine and fluphenazine treatment on responses to m-chlorophenylpiperazine infusions in schizophrenia. Arch Gen Psychiat 1993; 50 (8): 636–44.
21. Ritsner M, Gibel A, Ram E et al. Alterations in DHEA metabolism in schizophrenia: two-month case-control study. Eur Neuropsychopharmacol 2006; 16 (137): 146.
22. Ritsner M, Maayan R, Gibel A et al. Differences in blood pregnenolone and dehydroepiandrosterone levels between schizophrenia patients and healthy subjects. Eur Neuropsychopharmacol 2007; 17: 358–65.
23. Ryan MC, Flanagan S, Kinsella U et al. The effects of atypical antipsychotics on visceral fat distribution in first episode, drug-naive patients with schizophrenia. Life Sci 2004; 74 (16): 1999–2008.
24. Strous RD, Maayan R, Lapidus R et al. Increased circulatory dehydroepiandrosterone and dehydroepiandrosterone-sulphate in first-episode schizophrenia: relationship to gender, aggression and symptomatology. Schizophr Res 2004; 71 (2–3): 427–34.
25. Tanaka K, Morinobu S, Ichimura M et al. Decreased levels of ghrelin, cortisol, and fasting blood sugar, but not n-octanoylated ghrelin, in Japanese schizophrenic inpatients treated with olanzapine. Prog Neuropsychopharmacol Biol Psychiat 2008; 32 (6): 1527–32.
26. Tourney G, Erb JL. Temporal variations in androgens and stress hormones in control and schizophrenic subjects. Biol Psychiat 1979; 14: 395–404.
27. Venkatasubramanian G, Chittiprol S, Neelakantachar N et al. Effect of antipsychotic treatment on Insulin-like Growth Factor-1 and cortisol in schizophrenia: a longitudinal study. Schizophr Res 2010; 119 (1–3): 131–7.

