Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2017
Мемантин: обзор применения в неврологии №01 2017
Номера страниц в выпуске:34-43
Мемантин – это неконкурентный антагонист (негативный аллостерический модулятор) магниевого сайта N-метил-D-аспартат-рецептора, обладающий рядом полезных в неврологической практике свойств, в частности анальгетическим, антимигренозным, антиспастическим, противопаркинсоническим, нейропротективным и другими. В настоящей статье подробно рассматривается доказательная база для его применения при различных неврологических заболеваниях.
Ключевые слова: мемантин, мигрень, фибромиалгия, хронический болевой синдром, болезнь Паркинсона.
yubykov@gmail.com
Ключевые слова: мемантин, мигрень, фибромиалгия, хронический болевой синдром, болезнь Паркинсона.
yubykov@gmail.com
Мемантин – это неконкурентный антагонист (негативный аллостерический модулятор) магниевого сайта N-метил-D-аспартат-рецептора, обладающий рядом полезных в неврологической практике свойств, в частности анальгетическим, антимигренозным, антиспастическим, противопаркинсоническим, нейропротективным и другими. В настоящей статье подробно рассматривается доказательная база для его применения при различных неврологических заболеваниях.
Ключевые слова: мемантин, мигрень, фибромиалгия, хронический болевой синдром, болезнь Паркинсона.
yubykov@gmail.com
Для цитирования: Беккер Р.А., Быков Ю.В. Мемантин: обзор применения в неврологии. Психиатрия и психофармакотерапия. 2017; 19 (1): 34–43.
Memantine is an uncompetitive antagonist (a negative allosteric modulator) of the magnesium site of NMDA-receptor. It has several pharmacologic properties that might make it useful in some neurologic diseases. Among those properties are its analgesic, antimigraine, antispasmodic, antiparkinsonian, neuroprotective and others. This article thoroughly reviews the existing evidence base for memantine off-label use in neurology in diseases other than Alzheimer’s and other dementias.
Key words: memantine, migraine, fibromyalgia, chronic pain syndromes, Parkinson disease.
yubykov@gmail.com
For citation: Bekker R.A., Bykov Yu.V. Memantine: a review of its use in neurology. Psychiatry and Psychopharmacotherapy. 2017; 19 (1): 34–43.
В открытом исследовании показано, что мемантин эффективен при БП и способен не только уменьшать при ней когнитивные нарушения, но и улучшать моторную функцию, уменьшать проявления экстрапирамидного синдрома, а также уменьшать или устранять вызываемые леводопой дискинезии, сглаживать колебания моторной активности – устранять феномен «включения–выключения» (S.Varanese и соавт., 2010). Позже описан случай, когда назначение мемантина с целью уменьшения когнитивной дисфункции при БП привело к одновременному купированию дискинезий от леводопы и исчезновению феномена «включения–выключения» (E.Vidal и соавт., 2013).
В одном 90-дневном краткосрочном рандомизированном контролируемом исследовании (РКИ), в котором участвовали 25 пациентов в каждой из двух групп, оценивалось влияние мемантина (20 мг/сут) на походку, аксиальную устойчивость, частоту падений, мышечный тонус и другие важные для самообслуживания и качества жизни больных с БП параметры по сравнению с плацебо, был получен статистически достоверный положительный результат почти по всем изучаемым параметрам, в частности по общему показателю шкалы Unified Parkinson's Disease Rating Scale – UPDRS (р<0,05) и по показателю аксиальной устойчивости (р<0,01), кроме улучшения походки – оно не достигло статистической значимости (C.Moreau и соавт., 2013).
В другом небольшом 24-недельном РКИ изучали влияние мемантина (20 мг/сут) на показатели кратковременной памяти, концентрации внимания и когнитивные функции больных с БП и БП-ассоциированными когнитивными нарушениями либо БП-ассоциированной деменцией. В группе больных с когнитивными нарушениями или деменцией вследствие БП было 30 больных. К сроку 12 и 24 нед показатели кратковременной памяти, концентрации внимания, когнитивного функционирования у больных, получавших мемантин, были статистически значимо (p<0,05) лучше, чем в аналогичной группе больных, получавших плацебо (K.Wesnes и соавт., 2014).
В еще одном РКИ изучали влияние мемантина (20 мг/сут) на способность больных БП к самообслуживанию и к достижению индивидуально поставленных бытовых и хозяйственных целей и на нагрузку, которая ложится на работника по уходу или члена семьи, ухаживающего за больным с БП. При этом было показано, что лечение мемантином статистически достоверно (p<0,01) приводит к улучшению самообслуживания, к лучшему достижению индивидуально поставленных бытовых и хозяйственных целей и к снижению нагрузки на работников по уходу или членов семьи у 63% больных, по сравнению с всего 7% в группе плацебо (I.Leroi и соавт., 2014).
А в одном обзоре, посвященном лечению психозов и когнитивных нарушений при БП, указывается, что лечение психозов, часто возникающих на фоне БП, особенно в поздних стадиях, представляет собой большую терапевтическую проблему, так как этим больным противопоказаны многие антипсихотики (АП) из-за возможного резкого ухудшения моторных и когнитивных функций (более или менее безопасными для больных с БП являются лишь клозапин и кветиапин, два атипичных АП с наиболее слабой D2-блокирующей активностью и наименьшим потенциалом вызывания экстрапирамидных нарушений). Между тем, ингибиторы ацетилхолинэстеразы, в частности донепезил, ривастигмин, галантамин, ипидакрин, а также мемантин могут обладать антипсихотическим потенциалом у больных с БП и могут одновременно с улучшением когнитивного функционирования способствовать уменьшению психотических проявлений, предоставляя тем самым более безопасную альтернативу применению АП, или удачно дополняя разрешенные при БП препараты группы АП: кветиапин и клозапин (J.Hindle, 2013).
В Кокрейновском метаобзоре, посвященном лечению субъективной утомляемости и усталости на фоне БП (одной из частых жалоб больных с БП), указывается, что ни для одного из изученных лекарств (модафинил, метилфенидат, амфетамин, кофеин, амантадин, мемантин, разагилин, леводопа/карбидопа) не существует в настоящий момент убедительных доказательств эффективности в РКИ в отношении этого конкретного симптома, однако имеются многочисленные открытые исследования и сообщения случаев; при этом указывается, что некоторые из изученных лекарств хорошо переносятся больными с БП и имеют мало побочных эффектов – к ним относится и мемантин (R.Elbers и соавт., 2015). Учитывая хорошую переносимость мемантина, отсутствие «более доказательных» методов устранения субъективной утомляемости и усталости при БП и ограниченность наших возможностей влияния на эту симптоматику, его применение в этом качестве в виде дополнения к основному лечению (дофаминергическим агонистам и/или леводопе) следует считать показанным.
В одном небольшом РКИ изучали влияние мемантина на немоторные симптомы БП, в частности депрессию, когнитивные нарушения, тревожность, утомляемость, концентрацию внимания и память, дневную сонливость и нарушения ночного сна. По всем изученным параметрам наблюдалась тенденция к улучшению, не достигшая, однако, статистической значимости (авторы сделали вывод, что это произошло из-за небольшого размера выборки). Такую же тенденцию к улучшению продемонстрировали и собственно моторные симптомы БП (общий показатель шкалы UPDRS). Тем не менее, несмотря на то что улучшение не достигло статистической значимости, большинство больных (более 2/3) по завершении исследования выбрали продолжение терапии мемантином в открытом режиме, что заставило авторов предположить, что больные ощущают некое субъективное улучшение от терапии мемантином, не детектируемое имеющимися, недостаточно чувствительными, по их мнению, инструментами типа шкал депрессии и тревоги (W.Ondo и соавт., 2011).
БП также часто сопровождается нарушениями сна и извращением цикла «сон–бодрствование», развитием патологической дневной сонливости, ночным возбуждением, усилением психотической симптоматики и нарушений поведения к ночи (синдром «захода солнца»), порой вплоть до кратковременных делириозных состояний в ночное время. Патогенетической основой этих проявлений являются нейродегенеративные изменения в базальных ганглиях ствола мозга, принимающих участие в том числе и в регуляции цикла «сон–бодрствование», а также часто усиливающаяся к ночи акатизия или возникающая ночью акинезия. Эффективных методов лечения ночной бессонницы при БП, патологической дневной сонливости, ночного возбуждения и ухудшения психического состояния к ночи почти нет. Однако имеются данные об эффективности мемантина в терапии этих состояний (особенно нарушений поведения в ночное время), и эффективности эсзопиклона в терапии ночной бессонницы и кошмаров на фоне БП (N.Diederich, D.McIntyre, 2012).
Как это обычно и происходит (за исключением тех случаев, когда полученные в доклинических испытаниях на животных результаты почему-либо не привлекли внимания других исследователей), полученные на животных положительные результаты послужили основанием для изучения эффективности мемантина при постинсультных состояниях у человека. Так, в одном двойном слепом РКИ у больных с ишемическим инсультом легкой или средней степени тяжести, больные получали по 20 мг/сут мемантина в качестве дополнительного к стандартной терапии средства, либо плацебо (H.Kafi и соавт., 2014). Те пациенты (29 человек), которые дополнительно получали мемантин, показали значительное улучшение неврологического статуса по сравнению с контрольной группой, в которой больные получали плацебо, т.е. только стандартную терапию (24 человека); p<0,001.
В другом РКИ российских исследователей, посвященном изучению эффективности мемантина в краткосрочном лечении в восстановительном периоде после ишемического инсульта, также наблюдался положительный эффект терапии мемантином, выразившийся в статистически достоверном улучшении памяти, концентрации внимания, психоэмоционального статуса (показателей депрессии и тревоги) по сравнению с плацебо; p<0,001 (С.В.Котов и соавт., 2005). В группу исследования вошли 38 больных с ишемическим инсультом, в контрольную группу вошел 31 пациент, который получал 20% раствор пирацетама по 10 мл внутривенно. Мемантин (в исследовании использовалась доза 20 мг/сут) больные принимали внутрь по схеме: 1-я неделя – 5 мг утром, 2-я неделя – 5 мг 2 раза в день (утром и днем), с 3-й недели и далее – 10 мг 2 раза в день. В другом исследовании, также изучавшем эффективность мемантина в восстановительном периоде после ишемического инсульта, отмечалось положительное влияние мемантина на частоту субъективно отмечаемых головных болей (ГБ), когнитивных и мнестических нарушений больных в постинсультном периоде, по сравнению с плацебо. Также наблюдалось статистически достоверное (p<0,001) улучшение объективных показателей памяти, концентрации внимания, психоэмоционального статуса (показателей шкал депрессии и тревоги). Кроме того, под влиянием мемантина отмечалась достоверная положительная динамика наблюдавшихся на электроэнцефалографии очаговых и диффузных патологических изменений, вызванных инсультом, что авторы связали с положительным влиянием мемантина на мозговой кровоток и метаболизм, особенно в корковых структурах и структурах ретикулярной формации (Е.В.Исакова и соавт., 2005).
Достаточно давно известно, что при повторных ишемических атаках, даже не приводящих к развитию ишемического инсульта, так называемых транзиторных ишемических атаках, на первый план в клинической картине могут выходить именно когнитивные нарушения, что в конечном итоге приводит к формированию картины, хорошо знакомой практическим врачам – картины дисциркуляторной энцефалопатии или сосудистой деменции. Эти когнитивные нарушения хорошо поддаются терапии мемантином (Н.В.Вахнина и соавт., 2005).
Это послужило основанием попытаться изучить эффективность мемантина при ЧМТ и у человека. С этой целью было проведено 24-недельное открытое сравнительное исследование, посвященное изучению эффективности, безопасности и переносимости мемантина (20 мг/сут) у 20 больных с когнитивными нарушениями в отдаленном периоде после перенесенных ЧМТ. В качестве препарата сравнения в контрольной группе (n=21) использовался пирацетам в дозе 2400 мг/сут. Результаты проведенного исследования показали статистически достоверное улучшение памяти, мышления, зрительно-пространственных функций, начиная с 12-й недели приема мемантина и в дальнейшем до окончания исследования, по сравнению с пирацетамом. В контрольной группе к концу 4-й недели приема пирацетама были отмечены нестойкое улучшение активности и внимания и тенденция к улучшению памяти. Переносимость лечения в обеих группах была хорошей (М.М.Одинак и соавт, 2005).
В литературе имеется сообщение случая, описывающее 2 пациентов, у которых в результате серьезных травм нижних конечностей развились фантомные боли, резистентные к сильным опиоидам. Назначение мемантина принесло положительный результат в обоих случаях, причем без видимых побочных эффектов (R.Hackworth и соавт., 2008).
В двойном слепом РКИ у 19 пациентов, перенесших ампутацию верхней конечности и страдавших от фантомных болей, дополнительное назначение мемантина в дозе 20–30 мг/сут в раннем послеоперационном периоде привело к снижению потребления ропивакаина (который все пациенты получали в виде непрерывной инфузионной анестезии в плечевое сплетение) и к уменьшению интенсивности фантомных болей – 10 пациентов, по сравнению с плацебо – 9 пациентов (M.Schley и соавт., 2007).
Однако в небольшом открытом исследовании (8 пациентов) мемантин в дозе 30 мг/сут оказался неэффективным при лечении хронических фантомных болей (K.Wiech и соавт., 2004). А в еще одном РКИ, куда были включены 15 пациентов с хроническими фантомными болевыми синдромами длительностью от 1 года до 28 лет, развившимися после ампутации конечности, мемантин, назначенный в дозе 20 мг/сут, не показал большей эффективности по сравнению с плацебо (L.Nikolajsen и соавт., 2000).
Немецкими авторами в небольшом открытом исследовании, куда были включены всего 3 пациента с КРБС, показана эффективность мемантина в течение 8 нед терапии (N.Sinis и соавт., 2006). Этими же авторами в другом небольшом открытом исследовании (6 пациентов) повторно показано, что мемантин оказывает положительное влияние на симптоматику КРБС; в обоих исследованиях эффект наблюдался у всех пациентов, что часто бывает при малых выборках (N.Sinis и соавт., 2007). Лечение мемантином этих больных в течение 6 нед привело к купированию болевого синдрома, сопровождавшемуся одновременным улучшением двигательных и вегетативных функций, уменьшением депрессии и тревожности.
В двойном слепом РКИ (15 пациенток) показано, что назначение мемантина в составе комплексной премедикации перед мастэктомией по поводу рака молочной железы (РМЖ) или по другим показаниям, значительно уменьшает интенсивность послеоперационной боли и потребление анальгетиков по сравнению с плацебо; p<0,005 (V.Morel и соавт., 2016).
В другом двойном слепом РКИ, куда вошли 20 женщин с РМЖ, мемантин, назначенный в дозе 5–20 мг/сут в течение 4 нед, эффективно профилактировал развитие нейропатической боли после мастэктомии по сравнению с плацебо; p<0,005 (G.Pickering и соавт., 2014). Мемантин назначался с профилактической целью, и его прием начинался за 2 нед до предстоящей операции. В этом исследовании показано, что мемантин при РМЖ обладает не только анальгетической активностью, но и улучшает когнитивные функции пациенток (что важно в связи с тем, что применяемая при РМЖ химиотерапия и эстрогеновая блокада нередко вызывают существенное ухудшение когнитивного функционирования), что улучшало их качество жизни.
В экспериментальной модели люмбоишиалгии на животных (перевязка седалищного нерва) показано, что мемантин эффективно снижает вызываемую повреждением нерва гипералгезию, механическую аллодинию и тактильную гиперчувствительность как при однократном, так и при длительном его введении, особенно если введение мемантина начиналось одновременно с началом операции или предшествовало ей. В последующем, в открытом исследовании эффективности мемантина при дискогенных болях, люмбоишиалгиях, радикулоневритах у людей, показано, что мемантин в дозе 30–40 мг/сут (начальная доза 10 мг/сут с последующим наращиванием по переносимости) эффективен в составе комплексной терапии при всех видах дискогенных и корешковых болей, в качестве адъюванта к стандартной терапии (К.Т.Алиев, 2003).
Эпилепсия
Мемантин оказывает противосудорожное действие в экспериментах на животных, в частности, предотвращая или отсрочивая и уменьшая вызываемые применением каината, NMDA, пентилентетразола (коразола, кардиазола), стрихнина судороги у экспериментальных животных (A.Dhir, K.Chopra, 2015). Это неудивительно, если вспомнить, что механизм действия мемантина основан на связывании с магниевым сайтом NMDA-рецептора, и что противосудорожное действие препаратов магния известно давно, а гиперактивация NMDA-рецепторов (непосредственно, как при применении NMDA или стрихнина, каината, или косвенно, как при применении антагонистов g-аминомасляной кислоты вроде пентилентетразола или изониазида или при электростимуляции) играет ключевую роль в механизмах запуска припадка (A.Dhir, K.Chopra, 2015). Кроме того, мемантин уменьшает вызываемый повторными введениями судорожных ядов или повторными электростимуляциями киндлинг (облегчение возникновения повторных припадков по сравнению с первым) и уменьшает вызываемые судорожными припадками неблагоприятные морфологические изменения в лимбической системе и гиппокампе экспериментальных животных, дезориентацию и когнитивные нарушения после припадка (D.Vasil'ev и соавт., 2013).
Это послужило основанием для изучения эффективности мемантина при эпилепсии у людей. С этой целью было предпринято открытое проспективное неконтролируемое пилотное исследование эффективности добавления мемантина к стандартной противоэпилептической терапии в отношении коррекции когнитивных и поведенческих нарушений при эпилепсии. В описанном исследовании участвовали 50 пациентов с фокальными формами эпилепсии, у которых наблюдались симптомы когнитивного дефицита и/или поведенческие нарушения разной степени выраженности. Доза мемантина в этом исследовании составляла от 5 до 10 мг/сут в зависимости от переносимости препарата. Терапевтический эффект мемантина оценивался через 2 мес от начала лечения. В результате исследования зафиксировано статистически достоверное улучшение памяти и когнитивных функций больных фокальной эпилепсией по результатам тестов, а также положительное влияние мемантина на психическое состояние и поведение больных: уменьшение эксплозивности, раздражительности, показателей депрессии и тревоги (Ю.В.Соломатин и соавт., 2013).
Это послужило основанием для дальнейшего изучения эффективности мемантина при РС в формате РКИ. Одно из таких исследований опубликовано в 2007 г. российскими учеными. В этом исследовании участвовали 26 пациентов с достоверно установленным диагнозом РС, все со вторично прогрессирующим типом течения болезни. Среди этих больных были 18 женщин и 8 мужчин (что, в целом, адекватно отражает более высокую заболеваемость РС в популяции среди лиц женского пола в соотношении примерно 2:1 и их преобладание среди обращающихся за помощью по поводу РС больных). Средний возраст вошедших в исследование больных составлял 38,1±8,8 года. Длительность исследования составила 9 мес в самом исследовании (рандомизированной плацебо-контролируемой его фазе) и еще 12 мес в открытой фазе после его завершения. В этом исследовании использовалась доза мемантина 20 мг/сут, а схема наращивания была следующей: в 1-ю неделю больные получали 5 мг мемантина утром, со 2-й недели – 5 мг утром и 5 мг в обед, с 3-й недели – 10 мг утром и 5 мг в обед, с 4-й недели и далее – 20 мг/сут в 2 приема, по 10 мг утром и в обед. При этом были получены следующие результаты: мемантин, согласно данным российских исследователей, достоверно отличался от плацебо по показателям улучшения рабочей (кратковременной) памяти, слухоречевой и зрительной долговременной памяти, самоконтроля, психического статуса (в частности, настроения и уровня тревожности). У ряда больных объективно регистрируемое улучшение также сопровождалось субъективным ощущением уменьшения утомляемости, повышения общего жизненного тонуса и активности (Н.Ф.Булдакова и соавт., 2007).
Однако в недавнем двойном слепом РКИ у 50 пациентов с РС и когнитивными нарушениями мемантин в дозе 20 мг/сут не показал эффективности по сравнению с плацебо. Кроме того, мемантин хуже переносился (L.Peyro Saint Paul и соавт., 2016). Такой же отрицательный результат получен в другом двойном слепом РКИ, где больные с РС и когнитивными нарушениями получали мемантин в дозе 10 мг/сут с последующим титрованием дозы до 20 мг/сут еще в течение 12 нед. Ни по одному из изучавшихся в этом исследовании параметров эффект не отличался от плацебо (J.Lovera и соавт., 2010). Также эффективность мемантина не подтверждена в другом РКИ, где прицельно оценивали влияние этого препарата на проявления спастичности и пластичность движений при РС (L.Mehta и соавт., 2010). Более того, в некоторых исследованиях показали, что в высокой дозе (30 мг/сут) мемантин способен приводить к (временному и обратимому) неврологическому ухудшению при РС (P.Villoslada и соавт., 2009).
Кохрановский метаобзор от 2013 г., посвященный фармакологическому лечению когнитивных нарушений при РС (учитывающий в том числе и приведенные выше данные от 2010 г.), менее категоричен: в нем утверждается лишь, что существует умеренного качества доказательная база, показывающая отсутствие отличия от плацебо у 10 мг/сут донепезила при лечении когнитивных нарушений при РС, а о мемантине и амантадине не утверждается ничего (ни об их эффективности, ни их неэффективности), а лишь отмечается их хорошая переносимость и безопасность при РС, малое количество побочных эффектов, и констатируется необходимость более масштабных и методологически корректных исследований по антидементным препаратам (в том числе мемантину) при РС (D.He и соавт., 2013). Учитывая практически полное отсутствие эффективных методов устранения когнитивных нарушений при РС, применение мемантина при этой патологии в качестве «терапии отчаяния» нельзя считать полностью необоснованным.
Одной исследовательской группой выдвинуто предположение, что селективная блокада NR2B подтипа NMDA-рецепторов, в наибольшей мере ответственных за воспаление, эксайтотоксичность и когнитивные нарушения, может быть более перспективным подходом в лечении РС, чем неспецифическая блокада NMDA-рецепторов как таковых, осуществляемая мемантином. Это подтверждается в экспериментальной модели на животных; надо отметить, что селективные антагонисты NR2B подтипа NMDA-рецепторов в настоящее время проходят клинические испытания II фазы по другим показаниям – депрессивные состояния, деменции (M.Farjam и соавт., 2014).
В небольшом открытом пилотном исследовании, в котором участвовали 4 больных, авторы показали, что мемантин при БХ не только способствует торможению прогрессирования специфической БХ-ассоциированной деменции, но и улучшает моторную функцию больных, уменьшает дискинезии, нарушения поведения, депрессивную и тревожную симптоматику. Кроме того, при изучении действия мемантина на церебральный кровоток и метаболизм у больных с БХ при помощи позитронно-эмиссионной томографии с 18F-фтордезоксиглюкозой показано, что назначение мемантина приводит к улучшению кровотока и потребления глюкозы в пораженных болезнью базальных ядрах (L.Hjermind и соавт., 2011). Один из этих четырех больных, выбравший продолжение терапии мемантином и после завершения исследования, не имел признаков клинического ухудшения и через 18 мес после окончания 4-месячного исследования, в то время как у других трех больных, прекративших прием мемантина после 3–4 мес терапии, уже к сроку 12 мес после исследования определялись клинически заметные ухудшения как в отношении когнитивного функционирования, так и в отношении моторных функций и психического статуса (L.Hjermind и соавт., 2011). В другом пилотном исследовании, в котором участвовали 18 больных БХ, также у большинства (более 2/3) был достигнут положительный эффект при лечении мемантином как в отношении когнитивных функций, так и моторики, самообслуживания, психического статуса. При этом мемантин хорошо переносится больными с БХ, имеет мало побочных эффектов. Важно отметить, что среди ответивших на лечение мемантином было двое больных с генетически особенно тяжелыми формами БХ, имевших более 80 повторов в гене белка хантингтина и раннее начало болезни, в подростковом возрасте (W.Ondo и соавт., 2007). Еще одно открытое исследование, включавшее 27 больных с БХ, было длительным (более 2 лет) и показало, что мемантин (применявшийся в этом исследовании в дозах до 30–40 мг/сут), по-видимому, способен тормозить прогрессирование БХ (A.Beister и соавт., 2004). Авторы этого исследования призывают изучить мемантин при БХ в формате многоцентрового РКИ.
Описан также интересный клинический случай, когда добавление мемантина (5 мг/сут с постепенной титрацией до 20 мг/сут) помогло снять проявления психоза, не полностью поддававшиеся терапии рисперидоном (4–6 мг/сут), одновременно улучшив настроение, моторные функции, способность к самообслуживанию и когнитивное функционирование 32-летней больной с тяжелой формой БХ (E.Cankurtaran и соавт., 2006). На протяжении
6 мес наблюдения данная больная, продолжавшая получать мемантин и рисперидон, не проявляла признаков прогрессирования болезни, ухудшения когнитивного или моторного функционирования или возобновления психоза (E.Cankurtaran и соавт., 2006).
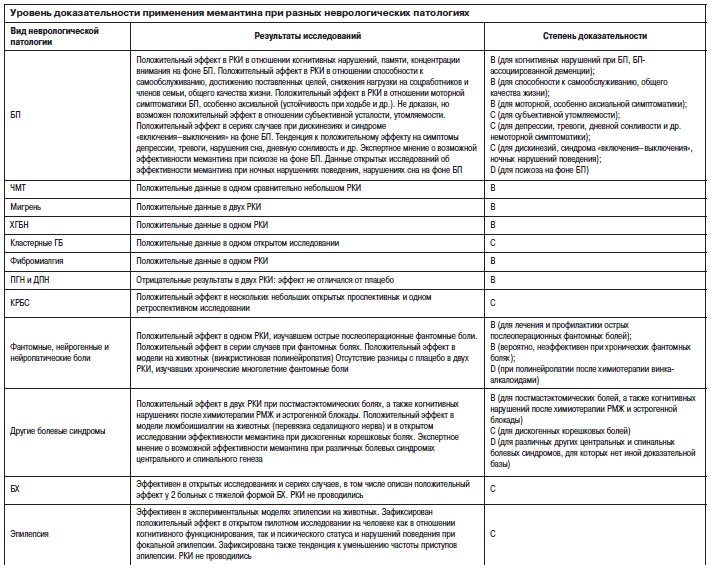 Еще в самом начале клинического применения мемантина, в начале 1980-х годов, было обращено внимание на его способность снижать спастичность мышц у больных с детским церебральным параличом (ДЦП), последствиями ЧМТ, постинсультными спастическими параличами и экстрапирамидными нарушениями (H.Rohde, 1982). При этом отмечалось также улучшение когнитивного функционирования и настроения у больных с ДЦП и другими спастическими синдромами (H.Rohde, 1982). В более позднем открытом исследовании, посвященном изучению эффективности адъювантного лечения мемантином после стереотаксических хирургических вмешательств на мозге, производившихся с целью симптоматического лечения тяжелых экстрапирамидных и спастических расстройств (в том числе ДЦП, последствий ЧМТ и др.), это наблюдение об эффективности мемантина в устранении спастичности при ДЦП и других подобных синдромах также подтвердилось (F.Mundinger, E.Milios, 1985). Эффективность мемантина, наряду с дантроленом, центральными миорелаксантами типа баклофена и тизанидина, в устранении спастичности мышц при ДЦП, последствиях инсультов и ЧМТ и, возможно, даже при РС, продемонстрирована в открытом исследовании российскими учеными (D.Kasatkin, 2008).
Еще в самом начале клинического применения мемантина, в начале 1980-х годов, было обращено внимание на его способность снижать спастичность мышц у больных с детским церебральным параличом (ДЦП), последствиями ЧМТ, постинсультными спастическими параличами и экстрапирамидными нарушениями (H.Rohde, 1982). При этом отмечалось также улучшение когнитивного функционирования и настроения у больных с ДЦП и другими спастическими синдромами (H.Rohde, 1982). В более позднем открытом исследовании, посвященном изучению эффективности адъювантного лечения мемантином после стереотаксических хирургических вмешательств на мозге, производившихся с целью симптоматического лечения тяжелых экстрапирамидных и спастических расстройств (в том числе ДЦП, последствий ЧМТ и др.), это наблюдение об эффективности мемантина в устранении спастичности при ДЦП и других подобных синдромах также подтвердилось (F.Mundinger, E.Milios, 1985). Эффективность мемантина, наряду с дантроленом, центральными миорелаксантами типа баклофена и тизанидина, в устранении спастичности мышц при ДЦП, последствиях инсультов и ЧМТ и, возможно, даже при РС, продемонстрирована в открытом исследовании российскими учеными (D.Kasatkin, 2008).
Однако следует отметить, что РКИ по применению мемантина в качестве антиспастического агента при ДЦП и других спастических состояниях центрального генеза не проводились, а установленная в частности и российскими исследователями в открытых исследованиях эффективность мемантина как антиспастического агента при РС позже не получила подтверждения в РКИ (о чем упоминалось в разделе, посвященном применению мемантина при РС).
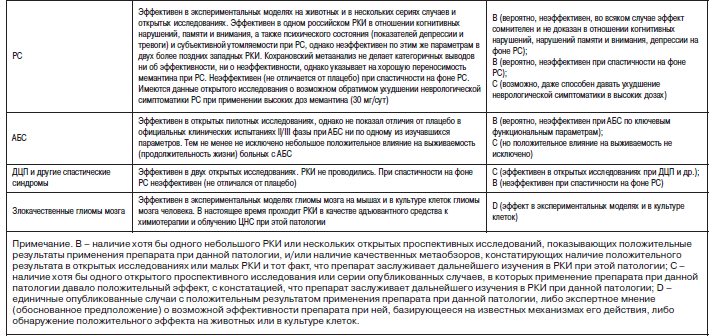 Мемантин обладает широким спектром активности при разных неврологических заболеваниях, однако доказательная база для его применения при различных патологиях нервной системы неодинакова по качеству. В число наиболее хорошо доказанных эффектов мемантина входит его анальгетическая активность при таких болевых синдромах, как мигрень, фибромиалгия, ХГБН, нейропротективная и прокогнитивная активность при постинсультных состояниях, ЧМТ, а также положительное влияние на различные (как моторные, так и немоторные) проявления БП. По некоторым другим неврологическим заболеваниям, например БХ, доступны лишь данные открытых исследований. А по таким патологиям, как РС или ПГН, мемантин не показал достоверного отличия от плацебо (см. таблицу).
Мемантин обладает широким спектром активности при разных неврологических заболеваниях, однако доказательная база для его применения при различных патологиях нервной системы неодинакова по качеству. В число наиболее хорошо доказанных эффектов мемантина входит его анальгетическая активность при таких болевых синдромах, как мигрень, фибромиалгия, ХГБН, нейропротективная и прокогнитивная активность при постинсультных состояниях, ЧМТ, а также положительное влияние на различные (как моторные, так и немоторные) проявления БП. По некоторым другим неврологическим заболеваниям, например БХ, доступны лишь данные открытых исследований. А по таким патологиям, как РС или ПГН, мемантин не показал достоверного отличия от плацебо (см. таблицу).
Сведения об авторах
Беккер Роман Александрович – исследователь в области психофармакотерапии, Университет им. Давида Бен-Гуриона в Негеве
Быков Юрий Витальевич – ФГБОУ ВО СтГМУ. E-mail: yubykov@gmail.com
Ключевые слова: мемантин, мигрень, фибромиалгия, хронический болевой синдром, болезнь Паркинсона.
yubykov@gmail.com
Для цитирования: Беккер Р.А., Быков Ю.В. Мемантин: обзор применения в неврологии. Психиатрия и психофармакотерапия. 2017; 19 (1): 34–43.
Memantine: a review of its use in neurology
R.A.Bekker1, Yu.V.Bykov2
1 David Ben-Gurion University in Negev. 8410501, Israel, Be'er Sheva;
2 Stavropol State Medical University of the Ministry of Health of the Russian Federation. 355017, Russian Federation, Stavropol, ul. Mira, d. 310
Memantine is an uncompetitive antagonist (a negative allosteric modulator) of the magnesium site of NMDA-receptor. It has several pharmacologic properties that might make it useful in some neurologic diseases. Among those properties are its analgesic, antimigraine, antispasmodic, antiparkinsonian, neuroprotective and others. This article thoroughly reviews the existing evidence base for memantine off-label use in neurology in diseases other than Alzheimer’s and other dementias.
Key words: memantine, migraine, fibromyalgia, chronic pain syndromes, Parkinson disease.
yubykov@gmail.com
For citation: Bekker R.A., Bykov Yu.V. Memantine: a review of its use in neurology. Psychiatry and Psychopharmacotherapy. 2017; 19 (1): 34–43.
Предисловие
В первой части нашей работы по мемантину уже была освещена эффективность этого препарата при психических заболеваниях. Там же мы подробно осветили основные фармакологические свойства этого препарата, в том числе его эффективность при единственном официальном показании к его применению – болезни Альцгеймера, а также его эффективность (или неэффективность) при различных других деменциях – сосудистой, мультиинфарктной, ВИЧ-ассоциированной деменции, деменции телец Леви. В этой же статье мы постараемся подробно рассмотреть доказательную базу для применения мемантина при различных других неврологических патологиях, в том числе сопровождающихся (болезнь Паркинсона – БП, эпилепсия) или не сопровождающихся когнитивными нарушениями.Болезнь Паркинсона
Поскольку мемантин является модифицированным производным известного антипаркинсонического средства амантадина, и, подобно амантадину, обладает продофаминергическими свойствами, а в механизмах действия амантадина, в свою очередь, большую роль, наряду с его прямым дофаминопозитивным действием, играет его антагонизм к N-метил-D-аспартат-рецепторам (NMDA-рецепторам) – свойство, которое было целенаправленно усилено при создании мемантина, то эффективность мемантина при БП также много подвергалась изучению в различных аспектах (количество исследований не намного меньше, чем по амантадину).В открытом исследовании показано, что мемантин эффективен при БП и способен не только уменьшать при ней когнитивные нарушения, но и улучшать моторную функцию, уменьшать проявления экстрапирамидного синдрома, а также уменьшать или устранять вызываемые леводопой дискинезии, сглаживать колебания моторной активности – устранять феномен «включения–выключения» (S.Varanese и соавт., 2010). Позже описан случай, когда назначение мемантина с целью уменьшения когнитивной дисфункции при БП привело к одновременному купированию дискинезий от леводопы и исчезновению феномена «включения–выключения» (E.Vidal и соавт., 2013).
В одном 90-дневном краткосрочном рандомизированном контролируемом исследовании (РКИ), в котором участвовали 25 пациентов в каждой из двух групп, оценивалось влияние мемантина (20 мг/сут) на походку, аксиальную устойчивость, частоту падений, мышечный тонус и другие важные для самообслуживания и качества жизни больных с БП параметры по сравнению с плацебо, был получен статистически достоверный положительный результат почти по всем изучаемым параметрам, в частности по общему показателю шкалы Unified Parkinson's Disease Rating Scale – UPDRS (р<0,05) и по показателю аксиальной устойчивости (р<0,01), кроме улучшения походки – оно не достигло статистической значимости (C.Moreau и соавт., 2013).
В другом небольшом 24-недельном РКИ изучали влияние мемантина (20 мг/сут) на показатели кратковременной памяти, концентрации внимания и когнитивные функции больных с БП и БП-ассоциированными когнитивными нарушениями либо БП-ассоциированной деменцией. В группе больных с когнитивными нарушениями или деменцией вследствие БП было 30 больных. К сроку 12 и 24 нед показатели кратковременной памяти, концентрации внимания, когнитивного функционирования у больных, получавших мемантин, были статистически значимо (p<0,05) лучше, чем в аналогичной группе больных, получавших плацебо (K.Wesnes и соавт., 2014).
В еще одном РКИ изучали влияние мемантина (20 мг/сут) на способность больных БП к самообслуживанию и к достижению индивидуально поставленных бытовых и хозяйственных целей и на нагрузку, которая ложится на работника по уходу или члена семьи, ухаживающего за больным с БП. При этом было показано, что лечение мемантином статистически достоверно (p<0,01) приводит к улучшению самообслуживания, к лучшему достижению индивидуально поставленных бытовых и хозяйственных целей и к снижению нагрузки на работников по уходу или членов семьи у 63% больных, по сравнению с всего 7% в группе плацебо (I.Leroi и соавт., 2014).
А в одном обзоре, посвященном лечению психозов и когнитивных нарушений при БП, указывается, что лечение психозов, часто возникающих на фоне БП, особенно в поздних стадиях, представляет собой большую терапевтическую проблему, так как этим больным противопоказаны многие антипсихотики (АП) из-за возможного резкого ухудшения моторных и когнитивных функций (более или менее безопасными для больных с БП являются лишь клозапин и кветиапин, два атипичных АП с наиболее слабой D2-блокирующей активностью и наименьшим потенциалом вызывания экстрапирамидных нарушений). Между тем, ингибиторы ацетилхолинэстеразы, в частности донепезил, ривастигмин, галантамин, ипидакрин, а также мемантин могут обладать антипсихотическим потенциалом у больных с БП и могут одновременно с улучшением когнитивного функционирования способствовать уменьшению психотических проявлений, предоставляя тем самым более безопасную альтернативу применению АП, или удачно дополняя разрешенные при БП препараты группы АП: кветиапин и клозапин (J.Hindle, 2013).
В Кокрейновском метаобзоре, посвященном лечению субъективной утомляемости и усталости на фоне БП (одной из частых жалоб больных с БП), указывается, что ни для одного из изученных лекарств (модафинил, метилфенидат, амфетамин, кофеин, амантадин, мемантин, разагилин, леводопа/карбидопа) не существует в настоящий момент убедительных доказательств эффективности в РКИ в отношении этого конкретного симптома, однако имеются многочисленные открытые исследования и сообщения случаев; при этом указывается, что некоторые из изученных лекарств хорошо переносятся больными с БП и имеют мало побочных эффектов – к ним относится и мемантин (R.Elbers и соавт., 2015). Учитывая хорошую переносимость мемантина, отсутствие «более доказательных» методов устранения субъективной утомляемости и усталости при БП и ограниченность наших возможностей влияния на эту симптоматику, его применение в этом качестве в виде дополнения к основному лечению (дофаминергическим агонистам и/или леводопе) следует считать показанным.
В одном небольшом РКИ изучали влияние мемантина на немоторные симптомы БП, в частности депрессию, когнитивные нарушения, тревожность, утомляемость, концентрацию внимания и память, дневную сонливость и нарушения ночного сна. По всем изученным параметрам наблюдалась тенденция к улучшению, не достигшая, однако, статистической значимости (авторы сделали вывод, что это произошло из-за небольшого размера выборки). Такую же тенденцию к улучшению продемонстрировали и собственно моторные симптомы БП (общий показатель шкалы UPDRS). Тем не менее, несмотря на то что улучшение не достигло статистической значимости, большинство больных (более 2/3) по завершении исследования выбрали продолжение терапии мемантином в открытом режиме, что заставило авторов предположить, что больные ощущают некое субъективное улучшение от терапии мемантином, не детектируемое имеющимися, недостаточно чувствительными, по их мнению, инструментами типа шкал депрессии и тревоги (W.Ondo и соавт., 2011).
БП также часто сопровождается нарушениями сна и извращением цикла «сон–бодрствование», развитием патологической дневной сонливости, ночным возбуждением, усилением психотической симптоматики и нарушений поведения к ночи (синдром «захода солнца»), порой вплоть до кратковременных делириозных состояний в ночное время. Патогенетической основой этих проявлений являются нейродегенеративные изменения в базальных ганглиях ствола мозга, принимающих участие в том числе и в регуляции цикла «сон–бодрствование», а также часто усиливающаяся к ночи акатизия или возникающая ночью акинезия. Эффективных методов лечения ночной бессонницы при БП, патологической дневной сонливости, ночного возбуждения и ухудшения психического состояния к ночи почти нет. Однако имеются данные об эффективности мемантина в терапии этих состояний (особенно нарушений поведения в ночное время), и эффективности эсзопиклона в терапии ночной бессонницы и кошмаров на фоне БП (N.Diederich, D.McIntyre, 2012).
Постинсультные состояния
Результаты исследований свидетельствуют о том, что мемантин обладает нейропротективным действием у больных после перенесенного инсульта. В частности, мемантин увеличивает секрецию BDNF, уменьшает секрецию воспалительных цитокинов и воспалительную активацию нейроглии с ее реактивным разрастанием, вызывает улучшение васкуляризации мозга, сопровождающееся параллельным улучшением сенсорной и моторной функции корковых отделов головного мозга (H.López-Valdés и соавт., 2014). В эксперименте также продемонстрировано, что мемантин может использоваться в качестве дополнительной терапии для повышения безопасности тромболизиса (A.Montagne и соавт., 2012). Показано, что мемантин накапливается в большом количестве в гематоме в ранний период экспериментального геморрагического инсульта у животных (S.Lee, 2006). Мемантин, введенный животным в раннем постинсультном периоде, значительно уменьшает воспалительную инфильтрацию и апоптоз нейронов в очаге повреждения.Как это обычно и происходит (за исключением тех случаев, когда полученные в доклинических испытаниях на животных результаты почему-либо не привлекли внимания других исследователей), полученные на животных положительные результаты послужили основанием для изучения эффективности мемантина при постинсультных состояниях у человека. Так, в одном двойном слепом РКИ у больных с ишемическим инсультом легкой или средней степени тяжести, больные получали по 20 мг/сут мемантина в качестве дополнительного к стандартной терапии средства, либо плацебо (H.Kafi и соавт., 2014). Те пациенты (29 человек), которые дополнительно получали мемантин, показали значительное улучшение неврологического статуса по сравнению с контрольной группой, в которой больные получали плацебо, т.е. только стандартную терапию (24 человека); p<0,001.
В другом РКИ российских исследователей, посвященном изучению эффективности мемантина в краткосрочном лечении в восстановительном периоде после ишемического инсульта, также наблюдался положительный эффект терапии мемантином, выразившийся в статистически достоверном улучшении памяти, концентрации внимания, психоэмоционального статуса (показателей депрессии и тревоги) по сравнению с плацебо; p<0,001 (С.В.Котов и соавт., 2005). В группу исследования вошли 38 больных с ишемическим инсультом, в контрольную группу вошел 31 пациент, который получал 20% раствор пирацетама по 10 мл внутривенно. Мемантин (в исследовании использовалась доза 20 мг/сут) больные принимали внутрь по схеме: 1-я неделя – 5 мг утром, 2-я неделя – 5 мг 2 раза в день (утром и днем), с 3-й недели и далее – 10 мг 2 раза в день. В другом исследовании, также изучавшем эффективность мемантина в восстановительном периоде после ишемического инсульта, отмечалось положительное влияние мемантина на частоту субъективно отмечаемых головных болей (ГБ), когнитивных и мнестических нарушений больных в постинсультном периоде, по сравнению с плацебо. Также наблюдалось статистически достоверное (p<0,001) улучшение объективных показателей памяти, концентрации внимания, психоэмоционального статуса (показателей шкал депрессии и тревоги). Кроме того, под влиянием мемантина отмечалась достоверная положительная динамика наблюдавшихся на электроэнцефалографии очаговых и диффузных патологических изменений, вызванных инсультом, что авторы связали с положительным влиянием мемантина на мозговой кровоток и метаболизм, особенно в корковых структурах и структурах ретикулярной формации (Е.В.Исакова и соавт., 2005).
Достаточно давно известно, что при повторных ишемических атаках, даже не приводящих к развитию ишемического инсульта, так называемых транзиторных ишемических атаках, на первый план в клинической картине могут выходить именно когнитивные нарушения, что в конечном итоге приводит к формированию картины, хорошо знакомой практическим врачам – картины дисциркуляторной энцефалопатии или сосудистой деменции. Эти когнитивные нарушения хорошо поддаются терапии мемантином (Н.В.Вахнина и соавт., 2005).
Черепно-мозговые травмы
Известно, что NMDA-опосредованная эксайтотоксичность играет важную роль в механизмах травматического повреждения мозга и в развивающемся при черепно-мозговых травмах (ЧМТ) воспалении нервной ткани. В современных экспериментах на животных (T.Kelestemur и соавт., 2016) показано, что мемантин в сочетании с мелатонином защищает мозг от травматического повреждения, при этом наблюдалось уменьшение фрагментации ДНК, уменьшение фосфорилирования и активации проапоптотического белка p38, снижение активности индуцируемой воспалением синтазы оксида азота (iNOS). Также в экспериментах на животных продемонстрировано, что мемантин обладает нейропротективным действием при экспериментальном субарахноидальном кровоизлиянии, что дает основания рассматривать мемантин как перспективный для изучения при ЧМТ терапевтический агент (C.Huang и соавт., 2015). Показано также, что мемантин значительно снижает оксидативный стресс и уровень перекисного окисления липидов у крыс с экспериментальной травмой черепа в группе лечения по сравнению с другой группой, получавшей плацебо; p<0,01 (H.Ozsüer и соавт., 2005).Это послужило основанием попытаться изучить эффективность мемантина при ЧМТ и у человека. С этой целью было проведено 24-недельное открытое сравнительное исследование, посвященное изучению эффективности, безопасности и переносимости мемантина (20 мг/сут) у 20 больных с когнитивными нарушениями в отдаленном периоде после перенесенных ЧМТ. В качестве препарата сравнения в контрольной группе (n=21) использовался пирацетам в дозе 2400 мг/сут. Результаты проведенного исследования показали статистически достоверное улучшение памяти, мышления, зрительно-пространственных функций, начиная с 12-й недели приема мемантина и в дальнейшем до окончания исследования, по сравнению с пирацетамом. В контрольной группе к концу 4-й недели приема пирацетама были отмечены нестойкое улучшение активности и внимания и тенденция к улучшению памяти. Переносимость лечения в обеих группах была хорошей (М.М.Одинак и соавт, 2005).
Мигрень
Глутамат играет важную роль в патофизиологии болевых синдромов, в том числе и мигрени (M.Bigal и соавт., 2008). В 12-недельном двойном слепом РКИ оценивали эффективность мемантина в качестве профилактического средства у больных с мигренью без ауры (R.Noruzzadeh и соавт., 2016). Мемантин назначался в дозе 10 мг/сут и сравнивался с плацебо. Показан положительный эффект этого препарата у 25 пациентов (p<0,001). В открытом исследовании мемантин положительно зарекомендовал себя при лечении резистентных форм мигрени у 28 пациентов (M.Bigal и соавт., 2008). Отмечено достоверное снижение интенсивности ГБ в течение 3 мес терапии мемантином в дозе 10–20 мг/сут (p<0,001). В другом ретроспективном исследовании, куда были включены 60 пациентов с мигренью, которые получали мемантин в качестве превентивной терапии в дозе 5–20 мг/сут, большинство пациентов в течение 2 мес терапии отмечали значительное улучшение, снижение частоты и интенсивности ГБ (A.Charles и соавт., 2007). Побочные эффекты при приеме мемантина были редкими и незначительными.Кластерная ГБ
При кластерной ГБ, редком виде первичных ГБ, отмечается повышенное содержание в крови и ликворе кинурениновой кислоты и других метаболитов кинуренинового пути метаболизма триптофана и повышенная активность NMDA-рецепторов (M.Curto и соавт., 2015). В открытом пилотном исследовании установлено, что мемантин оказывает положительный эффект при этой патологии, урежая приступы кластерной ГБ и снижая содержание кинурениновых метаболитов триптофана, а также гистамина и ряда воспалительных цитокинов в крови и ликворе на высоте приступа (M.Curto и соавт., 2015). Проведение РКИ затрудняется редкостью этой патологии, тем не менее авторы вышеупомянутой статьи призывают к изучению мемантина при кластерной ГБ в формате РКИ.ГБ напряжения
В двойном слепом РКИ мемантин, назначенный в дозе 20–40 мг/сут у 40 пациентов с хронической ГБ напряжения (ХГБН) в качестве профилактического средства, показал более высокую эффективность по сравнению с плацебо (p<0,001). Эффект проявлялся в снижении частоты и интенсивности приступов ГБ (K.Lindelof, L.Bendtsen, 2009).Фантомные, нейропатические и нейрогенные боли
В эксперименте на животных мемантин эффективно устраняет проявления винкристиновой полинейропатии, служащие экспериментальной моделью нейропатических болей как таковых (B.Park и соавт., 2010).В литературе имеется сообщение случая, описывающее 2 пациентов, у которых в результате серьезных травм нижних конечностей развились фантомные боли, резистентные к сильным опиоидам. Назначение мемантина принесло положительный результат в обоих случаях, причем без видимых побочных эффектов (R.Hackworth и соавт., 2008).
В двойном слепом РКИ у 19 пациентов, перенесших ампутацию верхней конечности и страдавших от фантомных болей, дополнительное назначение мемантина в дозе 20–30 мг/сут в раннем послеоперационном периоде привело к снижению потребления ропивакаина (который все пациенты получали в виде непрерывной инфузионной анестезии в плечевое сплетение) и к уменьшению интенсивности фантомных болей – 10 пациентов, по сравнению с плацебо – 9 пациентов (M.Schley и соавт., 2007).
Однако в небольшом открытом исследовании (8 пациентов) мемантин в дозе 30 мг/сут оказался неэффективным при лечении хронических фантомных болей (K.Wiech и соавт., 2004). А в еще одном РКИ, куда были включены 15 пациентов с хроническими фантомными болевыми синдромами длительностью от 1 года до 28 лет, развившимися после ампутации конечности, мемантин, назначенный в дозе 20 мг/сут, не показал большей эффективности по сравнению с плацебо (L.Nikolajsen и соавт., 2000).
Фибромиалгия
В двойном слепом РКИ показана эффективность мемантина при купировании болевого синдрома на фоне фибромиалгии (B.Olivan-Blázquez и соавт., 2014). Мемантин в дозе 20 мг/сут, назначенный в течение 1 мес у 63 пациенток с фибромиалгией, достоверно (p<0,001) снизил интенсивность боли по визуальной аналоговой шкале и по данным сфигмоманометра, по сравнению с плацеботерапией.Комплексный региональный болевой синдром
В ретроспективном исследовании, куда были включены 56 пациентов (34 женщины и 22 мужчины) с комплексным региональным болевым синдромом (КРБС), которые получали мемантин в стартовой дозе 5–10 мг/сут в течение 4–7 дней с последующим наращиванием дозы до 40–60 мг/сут в зависимости от переносимости, 13 (23,2%) пациентов дали полную ремиссию по болевому синдрому, а еще у 18 (32,1%) пациентов было достигнуто значительное улучшение. Таким образом, в сумме эффективность мемантина при этой патологии в данном исследовании составила 55,3% (M.Ahmad-Sabry, G.Shareghi, 2015).Немецкими авторами в небольшом открытом исследовании, куда были включены всего 3 пациента с КРБС, показана эффективность мемантина в течение 8 нед терапии (N.Sinis и соавт., 2006). Этими же авторами в другом небольшом открытом исследовании (6 пациентов) повторно показано, что мемантин оказывает положительное влияние на симптоматику КРБС; в обоих исследованиях эффект наблюдался у всех пациентов, что часто бывает при малых выборках (N.Sinis и соавт., 2007). Лечение мемантином этих больных в течение 6 нед привело к купированию болевого синдрома, сопровождавшемуся одновременным улучшением двигательных и вегетативных функций, уменьшением депрессии и тревожности.
Постгерпетическая невралгия и диабетическая полинейропатия
Двойное слепое РКИ, где мемантин назначался в дозе 10–20 мг/сут в течение 4 нед, не показало отличия эффективности мемантина при постгерпетической невралгии (ПГН) и болезненных диабетических полинейропатиях (ДПН) от плацебо (E.Eisenberg и соавт., 1998). В другом, более позднем, двойном слепом РКИ, где мемантин назначался уже в более высоких дозах (35–55 мг/сут), также не было показано отличия эффекта при назначении мемантина у больных с ПГН или ДПН от плацебо, в роли которого использовался лоразепам (C.Sang и соавт., 2002).Другие болевые синдромы
Достаточно давно известно, что гиперактивация NMDA-рецепторов играет важную роль в патогенезе таких проявлений центральных и спинальных болевых синдромов, как спонтанные приступы боли, гипералгезия и тактильная аллодиния. Поэтому мемантин может играть важную роль в комплексной патогенетической терапии различных болевых синдромов центрального и спинального генеза (В.А.Зинкевич и соавт., 2000).В двойном слепом РКИ (15 пациенток) показано, что назначение мемантина в составе комплексной премедикации перед мастэктомией по поводу рака молочной железы (РМЖ) или по другим показаниям, значительно уменьшает интенсивность послеоперационной боли и потребление анальгетиков по сравнению с плацебо; p<0,005 (V.Morel и соавт., 2016).
В другом двойном слепом РКИ, куда вошли 20 женщин с РМЖ, мемантин, назначенный в дозе 5–20 мг/сут в течение 4 нед, эффективно профилактировал развитие нейропатической боли после мастэктомии по сравнению с плацебо; p<0,005 (G.Pickering и соавт., 2014). Мемантин назначался с профилактической целью, и его прием начинался за 2 нед до предстоящей операции. В этом исследовании показано, что мемантин при РМЖ обладает не только анальгетической активностью, но и улучшает когнитивные функции пациенток (что важно в связи с тем, что применяемая при РМЖ химиотерапия и эстрогеновая блокада нередко вызывают существенное ухудшение когнитивного функционирования), что улучшало их качество жизни.
В экспериментальной модели люмбоишиалгии на животных (перевязка седалищного нерва) показано, что мемантин эффективно снижает вызываемую повреждением нерва гипералгезию, механическую аллодинию и тактильную гиперчувствительность как при однократном, так и при длительном его введении, особенно если введение мемантина начиналось одновременно с началом операции или предшествовало ей. В последующем, в открытом исследовании эффективности мемантина при дискогенных болях, люмбоишиалгиях, радикулоневритах у людей, показано, что мемантин в дозе 30–40 мг/сут (начальная доза 10 мг/сут с последующим наращиванием по переносимости) эффективен в составе комплексной терапии при всех видах дискогенных и корешковых болей, в качестве адъюванта к стандартной терапии (К.Т.Алиев, 2003).
Эпилепсия
Мемантин оказывает противосудорожное действие в экспериментах на животных, в частности, предотвращая или отсрочивая и уменьшая вызываемые применением каината, NMDA, пентилентетразола (коразола, кардиазола), стрихнина судороги у экспериментальных животных (A.Dhir, K.Chopra, 2015). Это неудивительно, если вспомнить, что механизм действия мемантина основан на связывании с магниевым сайтом NMDA-рецептора, и что противосудорожное действие препаратов магния известно давно, а гиперактивация NMDA-рецепторов (непосредственно, как при применении NMDA или стрихнина, каината, или косвенно, как при применении антагонистов g-аминомасляной кислоты вроде пентилентетразола или изониазида или при электростимуляции) играет ключевую роль в механизмах запуска припадка (A.Dhir, K.Chopra, 2015). Кроме того, мемантин уменьшает вызываемый повторными введениями судорожных ядов или повторными электростимуляциями киндлинг (облегчение возникновения повторных припадков по сравнению с первым) и уменьшает вызываемые судорожными припадками неблагоприятные морфологические изменения в лимбической системе и гиппокампе экспериментальных животных, дезориентацию и когнитивные нарушения после припадка (D.Vasil'ev и соавт., 2013).
Это послужило основанием для изучения эффективности мемантина при эпилепсии у людей. С этой целью было предпринято открытое проспективное неконтролируемое пилотное исследование эффективности добавления мемантина к стандартной противоэпилептической терапии в отношении коррекции когнитивных и поведенческих нарушений при эпилепсии. В описанном исследовании участвовали 50 пациентов с фокальными формами эпилепсии, у которых наблюдались симптомы когнитивного дефицита и/или поведенческие нарушения разной степени выраженности. Доза мемантина в этом исследовании составляла от 5 до 10 мг/сут в зависимости от переносимости препарата. Терапевтический эффект мемантина оценивался через 2 мес от начала лечения. В результате исследования зафиксировано статистически достоверное улучшение памяти и когнитивных функций больных фокальной эпилепсией по результатам тестов, а также положительное влияние мемантина на психическое состояние и поведение больных: уменьшение эксплозивности, раздражительности, показателей депрессии и тревоги (Ю.В.Соломатин и соавт., 2013).
Рассеянный склероз
Первоначально мемантин показал многообещающие результаты в экспериментальных моделях рассеянного склероза (РС) на животных (так называемый экспериментальный аутоиммунный энцефаломиелит), что неоднократно воспроизводилось и в более поздних экспериментах (G.Sulkowski и соавт., 2014).Это послужило основанием для дальнейшего изучения эффективности мемантина при РС в формате РКИ. Одно из таких исследований опубликовано в 2007 г. российскими учеными. В этом исследовании участвовали 26 пациентов с достоверно установленным диагнозом РС, все со вторично прогрессирующим типом течения болезни. Среди этих больных были 18 женщин и 8 мужчин (что, в целом, адекватно отражает более высокую заболеваемость РС в популяции среди лиц женского пола в соотношении примерно 2:1 и их преобладание среди обращающихся за помощью по поводу РС больных). Средний возраст вошедших в исследование больных составлял 38,1±8,8 года. Длительность исследования составила 9 мес в самом исследовании (рандомизированной плацебо-контролируемой его фазе) и еще 12 мес в открытой фазе после его завершения. В этом исследовании использовалась доза мемантина 20 мг/сут, а схема наращивания была следующей: в 1-ю неделю больные получали 5 мг мемантина утром, со 2-й недели – 5 мг утром и 5 мг в обед, с 3-й недели – 10 мг утром и 5 мг в обед, с 4-й недели и далее – 20 мг/сут в 2 приема, по 10 мг утром и в обед. При этом были получены следующие результаты: мемантин, согласно данным российских исследователей, достоверно отличался от плацебо по показателям улучшения рабочей (кратковременной) памяти, слухоречевой и зрительной долговременной памяти, самоконтроля, психического статуса (в частности, настроения и уровня тревожности). У ряда больных объективно регистрируемое улучшение также сопровождалось субъективным ощущением уменьшения утомляемости, повышения общего жизненного тонуса и активности (Н.Ф.Булдакова и соавт., 2007).
Однако в недавнем двойном слепом РКИ у 50 пациентов с РС и когнитивными нарушениями мемантин в дозе 20 мг/сут не показал эффективности по сравнению с плацебо. Кроме того, мемантин хуже переносился (L.Peyro Saint Paul и соавт., 2016). Такой же отрицательный результат получен в другом двойном слепом РКИ, где больные с РС и когнитивными нарушениями получали мемантин в дозе 10 мг/сут с последующим титрованием дозы до 20 мг/сут еще в течение 12 нед. Ни по одному из изучавшихся в этом исследовании параметров эффект не отличался от плацебо (J.Lovera и соавт., 2010). Также эффективность мемантина не подтверждена в другом РКИ, где прицельно оценивали влияние этого препарата на проявления спастичности и пластичность движений при РС (L.Mehta и соавт., 2010). Более того, в некоторых исследованиях показали, что в высокой дозе (30 мг/сут) мемантин способен приводить к (временному и обратимому) неврологическому ухудшению при РС (P.Villoslada и соавт., 2009).
Кохрановский метаобзор от 2013 г., посвященный фармакологическому лечению когнитивных нарушений при РС (учитывающий в том числе и приведенные выше данные от 2010 г.), менее категоричен: в нем утверждается лишь, что существует умеренного качества доказательная база, показывающая отсутствие отличия от плацебо у 10 мг/сут донепезила при лечении когнитивных нарушений при РС, а о мемантине и амантадине не утверждается ничего (ни об их эффективности, ни их неэффективности), а лишь отмечается их хорошая переносимость и безопасность при РС, малое количество побочных эффектов, и констатируется необходимость более масштабных и методологически корректных исследований по антидементным препаратам (в том числе мемантину) при РС (D.He и соавт., 2013). Учитывая практически полное отсутствие эффективных методов устранения когнитивных нарушений при РС, применение мемантина при этой патологии в качестве «терапии отчаяния» нельзя считать полностью необоснованным.
Одной исследовательской группой выдвинуто предположение, что селективная блокада NR2B подтипа NMDA-рецепторов, в наибольшей мере ответственных за воспаление, эксайтотоксичность и когнитивные нарушения, может быть более перспективным подходом в лечении РС, чем неспецифическая блокада NMDA-рецепторов как таковых, осуществляемая мемантином. Это подтверждается в экспериментальной модели на животных; надо отметить, что селективные антагонисты NR2B подтипа NMDA-рецепторов в настоящее время проходят клинические испытания II фазы по другим показаниям – депрессивные состояния, деменции (M.Farjam и соавт., 2014).
Болезнь Хантингтона
Изначально положительное действие мемантина на симптоматику болезни Хантингтона (БХ) обнаружили в экспериментальных моделях БХ на мышах. Кроме положительного влияния на поведение, моторные и когнитивные функции трансгенных животных, в культурах клеток мозга мышей этой экспериментальной линии мемантин уменьшал проявления апоптоза и эксайтотоксичности и нарушения синапсообразования, вызываемые аномальным белком хантингтином (A.Milnerwood и соавт., 2012; A.Dau и соавт., 2014; R.Carter и соавт., 2014).В небольшом открытом пилотном исследовании, в котором участвовали 4 больных, авторы показали, что мемантин при БХ не только способствует торможению прогрессирования специфической БХ-ассоциированной деменции, но и улучшает моторную функцию больных, уменьшает дискинезии, нарушения поведения, депрессивную и тревожную симптоматику. Кроме того, при изучении действия мемантина на церебральный кровоток и метаболизм у больных с БХ при помощи позитронно-эмиссионной томографии с 18F-фтордезоксиглюкозой показано, что назначение мемантина приводит к улучшению кровотока и потребления глюкозы в пораженных болезнью базальных ядрах (L.Hjermind и соавт., 2011). Один из этих четырех больных, выбравший продолжение терапии мемантином и после завершения исследования, не имел признаков клинического ухудшения и через 18 мес после окончания 4-месячного исследования, в то время как у других трех больных, прекративших прием мемантина после 3–4 мес терапии, уже к сроку 12 мес после исследования определялись клинически заметные ухудшения как в отношении когнитивного функционирования, так и в отношении моторных функций и психического статуса (L.Hjermind и соавт., 2011). В другом пилотном исследовании, в котором участвовали 18 больных БХ, также у большинства (более 2/3) был достигнут положительный эффект при лечении мемантином как в отношении когнитивных функций, так и моторики, самообслуживания, психического статуса. При этом мемантин хорошо переносится больными с БХ, имеет мало побочных эффектов. Важно отметить, что среди ответивших на лечение мемантином было двое больных с генетически особенно тяжелыми формами БХ, имевших более 80 повторов в гене белка хантингтина и раннее начало болезни, в подростковом возрасте (W.Ondo и соавт., 2007). Еще одно открытое исследование, включавшее 27 больных с БХ, было длительным (более 2 лет) и показало, что мемантин (применявшийся в этом исследовании в дозах до 30–40 мг/сут), по-видимому, способен тормозить прогрессирование БХ (A.Beister и соавт., 2004). Авторы этого исследования призывают изучить мемантин при БХ в формате многоцентрового РКИ.
Описан также интересный клинический случай, когда добавление мемантина (5 мг/сут с постепенной титрацией до 20 мг/сут) помогло снять проявления психоза, не полностью поддававшиеся терапии рисперидоном (4–6 мг/сут), одновременно улучшив настроение, моторные функции, способность к самообслуживанию и когнитивное функционирование 32-летней больной с тяжелой формой БХ (E.Cankurtaran и соавт., 2006). На протяжении
6 мес наблюдения данная больная, продолжавшая получать мемантин и рисперидон, не проявляла признаков прогрессирования болезни, ухудшения когнитивного или моторного функционирования или возобновления психоза (E.Cankurtaran и соавт., 2006).
Амиотрофический боковой склероз
В патогенезе амиотрофического бокового склероза (АБС) большую роль играет нарушение глутаматергической нейротрансмиссии и эксайтотоксичность глутамата. В качестве одного из немногих средств, эффективных при АБС, Американским агентством по контролю за лекарственными средствами и продуктами (FDA) утверждено антиглутаматергическое средство рилузол. В свете этого неудивительно, что предпринимались попытки использовать и при этой патологии антагонист NMDA-рецепторов мемантин. При этом в открытых пилотных исследованиях были получены многообещающие предварительные результаты как в отношении улучшения когнитивного функционирования, настроения, общего самочувствия больных с АБС, так и в отношении более специфичных для АБС проявлений, таких, как боль, мышечная слабость, спастичность и др. (K.Jain, 2000; S.Sonkusare и соавт., 2005). Однако в РКИ II/III фазы официальных клинических испытаний мемантина при АБС, он не показал какой-либо эффективности при этой патологии ни по одному из изучавшихся исследователями параметров (когнитивное функционирование, объективные нейрофизиологические показатели, сила мышц, волюметрия легких и т.д.). В то же время исследователи не смогли исключить (как, впрочем, и убедительно доказать) того, что мемантин, возможно, оказывает небольшое положительное влияние на продолжительность жизни (выживаемость) больных с АБС (M.de Carvalho и соавт., 2010). Учитывая, сколь ограничены наши возможности помочь этим больным, применение мемантина при этой патологии в качестве «терапии отчаяния» не выглядит необоснованным, несмотря на отсутствие эффекта в РКИ по изучавшимся параметрам.Детский церебральный паралич и другие спастические и экстрапирамидные синдромы
 Еще в самом начале клинического применения мемантина, в начале 1980-х годов, было обращено внимание на его способность снижать спастичность мышц у больных с детским церебральным параличом (ДЦП), последствиями ЧМТ, постинсультными спастическими параличами и экстрапирамидными нарушениями (H.Rohde, 1982). При этом отмечалось также улучшение когнитивного функционирования и настроения у больных с ДЦП и другими спастическими синдромами (H.Rohde, 1982). В более позднем открытом исследовании, посвященном изучению эффективности адъювантного лечения мемантином после стереотаксических хирургических вмешательств на мозге, производившихся с целью симптоматического лечения тяжелых экстрапирамидных и спастических расстройств (в том числе ДЦП, последствий ЧМТ и др.), это наблюдение об эффективности мемантина в устранении спастичности при ДЦП и других подобных синдромах также подтвердилось (F.Mundinger, E.Milios, 1985). Эффективность мемантина, наряду с дантроленом, центральными миорелаксантами типа баклофена и тизанидина, в устранении спастичности мышц при ДЦП, последствиях инсультов и ЧМТ и, возможно, даже при РС, продемонстрирована в открытом исследовании российскими учеными (D.Kasatkin, 2008).
Еще в самом начале клинического применения мемантина, в начале 1980-х годов, было обращено внимание на его способность снижать спастичность мышц у больных с детским церебральным параличом (ДЦП), последствиями ЧМТ, постинсультными спастическими параличами и экстрапирамидными нарушениями (H.Rohde, 1982). При этом отмечалось также улучшение когнитивного функционирования и настроения у больных с ДЦП и другими спастическими синдромами (H.Rohde, 1982). В более позднем открытом исследовании, посвященном изучению эффективности адъювантного лечения мемантином после стереотаксических хирургических вмешательств на мозге, производившихся с целью симптоматического лечения тяжелых экстрапирамидных и спастических расстройств (в том числе ДЦП, последствий ЧМТ и др.), это наблюдение об эффективности мемантина в устранении спастичности при ДЦП и других подобных синдромах также подтвердилось (F.Mundinger, E.Milios, 1985). Эффективность мемантина, наряду с дантроленом, центральными миорелаксантами типа баклофена и тизанидина, в устранении спастичности мышц при ДЦП, последствиях инсультов и ЧМТ и, возможно, даже при РС, продемонстрирована в открытом исследовании российскими учеными (D.Kasatkin, 2008).Однако следует отметить, что РКИ по применению мемантина в качестве антиспастического агента при ДЦП и других спастических состояниях центрального генеза не проводились, а установленная в частности и российскими исследователями в открытых исследованиях эффективность мемантина как антиспастического агента при РС позже не получила подтверждения в РКИ (о чем упоминалось в разделе, посвященном применению мемантина при РС).
Злокачественные глиомы мозга
Высвобождение глутамата из клеток злокачественной глиомы повышено по сравнению с нормальными клетками нейроглии. Показано, что избыточная секреция глутамата клетками опухоли ускоряет рост соседних клеток и применение мемантина, ламотриджина, декстрометорфана, малых доз кетамина (MK-801) способно тормозить рост опухолевых клеток глиомы в культуре, а также экспериментальных глиом у мышей. Предложено провести клинические испытания адъювантного применения антиглутаматергических агентов при злокачественных глиомах, в комбинации с химиотерапией и облучением центральной нервной системы – ЦНС (T.Takano и соавт., 2001). В настоящее время проводится несколько РКИ антиглутаматергических агентов (в том числе мемантина, сульфасалазина, ламотриджина) в комбинации с химиотерапией и облучением ЦНС при злокачественных глиомах (S.Blecic и соавт., 2013).Выводы
 Мемантин обладает широким спектром активности при разных неврологических заболеваниях, однако доказательная база для его применения при различных патологиях нервной системы неодинакова по качеству. В число наиболее хорошо доказанных эффектов мемантина входит его анальгетическая активность при таких болевых синдромах, как мигрень, фибромиалгия, ХГБН, нейропротективная и прокогнитивная активность при постинсультных состояниях, ЧМТ, а также положительное влияние на различные (как моторные, так и немоторные) проявления БП. По некоторым другим неврологическим заболеваниям, например БХ, доступны лишь данные открытых исследований. А по таким патологиям, как РС или ПГН, мемантин не показал достоверного отличия от плацебо (см. таблицу).
Мемантин обладает широким спектром активности при разных неврологических заболеваниях, однако доказательная база для его применения при различных патологиях нервной системы неодинакова по качеству. В число наиболее хорошо доказанных эффектов мемантина входит его анальгетическая активность при таких болевых синдромах, как мигрень, фибромиалгия, ХГБН, нейропротективная и прокогнитивная активность при постинсультных состояниях, ЧМТ, а также положительное влияние на различные (как моторные, так и немоторные) проявления БП. По некоторым другим неврологическим заболеваниям, например БХ, доступны лишь данные открытых исследований. А по таким патологиям, как РС или ПГН, мемантин не показал достоверного отличия от плацебо (см. таблицу).Сведения об авторах
Беккер Роман Александрович – исследователь в области психофармакотерапии, Университет им. Давида Бен-Гуриона в Негеве
Быков Юрий Витальевич – ФГБОУ ВО СтГМУ. E-mail: yubykov@gmail.com
Список исп. литературыСкрыть список1. Алиев К.Т. Клиническая эффективность мемантина при спондилогенных болевых синдромах в пояснице и нижних конечностях. Автореф. дис. … канд. мед. наук. ФГБОУ ВО «Первый СПбГМУ им. акад. И.П.Павлова». СПб., 2003. / Aliev K.T. Klinicheskaia effektivnost' memantina pri spondilogennykh bolevykh sindromakh v poiasnitse i nizhnikh konechnostiakh. Avtoref. dis. … kand. med. nauk. FGBOU VO «Pervyi SPbGMU im. akad. I.P.Pavlova». SPb., 2003. [in Russian]
2. Булдакова Н.Ф., Мугутдинова Б.Т., Овчаров В.В. и др. Диагностика и лечение когнитивных нарушений при рассеянном склерозе. Consilium Medicum. 2007; 8 (9): 53–6. / Buldakova N.F., Mugutdinova B.T., Ovcharov V.V. i dr. Diagnostika i lechenie kognitivnykh narushenii pri rasseiannom skleroze. Consilium Medicum. 2007; 8 (9): 53–6. [in Russian]
3. Вахнина Н.В., Парфенов В.А., Никитина Л.Ю. Когнитивные нарушения при инсульте и их лечение мемантином. Клин. геронтология. 2005; 8 (11): 49–52. / Vakhnina N.V., Parfenov V.A., Nikitina L.Iu. Kognitivnye narusheniia pri insul'te i ikh lechenie memantinom. Klin. gerontologiia. 2005; 8 (11): 49–52. [in Russian]
4. Зинкевич В.А., Графова В.Н., Кукушкин М.Л., Киселев А.В. Эффекты акатинола (мемантина) при центрально-спинальном болевом синдроме. Бюл. эксперим. биологии и медицины. 2000; 5: 500–3. / Zinkevich V.A., Grafova V.N., Kukushkin M.L., Kiselev A.V. Effekty akatinola (memantina) pri tsentral'no-spinal'nom bolevom sindrome. Biul. eksperim. biologii i meditsiny. 2000; 5: 500–3.
[in Russian]
5. Исакова Е.В., Котов С.В., Чатаева Г.С. Акатинол мемантин при хронической ишемии головного мозга. Альманах клинической медицины. 2005; 8–3: 143–7. / Isakova E.V., Kotov S.V., Chataeva G.S. Akatinol memantin pri khronicheskoi ishemii golovnogo mozga. Al'manakh klinicheskoi meditsiny. 2005; 8–3: 143–7. [in Russian]
6. Котов С.В., Исакова Е.В., Чатаева Г.С., Прохорова Н.В. Акатинол мемантин в лечении больных ишемическим инсультом. Психиатрия и психофармакотерапия. 2005; 06: 343–5. / Kotov S.V., Isakova E.V., Chataeva G.S., Prokhorova N.V. Akatinol memantin v lechenii bol'nykh ishemicheskim insul'tom. Psychiatry and Psychopharmacotherapy. 2005; 06: 343–5. [in Russian]
7. Одинак М.М., Литвиненко И.В., Емелин А.Ю. Открытое сравнительное исследование эффективности мемантина в терапии посттравматических когнитивных расстройств. Неврол. журн. 2005; 6 (10): 32–8. / Odinak M.M., Litvinenko I.V., Emelin A.Iu. Otkrytoe sravnitel'noe issledovanie effektivnosti memantina v terapii posttravmaticheskikh kognitivnykh rasstroistv. Nevrol. zhurn. 2005; 6 (10): 32–8. [in Russian]
8. Соломатин Ю.В., Курбатова В.В., Сердюк И.Е. и др. Опыт применения препарата мемантин у больных с фокальной эпилепсией и когнитивными нарушениями. Эпилепсия и пароксизмальные состояния. 2013; 2 (5): 11–7. / Solomatin Yu.V., Kurbatova V.V., Serdiuk I.E. i dr. Opyt primeneniia preparata memantin u bol'nykh s fokal'noi epilepsiei i kognitivnymi narusheniiami. Epilepsiia i paroksizmal'nye sostoianiia. 2013; 2 (5): 11–7. [in Russian]
9. Ahmad-Sabry MH, Shareghi G. Effects of memantine on pain in patients with complex regional pain syndrome – a retrospective study. Middle East J Anaesthesiol 2015; 23 (1): 51–4.
10. Beister A, Kraus P, Kuhn W et al. The N-methyl-D-aspartate antagonist memantine retards progression of Huntington's disease. J Neural Transm 2004; (Suppl.) 68: 117–22.
11. Bigal M, Rapoport A, Sheftell F et al. Memantine in the preventive treatment of refractory migraine. Headache 2008; 48 (9): 1337–42.
12. Blecic S, Rynkowski M, De Witte O et al. Glutamate and malignant gliomas, from epilepsia to biological aggressiveness: therapeutic implications. (Article in French). Bull Cancer. 2013; 100 (9): 829–35.
13. Cankurtaran ES, Ozalp E, Soygur H et al. Clinical experience with risperidone and memantine in the treatment of Huntington's disease. J Natl Med Assoc 2006; 98 (8): 1353–5.
14. Carter RL, Chen Y, Kunkanjanawan T et al. Reversal of cellular phenotypes in neural cells derived from Huntington's disease monkey-induced pluripotent stem cells. Stem Cell Reports 2014; 3 (4): 585–93.
15. Charles A, Flippen C, Romero Reyes M, Brennan KC. Memantine for prevention of migraine: a retrospective study of 60 cases. J Headache Pain 2007; 8 (4): 248–50.
16. Curto M, Lionetto L, Negro A et al. Altered serum levels of kynurenine metabolites in patients affected by cluster headache. J Headache Pain 2015; 17 (1): 27.
17. Dau A, Gladding CM, Sepers MD et al. Chronic blockade of extrasynaptic NMDA receptors ameliorates synaptic dysfunction and pro-death signaling in Huntington disease transgenic mice. Neurobiol Dis 2014; 62: 533–42.
18. De Carvalho M, Pinto S, Costa J et al. A randomized, placebo-controlled trial of memantine for functional disability in amyotrophic lateral sclerosis. Amyotroph Lateral Scler 2010; 11 (5): 456–60.
19. Dhir A, Chopra K. Memantine delayed N-methyl-D-aspartate – induced convulsions in neonatal rats. Fundam Clin Pharmacol 2015; 29 (1): 72–8.
20. Diederich NJ, McIntyre DJ. Sleep disorders in Parkinson's disease: many causes, few therapeutic options. J Neurol Sci 2012; 314 (1–2): 12–9.
21. Eisenberg E, Kleiser A, Dortort A et al. The NMDA (N-methyl-D-aspartate) receptor antagonist memantine in the treatment of postherpetic neuralgia: a double-blind, placebo-controlled study. Eur J Pain 1998; 2 (4): 321–7.
22. Elbers RG, Verhoef J, van Wegen EE et al. Interventions for fatigue in Parkinson's disease. Cochrane Database Syst Rev 2015; (10): CD010925.
23. Farjam M, Beigi Zarandi FB, Farjadian S et al. Inhibition of NR2B-Containing N-methyl-D-Aspartate Receptors (NMDARs) in Experimental Autoimmune Encephalomyelitis, a Model of Multiple Sclerosis. Iran J Pharm Res 2014; 13 (2): 695–705.
24. Hackworth RJ, Tokarz KA, Fowler IM et al. Profound pain reduction after induction of memantine treatment in two patients with severe phantom limb pain. Anesth Analg 2008; 107 (4): 1377–9.
25. He D, Zhang Y, Dong S et al. Pharmacological treatment for memory disorder in multiple sclerosis. Cochrane Database Syst Rev 2013; 12: CD008876.
26. Hindle JV. The practical management of cognitive impairment and psychosis in the older Parkinson's disease patient. J Neural Transm (Vienna) 2013; 120 (4): 649–53.
27. Hjermind LE, Law I, Jonch A et al. Huntington's disease: effect of memantine on FDG-PET brain metabolism? J Neuropsychiatry Clin Neurosci 2011; 23 (2): 206–10.
28. Huang CY, Wang LC, Wang HK et al. Memantine alleviates brain injury and neurobehavioral deficits after experimental subarachnoid hemorrhage. Mol Neurobiol 2015; 51 (3): 1038–52.
29. Jain KK. Evaluation of memantine for neuroprotection in dementia. Expert Opin Investig Drugs 2000; 9 (6): 1397–406.
30. Kafi H, Salamzadeh J, Beladimoghadam N et al. Study of the neuroprotective effects of memantine in patients with mild to moderate ischemic stroke. Iran J Pharm Res 2014; 13 (2): 591–8.
31. Kasatkin DS. Pathogenetic therapy of spasticity. (Article in Russian). Zh Nevrol Psikhiatr Im SS Korsakova 2008; 108 (3): 80–5.
32. Kelestemur T, Yulug B, Caglayan AB et al. Targeting different pathophysiological events after traumatic brain injury in mice: Role of melatonin and memantine. Neurosci Lett 2016; 612: 92–7.
33. Lee ST, Chu K, Jung KH et al. Memantine reduces hematoma expansion in experimental intracerebral hemorrhage, resulting in functional improvement. J Cereb Blood Flow Metab 2006; 26 (4): 536–44.
34. Leroi I, Atkinson R, Overshott R. Memantine improves goal attainment and reduces caregiver burden in Parkinson's disease with dementia. Int J Geriatr Psychiatry 2014; 29 (9): 899–905.
35. Lindelof K, Bendtsen L. Memantine for prophylaxis of chronic tension-type headache – a double-blind, randomized, crossover clinical trial. Cephalalgia 2009; 29 (3): 314–21.
36. López-Valdés HE, Clarkson AN, Ao Y et al. Memantine enhances recovery from stroke. Stroke 2014; 45 (7): 2093–100.
37. Lovera JF, Frohman E, Brown TR et al. Memantine for cognitive impairment in multiple sclerosis: a randomized placebo-controlled trial. Mult Scler 2010; 16 (6): 715–23.
38. Mehta LR, McDermott MP, Goodman AD, Schwid SR. A randomized trial of memantine as treatment for spasticity in multiple sclerosis. Mult Scler 2010; 16 (2): 248–51.
39. Milnerwood AJ, Kaufman AM, Sepers MD et al. Mitigation of augmented extrasynaptic NMDAR signaling and apoptosis in cortico-striatal co-cultures from Huntington's disease mice. Neurobiol Dis 2012; 48 (1): 40–51.
40. Moreau C, Delval A, Tiffreau V et al. Memantine for axial signs in Parkinson's disease: a randomised, double-blind, placebo-controlled pilot study. J Neurol Neurosurg Psychiatry 2013; 84 (5): 552–5.
41. Morel V, Joly D, Villatte C et al. Memantine before Mastectomy Prevents Post-Surgery Pain: A Randomized, Blinded Clinical Trial in Surgical Patients. PLoS One 2016; 11 (4): e0152741.
42. Mundinger F, Milios E. Experiences with memantine in the treatment of severe spastic and extrapyramidal movement disorders in combination with stereotaxic surgery. (Article in German). Nervenarzt 1985; 56 (2): 106–9.
43. Nikolajsen L, Gottrup H, Kristensen AG, Jensen TS. Memantine (a N-methyl-D-aspartate receptor antagonist) in the treatment of neuropathic pain after amputation or surgery: a randomized, double-blinded, cross-over study. Anesth Analg 2000; 91 (4): 960–6.
44. Noruzzadeh R, Modabbernia A, Aghamollaii V et al. Memantine for Prophylactic Treatment of Migraine Without Aura: A Randomized Double-Blind Placebo-Controlled Study. Headache 2016; 56 (1): 95–103.
45. Olivan-Blázquez B, Herrera-Mercadal P, Puebla-Guedea M et al. Efficacy of memantine in the treatment of fibromyalgia: A double-blind, randomised, controlled trial with 6-month follow-up. Pain 2014; 155 (12): 2517–25.
46. Ondo WG, Mejia NI, Hunter CB. A pilot study of the clinical efficacy and safety of memantine for Huntington's disease. Parkinsonism Relat Disord 2007; 13 (7): 453–4.
47. Ondo WG, Shinawi L, Davidson A et al. Memantine for non-motor features of Parkinson's disease: a double-blind placebo controlled exploratory pilot trial. Parkinsonism Relat Disord 2011; 17 (3): 156–9.
48. Ozsüer H, Görgülü A, Kiriş T, Cobanoğlu S. The effects of memantine on lipid peroxidation following closed-head trauma in rats. Neurosurg Rev 2005; 28 (2): 143–7.
49. Park BY, Park SH, Kim WM et al. Antinociceptive Effect of Memantine and Morphine on Vincristine-induced Peripheral Neuropathy in Rats. Korean J Pain 2010; 23 (3): 179–85.
50. Peyro Saint Paul L, Creveuil C1, Heinzlef O et al. Efficacy and safety profile of memantine in patients with cognitive impairment in multiple sclerosis: A randomized, placebo-controlled study. J Neurol Sci 2016; 363: 69–76.
51. Pickering G, Morel V, Joly D et al. Prevention of post-mastectomy neuropathic pain with memantine: study protocol for a randomized controlled trial. Trials 2014; 15: 331.
52. Rohde H. Results of clinical trials of the antispasmodic agent memantine. (Article in German). Fortschr Med 1982; 100 (43): 2023–6.
53. Sang CN, Booher S, Gilron I et al. Dextromethorphan and memantine in painful diabetic neuropathy and postherpetic neuralgia: efficacy and dose-response trials. Anesthesiology 2002; 96 (5): 1053–61.
54. Schley M, Topfner S, Wiech K et al. Continuous brachial plexus blockade in combination with the NMDA receptor antagonist memantine preventsphantom pain in acute traumatic upper limb amputees. Eur J Pain. 2007; 11 (3): 299–308.
55. Sinis N, Birbaumer N, Gustin S et al. Memantine treatment of complex regional pain syndrome: a preliminary report of six cases. Clin J Pain 2007; 23 (3): 237–43.
56. Sinis N, Birbaumer N, Schwarz A et al. Memantine and Complex Regional Pain Syndrome (CRPS): effects of treatment and cortical reorganisation. (Article in German). Handchir Mikrochir Plast Chir 2006; 38 (3): 164–71.
57. Sonkusare SK, Kaul CL, Ramarao P. Dementia of Alzheimer's disease and other neurodegenerative disorders-memantine, a new hope. Pharmacol Res 2005; 51 (1): 1–17.
58. Sulkowski G, Dąbrowska-Bouta B, Salińska E et al. Modulation of glutamate transport and receptor binding by glutamate receptor antagonists in EAE rat brain. PLoS One 2014; 9 (11): e113954.
59. Takano T, Lin JH, Arcuino G et al. Glutamate release promotes growth of malignant gliomas. Nat Med 2001; 7 (9): 1010–5.
60. Varanese S, Howard J, Di Rocco A. NMDA antagonist memantine improves levodopa-induced dyskinesias and on-off phenomena in Parkinson's disease. Mov Disord 2010; 25 (4): 508–10.
61. Vasil'ev DS, Tumanova NL, Lavrent'eva VV et al. The ability of NMDA glutamate receptor blockers to prevent a pentylenetetrazole kindling in mice and morphological changes in the hippocampus. (Article in Russian). Ross Fiziol Zh Im IM Sechenova 2013; 99 (9): 1023–35.
62. Vidal EI, Fukushima FB, Valle AP et al. Unexpected improvement in levodopa-induced dyskinesia and on-off phenomena after introduction of memantine for treatment of Parkinson's disease dementia. J Am Geriatr Soc 2013; 61 (1): 170–2.
63. Villoslada P, Arrondo G, Sepulcre J et al. Memantine induces reversible neurologic impairment in patients with MS. Neurology 2009; 72 (19): 1630–3.
64. Wesnes KA, Aarsland D, Ballard C et al. Memantine improves attention and episodic memory in Parkinson's disease dementia and dementia with Lewy bodies. Int J Geriatr Psychiatry 2015; 30 (1): 46–54.
65. Wiech K, Kiefer RT, Töpfner S et al. A placebo-controlled randomized crossover trial of the N-methyl-D-aspartic acid receptor antagonist, memantine, in patients with chronic phantom limb pain. Anesth Analg 2004; 98 (2): 408–13.

