Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№06 2017
Пролонгированные антипсихотики компании «Янссен» в историческом разрезе: прошлое, настоящее, будущее №06 2017
Номера страниц в выпуске:18-27
В данной статье мы рассказываем читателю об истории создания пролонгированных антипсихотиков компании «Янссен» в контексте общей истории психофармакологии, а затем проводим сопоставление всех имеющихся на рынке пролонгированных форм антипсихотиков, обобщая данные о них в табличной форме. Кроме того, мы также приоткрываем завесу тайны над будущим сверхпролонгированных антипсихотиков и дальнейшими планами компании «Янссен».
Ключевые слова: компания «Янссен», антипсихотик, шизофрения, история психофармакологии, пролонгированный антипсихотик, галоперидол, галоперидола деканоат, пимозид, рисперидон, Рисполепт, Рисполепт Конста, палиперидон, палиперидона пальмитат, Инвега, Ксеплион, Тревикта.
Для цитирования: Беккер Р.А., Быков Ю.В. Пролонгированные антипсихотики фирмы «Янссен» в историческом разрезе: прошлое, настоящее, будущее. Психиатрия и психофармакотерапия. 2017; 19 (6): 18–27.
Ключевые слова: компания «Янссен», антипсихотик, шизофрения, история психофармакологии, пролонгированный антипсихотик, галоперидол, галоперидола деканоат, пимозид, рисперидон, Рисполепт, Рисполепт Конста, палиперидон, палиперидона пальмитат, Инвега, Ксеплион, Тревикта.
Для цитирования: Беккер Р.А., Быков Ю.В. Пролонгированные антипсихотики фирмы «Янссен» в историческом разрезе: прошлое, настоящее, будущее. Психиатрия и психофармакотерапия. 2017; 19 (6): 18–27.
В данной статье мы рассказываем читателю об истории создания пролонгированных антипсихотиков компании «Янссен» в контексте общей истории психофармакологии, а затем проводим сопоставление всех имеющихся на рынке пролонгированных форм антипсихотиков, обобщая данные о них в табличной форме. Кроме того, мы также приоткрываем завесу тайны над будущим сверхпролонгированных антипсихотиков и дальнейшими планами компании «Янссен».
Ключевые слова: компания «Янссен», антипсихотик, шизофрения, история психофармакологии, пролонгированный антипсихотик, галоперидол, галоперидола деканоат, пимозид, рисперидон, Рисполепт, Рисполепт Конста, палиперидон, палиперидона пальмитат, Инвега, Ксеплион, Тревикта.
Для цитирования: Беккер Р.А., Быков Ю.В. Пролонгированные антипсихотики фирмы «Янссен» в историческом разрезе: прошлое, настоящее, будущее. Психиатрия и психофармакотерапия. 2017; 19 (6): 18–27.
1David Ben-Gurion University in Negev. 8410501, Israel, Be'er Sheva;
2Stavropol State Medical University of the Ministry of Health of the Russian Federation. 355017, Russian Federation, Stavropol, ul. Mira, d. 310yubykov@gmail.com
In this article, we will tell the reader about the history of the development of long-acting antipsychotics (LAIs) made by Janssen company in the context of the general history of psychopharmacology. Then we perform a thorough comparative analysis and comparison of all commercially available LAIs, summarizing data on them in the tables. Additionally, we also describe the future of ultra-prolonged LAIs and further plans of Janssen company.
Key words: Janssen company, antipsychotic, schizophrenia, history of psychopharmacology, long-acting antipsychotic, haloperidol, haloperidol decanoate, pimozide, risperidone, Risperdal, Risperdal Consta, paliperidone, paliperidone palmitate, Invega, Invega Sustenna, Invega Trinza.
For citation: Bekker R.A., Bykov Yu.V. Long-acting antipsychotics made by Janssen: their history, their current value and the future. Psychiatry and Psychopharmacotherapy. 2017; 19 (6): 18–27.
Общие исторические сведения
Исследуя галоперидол на животных, П.Янссен и Б.Херманс обратили внимание, что он не слишком эффективен как анальгетик и не вызывает у мышей характерного для опиоидных анальгетиков возбуждения в первой фазе действия (отражающего опиоидную эйфорию), почти не угнетает дыхание и перистальтику кишечника (что также должно было быть характерным проявлением действия опиоидов), но зато вызывает у мышей сонливость, седацию, оглушенность, безразличие к внешним стимулам и каталепсию (восковую гибкость). Как уже было известно, подобные эффекты вызывают у животных большие дозы хлорпромазина. Мыши П.Янссена после введения галоперидола выглядели совершенно так же, как обработанные большой дозой хлорпромазина, притом проявляли даже более сильную каталепсию при меньшей степени седации и сонливости и меньшей выраженности гипотензии и тахикардии (J.Moncrieff, 2013).
Важно подчеркнуть, что, хотя галоперидол изначально был открыт П.Янссеном случайно (так же как ранее случайно был открыт хлорпромазин), в процессе поисков нового, более эффективного, чем меперидин, синтетического опиоидного анальгетика, фармакологический гений П.Янссена проявился именно в том, что он сумел правильно оценить значение своего открытия и продолжить разработку этого препарата. В 1957 г. рыночные перспективы психофармакологических препаратов были еще далеко не так очевидны, как сегодня, и множество перспективных препаратов разных фирм были либо недооценены и на длительное время отложены (как это произошло уже в начале 1960-х годов с только что синтезированным клозапином), либо вообще забыты, положены на полку (J.Moncrieff, 2013).
В то время уже было известно, что симптомы отравления амфетамином и кокаином в некоторых аспектах схожи с симптомами шизофрении, и амфетаминовый либо кокаиновый психоз был предложен в качестве экспериментальных моделей шизофрении. Поэтому, предположив, что синтезированный им галоперидол является не опиоидным анальгетиком, а таким же АП, как хлорпромазин (с которым галоперидол был схож в своей способности вызывать каталепсию), П.Янссен решил проверить, насколько эффективно галоперидол антагонизирует психозоподобные эффекты амфетамина и кокаина в новой, только что предложенной экспериментальной модели шизофрении на животных (M.Singh, S.Kay, 1975; E.Richelson, A.Nelson, 1984).
Проведя эту серию экспериментов, П.Янссен, по его собственным словам, очень впечатлился тем, насколько сильно галоперидол оказался способным противодействовать поведенческим изменениям, вызываемым у мышей воздействием амфетамина или кокаина, а также рвоте, вызываемой воздействием апоморфина. Оба эффекта у галоперидола были выражены гораздо сильнее, чем у хлорпромазина, и проявлялись в гораздо меньших дозах (J.Moncrieff, 2013).
Поскольку к тому времени благодаря работам Жана Деле и Пьера Деникера уже было известно, что хлорпромазин является эффективным АП, то П.Янссен предположил, что галоперидол еще более мощный и высокопотентный АП, чем хлорпромазин, и потенциально способен вызывать более сильный АП-эффект при меньшей степени гипотензии и седации (J.Moncrieff, 2013).
Всего через 5 нед после того, как галоперидол был впервые синтезирован, П.Янссен стал давать его для исследования на пациентах своим друзьям и знакомым-психиатрам. Одними из первых, кто начал применять галоперидол для лечения психозов, были двое бельгийских психиатров из Университета Льежа – Поль Диври и Жан Бобон (C.Ramachandraiah и соавт., 2009). Одним из первых пациентов П.Диври был 18-летний юноша, студент архитектурного факультета Университета Льежа, сын местного врача, поступивший с острым параноидным психозом, бессонницей, тревогой, сильным психомоторным возбуждением и агрессией. Всего через полчаса после внутримышечной инъекции первых 10 мг галоперидола этот молодой человек, до того агрессивно отвергавший любые предложения персонала принимать лекарства, начал сотрудничать с персоналом и спокойно принял снотворное, после чего уснул. На следующее утро у юноши уже не было никаких признаков психоза, он был абсолютно нормален, спокоен, адекватен, доступен контакту и через 2 нед был выписан в ремиссии с рекомендацией принимать в качестве поддерживающей терапии 1 мг галоперидола в сутки (J.Moncrieff, 2013).
Молодой человек следовал этой рекомендации на протяжении 7 лет, в течение которых он успел благополучно окончить архитектурный факультет, работал архитектором, женился, у него появились дети, он вел абсолютно нормальную социальную жизнь, имел много друзей. После 7 лет приема галоперидола в дозе 1 мг, в возрасте 25 лет, молодой человек решил, что больше не нуждается в галоперидоле, и будучи поддержан в этом решении местным наблюдавшим его врачом, но вопреки мнению П.Диври, Ж.Бобона и П.Янссена, считавших, что поддерживающую терапию нужно продолжить, прекратил принимать галоперидол. Всего через несколько дней после прекращения приема галоперидола психоз вернулся, причем на этот раз даже более высокие, чем первоначально использованные для его лечения в 18-летнем возрасте 10 мг дозы галоперидола уже не могли ему помочь. К прежнему до бросания приема галоперидола уровню социального функционирования этот молодой человек уже не смог вернуться никогда (J.Moncrieff, 2013).
Важно отметить, что галоперидол был не просто «еще одним новым АП». Большая антипсихотическая мощность, высокая потентность галоперидола по сравнению с хлорпромазином, его быстро наступающее и длительное воздействие на продуктивную (галлюцинаторно-бредовую) симптоматику шизофрении, а также то, что он относительно мало связывается с a1-адренорецепторами, М-холинорецепторами и H1-гистаминовыми рецепторами, обеспечили ему лучшую по сравнению с хлорпромазином переносимость, возможность применения с первых дней в полных АП-дозах (без необходимости медленного наращивания доз, как у хлорпромазина), гораздо меньший уровень седации, ортостатической гипотензии и тахикардии, холинолитических побочных эффектов (запоры, задержка мочи, делирий и др.), сексуальных расстройств. Эти свойства наряду с отсутствием свойственной хлорпромазину гепатотоксичности, более низкой склонностью вызывать аллергические реакции обусловили широкое распространение и популярность галоперидола. Для своего времени этот препарат был даже более революционным, чем хлорпромазин. Именно благодаря внедрению в практику галоперидола многие длительно или пожизненно институционализированные пациенты с психозами, в том числе не переносящие хлорпромазин или не получающие от него должного эффекта, получили возможность социализации и возвращения к жизни вне стен больничных заведений (M.Singh, S.Kay, 1975; E.Richelson, A.Nelson, 1984).
Как рассказывал в 1990-х годах историку психиатрии Дэвиду Хейли сам П.Янссен, вспоминая эту историю, именно случай упомянутого юноши как никогда убедительно показал как ему самому, так и психиатрам П.Диври и Ж.Бобону, участвовавшим в курации этого случая, важность и полезность длительной поддерживающей АП-терапии шизофрении. К этому времени было уже известно, как непосредственно из клинической практики, так и из статистических данных, что многие, если не большинство, больных шизофренией необоснованно бросают поддерживающую АП-терапию, в которой на самом деле нуждаются. Было также уже известно, что проблема низкой приверженности больных шизофренией длительной поддерживающей АП-терапии – одно из основных препятствий к поддержанию долгосрочных и качественных ремиссий (J.Moncrieff, 2013).
Это подтолкнуло П.Янссена и его сотрудников искать способы обеспечить гарантированное длительное поступление в организм АП после однократной внутримышечной инъекции, которую было бы легче уговорить или заставить больного сделать, чем обеспечивать ежедневный контроль за постоянным приемом перорального АП.
К этому времени химикам-фармакологам уже было известно (из опыта создания пролонгированных форм препаратов половых гормонов – тестостерона, прогестерона, эстрадиола), что одним из способов обеспечить длительное постепенное высвобождение препарата после однократной внутримышечной инъекции является его этерификация – присоединение при помощи эфирной связи к исходной молекуле препарата остатка той или иной жирной кислоты с достаточно длинным углеродным скелетом (например, декановой, пальмитиновой или энантовой жирных кислот). При этом получается препарат, не растворимый в воде, но хорошо растворимый в стерильных инъекционных маслах и медленно разрушающийся эстеразами в мышечной ткани после инъекции. Длина же углеродного скелета жирной кислоты определяет продолжительность действия пролонгированного препарата (чем длиннее эфирный «хвост», тем больше период полувсасывания и полувыведения – T1/2). В середине 1960-х годов, когда П.Янссен и его команда решили заняться созданием пролонгированной формы галоперидола, в США уже были коммерчески доступны (с 1966 и 1967 г. соответственно) первые ПАП другой фирмы – флуфеназина энантат с длительностью действия около 1 нед и применяемый по сей день флуфеназина деканоат с длительностью действия около 1 мес. Эти препараты послужили доказательством принципиальной возможности создания ПАП (D.Johnson, 2009). Таким образом, сама концепция не была новой для П.Янссена и его команды.
Основываясь на этом же принципе, П.Янссен и его команда синтезировали галоперидола деканоат. В Бельгии, на родине первооткрывателя, препарат стал применяться практически сразу после его появления в 1968 г., став, таким образом, одним из первых ПАП, доступных в этой стране (флуфеназина деканоат, наоборот, был первоначально доступен в США, и некоторое время его не было в европейских странах). Несмотря на то что галоперидола деканоат с формальной точки зрения не был исторически первым ПАП (первым был флуфеназина деканоат), в Бельгии этот препарат в то время революционизировал поддерживающую терапию шизофрении и радикально снизил количество рецидивов при ней за счет обеспечения более высокой приверженности больных длительной АП-терапии (H.Meltzer, S.Fatemi, 1998; J.Moncrieff, 2013). Однако вследствие бюрократических сложностей, традиционно сопровождавших регистрацию первых АП (достаточно вспомнить хотя бы историю о том, что из-за позиции Управления по контролю пищевых продуктов и лекарств в США – Food and Drug Administration, FDA– хлорпромазин вплоть до конца 1970-х годов в США был зарегистрирован не как АП, а лишь как противорвотное средство и применялся по основному показанию де-факто off-label), во всей остальной Европе, кроме Бельгии и Франции, галоперидола деканоат стал коммерчески доступен лишь в 1981 г., а в США еще позже – только в 1986 г. (P.Knudsen, 1985).
По сей день галоперидола деканоат является одним из самых коммерчески успешных, широко применяемых и доступных пролонгированных типичных АП (ПТАП), не в последнюю очередь благодаря своей дешевизне и высокой АП-активности (H.Meltzer, S.Fatemi, 1998; J.Moncrieff, 2013).
Чтобы читатель понимал, почему создание первых ПАП – такая важная историческая веха в развитии психофармакологии, мы перед тем как перейти к дальнейшему описанию истории создания различных ПАП компании «Янссен», поговорим о том, какие сравнительные преимущества имеют ПАП перед непролонгированными АП и каковы их сравнительные недостатки.
• У пациента отсутствует необходимость в ежедневном пероральном приеме АП, а у родственников или персонала, соответственно, отсутствует необходимость в постоянном контроле за соблюдением пациентами режима терапии (J.Gerlach, 1995; G.Remington, M.Adams, 1995).
• Снижается вероятность преднамеренных или случайных (непреднамеренных) пропусков или «забываний» введения в организм препарата (J.Gerlach, 1995; G.Remington, M.Adams, 1995).
• Повышается удобство терапии АП и приверженность больных длительному приему АП (J.Gerlach, 1995; G.Remington, M.Adams, 1995).
• Также снижается риск преднамеренной или случайной (непреднамеренной) передозировки препарата (J.Gerlach, 1995; G.Remington, M.Adams, 1995).
• После прекращения лечения ПАП концентрация активного вещества в крови снижается гораздо медленнее, чем после прекращения приема или введения непролонгированных форм АП. Это уменьшает риск ранних рецидивов заболевания вскоре после окончания лечения (S.Brissos и соавт., 2014).
• При использовании инъекционных ПАП исключается «эффект первого прохождения через печень». Это обеспечивает более предсказуемую фармакокинетику АП, меньшую ее зависимость от генетических особенностей цитохромов P450 печени конкретного пациента, более высокую и более предсказуемую биодоступность, более четкую и линейную зависимость концентрации препарата в крови от дозы (P.Rocca и соавт., 2013).
Недостатки ПАП:
• В случае непреднамеренной передозировки, или возникновения после введения ПАП тяжелых побочных эффектов – ПЭ (например, тяжелого экстрапирамидного синдрома – ЭПС, тяжелой акатизии или злокачественного нейролептического синдрома), или проявлений лекарственной аллергии, вынуждающих к немедленной отмене препарата, отсутствует возможность добиться ускорения элиминации препарата. Это увеличивает продолжительность и тяжесть проявления данных ПЭ, а в некоторых случаях, например при возникновении злокачественного нейролептического синдрома, может даже быть опасным для жизни пациента (J.Gerlach, 1995; G.Remington, M.Adams, 1995).
• Отсутствует возможность оперативного маневрирования концентрацией АП в крови при ухудшении и последующем быстром улучшении состояния. Это может вынуждать в некоторых случаях кратковременно добавлять непролонгированный пероральный или инъекционный препарат к уже находящейся в организме «базисной» дозе ПАП при ухудшении состояния и отменять этот «довесок» (пероральную или быстродействующую инъекционную суплементацию) при последующем улучшении состояния.
• Отсутствует возможность организации «лекарственных каникул» (специально рекомендованных врачом кратковременных, обычно на 1–2 дня, и регулярных, например ежемесячных или еженедельных, отмен или снижений доз АП), которые, как считают некоторые специалисты, могут снизить риск развития поздних дискинезий (ПД) при длительной терапии АП, особенно ТАП.
• В случае применения ПТАП или высоких доз ПААП, при которых ААП теряют свою «атипичность» и могут вызывать выраженные ЭПС или акатизию, может возникнуть необходимость в пероральном приеме холинолитических корректоров, b-адреноблокаторов и других препаратов. Это нередко не дает возможности полностью уйти от пероральной терапии с присущими ей проблемами удобства лечения, приверженности больных терапии и необходимости контроля приема препаратов родственниками пациентов или персоналом. Кроме того, такая вынужденная необходимость в пероральных препаратах для коррекции ПЭ от ПАП усложняет и удорожает схему лечения, снижает ее удобство и приверженность больных терапии.
Тем не менее, несмотря на наличие у ПАП упомянутых недостатков, суммарный баланс сравнительных преимуществ и недостатков, как считают сегодня большинство специалистов, положителен в пользу пролонгированных форм.
• Для минимизации вышеперечисленных недостатков применения пролонгированных форм антипсихотиков важно проводить предварительную проверку переносимости молекулы (о чём указано в инструкциях по применению препаратов).
Показано, что именно непрерывность, последовательность и преемственность лечения АП на всех этапах болезни, как в стационаре, так и вне его, является одним из важнейших предикторов для более благоприятного долгосрочного прогноза шизофрении. Между тем клинические, психологические и экономические проблемы, возникающие из-за низкого уровня критичности пациентов с шизофренией к собственной болезни и вытекающего из этого низкого уровня приверженности их соблюдению режима АП-терапии, частого необоснованного самовольного прекращения ими лечения или самовольного снижения доз АП, осложняют проведение пероральной АП-терапии, особенно длительной. Это подчеркивает важность обеспечения непрерывной доставки АП в организм больного на всех этапах лечения шизофрении. Именно для того, чтобы решить эту проблему и повысить приверженность больных шизофренией АП-терапии, и были введены в клиническую практику ПАП (N.Daghistani, J.Rey, 2016).
Большинство исследователей отмечают, что применение при шизофрении инъекционных форм ПАП снижает как процент госпитализаций, так и процент внегоспитальных (амбулаторно купируемых) рецидивов и обострений психозов, повышает приверженность больных лечению и уменьшает риск преждевременного его прекращения, сокращает время пребывания больных в стационаре, а также способствует становлению и поддержанию более качественных, более глубоких и длительных ремиссий по сравнению с пероральным приемом АП (G.Kaplan и соавт., 2013; C.Montemagni и соавт., 2016). Современные исследования указывают на то, что среди всех существующих сегодня терапевтических альтернатив именно инъекционные формы ПАП способны обеспечить наиболее оптимальную и эффективную стратегию поддерживающего лечения шизофрении, его непрерывность на всех этапах болезни (R.Herold, 2017). В сумме это улучшение результатов лечения приводит к снижению социальной и экономической нагрузки при лечении шизофрении, уменьшению как прямых, так и косвенных расходов и семьи больного, и системы здравоохранения, снижению экономических потерь общества от госпитализации и временной нетрудоспособности больных (G.Kaplan и соавт., 2013).
Некоторые исследователи даже указывают на то, что применение ПАП может в большей степени тормозить прогрессирование шизофрении, нарастание когнитивных нарушений, негативной симптоматики («шизофренического дефекта личности») и в большей степени положительно влиять на долгосрочные функциональные исходы больных шизофренией по сравнению с пероральными формами АП. Происходит это за счет лучшего противорецидивного эффекта у ПАП по сравнению с пероральными АП. Это, в свою очередь, приводит к уменьшению влияния кумулятивной когнитивной и поведенческой токсичности каждого из перенесенных психозов (за счет уменьшения числа эпизодов психозов за жизнь) на долгосрочные функциональные исходы больных шизофренией, к торможению нарастания негативной и когнитивной симптоматики и улучшению социализации больных. Раннее, своевременное применение ПАП, по некоторым данным, также способно затормозить нарастание резистентности шизофрении и отсрочить перевод на клозапин или даже полностью его избежать (C.Montemagni и соавт., 2016).
Ранее традиционно считалось, что ПАП следует резервировать для больных шизофренией в поздних стадиях заболевания, а также для больных с наиболее тяжелой и выраженной симптоматикой, низкой эффективностью лечения или выраженной резистентностью, более частыми и тяжелыми рецидивами, а также низким уровнем критики, осознания болезни или низкой приверженностью лечению, предысторией неоднократного бросания лечения АП. Однако в последние годы происходит смена парадигмы в пользу более частого применения ПАП на более ранних стадиях болезни и у более широкого круга больных (A.González-Rodríguez и соавт., 2015).
Основными показаниями для назначения ПАП являются (P.Llorca и соавт., 2013):
• В 1-й линии терапии:
– Шизофрения.
– Шизоаффективное расстройство.
– Хронические бредовые расстройства.
• В качестве терапии 2-й линии при неэффективности пероральной терапии или низкой приверженности к лечению:
– Биполярное аффективное расстройство с частыми и тяжелыми маниями.
– Некоторые расстройства личности с выраженной агрессивностью, злобностью.
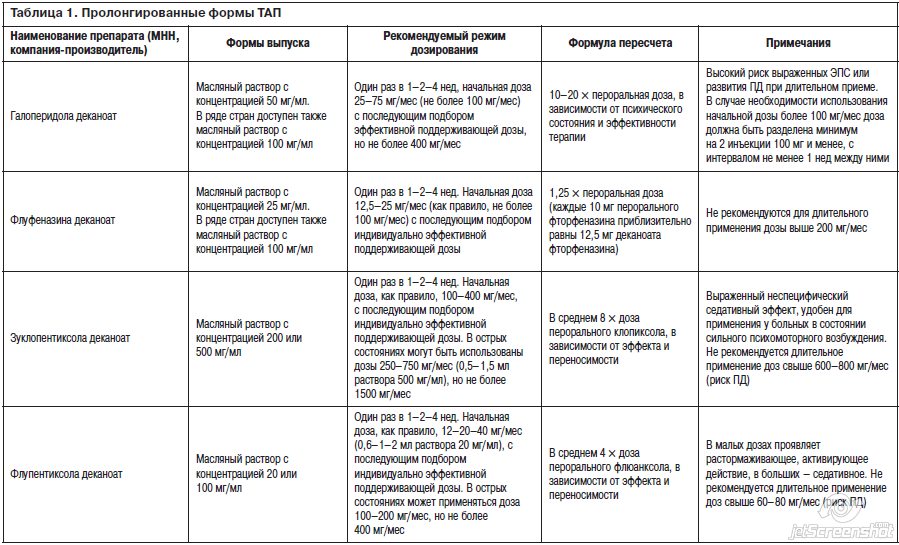
Для удобства читателя мы также приведем здесь сводную справочную таблицу всех присутствующих ныне на рынке ПТАП, их режимов дозирования, методов пересчета пероральной дозы ТАП в дозу ПТАП и др. (табл. 1).
Предыстория создания дифенилбутилпиперидиновых АП такова. Уже к началу 1960-х годов первоначальный энтузиазм по поводу синтеза все более и более мощных и вызывающих все более и более выраженный ЭПС АП из числа селективных D2-блокаторов – энтузиазм, приведший к созданию таких препаратов, как трифлуперидол, дроперидол, бенперидол (кстати, тоже разработки команды П.Янссена) и тиопроперазин, стал угасать. Одновременно в среде как практикующих психиатров, так и химиков-фармакологов стало постепенно накапливаться понимание того, что вызываемые мощными АП выраженные ЭПС и акатизия, нейролептические депрессии, вторичная негативная и когнитивная симптоматика (нейролептический дефицитарный синдром), а также седация и прибавка массы тела не только осложняют и затрудняют лечение шизофрении как таковой, но и являются одними из основных причин низкой приверженности больных шизофренией лечению АП, явного или скрытого отказа от лечения данными препаратами.
Кроме того, уже к началу 1960-х годов в среде практикующих психиатров начали появляться первые проблески понимания принципиальной ограниченности эффекта существовавших тогда АП в отношении негативной, когнитивной и депрессивной симптоматики шизофрении. К ним также начало постепенно приходить осознание того, что именно негативная, когнитивная и депрессивная симптоматика даже в большей степени, чем продуктивная психотическая симптоматика, определяет долгосрочные функциональные исходы больных шизофренией, а также степень социальной и профессиональной адаптированности таких больных. Сегодня это уже является «общим местом», но в начале 1960-х годов было очевидно еще далеко не всем.
На этом фоне у практикующих психиатров еще в начале 1960-х годов, задолго до оформления современной концепции ААП, начал постепенно формироваться запрос на создание такого АП, который был бы одновременно и мощным, высокопотентным (в идеале не уступающим по селективному антипсихотическому действию и по миллиграммовой потентности уже упоминавшимся галоперидолу и фторфеназину), и вызывающим по возможности меньше ЭПС, вторичной негативной и когнитивной симптоматики, нейролептических депрессий. В идеале такой АП даже должен был бы обладать некой собственной активностью в отношении когнитивной, негативной и депрессивной симптоматики. Еще одним теоретически желательным свойством для такого АП в тогдашней психиатрической литературе назывался длительный период полувыведения из организма – такой, чтобы одно-двукратный случайный пропуск перорального приема мало влиял на общую эффективность АП-терапии и в идеале были возможны пероральный прием или инъекционное введение препарата 1 раз в несколько дней или 1 раз в неделю. Теоретически это должно было повысить приверженность больных шизофренией АП-терапии.
И здесь так же, как в истории с галоперидолом и галоперидола деканоатом, передовые разработки в науке снова принадлежали П.Янссен и его команде. Отвечая на описанный запрос рынка, сотрудники компании «Янссен» под непосредственным руководством П.Янссена в 1963 г. синтезировали первый дифенилбутилпиперидиновый пероральный АП – пимозид. Пимозид и его аналоги в наше время часто называют «АП полуторного поколения (11/2)» или «наполовину атипичные АП». При этом имеется в виду, что I поколение АП – типичные АП – ТАП (галоперидол, флуфеназин и др.), а II поколение АП – ААП (рисперидон, палиперидон, оланзапин и др.). Между тем пимозид и его аналоги обладают свойствами, в некоторых отношениях «промежуточными» между ТАП и ААП, за что и были впоследствии, уже после появления ААП, названы «АП полуторного поколения» или «наполовину атипичные».
В частности, уже в конце 1960-х годов было известно, что пимозид в отличие от ТАП обладает антидепрессивной активностью в экспериментах на животных, а также в отличие от ТАП способен улучшать не только поведение животных (отражающее воздействие на продуктивную симптоматику и агрессивность), но и их когнитивное функционирование и социальное взаимодействие с другими членами сообщества в экспериментальных моделях шизофрении, вызванной воздействием на животных кетамина. Антидепрессивная, антинегативная, просоциальная и прокогнитивная активность пимозида проявляется и при клиническом его применении у человека. Первоначально механизм антидепрессивного, просоциального и прокогнитивного действия пимозида оставался неизвестным. Однако сравнительно недавно было показано, что пимозид в отличие от большинства ТАП обладает сильной 5-HT6- и очень сильной 5-HT7-блокирующей активностью (Ki=71 и 0,5 nM соответственно). А эти свойства сегодня считаются настолько желательными для ААП и обеспечивающими их важные преимущества перед ТАП в отношении влияния на когнитивную, негативную и депрессивную симптоматику шизофрении, что при синтезе новых ААП, таких как луразидон, сейчас уделяется большое внимание желательности наличия у них мощных 5-HT6- и 5-HT7-блокирующих свойств. Таким образом, можно сказать, что пимозид значительно опередил свое время, предвосхитив дальнейшее появление самых современных ААП (R.Mahesh и соавт., 2011).
Кроме того, пимозид обладает очень хорошим профилем переносимости, также сближающим его с современными ААП и позволяющим называть его «АП полуторного поколения». В частности, пимозид вызывает очень мало седации и ортостатической гипотензии, что объясняют его слабым сродством по отношению к H1-гистаминовым рецепторам (Ki=692 nM) и к a1-адренергическим рецепторам (Ki=197,7 nM), мало влияет на углеводный метаболизм и массу тела, что объясняют очень малым сродством к M3-холинергическим рецепторам (Ki=1955 nM). Также пимозид подобно современным ААП вызывает относительно мало ЭПС, что связывают как с его способностью сильно блокировать 5-HT6- и 5-HT7-рецепторы, так и с его довольно сильной (Ki=48,4 nM) тропностью к 5-HT2A-рецепторам, тем самым рецепторам, с блокадой которых обычно связывают пониженную способность ААП вызывать ЭПС (L.Brunton и соавт., 2017).
Выраженную способность пимозида блокироватьa-субъединицу калиевых каналов, или иначе белок hERG (Ki=18 nM), а также верапамил-чувствительные медленные кальциевые каналы, тоже связывают не только с его способностью удлинять интервал QT и вызывать сердечные аритмии, в том числе жизнеопасные, но и с возможным вкладом этих свойств в сильный АП-эффект препарата. Принято считать, что именно благодаря наличию этих дополнительных рецепторных свойств пимозид в отличие от ТАП способен вызывать АП-эффект при дозах, не обеспечивающих 65–70% степень блокады дофаминовых D2-рецепторов стриатума, и, таким образом, давать в терапевтических дозах менее выраженные ЭПС, чем ТАП (L.Brunton и соавт., 2017). Важным положительным свойством пимозида, обеспечившим его коммерческий успех, явился также его большой T1/2 (55–65 ч), позволяющий применять препарат 1 раз в сутки и даже 1 раз в 2 дня и снижающий риск рецидива заболевания при нерегулярном приеме или случайных пропусках (H.Meltzer, S.Fatemi, 1998; S.Stahl, N.Muntner, 2013; L.Brunton и соавт., 2017).
Вслед за успехом пимозида в том же 1963 г. командой П.Янссена был запущен в продажу внутримышечный пролонгированный аналог препарата – флуспирилен, допускающий внутримышечное введение 1 раз в неделю и также обладающий многими из присущих пимозиду «наполовину атипичных» свойств, в частности хорошей переносимостью, относительно низким уровнем ЭПС и положительным влиянием на негативную и когнитивную симптоматику и социальное функционирование больных шизофренией. В 1968 г. компанией «Янссен» был запущен третий дифенилбутилпиперидиновый АП, обладающий очень большим T1/2 даже при пероральном приеме, – пенфлюридол, допускающий пероральное применение в режиме 1 раз в неделю. Это наряду с хорошей переносимостью дифенилбутилпиперидинов, безусловно, повышает удобство лечения и приверженность больных АП-терапии (H.Meltzer, S.Fatemi, 1998; S.Stahl, N.Muntner, 2013).
Видный советский фармаколог М.Д.Машковский еще в 1970-х годах называл пимозид и флуспирилен важными средствами социальной реабилитации больных шизофренией, подчеркивая их специфическое активирующее, растормаживающее, социализирующее действие, облегчение под их влиянием вовлечения больных в трудовые процессы (М.Д.Машковский, 2002).
Несмотря на то что дифенилбутилпиперидиновые производные (пимозид, флуспирилен, пенфлюридол) были значительным шагом вперед по сравнению с галоперидолом в отношении переносимости, так же как галоперидол был прорывом по сравнению с хлорпромазином, проблема ЭПС и при применении дифенилбутилпиперидинов продолжала оставаться актуальной. В ответ на запросы рынка компания «Янссен» в 1968 г. синтезировала, а в 1972 г. выпустила на рынок инновационный антихолинергический корректор дексетимид, отличием которого от тригексифенидила, бензтропина, биперидена и других имевшихся на рынке корректоров, была большая продолжительность действия – до 3 дней после однократной инъекции. Это позволяло эффективно контролировать ЭПС у пациентов, получающих АП-терапию, и повысить их приверженность лечению (R.Dom и соавт., 1971; H.Huygens и соавт., 1973). Компания также продолжила работать над улучшением переносимости АП, что привело к последующему синтезу ею исторически первого «настоящего, постклозапинового ААП» – рисперидона, о котором пойдет речь далее.
Поэтому с того времени, когда на примерах пимозида и клозапина стало ясно, что ассоциация сильного АП-эффекта с выраженными ЭПС вовсе не является обязательной, усилия химиков-фармакологов всего мира были сосредоточены на разработке таких АП, которые бы по возможности также вызывали мало ЭПС, но не обладали такими же неприятными и опасными ПЭ, как пимозид и клозапин. И, разумеется, этим занималась, в частности, и команда П.Янссена.
Инновационные усилия компании «Янссен» увенчались успехом. В результате целенаправленного поиска соединений с такими свойствами в конце 1980-х годов под непосредственным руководством П.Янссена сотрудники его компании синтезировали рисперидон (Рисполепт), ставший исторически первым «АП II поколения», или первым ААП, и обладающий в отличие от упомянутых пимозида и клозапина хорошим профилем безопасности, в частности, не вызывающим свойственных этим препаратам сердечных аритмий и агранулоцитоза. Именно Рисполепт (рисперидон) стал первым «настоящим», целенаправленно синтезированным, а не случайно открытым, как клозапин, т.е. постклозапиновым ААП. Именно рисперидон открыл собой эру широкого применения ААП в психиатрии, поскольку из-за риска агранулоцитоза клозапин считался и продолжает считаться препаратом глубокого резерва для тяжелых и резистентных форм шизофрении. В 1993 г. рисперидон был официально одобрен FDA и поступил в продажу в США (H.Meltzer, S.Fatemi, 1998; S.Stahl, N.Muntner, 2013).
Во множестве исследований показано, что рисперидон имеет лучшую переносимость по сравнению с ТАП, значительно более низкий уровень ЭПС, нейролептических депрессий, вторичной негативной симптоматики, а также в отличие от ТАП обладает высокой эффективностью в отношении не только продуктивных, но и негативных, депрессивных и когнитивных симптомов шизофрении (S.Leucht и соавт., 1999; M.Krebs и соавт., 2006).
Хорошая переносимость рисперидона, более низкий по сравнению с ТАП уровень ЭПС и вторичной ятрогенной негативной симптоматики при его приеме, а также его более широкий по сравнению с ТАП спектр эффективности в отношении различных субдоменов симптоматики шизофрении, включая негативную, когнитивную и аффективную симптоматику, способствовали повышению приверженности больных шизофренией длительной АП-терапии, улучшению их социализации, уменьшению стигматизации, повышению общего качества их жизни. Как говорил сам П.Янссен по этому поводу: «врачи поблагодарили меня за галоперидол, но пациенты поблагодарили меня за рисперидон» (S.Leucht и соавт., 1999; M.Krebs и соавт., 2006).
Вскоре после появления рисперидона другие компании-производители также выпустили конкурирующие пероральные ААП. Так появились кветиапин, оланзапин, арипипразол, зипрасидон, а затем и другие. Процесс пополнения группы пероральных ААП продолжается и сегодня. Так, относительно недавно на мировом рынке появились азенапин, карипразин, илоперидон, луразидон.
Однако внедрение в психиатрическую практику пероральных ААП хотя и позволило улучшить качество жизни больных шизофренией, снизить уровень ЭПС и повысить эффективность лечения негативных, аффективных и когнитивных симптомов болезни, приверженность больных длительной поддерживающей АП-терапии, тем не менее не смогло полностью решить проблему недостаточной приверженности этих больных лечению.
Принципиальным недостатком терапии ААП по сравнению с ТАП долгое время являлось отсутствие инъекционных форм, как простых (непролонгированных), так и в особенности пролонгированных. Это ограничивало возможные сферы применения ААП относительно нетяжелыми и сохранными больными, согласными принимать препараты перорально, приверженными терапии и хотя бы частично критичными к своей болезни (Е.В.Оленева и соавт., 2017).
С другой стороны, применение единственных доступных до недавнего времени ПАП, а именно типичных (ПТАП), таких как галоперидола деканоат, фторфеназина деканоат и других, сдерживалось их низкой эффективностью в отношении негативных, депрессивных и когнитивных симптомов шизофрении, высоким риском возникновения выраженных ЭПС, вторичной ятрогенной негативной симптоматики, нейролептических депрессий, повышением риска возникновения ПД при длительной терапии, нередкой необходимостью в сопутствующем пероральном приеме корректоров, т.е. по сути теми же недостатками, которые свойственны пероральным или быстродействующим инъекционным формам ТАП (Е.В.Оленева и соавт., 2017).
В то же время несомненными преимуществами ПТАП перед пероральными или быстродействующими инъекционными формами ТАП являются возможность обеспечения более высокого уровня приверженности терапии АП, а также то, что при использовании ПТАП достигаются более низкие равновесные концентрации АП в крови, чем при использовании пероральных или быстродействующих инъекционных форм, и отсутствуют резкие колебания концентрации в крови, свойственные пероральным или быстродействующим инъекционным ТАП. Это способствует повышению эффективности и безопасности терапии ПТАП по сравнению с пероральными формами ТАП (Е.В.Оленева и соавт., 2017).
В свете всего сказанного совершенно логично, что у специалистов сформировался запрос на ПААП как препарат, который бы объединял в себе преимущества инъекционных ПАП в плане обеспечения приверженности пациентов терапии АП и низкого уровня колебаний концентрации в крови с такими достоинствами пероральных ААП, как лучшая переносимость по сравнению с ТАП, более низкий уровень ЭПС, более высокая безопасность применения (например, снижение риска ПД), большая по сравнению с ТАП эффективность в отношении негативных, аффективных и когнитивных симптомов шизофрении. Отвечая на этот запрос рынка, компания «Янссен» в начале 2000-х годов разработала и в 2003 г., уже после смерти основателя компании П.Янссена, выпустила на рынок исторически первый ПААП – инъекционный рисперидон пролонгированного действия под торговым наименованием Рисполепт Конста (Е.В.Оленева и соавт., 2017).
Как и в случае с пероральным рисперидоном, ставшим родоначальником целого нового класса АП – ААП, вслед за выпуском компанией «Янссен» исторически первого ПААП – Рисполепта Конста, другие конкурирующие компании-производители также выпустили пролонгированные инъекционные версии своих ААП. Так были введены в клиническую практику оланзапина памоат, арипипразола моногидрат и арипипразола лауроксил, также позволяющие введение 1 раз в месяц (M.Bernardo, M.Bioque, 2016).
Стоит заметить, что при создании Рисполепта Конста компания «Янссен» столкнулась с уникальной трудностью, именно вследствие которой от возникновения идеи до ее практического воплощения прошло 10 лет. В молекуле рисперидона нет подходящего гидроксильного радикала, из-за этого он не может быть этерифицирован без потери эффективности. Таким образом, традиционные методы создания ПАП путем этерификации молекулы и растворения эфира АП в масле оказались неприменимы к рисперидону. Однако ученые компании «Янссен» с честью вышли из данного затруднения, предложив уникальную технологию создания пролонгированного препарата в виде водной суспензии специальных биосовместимых и биодеградируемых микросфер, постепенно высвобождающих рисперидон с поверхности в процессе своего разрушения после инъекции (Е.В.Оленева и соавт., 2017).
Помимо того что такая технология вообще позволила впервые создать пролонгированную форму ААП, она дала еще ряд преимуществ. В частности, благодаря такой форме выпуска пролонгированного рисперидона при его введении отсутствуют проблема аллергии на масляный растворитель и консервант (нередко встречающейся при применении ПТАП), выраженная местная болезненность, риск образования масляных гранулем (олеом) или абсцессов, обеспечивается более равномерная терапевтическая концентрация рисперидона в крови на протяжении всего срока действия инъекции, чем характерные для ПТАП графики концентраций с плавным повышением в 1-ю неделю и последующим снижением (Е.В.Оленева и соавт., 2017).
С созданием Рисполепта Конста компания «Янссен» задала новый тренд в индустрии ПАП. Все новые ПААП, выходящие на рынок, даже те, которые теоретически могли бы быть созданы в виде масляных растворов (например, оланзапина памоат), теперь производятся в виде водных суспензий, содержащих микрокристаллы (M.Bernardo, M.Bioque, 2016).
К важным достоинствам палиперидона (Инвеги) по сравнению с рисперидоном (Рисполептом) относится также его улучшенный рецепторный профиль. В силу меньшей a1-адреноблокирующей и H1-гистаминоблокирующей активности по сравнению с рисперидоном палиперидон вызывает меньше ортостатической гипотензии, тахикардии и седации. А более благоприятное соотношение 5-HT2A- и D2-блокады у палиперидона по сравнению с рисперидоном обеспечивает более низкий уровень ЭПС и меньшую выраженность гиперпролактинемии по сравнению с рисперидоном (F.Awouters, P.Lewi, 2007; S.Stahl, N.Muntner, 2013; N.Daghistani, J.Rey, 2016).
Вслед за выпуском перорального палиперидона (Инвега) компания «Янссен» создала его пролонгированные формы, что позволило еще больше повысить удобство поддерживающей терапии и повысить приверженность больных данному препарату. В 2009 г. появился палиперидона пальмитат, позволяющий введение 1 раз в месяц, под торговыми названиями Инвега Сустенна (в США) и Ксеплион (в Европе и РФ) [S.Stahl, N.Muntner, 2013; N.Daghistani, J.Rey, 2016].
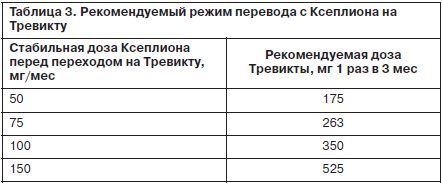
А в 2015 г. компания «Янссен» зарегистрировала в США новую, уникальную, не имеющую пока аналогов на рынке ПАП сверхпролонгированную форму палиперидона пальмитата, позволяющую введение 1 раз в 3 мес (т.е. достаточно всего 4 инъекций в год), под торговыми названиями Инвега Тринза (в США) и Тревикта (в ЕС и РФ). В России Тревикта была зарегистрирована в 2016 г., стала доступна для пациентов в марте 2017 г. Это позволяет значительно повысить удобство лечения и приверженность больных терапии, освобождает их от частых контроля и инъекций (N.Daghistani, J.Rey, 2016).
Важно отметить, что, хотя палиперидона пальмитат является эфиром активного соединения (палиперидона) с жирной кислотой, он, как и другие современные ПААП, в обеих своих формах (Ксеплион и Тревикта) производится не в виде масляного раствора, а в виде суспензии микрокристаллов. Таким образом, у Ксеплиона и Тревикты изначально имеются те же преимущества перед масляными растворами ПАП, которые были нами указаны для Рисполепта Конста, а именно: отсутствие аллергических реакций на масло, местной болезненности, риска образования олеом, неравномерности всасывания. Различие между Ксеплионом и Тревиктой – в размере микрокристаллов суспензии, что приводит к различиям в скорости всасывания и выведения и, как следствие, различиям в длительности действия (N.Daghistani, J.Rey, 2016).
В компании «Янссен» считают, что за сверхпролонгированными формами ААП, позволяющими введение 1 раз в несколько месяцев, – большое будущее, и это позволит революционизировать поддерживающую терапию шизофрении и повысить приверженность больных терапии еще в большей мере, чем в свое время произвели революцию первые ПТАП (галоперидол-деканоат и др.), а затем первый ПААП – Рисполепт Конста (B.Yerragunta и соавт., 2015).
 В настоящее время известно, что подобно тому, как вслед за Рисполептом появились и другие ААП, а вслед за Рисполептом Конста – другие ПААП, ряд компаний-конкурентов, впечатлившись рыночным успехом препарата Тревикта, также ведет разработку собственных сверхпролонгированных форм ААП. В частности, на ранних стадиях находится разработка 3-месячной пролонгированной формы арипипразола (L.Citrome, 2016), а также импланта арипипразола (A.Hedayati и соавт., 2017).
В настоящее время известно, что подобно тому, как вслед за Рисполептом появились и другие ААП, а вслед за Рисполептом Конста – другие ПААП, ряд компаний-конкурентов, впечатлившись рыночным успехом препарата Тревикта, также ведет разработку собственных сверхпролонгированных форм ААП. В частности, на ранних стадиях находится разработка 3-месячной пролонгированной формы арипипразола (L.Citrome, 2016), а также импланта арипипразола (A.Hedayati и соавт., 2017).
Однако, как всегда, компания «Янссен» и здесь оказалась первопроходцем – именно ей принадлежит честь создания первого сверхпролонгированного ААП – препарата Тревикта (в США – Инвега Тринза).
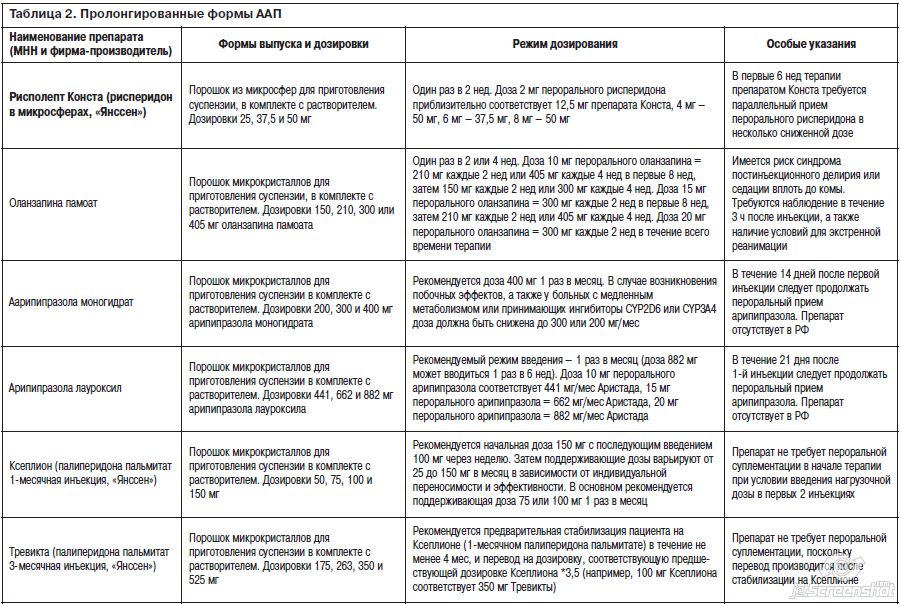
Для удобства читателя мы приведем в краткой табличной форме справочную информацию обо всех присутствующих на сегодняшний день на мировом рынке пролонгированных инъекционных формах ААП, их формах выпуска и дозировках, рекомендуемых режимах введения и методах пересчета доз (табл. 2, 3).
В этом же инновационном русле лежит и создание компанией «Янссен» в 1960-х годах дифенилбутилпиперидиновых АП длительного действия – пимозида, флуспирилена, пенфлюридола. Эти препараты почти на 2 десятилетия предвосхитили создание современных ААП. Именно они впервые создали более благоприятные условия для социальной реабилитации больных шизофренией, их вовлечения в трудовые процессы. Пимозид и его аналоги задолго до появления клозапина и современных ААП показали принципиальную возможность получения мощного антипсихотического эффекта без тяжелых экстрапирамидных побочных явлений, а также возможность влияния АП на проявления негативной, когнитивной и депрессивной симптоматики.
Добрая традиция компании «Янссен» всегда быть первой или одной из первых с принципиально новыми предложениями на рынке АП была продолжена с созданием Рисполепта (рисперидона) – исторически первого «настоящего», постклозапинового ААП, снискавшего заслуженную любовь как психиатров, так и пациентов. Затем ею был создан Рисполепт Конста, ставший опять-таки исторически первым ПААП и первым в мире ПАП не на масляной основе.
Сегодня компания «Янссен», продолжая свою историческую традицию опережающего развития этого направления в психофармакологии, имеет в своем портфеле инновационный ПААП, аналогов которому нет ни у одного из конкурентов на рынке, – Тревикта. Это особая форма выпуска палиперидона пальмитата, обеспечивающая гарантированное равномерное поступление препарата в кровь в течение 3 мес после инъекции, что позволяет вводить препарат 1 раз в 3 мес, т.е. всего 4 раза в год. Редкие инъекции этой пролонгированной формы значительно повышают приверженность больных терапии, удобство терапии для них самих и их родственников, разгружают врачей и средний медицинский персонал и с фармакоэкономической точки зрения обходятся дешевле, чем инъекции препарата Ксеплион или сопоставимых ПААП 1 раз в месяц. При этом терапевтический эффект как минимум не хуже, чем у 1-месячных форм палиперидона или других ПААП.
Сведения об авторах
Беккер Роман Александрович – исследователь в области психофармакотерапии, Университет им. Давида Бен-Гуриона в Негеве
Быков Юрий Витальевич – ФГБОУ ВО СтГМУ. E-mail: yubykov@gmail.com
Ключевые слова: компания «Янссен», антипсихотик, шизофрения, история психофармакологии, пролонгированный антипсихотик, галоперидол, галоперидола деканоат, пимозид, рисперидон, Рисполепт, Рисполепт Конста, палиперидон, палиперидона пальмитат, Инвега, Ксеплион, Тревикта.
Для цитирования: Беккер Р.А., Быков Ю.В. Пролонгированные антипсихотики фирмы «Янссен» в историческом разрезе: прошлое, настоящее, будущее. Психиатрия и психофармакотерапия. 2017; 19 (6): 18–27.
Long-acting antipsychotics made by Janssen: their history, their current value and the future
R.A.Bekker1, Yu.V.Bykov21David Ben-Gurion University in Negev. 8410501, Israel, Be'er Sheva;
2Stavropol State Medical University of the Ministry of Health of the Russian Federation. 355017, Russian Federation, Stavropol, ul. Mira, d. 310yubykov@gmail.com
In this article, we will tell the reader about the history of the development of long-acting antipsychotics (LAIs) made by Janssen company in the context of the general history of psychopharmacology. Then we perform a thorough comparative analysis and comparison of all commercially available LAIs, summarizing data on them in the tables. Additionally, we also describe the future of ultra-prolonged LAIs and further plans of Janssen company.
Key words: Janssen company, antipsychotic, schizophrenia, history of psychopharmacology, long-acting antipsychotic, haloperidol, haloperidol decanoate, pimozide, risperidone, Risperdal, Risperdal Consta, paliperidone, paliperidone palmitate, Invega, Invega Sustenna, Invega Trinza.
For citation: Bekker R.A., Bykov Yu.V. Long-acting antipsychotics made by Janssen: their history, their current value and the future. Psychiatry and Psychopharmacotherapy. 2017; 19 (6): 18–27.
Введение
Цель создания нами данного обзора – представить читателю историческую справку об интереснейшей и поучительной истории создания пролонгированных антипсихотиков (ПАП), прежде всего компании «Янссен», а затем дать практическую информацию о их фармакокинетике, фармакодинамике, механизмах действия, режиме дозирования и научить читателя применять самые современные пролонгированные атипичные АП (ПААП), включая инновационный 3-месячный палиперидона пальмитат (Тревикта), в своей клинической практике. Кроме того, в данном обзоре мы также хотим привести сопоставление имеющихся на рынке ПАП, их преимуществ и недостатков, чтобы практикующие психиатры могли сделать обоснованный выбор поддерживающей терапии для блага своих пациентов.Общие исторические сведения
История создания галоперидола деканоата
Когда Пол Янссен, глава фармацевтической компании «Янссен», начинал свое дело, его компания была очень маленькой и он понимал, что для того, чтобы выжить на высококонкурентном и быстро развивающемся фармацевтическом рынке, компания должна иметь портфель эксклюзивных, очень успешных препаратов. В частности, П.Янссен очень хотел создать более сильный и эффективный синтетический опиоидный анальгетик, чем синтезированный ранее им самим декстроморамид (пальфиум) и созданный до него в 1939 г. меперидин (лидол) [C.Ramachandraiah и соавт., 2009]. После бесед со своим другом и коллегой, химиком Арнольдом Бекеттом, П.Янссен решил попробовать добиться успеха, выбрав в качестве молекулы-прототипа меперидин. Чтобы избежать обвинений в нарушении патентов от компании-производителя меперидина, П.Янссен решил радикально, до неузнаваемости, изменить структуру его молекулы. Так появилось первое бутирофеноновое производное, которое компания назвала «R1187». После перебора еще 44 бутирофеноновых производных 11 февраля 1958 г. Берт Херманс, один из ближайших сотрудников П.Янссена, синтезировал «бутирофенон №45», которому компания присвоила кодовое название «R1625». Это и было то самое лекарство, которое впоследствии было названо галоперидолом. За химическое строение с двумя галогеновыми атомами в молекуле его неоднократно называли одним из важнейших лекарств XX в. (B.Granger, S.Albu, 2005; F.López-Muñoz, C.Alamo, 2009).Исследуя галоперидол на животных, П.Янссен и Б.Херманс обратили внимание, что он не слишком эффективен как анальгетик и не вызывает у мышей характерного для опиоидных анальгетиков возбуждения в первой фазе действия (отражающего опиоидную эйфорию), почти не угнетает дыхание и перистальтику кишечника (что также должно было быть характерным проявлением действия опиоидов), но зато вызывает у мышей сонливость, седацию, оглушенность, безразличие к внешним стимулам и каталепсию (восковую гибкость). Как уже было известно, подобные эффекты вызывают у животных большие дозы хлорпромазина. Мыши П.Янссена после введения галоперидола выглядели совершенно так же, как обработанные большой дозой хлорпромазина, притом проявляли даже более сильную каталепсию при меньшей степени седации и сонливости и меньшей выраженности гипотензии и тахикардии (J.Moncrieff, 2013).
Важно подчеркнуть, что, хотя галоперидол изначально был открыт П.Янссеном случайно (так же как ранее случайно был открыт хлорпромазин), в процессе поисков нового, более эффективного, чем меперидин, синтетического опиоидного анальгетика, фармакологический гений П.Янссена проявился именно в том, что он сумел правильно оценить значение своего открытия и продолжить разработку этого препарата. В 1957 г. рыночные перспективы психофармакологических препаратов были еще далеко не так очевидны, как сегодня, и множество перспективных препаратов разных фирм были либо недооценены и на длительное время отложены (как это произошло уже в начале 1960-х годов с только что синтезированным клозапином), либо вообще забыты, положены на полку (J.Moncrieff, 2013).
В то время уже было известно, что симптомы отравления амфетамином и кокаином в некоторых аспектах схожи с симптомами шизофрении, и амфетаминовый либо кокаиновый психоз был предложен в качестве экспериментальных моделей шизофрении. Поэтому, предположив, что синтезированный им галоперидол является не опиоидным анальгетиком, а таким же АП, как хлорпромазин (с которым галоперидол был схож в своей способности вызывать каталепсию), П.Янссен решил проверить, насколько эффективно галоперидол антагонизирует психозоподобные эффекты амфетамина и кокаина в новой, только что предложенной экспериментальной модели шизофрении на животных (M.Singh, S.Kay, 1975; E.Richelson, A.Nelson, 1984).
Проведя эту серию экспериментов, П.Янссен, по его собственным словам, очень впечатлился тем, насколько сильно галоперидол оказался способным противодействовать поведенческим изменениям, вызываемым у мышей воздействием амфетамина или кокаина, а также рвоте, вызываемой воздействием апоморфина. Оба эффекта у галоперидола были выражены гораздо сильнее, чем у хлорпромазина, и проявлялись в гораздо меньших дозах (J.Moncrieff, 2013).
Поскольку к тому времени благодаря работам Жана Деле и Пьера Деникера уже было известно, что хлорпромазин является эффективным АП, то П.Янссен предположил, что галоперидол еще более мощный и высокопотентный АП, чем хлорпромазин, и потенциально способен вызывать более сильный АП-эффект при меньшей степени гипотензии и седации (J.Moncrieff, 2013).
Всего через 5 нед после того, как галоперидол был впервые синтезирован, П.Янссен стал давать его для исследования на пациентах своим друзьям и знакомым-психиатрам. Одними из первых, кто начал применять галоперидол для лечения психозов, были двое бельгийских психиатров из Университета Льежа – Поль Диври и Жан Бобон (C.Ramachandraiah и соавт., 2009). Одним из первых пациентов П.Диври был 18-летний юноша, студент архитектурного факультета Университета Льежа, сын местного врача, поступивший с острым параноидным психозом, бессонницей, тревогой, сильным психомоторным возбуждением и агрессией. Всего через полчаса после внутримышечной инъекции первых 10 мг галоперидола этот молодой человек, до того агрессивно отвергавший любые предложения персонала принимать лекарства, начал сотрудничать с персоналом и спокойно принял снотворное, после чего уснул. На следующее утро у юноши уже не было никаких признаков психоза, он был абсолютно нормален, спокоен, адекватен, доступен контакту и через 2 нед был выписан в ремиссии с рекомендацией принимать в качестве поддерживающей терапии 1 мг галоперидола в сутки (J.Moncrieff, 2013).
Молодой человек следовал этой рекомендации на протяжении 7 лет, в течение которых он успел благополучно окончить архитектурный факультет, работал архитектором, женился, у него появились дети, он вел абсолютно нормальную социальную жизнь, имел много друзей. После 7 лет приема галоперидола в дозе 1 мг, в возрасте 25 лет, молодой человек решил, что больше не нуждается в галоперидоле, и будучи поддержан в этом решении местным наблюдавшим его врачом, но вопреки мнению П.Диври, Ж.Бобона и П.Янссена, считавших, что поддерживающую терапию нужно продолжить, прекратил принимать галоперидол. Всего через несколько дней после прекращения приема галоперидола психоз вернулся, причем на этот раз даже более высокие, чем первоначально использованные для его лечения в 18-летнем возрасте 10 мг дозы галоперидола уже не могли ему помочь. К прежнему до бросания приема галоперидола уровню социального функционирования этот молодой человек уже не смог вернуться никогда (J.Moncrieff, 2013).
Важно отметить, что галоперидол был не просто «еще одним новым АП». Большая антипсихотическая мощность, высокая потентность галоперидола по сравнению с хлорпромазином, его быстро наступающее и длительное воздействие на продуктивную (галлюцинаторно-бредовую) симптоматику шизофрении, а также то, что он относительно мало связывается с a1-адренорецепторами, М-холинорецепторами и H1-гистаминовыми рецепторами, обеспечили ему лучшую по сравнению с хлорпромазином переносимость, возможность применения с первых дней в полных АП-дозах (без необходимости медленного наращивания доз, как у хлорпромазина), гораздо меньший уровень седации, ортостатической гипотензии и тахикардии, холинолитических побочных эффектов (запоры, задержка мочи, делирий и др.), сексуальных расстройств. Эти свойства наряду с отсутствием свойственной хлорпромазину гепатотоксичности, более низкой склонностью вызывать аллергические реакции обусловили широкое распространение и популярность галоперидола. Для своего времени этот препарат был даже более революционным, чем хлорпромазин. Именно благодаря внедрению в практику галоперидола многие длительно или пожизненно институционализированные пациенты с психозами, в том числе не переносящие хлорпромазин или не получающие от него должного эффекта, получили возможность социализации и возвращения к жизни вне стен больничных заведений (M.Singh, S.Kay, 1975; E.Richelson, A.Nelson, 1984).
Как рассказывал в 1990-х годах историку психиатрии Дэвиду Хейли сам П.Янссен, вспоминая эту историю, именно случай упомянутого юноши как никогда убедительно показал как ему самому, так и психиатрам П.Диври и Ж.Бобону, участвовавшим в курации этого случая, важность и полезность длительной поддерживающей АП-терапии шизофрении. К этому времени было уже известно, как непосредственно из клинической практики, так и из статистических данных, что многие, если не большинство, больных шизофренией необоснованно бросают поддерживающую АП-терапию, в которой на самом деле нуждаются. Было также уже известно, что проблема низкой приверженности больных шизофренией длительной поддерживающей АП-терапии – одно из основных препятствий к поддержанию долгосрочных и качественных ремиссий (J.Moncrieff, 2013).
Это подтолкнуло П.Янссена и его сотрудников искать способы обеспечить гарантированное длительное поступление в организм АП после однократной внутримышечной инъекции, которую было бы легче уговорить или заставить больного сделать, чем обеспечивать ежедневный контроль за постоянным приемом перорального АП.
К этому времени химикам-фармакологам уже было известно (из опыта создания пролонгированных форм препаратов половых гормонов – тестостерона, прогестерона, эстрадиола), что одним из способов обеспечить длительное постепенное высвобождение препарата после однократной внутримышечной инъекции является его этерификация – присоединение при помощи эфирной связи к исходной молекуле препарата остатка той или иной жирной кислоты с достаточно длинным углеродным скелетом (например, декановой, пальмитиновой или энантовой жирных кислот). При этом получается препарат, не растворимый в воде, но хорошо растворимый в стерильных инъекционных маслах и медленно разрушающийся эстеразами в мышечной ткани после инъекции. Длина же углеродного скелета жирной кислоты определяет продолжительность действия пролонгированного препарата (чем длиннее эфирный «хвост», тем больше период полувсасывания и полувыведения – T1/2). В середине 1960-х годов, когда П.Янссен и его команда решили заняться созданием пролонгированной формы галоперидола, в США уже были коммерчески доступны (с 1966 и 1967 г. соответственно) первые ПАП другой фирмы – флуфеназина энантат с длительностью действия около 1 нед и применяемый по сей день флуфеназина деканоат с длительностью действия около 1 мес. Эти препараты послужили доказательством принципиальной возможности создания ПАП (D.Johnson, 2009). Таким образом, сама концепция не была новой для П.Янссена и его команды.
Основываясь на этом же принципе, П.Янссен и его команда синтезировали галоперидола деканоат. В Бельгии, на родине первооткрывателя, препарат стал применяться практически сразу после его появления в 1968 г., став, таким образом, одним из первых ПАП, доступных в этой стране (флуфеназина деканоат, наоборот, был первоначально доступен в США, и некоторое время его не было в европейских странах). Несмотря на то что галоперидола деканоат с формальной точки зрения не был исторически первым ПАП (первым был флуфеназина деканоат), в Бельгии этот препарат в то время революционизировал поддерживающую терапию шизофрении и радикально снизил количество рецидивов при ней за счет обеспечения более высокой приверженности больных длительной АП-терапии (H.Meltzer, S.Fatemi, 1998; J.Moncrieff, 2013). Однако вследствие бюрократических сложностей, традиционно сопровождавших регистрацию первых АП (достаточно вспомнить хотя бы историю о том, что из-за позиции Управления по контролю пищевых продуктов и лекарств в США – Food and Drug Administration, FDA– хлорпромазин вплоть до конца 1970-х годов в США был зарегистрирован не как АП, а лишь как противорвотное средство и применялся по основному показанию де-факто off-label), во всей остальной Европе, кроме Бельгии и Франции, галоперидола деканоат стал коммерчески доступен лишь в 1981 г., а в США еще позже – только в 1986 г. (P.Knudsen, 1985).
По сей день галоперидола деканоат является одним из самых коммерчески успешных, широко применяемых и доступных пролонгированных типичных АП (ПТАП), не в последнюю очередь благодаря своей дешевизне и высокой АП-активности (H.Meltzer, S.Fatemi, 1998; J.Moncrieff, 2013).
Чтобы читатель понимал, почему создание первых ПАП – такая важная историческая веха в развитии психофармакологии, мы перед тем как перейти к дальнейшему описанию истории создания различных ПАП компании «Янссен», поговорим о том, какие сравнительные преимущества имеют ПАП перед непролонгированными АП и каковы их сравнительные недостатки.
Преимущества и недостатки пролонгированных форм АП по сравнению с непролонгированными
Преимущества ПАП:• У пациента отсутствует необходимость в ежедневном пероральном приеме АП, а у родственников или персонала, соответственно, отсутствует необходимость в постоянном контроле за соблюдением пациентами режима терапии (J.Gerlach, 1995; G.Remington, M.Adams, 1995).
• Снижается вероятность преднамеренных или случайных (непреднамеренных) пропусков или «забываний» введения в организм препарата (J.Gerlach, 1995; G.Remington, M.Adams, 1995).
• Повышается удобство терапии АП и приверженность больных длительному приему АП (J.Gerlach, 1995; G.Remington, M.Adams, 1995).
• Также снижается риск преднамеренной или случайной (непреднамеренной) передозировки препарата (J.Gerlach, 1995; G.Remington, M.Adams, 1995).
• После прекращения лечения ПАП концентрация активного вещества в крови снижается гораздо медленнее, чем после прекращения приема или введения непролонгированных форм АП. Это уменьшает риск ранних рецидивов заболевания вскоре после окончания лечения (S.Brissos и соавт., 2014).
• При использовании инъекционных ПАП исключается «эффект первого прохождения через печень». Это обеспечивает более предсказуемую фармакокинетику АП, меньшую ее зависимость от генетических особенностей цитохромов P450 печени конкретного пациента, более высокую и более предсказуемую биодоступность, более четкую и линейную зависимость концентрации препарата в крови от дозы (P.Rocca и соавт., 2013).
Недостатки ПАП:
• В случае непреднамеренной передозировки, или возникновения после введения ПАП тяжелых побочных эффектов – ПЭ (например, тяжелого экстрапирамидного синдрома – ЭПС, тяжелой акатизии или злокачественного нейролептического синдрома), или проявлений лекарственной аллергии, вынуждающих к немедленной отмене препарата, отсутствует возможность добиться ускорения элиминации препарата. Это увеличивает продолжительность и тяжесть проявления данных ПЭ, а в некоторых случаях, например при возникновении злокачественного нейролептического синдрома, может даже быть опасным для жизни пациента (J.Gerlach, 1995; G.Remington, M.Adams, 1995).
• Отсутствует возможность оперативного маневрирования концентрацией АП в крови при ухудшении и последующем быстром улучшении состояния. Это может вынуждать в некоторых случаях кратковременно добавлять непролонгированный пероральный или инъекционный препарат к уже находящейся в организме «базисной» дозе ПАП при ухудшении состояния и отменять этот «довесок» (пероральную или быстродействующую инъекционную суплементацию) при последующем улучшении состояния.
• Отсутствует возможность организации «лекарственных каникул» (специально рекомендованных врачом кратковременных, обычно на 1–2 дня, и регулярных, например ежемесячных или еженедельных, отмен или снижений доз АП), которые, как считают некоторые специалисты, могут снизить риск развития поздних дискинезий (ПД) при длительной терапии АП, особенно ТАП.
• В случае применения ПТАП или высоких доз ПААП, при которых ААП теряют свою «атипичность» и могут вызывать выраженные ЭПС или акатизию, может возникнуть необходимость в пероральном приеме холинолитических корректоров, b-адреноблокаторов и других препаратов. Это нередко не дает возможности полностью уйти от пероральной терапии с присущими ей проблемами удобства лечения, приверженности больных терапии и необходимости контроля приема препаратов родственниками пациентов или персоналом. Кроме того, такая вынужденная необходимость в пероральных препаратах для коррекции ПЭ от ПАП усложняет и удорожает схему лечения, снижает ее удобство и приверженность больных терапии.
Тем не менее, несмотря на наличие у ПАП упомянутых недостатков, суммарный баланс сравнительных преимуществ и недостатков, как считают сегодня большинство специалистов, положителен в пользу пролонгированных форм.
• Для минимизации вышеперечисленных недостатков применения пролонгированных форм антипсихотиков важно проводить предварительную проверку переносимости молекулы (о чём указано в инструкциях по применению препаратов).
Показано, что именно непрерывность, последовательность и преемственность лечения АП на всех этапах болезни, как в стационаре, так и вне его, является одним из важнейших предикторов для более благоприятного долгосрочного прогноза шизофрении. Между тем клинические, психологические и экономические проблемы, возникающие из-за низкого уровня критичности пациентов с шизофренией к собственной болезни и вытекающего из этого низкого уровня приверженности их соблюдению режима АП-терапии, частого необоснованного самовольного прекращения ими лечения или самовольного снижения доз АП, осложняют проведение пероральной АП-терапии, особенно длительной. Это подчеркивает важность обеспечения непрерывной доставки АП в организм больного на всех этапах лечения шизофрении. Именно для того, чтобы решить эту проблему и повысить приверженность больных шизофренией АП-терапии, и были введены в клиническую практику ПАП (N.Daghistani, J.Rey, 2016).
Большинство исследователей отмечают, что применение при шизофрении инъекционных форм ПАП снижает как процент госпитализаций, так и процент внегоспитальных (амбулаторно купируемых) рецидивов и обострений психозов, повышает приверженность больных лечению и уменьшает риск преждевременного его прекращения, сокращает время пребывания больных в стационаре, а также способствует становлению и поддержанию более качественных, более глубоких и длительных ремиссий по сравнению с пероральным приемом АП (G.Kaplan и соавт., 2013; C.Montemagni и соавт., 2016). Современные исследования указывают на то, что среди всех существующих сегодня терапевтических альтернатив именно инъекционные формы ПАП способны обеспечить наиболее оптимальную и эффективную стратегию поддерживающего лечения шизофрении, его непрерывность на всех этапах болезни (R.Herold, 2017). В сумме это улучшение результатов лечения приводит к снижению социальной и экономической нагрузки при лечении шизофрении, уменьшению как прямых, так и косвенных расходов и семьи больного, и системы здравоохранения, снижению экономических потерь общества от госпитализации и временной нетрудоспособности больных (G.Kaplan и соавт., 2013).
Некоторые исследователи даже указывают на то, что применение ПАП может в большей степени тормозить прогрессирование шизофрении, нарастание когнитивных нарушений, негативной симптоматики («шизофренического дефекта личности») и в большей степени положительно влиять на долгосрочные функциональные исходы больных шизофренией по сравнению с пероральными формами АП. Происходит это за счет лучшего противорецидивного эффекта у ПАП по сравнению с пероральными АП. Это, в свою очередь, приводит к уменьшению влияния кумулятивной когнитивной и поведенческой токсичности каждого из перенесенных психозов (за счет уменьшения числа эпизодов психозов за жизнь) на долгосрочные функциональные исходы больных шизофренией, к торможению нарастания негативной и когнитивной симптоматики и улучшению социализации больных. Раннее, своевременное применение ПАП, по некоторым данным, также способно затормозить нарастание резистентности шизофрении и отсрочить перевод на клозапин или даже полностью его избежать (C.Montemagni и соавт., 2016).
Ранее традиционно считалось, что ПАП следует резервировать для больных шизофренией в поздних стадиях заболевания, а также для больных с наиболее тяжелой и выраженной симптоматикой, низкой эффективностью лечения или выраженной резистентностью, более частыми и тяжелыми рецидивами, а также низким уровнем критики, осознания болезни или низкой приверженностью лечению, предысторией неоднократного бросания лечения АП. Однако в последние годы происходит смена парадигмы в пользу более частого применения ПАП на более ранних стадиях болезни и у более широкого круга больных (A.González-Rodríguez и соавт., 2015).
Основными показаниями для назначения ПАП являются (P.Llorca и соавт., 2013):
• В 1-й линии терапии:
– Шизофрения.
– Шизоаффективное расстройство.
– Хронические бредовые расстройства.
• В качестве терапии 2-й линии при неэффективности пероральной терапии или низкой приверженности к лечению:
– Биполярное аффективное расстройство с частыми и тяжелыми маниями.
– Некоторые расстройства личности с выраженной агрессивностью, злобностью.
Для удобства читателя мы также приведем здесь сводную справочную таблицу всех присутствующих ныне на рынке ПТАП, их режимов дозирования, методов пересчета пероральной дозы ТАП в дозу ПТАП и др. (табл. 1).

Важная веха на пути к ПААП – дифенилбутилпиперидины
Во многих книгах, посвященных истории психиатрии и психофармакологии, и, в частности, истории создания современных ПААП, часто незаслуженно забывают о такой важной вехе на пути к современным ПААП, как синтез дифенилбутилпиперидиновых АП – пимозида, флуспирилена, пенфлюридола. Между тем история их создания тоже весьма интересна и поучительна, а их синтез и внедрение в клиническую практику и научный оборот также относятся к заслугам именно П.Янссена и его команды.Предыстория создания дифенилбутилпиперидиновых АП такова. Уже к началу 1960-х годов первоначальный энтузиазм по поводу синтеза все более и более мощных и вызывающих все более и более выраженный ЭПС АП из числа селективных D2-блокаторов – энтузиазм, приведший к созданию таких препаратов, как трифлуперидол, дроперидол, бенперидол (кстати, тоже разработки команды П.Янссена) и тиопроперазин, стал угасать. Одновременно в среде как практикующих психиатров, так и химиков-фармакологов стало постепенно накапливаться понимание того, что вызываемые мощными АП выраженные ЭПС и акатизия, нейролептические депрессии, вторичная негативная и когнитивная симптоматика (нейролептический дефицитарный синдром), а также седация и прибавка массы тела не только осложняют и затрудняют лечение шизофрении как таковой, но и являются одними из основных причин низкой приверженности больных шизофренией лечению АП, явного или скрытого отказа от лечения данными препаратами.
Кроме того, уже к началу 1960-х годов в среде практикующих психиатров начали появляться первые проблески понимания принципиальной ограниченности эффекта существовавших тогда АП в отношении негативной, когнитивной и депрессивной симптоматики шизофрении. К ним также начало постепенно приходить осознание того, что именно негативная, когнитивная и депрессивная симптоматика даже в большей степени, чем продуктивная психотическая симптоматика, определяет долгосрочные функциональные исходы больных шизофренией, а также степень социальной и профессиональной адаптированности таких больных. Сегодня это уже является «общим местом», но в начале 1960-х годов было очевидно еще далеко не всем.
На этом фоне у практикующих психиатров еще в начале 1960-х годов, задолго до оформления современной концепции ААП, начал постепенно формироваться запрос на создание такого АП, который был бы одновременно и мощным, высокопотентным (в идеале не уступающим по селективному антипсихотическому действию и по миллиграммовой потентности уже упоминавшимся галоперидолу и фторфеназину), и вызывающим по возможности меньше ЭПС, вторичной негативной и когнитивной симптоматики, нейролептических депрессий. В идеале такой АП даже должен был бы обладать некой собственной активностью в отношении когнитивной, негативной и депрессивной симптоматики. Еще одним теоретически желательным свойством для такого АП в тогдашней психиатрической литературе назывался длительный период полувыведения из организма – такой, чтобы одно-двукратный случайный пропуск перорального приема мало влиял на общую эффективность АП-терапии и в идеале были возможны пероральный прием или инъекционное введение препарата 1 раз в несколько дней или 1 раз в неделю. Теоретически это должно было повысить приверженность больных шизофренией АП-терапии.
И здесь так же, как в истории с галоперидолом и галоперидола деканоатом, передовые разработки в науке снова принадлежали П.Янссен и его команде. Отвечая на описанный запрос рынка, сотрудники компании «Янссен» под непосредственным руководством П.Янссена в 1963 г. синтезировали первый дифенилбутилпиперидиновый пероральный АП – пимозид. Пимозид и его аналоги в наше время часто называют «АП полуторного поколения (11/2)» или «наполовину атипичные АП». При этом имеется в виду, что I поколение АП – типичные АП – ТАП (галоперидол, флуфеназин и др.), а II поколение АП – ААП (рисперидон, палиперидон, оланзапин и др.). Между тем пимозид и его аналоги обладают свойствами, в некоторых отношениях «промежуточными» между ТАП и ААП, за что и были впоследствии, уже после появления ААП, названы «АП полуторного поколения» или «наполовину атипичные».
В частности, уже в конце 1960-х годов было известно, что пимозид в отличие от ТАП обладает антидепрессивной активностью в экспериментах на животных, а также в отличие от ТАП способен улучшать не только поведение животных (отражающее воздействие на продуктивную симптоматику и агрессивность), но и их когнитивное функционирование и социальное взаимодействие с другими членами сообщества в экспериментальных моделях шизофрении, вызванной воздействием на животных кетамина. Антидепрессивная, антинегативная, просоциальная и прокогнитивная активность пимозида проявляется и при клиническом его применении у человека. Первоначально механизм антидепрессивного, просоциального и прокогнитивного действия пимозида оставался неизвестным. Однако сравнительно недавно было показано, что пимозид в отличие от большинства ТАП обладает сильной 5-HT6- и очень сильной 5-HT7-блокирующей активностью (Ki=71 и 0,5 nM соответственно). А эти свойства сегодня считаются настолько желательными для ААП и обеспечивающими их важные преимущества перед ТАП в отношении влияния на когнитивную, негативную и депрессивную симптоматику шизофрении, что при синтезе новых ААП, таких как луразидон, сейчас уделяется большое внимание желательности наличия у них мощных 5-HT6- и 5-HT7-блокирующих свойств. Таким образом, можно сказать, что пимозид значительно опередил свое время, предвосхитив дальнейшее появление самых современных ААП (R.Mahesh и соавт., 2011).
Кроме того, пимозид обладает очень хорошим профилем переносимости, также сближающим его с современными ААП и позволяющим называть его «АП полуторного поколения». В частности, пимозид вызывает очень мало седации и ортостатической гипотензии, что объясняют его слабым сродством по отношению к H1-гистаминовым рецепторам (Ki=692 nM) и к a1-адренергическим рецепторам (Ki=197,7 nM), мало влияет на углеводный метаболизм и массу тела, что объясняют очень малым сродством к M3-холинергическим рецепторам (Ki=1955 nM). Также пимозид подобно современным ААП вызывает относительно мало ЭПС, что связывают как с его способностью сильно блокировать 5-HT6- и 5-HT7-рецепторы, так и с его довольно сильной (Ki=48,4 nM) тропностью к 5-HT2A-рецепторам, тем самым рецепторам, с блокадой которых обычно связывают пониженную способность ААП вызывать ЭПС (L.Brunton и соавт., 2017).
Выраженную способность пимозида блокироватьa-субъединицу калиевых каналов, или иначе белок hERG (Ki=18 nM), а также верапамил-чувствительные медленные кальциевые каналы, тоже связывают не только с его способностью удлинять интервал QT и вызывать сердечные аритмии, в том числе жизнеопасные, но и с возможным вкладом этих свойств в сильный АП-эффект препарата. Принято считать, что именно благодаря наличию этих дополнительных рецепторных свойств пимозид в отличие от ТАП способен вызывать АП-эффект при дозах, не обеспечивающих 65–70% степень блокады дофаминовых D2-рецепторов стриатума, и, таким образом, давать в терапевтических дозах менее выраженные ЭПС, чем ТАП (L.Brunton и соавт., 2017). Важным положительным свойством пимозида, обеспечившим его коммерческий успех, явился также его большой T1/2 (55–65 ч), позволяющий применять препарат 1 раз в сутки и даже 1 раз в 2 дня и снижающий риск рецидива заболевания при нерегулярном приеме или случайных пропусках (H.Meltzer, S.Fatemi, 1998; S.Stahl, N.Muntner, 2013; L.Brunton и соавт., 2017).
Вслед за успехом пимозида в том же 1963 г. командой П.Янссена был запущен в продажу внутримышечный пролонгированный аналог препарата – флуспирилен, допускающий внутримышечное введение 1 раз в неделю и также обладающий многими из присущих пимозиду «наполовину атипичных» свойств, в частности хорошей переносимостью, относительно низким уровнем ЭПС и положительным влиянием на негативную и когнитивную симптоматику и социальное функционирование больных шизофренией. В 1968 г. компанией «Янссен» был запущен третий дифенилбутилпиперидиновый АП, обладающий очень большим T1/2 даже при пероральном приеме, – пенфлюридол, допускающий пероральное применение в режиме 1 раз в неделю. Это наряду с хорошей переносимостью дифенилбутилпиперидинов, безусловно, повышает удобство лечения и приверженность больных АП-терапии (H.Meltzer, S.Fatemi, 1998; S.Stahl, N.Muntner, 2013).
Видный советский фармаколог М.Д.Машковский еще в 1970-х годах называл пимозид и флуспирилен важными средствами социальной реабилитации больных шизофренией, подчеркивая их специфическое активирующее, растормаживающее, социализирующее действие, облегчение под их влиянием вовлечения больных в трудовые процессы (М.Д.Машковский, 2002).
Несмотря на то что дифенилбутилпиперидиновые производные (пимозид, флуспирилен, пенфлюридол) были значительным шагом вперед по сравнению с галоперидолом в отношении переносимости, так же как галоперидол был прорывом по сравнению с хлорпромазином, проблема ЭПС и при применении дифенилбутилпиперидинов продолжала оставаться актуальной. В ответ на запросы рынка компания «Янссен» в 1968 г. синтезировала, а в 1972 г. выпустила на рынок инновационный антихолинергический корректор дексетимид, отличием которого от тригексифенидила, бензтропина, биперидена и других имевшихся на рынке корректоров, была большая продолжительность действия – до 3 дней после однократной инъекции. Это позволяло эффективно контролировать ЭПС у пациентов, получающих АП-терапию, и повысить их приверженность лечению (R.Dom и соавт., 1971; H.Huygens и соавт., 1973). Компания также продолжила работать над улучшением переносимости АП, что привело к последующему синтезу ею исторически первого «настоящего, постклозапинового ААП» – рисперидона, о котором пойдет речь далее.
Рисполепт Конста – исторически первый ПААП
Появление в конце 1960-х годов дифенилбутилпиперидиновых производных компании «Янссен» (пимозида и флуспирилена), теперь часто называемых «АП полуторного поколения», а также в 1972 г. клозапина доказало принципиальную возможность получения мощного АП-эффекта без выраженных сопутствующих ЭПС и возможность расширения спектра действия АП не только на продуктивную, но и на когнитивную, негативную и депрессивную симптоматику шизофрении. Однако дифенилбутилпиперидины обладают нежелательной способностью удлинять интервал QT и вызывать сердечные аритмии, а клозапин способен в 1–2% случаев вызывать тяжелое и иногда смертельно опасное осложнение – агранулоцитоз (S.Stahl, N.Muntner, 2013).Поэтому с того времени, когда на примерах пимозида и клозапина стало ясно, что ассоциация сильного АП-эффекта с выраженными ЭПС вовсе не является обязательной, усилия химиков-фармакологов всего мира были сосредоточены на разработке таких АП, которые бы по возможности также вызывали мало ЭПС, но не обладали такими же неприятными и опасными ПЭ, как пимозид и клозапин. И, разумеется, этим занималась, в частности, и команда П.Янссена.
Инновационные усилия компании «Янссен» увенчались успехом. В результате целенаправленного поиска соединений с такими свойствами в конце 1980-х годов под непосредственным руководством П.Янссена сотрудники его компании синтезировали рисперидон (Рисполепт), ставший исторически первым «АП II поколения», или первым ААП, и обладающий в отличие от упомянутых пимозида и клозапина хорошим профилем безопасности, в частности, не вызывающим свойственных этим препаратам сердечных аритмий и агранулоцитоза. Именно Рисполепт (рисперидон) стал первым «настоящим», целенаправленно синтезированным, а не случайно открытым, как клозапин, т.е. постклозапиновым ААП. Именно рисперидон открыл собой эру широкого применения ААП в психиатрии, поскольку из-за риска агранулоцитоза клозапин считался и продолжает считаться препаратом глубокого резерва для тяжелых и резистентных форм шизофрении. В 1993 г. рисперидон был официально одобрен FDA и поступил в продажу в США (H.Meltzer, S.Fatemi, 1998; S.Stahl, N.Muntner, 2013).
Во множестве исследований показано, что рисперидон имеет лучшую переносимость по сравнению с ТАП, значительно более низкий уровень ЭПС, нейролептических депрессий, вторичной негативной симптоматики, а также в отличие от ТАП обладает высокой эффективностью в отношении не только продуктивных, но и негативных, депрессивных и когнитивных симптомов шизофрении (S.Leucht и соавт., 1999; M.Krebs и соавт., 2006).
Хорошая переносимость рисперидона, более низкий по сравнению с ТАП уровень ЭПС и вторичной ятрогенной негативной симптоматики при его приеме, а также его более широкий по сравнению с ТАП спектр эффективности в отношении различных субдоменов симптоматики шизофрении, включая негативную, когнитивную и аффективную симптоматику, способствовали повышению приверженности больных шизофренией длительной АП-терапии, улучшению их социализации, уменьшению стигматизации, повышению общего качества их жизни. Как говорил сам П.Янссен по этому поводу: «врачи поблагодарили меня за галоперидол, но пациенты поблагодарили меня за рисперидон» (S.Leucht и соавт., 1999; M.Krebs и соавт., 2006).
Вскоре после появления рисперидона другие компании-производители также выпустили конкурирующие пероральные ААП. Так появились кветиапин, оланзапин, арипипразол, зипрасидон, а затем и другие. Процесс пополнения группы пероральных ААП продолжается и сегодня. Так, относительно недавно на мировом рынке появились азенапин, карипразин, илоперидон, луразидон.
Однако внедрение в психиатрическую практику пероральных ААП хотя и позволило улучшить качество жизни больных шизофренией, снизить уровень ЭПС и повысить эффективность лечения негативных, аффективных и когнитивных симптомов болезни, приверженность больных длительной поддерживающей АП-терапии, тем не менее не смогло полностью решить проблему недостаточной приверженности этих больных лечению.
Принципиальным недостатком терапии ААП по сравнению с ТАП долгое время являлось отсутствие инъекционных форм, как простых (непролонгированных), так и в особенности пролонгированных. Это ограничивало возможные сферы применения ААП относительно нетяжелыми и сохранными больными, согласными принимать препараты перорально, приверженными терапии и хотя бы частично критичными к своей болезни (Е.В.Оленева и соавт., 2017).
С другой стороны, применение единственных доступных до недавнего времени ПАП, а именно типичных (ПТАП), таких как галоперидола деканоат, фторфеназина деканоат и других, сдерживалось их низкой эффективностью в отношении негативных, депрессивных и когнитивных симптомов шизофрении, высоким риском возникновения выраженных ЭПС, вторичной ятрогенной негативной симптоматики, нейролептических депрессий, повышением риска возникновения ПД при длительной терапии, нередкой необходимостью в сопутствующем пероральном приеме корректоров, т.е. по сути теми же недостатками, которые свойственны пероральным или быстродействующим инъекционным формам ТАП (Е.В.Оленева и соавт., 2017).
В то же время несомненными преимуществами ПТАП перед пероральными или быстродействующими инъекционными формами ТАП являются возможность обеспечения более высокого уровня приверженности терапии АП, а также то, что при использовании ПТАП достигаются более низкие равновесные концентрации АП в крови, чем при использовании пероральных или быстродействующих инъекционных форм, и отсутствуют резкие колебания концентрации в крови, свойственные пероральным или быстродействующим инъекционным ТАП. Это способствует повышению эффективности и безопасности терапии ПТАП по сравнению с пероральными формами ТАП (Е.В.Оленева и соавт., 2017).
В свете всего сказанного совершенно логично, что у специалистов сформировался запрос на ПААП как препарат, который бы объединял в себе преимущества инъекционных ПАП в плане обеспечения приверженности пациентов терапии АП и низкого уровня колебаний концентрации в крови с такими достоинствами пероральных ААП, как лучшая переносимость по сравнению с ТАП, более низкий уровень ЭПС, более высокая безопасность применения (например, снижение риска ПД), большая по сравнению с ТАП эффективность в отношении негативных, аффективных и когнитивных симптомов шизофрении. Отвечая на этот запрос рынка, компания «Янссен» в начале 2000-х годов разработала и в 2003 г., уже после смерти основателя компании П.Янссена, выпустила на рынок исторически первый ПААП – инъекционный рисперидон пролонгированного действия под торговым наименованием Рисполепт Конста (Е.В.Оленева и соавт., 2017).
Как и в случае с пероральным рисперидоном, ставшим родоначальником целого нового класса АП – ААП, вслед за выпуском компанией «Янссен» исторически первого ПААП – Рисполепта Конста, другие конкурирующие компании-производители также выпустили пролонгированные инъекционные версии своих ААП. Так были введены в клиническую практику оланзапина памоат, арипипразола моногидрат и арипипразола лауроксил, также позволяющие введение 1 раз в месяц (M.Bernardo, M.Bioque, 2016).
Стоит заметить, что при создании Рисполепта Конста компания «Янссен» столкнулась с уникальной трудностью, именно вследствие которой от возникновения идеи до ее практического воплощения прошло 10 лет. В молекуле рисперидона нет подходящего гидроксильного радикала, из-за этого он не может быть этерифицирован без потери эффективности. Таким образом, традиционные методы создания ПАП путем этерификации молекулы и растворения эфира АП в масле оказались неприменимы к рисперидону. Однако ученые компании «Янссен» с честью вышли из данного затруднения, предложив уникальную технологию создания пролонгированного препарата в виде водной суспензии специальных биосовместимых и биодеградируемых микросфер, постепенно высвобождающих рисперидон с поверхности в процессе своего разрушения после инъекции (Е.В.Оленева и соавт., 2017).
Помимо того что такая технология вообще позволила впервые создать пролонгированную форму ААП, она дала еще ряд преимуществ. В частности, благодаря такой форме выпуска пролонгированного рисперидона при его введении отсутствуют проблема аллергии на масляный растворитель и консервант (нередко встречающейся при применении ПТАП), выраженная местная болезненность, риск образования масляных гранулем (олеом) или абсцессов, обеспечивается более равномерная терапевтическая концентрация рисперидона в крови на протяжении всего срока действия инъекции, чем характерные для ПТАП графики концентраций с плавным повышением в 1-ю неделю и последующим снижением (Е.В.Оленева и соавт., 2017).
С созданием Рисполепта Конста компания «Янссен» задала новый тренд в индустрии ПАП. Все новые ПААП, выходящие на рынок, даже те, которые теоретически могли бы быть созданы в виде масляных растворов (например, оланзапина памоат), теперь производятся в виде водных суспензий, содержащих микрокристаллы (M.Bernardo, M.Bioque, 2016).
Тревикта – исторически первый сверхпролонгированный АП
После создания Рисполепта и Рисполепта Конста компания «Янссен» продолжила работу над улучшением переносимости и эффективности ААП. Результатом этой работы было появление на рынке США в 2006 г. и в Евросоюзе в 2007 г. палиперидона (Инвега) – основного активного метаболита рисперидона (палиперидон – это 9-гидроксирисперидон), обладающего улучшенными по сравнению с исходным соединением фармакодинамическими и фармакокинетическими свойствами. В частности, палиперидон меньше зависит от особенностей генетики цитохромов P450 печени конкретного пациента, создает более предсказуемую и более линейно зависящую от дозы концентрацию в крови после перорального приема, имеет длительный T1/2 (24 ч), позволяющий применять его 1 раз в сутки, и выпускается в виде специальной пероральной пролонгированной формы (OROS Extended Release), которая обеспечивает медленное всасывание и высвобождение препарата, отсутствие резкого пика концентрации вскоре после приема, что сглаживает ЭПС и другие ПЭ на пике (F.Awouters, P.Lewi, 2007; S.Stahl, N.Muntner, 2013; N.Daghistani, J.Rey, 2016).К важным достоинствам палиперидона (Инвеги) по сравнению с рисперидоном (Рисполептом) относится также его улучшенный рецепторный профиль. В силу меньшей a1-адреноблокирующей и H1-гистаминоблокирующей активности по сравнению с рисперидоном палиперидон вызывает меньше ортостатической гипотензии, тахикардии и седации. А более благоприятное соотношение 5-HT2A- и D2-блокады у палиперидона по сравнению с рисперидоном обеспечивает более низкий уровень ЭПС и меньшую выраженность гиперпролактинемии по сравнению с рисперидоном (F.Awouters, P.Lewi, 2007; S.Stahl, N.Muntner, 2013; N.Daghistani, J.Rey, 2016).
Вслед за выпуском перорального палиперидона (Инвега) компания «Янссен» создала его пролонгированные формы, что позволило еще больше повысить удобство поддерживающей терапии и повысить приверженность больных данному препарату. В 2009 г. появился палиперидона пальмитат, позволяющий введение 1 раз в месяц, под торговыми названиями Инвега Сустенна (в США) и Ксеплион (в Европе и РФ) [S.Stahl, N.Muntner, 2013; N.Daghistani, J.Rey, 2016].
А в 2015 г. компания «Янссен» зарегистрировала в США новую, уникальную, не имеющую пока аналогов на рынке ПАП сверхпролонгированную форму палиперидона пальмитата, позволяющую введение 1 раз в 3 мес (т.е. достаточно всего 4 инъекций в год), под торговыми названиями Инвега Тринза (в США) и Тревикта (в ЕС и РФ). В России Тревикта была зарегистрирована в 2016 г., стала доступна для пациентов в марте 2017 г. Это позволяет значительно повысить удобство лечения и приверженность больных терапии, освобождает их от частых контроля и инъекций (N.Daghistani, J.Rey, 2016).
Важно отметить, что, хотя палиперидона пальмитат является эфиром активного соединения (палиперидона) с жирной кислотой, он, как и другие современные ПААП, в обеих своих формах (Ксеплион и Тревикта) производится не в виде масляного раствора, а в виде суспензии микрокристаллов. Таким образом, у Ксеплиона и Тревикты изначально имеются те же преимущества перед масляными растворами ПАП, которые были нами указаны для Рисполепта Конста, а именно: отсутствие аллергических реакций на масло, местной болезненности, риска образования олеом, неравномерности всасывания. Различие между Ксеплионом и Тревиктой – в размере микрокристаллов суспензии, что приводит к различиям в скорости всасывания и выведения и, как следствие, различиям в длительности действия (N.Daghistani, J.Rey, 2016).
Перспективные разработки компании «Янссен» в области сверхпролонгированных АП
Разработав уникальную сверхпролонгированную форму палиперидона пальмитата, позволяющую введение 1 раз в 3 мес (4 раза в год) – препарат Тревикта, компания «Янссен» отнюдь не почила на лаврах, а продолжила разработки новых сверхпролонгированных форм ААП.
В компании «Янссен» считают, что за сверхпролонгированными формами ААП, позволяющими введение 1 раз в несколько месяцев, – большое будущее, и это позволит революционизировать поддерживающую терапию шизофрении и повысить приверженность больных терапии еще в большей мере, чем в свое время произвели революцию первые ПТАП (галоперидол-деканоат и др.), а затем первый ПААП – Рисполепт Конста (B.Yerragunta и соавт., 2015).
 В настоящее время известно, что подобно тому, как вслед за Рисполептом появились и другие ААП, а вслед за Рисполептом Конста – другие ПААП, ряд компаний-конкурентов, впечатлившись рыночным успехом препарата Тревикта, также ведет разработку собственных сверхпролонгированных форм ААП. В частности, на ранних стадиях находится разработка 3-месячной пролонгированной формы арипипразола (L.Citrome, 2016), а также импланта арипипразола (A.Hedayati и соавт., 2017).
В настоящее время известно, что подобно тому, как вслед за Рисполептом появились и другие ААП, а вслед за Рисполептом Конста – другие ПААП, ряд компаний-конкурентов, впечатлившись рыночным успехом препарата Тревикта, также ведет разработку собственных сверхпролонгированных форм ААП. В частности, на ранних стадиях находится разработка 3-месячной пролонгированной формы арипипразола (L.Citrome, 2016), а также импланта арипипразола (A.Hedayati и соавт., 2017).Однако, как всегда, компания «Янссен» и здесь оказалась первопроходцем – именно ей принадлежит честь создания первого сверхпролонгированного ААП – препарата Тревикта (в США – Инвега Тринза).
Для удобства читателя мы приведем в краткой табличной форме справочную информацию обо всех присутствующих на сегодняшний день на мировом рынке пролонгированных инъекционных формах ААП, их формах выпуска и дозировках, рекомендуемых режимах введения и методах пересчета доз (табл. 2, 3).
Заключение
Как видно из данных, приведенных нами в обзоре, компания «Янссен» с самого своего прихода на рынок АП всегда находилась и по сей день находится в авангарде инноваций и исследований. К прорывным для своего времени открытиям сотрудников компании «Янссен» относится, в частности, создание галоперидола – не только одного из первых, но и по сей день одного из самых коммерчески успешных и широко применяемых высокопотентных ТАП, а затем и его пролонгированной формы (галоперидола деканоата), в свое время революционизировавшей поддерживающую терапию шизофрении.В этом же инновационном русле лежит и создание компанией «Янссен» в 1960-х годах дифенилбутилпиперидиновых АП длительного действия – пимозида, флуспирилена, пенфлюридола. Эти препараты почти на 2 десятилетия предвосхитили создание современных ААП. Именно они впервые создали более благоприятные условия для социальной реабилитации больных шизофренией, их вовлечения в трудовые процессы. Пимозид и его аналоги задолго до появления клозапина и современных ААП показали принципиальную возможность получения мощного антипсихотического эффекта без тяжелых экстрапирамидных побочных явлений, а также возможность влияния АП на проявления негативной, когнитивной и депрессивной симптоматики.
Добрая традиция компании «Янссен» всегда быть первой или одной из первых с принципиально новыми предложениями на рынке АП была продолжена с созданием Рисполепта (рисперидона) – исторически первого «настоящего», постклозапинового ААП, снискавшего заслуженную любовь как психиатров, так и пациентов. Затем ею был создан Рисполепт Конста, ставший опять-таки исторически первым ПААП и первым в мире ПАП не на масляной основе.
Сегодня компания «Янссен», продолжая свою историческую традицию опережающего развития этого направления в психофармакологии, имеет в своем портфеле инновационный ПААП, аналогов которому нет ни у одного из конкурентов на рынке, – Тревикта. Это особая форма выпуска палиперидона пальмитата, обеспечивающая гарантированное равномерное поступление препарата в кровь в течение 3 мес после инъекции, что позволяет вводить препарат 1 раз в 3 мес, т.е. всего 4 раза в год. Редкие инъекции этой пролонгированной формы значительно повышают приверженность больных терапии, удобство терапии для них самих и их родственников, разгружают врачей и средний медицинский персонал и с фармакоэкономической точки зрения обходятся дешевле, чем инъекции препарата Ксеплион или сопоставимых ПААП 1 раз в месяц. При этом терапевтический эффект как минимум не хуже, чем у 1-месячных форм палиперидона или других ПААП.
Сведения об авторах
Беккер Роман Александрович – исследователь в области психофармакотерапии, Университет им. Давида Бен-Гуриона в Негеве
Быков Юрий Витальевич – ФГБОУ ВО СтГМУ. E-mail: yubykov@gmail.com
Список исп. литературыСкрыть список1. Awouters FH, Lewi PJ. Forty years of antipsychotic Drug research – from haloperidol to paliperidone – with Dr. Paul Janssen. Arzneimittelforschung 2007; 57 (10): 625–32.
2. Bernardo M, Bioque M. Three-month paliperidone palmitate – a new treatment option for schizophrenia.Expert Rev Clin Pharmacol 2016; 9 (7): 899–904.
3. Brissos S, Veguilla MR, Taylor D et al. The role of long-acting injectable antipsychotics in schizophrenia: a critical appraisal. Ther Adv Psychopharmacol 2014; 4 (5): 198–219.
4. Brunton L, Knollman B, Hilal-Dandan R. Goodman and Gilman's The Pharmacological Basis of Therapeutics, 13th Edition. McGraw-Hill Education. 13th Ed. 2017.
5. Citrome L. Emerging pharmacological therapies in schizophrenia: what's new, what's different, what's next? CNS Spectr 2016; 21 (S1): 1.
6. Daghistani N, Rey JA. Invega Trinza: The First Four-Times-a-Year, Long-Acting Injectable Antipsychotic Agent. P T 2016; 41 (4): 222–7.
7. Dom R, Van Lommel R, Baro F. A quantitative study of neuroleptic-induced extrapyramidal symptoms and their response to dexetimide, a potent and long-acting antiparkinsonian agent. Acta Psychiatr Scand 1971; 47 (4): 399–410.
8. D'Souza S, Faraj J, DeLuca P. Microsphere delivery of Risperidone as an alternative to combination therapy. Eur J Pharm Biopharm 2013; 85 (3 Pt. A): 631–9.
9. Gerlach J. Depot neuroleptics in relapse prevention: advantages and disadvantages. Int Clin Psychopharmacol 1995; 9 (Suppl. 5): 17–20.
10. González-Rodríguez A, Catalán R, Penadés R et al. Profile of paliperidone palmitate once-monthly long-acting injectable in the management of schizophrenia: long-term safety, efficacy, and patient acceptability – a review. Patient Prefer Adherence 2015; 9: 695–706.
11. Granger B, Albu S. The haloperidol story. Ann Clin Psychiatry 2005; 17 (3): 137–40.
12. Hedayati A, Yazdi SG, Dehghankelishadi P et al. Preparation, optimization and physicochemical characterization of Aripiprazole loaded nano-porous in situ forming implant. Pharm Nanotechnol 2017.
13. Herold R. Long-acting injection – four-times-a-year. Review of the
3-monthly paliperidone-palmitate injection. Article in Hungarian. Psychiatr Hung 2017; 32 (1): 96–107.
14. Huygens H, Vereecken JL, Tanghe A. Dexetimide (R 16470) in the control of neuroleptic-induced extrapyramidal side-effects. Its prophylactic value and duration of action. Psychiatr Neurol Neurochir 1973; 76 (4): 251–9.
15. Johnson DA. Review Historical perspective on antipsychotic long-
acting injections. Br J Psychiatry 2009; 52 (Suppl.): S7–12.
16. Kaplan G, Casoy J, Zummo J. Impact of long-acting injectable antipsychotics on medication adherence and clinical, functional, and economic outcomes of schizophrenia. Patient Prefer Adherence 2013; 7: 1171–80.
17. Knudsen P. Chemotherapy with neuroleptics. Clinical and pharmacokinetic aspects with a particular view to depot preparations. Acta Psychiatr Scand 1985; 322 (Suppl.): 51–75.
18. Krebs M, Leopold K, Hinzpeter A, Schaefer M. Current schizophrenia drugs: efficacy and side effects. Expert Opin Pharmacother 2006; 7: 1005–16.
19. Leucht S, Pitschel-Walz G, Abraham D, Kissling W. Efficacy and extrapyramidal side-effects of the new antipsychotics olanzapine, quetiapine, risperidone, and sertindole compared to conventional antipsychotics and placebo. A meta-analysis of randomized controlled trials. Schizophr Res 1999; 35: 51–68.
20. Llorca PM, Abbar M, Courtet P et al. Guidelines for the use and management of long-acting injectable antipsychotics in serious mental illness. BMC Psychiatry 2013; 13: 340.
21. López-Muñoz F, Alamo C. The consolidation of neuroleptic therapy: Janssen, the discovery of haloperidol and its introduction into clinical practice. Brain Res Bull 2009; 79 (2): 130–41.
22. Mahesh R et al. Antidepressant like Effect of Pimozide in Acute and Chronic Animal Models of Depression. Indian J Pharmaceutic Educ Res 2011; 45 (1): 46–53.
23. Meltzer HY, Fatemi SH. Treatment of schizophrenia. The American psychiatric text book of psychopharmacology. American Psychiatric Press, Washington 1998; p. 127–35.
24. Moncrieff J. The Bitterest Pills: The Troubling Story of Antipsychotic Drugs. Palgrave Macmillan 2013.
25. Montemagni C, Frieri T, Rocca P. Second-generation long-acting injectable antipsychotics in schizophrenia: patient functioning and quality of life. Neuropsychiatr Dis Treat 2016; 12: 917–29.
26. Navitha A, Jogala S, Krishnamohan C et al. Development of novel risperidone implants using blends of polycaprolactones and in vitro in vivo correlation studies. J Adv Pharm Technol Res 2014; 5 (2): 84–9.
27. Nussbaum AM, Stroup TS. Paliperidone palmitate for schizophrenia. Cochrane Database Syst Rev 2012; 6: CD008296.
28. Ramachandraiah CT, Subramaniam N, Tancer M. The story of antipsychotics: Past and present. Indian J Psychiatry 2009; 51 (4): 324–6.
29. Remington GJ, Adams ME. Depot neuroleptic therapy: clinical considerations. Can J Psychiatry 1995; 40 (3 Suppl. 1): S5–11.
30. Richelson E, Nelson A. Antagonism by neuroleptics of neurotransmitter receptors of normal human brain in vitro. Eur J Pharmacol 1984; 103: 197–204.
31. Rocca P, Sandei L, Bava I, Frieri T. Risperidone long-acting injection in the treatment of first episode schizophrenia. Curr Psychopharmacol 2013; 2: 29–36.
32. Singh MM, Kay SR. A comparative study of haloperidol and chlorpromazine in terms of clinical effects and therapeutic reversal with benztropine in schizophrenia. Theoretical implications for potency differences among neuroleptics. Psychopharmacologia 1975; 43: 103–13.
33. Stahl SM, Muntner N. Stahl's Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. Cambridge University Press. 4th Ed. 2013.
34. Wang L, Wang A, Zhao X et al. Design of a long-term antipsychotic in situ forming implant and its release control method and mechanism. Int J Pharm 2012; 427 (2): 284–92.
35. Yerragunta B, Jogala S, Chinnala KM et al. Development of a novel 3-month drug releasing risperidone microspheres. J Pharm Bioallied Sci 2015; 7 (1): 37–44.
36. Машковский М.Д. Лекарственные средства. Изд. 14-е, перераб., испр. и доп. М.: Новая волна, 2002. / Mashkovskii M.D. Lekarstvennye sredstva. Izd. 14-e, pererab., ispr. i dop. M.: Novaia volna, 2002. [in Russian]
37. Оленева Е.В., Рывкин П.В., Ладыженский М.Я. Инъекционный палиперидона пальмитат трехмесячного действия (Тревикта) – новое слово в длительной терапии больных шизофрении. Совр. терапия психических расстройств. 2017; 1: 35–43. / Oleneva E.V., Ryvkin P.V., Ladyzhenskii M.Ia. In"ektsionnyi paliperidona pal'mitat trekhmesiachnogo deistviia (Trevikta) – novoe slovo v dlitel'noi terapii bol'nykh shizofrenii. Sovr. terapiia psikhicheskikh rasstroistv. 2017; 1: 35–43. [in Russian]


