Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2018
Антидепрессивная терапия и социальное функционирование: выбор антидепрессанта для водителей №01 2018
Номера страниц в выпуске:27-31
Современные алгоритмы антидепрессивной терапии предполагают длительные курсы лечения, поэтому переносимость антидепрессанта с минимизацией поведенческой токсичности необходима для обеспечения полноценного социального функционирования пациентов. В частности, антидепрессанты с выраженным седативным компонентом действия могут замедлять время реакции и ухудшать внимание, тем самым негативно влияя на способность к управлению транспортным средством. В статье приводятся современные данные о подходах к антидепрессивной терапии у водителей, в том числе о дополнительных факторах, повышающих риск аварий на фоне приема антидепрессантов. Обосновываются критерии выбора антидепрессанта для минимизации рисков, связанных с вождением.
Ключевые слова: антидепрессанты, вождение автомобиля.
Для цитирования: Петрова Н.Н., Маркин А.В. Антидепрессивная терапия и социальное функционирование: выбор антидепрессанта для водителей. Психиатрия и психофармакотерапия. 2018; 20 (1): 27–31.
Ключевые слова: антидепрессанты, вождение автомобиля.
Для цитирования: Петрова Н.Н., Маркин А.В. Антидепрессивная терапия и социальное функционирование: выбор антидепрессанта для водителей. Психиатрия и психофармакотерапия. 2018; 20 (1): 27–31.
Современные алгоритмы антидепрессивной терапии предполагают длительные курсы лечения, поэтому переносимость антидепрессанта с минимизацией поведенческой токсичности необходима для обеспечения полноценного социального функционирования пациентов. В частности, антидепрессанты с выраженным седативным компонентом действия могут замедлять время реакции и ухудшать внимание, тем самым негативно влияя на способность к управлению транспортным средством. В статье приводятся современные данные о подходах к антидепрессивной терапии у водителей, в том числе о дополнительных факторах, повышающих риск аварий на фоне приема антидепрессантов. Обосновываются критерии выбора антидепрессанта для минимизации рисков, связанных с вождением.
Ключевые слова: антидепрессанты, вождение автомобиля.
Для цитирования: Петрова Н.Н., Маркин А.В. Антидепрессивная терапия и социальное функционирование: выбор антидепрессанта для водителей. Психиатрия и психофармакотерапия. 2018; 20 (1): 27–31.
Saint Petersburg State University. 199034, Russian Federation, Saint Petersburg, Universitetskaia nab., d. 7/9 petrova_nn@mail.ru
Modern algorithms antidepressant therapy suggest prolonged courses of treatment, therefore, the tolerability of an antidepressant with minimize the behavioural toxicity is necessary to ensure the full social functioning of patients. In particular, antidepressants with pronounced sedative component of action can slow down reaction time and impair attention and thereby adversely affecting the ability to control the vehicle. The article presents modern data about approaches to antidepressant therapy in drivers, including additional factors that increase the risk of accidents in patients receiving antidepressants. Selection criteria of the antidepressant to minimize the risks associated with driving are proposed.
Key words: antidepressants, driving.
For citation: Petrova N.N., Markin A.V. Antidepressive therapy and social functioning: choosing antidepressant for drivers. Psychiatry and Psychopharmacotherapy. 2018; 20 (1): 27–31.
По данным метаанализов, современные антидепрессанты обнаруживают определенные различия по структуре побочных эффектов, что необходимо учитывать при индивидуальных назначениях, особенно если имеются сведения о нежелательных явлениях, развивавшихся у пациента в процессе тимоаналептической терапии ранее [1, 2]. Например, среди селективных ингибиторов обратного захвата серотонина (СИОЗС) флуоксетин считается лидером по частоте гастроинтестинальных расстройств (тошнота, рвота, диарея), флувоксамин – по частоте тошноты, пароксетин – потливости и седации, сертралин – диареи. При этом частота тошноты и рвоты при приеме дулоксетина и венлафаксина (СИОЗС и норадреналина – СИОЗСН) выше, чем у препаратов группы СИОЗС. При приеме миртазапина и пароксетина отмечается значительная прибавка массы тела, а миртазапина и тразодона – выраженная седация.
Согласно рекомендациям S.Kennedy и соавт. «Canadian Network for Mood and Anxiety Treatments» [3] по фармакологическому ведению взрослых пациентов с большим депрессивным расстройством, предназначенные для психиатров и врачей смежных специальностей, прием антидепрессантов должен длиться 6–9 мес после достижения симптоматической ремиссии, а при повышенном риске рецидива – 2 года и более. Имеются данные, подтверждающие это положение. В метаанализе исследований по поддерживающей терапии было выявлено, что антидепрессанты в качестве поддерживающей терапии превосходят плацебо как при длительном приеме от 1 до 12 мес (72 исследования), так и в течение более 12 мес (35 исследований) [4]. Обзор 16 рандомизированных контролируемых исследований – РКИ (n>4000), проведенный Управлением по контролю за качеством пищевых продуктов и лекарственных средств США (FDA), выявил, что преимущество антидепрессантов в качестве поддерживающей терапии над плацебо в 2 раза возрастало при 52-недельном периоде наблюдения по сравнению с 24-недельным (37% против 18% соответственно) [5].
В нескольких рандомизированных плацебо-контролируемых исследованиях продемонстрировано преимущество более длительной поддерживающей антидепрессивной терапии, а именно, в течение 2 лет по сравнению с 1 годом. Если клинические факторы риска отсутствуют, то поддерживающую терапию рекомендовано продолжать более 2 лет (уровни доказательности 3 и 4) [6].
При резком прекращении приема антидепрессантов до 40% пациентов могут испытывать симптомы отмены (бессонница, тошнота, потеря равновесия, сенсорные расстройства, повышенная возбудимость) [7]. Например, формы выпуска пароксетина и венлафаксина немедленного высвобождения чаще вызывают симптомы отмены по сравнению с препаратами с более длительным периодом полувыведения [8].
Приоритетными при выборе препарата становятся минимальная выраженность поведенческой токсичности и спектр побочных действий. Особое значение в этом случае приобретают индивидуальная чувствительность и исходное отношение больного к антидепрессанту и психофармакотерапии в целом. В качестве препаратов выбора выступают антидепрессанты различной структуры, сочетающие мягкий тимоаналептический эффект с хорошей переносимостью [9].
Хорошая переносимость антидепрессивной терапии с минимизацией явлений поведенческой токсичности актуальна для обеспечения активного социального функционирования пациентов, что в современном обществе часто связано с необходимостью вождения автомобиля. Антидепрессанты с выраженным седативным компонентом действия могут замедлять время реакции и ухудшать внимание, тем самым негативно влияя на способность к управлению транспортным средством. Несмотря на отставание по уровню потребления на душу населения от западноевропейских или североамериканских стран, количество продаж антидепрессантов в России за 2016 г. достигло почти 7 млн упаковок только в розничных аптеках (данные IMS – Information Manage) [10].
Метаанализ от 2017 г., включивший данные исследований 1995–2015 гг., показал 40% повышение риска попасть в аварию и более чем трехкратное (отношение шансов – ОШ 3,19) повышение риска попасть в аварию со смертельным исходом у водителей, принимавших антидепрессанты [11].
Доступные зарубежные обзоры применения антидепрессантов у водителей выделяют помимо различий между препаратами дополнительные факторы, повышающие риск аварий на фоне приема антидепрессантов.
Трициклические антидепрессанты (ТЦА), к которым относятся амитриптилин, имипрамин, а также активные метаболиты нортриптилин, дезипрамин и доксепин, повышают вероятность аварии в среднем на 41% [12]. Механизмы, определяющие этот риск, связаны не только с седацией, характерной для всех ТЦА, хоть и выраженной в разной степени, но и с антихолинергическим действием, влияющим на зрение, и риском ортостатической гипотензии.
K.Iwamoto и соавт. (Япония) установили прямую корреляцию между уровнем амитриптилина в плазме и способностью совершения маневров (через 4 ч после приема 25 мг амитриптилина) [13].
A.Brunnauer и соавт. показали, что только 10% пациентов, получающих ТЦА, способны сдать тест на вождение (Global Driving Ability Test), в то время как среди пациентов, применяющих миртазапин, эта цифра выше, хотя и не превышает 50% [14].
В норвежском исследовании J.Bramness и соавт. сравнили 2 группы пациентов: получавших седативные антидепрессанты (ТЦА и миртазапин) и неседативные. Было показано, что в 1-й группе риск дорожных происшествий был на 40% выше (ОШ 1,4, 95% доверительный интервал – ДИ 1,2–1,6) [15].
Пожилой возраст и использование более высоких доз значимо увеличивают риск аварии на фоне терапии амитриптилином. Применение 125 мг амитриптилина у пожилых повышает риск аварии на 220–230% (ОШ 2,2, 95% ДИ 3,1–3,5 [16] и ОШ 2,3, ДИ 1,1–4,8 [17]).
Фактически даже использование субтерапевтических доз ТЦА, недостаточных для адекватной терапии депрессии, ухудшает психомоторные функции и визуальное восприятие, что позволяет относить ТЦА к последней линии терапии депрессии у водителей при наличии альтернативы [14].
СИОЗС и другие современные антидепрессанты продемонстрировали преимущество по сравнению с ТЦА в отношении влияния на избирательность внимания [14], и, казалось бы, проблема выбора антидепрессанта для водителя должна быть решена. Однако в обзорах, посвященных влиянию современных антидепрессантов на способность к вождению, было отмечено, что данные носят «неясный и противоречивый» характер. Возможно, это обусловлено неоднородностью группы препаратов, включенных в исследования. Так, M.Wingen и соавт. сообщили об ухудшении маневрирования транспортным средством в тесте SDLP (Standard Deviation Lateral Position) при использовании как СИОЗС, так и СИОЗСН, но не рассматривая каждый препарат в отдельности [18].
Серьезные различия имеются между плацебо-контролируемыми исследованиями, проведенными в «стерильных» условиях научного эксперимента, и наблюдательными исследованиями из реальной жизни. Например, двойное слепое плацебо-контролируемое исследование 1998 г. показало отсутствие влияния венлафаксина на тест SDLP [19],
а данные натуралистических наблюдений A.LeRoy и cоавт. зафиксировали драматическое увеличение риска аварий при применении венлафаксина на 78%. Аналогичные данные были получены для дулоксетина (78%) и еще в большей степени – для тразодона и нефазадона – риск +90% [12]. Подобные риски были обнаружены и в объемном Норвежском наблюдательном исследовании J.Bramness и соавт. [15].
Для понимания значимости риска аварии, связанного с антидепрессивной терапией, некоторые авторы приводят эквивалентные риски, связанные с уровнем алкоголя в крови, среди них результаты 5-летнего когортного наблюдения за 409 171 взрослым жителем штата Вашингтон. Различные седативные препараты, в том числе и антидепрессант тразодон, принимали 5,8% пациентов (табл. 1) [20].
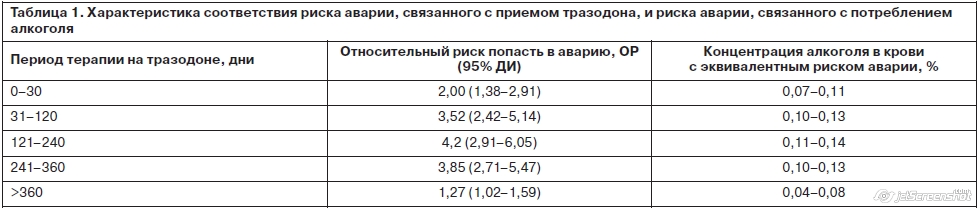
Пик риска аварий отмечен на 4–8-м месяце терапии антидепрессантами, что вступает в противоречие с мнением о возможности полной адаптации к антидепрессантам через 1–2 нед терапии [21] и с мнением, что риск аварий связан исключительно с симптомами депрессии, которая сама по себе может влиять на скорость психомоторных реакций и увеличивает вероятность аварий почти в 2 раза (ОШ 1,9 с разбросом 1,06–3,39) [11].
В целом к факторам, доказано повышающим риск аварий у водителей, принимающих антидепрессанты, относятся:
• пожилой возраст;
• 1-я неделя терапии антидепрессантом;
• резкое повышение дозировки антидепрессанта;
• более высокая степень тяжести депрессии;
• взаимодействие по системе цитохрома при одновременном применении других препаратов, обладающих угнетающим действием на центральную нервную систему (ЦНС) [22].
Подтверждение негативного влияния комбинированной терапии современными антидепрессантами с другим препаратами на способность к управлению автомобилем было получено в исследовании C.Des las Cuevas и соавт. При сочетании СИОЗС или СИОЗСН и других препаратов, влияющих на ЦНС, подавляющее большинство (80%) пациентов не смогли пройти электронные тесты, необходимые для получения водительских прав в Испании [23].
Повышать риски, связанные с вождением автомобиля, могут следующие группы психотропных препаратов [21]:
• Барбитураты – повышают риски в 7,5 раза.
• Бензодиазепины удваивают риск аварий.
• Антипсихотики II поколения повышают риски на 120%.
• Небензодиазепиновые гипнотики: суммарно золпидем, залеплон, эсзопиклон повышали риск на 48%, причем выделение отдельно группы лиц, принимавших золпидем, показало риск выше более чем в 2 раза по сравнению с непринимавшими гипнотики лицами [20].
• Антипаркинсонические средства вызывают внезапные «сонные атаки» почти у каждого третьего пациента [23].
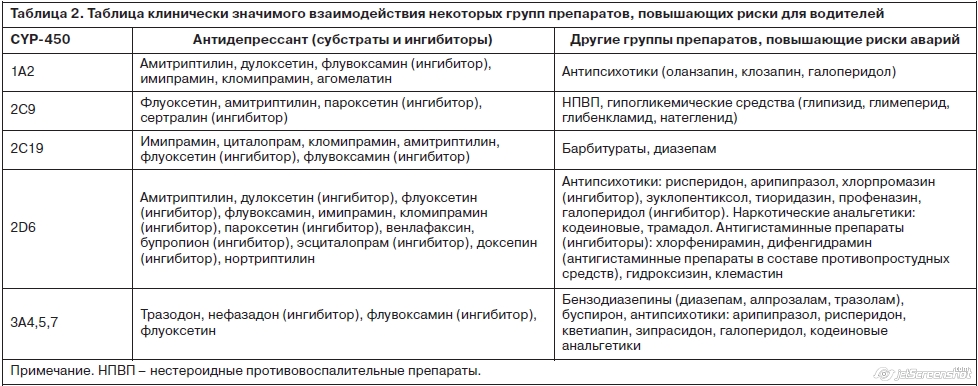
Риски копроскрипции современных антидепрессантов и указанных групп препаратов могут заключаться не только в наложении седативных эффектов, но и в значительном повышении концентрации веществ при совпадении в пути выведения по ферменту в системе цитохрома. Многие наиболее применяемые в России и мире антидепрессанты из группы СИОЗС и СИОЗСН являются мощными ингибиторами системы цитохрома P450, которые могут значительно повышать концентрацию препаратов из группы риска для водителей (табл. 2). Например, флуоксетин и флувоксамин замедляют выведение триазоловых бензодиазепинов (триазолам, алпрозалам, мидозалам). При таком сочетании происходит повышение концентрации бензодиазепинов и, соответственно, побочных эффектов, таких как седация, головокружение, снижение внимания и реакции [11].
Необходимо учитывать, что антидепрессанты могут повышать концентрацию лекарств для соматической терапии, которые имеют собственные риски для водителей. Так риски показаны: для мышечных миорелаксантов – +209%, для инсулина – в 1,8 раза, для метформина и препаратов сульфонил мочевины – в 1,5 раза (риски, связанные с развитием гипогликемических состояний). Отмечены риски у седативных антигистаминных препаратов (в том числе входящих в комплексные противопростудные средства), антиспастических гастроинтестинальных и противорвотных средств с антихолинергическим (атропиноподобным) действием (см. табл. 2) [24].
Следует отметить, что субстраты конкурируют за выведение через фермент и повышаются
 уровни обоих препаратов, в то время как ингибиторы, как правило, повышают концентрации других препаратов, выводящихся этим ферментом. Например, комбинация флувоксамина и агомелатина (нерекомендованная комбинация) может повышать концентрацию агомелатина в 12–412 раз в зависимости от врожденной активности ферментной системы CYP1A2 [25].
уровни обоих препаратов, в то время как ингибиторы, как правило, повышают концентрации других препаратов, выводящихся этим ферментом. Например, комбинация флувоксамина и агомелатина (нерекомендованная комбинация) может повышать концентрацию агомелатина в 12–412 раз в зависимости от врожденной активности ферментной системы CYP1A2 [25].
Антидепрессанты из всех классов способны потенцировать действие алкоголя, что может проявляться в передозировке, сонливости или головокружении [11].
Исходя из представленных данных хорошей альтернативой для лечения депрессии у лиц, управляющих автомобилем, может стать милнаципран (Иксел). Иксел не взаимодействует с мускариновыми, гистаминовыми и a1-адренорецепторами, селективно действуя только на серотониновые и норадреналиновые переносчики медиаторов.
В своем классе (СИОЗСН) в терапевтической дозе препарат обладает равнопотентным соотношением процента захвата транспортеров, т.е. наиболее норадренергическим действием. Как известно, именно дефицит норадреналина при депрессии снижает способность к концентрации внимания.
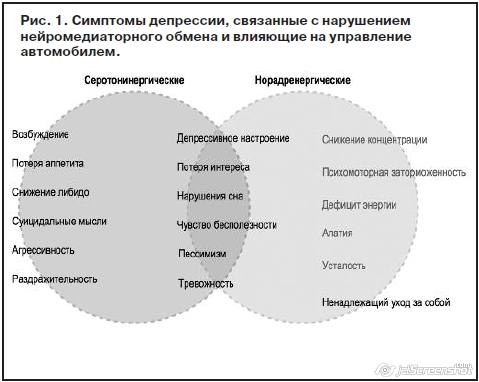
На рис. 1 представлены симптомы депрессии, связанные с серотонином и норадреналином, влияющие на управление автомобилем [26].
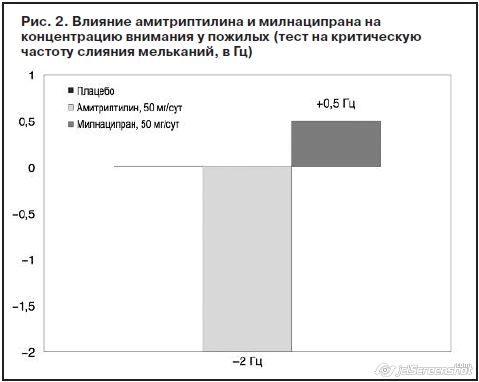
В плацебо-контролируемом исследовании было продемонстрировано, что в отличие от амитриптилина милнаципран (Иксел) достоверно (p<0,05) улучшал внимание у пожилых, т.е. у тех пациентов, у которых применение антидепрессантов сопровождается повышением риска аварий. Это было подтверждено по способности реагировать на критическую частоту слияния мельканий (частота, при которой мелькающий свет воспринимается как немерцающий); рис. 2 [27].
В двойном слепом плацебо-контролируемом перекрестном исследовании, как в лабораторных тестах, так и в реальной дорожной ситуации, милнаципран в дозе 50 мг 2 раза в день достоверно не ухудшал способности к вождению. Положительным можно считать факт, что милнаципран не потенцировал, а в некоторых тестах ослаблял действие низких доз алкоголя (табл. 3) [28].
 Представляется важным, что милнаципран выделяется среди других антидепрессантов отсутствием взаимодействия с системой цитохрома. Согласно инструкции «даже в концентрациях, в 25 раз превышающих среднетерапевтические, милнаципран не влияет на систему микросомального окисления в гепатоцитах.., в силу чего не следует ожидать взаимодействия с индукторами и ингибиторами микросомального окисления».
Представляется важным, что милнаципран выделяется среди других антидепрессантов отсутствием взаимодействия с системой цитохрома. Согласно инструкции «даже в концентрациях, в 25 раз превышающих среднетерапевтические, милнаципран не влияет на систему микросомального окисления в гепатоцитах.., в силу чего не следует ожидать взаимодействия с индукторами и ингибиторами микросомального окисления».
Таким образом, к критериям выбора антидепрессанта для водителей можно отнести следующие параметры препарата:
• антидепрессант не должен вызывать седацию, миорелаксацию, не должен обладать холинергическим или антигистаминным действием, не должен угнетать ЦНС, в том числе у пожилых как наиболее чувствительной группы пациентов, кроме того, желательно избежать потенцирование действия алкоголя;
• антидепрессант должен иметь понятный механизм улучшения когнитивных функций, в первую очередь способности к активации психомоторных реакций и внимания, сниженных в результате депрессии;
• антидепрессант должен обладать низким потенциалом лекарственных интеракций, в идеале – характеризоваться отсутствием метаболизма в системе цитохрома, поскольку невозможно исключить необходимость комбинированной терапии в процессе длительного лечения депрессий.
Сведения об авторе
Петрова Наталия Николаевна – д-р мед. наук, проф., зав. каф. психиатрии и наркологии ФГБОУ ВО СПбГУ. E-mail: petrova_nn@mail.ru
Ключевые слова: антидепрессанты, вождение автомобиля.
Для цитирования: Петрова Н.Н., Маркин А.В. Антидепрессивная терапия и социальное функционирование: выбор антидепрессанта для водителей. Психиатрия и психофармакотерапия. 2018; 20 (1): 27–31.
Antidepressive therapy and social functioning: choosing antidepressant for drivers
N.N.Petrova, A.V.MarkinSaint Petersburg State University. 199034, Russian Federation, Saint Petersburg, Universitetskaia nab., d. 7/9 petrova_nn@mail.ru
Modern algorithms antidepressant therapy suggest prolonged courses of treatment, therefore, the tolerability of an antidepressant with minimize the behavioural toxicity is necessary to ensure the full social functioning of patients. In particular, antidepressants with pronounced sedative component of action can slow down reaction time and impair attention and thereby adversely affecting the ability to control the vehicle. The article presents modern data about approaches to antidepressant therapy in drivers, including additional factors that increase the risk of accidents in patients receiving antidepressants. Selection criteria of the antidepressant to minimize the risks associated with driving are proposed.
Key words: antidepressants, driving.
For citation: Petrova N.N., Markin A.V. Antidepressive therapy and social functioning: choosing antidepressant for drivers. Psychiatry and Psychopharmacotherapy. 2018; 20 (1): 27–31.
По данным метаанализов, современные антидепрессанты обнаруживают определенные различия по структуре побочных эффектов, что необходимо учитывать при индивидуальных назначениях, особенно если имеются сведения о нежелательных явлениях, развивавшихся у пациента в процессе тимоаналептической терапии ранее [1, 2]. Например, среди селективных ингибиторов обратного захвата серотонина (СИОЗС) флуоксетин считается лидером по частоте гастроинтестинальных расстройств (тошнота, рвота, диарея), флувоксамин – по частоте тошноты, пароксетин – потливости и седации, сертралин – диареи. При этом частота тошноты и рвоты при приеме дулоксетина и венлафаксина (СИОЗС и норадреналина – СИОЗСН) выше, чем у препаратов группы СИОЗС. При приеме миртазапина и пароксетина отмечается значительная прибавка массы тела, а миртазапина и тразодона – выраженная седация.
Согласно рекомендациям S.Kennedy и соавт. «Canadian Network for Mood and Anxiety Treatments» [3] по фармакологическому ведению взрослых пациентов с большим депрессивным расстройством, предназначенные для психиатров и врачей смежных специальностей, прием антидепрессантов должен длиться 6–9 мес после достижения симптоматической ремиссии, а при повышенном риске рецидива – 2 года и более. Имеются данные, подтверждающие это положение. В метаанализе исследований по поддерживающей терапии было выявлено, что антидепрессанты в качестве поддерживающей терапии превосходят плацебо как при длительном приеме от 1 до 12 мес (72 исследования), так и в течение более 12 мес (35 исследований) [4]. Обзор 16 рандомизированных контролируемых исследований – РКИ (n>4000), проведенный Управлением по контролю за качеством пищевых продуктов и лекарственных средств США (FDA), выявил, что преимущество антидепрессантов в качестве поддерживающей терапии над плацебо в 2 раза возрастало при 52-недельном периоде наблюдения по сравнению с 24-недельным (37% против 18% соответственно) [5].
В нескольких рандомизированных плацебо-контролируемых исследованиях продемонстрировано преимущество более длительной поддерживающей антидепрессивной терапии, а именно, в течение 2 лет по сравнению с 1 годом. Если клинические факторы риска отсутствуют, то поддерживающую терапию рекомендовано продолжать более 2 лет (уровни доказательности 3 и 4) [6].
При резком прекращении приема антидепрессантов до 40% пациентов могут испытывать симптомы отмены (бессонница, тошнота, потеря равновесия, сенсорные расстройства, повышенная возбудимость) [7]. Например, формы выпуска пароксетина и венлафаксина немедленного высвобождения чаще вызывают симптомы отмены по сравнению с препаратами с более длительным периодом полувыведения [8].
Приоритетными при выборе препарата становятся минимальная выраженность поведенческой токсичности и спектр побочных действий. Особое значение в этом случае приобретают индивидуальная чувствительность и исходное отношение больного к антидепрессанту и психофармакотерапии в целом. В качестве препаратов выбора выступают антидепрессанты различной структуры, сочетающие мягкий тимоаналептический эффект с хорошей переносимостью [9].
Хорошая переносимость антидепрессивной терапии с минимизацией явлений поведенческой токсичности актуальна для обеспечения активного социального функционирования пациентов, что в современном обществе часто связано с необходимостью вождения автомобиля. Антидепрессанты с выраженным седативным компонентом действия могут замедлять время реакции и ухудшать внимание, тем самым негативно влияя на способность к управлению транспортным средством. Несмотря на отставание по уровню потребления на душу населения от западноевропейских или североамериканских стран, количество продаж антидепрессантов в России за 2016 г. достигло почти 7 млн упаковок только в розничных аптеках (данные IMS – Information Manage) [10].
Метаанализ от 2017 г., включивший данные исследований 1995–2015 гг., показал 40% повышение риска попасть в аварию и более чем трехкратное (отношение шансов – ОШ 3,19) повышение риска попасть в аварию со смертельным исходом у водителей, принимавших антидепрессанты [11].
Доступные зарубежные обзоры применения антидепрессантов у водителей выделяют помимо различий между препаратами дополнительные факторы, повышающие риск аварий на фоне приема антидепрессантов.
Трициклические антидепрессанты (ТЦА), к которым относятся амитриптилин, имипрамин, а также активные метаболиты нортриптилин, дезипрамин и доксепин, повышают вероятность аварии в среднем на 41% [12]. Механизмы, определяющие этот риск, связаны не только с седацией, характерной для всех ТЦА, хоть и выраженной в разной степени, но и с антихолинергическим действием, влияющим на зрение, и риском ортостатической гипотензии.
K.Iwamoto и соавт. (Япония) установили прямую корреляцию между уровнем амитриптилина в плазме и способностью совершения маневров (через 4 ч после приема 25 мг амитриптилина) [13].
A.Brunnauer и соавт. показали, что только 10% пациентов, получающих ТЦА, способны сдать тест на вождение (Global Driving Ability Test), в то время как среди пациентов, применяющих миртазапин, эта цифра выше, хотя и не превышает 50% [14].
В норвежском исследовании J.Bramness и соавт. сравнили 2 группы пациентов: получавших седативные антидепрессанты (ТЦА и миртазапин) и неседативные. Было показано, что в 1-й группе риск дорожных происшествий был на 40% выше (ОШ 1,4, 95% доверительный интервал – ДИ 1,2–1,6) [15].
Пожилой возраст и использование более высоких доз значимо увеличивают риск аварии на фоне терапии амитриптилином. Применение 125 мг амитриптилина у пожилых повышает риск аварии на 220–230% (ОШ 2,2, 95% ДИ 3,1–3,5 [16] и ОШ 2,3, ДИ 1,1–4,8 [17]).
Фактически даже использование субтерапевтических доз ТЦА, недостаточных для адекватной терапии депрессии, ухудшает психомоторные функции и визуальное восприятие, что позволяет относить ТЦА к последней линии терапии депрессии у водителей при наличии альтернативы [14].
СИОЗС и другие современные антидепрессанты продемонстрировали преимущество по сравнению с ТЦА в отношении влияния на избирательность внимания [14], и, казалось бы, проблема выбора антидепрессанта для водителя должна быть решена. Однако в обзорах, посвященных влиянию современных антидепрессантов на способность к вождению, было отмечено, что данные носят «неясный и противоречивый» характер. Возможно, это обусловлено неоднородностью группы препаратов, включенных в исследования. Так, M.Wingen и соавт. сообщили об ухудшении маневрирования транспортным средством в тесте SDLP (Standard Deviation Lateral Position) при использовании как СИОЗС, так и СИОЗСН, но не рассматривая каждый препарат в отдельности [18].
Серьезные различия имеются между плацебо-контролируемыми исследованиями, проведенными в «стерильных» условиях научного эксперимента, и наблюдательными исследованиями из реальной жизни. Например, двойное слепое плацебо-контролируемое исследование 1998 г. показало отсутствие влияния венлафаксина на тест SDLP [19],
а данные натуралистических наблюдений A.LeRoy и cоавт. зафиксировали драматическое увеличение риска аварий при применении венлафаксина на 78%. Аналогичные данные были получены для дулоксетина (78%) и еще в большей степени – для тразодона и нефазадона – риск +90% [12]. Подобные риски были обнаружены и в объемном Норвежском наблюдательном исследовании J.Bramness и соавт. [15].
Для понимания значимости риска аварии, связанного с антидепрессивной терапией, некоторые авторы приводят эквивалентные риски, связанные с уровнем алкоголя в крови, среди них результаты 5-летнего когортного наблюдения за 409 171 взрослым жителем штата Вашингтон. Различные седативные препараты, в том числе и антидепрессант тразодон, принимали 5,8% пациентов (табл. 1) [20].

Пик риска аварий отмечен на 4–8-м месяце терапии антидепрессантами, что вступает в противоречие с мнением о возможности полной адаптации к антидепрессантам через 1–2 нед терапии [21] и с мнением, что риск аварий связан исключительно с симптомами депрессии, которая сама по себе может влиять на скорость психомоторных реакций и увеличивает вероятность аварий почти в 2 раза (ОШ 1,9 с разбросом 1,06–3,39) [11].
В целом к факторам, доказано повышающим риск аварий у водителей, принимающих антидепрессанты, относятся:
• пожилой возраст;
• 1-я неделя терапии антидепрессантом;
• резкое повышение дозировки антидепрессанта;
• более высокая степень тяжести депрессии;
• взаимодействие по системе цитохрома при одновременном применении других препаратов, обладающих угнетающим действием на центральную нервную систему (ЦНС) [22].
Подтверждение негативного влияния комбинированной терапии современными антидепрессантами с другим препаратами на способность к управлению автомобилем было получено в исследовании C.Des las Cuevas и соавт. При сочетании СИОЗС или СИОЗСН и других препаратов, влияющих на ЦНС, подавляющее большинство (80%) пациентов не смогли пройти электронные тесты, необходимые для получения водительских прав в Испании [23].
Повышать риски, связанные с вождением автомобиля, могут следующие группы психотропных препаратов [21]:
• Барбитураты – повышают риски в 7,5 раза.
• Бензодиазепины удваивают риск аварий.
• Антипсихотики II поколения повышают риски на 120%.
• Небензодиазепиновые гипнотики: суммарно золпидем, залеплон, эсзопиклон повышали риск на 48%, причем выделение отдельно группы лиц, принимавших золпидем, показало риск выше более чем в 2 раза по сравнению с непринимавшими гипнотики лицами [20].
• Антипаркинсонические средства вызывают внезапные «сонные атаки» почти у каждого третьего пациента [23].
Риски копроскрипции современных антидепрессантов и указанных групп препаратов могут заключаться не только в наложении седативных эффектов, но и в значительном повышении концентрации веществ при совпадении в пути выведения по ферменту в системе цитохрома. Многие наиболее применяемые в России и мире антидепрессанты из группы СИОЗС и СИОЗСН являются мощными ингибиторами системы цитохрома P450, которые могут значительно повышать концентрацию препаратов из группы риска для водителей (табл. 2). Например, флуоксетин и флувоксамин замедляют выведение триазоловых бензодиазепинов (триазолам, алпрозалам, мидозалам). При таком сочетании происходит повышение концентрации бензодиазепинов и, соответственно, побочных эффектов, таких как седация, головокружение, снижение внимания и реакции [11].
Необходимо учитывать, что антидепрессанты могут повышать концентрацию лекарств для соматической терапии, которые имеют собственные риски для водителей. Так риски показаны: для мышечных миорелаксантов – +209%, для инсулина – в 1,8 раза, для метформина и препаратов сульфонил мочевины – в 1,5 раза (риски, связанные с развитием гипогликемических состояний). Отмечены риски у седативных антигистаминных препаратов (в том числе входящих в комплексные противопростудные средства), антиспастических гастроинтестинальных и противорвотных средств с антихолинергическим (атропиноподобным) действием (см. табл. 2) [24].

Следует отметить, что субстраты конкурируют за выведение через фермент и повышаются
 уровни обоих препаратов, в то время как ингибиторы, как правило, повышают концентрации других препаратов, выводящихся этим ферментом. Например, комбинация флувоксамина и агомелатина (нерекомендованная комбинация) может повышать концентрацию агомелатина в 12–412 раз в зависимости от врожденной активности ферментной системы CYP1A2 [25].
уровни обоих препаратов, в то время как ингибиторы, как правило, повышают концентрации других препаратов, выводящихся этим ферментом. Например, комбинация флувоксамина и агомелатина (нерекомендованная комбинация) может повышать концентрацию агомелатина в 12–412 раз в зависимости от врожденной активности ферментной системы CYP1A2 [25].Антидепрессанты из всех классов способны потенцировать действие алкоголя, что может проявляться в передозировке, сонливости или головокружении [11].
Исходя из представленных данных хорошей альтернативой для лечения депрессии у лиц, управляющих автомобилем, может стать милнаципран (Иксел). Иксел не взаимодействует с мускариновыми, гистаминовыми и a1-адренорецепторами, селективно действуя только на серотониновые и норадреналиновые переносчики медиаторов.
В своем классе (СИОЗСН) в терапевтической дозе препарат обладает равнопотентным соотношением процента захвата транспортеров, т.е. наиболее норадренергическим действием. Как известно, именно дефицит норадреналина при депрессии снижает способность к концентрации внимания.
На рис. 1 представлены симптомы депрессии, связанные с серотонином и норадреналином, влияющие на управление автомобилем [26].
В плацебо-контролируемом исследовании было продемонстрировано, что в отличие от амитриптилина милнаципран (Иксел) достоверно (p<0,05) улучшал внимание у пожилых, т.е. у тех пациентов, у которых применение антидепрессантов сопровождается повышением риска аварий. Это было подтверждено по способности реагировать на критическую частоту слияния мельканий (частота, при которой мелькающий свет воспринимается как немерцающий); рис. 2 [27].
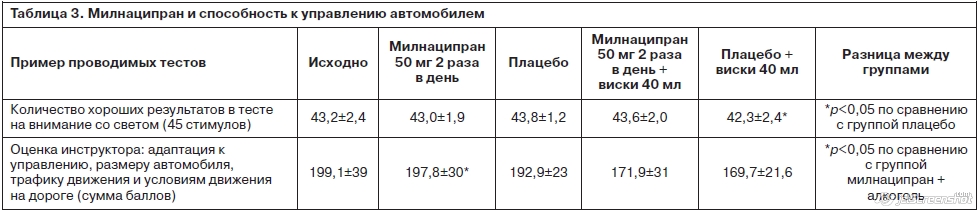
В двойном слепом плацебо-контролируемом перекрестном исследовании, как в лабораторных тестах, так и в реальной дорожной ситуации, милнаципран в дозе 50 мг 2 раза в день достоверно не ухудшал способности к вождению. Положительным можно считать факт, что милнаципран не потенцировал, а в некоторых тестах ослаблял действие низких доз алкоголя (табл. 3) [28].

 Представляется важным, что милнаципран выделяется среди других антидепрессантов отсутствием взаимодействия с системой цитохрома. Согласно инструкции «даже в концентрациях, в 25 раз превышающих среднетерапевтические, милнаципран не влияет на систему микросомального окисления в гепатоцитах.., в силу чего не следует ожидать взаимодействия с индукторами и ингибиторами микросомального окисления».
Представляется важным, что милнаципран выделяется среди других антидепрессантов отсутствием взаимодействия с системой цитохрома. Согласно инструкции «даже в концентрациях, в 25 раз превышающих среднетерапевтические, милнаципран не влияет на систему микросомального окисления в гепатоцитах.., в силу чего не следует ожидать взаимодействия с индукторами и ингибиторами микросомального окисления». Таким образом, к критериям выбора антидепрессанта для водителей можно отнести следующие параметры препарата:
• антидепрессант не должен вызывать седацию, миорелаксацию, не должен обладать холинергическим или антигистаминным действием, не должен угнетать ЦНС, в том числе у пожилых как наиболее чувствительной группы пациентов, кроме того, желательно избежать потенцирование действия алкоголя;
• антидепрессант должен иметь понятный механизм улучшения когнитивных функций, в первую очередь способности к активации психомоторных реакций и внимания, сниженных в результате депрессии;
• антидепрессант должен обладать низким потенциалом лекарственных интеракций, в идеале – характеризоваться отсутствием метаболизма в системе цитохрома, поскольку невозможно исключить необходимость комбинированной терапии в процессе длительного лечения депрессий.
Сведения об авторе
Петрова Наталия Николаевна – д-р мед. наук, проф., зав. каф. психиатрии и наркологии ФГБОУ ВО СПбГУ. E-mail: petrova_nn@mail.ru
Список исп. литературыСкрыть список1. Brambilla P, Cipriani A, Hotopf M, Barbui C. Side-effect profile of fluoxetine in comparison with other SSRIs, tricyclic and newer antidepressants: a meta-analysis of clinical trial data. Pharmacopsychiatry 2005; 38 (2): 69–77.
2. Gartlehner G, Hansen RA, Morgan LC et al. Second-generation antidepressants in the pharmacologic treatment of adult depression: an update of the 2007 comparative effectiveness review. Rockville (MD). Agency for Healthcare Research and Quality (US) 2011; 12-EHC012-EF.
3. CANMAT 2016 Clinical Guidelines for the Management of Adults with Major Depressive Disorder: Section 3. Pharmacological Treatments. Can J Psychiat 2016; 61 (9): 540–60.
4. Sim K, Lau WK, Sim J et al. Prevention of relapse and recurrence in adults with major depressive disorder: systematic review and meta-analyses of controlled trials. Int J Neuropsychopharmacol 2015; 19 (2): pyv076.
5. Borges S, Chen YF, Laughren TP et al. Review of maintenance trials for major depressive disorder: a 25-year perspective from the US Food and Drug Administration. J Clin Psychiatry 2014; 75: 205–14.
6. Trivedi MH, Dunner DL, Kornstein SG et al. Psychosocial outcomes in patients with recurrent major depressive disorder during 2 years of maintenance treatment with venlafaxine extended release. J Affect Disord 2010; 126: 420–9.
7. Fava GA, Gatti A, Belaise C et al. Withdrawal symptoms after selective serotonin reuptake inhibitor discontinuation: a systematic review. Psychother Psychosom 2015; 84: 72–81.
8. Renoir T. Selective serotonin reuptake inhibitor antidepressant treatment discontinuation syndrome: a review of the clinical evidence and the possible mechanisms involved. Front Pharmacol 2013; 4: 45.
9. Романов Д.В. Алгоритмы дифференцированной терапии депрессий с применением современных антидепрессантов. Психиатрия и психофармакотерапия. 2012; 14 (2): 56–60. / Romanov D.V. Algoritmy differentsirovannoi terapii depressii s primeneniem sovremennykh antidepressantov. Psychiatry and Psychopharmacotherapy. 2012; 14 (2): 56–60. [in Russian]
10. IMS http://www.ims-retail.ru
11. Hill LL, Lauzon VL, Winbrock EL et al. Depression, antidepressants and driving safety. Inj Epidemiol 2017; 4 (1): 10. DOI: 10.1186/s40621-017-0107-x
12. LeRoy AA, Morse ML. Department of Transportation. HS 810 858. Multiple medications and vehicle crashes: analysis of databases. 2008. Available at: http:// www.nhtsa.gov/DOT/NHTSA/Traffic%20Injury%20Control/Articles/Associated%20Files/ 810858.pdf
13. Iwamoto K, Takahashi M, Nakamura Y et al. The effects of acute treatment with paroxetine, amitriptyline, and placebo on driving performance and cognitive function in healthy Japanese subjects: a double-blind crossover trial. Hum Psychopharmacol Clin Exp 2008; 23: 399–407.
14. Brunnauer A, Laux G, Geiger E et al. Antidepressants and driving ability: results from a clinical study. J Clin Psychiatry 2006; 67: 1776–81. [PubMed: 17196059]
15. Bramness JG, Skurtveit S, Neutel CI et al. Minor increase risk of road traffic accident after prescriptions of antidepressants: a study of population registry data in Norway. J Clin Psychiatry 2008; 69: 1099–103.
16. Ray WA, Fought RL, Decker MD. Psychoactive drugs and the risk of injurious motor vehicle crashes in elderly drivers. Am J Epidemiol 1992; 136: 873–83. [PubMed: 1442753]
17. Leveille SG, Buchner DM, Koepsell TD et al. Psychactive medications and injurious motor vehicle collisions involving older drivers. Epidemiology 1994; 5: 591–8. [PubMed: 7841240]
18. Wingen M, Ramaekers J, Schmitt J. Driving impairment in depressed patients receiving long-termantidepressant treatment. Psychopharmacology 2006; 188: 84–91. [PubMed: 16865389]
19. O'Hanlon JF, Robbe HW, Vermeeren A et al. Venlafaxine's effects onhealthy volunteers' driving, psychomotor, and vigilance performance during 15-day fixed and incremental dosing regimens. J Clin Psychopharmacol 1998; 18: 212–21. [PubMed: 9617980]
20. Hansen R, Boudreau D, Grossman D et al. Sedative Hypnotic Medication Use and the risk of Motor Vehicle Crash. Am J Pub Health 2015; 105 (8).
21. Hetland A, Carr D Ann Pharmacother. Medications and Impaired Driving. Rev Liter 2014; 48 (4): 494–506.
22. Sansone R, Sansone L. Driving on antidepressants: cruising for a crush? Psychiatry (Edgemont) 2009; 7 (9): 13–6.
23. Des las Cuevas C, Sanz EJ. Fitness to drive of psychiatric patients. Prim Care Companion 2008; 10: 384–90.
24. Indiana University Department of Medicine Clinical Pharmacology P450 Drug Interactions "Clinically Relevant". http://medicine.iupui.edu/clinpharm/ddis/clinical-table
25. SnPc agomelatine, EMA 2008. http://www.ema.europa.eu/ema/
26. Nutt DJ Relationship of neurotransmitter to the symptoms of major depressive disorder. J Clin Psychiatry 2008; 69 (Suppl. E1): 4–7.
27. Hindmarch I, Rigney U, Stanley N, Briley M. Pharmacodynamics of milnacipran in young and elderly volunteers. Br J Clin Pharmacol 2000; 49 (2): 118–25.
28. Richet F, Marais J, Serre C, Panconi E. Effects of milnacipran on driving vigilance Int J Psychiatry Clin Pract 2004; 8 (2): 109–15.


