Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№05 2012
К вопросу изучения механизмов развития оксидативного стресса у больных параноидной приступообразной шизофренией, получающих антипсихотическую терапию №05 2012
Номера страниц в выпуске:19-25
Изучалась связь антипсихотической (АП) терапии и ассоциированных с нею побочных эффектов с оксидативным стрессом и нейроэндокринными нарушениями. В исследование включались: пациенты с диагнозом шизофрении параноидной, эпизодической (F20.01, F20.02, F20.03), в возрасте от 18 до 65 лет, с длительностью антипсихотической монотерапии одним из антипсихотиков (рисперидон, палиперидон, оланзапин, галоперидол) не менее 4 нед. Группу контроля составили здоровые доноры. Применялись клинический, психометрический и лабораторный методы. Биохимические показатели определялись в крови. Уровень продуктов перекисного окисления липидов (ПОЛ) и активность ферментов супероксиддисмутазы (СОД) и каталазы (КАТ) оказались достоверно ниже в группе пациентов по сравнению с группой контроля спустя месяц фармакотерапии. В нашем исследовании не удалось выявить существенных различий во влиянии на состояние про- и антиоксидантных систем терапии типичными и атипичными антипсихотиками. Вместе с тем обнаружена положительная корреляция между выраженностью ПОЛ, активностью КАТ и выраженностью обусловленных фармакотерапией экстрапирамидных расстройств – тремора (p<0,005). Обнаружена отрицательная корреляция между уровнем тиреотропного гормона гипофиза (ТТГ) и индексом Клейна (ИК), который характеризует общую степень окисленности липидов. Не обнаружено корреляций между уровнем пролактина и интенсивностью ПОЛ. Регрессионный анализ выборки показал влияние на снижение уровня пролактина факторов «длительность заболевания» и «число обострений», 22 и 29% соответственно. Также выявлена положительная корреляция между уровнем пролактина и выраженностью акатизии (p<0,005). Таким образом, были получены новые данные о развитии нейроэндокринной дисфункции у больных шизофренией и показано влияние АП терапии больных параноидной шизофренией на состояние про- и антиоксидантной систем организма.
Резюме. Изучалась связь антипсихотической (АП) терапии и ассоциированных с нею побочных эффектов с оксидативным стрессом и нейроэндокринными нарушениями. В исследование включались: пациенты с диагнозом шизофрении параноидной, эпизодической (F20.01, F20.02, F20.03), в возрасте от 18 до 65 лет, с длительностью антипсихотической монотерапии одним из антипсихотиков (рисперидон, палиперидон, оланзапин, галоперидол) не менее 4 нед. Группу контроля составили здоровые доноры. Применялись клинический, психометрический и лабораторный методы. Биохимические показатели определялись в крови. Уровень продуктов перекисного окисления липидов (ПОЛ) и активность ферментов супероксиддисмутазы (СОД) и каталазы (КАТ) оказались достоверно ниже в группе пациентов по сравнению с группой контроля спустя месяц фармакотерапии. В нашем исследовании не удалось выявить существенных различий во влиянии на состояние про- и антиоксидантных систем терапии типичными и атипичными антипсихотиками. Вместе с тем обнаружена положительная корреляция между выраженностью ПОЛ, активностью КАТ и выраженностью обусловленных фармакотерапией экстрапирамидных расстройств – тремора (p<0,005). Обнаружена отрицательная корреляция между уровнем тиреотропного гормона гипофиза (ТТГ) и индексом Клейна (ИК), который характеризует общую степень окисленности липидов. Не обнаружено корреляций между уровнем пролактина и интенсивностью ПОЛ. Регрессионный анализ выборки показал влияние на снижение уровня пролактина факторов «длительность заболевания» и «число обострений», 22 и 29% соответственно. Также выявлена положительная корреляция между уровнем пролактина и выраженностью акатизии (p<0,005). Таким образом, были получены новые данные о развитии нейроэндокринной дисфункции у больных шизофренией и показано влияние АП терапии больных параноидной шизофренией на состояние про- и антиоксидантной систем организма.
Ключевые слова: шизофрения, оксидативный стресс, нитрозативный стресс, антиоксиданты, типичные нейролептики, атипичные антипсихотики.
On the study of the mechanisms of oxidative stress in patients with paranoid schizophrenia paroxysmal receiving antipsychotic medication
L.Ya.Libin1,2, M.V.Ivanov1, N.D.Eschenko3, S.A.Lesnikova1,2, S.G.Dagaev4
1V.M.Bekhterev Research Psychoneurological Institute; 2SPb GBUZ Mental hospital №3;
3St.-Petersburg State University; 4Institute of Toxicology of the Federal Medical and Biological Agency, St.-Petersburg
Summary. Examined the association of antipsychotic (AP) treatment and associated side effects of oxidative stress and neuroendocrine disorders. The study included: patients with a diagnosis of paranoid schizophrenia, paroxysmal (F20.01, F20.02, F20.03), aged
18 to 65 years, with a duration of antipsychotic monotherapy with one of the antipsychotics (risperidone, paliperidone, olanzapine, haloperidol) for at least 4 weeks. The control group consisted of healthy donors. Clinical, psychometric and laboratory methods were applied. Biochemical parameters were determined in the blood. The level of lipid peroxidation products and the enzyme activity of SOD and CAT were significantly lower in the patient group compared with the control group after one month of pharmacotherapy. The study failed to detect significant differences in the effect of the state of pro- and antioxidant therapy systems with typical and atypical antipsychotics. However, a positive correlation was found between the degree of lipid peroxidation, the activity of CAT and severity of extrapyramidal disorders due to drug treatment – tremor (p<0,005). A negative correlation was found between the level of thyroid stimulating hormone, pituitary gland (TSH) and Klein index (IR), which characterizes the overall degree of oxidation of the lipids. No correlation was found between prolactin levels and the intensity of lipid peroxidation. Regression analysis showed the sample to reduce the influence of prolactin factors «duration of disease» and «the number of exacerbations», by 22 and 29%, respectively.
A positive correlation was found between prolactin levels and the severity of akathisia (p<0,005) Thus, we have obtained new data on the development of neuroendocrine dysfunction in patients with schizophrenia and the effect of pro and antioxidant AP therapy systems in patients with paranoid schizophrenia.
Key words: schizophrenia, oxidative stress, nitrosative stress, antioxidants, typical antipsychotics, atypical antipsychotics.
Введение
Современные исследования о патогенезе шизофрении, включающие данные из области смежных нейронаук, результаты применения методов нейровизуализации позволяют рассматривать шизофрению уже не столько как функциональное расстройство, а как одно из полиэтиологических заболеваний с очевидной тенденцией к развитию нейродегенеративных процессов [20]. В настоящее время можно считать доказанным, что механизмы окислительного стресса (ОС) активно задействованы в патогенезе шизофрении. Эта гипотеза всегда имела теоретическую привлекательность по следующим причинам: головной мозг (ГМ) является особенно уязвимым к окислительному повреждению из-за сравнительно высокого коэффициента использования кислорода и, следовательно, активного образования свободных радикалов, относительной слабости антиоксидантной защиты и богатства полиненасыщенными жирными кислотами, представляющих собой готовые субстраты окисления, активного оборота нейротрансмиттеров и наличия металлов переменной валентности, таких как железо и медь [10, 33, 34]. Установлено, что увеличение стационарного уровня свободнорадикальных форм кислорода и азота в мозге приводит к возникновению ОС или нитрозативного стресса, что может быть одним из факторов, способствующих развитию нейродегенеративных и психических заболеваний [2, 33, 34]. Обнаружены нарушения со стороны регуляции перекисного окисления липидов (ПОЛ) у больных шизофренией, эпилепсией, рассеянным склерозом, болезнью Паркинсона и Альцгеймера и др. [32, 36]. Работа нейромедиаторных систем тесно связана с интенсивностью процессов ПОЛ. Выявлена зависимость между составом фосфолипидов синаптических мембран, интенсивностью процессов ПОЛ в них и функциональной активностью нейромедиаторных систем. Электрическая активность нейронов и чувствительность рецепторов к медиаторам также зависят от активности ПОЛ. Установлено, что активные формы кислорода (АФК), инициируя ПОЛ, воздействуют на рецепторный аппарат и могут влиять на дофаминергическую передачу [30]. Кроме того, показано, что следствием ОС могут являться нарушения холинергической трансмиссии [25]. Структура и функция биомембран нейронов, мембранно-связанных белков, таких как рецепторы, ферменты, ионофоры, зависят от интенсивности свободнорадикальных процессов в организме. ПОЛ играет важную роль в модификации мембран и, следовательно, нарушении работы рецепторного аппарата [33]. Катехоламины (дофамин и норадреналин) активируют процессы ПОЛ и могут усиливать цитотоксическое действие в областях центральной нервной системы, содержащих катехоламинергические нейроны [35]. Именно поэтому наивысшая активность таких компонентов антиоксидантной защиты (АОЗ), как глутатионпероксидаза и глутатионредуктаза, регистрируется в областях с максимальным содержанием дофамина [18]. Избыточная продукция или недостаточно быстрая нейтрализация глутамата, дофамина, норадреналина приводит к нейротоксическим эффектам, связанным со стимуляцией образования АФК. При этом нарушение дофаминергической нейротрансмиссии рассматривается как один из центральных механизмов патофизиологии шизофрении [11, 13]. Каждый из катехоламинов, и прежде всего дофамин, способен к аутоокислению с образованием реакционно-способных радикальных продуктов. Спонтанное или ферментативное (с помощью моноаминоксидазы) превращение дофамина может сопровождаться образованием супероксиданиона (О2-) и перекиси водорода (Н2О2) [29]. Избыточная генерация Н2О2 угнетает активность СОД, что в свою очередь повышает уровень О2-.
Таким образом, АФК ингибируют активность ферментов-антиоксидантов, что приводит к снижению буферной емкости ферментативной АОЗ и дополнительному повышению уровня АФК. Параллельно наблюдается истощение неферментативных компонентов АОЗ, таких как токоферол, аскорбиновая кислота, глутатион, которые при нейтрализации радикальных продуктов переходят в неактивное состояние или образуют радикальные продукты разной степени токсичности [33]. В моделях болезни Паркинсона на животных обнаружен повышенный оборот дофамина, что сопровождается высокой скоростью его аутоокисления и образованием реакционно-способных соединений, приводящих к гибели дофаминергических нейронов. Это ускоряет оборот дофамина в здоровых клетках, что приводит к прогрессированию заболевания [12]. При этом следует отметить, что одно из признанных модельных состояний – блокада дофаминовых рецепторов II типа нейролептиком галоперидолом – полностью воспроизводит картину экстрапирамидных расстройств (ЭПР), наиболее частого неврологического осложнения антипсихотической терапии [24, 26]. Галоперидол избирательно блокирует дофаминовые Д2-рецепторы, связанные с его применением двигательные нарушения возникают при блокаде 70–80% популяции Д2-рецепторов нигростриатальной системы [8], вовлеченной в организацию двигательной и поведенческой активности. В свою очередь, известно, что блокада дофаминовых Д2-рецепторов галоперидолом может увеличивать синаптический выход глутамата [3], а одним из важных источников образования АФК является активация глутаматом глутаматных рецепторов. Показано, что связывание лиганда с NМДА-рецепторами приводит к генерации О2- [28]. При активации глутаматных рецепторов увеличивается продукция еще одного АФК – оксида азота (NO) – из аргинина. Этому способствует открытие Са2+-каналов, связанных с глутаматными рецепторами, вход Са2+ внутрь клетки и, как следствие, активация NO-синтазы, а также фосфолипаз, ксантиноксидазы [29]. Образующийся NO взаимодействует с О2- с образованием пероксинитрита (ONOO-), который является высокореакционной молекулой. Пероксинитрит разрушается до гидроксильного радикала и диоксида азота (NO2). Обе эти молекулы участвуют в повреждении липидных мембран, белков рецепторов, наследственного материала.
Кроме того, ONOO- способен взаимодействовать с фактором транскрипции и вызывать апоптоз [35]. В серии предварительно проведенных нами экспериментов на животных мы пришли к выводу, что блокада Д2-дофаминовых рецепторов типичным нейролептиком галоперидолом вызывала интенсификацию ПОЛ в структурах ГМ. При этом наиболее значимыми были изменения в стриатуме, где обнаружено повышение содержания как первичных, так и конечных продуктов ПОЛ. Активность СОД в коре, стриатуме и гиппокампе животных при действии галоперидола коррелировала с наличием или отсутствием двигательных нарушений (каталепсии). Результаты наших экспериментов, включающих использование блокаторов глутаматных NMDA-рецепторов, позволили также выделить два клинически идентичных, но гетерогенных по биохимическим показателям варианта двигательных нарушений (каталепсии): первый обусловлен только блокадой Д2-дофаминовых рецепторов в области стриатума, второй – обусловленный синергическим действием блокады дофамин- и глутаматергической систем. При этом во втором случае блокада глутаматных NMDA-рецепторов оказывала протекторное действие по отношению к процессам свободнорадикального окисления (СРО) [15]. Таким образом, и сам шизофренический процесс, и проводимая в процессе его лечения фармакотерапия могут оказывать влияние на состояние про- и антиоксидантных систем, а учитывая универсальность, способность к самоускорению и влияние СРО на многие жизненно важные процессы, развитие ОС способно перекрывать вклад специфических нарушений нейромедиации и приводить к необратимым последствиям [36]. Вместе с тем данные об эффективности антиоксидантов в составе комплексной терапии больных шизофренией носят крайне противоречивый характер. От обнадеживающих, как, например, слепое плацебо-контролируемое исследование N-ацетилцистеина у больных шизофренией [5], до неубедительных и малоинформативных в силу малого объема выборки или дизайна исследований [6]. Уточнению механизмов развития оксидативного стресса у больных параноидной шизофренией, оценке влияния антипсихотической терапии на процессы радикалообразования, уточнению обоснованности антиоксидантной терапии у этой группы больных посвящена наша работа.
Материалы и методы
В исследование включались: пациенты с диагнозом шизофрении параноидной, эпизодической (F20.01, F20.02, F20.03), согласно критериям Международной классификации болезней 10-го пересмотра (МКБ-10), возраст от 19 до 65 лет (средний возраст 31,6±1,81 года, возраст начала болезни 25,2±7,8 года), получавшие в связи с обострением заболевания (общий балл PANSS>55) в течение 1 мес монотерапию одним из четырех антипсихотиков (рисперидон, палиперидон, оланзапин, галоперидол). Допускалось использование корректоров. В исследование не включались: пациенты с органическими заболеваниями ГМ, хроническими заболеваниями печени и почек, бронхолегочной патологией. Материал исследования составили 72 пациента (38 мужчин, 34 женщины): 22 пациента получали терапию традиционным нейролептиком галоперидолом (14,6±1,87 мг); 50 больных лечились атипичными антипсихотиками, в том числе 20 больных получали рисперидон (5,5±1,97 мг), 16 – палиперидон (7,5±2,20 мг), 14 – зипрексу (12,9±2,34 мг). Все пациенты в качестве корректора получали тригексифенидил (циклодол). Дозы корректора по группам представлены в таблице.
Группу контроля составили 30 здоровых доноров (16 мужчин, 14 женщин). Больных обследовали на стадии
обострения заболевания, в условиях стационарного или полустационарного лечения, с длительностью монотерапии антипсихотиками не менее 4 нед. Обследование носило комплексный характер и включало клинико-психопатологический, клинико-лабораторный и психометрический методы. Использовались следующие шкалы: PANSS [14], шкала побочных эффектов UKU [16], шкала депрессии Калгари (CDSS) [1], согласно которой депрессия определялась при сумме баллов от 5 и выше [19], общая клиническая шкала акатизии, шкала акатизии Барнса (BARS) [4], шкала оценки неврологического статуса Симпсона–Ангуса [23], шкала патологических непроизвольных движений [9]. В крови определялись биохимические показатели: гормоны – пролактин, ТТГ; ферменты антиоксидантной защиты – СОД и КАТ; показатели ПОЛ – диеновые конъюгаты (ДК) и триеновые конъюгаты (ТК); основания Шиффа (ОШ), малоновый диальдегид (МДА); ИК [27]. У всех пациентов определяли натощак уровень пролактина в сыворотке крови с помощью тест-системы Ortho-Clinical Diagnostics: использовались референтные значения, принятые в Российской Федерации и США: пролактин – для мужчин от 3,28 мкг/л (нг/мл) до 19,68 мкг/л (нг/мл), для женщин от 3,24 нг/мл до 29,12 нг/мл. Статистические методы включали описательную статистику: среднее арифметическое, стандартное отклонение. Проведены: регрессионный анализ, параметрический корреляционный анализ по Пирсону и сравнительный анализ по t-критерию Стьюдента [38].
Результаты
В психическом статусе обследованных больных преобладала параноидная (50%), галлюцинаторно-параноидная (35%) и депрессивно-параноидная (15%) симптоматика. Не выявлено корреляций между синдромальной структурой и показателями ПОЛ и активностью ферментов АОЗ (СОД и КАТ). Однако при корреляционном анализе показателей шкалы PANSS (общий балл, субшкалы позитивных симптомов и негативных симптомов) и исследуемых биохимических показателей выявлена прямая корреляция этих данных с активностью КАТ (p<0,005), что может косвенно свидетельствовать о связи активности этого фермента с остротой психопатологической симптоматики.
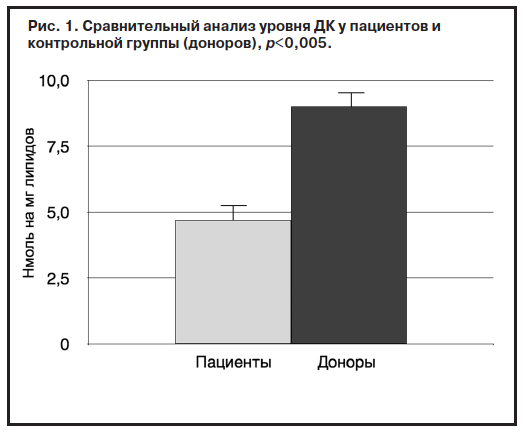
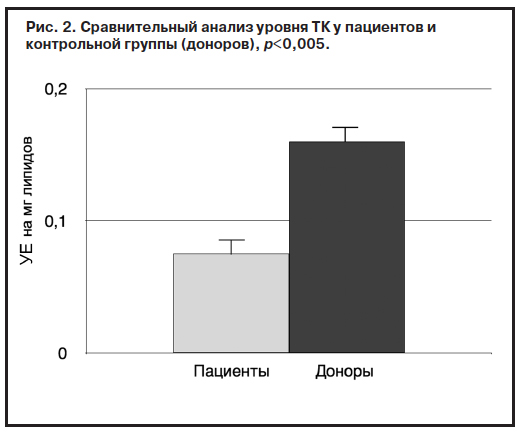
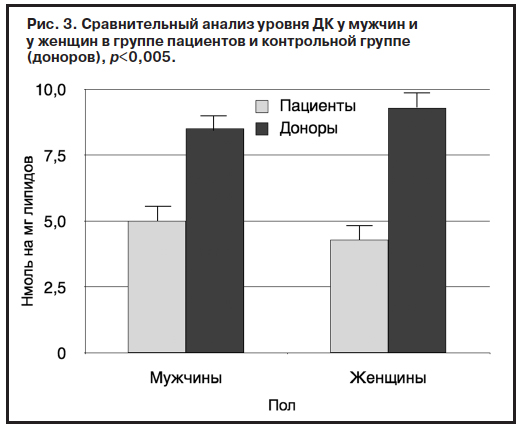
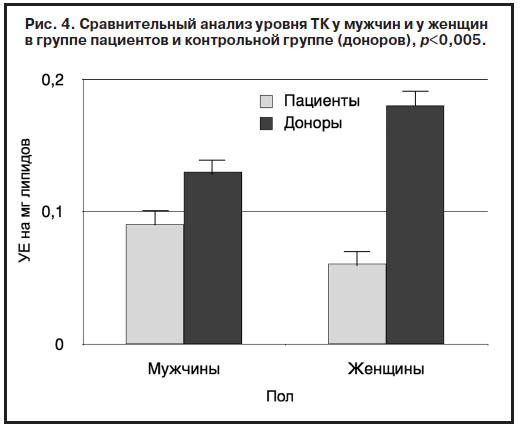
Уровень продуктов ПОЛ (ДК, ТК, ОШ) и активность ферментов АО защиты (СОД, КАТ) оказались достоверно ниже в группе пациентов по сравнению с группой контроля спустя месяц фармакотерапии. Выявленная закономерность сохранялась как при сравнительном анализе общих показателей группы пациентов и контрольной группы – доноров (рис. 1, 2), так и при парном сравнении мужчин и женщин этих групп (рис. 3, 4).
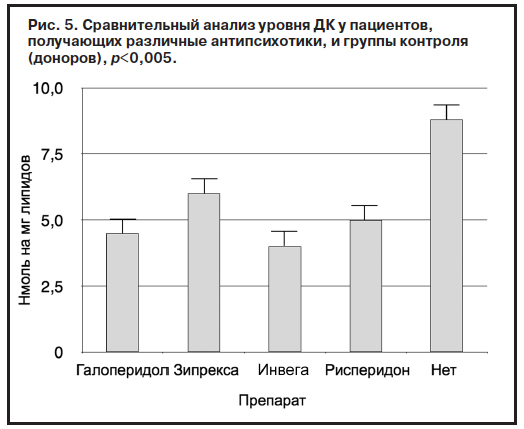
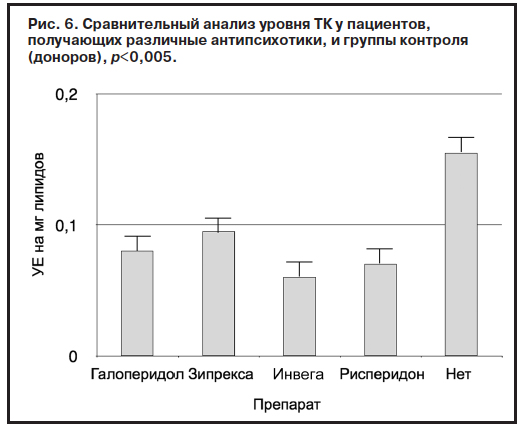
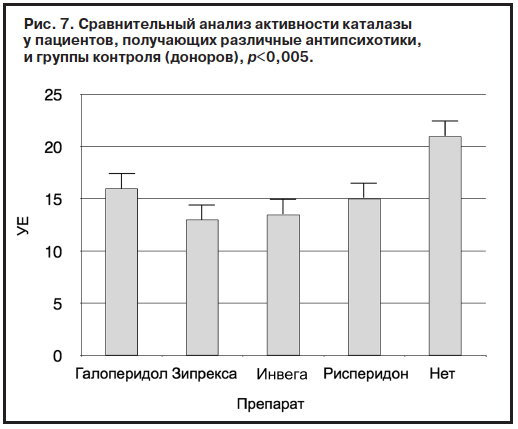
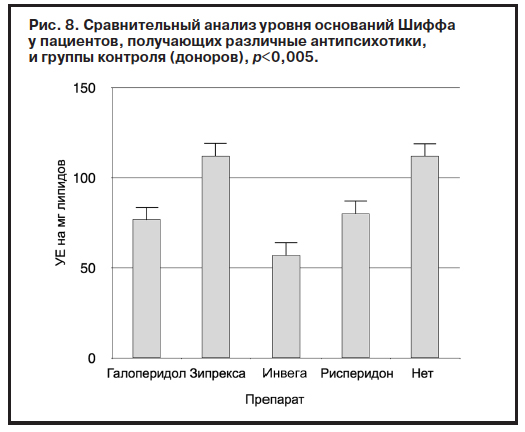
Вопреки ожиданиям в нашем исследовании не удалось выявить существенных различий по влиянию на состояние про- и антиоксидантных систем терапии между типичными и атипичными антипсихотиками (рис. 5–8).
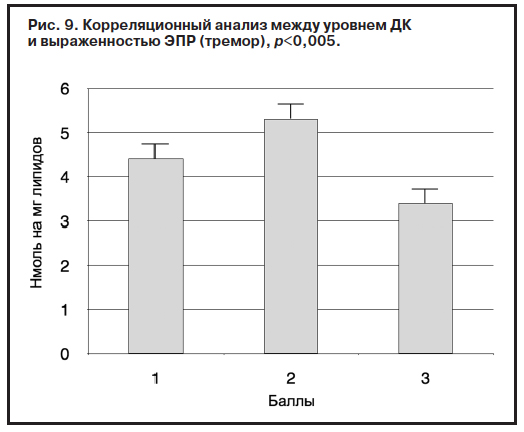
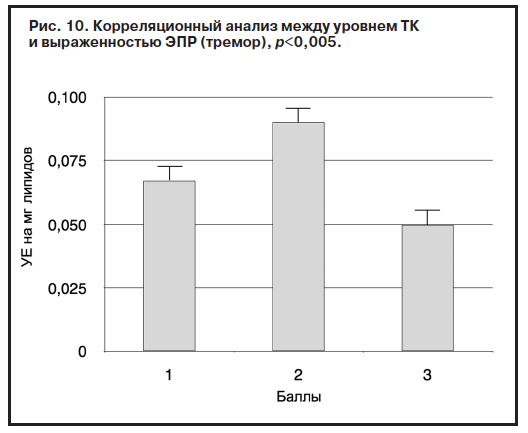
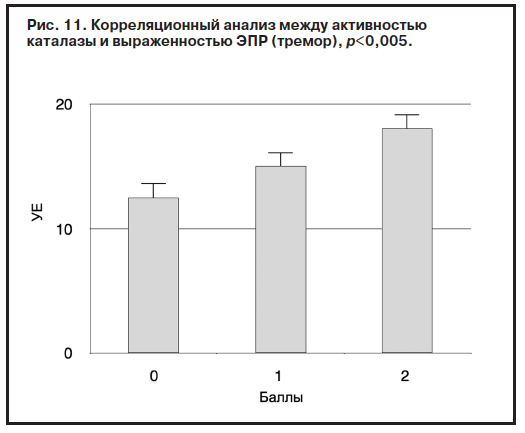
У 65% больных клинически и по результатам психометрической оценки (шкала Симпсона–Ангуса, UKU) были выявлены экстрапирамидные побочные эффекты антипсихотической терапии: тремор верхних конечностей и гипокинезия. Тяжелых двигательных нарушений не выявлено, о чем свидетельствуют относительно невысокие дозы корректоров в исследуемой группе (см. таблицу). Вместе с тем обнаружена положительная корреляция между концентрацией продуктов ПОЛ (ДК, ТК), активностью КАТ и выраженностью обусловленных фармакотерапией экстрапирамидных расстройств – тремора и гипокинезии (рис. 9–11).
Согласно данным общей клинической шкалы акатизии и шкалы акатизии Барнса (BARS) 30% больных имели легкую степень акатизии, у 10% пациентов отмечалась умеренная акатизия, 1/3 больных в легкой или умеренной степени испытывали субъективное осознание беспокойства, у 5% отмечалась умеренная степень дистресса.
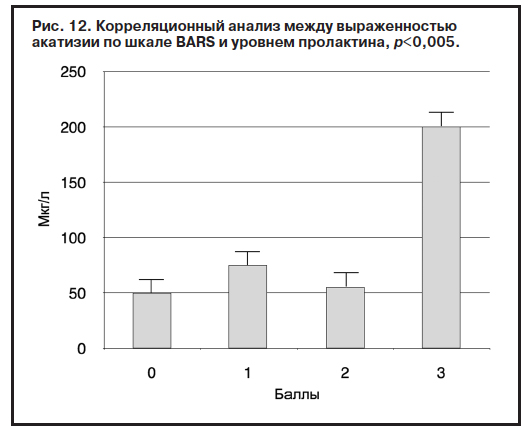
Исследование выявило, что 80% обследованных больных имели гиперпролактинемию, в том числе 82% мужчин и 88% женщин (уровень пролактина выше 19,68 мкг/л и 29,12 мкг/л соответственно). У 20% больных отмечались клинические проявления гиперпролактинемии, такие как нарушения менструального цикла, галакторея, гинекомастия, снижение либидо. При этом не была выявлена связь между уровнем пролактина и основными показателями ПОЛ и активностью ферментов АО защиты. Выявлена положительная корреляция между уровнем пролактина и выраженностью акатизии (p<0,005) – рис. 12.
Регрессионный анализ выборки позволил выявить влияние на снижение уровня пролактина факторов «длительность заболевания» и «число обострений» (22 и 29% соответственно) от всех действующих факторов, что отражают следующие уравнения:
Y=94–43lnX, R2=0,22
Y=96–76lnX, R2=0,29.
У 5,6% больных выявлен субклинический гипотиреоз (превышение уровня ТТГ выше нормативных значений 0,4–4,0 мкЕД/л). Обнаружена корреляция между уровнем ТТГ и ИК (характеризует общую степень окисленности липидов).
Обсуждение и выводы
Обзор литературы и результаты, полученные нами в ходе клинических исследований и экспериментов на животных, позволяют сделать вывод, что как сам шизофренический процесс, так и применение антипсихотиков могут оказывать существенное влияние на процессы радикалообразования. Обусловленный шизофреническим процессом интенсивный дофаминооборот не прекращается непосредственно после начала нейролептической терапии [11, 13]. Конкурируя за рецептор, молекула антипсихотика вытесняет эндогенный лиганд из связи лиганд–рецептор, блокируя последний. Однако дофамин продолжает нарабатываться, активно функционируют ферментные системы его синтеза и утилизации, что сопровождается активным образованием АФК и является предпосылкой для развития ОС [29]. Спонтанное или ферментативное (с помощью моноаминоксидазы) превращение дофамина может сопровождаться образованием супероксиданиона (О2-) и перекиси водорода (Н2О2), устранением которой и занимается фермент КАТ, повышение активности которого коррелировало, согласно полученным данным, как с показателями остроты состояния (данные шкалы PANSS), так и с выраженностью ЭПР – тремора (см. рис. 9–11).
Из литературных источников известно, что показатели ОС нарастают в периоды обострения заболевания и снижаются по мере редукции психотической симптоматики [37]. Пациенты, включенные в наше исследование, на момент забора крови 4 нед получали антипсихотическую терапию. Редукцией психотической симптоматики, возможно, постепенной стабилизацией дофаминооборота и активацией АОЗ можно объяснить то, что показатели ПОЛ и активности ферментов оказались в исследуемой группе больных значительно ниже нормативных значений
(см. рис. 1–8). Кроме того, мы исследовали показатели периферической крови, и судить о том, что происходит в заинтересованных мозговых структурах, можем лишь опосредованно, опираясь на опубликованные клинические данные и результаты экспериментов на животных.
Оценивая роль антипсихотической терапии по влиянию на развитие ОС, следует отметить, что многие используемые в клинической практике нейролептики, помимо основного механизма действия, сами обладают про- или антиоксидантной активностью. Так, например, галоперидол – антиоксидант в тестовых средах проявляет прооксидантную активность, с одной стороны, в виде своего метаболита галоперидола-пирридина, а с другой – усиливает метаболизм дофамина и работу ферментов его утилизации [7]. Данные о прооксидантной активности (способности вызывать ОС) клозапина и галоперидола у мышей опубликованы в 2004 г. в работе M.Polydoro и соавт. В других работах отмечаются антиоксидантные свойства оланзапина и преимущества антипсихотиков II генерации перед типичными нейролептиками [21, 22]. Логично предполагать, что, реализуя свои антипсихотические эффекты не только благодаря блокаде D2-рецепторов, но и за счет взаимодействия с 5HT2-серотониновыми рецепторами, более мягко взаимодействуя с дофаминергической системой и, как следствие, имея лучший профиль переносимости, атипичные антипсихотики будут иметь преимущества и в отношении меньшего риска развития ОС. Выбор палиперидона (9-гидроксирисперидон) в качестве одного из используемых в исследовании антипсихотиков, являющегося метаболитом рисперидона, но не взаимодействующего с системой цитохромов печени P-450, также способной генерировать свободные радикалы, позволил сделать предположение об отсутствии существенного влияния последней на наблюдаемые в исследовании свободнорадикальные процессы.
В нашей работе достоверных различий между подгруппами пациентов, получающих галоперидол, оланзапин, рисперидон и палиперидон, найдено не было (см. рис. 5–8). Возможно, получить статистически достоверные различия помешала сравнительно малая выборка пациентов. Однако выявленные корреляции между выраженностью ЭПР и количеством первичных и промежуточных продуктов ПОЛ, а также активностью КАТ (см. рис. 9–11), позволяют предполагать, что ведущим фактором, способствующим развитию ОС, является именно блокада Д2-рецепторов, клиническим проявлением которой независимо от выбора препарата являются ЭПР, всегда возникающие при блокаде 70–80% рецепторов нигростриатума [8], что также нашло подтверждение в серии наших экспериментов на животных [15]. Поскольку одним из наиболее частых после неврологических расстройств осложнений антипсихотической терапии является нейроэндокринная дисфункция, в нашей работе мы попытались оценить ее вклад в потенциацию ОС. Выявленный у ряда больных гипотиреоз коррелировал с ИК-показателем, характеризующим степень окисленности липидов, что не противоречит литературным данным.
Также в соответствии с данными литературы в нашем исследовании не было выявлено корреляций между уровнем пролактина и показателями ОС и АОЗ. Вместе с тем еще раз подтвердились уже представленные в литературных источниках сведения о связи акатизии и гиперпролактинемии и были получены новые данные о значимом влиянии на снижение уровня пролактина факторов «длительность заболевания» и «число обострений» (22 и 29% соответственно). Указанный феномен, возможно, объясняется снижением реактивности тубероинфундибулярной системы, отвечающей за секрецию пролактина, в ответ на фармакотерапию. Однако эти данные носят предварительный характер и нуждаются в дальнейшей тщательной проверке и изучении. Можно предположить, что, учитывая выявленное снижение уровня продуктов ПОЛ и активности ферментов АОЗ по мере редукции психопатологической симптоматики и продолжения антипсихотической терапии, препараты, обладающие антиоксидантными свойствами, имеет смысл использовать на самых ранних этапах лечения приступа заболевания. Возможно, основанием для их включения в схему фармакотерапии могут быть клинические признаки нарушения дофаминергической нейромедиации, такие как наличие психотической психопатологической симптоматики и наличие ЭПР, обусловленных фармакотерапией.
Таким образом, в нашей работе показана связь клинических проявлений параноидной шизофрении (остроты симптоматики), неврологических побочных эффектов фармакотерапии, нейротрансмиттерных нарушений и некоторых показателей ОС (ПОЛ и активности КАТ). Уточнены механизмы влияния антипсихотической терапии больных параноидной шизофренией на состояние про- и АО систем организма. Были получены новые данные о развитии нейроэндокринной дисфункции у больных шизофренией.
Сведения об авторах
Либин Леонид Яковлевич – врач-психиатр, зав. дневным стационаром СПб ГБУЗ ПНД №3
Иванов Михаил Владимирович – д-р мед. наук, проф., руководитель отд-ния биологической терапии психических больных ФГБУ СПб НИПНИ им. В.М.Бехтерева
Ключевые слова: шизофрения, оксидативный стресс, нитрозативный стресс, антиоксиданты, типичные нейролептики, атипичные антипсихотики.
On the study of the mechanisms of oxidative stress in patients with paranoid schizophrenia paroxysmal receiving antipsychotic medication
L.Ya.Libin1,2, M.V.Ivanov1, N.D.Eschenko3, S.A.Lesnikova1,2, S.G.Dagaev4
1V.M.Bekhterev Research Psychoneurological Institute; 2SPb GBUZ Mental hospital №3;
3St.-Petersburg State University; 4Institute of Toxicology of the Federal Medical and Biological Agency, St.-Petersburg
Summary. Examined the association of antipsychotic (AP) treatment and associated side effects of oxidative stress and neuroendocrine disorders. The study included: patients with a diagnosis of paranoid schizophrenia, paroxysmal (F20.01, F20.02, F20.03), aged
18 to 65 years, with a duration of antipsychotic monotherapy with one of the antipsychotics (risperidone, paliperidone, olanzapine, haloperidol) for at least 4 weeks. The control group consisted of healthy donors. Clinical, psychometric and laboratory methods were applied. Biochemical parameters were determined in the blood. The level of lipid peroxidation products and the enzyme activity of SOD and CAT were significantly lower in the patient group compared with the control group after one month of pharmacotherapy. The study failed to detect significant differences in the effect of the state of pro- and antioxidant therapy systems with typical and atypical antipsychotics. However, a positive correlation was found between the degree of lipid peroxidation, the activity of CAT and severity of extrapyramidal disorders due to drug treatment – tremor (p<0,005). A negative correlation was found between the level of thyroid stimulating hormone, pituitary gland (TSH) and Klein index (IR), which characterizes the overall degree of oxidation of the lipids. No correlation was found between prolactin levels and the intensity of lipid peroxidation. Regression analysis showed the sample to reduce the influence of prolactin factors «duration of disease» and «the number of exacerbations», by 22 and 29%, respectively.
A positive correlation was found between prolactin levels and the severity of akathisia (p<0,005) Thus, we have obtained new data on the development of neuroendocrine dysfunction in patients with schizophrenia and the effect of pro and antioxidant AP therapy systems in patients with paranoid schizophrenia.
Key words: schizophrenia, oxidative stress, nitrosative stress, antioxidants, typical antipsychotics, atypical antipsychotics.
Введение
Современные исследования о патогенезе шизофрении, включающие данные из области смежных нейронаук, результаты применения методов нейровизуализации позволяют рассматривать шизофрению уже не столько как функциональное расстройство, а как одно из полиэтиологических заболеваний с очевидной тенденцией к развитию нейродегенеративных процессов [20]. В настоящее время можно считать доказанным, что механизмы окислительного стресса (ОС) активно задействованы в патогенезе шизофрении. Эта гипотеза всегда имела теоретическую привлекательность по следующим причинам: головной мозг (ГМ) является особенно уязвимым к окислительному повреждению из-за сравнительно высокого коэффициента использования кислорода и, следовательно, активного образования свободных радикалов, относительной слабости антиоксидантной защиты и богатства полиненасыщенными жирными кислотами, представляющих собой готовые субстраты окисления, активного оборота нейротрансмиттеров и наличия металлов переменной валентности, таких как железо и медь [10, 33, 34]. Установлено, что увеличение стационарного уровня свободнорадикальных форм кислорода и азота в мозге приводит к возникновению ОС или нитрозативного стресса, что может быть одним из факторов, способствующих развитию нейродегенеративных и психических заболеваний [2, 33, 34]. Обнаружены нарушения со стороны регуляции перекисного окисления липидов (ПОЛ) у больных шизофренией, эпилепсией, рассеянным склерозом, болезнью Паркинсона и Альцгеймера и др. [32, 36]. Работа нейромедиаторных систем тесно связана с интенсивностью процессов ПОЛ. Выявлена зависимость между составом фосфолипидов синаптических мембран, интенсивностью процессов ПОЛ в них и функциональной активностью нейромедиаторных систем. Электрическая активность нейронов и чувствительность рецепторов к медиаторам также зависят от активности ПОЛ. Установлено, что активные формы кислорода (АФК), инициируя ПОЛ, воздействуют на рецепторный аппарат и могут влиять на дофаминергическую передачу [30]. Кроме того, показано, что следствием ОС могут являться нарушения холинергической трансмиссии [25]. Структура и функция биомембран нейронов, мембранно-связанных белков, таких как рецепторы, ферменты, ионофоры, зависят от интенсивности свободнорадикальных процессов в организме. ПОЛ играет важную роль в модификации мембран и, следовательно, нарушении работы рецепторного аппарата [33]. Катехоламины (дофамин и норадреналин) активируют процессы ПОЛ и могут усиливать цитотоксическое действие в областях центральной нервной системы, содержащих катехоламинергические нейроны [35]. Именно поэтому наивысшая активность таких компонентов антиоксидантной защиты (АОЗ), как глутатионпероксидаза и глутатионредуктаза, регистрируется в областях с максимальным содержанием дофамина [18]. Избыточная продукция или недостаточно быстрая нейтрализация глутамата, дофамина, норадреналина приводит к нейротоксическим эффектам, связанным со стимуляцией образования АФК. При этом нарушение дофаминергической нейротрансмиссии рассматривается как один из центральных механизмов патофизиологии шизофрении [11, 13]. Каждый из катехоламинов, и прежде всего дофамин, способен к аутоокислению с образованием реакционно-способных радикальных продуктов. Спонтанное или ферментативное (с помощью моноаминоксидазы) превращение дофамина может сопровождаться образованием супероксиданиона (О2-) и перекиси водорода (Н2О2) [29]. Избыточная генерация Н2О2 угнетает активность СОД, что в свою очередь повышает уровень О2-.
Таким образом, АФК ингибируют активность ферментов-антиоксидантов, что приводит к снижению буферной емкости ферментативной АОЗ и дополнительному повышению уровня АФК. Параллельно наблюдается истощение неферментативных компонентов АОЗ, таких как токоферол, аскорбиновая кислота, глутатион, которые при нейтрализации радикальных продуктов переходят в неактивное состояние или образуют радикальные продукты разной степени токсичности [33]. В моделях болезни Паркинсона на животных обнаружен повышенный оборот дофамина, что сопровождается высокой скоростью его аутоокисления и образованием реакционно-способных соединений, приводящих к гибели дофаминергических нейронов. Это ускоряет оборот дофамина в здоровых клетках, что приводит к прогрессированию заболевания [12]. При этом следует отметить, что одно из признанных модельных состояний – блокада дофаминовых рецепторов II типа нейролептиком галоперидолом – полностью воспроизводит картину экстрапирамидных расстройств (ЭПР), наиболее частого неврологического осложнения антипсихотической терапии [24, 26]. Галоперидол избирательно блокирует дофаминовые Д2-рецепторы, связанные с его применением двигательные нарушения возникают при блокаде 70–80% популяции Д2-рецепторов нигростриатальной системы [8], вовлеченной в организацию двигательной и поведенческой активности. В свою очередь, известно, что блокада дофаминовых Д2-рецепторов галоперидолом может увеличивать синаптический выход глутамата [3], а одним из важных источников образования АФК является активация глутаматом глутаматных рецепторов. Показано, что связывание лиганда с NМДА-рецепторами приводит к генерации О2- [28]. При активации глутаматных рецепторов увеличивается продукция еще одного АФК – оксида азота (NO) – из аргинина. Этому способствует открытие Са2+-каналов, связанных с глутаматными рецепторами, вход Са2+ внутрь клетки и, как следствие, активация NO-синтазы, а также фосфолипаз, ксантиноксидазы [29]. Образующийся NO взаимодействует с О2- с образованием пероксинитрита (ONOO-), который является высокореакционной молекулой. Пероксинитрит разрушается до гидроксильного радикала и диоксида азота (NO2). Обе эти молекулы участвуют в повреждении липидных мембран, белков рецепторов, наследственного материала.
Кроме того, ONOO- способен взаимодействовать с фактором транскрипции и вызывать апоптоз [35]. В серии предварительно проведенных нами экспериментов на животных мы пришли к выводу, что блокада Д2-дофаминовых рецепторов типичным нейролептиком галоперидолом вызывала интенсификацию ПОЛ в структурах ГМ. При этом наиболее значимыми были изменения в стриатуме, где обнаружено повышение содержания как первичных, так и конечных продуктов ПОЛ. Активность СОД в коре, стриатуме и гиппокампе животных при действии галоперидола коррелировала с наличием или отсутствием двигательных нарушений (каталепсии). Результаты наших экспериментов, включающих использование блокаторов глутаматных NMDA-рецепторов, позволили также выделить два клинически идентичных, но гетерогенных по биохимическим показателям варианта двигательных нарушений (каталепсии): первый обусловлен только блокадой Д2-дофаминовых рецепторов в области стриатума, второй – обусловленный синергическим действием блокады дофамин- и глутаматергической систем. При этом во втором случае блокада глутаматных NMDA-рецепторов оказывала протекторное действие по отношению к процессам свободнорадикального окисления (СРО) [15]. Таким образом, и сам шизофренический процесс, и проводимая в процессе его лечения фармакотерапия могут оказывать влияние на состояние про- и антиоксидантных систем, а учитывая универсальность, способность к самоускорению и влияние СРО на многие жизненно важные процессы, развитие ОС способно перекрывать вклад специфических нарушений нейромедиации и приводить к необратимым последствиям [36]. Вместе с тем данные об эффективности антиоксидантов в составе комплексной терапии больных шизофренией носят крайне противоречивый характер. От обнадеживающих, как, например, слепое плацебо-контролируемое исследование N-ацетилцистеина у больных шизофренией [5], до неубедительных и малоинформативных в силу малого объема выборки или дизайна исследований [6]. Уточнению механизмов развития оксидативного стресса у больных параноидной шизофренией, оценке влияния антипсихотической терапии на процессы радикалообразования, уточнению обоснованности антиоксидантной терапии у этой группы больных посвящена наша работа.
Материалы и методы
В исследование включались: пациенты с диагнозом шизофрении параноидной, эпизодической (F20.01, F20.02, F20.03), согласно критериям Международной классификации болезней 10-го пересмотра (МКБ-10), возраст от 19 до 65 лет (средний возраст 31,6±1,81 года, возраст начала болезни 25,2±7,8 года), получавшие в связи с обострением заболевания (общий балл PANSS>55) в течение 1 мес монотерапию одним из четырех антипсихотиков (рисперидон, палиперидон, оланзапин, галоперидол). Допускалось использование корректоров. В исследование не включались: пациенты с органическими заболеваниями ГМ, хроническими заболеваниями печени и почек, бронхолегочной патологией. Материал исследования составили 72 пациента (38 мужчин, 34 женщины): 22 пациента получали терапию традиционным нейролептиком галоперидолом (14,6±1,87 мг); 50 больных лечились атипичными антипсихотиками, в том числе 20 больных получали рисперидон (5,5±1,97 мг), 16 – палиперидон (7,5±2,20 мг), 14 – зипрексу (12,9±2,34 мг). Все пациенты в качестве корректора получали тригексифенидил (циклодол). Дозы корректора по группам представлены в таблице.
Группу контроля составили 30 здоровых доноров (16 мужчин, 14 женщин). Больных обследовали на стадии
обострения заболевания, в условиях стационарного или полустационарного лечения, с длительностью монотерапии антипсихотиками не менее 4 нед. Обследование носило комплексный характер и включало клинико-психопатологический, клинико-лабораторный и психометрический методы. Использовались следующие шкалы: PANSS [14], шкала побочных эффектов UKU [16], шкала депрессии Калгари (CDSS) [1], согласно которой депрессия определялась при сумме баллов от 5 и выше [19], общая клиническая шкала акатизии, шкала акатизии Барнса (BARS) [4], шкала оценки неврологического статуса Симпсона–Ангуса [23], шкала патологических непроизвольных движений [9]. В крови определялись биохимические показатели: гормоны – пролактин, ТТГ; ферменты антиоксидантной защиты – СОД и КАТ; показатели ПОЛ – диеновые конъюгаты (ДК) и триеновые конъюгаты (ТК); основания Шиффа (ОШ), малоновый диальдегид (МДА); ИК [27]. У всех пациентов определяли натощак уровень пролактина в сыворотке крови с помощью тест-системы Ortho-Clinical Diagnostics: использовались референтные значения, принятые в Российской Федерации и США: пролактин – для мужчин от 3,28 мкг/л (нг/мл) до 19,68 мкг/л (нг/мл), для женщин от 3,24 нг/мл до 29,12 нг/мл. Статистические методы включали описательную статистику: среднее арифметическое, стандартное отклонение. Проведены: регрессионный анализ, параметрический корреляционный анализ по Пирсону и сравнительный анализ по t-критерию Стьюдента [38].
Результаты
В психическом статусе обследованных больных преобладала параноидная (50%), галлюцинаторно-параноидная (35%) и депрессивно-параноидная (15%) симптоматика. Не выявлено корреляций между синдромальной структурой и показателями ПОЛ и активностью ферментов АОЗ (СОД и КАТ). Однако при корреляционном анализе показателей шкалы PANSS (общий балл, субшкалы позитивных симптомов и негативных симптомов) и исследуемых биохимических показателей выявлена прямая корреляция этих данных с активностью КАТ (p<0,005), что может косвенно свидетельствовать о связи активности этого фермента с остротой психопатологической симптоматики.
Уровень продуктов ПОЛ (ДК, ТК, ОШ) и активность ферментов АО защиты (СОД, КАТ) оказались достоверно ниже в группе пациентов по сравнению с группой контроля спустя месяц фармакотерапии. Выявленная закономерность сохранялась как при сравнительном анализе общих показателей группы пациентов и контрольной группы – доноров (рис. 1, 2), так и при парном сравнении мужчин и женщин этих групп (рис. 3, 4).




Вопреки ожиданиям в нашем исследовании не удалось выявить существенных различий по влиянию на состояние про- и антиоксидантных систем терапии между типичными и атипичными антипсихотиками (рис. 5–8).




У 65% больных клинически и по результатам психометрической оценки (шкала Симпсона–Ангуса, UKU) были выявлены экстрапирамидные побочные эффекты антипсихотической терапии: тремор верхних конечностей и гипокинезия. Тяжелых двигательных нарушений не выявлено, о чем свидетельствуют относительно невысокие дозы корректоров в исследуемой группе (см. таблицу). Вместе с тем обнаружена положительная корреляция между концентрацией продуктов ПОЛ (ДК, ТК), активностью КАТ и выраженностью обусловленных фармакотерапией экстрапирамидных расстройств – тремора и гипокинезии (рис. 9–11).



Согласно данным общей клинической шкалы акатизии и шкалы акатизии Барнса (BARS) 30% больных имели легкую степень акатизии, у 10% пациентов отмечалась умеренная акатизия, 1/3 больных в легкой или умеренной степени испытывали субъективное осознание беспокойства, у 5% отмечалась умеренная степень дистресса.
Исследование выявило, что 80% обследованных больных имели гиперпролактинемию, в том числе 82% мужчин и 88% женщин (уровень пролактина выше 19,68 мкг/л и 29,12 мкг/л соответственно). У 20% больных отмечались клинические проявления гиперпролактинемии, такие как нарушения менструального цикла, галакторея, гинекомастия, снижение либидо. При этом не была выявлена связь между уровнем пролактина и основными показателями ПОЛ и активностью ферментов АО защиты. Выявлена положительная корреляция между уровнем пролактина и выраженностью акатизии (p<0,005) – рис. 12.

Регрессионный анализ выборки позволил выявить влияние на снижение уровня пролактина факторов «длительность заболевания» и «число обострений» (22 и 29% соответственно) от всех действующих факторов, что отражают следующие уравнения:
Y=94–43lnX, R2=0,22
Y=96–76lnX, R2=0,29.
У 5,6% больных выявлен субклинический гипотиреоз (превышение уровня ТТГ выше нормативных значений 0,4–4,0 мкЕД/л). Обнаружена корреляция между уровнем ТТГ и ИК (характеризует общую степень окисленности липидов).
Обсуждение и выводы
Обзор литературы и результаты, полученные нами в ходе клинических исследований и экспериментов на животных, позволяют сделать вывод, что как сам шизофренический процесс, так и применение антипсихотиков могут оказывать существенное влияние на процессы радикалообразования. Обусловленный шизофреническим процессом интенсивный дофаминооборот не прекращается непосредственно после начала нейролептической терапии [11, 13]. Конкурируя за рецептор, молекула антипсихотика вытесняет эндогенный лиганд из связи лиганд–рецептор, блокируя последний. Однако дофамин продолжает нарабатываться, активно функционируют ферментные системы его синтеза и утилизации, что сопровождается активным образованием АФК и является предпосылкой для развития ОС [29]. Спонтанное или ферментативное (с помощью моноаминоксидазы) превращение дофамина может сопровождаться образованием супероксиданиона (О2-) и перекиси водорода (Н2О2), устранением которой и занимается фермент КАТ, повышение активности которого коррелировало, согласно полученным данным, как с показателями остроты состояния (данные шкалы PANSS), так и с выраженностью ЭПР – тремора (см. рис. 9–11).
Из литературных источников известно, что показатели ОС нарастают в периоды обострения заболевания и снижаются по мере редукции психотической симптоматики [37]. Пациенты, включенные в наше исследование, на момент забора крови 4 нед получали антипсихотическую терапию. Редукцией психотической симптоматики, возможно, постепенной стабилизацией дофаминооборота и активацией АОЗ можно объяснить то, что показатели ПОЛ и активности ферментов оказались в исследуемой группе больных значительно ниже нормативных значений
(см. рис. 1–8). Кроме того, мы исследовали показатели периферической крови, и судить о том, что происходит в заинтересованных мозговых структурах, можем лишь опосредованно, опираясь на опубликованные клинические данные и результаты экспериментов на животных.
Оценивая роль антипсихотической терапии по влиянию на развитие ОС, следует отметить, что многие используемые в клинической практике нейролептики, помимо основного механизма действия, сами обладают про- или антиоксидантной активностью. Так, например, галоперидол – антиоксидант в тестовых средах проявляет прооксидантную активность, с одной стороны, в виде своего метаболита галоперидола-пирридина, а с другой – усиливает метаболизм дофамина и работу ферментов его утилизации [7]. Данные о прооксидантной активности (способности вызывать ОС) клозапина и галоперидола у мышей опубликованы в 2004 г. в работе M.Polydoro и соавт. В других работах отмечаются антиоксидантные свойства оланзапина и преимущества антипсихотиков II генерации перед типичными нейролептиками [21, 22]. Логично предполагать, что, реализуя свои антипсихотические эффекты не только благодаря блокаде D2-рецепторов, но и за счет взаимодействия с 5HT2-серотониновыми рецепторами, более мягко взаимодействуя с дофаминергической системой и, как следствие, имея лучший профиль переносимости, атипичные антипсихотики будут иметь преимущества и в отношении меньшего риска развития ОС. Выбор палиперидона (9-гидроксирисперидон) в качестве одного из используемых в исследовании антипсихотиков, являющегося метаболитом рисперидона, но не взаимодействующего с системой цитохромов печени P-450, также способной генерировать свободные радикалы, позволил сделать предположение об отсутствии существенного влияния последней на наблюдаемые в исследовании свободнорадикальные процессы.
В нашей работе достоверных различий между подгруппами пациентов, получающих галоперидол, оланзапин, рисперидон и палиперидон, найдено не было (см. рис. 5–8). Возможно, получить статистически достоверные различия помешала сравнительно малая выборка пациентов. Однако выявленные корреляции между выраженностью ЭПР и количеством первичных и промежуточных продуктов ПОЛ, а также активностью КАТ (см. рис. 9–11), позволяют предполагать, что ведущим фактором, способствующим развитию ОС, является именно блокада Д2-рецепторов, клиническим проявлением которой независимо от выбора препарата являются ЭПР, всегда возникающие при блокаде 70–80% рецепторов нигростриатума [8], что также нашло подтверждение в серии наших экспериментов на животных [15]. Поскольку одним из наиболее частых после неврологических расстройств осложнений антипсихотической терапии является нейроэндокринная дисфункция, в нашей работе мы попытались оценить ее вклад в потенциацию ОС. Выявленный у ряда больных гипотиреоз коррелировал с ИК-показателем, характеризующим степень окисленности липидов, что не противоречит литературным данным.
Также в соответствии с данными литературы в нашем исследовании не было выявлено корреляций между уровнем пролактина и показателями ОС и АОЗ. Вместе с тем еще раз подтвердились уже представленные в литературных источниках сведения о связи акатизии и гиперпролактинемии и были получены новые данные о значимом влиянии на снижение уровня пролактина факторов «длительность заболевания» и «число обострений» (22 и 29% соответственно). Указанный феномен, возможно, объясняется снижением реактивности тубероинфундибулярной системы, отвечающей за секрецию пролактина, в ответ на фармакотерапию. Однако эти данные носят предварительный характер и нуждаются в дальнейшей тщательной проверке и изучении. Можно предположить, что, учитывая выявленное снижение уровня продуктов ПОЛ и активности ферментов АОЗ по мере редукции психопатологической симптоматики и продолжения антипсихотической терапии, препараты, обладающие антиоксидантными свойствами, имеет смысл использовать на самых ранних этапах лечения приступа заболевания. Возможно, основанием для их включения в схему фармакотерапии могут быть клинические признаки нарушения дофаминергической нейромедиации, такие как наличие психотической психопатологической симптоматики и наличие ЭПР, обусловленных фармакотерапией.
Таким образом, в нашей работе показана связь клинических проявлений параноидной шизофрении (остроты симптоматики), неврологических побочных эффектов фармакотерапии, нейротрансмиттерных нарушений и некоторых показателей ОС (ПОЛ и активности КАТ). Уточнены механизмы влияния антипсихотической терапии больных параноидной шизофренией на состояние про- и АО систем организма. Были получены новые данные о развитии нейроэндокринной дисфункции у больных шизофренией.
Сведения об авторах
Либин Леонид Яковлевич – врач-психиатр, зав. дневным стационаром СПб ГБУЗ ПНД №3
Иванов Михаил Владимирович – д-р мед. наук, проф., руководитель отд-ния биологической терапии психических больных ФГБУ СПб НИПНИ им. В.М.Бехтерева
Список исп. литературыСкрыть список1. Addington D et al. Calgary depression scale for schizophrenia, 1993.
2. Ames BN, Shigenaga M, Hagen T. Oxidants, autooxidants, and the degenerative diseases of aging. Proc Nat Acad Sci 1993; 90 (17): 7915–22.
3. Bardgett ME, Wrona CT, Newcomer JW, Csernansky JG. Subcortical excitatory amino acid levels after acute and subchronic administration of typical and atypical neuroleptics. Eur J Pharmacol 1993; 230: 245–50.
4. Barnes TR. A rating scale for drug-induced akathisia. Br J Psychiat 1989; 154: 672–6.
5. Berk M et al. N-acetyl cysteine as a glutathione precursor for schizophrenia. A double-blind, randomized, placebo-controlled trial bush. Biologic Psychiat 2008; 64: 361–8.
6. Berk M, Felicity Ng et al. Oxidative stress in psychiatric disorders: evidence base and therapeutic implications. Inter J Neuropsychopharmacol 2008; 11: 851–76.
7. Cooper JR, Bloom EB, Roth RH. The biochemical basis of neuropharmacology. Pub By Oxford University Press (M.A. NY) 2003; p. 405.
8. Farde L, Nordstrom A-L, Wiesel F-A et al. Positron emission tomographic analysis of central D1 and D2-dopamine receptor occupancy in patients treated with classical neuroleptics and clozapine-relation to extrapyramidal side effects. Arch Gen Psychiat 1992; 49: 538–44.
9. Guy W. NIMH. AIMS – Abnormal Involuntary Movement Scale. ECDEU assessment manual for psychopharmacology. Rockville, Maryland: National Institutes of Mental Health 1976; p. 534–7.
10. Halliwell B. (2006). Oxidative stress and neurodegeneration: where are we now? J Neurochemist 1997; p. 1634–58.
11. Howes OD, Kapur S. The dopamine hypothesis of schizophrenia: version III – the final common pathway. Schizophrenia Bulletin 2009; 35: 549–62.
12. Jenner P. Oxidative stress in Parkinson\'s disease and other neurodegenerative disorders. Path Biol 1996; 44: 57–64.
13. Kapur S. Psychosis as a state of aberrant salience: a framework linking biology, phenomenology, and pharmacology in schizophrenia. Am J Psychiat 2003; 160: 13–23.
14. Kay SR, Fizbein A, Opler LA. The positive and negative syndrome scale (PANSS) for schizophrenia. Schizophr Bull 1987; 13: 261.
15. Libin LYa, Dagaev SG, Kubarskaja LG, Eschenko ND. The effects of disturbance in neurumediator systems on lipid peroxidation and superoxide dismutase activity in rat brain cortex, hippocampus and striatum. Vestnik St.-Petersburg University 2012. Ser. 3. Iss. 3; p. 98–105.
16. Lingjaerde O, Ahlfors UG, Bech P et al. The UKU side effect rating scale. A new comprehensive rating scale for psychotropic drugs and a cross-sectional study of side effects in neuroleptic-treated patients. Acta Psychiat Scand 1987 (Suppl.); 334: 1–100.
17. Meyer U. Developmental neuroinflammation and schizophrenia. Prog Neuro-Psychopharmacol Biol Psychiat 2011. doi:10.1016/ j.pnpbp.2011.11.003
18. Mizuno Y, Ohta K. Regional distribution of thiobarbituric acid-reactive products, activities of enzymes regulating the metabolism of oxygen free radical, and some of the related enzymes in adult and aged rat brain. J Neurochem 1986; 46 (5): 1344–52.
19. Muller MJ. The Calgary Depression Rating Scale for schizophrenia in a healthy control group. Psychometric properties and reference values. J Affect Dis 2005; 88: 69–74.
20. Oertel-Kno ЕV, Bittner Robert A et al. Discovery and development of integrative biological markers for schizophrenia. Progress in Neurobiol 2011; 95: 686–702.
21. Padurariu М et al. Evaluation of antioxidant enzymes activities and lipid peroxidation in schizophrenic patients treated with typical and atypical antipsychotics. Neuroscience Letters 2010; 479: 317–20.
22. Reinke A et al. Haloperidol and clozapine, but not olanzapine, induces oxidative stress in rat brain. Neuroscience Letters 2004; 372: 157–60.
23. Simpson GM, Angus JW. A rating scale for extrapyramidal side effects. Acta Psychiat Scand 1970; 212 (44): 11–9.
24. Timmerman W, Tepper PG, Bohus BG, Horn AS. The potential antipsychotic activity of the partial dopamine receptor agonist. Eur J Pharmacol 1990; 181 (3): 253–60.
25. Yu BP. Aging and oxidative stress: modulation by dietary restriction. Free Radic Biol Med 1996; 21 (5): 651–68.
26. Арана Д., Розенбаум Д. Фармакотерапия психических расстройств. Пер. с англ. М.: Бином, 2004.
27. Арутюнян А.В., Дубинина Е.Е. Методы оценки свободнорадикального окисления и антиоксидантной системы организма. Метод. рекомендации. СПб.: ИКФ Фолиант, 2000.
28. Беспалов А.Ю., Звартау Э.Э. Нейропсихофармакология антагонистов NMDA-рецепторов. СПб.: Невский диалект, 2000.
29. Болдырев А.А. Роль активных форм кислорода в жизнедеятельности нейрона. Успехи физиологических наук. 2003; 34 (3): 21–34.
30. Бурлакова Е.Б., Губарева А.Е., Архипова Г.В., Рогинский В.А. Модуляция перекисного окисления липидов биогенными аминами в модельных системах. Вопр. мед. хим. 1992; 2: 17–20.
31. Горобец Л.Н. Нейроэндокринные дисфункции и нейролептическая терапия. М.: Медпрактика-М, 2007.
32. Гуляева Н.В., Ерин А.Н. Роль свободнорадикальных процессов в развитии нейродегенеративных заболеваний (болезнь Паркинсона и болезнь Альцгеймера). Нейрохимия. 1995; 12 (2): 3–16.
33. Дубинина Е.Е. Роль окислительного стресса при патологических состояниях нервной системы. Успехи функциональной нейрохимии. Под ред. С.А.Дамбиновой, А.А.Арутюняна. СПб.: Изд-во СПб ун-та. 2003; с. 285–301.
34. Ещенко Н.Д. Биохимия психических и нервных болезней. Избранные разделы. Учеб. пособие. СПб.: Изд-во СПб ун-та, 2004.
35. Зенков Н.К., Ланкин В.З., Меньщикова Е.Б. Окислительный стресс: биохимический и патофизиологический аспекты. М.: МАИК Наука/Интерпериодика, 2001.
36. Никушкин Е.В. Перекисное окисление липидов в ЦНС в норме и при патологии. Нейрохимия. 1989; 8 (1): 124–45.
37. Рачкаускас Г.С. Перекисное окисление липидов и состояние адениловой системы при шизофрении. История Сабуровой дачи: успехи психиатрии, неврологии, нейрохирургии и наркологии. Сб. науч. работ Украинского НИИ клинической и экспериментальной неврологии и психиатрии и Харьковской городской клинической психиатрической больницы №15. Под ред. И.Кутько, П.Петрюка. Харьков, 1996; 3: 322–3.
38. Урбах В.Ю. Математическая статистика для биологов и медиков. М.: Изд-во АН СССР, 1963.

