Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2012
Эндокринологические аспекты проблемы переносимости нейролептической терапии у больных шизофренией (возрастные и гендерные факторы) №01 2012
Номера страниц в выпуске:41-47
Данный обзор посвящен одной из актуальных тем психофармакологии – вопросам переносимости нейролептической терапии с учетом возрастных и гендерных факторов. Показано, что основными «уязвимыми» для формирования ряда нейроэндокринных дисфункций являются детский, подростковый и пожилой возрастные периоды. Кроме того, показана роль гендерного фактора в формировании нейроэндокринных дисфункций. Представлены основные принципы и подходы к назначению и проведению нейролептической терапии с учетом указанных факторов.
Резюме. Данный обзор посвящен одной из актуальных тем психофармакологии – вопросам переносимости нейролептической терапии с учетом возрастных и гендерных факторов. Показано, что основными «уязвимыми» для формирования ряда нейроэндокринных дисфункций являются детский, подростковый и пожилой возрастные периоды. Кроме того, показана роль гендерного фактора в формировании нейроэндокринных дисфункций. Представлены основные принципы и подходы к назначению и проведению нейролептической терапии с учетом указанных факторов.
Ключевые слова: шизофрения, нейролептики, возраст, гендер, нейроэндокринные дисфункции.
Endocrinological aspects of neuroleptic therapy tolerance in patients with schizophrenia (age and gender factors)
L.N.Gorobets
Moscow Research Institute of Psychiatry, Ministry of Health and Social Development of Russia, Moscow
Summary. This review deals with one of the topical issues of psychopharmacology, namely tolerance to neuroleptic therapy with regard to age and gender factors. Childhood, adolescence, and elderly age are shown to be mainly vulnerable in developing a number of neuroendocrine dysfunctions (NED). The role of a gender factor in developing NED is also indicated. The basic principles and approaches to the use and performance of neuroleptic therapy are given in terms of the above factors.
Key words: schizophrenia, neuroleptics, age, gender, neuroendocrine dysfunctions.
Антипсихотические препараты, или нейролептики составляют одну из главных групп психофармакотерапевтических (ПФТ) средств и занимают центральное место в современной психиатрической практике [7]. Следует отметить, что основное внимание исследователей и практических врачей долгое время было направлено в основном на изучение эффективности применяемых нейролептических средств в отношении психопатологической симптоматики. Так, при купирующей ПФТ учитывалась симптомоспецифичность нейролептика (влияние на галлюцинаторно-бредовую симптоматику, возбуждение, антидепрессивное действие и т.д.). При длительной противорецидивной терапии одной из основных оценок эффективности являлось отсутствие рецидивов психического заболевания. Значительно меньше внимания уделялось изучению переносимости антипсихотиков – побочным эффектам (ПЭ) и осложнениям (экстрапирамидным двигательным расстройствам, нейроэндокринным дисфункциям – НЭД, токсическому эффекту и др.). В последние десятилетия в связи с современными требованиями к проведению ПФТ, а также с появлением антипсихотиков нового поколения (АНП) изменились основные параметры оценки оптимального результата лечения, среди которых наряду с эффективностью все большее значение приобретают параметры переносимости [1, 4, 7].
Профиль переносимости (возможные ПЭ) оригинальных АНП, к которым относятся рисперидон, оланзапин, кветиапин, зипразидон, сертиндол и арипипразол, к настоящему моменту исследован достаточно широко [4, 7, 14, 22, 27]. Вместе с тем обращает на себя внимание все более широкое использование в российской психиатрической практике генериков АНП, в частности ридонекса (рисперидон) и нантарида (кветиапин), выпускаемых компанией «Гедеон Рихтер» (Венгрия). Применение препаратов-генериков позволяет решить одну из важных проблем – фармакоэкономическую, т.е. снизить стоимость лечения как для лечебных учреждений, так и для больного, особенно в случае необходимости длительной поддерживающей ПФТ. В то же время введение указанных препаратов в терапевтическую практику диктует необходимость проведения исследований, направленных на оценку показателей эффективности и профиля безопасности этих лекарственных средств. В двух российских исследованиях по изучению ридонекса (4–8 мг/сут) была показана высокая эффективность и вполне допустимая переносимость и безопасность препарата [9, 12]. Так, в 13,3% случаев у мужчин отмечались нарушения сексуальной сферы; увеличение массы тела за 12 нед исследования составила 1,15±0,79 кг, что позволяет оценивать выраженность данного эффекта как незначительную [12]. Необходимо подчеркнуть, что исследование и решение проблемы переносимости (ПЭ в целом и НЭД в частности) антипсихотиков является одной из важных составляющих на современном этапе разработки оптимизации терапии у психически больных.
Необходимо подчеркнуть, что исследование и решение проблемы переносимости (ПЭ в целом и НЭД в частности) антипсихотиков является одной из важных составляющих на современном этапе разработки оптимизации терапии у психически больных.
Проблемы, связанные с лекарствами (drug-related problem), – это явления и обстоятельства, имеющие отношение к лекарственной терапии, которые не позволяют достичь оптимального результата лечения или способны помешать его достижению [1]. В первую очередь это касается ПЭ препаратов. В этом отношении нейролептики занимают одно из первых мест среди лекарственных средств по частоте формирования ПЭ и осложнений, которая, по данным разных авторов, составляет от 2 до 100% случаев у госпитализированных и амбулаторных пациентов [4, 7, 31]. Одним из объяснений этому факту является высокая чувствительность центральной нервной системы (ЦНС) и эндокринной системы к любому (в данном случае к нейролептическому препарату) биологическому воздействию.
Анализ научной литературы показал, что, несмотря на значимость проблемы переносимости ПФТ, количество соответствующих исследований недостаточно. Кроме того, в связи с отсутствием валидных методологических подходов к изучению ПЭ и унифицированной оценки нежелательных явлений нейролептической терапии данные, касающиеся этой проблемы, приводимые разными авторами, неоднозначны, а часто и прямо противоречивы [4, 7, 33–35, 41, 54, 56].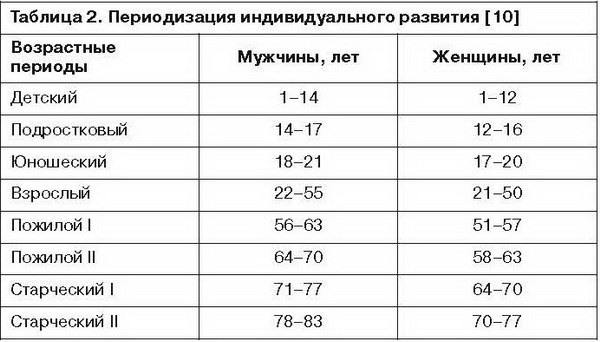
На основании экспериментальных, биологических и эпидемиологических исследований были выделены 2 группы факторов, влияющих на переносимость нейролептических препаратов. По мнению ряда авторов, к 1-й (основной) группе относятся факторы, связанные с применяемым антипсихотиком: особенности фармакодинамики (спектр рецепторной предпочтительности); широта терапевтического действия (диапазон между терапевтической и токсической дозами); фармакодинамические показатели; дозозависимость ПЭ; полипрагмазия, наличие ПЭ при предшествующей терапии и т.д. Ко 2-й не менее важной группе принадлежат факторы, относящиеся к пациенту: возрастные, гендерные, метаболические, элиминационные, энзимные, аллергические, иммунологические, морфофункциональные (включая антропометрические), коморбидные соматические заболевания, информационные и др. [4, 7, 15, 39, 44, 49, 55].
Расхождения в оценке частоты ПЭ и осложнений нейролептической терапии (каждого конкретного препарата), входящих в дефиницию переносимости, могут быть связаны со следующими обстоятельствами.
1. Большое значение имеет степень информированности больного (и, соответственно, предъявляемые жалобы) о возможных нежелательных эффектах нейролептиков (сведения, получаемые от врача, окружающих родственников и больных, а также содержащиеся во вкладыше к препарату).
2. Различные виды проводимых исследований. Так, в рандомизированных контролируемых исследованиях проводится вычленение собственно ПЭ нейролептика, тогда как в обсервационных – учет всех нежелательных явлений без учета того, является ли это ПЭ препарата. Необходимо отметить, что оценка нежелательного явления как ПЭ конкретного препарата весьма затруднительна.
К примеру, наличие нарушений менструального цикла или сексуальных дисфункций у больных при терапии исследуемым нейролептиком может быть связано с влиянием самого психического заболевания, коморбидными расстройствами или предшествующей ПФТ, а не с пролактогенным действием препарата [1, 4, 7]. 3. Различная длительность исследования (купирующая или длительная противорецидивная терапия). Ранее опубликованные нами данные [4] показали, что частота формирования НЭД значительно различается в зависимости от длительности проводимой терапии и препарата, что согласуется с большинством зарубежных исследований [14, 20–22, 24].
4. Необходимость объективизации наличия НЭД путем активного их выявления психиатром, а не только учет спонтанных жалоб, который довольно часто связан с субъективной значимостью НЭД для пациента.
5. Отсутствие достаточных и доступных в повседневной практике методов обследования для выявления НЭД (невозможность проведения гормональных, биохимических исследований и т.д.).
Таким образом, при анализе переносимости (НЭД) нейролептиков необходимо учитывать комплекс параметров, представленных в табл. 1.
В данной работе мы остановимся на двух важных факторах, относящихся к пациенту и влияющих на развитие НЭД, – возрастном и гендерном.
Возрастной фактор в развитии НЭД
Как было отмечено, возрастной фактор имеет большое значение в развитии НЭД при нейролептической терапии. В этой связи особое внимание уделяется наиболее «уязвимым» возрастным периодам – детскому, подростковому, юношескому, а также лицам пожилого возраста [4, 35, 45]. Основные возрастные параметры индивидуального развития представлены в табл. 2.
Кроме указанных в табл. 2 возрастных периодов, необходимо учитывать так называемые возрастные кризы, к которым относятся пубертатный (12–15 лет) и климактерический (45–55 лет у женщин и 50–60 лет у мужчин). Первый характеризуется «гормональной бурей», которая сопровождается непоседливостью, беспокойством, непослушанием, раздражительностью, упрямством, сменяющимися к 16 годам «фазой успокоения», выравниванием поведения и взаимоотношений с окружающими. Как правило, именно это время начала развития различных видов психических расстройств. Климактерический криз характеризуется эмоциональными и аффективными расстройствами на фоне изменений функционирования (обратного развития) эндокринной системы и присоединением коморбидных соматических заболеваний [10, 56].
Особенности нейролептической терапии у больных детского возраста
Несмотря на то что нейролептики относительно недавно нашли свое применение в детской психиатрической практике, в настоящее время от 40 до 60% детей, обращающихся за помощью к психиатру, получают нейролептическую терапию. Значительные трудности при выборе способа терапевтического вмешательства связаны с противоречивостью данных о безопасности применения нейролептиков у детей, и перед психиатром в этом случае всегда встает вопрос о соотношении «пользы и вреда» для пациента [10, 11, 16].
Актуальность проблемы безопасности (переносимости) ПФТ в детском возрасте имеет свои специфические аспекты, связанные как с особенностями протекания психических расстройств в данной возрастной группе, так и с нерешенностью целого ряда вопросов, к которым относятся: малая эффективность традиционных нейролептиков при рано манифестирующей шизофрении; ограничение применения АНП (по аннотациям к препаратам); отсутствие доступной информации о современных исследованиях по использованию антипсихотиков; противоречивость данных об эффективности и безопасности ПФТ у детей (особенно при длительном применении); трудность в подборе адекватных дозировок и т.д. [3]. Что касается возрастных ограничений для нейролептической терапии, то здесь установки различных клинических школ колеблются от ее полного отрицания для детей (вплоть до подросткового возраста) до признания возможности ее применения даже с младенчества. В первую очередь это связано с биологическими особенностями детского организма. Так, печень у детей имеет большие размеры относительно массы тела по сравнению со взрослыми, что способствует более активному метаболическому функционированию и быстрой элиминации нейролептических препаратов. Кроме того, гораздо более высокий, чем у взрослых, клиренс (скорость выведения) снижает вероятность накопления лекарственных веществ и, соответственно, побочных действий и осложнений от их применения, в связи с чем дети лучше переносят относительно более высокие (в весовом эквиваленте) дозировки многих лекарств по сравнению со взрослыми. Установлено, что цикл развития и функционирования дофамина и норадреналина по сравнению с серотонином у детей происходит раньше, что имеет значение в особенностях реагирования на препараты [11, 17, 57].
Важно иметь в виду, что реакции детей на нейролептическую терапию гораздо более индивидуализированы, чем у взрослых, и, соответственно, подбор препаратов, их комбинаций и дозировок должен быть строго индивидуальным и как можно менее шаблонным. Границы возрастных дозировок антипсихотиков размыты, и подбор доз должен опираться в первую очередь на уровень индивидуальной переносимости и эффективности при строгом контроле соматовегетативного состояния ребенка. Помимо принципа максимально возможной индивидуализации, необходимо следовать принципу минимальной достаточности. Он заключается в том, что основная цель лечения состоит не в полном устранении психопатологической симптоматики, а в достижении адекватной адаптации ребенка в микросоциальной среде. В этой связи проблема переносимости антипсихотической терапии в детской психиатрической практике, особенно амбулаторной, чрезвычайно важна, поскольку зачастую с большим трудом преодолеваемая родительская оппозиция к лечению ребенка «химией» становится совершенно некорректируемой, если при отсутствии или недостаточности эффективности терапии на начальных этапах развиваются ПЭ, в частности НЭД. Таким образом, при нейролептической терапии у детей необходимо использовать препараты и дозировки, имеющие минимальный риск развития ПЭ, даже порой в ущерб собственно психотропному действию [11]. В этом отношении большой интерес представляют АНП, к которым относятся производные бензизоксазола: рисперидон (например, ридонекс); производные дибензодиазепина: клозапин (лепонекс); кветиапин (например, нантарид); оланзапин (например, парнасан) и ряд других препаратов.
Вместе с тем, если в общей психиатрической практике наряду с традиционными нейролептиками успешно применяются современные, малотоксичные, тонко психопатологически сфокусированные препараты, то в детской практике этот процесс весьма затруднителен. Большинство АНП официально разрешены к применению после 14–16 лет, а апробация перспективных препаратов сопряжена с массой правовых, организационных и методологических сложностей. Детские психиатры постоянно сталкиваются с дилеммой: лечить «по старинке» или, фактически преступая закон, назначать более целесообразное (безопасное) лечение [11].
В данной ситуации при объяснении выбора того или иного АНП психиатр может сослаться только на отсутствие в перечне их противопоказаний детского возраста или на результаты немногочисленных терапевтических исследований применения антипсихотиков у детей. Первые данные о применении рисперидона у детей относятся к 1995 г. Рисперидон применялся при шизофрении и других психических расстройствах, в том числе резистентных к предшествующему лечению традиционными нейролептиками. На 2004 г. количество детей, включенных в клинические исследования и описанных в клинических наблюдениях, составило не менее 1 тыс. человек; 280 детей были включены в 5 контролируемых исследований по эффективности и безопасности применения рисперидона. Из зарегистрированных в Medline 176 отчетов об использовании атипичных антипсихотиков у детей за 1974–2003 гг. 43% касаются применения этого препарата. Количество респондентов в исследованиях составило 50–92,8%; в контролируемых – 65–69%, в том числе в длительных (до 3 лет) исследованиях показана хорошая переносимость рисперидона. Опыт пролонгированного (более 7 лет) исследования терапии рисперидоном ранней шизофрении у детей, проведенного в НЦПЗ РАМН, показал, что препарат в дозе 1/10 от средней терапевтической дозы для взрослых (2 мг/сут) является высокоэффективным и безопасным [8]. Из наиболее часто упоминаемых НЭД следует отметить повышение аппетита и массы тела, которые нормализуются после прекращения приема препарата, а также гиперпролактинемию, сопровождающуюся галактореей с отсутствием корреляций между уровнем пролактина, дозой препарата, симптомами пролактинемии и результатом лечения. Эти данные свидетельствует о том, что на сегодняшний день рисперидон является самым изученным препаратом нового поколения в детской психиатрической практике и применение его в дозировке 2 мг/сут является эффективным и безопасным в плане развития НЭД [3].
Применение клозапина у детей ограниченно в первую очередь в связи с серьезностью риска развития гранулоцитопении (3%) и агранулоцитоза (0,7–1,3%). Также описаны случаи повышения уровня пролактина и повышения массы тела. Перед назначением клозапина необходимо исключить факторы риска развития сахарного диабета (неоднократные исследования уровня глюкозы и инсулина). По мнению ряда авторов, клозапин у детей показан только в случае наличия резистентности к терапии другими антипсихотиками и назначается в дозировках 6,25 мг/сут [3, 16, 18, 37].
Информация о применении оланзапина, кветиапина и арипипразола у детей на сегодняшний день недостаточна в связи с противоречивостью данных исследований по эффективности и переносимости препаратов. Вместе с тем отмечается, что основные проблемы при применении оланзапина (2,5–5 мг/сут) связаны с нарушением толерантности к глюкозе, повышением уровня пролактина и повышением массы тела. Терапия кветиапином (25–50 мг/сут) характеризуется меньшим спектром НЭД – отмечается лишь незначительное повышение массы тела, а применение арипипразола (3,5–10 мг/сут) сопровождается повышением аппетита [3, 16, 37, 43].
Подводя итоги, можно сформулировать основные принципы и подходы к проведению нейролептической терапии у больных детского возраста.
1. Обоснованность назначаемой терапии (взвешенная оценка эффективности и переносимости препарата).
2. Получение информированного согласия на проведение терапии у законных представителей ребенка.
3. Комплексное (психиатрическое и общемедицинское) заключение перед назначением терапии.
4. При равной эффективности и прямых показаниях – назначение препаратов с наилучшим профилем безопасности (переносимости).
5. Избегание полипрагмазии.
6. Постепенная титрация и расчет дозы на 1 кг массы тела ребенка.
7. Регулярные динамические исследования в процессе терапии с целью выявления и минимизации НЭД.
По данным отечественных и зарубежных исследований, подростковый и юношеский возраст является одним из так называемых кризовых периодов, психобиологические особенности которого необходимо учитывать при проведении нейролептической терапии. Именно в этом возрастном периоде наблюдаются процессы, охватывающие наиболее важные стороны нейробиологического и психического созревания организма [5, 33, 37]. В первую очередь это касается значительной перестройки эндокринной системы вплоть до «гормональной бури», затрагивающей как половую сферу, так и другие звенья, участвующие в процессах роста и обеспечения метаболических процессов. Происходят активное созревание головного мозга – дифференциация внутримозговых связей и становление некоторых функций ЦНС [32], а также морфоконституциональные изменения в различных органах и системах и др.
С психиатрической точки зрения важное значение имеют неустойчивость аффективной сферы с частыми периодами смены настроения; активная перестройка процессов мышления; поведенческие особенности, характеризующиеся стремлением к независимости, оппозиционности, склонностью к тотальной критике существующих догм и представлений, протестом против влияния со стороны микросоциума [5, 6]. Именно на этот возрастной период приходится пик манифестации шизофрении и шизоаффективного психоза. По данным Л.М.Шмаоновой и соавт. (1979 г.), до 42,6% приступообразных форм шизофрении манифестируют в этом возрастном периоде [6]. Установлено, что подростки с первым психотическим эпизодом (ППЭ) обнаруживают повышенную резистентность к антипсихотическому эффекту традиционных нейролептиков, и вместе с тем у них повышается риск развития различных, в частности нейроэндокринных, ПЭ [2]. Кроме того, следует отметить, что адекватная, своевременно начатая терапия ППЭ у подростков имеет ключевое значение для всего дальнейшего течения шизофренического процесса, его прогноза и исхода, а также предотвращает развитие труднокурабельных метаболических эндокринных расстройств и способствует сохранению фертильности.
Приоритетное применение нейролептических препаратов с высокой эффективностью и лучшей переносимостью является одним из принципов ПФТ у больных подросткового и юношеского возраста. Как было отмечено, биологические особенности этого возрастного периода обусловливают высокую степень риска развития НЭД по сравнению со зрелым возрастом. По некоторым данным [20, 24], переносимость нейролептической терапии значительно хуже у молодых пациентов. В связи с этим на современном этапе клинической ПФТ АНП рассматриваются как препараты 1-й линии при терапии манифестных психозов юношеского возраста [6]. Этому способствуют и значительно меньшие по сравнению с детским возрастом ограничения и противопоказания по применению современных антипсихотиков. Несмотря на то что указанные препараты обладают лучшей переносимостью по сравнению с традиционными нейролептиками, профиль их ПЭ характеризуется довольно значительной представленностью НЭД. В связи с этим разработанные нами профилактические, диагностические и коррекционные мероприятия в отношении НЭД для взрослых пациентов вполне обоснованно применимы и для подростков [4].
Основные принципы терапевтической стратегии у больных шизофренией подросткового и юношеского возраста, по мнению В.Г.Каледы и соавт. (2004, 2006 гг.), состоят в следующем:
1. Необходимость достижения терапевтического альянса между врачом, пациентом и родителями (адекватная комплаентность).
2. Своевременное назначение нейролептической терапии.
3. Приоритетное использование антипсихотиков с высокой эффективностью и низкой частотой развития ПЭ и осложнений.
4. Ориентация на длительную поддерживающую нейролептическую терапию.
5. Проведение комплексной терапии – сочетание ПФТ с реабилитационными мероприятиями.
С позиций психоэндокринолога эти принципы желательно пополнить обязательными динамическими биологическими (включающими биохимические, гормональные, антропометрические и физикальные) методами исследования как до ПФТ, так и в ее процессе.
По данным некоторых авторов [47, 52], в ближайшие 30 лет ожидается значительное увеличение числа лиц пожилого возраста (старше 65 лет), которое составит до 20–25% в популяции и будет сопровождаться диспропорциональным возрастанием числа пожилых пациентов с шизофренией. Из них меньшая часть (20–25%) – пациенты с поздно манифестирующей шизофренией (ПМШ), а значительно бóльшая часть – пациенты с рано манифестирующей шизофренией (РМШ), дожившие до пожилого возраста. ПМШ в настоящее время определяется началом (включая продромальные симптомы) после 40–45 лет, характеризуется клиническими проявлениями в виде бреда преследования и слуховыми галлюцинациями, менее выраженными негативными симптомами, доминированием среди женщин, лучшим преморбидным уровнем функционирования, меньшими нарушениями по параметрам обучения, абстрактного мышления и требующими меньших суточных доз антипсихотиков по сравнению с пациентами с РМШ. Заслуживает внимания и то обстоятельство, что существующее со времен Э.Крепелина традиционное мнение о том, что симптомы при РМШ прогрессируют с возрастом, в последнее время пересматривается. Результаты современных исследований показали, что при адекватной ПФТ существует определенная тенденция некоторого клинического улучшения с возрастом. В целом эти исследования указывают на значительную гетерогенность возможных исходов. Так, у 20% пациентов с РМШ наблюдается ремиссия или значительное улучшение с течением времени, в том же проценте случаев отмечается постепенное ухудшение состояния. У тех и других наблюдаются меньшее число и менее тяжелая позитивная симптоматика по сравнению с молодыми пациентами на фоне персистирующих негативных проявлений. В отличие от ПМШ отмечается преобладание лиц мужского пола [47].
Антипсихотики считаются наиболее эффективными препаратами для лечения шизофрении на протяжении жизни, в том числе и в позднем возрасте. В то же время следует отметить, что до сих пор число публикаций, касающихся различных аспектов нейролептической терапии поздней шизофрении, весьма ограниченно (23 проспективных исследования, включая 8 двойных слепых контролируемых). Более того, большинство доступных исследований характеризуется малым размером выборок (40 пациентов в 52% исследований), отсутствием обсуждения необоснованной полипрагмазии и вопросов, связанных с «непреднамеренными» нарушениями приема препаратов [19, 23, 25, 30, 38].
Лекарственная терапия у больных шизофренией позднего возраста требует учета особенностей фармакодинамики и фармакокинетики, связанных с изменениями распределения, метаболизма и экскреции препаратов. Эти изменения в особенности касаются антипсихотиков, поскольку большинство из них жирорастворимы и связаны с белками. Общеизвестно, что процесс старения связан с уменьшением общего количества воды и мышечной массы и увеличением количества жировой ткани. В этой ситуации наблюдается увеличение объема распределения и периода полураспада нейролептика. К тому же, с возрастом печень синтезирует меньше протеинов плазмы, что приводит к эффекту увеличения «свободной фракции» (фармакологически активной, несвязанной части) антипсихотика. Связанное с возрастом снижение почечного клиренса вносит дополнительный вклад в аккумулирование препаратов и их активных метаболитов. Фармакодинамические изменения, ассоциированные со старением, увеличивают чувствительность пожилых пациентов к данному уровню нейролептика в плазме. Кроме того, дегенерация дофаминергических и холинергических нейронов может увеличивать риск развития ПЭ. Нельзя исключить, что эффективность и переносимость нейролептической терапии у лиц пожилого возраста связаны с влиянием сопутствующих (коморбидных) соматических заболеваний, полипрагмазией, нарушениями приверженности терапии в связи со слуховыми и когнитивными нарушениями («непреднамеренные» нарушения в виде приема неправильной дозы, нарушения схемы приема и др.). Общее влияние этих факторов приводит к значительному повышению чувствительности, в частности переносимости пожилых пациентов к нейролептической терапии [4]. Исследования, касающиеся применения традиционных нейролептических препаратов у лиц пожилого возраста, подтверждают эффективность этих препаратов и в то же время указывают на значительно более плохую их переносимость у указанного контингента больных. В этой связи более современные АНП довольно быстро стали препаратами выбора для пожилых пациентов с шизофренией, обладая эффективностью, сравнимой с традиционными нейролептиками, и более благоприятным спектром переносимости в сопоставимых дозах. Антипсихотики группы рисперидона (в частности, ридонекс) считаются наиболее широко применяемыми у пожилых больных, обладая минимальным риском развития НЭД, особенно нейролептической гиперпролактинемии (НГП). Приводятся данные о том, что повышение массы тела у больных пожилого возраста с дефицитом массы тела и плохим питанием при терапии оланзапином (в 14–16% случаев) является, с одной стороны, ПЭ, а с другой – может быть «полезным» у данной категории пациентов. Прием зипразидона характеризуется минимальной прибавкой массы тела и невыраженной НГП [7]. Данных о развитии НЭД при приеме клозапина, кветиапина и арипипразола у пожилых больных шизофренией в доступной литературе обнаружить не удалось [42].
Исследования, касающиеся применения традиционных нейролептических препаратов у лиц пожилого возраста, подтверждают эффективность этих препаратов и в то же время указывают на значительно более плохую их переносимость у указанного контингента больных. В этой связи более современные АНП довольно быстро стали препаратами выбора для пожилых пациентов с шизофренией, обладая эффективностью, сравнимой с традиционными нейролептиками, и более благоприятным спектром переносимости в сопоставимых дозах. Антипсихотики группы рисперидона (в частности, ридонекс) считаются наиболее широко применяемыми у пожилых больных, обладая минимальным риском развития НЭД, особенно нейролептической гиперпролактинемии (НГП). Приводятся данные о том, что повышение массы тела у больных пожилого возраста с дефицитом массы тела и плохим питанием при терапии оланзапином (в 14–16% случаев) является, с одной стороны, ПЭ, а с другой – может быть «полезным» у данной категории пациентов. Прием зипразидона характеризуется минимальной прибавкой массы тела и невыраженной НГП [7]. Данных о развитии НЭД при приеме клозапина, кветиапина и арипипразола у пожилых больных шизофренией в доступной литературе обнаружить не удалось [42].
На основании анализа научной литературы [25, 38, 42, 47, 50] можно сформулировать основные рекомендации по применению нейролептических препаратов у лиц пожилого возраста: подтверждение диагноза шизофрении (дифференциальная диагностика с психозами иной природы); тщательный сбор анамнеза (употребление ПАВ, предшествующая ПФТ, коморбидная соматическая патология и др.); диагностические исследования (биохимические, физикальные, инструментальные и т.д.); назначение АНП (кроме клозапина) в малых дозах (начальная доза должна составлять 25–50% от начальной дозы у взрослых) с постепенной их титрацией; пациенты с ПМШ нуждаются в более низких дозах по сравнению с РМШ; избегание полипрагмазии; обязательное сочетание ПФТ с психосоциальными вмешательствами.
Роль гендерного фактора в переносимости нейролептической терапии
Свидетельства о половых различиях при шизофрении отражают разницу у мужчин и женщин процессов нейрогенеза (структурные и функциональные особенности ЦНС, включающие нейроэндокринные и циркадианные параметры), генетической структуры, гормонального статуса и социальных факторов риска возникновения и течения заболевания [1, 4, 13]. Риск развития шизофрении «мужчины/женщины» находится в соотношении 1,4:1, и для женщин преобладающим является более поздний возраст начала заболевания. Следует сказать, что результаты исследований половых различий морфологии мозга противоречивы, но вместе с тем имеются данные о том, что гендерные различия определенных областей мозга характерны как для нормы, так и для патологии. Это позволяет предположить, что одни и те же факторы являются важными как обусловливающие половые различия и при нормальных процессах нейрогенеза, и у больных шизофренией [13, 36, 39]. По мнению J.Salem и соавт. (1998 г.), в понимании гендерных различий при шизофрении может иметь значение рассмотрение и дальнейшие исследования гипотезы о том, что мужчины более склонны к предположительно плохо прогнозируемому нейрогенетическому подтипу шизофрении, а женщины – к генетически «хорошему прогнозу» и «аффективному подтипу шизофрении», генетически имеющему отношение к аффективным расстройствам. Рассматривая гендерные различия в функционировании гипоталамо-гипофизарно-гонадной оси, следует указать на большую «уязвимость» этой сферы у женщин (больший риск развития НГП), с одной стороны, и определенную «эстрогенпротективность», объясняющую, в частности, более поздний дебют шизофрении у женщин в подростковом возрасте и увеличение заболеваемости в климактерическом периоде. Кроме того, имеются существенные половые различия как в структуре психических расстройств, так и в различных сферах социального функционирования [36, 51].
По мнению U.Groleger и соавт. (2010 г.), не существует конкретных рекомендаций или схем терапии, предполагающих роль гендерных различий как основного фактора в выборе того или иного антипсихотика, которая подходила бы для всех терапевтических модальностей (антипсихотик, доза, длительность приема и др.). Исследования специфичности по полу в отношении ПЭ антипсихотиков, проведенные посредством систематического просмотра данных PubMed с использованием ключевых слов (гендер, нейролептики, ПЭ), не обнаружили ссылок, конкретно описывающих данные исследования. В большинстве работ пол ассоциировался с такими факторами, как возраст, другие болезни, прибавка массы тела [28].
В незначительном количестве работ приводились единичные указания на связанные с гендерным фактором различия в ПЭ нейролептиков, такие как прибавка массы тела, метаболический синдром и сексуальные дисфункции. Вместе с тем указывается, что женщины отличаются от мужчин не только по распространенности, но и по проявлению клинических симптомов, связанных с ПЭ антипсихотиков [4, 26, 27].
В обзоре W.Aichhorn и соавт. (2006 г.) приводятся данные по исследованию гендерных фармакокинетических различий и нежелательных эффектов при применении 6 антипсихотиков 2-го поколения (АВП): арипипразол, клозапин, оланзапин, кветиапин, рисперидон и зипразидон. Связанные с полом различия продемонстрированы в фармакокинезе cytochrome P-450 (CYP) с наиболее высокой активностью у женщин для CYP3A4 и CYP2D6. Тем не менее, если даже и существуют фармакокинетические различия между мужчинами и женщинами, значимо более высокое содержание в плазме у женщин обнаружено только в отношении оланзапина и клозапина. На сегодняшний день различия по полу негативных эффектов недостаточно хорошо изучены, но такие эффекты, как прибавка массы тела, гиперпролактинемия и кардиологические проблемы отмечены как свойственные в основном женщинам. Большинство рассмотренных исследований демонстрируют, что клозапин и оланзапин ассоциируются с большей прибавкой массы тела, чем другие атипичные антипсихотики, и такие выраженные ПЭ, как метаболический синдром, включающий в себя «внутреннее ожирение» (increased visceral adiposity), гипергликемию, гипертензию и дислипидемию, вызванные АВП, наиболее часто встречаются у женщин. Кроме того, есть ряд свидетельств о том, что сексуальная дисфункция у женщин связана с высокими уровнями пролактина; в то же время период, когда степень повышения уровня пролактина у мужчин и женщин начинает различаться, остается неясным. Знания о рисках и выгодах, связанных с использованием АВП во время беременности и лактации, остаются ограниченными, хотя и подбор доз во время беременности зависит от препарата и состояния метаболизма и энзимов, ответственных за этот метаболизм. По данным ранее опубликованных нами исследований, при купирующей и длительной антипсихотической терапии у больных женского пола достоверно чаще, чем у мужчин, развивается синдром НГП и гиперпролактинемия достигает более высоких показателей [4]. В целом следует подчеркнуть, что данные о наличии полового диморфизма были большей частью получены post hoc (от лат. – «после этого, но не вследствие этого») и, стало быть, выводы остаются достаточно поверхностными и умозрительными, а значит, ограниченными. Для лучшего понимания основополагающих механизмов половых различий необходимы дальнейшие исследования, изначально направленные на биологическую основу этой проблемы. Более тщательные, методически продуманные направления новых исследований призваны помочь определить рамки области, в пределах которой эти различия будут также определять менеджмент клинических мероприятий.
Таким образом, приведенные данные о роли возрастных и гендерных факторов в переносимости антипсихотических препаратов свидетельствуют о необходимости учета этих параметров при проведении нейролептической терапии. Следует также подчеркнуть, что проблема переносимости в настоящее время более актуальна и значима по сравнению с эффективностью антипсихотиков, поскольку именно непереносимость или плохая переносимость являются одной из наиболее частых причин несоблюдения режима терапии вплоть до полного отказа от нее. Все это, безусловно, требует дальнейших всесторонних исследований указанной проблемы с целью уточнения участия возрастных и гендерных факторов в патобиологических механизмах шизофрении и разработке клинических, диагностических и терапевтических показаний к назначению нейролептической терапии с учетом указанных параметров.
Сведения об авторе
Горобец Людмила Николаевна – д-р мед. наук, проф., руководитель отд-ния психиатрической эндокринологии ФГБУ МНИИП Минздравсоцразвития РФ. E-mail: gorobetsln@mail.ru
Ключевые слова: шизофрения, нейролептики, возраст, гендер, нейроэндокринные дисфункции.
Endocrinological aspects of neuroleptic therapy tolerance in patients with schizophrenia (age and gender factors)
L.N.Gorobets
Moscow Research Institute of Psychiatry, Ministry of Health and Social Development of Russia, Moscow
Summary. This review deals with one of the topical issues of psychopharmacology, namely tolerance to neuroleptic therapy with regard to age and gender factors. Childhood, adolescence, and elderly age are shown to be mainly vulnerable in developing a number of neuroendocrine dysfunctions (NED). The role of a gender factor in developing NED is also indicated. The basic principles and approaches to the use and performance of neuroleptic therapy are given in terms of the above factors.
Key words: schizophrenia, neuroleptics, age, gender, neuroendocrine dysfunctions.
Антипсихотические препараты, или нейролептики составляют одну из главных групп психофармакотерапевтических (ПФТ) средств и занимают центральное место в современной психиатрической практике [7]. Следует отметить, что основное внимание исследователей и практических врачей долгое время было направлено в основном на изучение эффективности применяемых нейролептических средств в отношении психопатологической симптоматики. Так, при купирующей ПФТ учитывалась симптомоспецифичность нейролептика (влияние на галлюцинаторно-бредовую симптоматику, возбуждение, антидепрессивное действие и т.д.). При длительной противорецидивной терапии одной из основных оценок эффективности являлось отсутствие рецидивов психического заболевания. Значительно меньше внимания уделялось изучению переносимости антипсихотиков – побочным эффектам (ПЭ) и осложнениям (экстрапирамидным двигательным расстройствам, нейроэндокринным дисфункциям – НЭД, токсическому эффекту и др.). В последние десятилетия в связи с современными требованиями к проведению ПФТ, а также с появлением антипсихотиков нового поколения (АНП) изменились основные параметры оценки оптимального результата лечения, среди которых наряду с эффективностью все большее значение приобретают параметры переносимости [1, 4, 7].
Профиль переносимости (возможные ПЭ) оригинальных АНП, к которым относятся рисперидон, оланзапин, кветиапин, зипразидон, сертиндол и арипипразол, к настоящему моменту исследован достаточно широко [4, 7, 14, 22, 27]. Вместе с тем обращает на себя внимание все более широкое использование в российской психиатрической практике генериков АНП, в частности ридонекса (рисперидон) и нантарида (кветиапин), выпускаемых компанией «Гедеон Рихтер» (Венгрия). Применение препаратов-генериков позволяет решить одну из важных проблем – фармакоэкономическую, т.е. снизить стоимость лечения как для лечебных учреждений, так и для больного, особенно в случае необходимости длительной поддерживающей ПФТ. В то же время введение указанных препаратов в терапевтическую практику диктует необходимость проведения исследований, направленных на оценку показателей эффективности и профиля безопасности этих лекарственных средств. В двух российских исследованиях по изучению ридонекса (4–8 мг/сут) была показана высокая эффективность и вполне допустимая переносимость и безопасность препарата [9, 12]. Так, в 13,3% случаев у мужчин отмечались нарушения сексуальной сферы; увеличение массы тела за 12 нед исследования составила 1,15±0,79 кг, что позволяет оценивать выраженность данного эффекта как незначительную [12].
 Необходимо подчеркнуть, что исследование и решение проблемы переносимости (ПЭ в целом и НЭД в частности) антипсихотиков является одной из важных составляющих на современном этапе разработки оптимизации терапии у психически больных.
Необходимо подчеркнуть, что исследование и решение проблемы переносимости (ПЭ в целом и НЭД в частности) антипсихотиков является одной из важных составляющих на современном этапе разработки оптимизации терапии у психически больных.
Проблемы, связанные с лекарствами (drug-related problem), – это явления и обстоятельства, имеющие отношение к лекарственной терапии, которые не позволяют достичь оптимального результата лечения или способны помешать его достижению [1]. В первую очередь это касается ПЭ препаратов. В этом отношении нейролептики занимают одно из первых мест среди лекарственных средств по частоте формирования ПЭ и осложнений, которая, по данным разных авторов, составляет от 2 до 100% случаев у госпитализированных и амбулаторных пациентов [4, 7, 31]. Одним из объяснений этому факту является высокая чувствительность центральной нервной системы (ЦНС) и эндокринной системы к любому (в данном случае к нейролептическому препарату) биологическому воздействию.
Анализ научной литературы показал, что, несмотря на значимость проблемы переносимости ПФТ, количество соответствующих исследований недостаточно. Кроме того, в связи с отсутствием валидных методологических подходов к изучению ПЭ и унифицированной оценки нежелательных явлений нейролептической терапии данные, касающиеся этой проблемы, приводимые разными авторами, неоднозначны, а часто и прямо противоречивы [4, 7, 33–35, 41, 54, 56].

На основании экспериментальных, биологических и эпидемиологических исследований были выделены 2 группы факторов, влияющих на переносимость нейролептических препаратов. По мнению ряда авторов, к 1-й (основной) группе относятся факторы, связанные с применяемым антипсихотиком: особенности фармакодинамики (спектр рецепторной предпочтительности); широта терапевтического действия (диапазон между терапевтической и токсической дозами); фармакодинамические показатели; дозозависимость ПЭ; полипрагмазия, наличие ПЭ при предшествующей терапии и т.д. Ко 2-й не менее важной группе принадлежат факторы, относящиеся к пациенту: возрастные, гендерные, метаболические, элиминационные, энзимные, аллергические, иммунологические, морфофункциональные (включая антропометрические), коморбидные соматические заболевания, информационные и др. [4, 7, 15, 39, 44, 49, 55].
Расхождения в оценке частоты ПЭ и осложнений нейролептической терапии (каждого конкретного препарата), входящих в дефиницию переносимости, могут быть связаны со следующими обстоятельствами.
1. Большое значение имеет степень информированности больного (и, соответственно, предъявляемые жалобы) о возможных нежелательных эффектах нейролептиков (сведения, получаемые от врача, окружающих родственников и больных, а также содержащиеся во вкладыше к препарату).
2. Различные виды проводимых исследований. Так, в рандомизированных контролируемых исследованиях проводится вычленение собственно ПЭ нейролептика, тогда как в обсервационных – учет всех нежелательных явлений без учета того, является ли это ПЭ препарата. Необходимо отметить, что оценка нежелательного явления как ПЭ конкретного препарата весьма затруднительна.
К примеру, наличие нарушений менструального цикла или сексуальных дисфункций у больных при терапии исследуемым нейролептиком может быть связано с влиянием самого психического заболевания, коморбидными расстройствами или предшествующей ПФТ, а не с пролактогенным действием препарата [1, 4, 7]. 3. Различная длительность исследования (купирующая или длительная противорецидивная терапия). Ранее опубликованные нами данные [4] показали, что частота формирования НЭД значительно различается в зависимости от длительности проводимой терапии и препарата, что согласуется с большинством зарубежных исследований [14, 20–22, 24].
4. Необходимость объективизации наличия НЭД путем активного их выявления психиатром, а не только учет спонтанных жалоб, который довольно часто связан с субъективной значимостью НЭД для пациента.
5. Отсутствие достаточных и доступных в повседневной практике методов обследования для выявления НЭД (невозможность проведения гормональных, биохимических исследований и т.д.).
Таким образом, при анализе переносимости (НЭД) нейролептиков необходимо учитывать комплекс параметров, представленных в табл. 1.
В данной работе мы остановимся на двух важных факторах, относящихся к пациенту и влияющих на развитие НЭД, – возрастном и гендерном.
Возрастной фактор в развитии НЭД
Как было отмечено, возрастной фактор имеет большое значение в развитии НЭД при нейролептической терапии. В этой связи особое внимание уделяется наиболее «уязвимым» возрастным периодам – детскому, подростковому, юношескому, а также лицам пожилого возраста [4, 35, 45]. Основные возрастные параметры индивидуального развития представлены в табл. 2.
Кроме указанных в табл. 2 возрастных периодов, необходимо учитывать так называемые возрастные кризы, к которым относятся пубертатный (12–15 лет) и климактерический (45–55 лет у женщин и 50–60 лет у мужчин). Первый характеризуется «гормональной бурей», которая сопровождается непоседливостью, беспокойством, непослушанием, раздражительностью, упрямством, сменяющимися к 16 годам «фазой успокоения», выравниванием поведения и взаимоотношений с окружающими. Как правило, именно это время начала развития различных видов психических расстройств. Климактерический криз характеризуется эмоциональными и аффективными расстройствами на фоне изменений функционирования (обратного развития) эндокринной системы и присоединением коморбидных соматических заболеваний [10, 56].
Особенности нейролептической терапии у больных детского возраста
Несмотря на то что нейролептики относительно недавно нашли свое применение в детской психиатрической практике, в настоящее время от 40 до 60% детей, обращающихся за помощью к психиатру, получают нейролептическую терапию. Значительные трудности при выборе способа терапевтического вмешательства связаны с противоречивостью данных о безопасности применения нейролептиков у детей, и перед психиатром в этом случае всегда встает вопрос о соотношении «пользы и вреда» для пациента [10, 11, 16].
Актуальность проблемы безопасности (переносимости) ПФТ в детском возрасте имеет свои специфические аспекты, связанные как с особенностями протекания психических расстройств в данной возрастной группе, так и с нерешенностью целого ряда вопросов, к которым относятся: малая эффективность традиционных нейролептиков при рано манифестирующей шизофрении; ограничение применения АНП (по аннотациям к препаратам); отсутствие доступной информации о современных исследованиях по использованию антипсихотиков; противоречивость данных об эффективности и безопасности ПФТ у детей (особенно при длительном применении); трудность в подборе адекватных дозировок и т.д. [3]. Что касается возрастных ограничений для нейролептической терапии, то здесь установки различных клинических школ колеблются от ее полного отрицания для детей (вплоть до подросткового возраста) до признания возможности ее применения даже с младенчества. В первую очередь это связано с биологическими особенностями детского организма. Так, печень у детей имеет большие размеры относительно массы тела по сравнению со взрослыми, что способствует более активному метаболическому функционированию и быстрой элиминации нейролептических препаратов. Кроме того, гораздо более высокий, чем у взрослых, клиренс (скорость выведения) снижает вероятность накопления лекарственных веществ и, соответственно, побочных действий и осложнений от их применения, в связи с чем дети лучше переносят относительно более высокие (в весовом эквиваленте) дозировки многих лекарств по сравнению со взрослыми. Установлено, что цикл развития и функционирования дофамина и норадреналина по сравнению с серотонином у детей происходит раньше, что имеет значение в особенностях реагирования на препараты [11, 17, 57].
Важно иметь в виду, что реакции детей на нейролептическую терапию гораздо более индивидуализированы, чем у взрослых, и, соответственно, подбор препаратов, их комбинаций и дозировок должен быть строго индивидуальным и как можно менее шаблонным. Границы возрастных дозировок антипсихотиков размыты, и подбор доз должен опираться в первую очередь на уровень индивидуальной переносимости и эффективности при строгом контроле соматовегетативного состояния ребенка. Помимо принципа максимально возможной индивидуализации, необходимо следовать принципу минимальной достаточности. Он заключается в том, что основная цель лечения состоит не в полном устранении психопатологической симптоматики, а в достижении адекватной адаптации ребенка в микросоциальной среде. В этой связи проблема переносимости антипсихотической терапии в детской психиатрической практике, особенно амбулаторной, чрезвычайно важна, поскольку зачастую с большим трудом преодолеваемая родительская оппозиция к лечению ребенка «химией» становится совершенно некорректируемой, если при отсутствии или недостаточности эффективности терапии на начальных этапах развиваются ПЭ, в частности НЭД. Таким образом, при нейролептической терапии у детей необходимо использовать препараты и дозировки, имеющие минимальный риск развития ПЭ, даже порой в ущерб собственно психотропному действию [11]. В этом отношении большой интерес представляют АНП, к которым относятся производные бензизоксазола: рисперидон (например, ридонекс); производные дибензодиазепина: клозапин (лепонекс); кветиапин (например, нантарид); оланзапин (например, парнасан) и ряд других препаратов.
Вместе с тем, если в общей психиатрической практике наряду с традиционными нейролептиками успешно применяются современные, малотоксичные, тонко психопатологически сфокусированные препараты, то в детской практике этот процесс весьма затруднителен. Большинство АНП официально разрешены к применению после 14–16 лет, а апробация перспективных препаратов сопряжена с массой правовых, организационных и методологических сложностей. Детские психиатры постоянно сталкиваются с дилеммой: лечить «по старинке» или, фактически преступая закон, назначать более целесообразное (безопасное) лечение [11].
В данной ситуации при объяснении выбора того или иного АНП психиатр может сослаться только на отсутствие в перечне их противопоказаний детского возраста или на результаты немногочисленных терапевтических исследований применения антипсихотиков у детей. Первые данные о применении рисперидона у детей относятся к 1995 г. Рисперидон применялся при шизофрении и других психических расстройствах, в том числе резистентных к предшествующему лечению традиционными нейролептиками. На 2004 г. количество детей, включенных в клинические исследования и описанных в клинических наблюдениях, составило не менее 1 тыс. человек; 280 детей были включены в 5 контролируемых исследований по эффективности и безопасности применения рисперидона. Из зарегистрированных в Medline 176 отчетов об использовании атипичных антипсихотиков у детей за 1974–2003 гг. 43% касаются применения этого препарата. Количество респондентов в исследованиях составило 50–92,8%; в контролируемых – 65–69%, в том числе в длительных (до 3 лет) исследованиях показана хорошая переносимость рисперидона. Опыт пролонгированного (более 7 лет) исследования терапии рисперидоном ранней шизофрении у детей, проведенного в НЦПЗ РАМН, показал, что препарат в дозе 1/10 от средней терапевтической дозы для взрослых (2 мг/сут) является высокоэффективным и безопасным [8]. Из наиболее часто упоминаемых НЭД следует отметить повышение аппетита и массы тела, которые нормализуются после прекращения приема препарата, а также гиперпролактинемию, сопровождающуюся галактореей с отсутствием корреляций между уровнем пролактина, дозой препарата, симптомами пролактинемии и результатом лечения. Эти данные свидетельствует о том, что на сегодняшний день рисперидон является самым изученным препаратом нового поколения в детской психиатрической практике и применение его в дозировке 2 мг/сут является эффективным и безопасным в плане развития НЭД [3].
Применение клозапина у детей ограниченно в первую очередь в связи с серьезностью риска развития гранулоцитопении (3%) и агранулоцитоза (0,7–1,3%). Также описаны случаи повышения уровня пролактина и повышения массы тела. Перед назначением клозапина необходимо исключить факторы риска развития сахарного диабета (неоднократные исследования уровня глюкозы и инсулина). По мнению ряда авторов, клозапин у детей показан только в случае наличия резистентности к терапии другими антипсихотиками и назначается в дозировках 6,25 мг/сут [3, 16, 18, 37].
Информация о применении оланзапина, кветиапина и арипипразола у детей на сегодняшний день недостаточна в связи с противоречивостью данных исследований по эффективности и переносимости препаратов. Вместе с тем отмечается, что основные проблемы при применении оланзапина (2,5–5 мг/сут) связаны с нарушением толерантности к глюкозе, повышением уровня пролактина и повышением массы тела. Терапия кветиапином (25–50 мг/сут) характеризуется меньшим спектром НЭД – отмечается лишь незначительное повышение массы тела, а применение арипипразола (3,5–10 мг/сут) сопровождается повышением аппетита [3, 16, 37, 43].
Подводя итоги, можно сформулировать основные принципы и подходы к проведению нейролептической терапии у больных детского возраста.
1. Обоснованность назначаемой терапии (взвешенная оценка эффективности и переносимости препарата).
2. Получение информированного согласия на проведение терапии у законных представителей ребенка.
3. Комплексное (психиатрическое и общемедицинское) заключение перед назначением терапии.
4. При равной эффективности и прямых показаниях – назначение препаратов с наилучшим профилем безопасности (переносимости).
5. Избегание полипрагмазии.
6. Постепенная титрация и расчет дозы на 1 кг массы тела ребенка.
7. Регулярные динамические исследования в процессе терапии с целью выявления и минимизации НЭД.
По данным отечественных и зарубежных исследований, подростковый и юношеский возраст является одним из так называемых кризовых периодов, психобиологические особенности которого необходимо учитывать при проведении нейролептической терапии. Именно в этом возрастном периоде наблюдаются процессы, охватывающие наиболее важные стороны нейробиологического и психического созревания организма [5, 33, 37]. В первую очередь это касается значительной перестройки эндокринной системы вплоть до «гормональной бури», затрагивающей как половую сферу, так и другие звенья, участвующие в процессах роста и обеспечения метаболических процессов. Происходят активное созревание головного мозга – дифференциация внутримозговых связей и становление некоторых функций ЦНС [32], а также морфоконституциональные изменения в различных органах и системах и др.
С психиатрической точки зрения важное значение имеют неустойчивость аффективной сферы с частыми периодами смены настроения; активная перестройка процессов мышления; поведенческие особенности, характеризующиеся стремлением к независимости, оппозиционности, склонностью к тотальной критике существующих догм и представлений, протестом против влияния со стороны микросоциума [5, 6]. Именно на этот возрастной период приходится пик манифестации шизофрении и шизоаффективного психоза. По данным Л.М.Шмаоновой и соавт. (1979 г.), до 42,6% приступообразных форм шизофрении манифестируют в этом возрастном периоде [6]. Установлено, что подростки с первым психотическим эпизодом (ППЭ) обнаруживают повышенную резистентность к антипсихотическому эффекту традиционных нейролептиков, и вместе с тем у них повышается риск развития различных, в частности нейроэндокринных, ПЭ [2]. Кроме того, следует отметить, что адекватная, своевременно начатая терапия ППЭ у подростков имеет ключевое значение для всего дальнейшего течения шизофренического процесса, его прогноза и исхода, а также предотвращает развитие труднокурабельных метаболических эндокринных расстройств и способствует сохранению фертильности.
Приоритетное применение нейролептических препаратов с высокой эффективностью и лучшей переносимостью является одним из принципов ПФТ у больных подросткового и юношеского возраста. Как было отмечено, биологические особенности этого возрастного периода обусловливают высокую степень риска развития НЭД по сравнению со зрелым возрастом. По некоторым данным [20, 24], переносимость нейролептической терапии значительно хуже у молодых пациентов. В связи с этим на современном этапе клинической ПФТ АНП рассматриваются как препараты 1-й линии при терапии манифестных психозов юношеского возраста [6]. Этому способствуют и значительно меньшие по сравнению с детским возрастом ограничения и противопоказания по применению современных антипсихотиков. Несмотря на то что указанные препараты обладают лучшей переносимостью по сравнению с традиционными нейролептиками, профиль их ПЭ характеризуется довольно значительной представленностью НЭД. В связи с этим разработанные нами профилактические, диагностические и коррекционные мероприятия в отношении НЭД для взрослых пациентов вполне обоснованно применимы и для подростков [4].
Основные принципы терапевтической стратегии у больных шизофренией подросткового и юношеского возраста, по мнению В.Г.Каледы и соавт. (2004, 2006 гг.), состоят в следующем:
1. Необходимость достижения терапевтического альянса между врачом, пациентом и родителями (адекватная комплаентность).
2. Своевременное назначение нейролептической терапии.
3. Приоритетное использование антипсихотиков с высокой эффективностью и низкой частотой развития ПЭ и осложнений.
4. Ориентация на длительную поддерживающую нейролептическую терапию.
5. Проведение комплексной терапии – сочетание ПФТ с реабилитационными мероприятиями.
С позиций психоэндокринолога эти принципы желательно пополнить обязательными динамическими биологическими (включающими биохимические, гормональные, антропометрические и физикальные) методами исследования как до ПФТ, так и в ее процессе.
По данным некоторых авторов [47, 52], в ближайшие 30 лет ожидается значительное увеличение числа лиц пожилого возраста (старше 65 лет), которое составит до 20–25% в популяции и будет сопровождаться диспропорциональным возрастанием числа пожилых пациентов с шизофренией. Из них меньшая часть (20–25%) – пациенты с поздно манифестирующей шизофренией (ПМШ), а значительно бóльшая часть – пациенты с рано манифестирующей шизофренией (РМШ), дожившие до пожилого возраста. ПМШ в настоящее время определяется началом (включая продромальные симптомы) после 40–45 лет, характеризуется клиническими проявлениями в виде бреда преследования и слуховыми галлюцинациями, менее выраженными негативными симптомами, доминированием среди женщин, лучшим преморбидным уровнем функционирования, меньшими нарушениями по параметрам обучения, абстрактного мышления и требующими меньших суточных доз антипсихотиков по сравнению с пациентами с РМШ. Заслуживает внимания и то обстоятельство, что существующее со времен Э.Крепелина традиционное мнение о том, что симптомы при РМШ прогрессируют с возрастом, в последнее время пересматривается. Результаты современных исследований показали, что при адекватной ПФТ существует определенная тенденция некоторого клинического улучшения с возрастом. В целом эти исследования указывают на значительную гетерогенность возможных исходов. Так, у 20% пациентов с РМШ наблюдается ремиссия или значительное улучшение с течением времени, в том же проценте случаев отмечается постепенное ухудшение состояния. У тех и других наблюдаются меньшее число и менее тяжелая позитивная симптоматика по сравнению с молодыми пациентами на фоне персистирующих негативных проявлений. В отличие от ПМШ отмечается преобладание лиц мужского пола [47].
Антипсихотики считаются наиболее эффективными препаратами для лечения шизофрении на протяжении жизни, в том числе и в позднем возрасте. В то же время следует отметить, что до сих пор число публикаций, касающихся различных аспектов нейролептической терапии поздней шизофрении, весьма ограниченно (23 проспективных исследования, включая 8 двойных слепых контролируемых). Более того, большинство доступных исследований характеризуется малым размером выборок (40 пациентов в 52% исследований), отсутствием обсуждения необоснованной полипрагмазии и вопросов, связанных с «непреднамеренными» нарушениями приема препаратов [19, 23, 25, 30, 38].
Лекарственная терапия у больных шизофренией позднего возраста требует учета особенностей фармакодинамики и фармакокинетики, связанных с изменениями распределения, метаболизма и экскреции препаратов. Эти изменения в особенности касаются антипсихотиков, поскольку большинство из них жирорастворимы и связаны с белками. Общеизвестно, что процесс старения связан с уменьшением общего количества воды и мышечной массы и увеличением количества жировой ткани. В этой ситуации наблюдается увеличение объема распределения и периода полураспада нейролептика. К тому же, с возрастом печень синтезирует меньше протеинов плазмы, что приводит к эффекту увеличения «свободной фракции» (фармакологически активной, несвязанной части) антипсихотика. Связанное с возрастом снижение почечного клиренса вносит дополнительный вклад в аккумулирование препаратов и их активных метаболитов. Фармакодинамические изменения, ассоциированные со старением, увеличивают чувствительность пожилых пациентов к данному уровню нейролептика в плазме. Кроме того, дегенерация дофаминергических и холинергических нейронов может увеличивать риск развития ПЭ. Нельзя исключить, что эффективность и переносимость нейролептической терапии у лиц пожилого возраста связаны с влиянием сопутствующих (коморбидных) соматических заболеваний, полипрагмазией, нарушениями приверженности терапии в связи со слуховыми и когнитивными нарушениями («непреднамеренные» нарушения в виде приема неправильной дозы, нарушения схемы приема и др.). Общее влияние этих факторов приводит к значительному повышению чувствительности, в частности переносимости пожилых пациентов к нейролептической терапии [4].
 Исследования, касающиеся применения традиционных нейролептических препаратов у лиц пожилого возраста, подтверждают эффективность этих препаратов и в то же время указывают на значительно более плохую их переносимость у указанного контингента больных. В этой связи более современные АНП довольно быстро стали препаратами выбора для пожилых пациентов с шизофренией, обладая эффективностью, сравнимой с традиционными нейролептиками, и более благоприятным спектром переносимости в сопоставимых дозах. Антипсихотики группы рисперидона (в частности, ридонекс) считаются наиболее широко применяемыми у пожилых больных, обладая минимальным риском развития НЭД, особенно нейролептической гиперпролактинемии (НГП). Приводятся данные о том, что повышение массы тела у больных пожилого возраста с дефицитом массы тела и плохим питанием при терапии оланзапином (в 14–16% случаев) является, с одной стороны, ПЭ, а с другой – может быть «полезным» у данной категории пациентов. Прием зипразидона характеризуется минимальной прибавкой массы тела и невыраженной НГП [7]. Данных о развитии НЭД при приеме клозапина, кветиапина и арипипразола у пожилых больных шизофренией в доступной литературе обнаружить не удалось [42].
Исследования, касающиеся применения традиционных нейролептических препаратов у лиц пожилого возраста, подтверждают эффективность этих препаратов и в то же время указывают на значительно более плохую их переносимость у указанного контингента больных. В этой связи более современные АНП довольно быстро стали препаратами выбора для пожилых пациентов с шизофренией, обладая эффективностью, сравнимой с традиционными нейролептиками, и более благоприятным спектром переносимости в сопоставимых дозах. Антипсихотики группы рисперидона (в частности, ридонекс) считаются наиболее широко применяемыми у пожилых больных, обладая минимальным риском развития НЭД, особенно нейролептической гиперпролактинемии (НГП). Приводятся данные о том, что повышение массы тела у больных пожилого возраста с дефицитом массы тела и плохим питанием при терапии оланзапином (в 14–16% случаев) является, с одной стороны, ПЭ, а с другой – может быть «полезным» у данной категории пациентов. Прием зипразидона характеризуется минимальной прибавкой массы тела и невыраженной НГП [7]. Данных о развитии НЭД при приеме клозапина, кветиапина и арипипразола у пожилых больных шизофренией в доступной литературе обнаружить не удалось [42].
На основании анализа научной литературы [25, 38, 42, 47, 50] можно сформулировать основные рекомендации по применению нейролептических препаратов у лиц пожилого возраста: подтверждение диагноза шизофрении (дифференциальная диагностика с психозами иной природы); тщательный сбор анамнеза (употребление ПАВ, предшествующая ПФТ, коморбидная соматическая патология и др.); диагностические исследования (биохимические, физикальные, инструментальные и т.д.); назначение АНП (кроме клозапина) в малых дозах (начальная доза должна составлять 25–50% от начальной дозы у взрослых) с постепенной их титрацией; пациенты с ПМШ нуждаются в более низких дозах по сравнению с РМШ; избегание полипрагмазии; обязательное сочетание ПФТ с психосоциальными вмешательствами.
Роль гендерного фактора в переносимости нейролептической терапии
Свидетельства о половых различиях при шизофрении отражают разницу у мужчин и женщин процессов нейрогенеза (структурные и функциональные особенности ЦНС, включающие нейроэндокринные и циркадианные параметры), генетической структуры, гормонального статуса и социальных факторов риска возникновения и течения заболевания [1, 4, 13]. Риск развития шизофрении «мужчины/женщины» находится в соотношении 1,4:1, и для женщин преобладающим является более поздний возраст начала заболевания. Следует сказать, что результаты исследований половых различий морфологии мозга противоречивы, но вместе с тем имеются данные о том, что гендерные различия определенных областей мозга характерны как для нормы, так и для патологии. Это позволяет предположить, что одни и те же факторы являются важными как обусловливающие половые различия и при нормальных процессах нейрогенеза, и у больных шизофренией [13, 36, 39]. По мнению J.Salem и соавт. (1998 г.), в понимании гендерных различий при шизофрении может иметь значение рассмотрение и дальнейшие исследования гипотезы о том, что мужчины более склонны к предположительно плохо прогнозируемому нейрогенетическому подтипу шизофрении, а женщины – к генетически «хорошему прогнозу» и «аффективному подтипу шизофрении», генетически имеющему отношение к аффективным расстройствам. Рассматривая гендерные различия в функционировании гипоталамо-гипофизарно-гонадной оси, следует указать на большую «уязвимость» этой сферы у женщин (больший риск развития НГП), с одной стороны, и определенную «эстрогенпротективность», объясняющую, в частности, более поздний дебют шизофрении у женщин в подростковом возрасте и увеличение заболеваемости в климактерическом периоде. Кроме того, имеются существенные половые различия как в структуре психических расстройств, так и в различных сферах социального функционирования [36, 51].
По мнению U.Groleger и соавт. (2010 г.), не существует конкретных рекомендаций или схем терапии, предполагающих роль гендерных различий как основного фактора в выборе того или иного антипсихотика, которая подходила бы для всех терапевтических модальностей (антипсихотик, доза, длительность приема и др.). Исследования специфичности по полу в отношении ПЭ антипсихотиков, проведенные посредством систематического просмотра данных PubMed с использованием ключевых слов (гендер, нейролептики, ПЭ), не обнаружили ссылок, конкретно описывающих данные исследования. В большинстве работ пол ассоциировался с такими факторами, как возраст, другие болезни, прибавка массы тела [28].
В незначительном количестве работ приводились единичные указания на связанные с гендерным фактором различия в ПЭ нейролептиков, такие как прибавка массы тела, метаболический синдром и сексуальные дисфункции. Вместе с тем указывается, что женщины отличаются от мужчин не только по распространенности, но и по проявлению клинических симптомов, связанных с ПЭ антипсихотиков [4, 26, 27].
В обзоре W.Aichhorn и соавт. (2006 г.) приводятся данные по исследованию гендерных фармакокинетических различий и нежелательных эффектов при применении 6 антипсихотиков 2-го поколения (АВП): арипипразол, клозапин, оланзапин, кветиапин, рисперидон и зипразидон. Связанные с полом различия продемонстрированы в фармакокинезе cytochrome P-450 (CYP) с наиболее высокой активностью у женщин для CYP3A4 и CYP2D6. Тем не менее, если даже и существуют фармакокинетические различия между мужчинами и женщинами, значимо более высокое содержание в плазме у женщин обнаружено только в отношении оланзапина и клозапина. На сегодняшний день различия по полу негативных эффектов недостаточно хорошо изучены, но такие эффекты, как прибавка массы тела, гиперпролактинемия и кардиологические проблемы отмечены как свойственные в основном женщинам. Большинство рассмотренных исследований демонстрируют, что клозапин и оланзапин ассоциируются с большей прибавкой массы тела, чем другие атипичные антипсихотики, и такие выраженные ПЭ, как метаболический синдром, включающий в себя «внутреннее ожирение» (increased visceral adiposity), гипергликемию, гипертензию и дислипидемию, вызванные АВП, наиболее часто встречаются у женщин. Кроме того, есть ряд свидетельств о том, что сексуальная дисфункция у женщин связана с высокими уровнями пролактина; в то же время период, когда степень повышения уровня пролактина у мужчин и женщин начинает различаться, остается неясным. Знания о рисках и выгодах, связанных с использованием АВП во время беременности и лактации, остаются ограниченными, хотя и подбор доз во время беременности зависит от препарата и состояния метаболизма и энзимов, ответственных за этот метаболизм. По данным ранее опубликованных нами исследований, при купирующей и длительной антипсихотической терапии у больных женского пола достоверно чаще, чем у мужчин, развивается синдром НГП и гиперпролактинемия достигает более высоких показателей [4]. В целом следует подчеркнуть, что данные о наличии полового диморфизма были большей частью получены post hoc (от лат. – «после этого, но не вследствие этого») и, стало быть, выводы остаются достаточно поверхностными и умозрительными, а значит, ограниченными. Для лучшего понимания основополагающих механизмов половых различий необходимы дальнейшие исследования, изначально направленные на биологическую основу этой проблемы. Более тщательные, методически продуманные направления новых исследований призваны помочь определить рамки области, в пределах которой эти различия будут также определять менеджмент клинических мероприятий.
Таким образом, приведенные данные о роли возрастных и гендерных факторов в переносимости антипсихотических препаратов свидетельствуют о необходимости учета этих параметров при проведении нейролептической терапии. Следует также подчеркнуть, что проблема переносимости в настоящее время более актуальна и значима по сравнению с эффективностью антипсихотиков, поскольку именно непереносимость или плохая переносимость являются одной из наиболее частых причин несоблюдения режима терапии вплоть до полного отказа от нее. Все это, безусловно, требует дальнейших всесторонних исследований указанной проблемы с целью уточнения участия возрастных и гендерных факторов в патобиологических механизмах шизофрении и разработке клинических, диагностических и терапевтических показаний к назначению нейролептической терапии с учетом указанных параметров.
Сведения об авторе
Горобец Людмила Николаевна – д-р мед. наук, проф., руководитель отд-ния психиатрической эндокринологии ФГБУ МНИИП Минздравсоцразвития РФ. E-mail: gorobetsln@mail.ru
Список исп. литературыСкрыть список1. Аведисова А.С., Ахапкин Р.В. Проблемы клинической оценки переносимости терапии психотропными препаратами. Психиатр. и психофармакотер. Журн. им. П.Б.Ганнушкина. 2005; 1 (7): 17–20.
2. Барденштейн Л.М. Опыт применения атипичного нейролептика сероквеля для лечения первого психотического эпизода шизофрении у подростков. Психиатр. и психофармакотер. 2001; 3 (6): 213–4.
3. Бурдаков А.Н., Бурдакова Е.В., Фесенко Ю.А. Нейролептики в детской психиатрической практике. СПб.: ЭЛБИ-СПб, 2007.
4. Горобец Л.Н. Нейроэндокринные дисфункции и нейролептическая терапия. М.: Медпрактика-М, 2007.
5. Каледа В.Г., Бархатова А.Н., Стрельцова М.А. Современные подходы и принципы терапии шизофрении и шизоаффективного психоза юношеского возраста. Вопр. психического здоровья детей и подростков. 2004; 4 (2): 42–50.
6. Каледа В.Г. Терапия эндогенных приступообразных психозов юношеского возраста – основные принципы и подходы. Журн. неврол. и психиатр им. С.С.Корсакова. М.: Медиа Сфера, 2006; 106 (9): 4–11.
7. Клиническое руководство: модели диагностики и лечения психических и поведенческих расстройств. Под ред. В.Н.Краснова, И.Я.Гуровича. Сост. в Московском НИИ психиатрии Минздрава России. Соц. и клин. психиатрия (Прил.). М., 1999.
8. Козловская Г.В. Опыт пролонгированного лечения рисперидоном ранней шизофрении и аутизма у детей. Вопр. психического здоровья детей и подростков. 2008; 8 (1): 69–79.
9. Либин Л.Я., Чомская В.М., Лесникова С.А. и др. Оценка эффективности, безопасности и переносимости препарата Ридонекс у больных с параноидной формой шизофрении. Психиатр. и психофармакотер. 2011; 13 (6): 30–4.
10. Мамцева В.Н. Детская и подростковая психиатрия. М.: Медицина, 2003.
11. Северный А.А., Шевченко Ю.С., Волошин В.М. Проблема эффективности и безопасности современной психофармакотерапии детей и подростков. Вопр. психического здоровья детей и подростков. 2004; 4 (2): 39–42.
12. Ястребов Д.В. Терапия обсессивных и тревожных расстройств у больных с непсихотическими формами шизофрении. Психиатр. и психофармакотер. 2011; 13 (4): 38–47.
13. Abel KM, Drake R, Goldstein JM. Sex differences in schizophrenia. Int Rev Psychiat 2010; 22 (5): 417–28.
14. Aichhorn W, Whitworth AB, Weiss EM. Second-generation antipsychotics: is there evidence for sex differences in pharmacokinetic and adverse effect profiles? Drug Saf 2006; 29 (7): 587–98.
15. Cadenhead KS. Startle reactivity and prepulse inhibition in prodromal and early psychosis: effects of age, antipsychotics, tobacco and cannabis in a vulnerable population. Psychiat Res 2011; 188 (2): 208–16.
16. Carlisle LL, McClellan J. Psychopharmacology of schizophrenia in children and adolescents. Pediatr Clin North Am 2011; 58 (1): 205–18.
17. Correll CU. Symptomatic presentation and initial treatment for schizophrenia in children and adolescents. J Clin Psychiat 2010; 71 (11): e29.
18. Correll CU, Kratochvil CJ, March JS. Developments in pediatric psychopharmacology: focus on stimulants, antidepressants, and antipsychotics. J Clin Psychiat 2011; 72 (5): 655–70.
19. Dassori AM, Copeland LA, Zeber JE et al. Factors in second-generation antipsychotic switching patterns in a national sample of older veterans with schizophrenia. Psychiatr Serv 2011; 62 (1): 47–53.
20. Davidson M, Caspi A, Noy S. The treatment of schizophrenia: from premorbid manifestation to the first episode of psychosis. Dialogues in clinical neuroscience 2005; 1: 7–16.
21. Diflorio A, Jones J. Is sex important? Gender differences in bipolar disorder. Int J Psychiatr 2010; 22 (5): 437–52.
22. De Rivera JL, Lal S, Ettegi P et al. Effects of acute and chronic neuroleptic therapy in serum prolactin level in men and women of different age groups. Clin Endocrinol 1976; 5 (3): 273–82.
23. Felmet K, Zisook S, Kasckow JW. Elderly patients with schizophrenia and depression: diagnosis and treatment. Clin Schizophr Relat Psychoses 2011; 4 (4): 239–50.
24. Fleischhacker WW. Treatment of first episode of schizophrenia. Eur Psychat 2002; 17 (Suppl. 4): 371–5.
25. Fulton MM, Allen ER. Polypharmacy in the eldery: a literature review. J Am academy of nurse practitioners 2005; 17 (4): 123–32.
26. Groleger U, Novak-Grubic V. Gender, psychosis and psychotropic drugs: differences and similarities. Psychiatr Danub 2010; 22 (2): 338–42.
27. Grunder G, Wetzel H, Schlosser R. Neuroendocrine response to antipsychotics: effects of drug type and gender. Biol Psychiat 1999; 45 (1): 89–97.
28. Haack S, Seeringer A, Thürmann PA et al. Sex-specific differences in side effects of psychotropic drugs: genes or gender? Pharmacogenom 2009; 10 (9): 1511–26.
29. Jalenques I, Rachez C, Tourtauchaux R et al. Old patients suffering from long-standing schizophrenia: clinical aspects. Geriatr Psychol Neuropsychiatr Vieil 2011; 9 (3): 345–53.
30. Kasckow J, Fellows I, Golshan S et al. Treatment of subsyndromal depressive symptoms in middle-age and older patients with schizophrenia: effect of age on response. Am J Geriat Psychiat 2010; 18 (9): 853–7.
31. Keers R, Aitchinson KJ. Gender differences in antidepressant drug response. Int J Psychiat 2010; 22 (5): 485–500.
32. Kipke DM et al. Adolescent development and the biology of puberty: summary of a workshop on new research. Washington: National Academy of Science 1999; p. 12.
33. Koch-Weser J, Sellers EM, Zacest R. The ambiguity of adverse drug reactions. Eur J Clin Pharmacol 1977; 11: 75–8.
34. Kramer MS, Leventhal JM, Hutchinson TA, Feinstein AR. An algorithm for the operational assessment of drug reactions I. Background, description and instructions for use. JAMA 1979; 242: 623–32.
35. Levine J, Schooler N. Strategies for analyzing side effects data from SAFTEE. Psychopharmacol Bull 1986; 22: 343–81.
36. Leung A, Chue P. Sex differences in schizophrenia, a review of the literature. Acta Psychiatr Scand 2000; 401: 3–38.
37. Masi G, Liboni F. Management of schizophrenia in children and adolescents: focus on pharmacotherapy. Drugs 2011; 71 (2): 179–208.
38. Meyers BS, Jeste DV. Geriatric psychopharmacology: evolution of a discipline. J Clin Psychiat 2010; 71 (11): 1416–24.
39. Moriarty PJ, Lieber D, Bennett A et al. Gender differences in poor outcome patients with lifelong schizophrenia. Schizophr Bull 2001; 27 (1): 103–13.
40. Parker G, Brotche H. Gender differences in depression. Int Rev Psychiat 2010; 22 (5): 429–36.
41. Preskorn SH. Recent pharmacologic advances in antidepressant therapy for the elderly. Am J Med 1993; 24, 94 (5A): 2–12.
42. Rado J, Janicak PG. Aripiprazole for late-life schizophrenia. Clin Interv Aging 2010; 7 (5): 253–8.
43. Ribolsi M, Magni V, Rubino IA. Quetiapine fumarate for schizophrenia and bipolar disorder in young patients. Drugs Today (Barc) 2010; 46 (8): 581–7.
44. Robinson B. Brest changes in the male and female with chlorpromazine or reserpine Therapy. Med J Aust 1957; 44: 239–41.
45. Rost K, Hsieh YP, Xu S et al. Potential disparities in the management of schizophrenia in the United States. Psychiatr Serv 2011; 62 (6): 613–8.
46. Saad MF, Damani S, Gingerich RL. Sexual dimorphism in plasma leptin concentration. J Clin Endocrinol Metab 1997; 82: 579–84.
47. Sable JA, Jeste DV. Antipsychotic treatment for late-life schizophrenia. Current Psychiat Reports 2002; 4: 299–306.
48. Salem JE, Kring AM. The role of gender differences in the reduction of etiologic heterogeneity in schizophrenia. Clin Psychol Rev 1998; 18 (7): 795–819.
49. Smith S. Gender differences in antipsychotic prescribing. Int Rev Psychiat 2010; 22 (5): 472–84.
50. Suzuki T, Remington G, Uchida H et al. Management of schizophrenia in late life with antipsychotic medications: a qualitative review. Drugs Aging 2011; 28 (12): 961–80.
51. Szymanski S, Lieberman JA, Alvir JM et al. Gender differences in onset of illness, treatment response, course, and biologic indexes in first-episode schizophrenic patients. Am J Psychiat 1995; 152 (5): 698–703.
52. Talaslahti T, Alanen HM, Leinonen E. Severe psychoses in the elderly – schizophrenia and delusional disorder. Duodecim 2011; 127 (4): 375–82.
53. Tsuboi T, Suzuki T, Uchida H. A tipping point in drug dosing in late-life schizophrenia. Curr Psychiat Rep 2011; 13 (3): 225–33.
54. Von Bahr C, Wiesel FA, Movin G et al. Neuroendocrine responses to single oral doses of remoxipride and sulpiride in healthy female and male volunteers. Psychopharmacol (Berl) 1991; 103 (4): 443–8.
55. Weizman R, Weizman A, Levi J et al. Sexual dysfunction associated with hyperprolactinemia in males and females undergoing hemo dialysis. Psychosom Med 1983; 45: 259–69.
56. Wiffen BD, Rabinowitz J, Fleischhacker WW et al. Insight: demographic differences and associations with one-year outcome in schizophrenia and schizoaffective disorder. Clin Schizophr Relat Psychoses 2010; 4 (3): 169–75.
57. Wudarsky M, Nicolson R, Hamburger SD et al. Elevated prolactin in pediatric patients on typical and atypical antipsychotics. J Child Adolesc Psychopharmacol 1999; 9: 239–45.
1 января 2012
Количество просмотров: 2216

