Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№05 2009
Лечение депрессий у больных хроническим гепатитом С №05 2009
Номера страниц в выпуске:9-13
Распространенность депрессий среди больных хроническим гепатитом С (ХГС) очень высока. По данным разных авторов, депрессия поражает от 23 до 72% больных ХГС. Доказано, что противовирусная терапия (ПВТ) с применением препаратов интерферона-a (ИФН-a) часто осложняется развитием депрессий. Таким образом, большинство больных ХГС находятся в группе риска по развитию депрессии, так как применение препаратов ИФН-a – единственный доказанно эффективный метод лечения таких больных.
Введение
Распространенность депрессий среди больных хроническим гепатитом С (ХГС) очень высока. По данным разных авторов, депрессия поражает от 23 до 72% больных ХГС [1–7].
Доказано, что противовирусная терапия (ПВТ) с применением препаратов интерферона-a (ИФН-a) часто осложняется развитием депрессий. Таким образом, большинство больных ХГС находятся в группе риска по развитию депрессии, так как применение препаратов ИФН-a – единственный доказанно эффективный метод лечения таких больных [8–14].
Депрессии на фоне ПВТ отличаются быстротой развития, большой тяжестью и высоким суицидальным риском, поэтому обычной практикой в таком случае ранее становилось преждевременное прекращение ПВТ. Во многих исследованиях показано, что в таком решении «заинтересованы» как врач-интернист (справедливо опасающийся возможности не справиться с лечением психиатрической патологии, нередко осложненной опасностью суицидов), так и сам пациент, депрессивное состояние которого влияет на его поведение таким образом, что он стремится причинить себе вред, «наказать» себя, в том числе и отказываясь от ПВТ («Пусть будет что будет»; «Гепатит – это кара за мои грехи» и т.п.) [10–15].
Кроме того, зная о высокой вероятности развития депрессий у больных ХГС, многие врачи-интернисты не назначают препараты ИФН-a больным с отягощенным психиатрическим анамнезом, считая это противопоказанием к проведению ПВТ [7, 11, 16–18].
Предлагалось профилактическое назначение антидепрессантов всем больным ХГС, получающим ПВТ [19, 20], однако в дальнейшем от этого метода отказались из-за превышения возможного риска над пользой [21].
Распространенность психических расстройств у больных ХГС изначально выше, чем в среднем в популяции. Высока коморбидность ХГС с болезнями зависимости от психоактивных веществ (ПАВ) – подавляющее большинство наркоманов, использующих внутривенные инъекции, инфицированы вирусом гепатита С [4, 15]. Одним из неотъемлемых компонентов психопатологии болезней зависимости является депрессивная симптоматика, которая может развиваться на любом этапе заболевания, в том числе и на фоне стойкой и длительной ремиссии [1, 15, 22–24].
Способствует развитию депрессий и психогенный фактор, т.е. осознание пациентом, что он болен тяжелым хроническим заболеванием, полностью неизлечимым, с высокой вероятностью развития тяжелых и летальных осложнений (цирроз печени, гепатокарцинома).
Психофармакотерапия депрессий у больных ХГС в литературе освещена мало, в основном представлена описанием применения антидепрессивных препаратов (АДП) группы селективных ингибиторов обратного захвата серотонина (СИОЗС), а результаты по эффективности и переносимости, приводимые в разных публикациях, нередко противоречивы [21, 25–30].
Целями нашего исследования явились комплексное клинико-психопатологическое изучение депрессий у больных ХГС, сравнительная оценка психофармакотерапии разными АДП и разработка дифференцированных терапевтических рекомендаций.
Материалы и методы
В исследование включались больные ХГС старше 18 лет, находившиеся на лечении в Клинике нефрологии, внутренних и профессиональных болезней им. Е.М.Тареева ГОУ ВПО ММА им. И.М.Сеченова.
Из исследования были исключены больные с шизофренией и шизоаффективным расстройством, тяжелой соматической патологией, приводящей к появлению дополнительной психопатологической симптоматики (в том числе циррозом печени и проявлениями печеночной энцефалопатии), больные, злоупотреблявшие ПАВ, включая алкоголь, в течение 6 мес до начала исследования.
Для оценки состояния больных использовали клинико-психопатологический, клинико-катамнестический методы, применяли стандартизированные психометрические шкалы (шкала Монтгомери–Асберга для оценки депрессий – MADRS, шкала общего клинического впечатления – CGI, опросник депрессии Бека – BDI, шкалы оценки патологического влечения к алкоголю [31] и к наркотикам [32]).
Для лечения депрессий у больных ХГС применялись антидепрессанты, разные по механизму действия и спектру психофармакологической активности. Оценивались эффективность и переносимость следующих АДП: миртазапина, пароксетина, тианептина, миансерина, флувоксамина, эсциталопрама, пирлиндола, амитриптилина, кломипрамина.
Терапия АДП оценивалась как эффективная, если отмечалось отчетливое клиническое улучшение состояния и редукция симптомов по шкале MADRS составляла >50%. Также оценивалась скорость уменьшения выраженности психопатологической симптоматики, и отмечался факт достижения ремиссии (клинически и по психометрическим шкалам).
Дозы АДП подбирались индивидуально. В нашем исследовании не возникло необходимости применения высоких дозировок АДП. Для трициклических АДП (амитриптилин и кломипрамин) применялись малые дозы, малые и средние – для других АДП. Такой диапазон дозировок связан, с одной стороны, с необходимостью уменьшения нежелательных явлений (НЯ) терапии (одно из главных требований при применении АДП в соматической клинике), с другой – с тем, что в большинстве случаев хороший эффект при лечении депрессий у больных ХГС достигался при применении малых, иногда субтерапевтических дозировок АДП.
Регистрировались НЯ антидепрессивной терапии.
Анализ результатов исследования проводился с использованием методов статистической обработки, включая описательную статистику, непараметрические методы статистического анализа, в том числе медианный тест, критерий c2, методы Мак-Нимара, Манна–Уитни, Вилкоксона, коэффициент ранговой корреляции Спирмена и двусторонний критерий Фишера. Достоверным считался уровень значимости p<0,05.
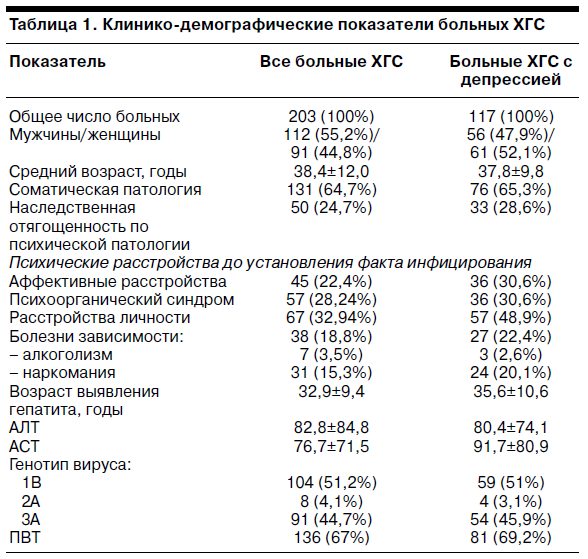
В исследование были включены 203 больных, клинико-демографические характеристики которых представлены в табл. 1. ПВТ получали 136 (67%) больных. В табл. 1 также представлены клинико-биохимические характеристики основного заболевания (ХГС).
У 117 (57,7%) больных выявлены депрессивные расстройства, клинически и по критериям Международной классификации болезней 10-го пересмотра, соответствовавшие депрессивному эпизоду (табл. 2). Среди больных, получающих ПВТ, преобладали депрессии средней и тяжелой степени, достоверно выше был суммарный балл по шкале MADRS.

Не выявлено связи между тяжестью депрессии и активностью ХГС.
Синдромальная оценка показала преобладание тревожных (40,8%), адинамических (20,4%) и дисфорических (18,4%) депрессий. Реже встречались апатическая и тоскливая депрессии (12,2 и 8,2% соответственно).
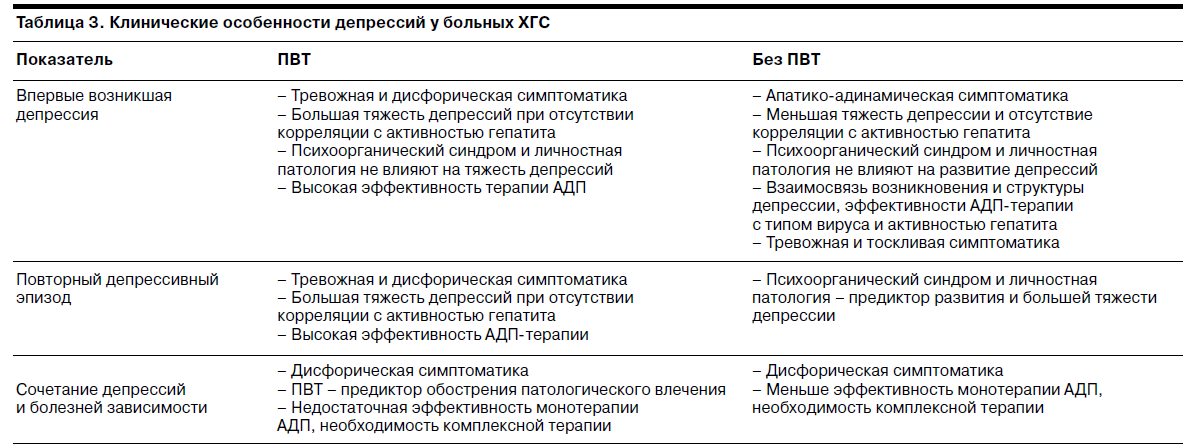
При впервые возникших и повторных депрессиях у больных ХГС, получающих ПВТ, преобладала тревожная и дисфорическая симптоматика; при впервые возникших депрессиях на фоне ХГС без проведения ПВТ – апатико-адинамическая симптоматика; при повторных депрессиях без ПВТ – тревожная и тоскливая симптоматика. Депрессии у больных ХГС, коморбидных с болезнями зависимости от ПАВ, были сходными по симптоматике независимо от применения ПВТ и протекали с выраженным дисфорическим компонентом. У таких больных аффективные расстройства были проявлением актуализации патологического влечения к ПАВ, причем при назначении ПВТ существенно возрастал риск рецидива зависимости.
Имела место высокая эффективность применения АДП. У всех больных, получавших антидепрессанты, клинически отмечено улучшение психического состояния. Доля больных с хорошим ответом на лечение антидепрессантами после 12 нед терапии составила ≈80%. Разные АДП показали приблизительно равную эффективность (миртазапин – 80,0%; пароксетин – 81,3%; тианептин – 77,4%; миансерин – 79,1%; флувоксамин – 78,3%; эсциталопрам – 76,8%; пирлиндол – 75,6%; амитриптилин – 80,2%; кломипрамин – 78,4%).
Суточные дозы АДП были невысокими и составляли для миртазапина до 30 мг/сут, пароксетина – до 20 мг/сут, тианептина – до 37,5 мг/сут, миансерина – до 60 мг/сут, флувоксамина – до 100 мг/сут, эсциталопрама – до 20 мг/сут, пирлиндола – до 50 мг/сут, амитриптилина – до 75 мг/сут, кломипрамина – до 75 мг/сут.
Предикторы эффективности психофармакотерапии депрессий у больных ХГС представлены в табл. 4.
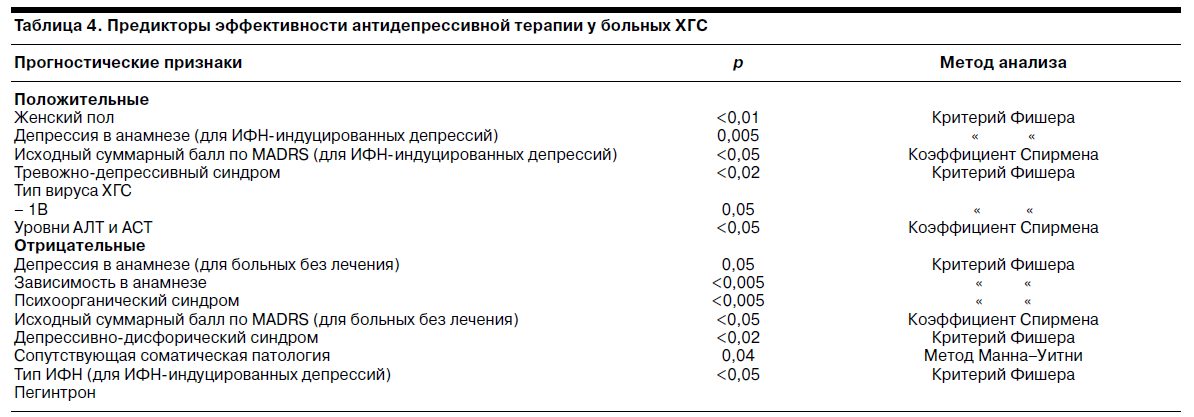
Антидепрессивная терапия наиболее эффективна при депрессиях на фоне ПВТ как при впервые возникшем, так и повторном эпизоде и при большей тяжести депрессии. Тревожно-депрессивный синдром и женский пол являлись положительными предикторами эффективности терапии. Лечение депрессии позволило во всех наблюдениях в полном объеме провести ПВТ, в том числе в случаях развития тяжелых депрессий с суицидальными мыслями.
При оценке влияния клинико-биохимических показателей ХГС на успешность психофармакотерапии отмечена достоверная положительная корреляция эффективности применения АДП со степенью активности гепатита [определявшейся по уровню аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ); p=0,03], эта закономерность была наиболее выраженной при депрессиях на фоне ПВТ. Генотип вируса 1В повышает вероятность успешного лечения впервые возникшей депрессии без ПВТ (p=0,05).
Эффективность лечения впервые возникшей депрессии без ПВТ обратно коррелирует с тяжестью депрессии, что значительно отличает ее от депрессий, развивающихся на фоне ПВТ, при которых эта корреляция является положительной. Успешное лечение депрессии повышало качество жизни больных и давало возможность в дальнейшем при наличии показаний проводить больным ПВТ.
Депрессивно-дисфорическая симптоматика, наличие сопутствующей психической и соматической патологии отрицательно влияли на эффективность терапии АДП у всех больных ХГС.
Достоверно худший ответ на антидепрессивную терапию отмечен у больных ХГС, получающих ПВТ с применением ИФН пролонгированного действия – пегилированного ИФН-a (Пегинтрон).
При оценке скорости развития антидепрессивного эффекта следует отметить достаточно быстрый темп улучшения состояния: к 3-й неделе доля больных с хорошим ответом на терапию составила 60%, а к 6-й – 75%. Достоверных отличий между разными АДП в скорости развития эффекта внутри и между группами больных ХГС без болезней зависимости с депрессией без ПВТ и с депрессией на фоне ПВТ не выявлено.
В группе с коморбидными болезнями зависимости депрессивные расстройства часто являлись признаком усиления патологического влечения к ПАВ. Монотерапия АДП у большей части этих больных была недостаточно эффективной. Отмечены существенные отличия в динамике патологического влечения к ПАВ в зависимости от применяемого антидепрессанта. В течение первых 3 нед достоверно более быстрый эффект развивался при использовании АДП с преобладанием седативного и снотворного эффектов (миртазапин, миансерин, амитриптилин), в дальнейшем различия в скорости редукции психопатологической симптоматики нивелировались. Данные АДП эффективно купировали тревогу и бессонницу, но для купирования других компонентов патологического влечения к ПАВ (идеаторного и поведенческого) требовались дополнительные назначения антипсихотиков и антиконвульсантов. Улучшения психического состояния удавалось достичь только при проведении комплексной психофармакотерапии. У 68% больных ХГС с коморбидными болезнями зависимости комплексная психофармакотерапия позволила провести ПВТ в полном объеме.
У больных ХГС с депрессией всех типов переносимость лечения АДП была хорошей, не наблюдалось случаев повышения активности аминотрансфераз и ухудшения других лабораторных показателей. Наилучшая переносимость отмечена при применении тианептина (Коаксил) – НЯ терапии АДП практически отсутствовали. Седативное действие и небольшая преходящая сонливость у пациентов, принимавших амитриптилин, миртазапин и миансерин, расценивались самими больными как благоприятные эффекты в тех случаях, когда в структуре депрессий наблюдались тревога и нарушения сна. Встречавшиеся побочные эффекты расценивались как легкие или умеренно выраженные и ни в одном случае не потребовали отмены терапии АДП.
Обсуждение
В исследовании не выявлено достоверных различий в частоте развития депрессивных расстройств у больных ХГС, получающих ПВТ, и у больных без противовирусного лечения (58,3 и 55,7% соответственно). Эти данные несколько отличаются от приводимых во многих публикациях [11–14, 26] и могут быть обусловлены тем, что в обеих группах с одинаковой частотой встречается преморбидная отягощенность психической патологией.
Не выявлено корреляции тяжести депрессивной симптоматики с тяжестью проявлений основного заболевания (ХГС). Это отличает депрессии, возникающие при ХГС, от других соматогенных депрессий, для которых такая взаимосвязь характерна и описана многими авторами [4–7, 33, 34], и еще раз подчеркивает необходимость выделения отдельного клинического подтипа «депрессия при ХГС», т.е. депрессия, которая развивается у больных ХГС, не получающих ПВТ. По данным некоторых авторов, подобная депрессия, обычно неглубокая по тяжести, с преобладанием апатико-адинамической симптоматики, с хроническим волнообразным течением, на протяжении многих лет может служить единственным клиническим симптомом ХГС [1, 2, 4, 5, 7, 18, 35].
У больных ХГС даже при депрессиях тяжелой и умеренной степени разные по «силе» АДП показали высокую эффективность (до 80% ответивших на лечение после 12 нед терапии), превосходящую эффективность при эндогенных депрессиях аналогичной тяжести [36, 37]. Эта закономерность в наибольшей степени проявляется при лечении депрессий на фоне ПВТ (81,9% больных с хорошим ответом на антидепрессивную терапию против 70,0% у больных ХГС без ПВТ; статистическая тенденция стремится к уровню достоверности). В группе больных с зависимостью от ПАВ анализ эффективности АДП показал достоверно меньший уровень ответа на терапию: <55% к 12-й неделе терапии АДП. Факторы, влияющие на эффективность терапии депрессивных нарушений у больных ХГС с зависимостью от ПАВ, нуждаются в дальнейшем исследовании.
Хорошая переносимость терапии АДП у больных ХГС в нашем исследовании частично может быть обусловлена некоторым перекрыванием побочных действий ПВТ и психофармакотерапии (причем побочные эффекты ПВТ сами больные оценивали как значительно более частые и тяжелые). Так, головная боль значительно чаще развивалась в группе больных, получавших ПВТ, совпадала с гриппоподобным синдромом, сопровождающим применение ИФН-a, и не зависела от сроков и дозы назначения АДП.
Проведен анализ назначений психофармакопрепаратов больным в динамике. Изменение дозировок и/или смена антидепрессанта, назначение дополнительно препаратов других психофармакологических групп проводились при недостаточной эффективности лечения. Изучалась динамика состояния при изменении терапии. Полученные результаты позволили разработать рекомендации по лечению депрессий у больных ХГС.
При отсутствии дополнительных противопоказаний лечение впервые возникших депрессий, как ИФН-индуцированных, так и соматогенных, следует начинать с препаратов с наименьшим числом побочных действий. По нашим данным, наилучшую переносимость показал тианептин (Коаксил). У больных ХГС тианептин эффективен даже при значительной тяжести депрессивных расстройств, что делает его препаратом первого выбора. Несколько больше нежелательных побочных действий отмечается при применении препаратов группы СИОЗС (эсциталопрам, пароксетин, флувоксамин). В случае недостаточной эффективности в течение 6–8 нед терапии необходима замена АДП на миртазапин или трициклический антидепрессант (амитриптилин, кломипрамин). При выраженной бессоннице целесообразно начинать терапию с АДП с преобладанием седативного действия (миртазапин, миансерин, флувоксамин, амитриптилин), которые позволяют проводить монотерапию АДП, не прибегая к дополнительным назначениям. При лечении повторных депрессивных эпизодов эффективнее проводить терапию трициклическими АДП или миртазапином. В случае возникновения повторного депрессивного эпизода на фоне ПВТ высока эффективность применения тианептина (Коаксил). Терапия депрессивных нарушений у больных с сопутствующими болезнями зависимости требует комплексного подхода: сочетание АДП с преобладанием седативного и снотворного действия (миртазапин, миансерин, флувоксамин) с антипсихотиками и антиконвульсантами (в малых и средних дозах).
После улучшения состояния терапию АДП прекращать не следует. Если у больного сохраняются хотя бы отдельные симптомы депрессии, в том числе нерезко выраженные, терапию АДП целесообразно продолжать вплоть до завершения ПВТ. В случае полного разрешения депрессивной симптоматики через 3–4 нед после нормализации настроения возможно снижение суточной дозы АДП на 1/4. При сохранении стабильности состояния дальнейшее снижение суточной дозы препарата возможно не ранее чем через 4 нед. При возобновлении депрессивной симптоматики дозу антидепрессанта следует немедленно увеличить до терапевтической.
Таким образом, учитывая высокую частоту развития депрессий у больных ХГС и их клиническую значимость, необходимы своевременная диагностика и адекватное лечение этих расстройств. Особое внимание следует обращать на психическое состояние больных с наличием факторов риска, таких как аффективная патология и злоупотребление ПАВ в анамнезе, наличие текущих психических расстройств и генотип вируса гепатита 3А.
Широкое использование врачами-интернистами скрининговых шкал-опросников не должно исключать квалифицированного осмотра психиатром.
При лечении депрессий у больных ХГС эффективность и переносимость АДП разных групп высока и примерно одинакова, однако спектр их клинической активности несколько отличается. Дифференцированный подход к назначению антидепрессивной терапии повышает ее эффективность.
Своевременное выявление и адекватное лечение депрессий у больных ХГС позволяет эффективнее проводить терапию основного заболевания, в том числе в полном объеме применять противовирусное лечение.
Распространенность депрессий среди больных хроническим гепатитом С (ХГС) очень высока. По данным разных авторов, депрессия поражает от 23 до 72% больных ХГС [1–7].
Доказано, что противовирусная терапия (ПВТ) с применением препаратов интерферона-a (ИФН-a) часто осложняется развитием депрессий. Таким образом, большинство больных ХГС находятся в группе риска по развитию депрессии, так как применение препаратов ИФН-a – единственный доказанно эффективный метод лечения таких больных [8–14].
Депрессии на фоне ПВТ отличаются быстротой развития, большой тяжестью и высоким суицидальным риском, поэтому обычной практикой в таком случае ранее становилось преждевременное прекращение ПВТ. Во многих исследованиях показано, что в таком решении «заинтересованы» как врач-интернист (справедливо опасающийся возможности не справиться с лечением психиатрической патологии, нередко осложненной опасностью суицидов), так и сам пациент, депрессивное состояние которого влияет на его поведение таким образом, что он стремится причинить себе вред, «наказать» себя, в том числе и отказываясь от ПВТ («Пусть будет что будет»; «Гепатит – это кара за мои грехи» и т.п.) [10–15].
Кроме того, зная о высокой вероятности развития депрессий у больных ХГС, многие врачи-интернисты не назначают препараты ИФН-a больным с отягощенным психиатрическим анамнезом, считая это противопоказанием к проведению ПВТ [7, 11, 16–18].
Предлагалось профилактическое назначение антидепрессантов всем больным ХГС, получающим ПВТ [19, 20], однако в дальнейшем от этого метода отказались из-за превышения возможного риска над пользой [21].
Распространенность психических расстройств у больных ХГС изначально выше, чем в среднем в популяции. Высока коморбидность ХГС с болезнями зависимости от психоактивных веществ (ПАВ) – подавляющее большинство наркоманов, использующих внутривенные инъекции, инфицированы вирусом гепатита С [4, 15]. Одним из неотъемлемых компонентов психопатологии болезней зависимости является депрессивная симптоматика, которая может развиваться на любом этапе заболевания, в том числе и на фоне стойкой и длительной ремиссии [1, 15, 22–24].
Способствует развитию депрессий и психогенный фактор, т.е. осознание пациентом, что он болен тяжелым хроническим заболеванием, полностью неизлечимым, с высокой вероятностью развития тяжелых и летальных осложнений (цирроз печени, гепатокарцинома).
Психофармакотерапия депрессий у больных ХГС в литературе освещена мало, в основном представлена описанием применения антидепрессивных препаратов (АДП) группы селективных ингибиторов обратного захвата серотонина (СИОЗС), а результаты по эффективности и переносимости, приводимые в разных публикациях, нередко противоречивы [21, 25–30].
Целями нашего исследования явились комплексное клинико-психопатологическое изучение депрессий у больных ХГС, сравнительная оценка психофармакотерапии разными АДП и разработка дифференцированных терапевтических рекомендаций.
Материалы и методы
В исследование включались больные ХГС старше 18 лет, находившиеся на лечении в Клинике нефрологии, внутренних и профессиональных болезней им. Е.М.Тареева ГОУ ВПО ММА им. И.М.Сеченова.
Из исследования были исключены больные с шизофренией и шизоаффективным расстройством, тяжелой соматической патологией, приводящей к появлению дополнительной психопатологической симптоматики (в том числе циррозом печени и проявлениями печеночной энцефалопатии), больные, злоупотреблявшие ПАВ, включая алкоголь, в течение 6 мес до начала исследования.
Для оценки состояния больных использовали клинико-психопатологический, клинико-катамнестический методы, применяли стандартизированные психометрические шкалы (шкала Монтгомери–Асберга для оценки депрессий – MADRS, шкала общего клинического впечатления – CGI, опросник депрессии Бека – BDI, шкалы оценки патологического влечения к алкоголю [31] и к наркотикам [32]).
Для лечения депрессий у больных ХГС применялись антидепрессанты, разные по механизму действия и спектру психофармакологической активности. Оценивались эффективность и переносимость следующих АДП: миртазапина, пароксетина, тианептина, миансерина, флувоксамина, эсциталопрама, пирлиндола, амитриптилина, кломипрамина.
Терапия АДП оценивалась как эффективная, если отмечалось отчетливое клиническое улучшение состояния и редукция симптомов по шкале MADRS составляла >50%. Также оценивалась скорость уменьшения выраженности психопатологической симптоматики, и отмечался факт достижения ремиссии (клинически и по психометрическим шкалам).
Дозы АДП подбирались индивидуально. В нашем исследовании не возникло необходимости применения высоких дозировок АДП. Для трициклических АДП (амитриптилин и кломипрамин) применялись малые дозы, малые и средние – для других АДП. Такой диапазон дозировок связан, с одной стороны, с необходимостью уменьшения нежелательных явлений (НЯ) терапии (одно из главных требований при применении АДП в соматической клинике), с другой – с тем, что в большинстве случаев хороший эффект при лечении депрессий у больных ХГС достигался при применении малых, иногда субтерапевтических дозировок АДП.
Регистрировались НЯ антидепрессивной терапии.
Анализ результатов исследования проводился с использованием методов статистической обработки, включая описательную статистику, непараметрические методы статистического анализа, в том числе медианный тест, критерий c2, методы Мак-Нимара, Манна–Уитни, Вилкоксона, коэффициент ранговой корреляции Спирмена и двусторонний критерий Фишера. Достоверным считался уровень значимости p<0,05.
В исследование были включены 203 больных, клинико-демографические характеристики которых представлены в табл. 1. ПВТ получали 136 (67%) больных. В табл. 1 также представлены клинико-биохимические характеристики основного заболевания (ХГС).

У 117 (57,7%) больных выявлены депрессивные расстройства, клинически и по критериям Международной классификации болезней 10-го пересмотра, соответствовавшие депрессивному эпизоду (табл. 2). Среди больных, получающих ПВТ, преобладали депрессии средней и тяжелой степени, достоверно выше был суммарный балл по шкале MADRS.

Не выявлено связи между тяжестью депрессии и активностью ХГС.
Синдромальная оценка показала преобладание тревожных (40,8%), адинамических (20,4%) и дисфорических (18,4%) депрессий. Реже встречались апатическая и тоскливая депрессии (12,2 и 8,2% соответственно).

При впервые возникших и повторных депрессиях у больных ХГС, получающих ПВТ, преобладала тревожная и дисфорическая симптоматика; при впервые возникших депрессиях на фоне ХГС без проведения ПВТ – апатико-адинамическая симптоматика; при повторных депрессиях без ПВТ – тревожная и тоскливая симптоматика. Депрессии у больных ХГС, коморбидных с болезнями зависимости от ПАВ, были сходными по симптоматике независимо от применения ПВТ и протекали с выраженным дисфорическим компонентом. У таких больных аффективные расстройства были проявлением актуализации патологического влечения к ПАВ, причем при назначении ПВТ существенно возрастал риск рецидива зависимости.
Имела место высокая эффективность применения АДП. У всех больных, получавших антидепрессанты, клинически отмечено улучшение психического состояния. Доля больных с хорошим ответом на лечение антидепрессантами после 12 нед терапии составила ≈80%. Разные АДП показали приблизительно равную эффективность (миртазапин – 80,0%; пароксетин – 81,3%; тианептин – 77,4%; миансерин – 79,1%; флувоксамин – 78,3%; эсциталопрам – 76,8%; пирлиндол – 75,6%; амитриптилин – 80,2%; кломипрамин – 78,4%).
Суточные дозы АДП были невысокими и составляли для миртазапина до 30 мг/сут, пароксетина – до 20 мг/сут, тианептина – до 37,5 мг/сут, миансерина – до 60 мг/сут, флувоксамина – до 100 мг/сут, эсциталопрама – до 20 мг/сут, пирлиндола – до 50 мг/сут, амитриптилина – до 75 мг/сут, кломипрамина – до 75 мг/сут.
Предикторы эффективности психофармакотерапии депрессий у больных ХГС представлены в табл. 4.

Антидепрессивная терапия наиболее эффективна при депрессиях на фоне ПВТ как при впервые возникшем, так и повторном эпизоде и при большей тяжести депрессии. Тревожно-депрессивный синдром и женский пол являлись положительными предикторами эффективности терапии. Лечение депрессии позволило во всех наблюдениях в полном объеме провести ПВТ, в том числе в случаях развития тяжелых депрессий с суицидальными мыслями.
При оценке влияния клинико-биохимических показателей ХГС на успешность психофармакотерапии отмечена достоверная положительная корреляция эффективности применения АДП со степенью активности гепатита [определявшейся по уровню аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ); p=0,03], эта закономерность была наиболее выраженной при депрессиях на фоне ПВТ. Генотип вируса 1В повышает вероятность успешного лечения впервые возникшей депрессии без ПВТ (p=0,05).
Эффективность лечения впервые возникшей депрессии без ПВТ обратно коррелирует с тяжестью депрессии, что значительно отличает ее от депрессий, развивающихся на фоне ПВТ, при которых эта корреляция является положительной. Успешное лечение депрессии повышало качество жизни больных и давало возможность в дальнейшем при наличии показаний проводить больным ПВТ.
Депрессивно-дисфорическая симптоматика, наличие сопутствующей психической и соматической патологии отрицательно влияли на эффективность терапии АДП у всех больных ХГС.
Достоверно худший ответ на антидепрессивную терапию отмечен у больных ХГС, получающих ПВТ с применением ИФН пролонгированного действия – пегилированного ИФН-a (Пегинтрон).
При оценке скорости развития антидепрессивного эффекта следует отметить достаточно быстрый темп улучшения состояния: к 3-й неделе доля больных с хорошим ответом на терапию составила 60%, а к 6-й – 75%. Достоверных отличий между разными АДП в скорости развития эффекта внутри и между группами больных ХГС без болезней зависимости с депрессией без ПВТ и с депрессией на фоне ПВТ не выявлено.
В группе с коморбидными болезнями зависимости депрессивные расстройства часто являлись признаком усиления патологического влечения к ПАВ. Монотерапия АДП у большей части этих больных была недостаточно эффективной. Отмечены существенные отличия в динамике патологического влечения к ПАВ в зависимости от применяемого антидепрессанта. В течение первых 3 нед достоверно более быстрый эффект развивался при использовании АДП с преобладанием седативного и снотворного эффектов (миртазапин, миансерин, амитриптилин), в дальнейшем различия в скорости редукции психопатологической симптоматики нивелировались. Данные АДП эффективно купировали тревогу и бессонницу, но для купирования других компонентов патологического влечения к ПАВ (идеаторного и поведенческого) требовались дополнительные назначения антипсихотиков и антиконвульсантов. Улучшения психического состояния удавалось достичь только при проведении комплексной психофармакотерапии. У 68% больных ХГС с коморбидными болезнями зависимости комплексная психофармакотерапия позволила провести ПВТ в полном объеме.
У больных ХГС с депрессией всех типов переносимость лечения АДП была хорошей, не наблюдалось случаев повышения активности аминотрансфераз и ухудшения других лабораторных показателей. Наилучшая переносимость отмечена при применении тианептина (Коаксил) – НЯ терапии АДП практически отсутствовали. Седативное действие и небольшая преходящая сонливость у пациентов, принимавших амитриптилин, миртазапин и миансерин, расценивались самими больными как благоприятные эффекты в тех случаях, когда в структуре депрессий наблюдались тревога и нарушения сна. Встречавшиеся побочные эффекты расценивались как легкие или умеренно выраженные и ни в одном случае не потребовали отмены терапии АДП.
Обсуждение
В исследовании не выявлено достоверных различий в частоте развития депрессивных расстройств у больных ХГС, получающих ПВТ, и у больных без противовирусного лечения (58,3 и 55,7% соответственно). Эти данные несколько отличаются от приводимых во многих публикациях [11–14, 26] и могут быть обусловлены тем, что в обеих группах с одинаковой частотой встречается преморбидная отягощенность психической патологией.
Не выявлено корреляции тяжести депрессивной симптоматики с тяжестью проявлений основного заболевания (ХГС). Это отличает депрессии, возникающие при ХГС, от других соматогенных депрессий, для которых такая взаимосвязь характерна и описана многими авторами [4–7, 33, 34], и еще раз подчеркивает необходимость выделения отдельного клинического подтипа «депрессия при ХГС», т.е. депрессия, которая развивается у больных ХГС, не получающих ПВТ. По данным некоторых авторов, подобная депрессия, обычно неглубокая по тяжести, с преобладанием апатико-адинамической симптоматики, с хроническим волнообразным течением, на протяжении многих лет может служить единственным клиническим симптомом ХГС [1, 2, 4, 5, 7, 18, 35].
У больных ХГС даже при депрессиях тяжелой и умеренной степени разные по «силе» АДП показали высокую эффективность (до 80% ответивших на лечение после 12 нед терапии), превосходящую эффективность при эндогенных депрессиях аналогичной тяжести [36, 37]. Эта закономерность в наибольшей степени проявляется при лечении депрессий на фоне ПВТ (81,9% больных с хорошим ответом на антидепрессивную терапию против 70,0% у больных ХГС без ПВТ; статистическая тенденция стремится к уровню достоверности). В группе больных с зависимостью от ПАВ анализ эффективности АДП показал достоверно меньший уровень ответа на терапию: <55% к 12-й неделе терапии АДП. Факторы, влияющие на эффективность терапии депрессивных нарушений у больных ХГС с зависимостью от ПАВ, нуждаются в дальнейшем исследовании.
Хорошая переносимость терапии АДП у больных ХГС в нашем исследовании частично может быть обусловлена некоторым перекрыванием побочных действий ПВТ и психофармакотерапии (причем побочные эффекты ПВТ сами больные оценивали как значительно более частые и тяжелые). Так, головная боль значительно чаще развивалась в группе больных, получавших ПВТ, совпадала с гриппоподобным синдромом, сопровождающим применение ИФН-a, и не зависела от сроков и дозы назначения АДП.
Проведен анализ назначений психофармакопрепаратов больным в динамике. Изменение дозировок и/или смена антидепрессанта, назначение дополнительно препаратов других психофармакологических групп проводились при недостаточной эффективности лечения. Изучалась динамика состояния при изменении терапии. Полученные результаты позволили разработать рекомендации по лечению депрессий у больных ХГС.
При отсутствии дополнительных противопоказаний лечение впервые возникших депрессий, как ИФН-индуцированных, так и соматогенных, следует начинать с препаратов с наименьшим числом побочных действий. По нашим данным, наилучшую переносимость показал тианептин (Коаксил). У больных ХГС тианептин эффективен даже при значительной тяжести депрессивных расстройств, что делает его препаратом первого выбора. Несколько больше нежелательных побочных действий отмечается при применении препаратов группы СИОЗС (эсциталопрам, пароксетин, флувоксамин). В случае недостаточной эффективности в течение 6–8 нед терапии необходима замена АДП на миртазапин или трициклический антидепрессант (амитриптилин, кломипрамин). При выраженной бессоннице целесообразно начинать терапию с АДП с преобладанием седативного действия (миртазапин, миансерин, флувоксамин, амитриптилин), которые позволяют проводить монотерапию АДП, не прибегая к дополнительным назначениям. При лечении повторных депрессивных эпизодов эффективнее проводить терапию трициклическими АДП или миртазапином. В случае возникновения повторного депрессивного эпизода на фоне ПВТ высока эффективность применения тианептина (Коаксил). Терапия депрессивных нарушений у больных с сопутствующими болезнями зависимости требует комплексного подхода: сочетание АДП с преобладанием седативного и снотворного действия (миртазапин, миансерин, флувоксамин) с антипсихотиками и антиконвульсантами (в малых и средних дозах).
После улучшения состояния терапию АДП прекращать не следует. Если у больного сохраняются хотя бы отдельные симптомы депрессии, в том числе нерезко выраженные, терапию АДП целесообразно продолжать вплоть до завершения ПВТ. В случае полного разрешения депрессивной симптоматики через 3–4 нед после нормализации настроения возможно снижение суточной дозы АДП на 1/4. При сохранении стабильности состояния дальнейшее снижение суточной дозы препарата возможно не ранее чем через 4 нед. При возобновлении депрессивной симптоматики дозу антидепрессанта следует немедленно увеличить до терапевтической.
Таким образом, учитывая высокую частоту развития депрессий у больных ХГС и их клиническую значимость, необходимы своевременная диагностика и адекватное лечение этих расстройств. Особое внимание следует обращать на психическое состояние больных с наличием факторов риска, таких как аффективная патология и злоупотребление ПАВ в анамнезе, наличие текущих психических расстройств и генотип вируса гепатита 3А.
Широкое использование врачами-интернистами скрининговых шкал-опросников не должно исключать квалифицированного осмотра психиатром.
При лечении депрессий у больных ХГС эффективность и переносимость АДП разных групп высока и примерно одинакова, однако спектр их клинической активности несколько отличается. Дифференцированный подход к назначению антидепрессивной терапии повышает ее эффективность.
Своевременное выявление и адекватное лечение депрессий у больных ХГС позволяет эффективнее проводить терапию основного заболевания, в том числе в полном объеме применять противовирусное лечение.
Список исп. литературыСкрыть список1. Бабкин Д.И. Психические нарушения у больных хроническими диффузными заболеваниями печени. Автореф. дис. ... канд. мед. наук. М., 2001.
2. Канищев А.В. Непсихотические расстройства психической сферы у больных вирусными гепатитами (клиника, диагностика, принципы психотерапии). Автореф. дис. ... канд. мед. наук. Харьков, 2004.
3. Crone C, Gabriel MG. Comprehensive review of hepatitis C for psychiatrists: risk, screening, diagnosis, treatment and interferon-based therapy complications. J Psych Pract 2003; 9: 93–110.
4. Czarnecki M, Inglot M, Malyszczak K et al. Neuropsychiatric disorders in persons HCV infected – own observations. Epidemiol 2005; 59 (2): 431–8.
5. Dwight MM, Kowdley KV, Russo JE et al. Depression, fatigue, and functional disability in patients with chronic hepatitis C. J Psychosom Res 2000; 49: 311–7.
6. Fontana RJ, Hussain KB, Schwartz SM et al. Emotional distress in chronic hepatitis C patients not receiving antiviral therapy J Hepatol. 2002; 36 (3): 401–7.
7. McDonald J, Jayasuriya R, Bindley P et al. Fatigue and psychological disorders in chronic hepatitis C. J Gastroenterol Hepatol 2002; 17 (2): 171–6.
8. Игнатова Т.М. Хронический гепатит С: клинико-морфологическая характеристика, течение, лечение. Автореф. дис. … докт. мед. наук. М., 2000.
9. Морозов А.О. Депрессии у больных хроническим вирусным гепатитом С, получающих противовирусную терапию. Автореф. дис. ... канд. мед. наук. М., 2006.
10. Ademmer K, Beutel M, Bretzel R et al. Suicidal ideation with IFN-alpha and ribavirin in a patient with hepatitis C. Psychosomatics 2001; 42 (4): 365–7.
11. Fontana RJ. Neuropsychiatric toxicity of antiviral treatment in chronic hepatitis C. Dig Dis 2000; 18: 107–16.
12. Loftis JM, Hauser P. The phenomenology and treatment of interferon-induced depression. J Affect Disord 2004; 82 (2): 175–90.
13. Raison CL, Borisov AS, Broadwell SD et al. Depression during pegylated interferon-alpha plus ribavirin therapy: prevalence and prediction. J Clin Psychiat 2005; 66 (1): 41–8.
14. Scalori A, Pozzi M, Bellia V et al. Interferon-induced depression: prevalence and management. Dig Liver Dis 2005; 37 (2): 102–7.
15. De Bie J, Robaeys G, Buntinx F. Acta Gastroenterol Belg. Hepatitis C, interferon alpha and psychiatric co-morbidity in intravenous drug users (IVDU): guidelines for clinical practice. 2005; 68 (1): 68–80.
16. Beratis S, Katrivanou A, Georgiou S et al. Major depression and risk of depressive symptomatology associated with short-term and low-dose interferon-alpha treatment. J Psychosom Res 2005; 58 (1): 15–8.
17. Bonaccorso S, Marino V, Puzella A et al. Increased depressive ratings in patients with hepatitis C receiving interferon-alpha-based immunotherapy are related to interferon-alpha-induced changes in the serotonergic system. J Clin Psychopharmacol 2002; 22: 86–90.
18. Hilsabeck RC, Hassanein TI, Carlson MD et al. Cognitive functioning and psychiatric symptomatology in patients with chronic hepatitis C Journal of the International Neuropsychological Society 2003; 9: 847–54.
19. Dominique L, Musselman MD, David H et al. Paroxetine for the prevention of depression induced by high-dose interferon alfa. N Engl J 2001; 344 (13).
20. Kraus MR, Schafer A, Al-Taie O, Scheurlen M. Prophylactic SSRI during interferon alpha re-therapy in patients with chronic hepatitis C and a history of interferon-induced depression. J Viral Hepat 2005; 12 (1): 96–100.
21. Kraus MR, Schafer A, Schuttker K et al. Therapy of interferon-induced depression in chronic hepatitis C with citalopram: a randomised, double-blind, placebo-controlled study. Gut 2008; 57 (4): 531–6.
22. Kalyoncu OA, Tan D, Mirsal H et al. Major depressive disorder with psychotic features induced by interferon-alpha treatment for hepatitis C in a polydrug abuser. J Psychopharmacol 2005; 19 (1): 102–5.
23. Schaefer M, Hinzpeter A, Mohmand A et al. Hepatitis C treatment in "difficult-to-treat" psychiatric patients with pegylated interferon-alpha and ribavirin: response and psychiatric side effects. Hepatology 2007; 46 (4): 991–8.
24. Schaefer M, Schwaiger M, Garkisch AS et al. Prevention of interferon-alpha associated depression in psychiatric risk patients with chronic hepatitis C. J Hepatol 2005; 42 (6): 793–8.
25. Кинкулькина М.А., Морозов А.О. Депрессии при противовирусной терапии хронических гепатитов: опыт применения коаксила. Психиат. и психофармакотер. 2003; 5: 198–200.
26. Asnis GM, De La Garza R 2nd. Interferon-induced depression: strategies in treatment. Prog Neuropsychopharmacol Biol Psychiatry. 2005; 29 (5): 808–18.
27. Gleason OC, Yates WR, Isbell MD, Philipsen MA. An open-label trial of citalopram for major depression in patients with hepatitis C. J Clin Psychiatry 2002; 63 (3): 194–8.
28. Maddock C, Baita A, OrrЭ MG et al. Psychopharmacological treatment of depression, anxiety, irritability and insomnia in patients receiving interferon-a. J Psychopharmacol 2004; 18 (1).
29. Morasco BJ, Rifai MA, Loftis JM et al. A randomized trial of paroxetine to prevent interferon-alpha-induced depression in patients with hepatitis C. J Affect Disord 2007; 103 (1–3): 83–90.
30. Schramm TM, Lawford BR, Macdonald GA, Cooksley WG. Sertraline treatment of interferon- alfa-induced depressive disorder. Med J Aust 2000; 173: 359–61.
31. Чередниченко Н.В., Альтшулер В.Б. Количественная оценка структуры и динамики патологического влечения к алкоголю у больных алкоголизмом. Вопр. наркол. 1992; 3: 14–7.
32. Иванец Н.Н., Винникова М.А. Диагностические критерии тяжести патологического влечения к наркотику. Журн. невропатол. и психиатр. им. С.С.Корсакова. 2001; 101 (8): 4–8.
33. Краснов В.Н. Депрессии в общей медицинской практике. Психиат. и психофармакотер. 2002; 5: 181–3.
34. Смулевич А.Б. Депрессия в общемедицинской практике. М., 2000.
35. Saunders JC. Neuropsychiatric symptoms of hepatitis C. Issues Ment Health Nurs. 2008; 29 (3): 209–20.
36. Мосолов С.Н., Вовин Р.Я., Пантелеева Г.П. Клиническая эффективность и переносимость препарата коаксил (тианептин) при терапии депрессии. Журн. неврол. и психиатрии им. С.С.Корсакова. 2003; 8: 29–34.
37. Мосолов С.Н., Костюкова Е.Г., Граненов Г.М. и др. Эффективность и переносимость миртазапина (ремерон) при умеренной и тяжелой депрессии и депрессиях, резистентных к первому курсу терапии трициклическими антидепрессантами. В кн.: Новые достижения в терапии психических заболеваний. Под ред. С.Н.Мосолова. М.: Бином, 2002; с. 278–91.
16 октября 2009
Количество просмотров: 2814


