Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Данные обзоры подготовлены по материалам 26-го Конгресса Европейской коллегии нейропсихофармакологии (октябрь 2013 года, Барселона) участниками проекта «Восточноевропейская академия Всемирной психиатрической ассоциации и компании «Сервье» специально для психиатрических журналов
Зоны 10 ВПА (East European Educational WPA-Servier Academy – «EEE WPA-Servier Academy»)
Резюме. В статье отражены аспекты развития современной концепции негативных симптомов шизофрении. Обзор охватывает последние данные о патофизиологии, генетических детерминантах, нейробиологии дефицитарных расстройств, а также связанных с ними нарушениях психосоциального функционирования больных. В деталях обсуждаются вопросы разработки оценочного инструментария и новые подходы фармакотерапии в рамках комплексного лечения шизофрении с преобладанием негативных симптомов.
Ключевые слова: негативные симптомы, психофармакотерапия, социальное функционирование, шизофрения.
Negative symptoms in schizophrenia in a focus of researcher, clinician and patient (upon materials of the 26th Congress of the European college of neuropsychopharmacology)
D.A.Smirnova
Psychiatry, Narcology, Psychotherapy and Clinical Psychology Department of Samara State Medical University
Summary. The article describes the modern aspects of the concept of negative symptoms in schizophrenia. Review includes the recent information on the pathophysiology, genetic determinants, neurobiology of deficitary symptoms and related impairment in psychosocial functioning in patients. The issues of development of tools for evaluation of negative symptoms and new approaches in pharmacotherapy within the complex treatment of schizophrenia with a predominance of negative symptoms are discussed in details.
Key words: functional outcome, negative symptoms, schizophrenia, psychopharmacotherapy.
В рамках 26-го Конгресса Европейской коллегии нейропсихофармакологии целый ряд докладов был посвящен проблеме негативной симптоматики при шизофрении. Так, один из симпозиумов носил название «Проливая свет на негативные симптомы: клиническое значение для практикующих психиатров». Ведущие международные эксперты в области психиатрии, освещая вопросы влияния негативных расстройств на клиническую динамику, качество жизни и социальное функционирование пациентов с шизофренией, поделились своим профессиональным мнением по поводу перспектив решения проблем, с которыми имеют дело врачи, пациенты и их близкие в повседневной практике, сталкиваясь с такими сложными для диагностики и истощающими психическую деятельность симптомами. Пристальный исследовательский взгляд на негативные симптомы шизофрении позволяет сформировать вызов традиционному мышлению клиницистов и по-новому определить тактику и мишени лечения этой социально значимой группы заболеваний.
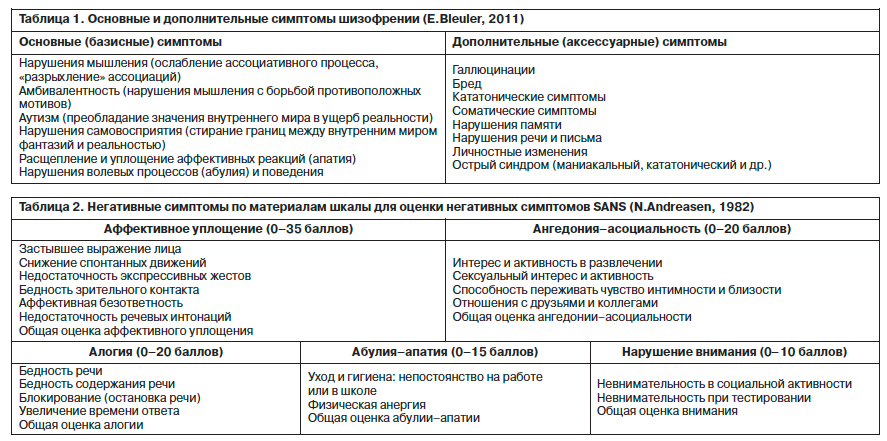
Обозначая исторический экскурс с его основными вехами в развитии теории о негативных симптомах, профессор упомянул понятия абулии E.Kraepelin (1898 г.), правила четырех «А» E.Bleuler (1911 г.), «динамического опустошения» W.Janzarik (1959 г.), первичных и вторичных негативных расстройств в работах J.Strauss, W.Carpenter, J.Bartko (1974 г.). Именно E.Bleuler, определив термин «шизофрения», предложил в большей мере акцентировать внимание на диагностике основных симптомов, которыми он считал «минус-симптомы», симптомы «выпадения» и утраты психический функций, в то время как продуктивные расстройства, по его мнению, являлись дополнительными и неспецифическими (табл. 1).
При этом негативные симптомы подразделялись на первичные и вторичные. К первичным относили ядерные нарушения шизофрении в форме так называемого дефицитарного синдрома, который проявляется еще в доманифестный период, существенно влияет на социальное функционирование больных и является камнем преткновения в терапии шизофрении. Вторичные симптомы являются следствием болезненного процесса, искаженной адаптации в болезни, влияния средовых факторов и медикаментозной терапии (J.Strauss и соавт., 1974). Например, паранойя или погружение в психотические переживания может спровоцировать социальную изоляцию, депрессия может вызвать ангедонию, снижение мотивации и социальную отгороженность, антипсихотическое лечение – акинезию и уплощенный аффект, а уменьшение контроля за пациентами в больничных учреждениях – проблемы мотивации и снижение инициативности.
Более подробно профессор J.Haro остановился на современной концепции, в рамках которой, по его мнению, до сих пор свежи взгляды N.Andreasen (1979 г.) и T.Crow (1980 г.). В 1979 г. профессор Университета Айовы (США) N.Andreasen выделила типы шизофрении с преимущественной позитивной, преимущественной негативной и смешанной симптоматикой и разработала шкалу для оценки негативных симптомов (Scale for the Assessment of Negative Symptoms – SANS, 1982). В первоисточнике шкала состояла из 30 признаков, впоследствии 5 из них были удалены в связи с низкой надежностью. Конечная версия валидизированной шкалы SANS включает 25 признаков (общий балл – 0–125), описывающих 5 негативных симптомов (табл. 2). Вступая в эру доказательной медицины, профессор N.Andreasen своими практическими разработками положила важное начало операциональной диагностике негативных симптомов. Одновременно с этим профессор T.Crow (1980 г.) из Клинического исследовательского центра г. Мидлсекс (Великобритания), основываясь на фактах корреляции негативных симптомов и когнитивных нарушений при шизофрении с нейробиологическими находками расширения желудочков мозга, отсутствия терапевтического влияния типичных дофаминблокирующих нейролептиков на негативную симптоматику и отрицательной корреляции повышения плотности дофаминовых рецепторов с негативными расстройствами, предложил выделять два базовых процесса при шизофрении и два типа шизофрении: 1-й тип – с позитивной симптоматикой, 2-й тип – с преобладанием негативной симптоматики и нарастающими когнитивными расстройствами (не реагирующий на терапию, с нарушением поведения, неврологической симптоматикой и моторными нарушениями).
В рамках диагностических критериев Руководства по диагностике и статистике психических расстройств 4-го издания (Diagnostic and Statistical Manual of mental disorders, 4th edition, Text Revision – DSM IV-TR, 2000 г.) к негативным симптомам стали относить 3 основных психопатологических признака: аффективное уплощение, алогию и абулию. В структуре аффективного уплощения описывали характерные обеднение мимических реакций, обездвиженность лица, недостаточный зрительный контакт (избегание взгляда в глаза), невыразительность пантомимики и движений. Алогию определяли как бедность речи, при которой ответы пациентов становились короткими и утрачивали содержание, а абулию – как безынициативность и утрату устойчивой целенаправленной деятельности. Дополнительными негативными симптомами считались когнитивные нарушения, ангедония, неадекватный аффект. В то же время в комментариях к классификации указывались сложности диагностики данных негативных симптомов и их неспецифичность, возможность их вторичного возникновения за счет эффектов психотропных препаратов, других психопатологических нарушений, факторов окружающей среды, в связи с которыми их не рассматривали в рамках критерия диагностики. В Международной классификации болезней 10-го пересмотра (МКБ-10) негативные симптомы представлены апатией, бедностью речи, неадекватностью или сглаженностью эмоциональных реакций и социальной отгороженностью.
Значимость проблемы негативной симптоматики до настоящего периода времени подчеркивает выраженный и растущий публикационный интерес. По данным англоязычной текстовой базы данных медицинских и биологических публикаций PubMed, созданной Национальным центром биотехнологической информации (National Center for Biotechnological Information – NCBI) на основе раздела «биотехнология» Национальной медицинской библиотеки США (National Library of Medicine – NLM), количество полнотекстовых статей, посвященных негативным симптомам, выросло с 1100 в 1980 г., что составляет 5%, до показателя 4600 в 2012 г., что соответствует 20% от числа всех статей, опубликованных по теме шизофрении (PubMed search, 2012).
В исследованиях с использованием позитронно-эмиссионной томографии было выявлено, что у больных шизофренией с преобладанием негативной симптоматики (алогия, эмоциональное уплощение, абулия и нарушения внимания) по сравнению с пациентами с преобладанием позитивных симптомов имеются более выраженные метаболические нарушения, в частности в лобной, височной и мозжечковой областях. Негативные симптомы ассоциированы с низким уровнем метаболизма глюкозы в правом полушарии, особенно в коре височной доли и вентральной области префронтальной коры; повышенный уровень метаболизма в коре мозжечка и сниженный – в нижних глубоких ядрах мозжечка (S.Potkin и соавт., 2002). Существенное уменьшение толщины слоя серого вещества в орбитофронтальной области статистически значимо коррелирует с более тяжелой негативной симптоматикой (rs=-0,76; p=0,006), дефицитом зрительной памяти, вербальной памяти и снижением показателя семантической беглости у больных шизофренией (W.Baaré и соавт., 1999).
Ассоциированные с искаженным метаболизмом изменения дофаминовой нейротрансмиссии в кортико-кортикальных, кортико-базальных ганглиях и мезокортикальной области, низкий уровень проведения импульсов по мозжечково-таламо-фронтальному пути и дисфукция кортико-таламо-мозжечково-кортикальной петли обратной связи (S.Potkin и соавт., 2002) подтвердили связанный с негативными симптомами феномен когнитивной дисметрии (N.Andreasen и соавт., 1999), проявляющийся в нарушении синхронизации психических процессов, в том числе «обеспечения своевременно быстрого, в должной мере плавного выполнения сложных моторных актов» и реализации «контроля и согласования постоянно меняющейся психической активности».
Несмотря на то что внимание проблеме негативных расстройств со стороны исследователей и клиницистов было уделено достаточно, ни один лекарственный препарат к 2000 г. так и не получил одобрения со стороны Управления по контролю качества пищевых продуктов и лекарственных препаратов Министерства здравоохранения и социальных служб США (Food and Drug Administration – FDA) на внесение в список такого показания для назначения, как «негативные симптомы» (B.Kirkpatrick и соавт., 2006).
Исследования последнего десятилетия XX в. не подтвердили первичной гипотезы о достаточной эффективности антипсихотиков II поколения в отношении редукции негативной симптоматики (R.Keefe и соавт., 1999). Важно отметить, что выводы в работах по атипичным нейролептикам преувеличивали возможности влияния нового поколения антипсихотиков на собственно негативные симптомы, в основном ссылаясь на те факты, что атипичные антипсихотики были более благополучны в отношении вторичных негативных симптомов и разница с I поколением антипсихотиков в их влиянии на негативные симптомы могла быть объяснена именно эффектом в рамках вторичных негативных симптомов, в то время как удельный вес терапевтического влияния в отношении суммарного негативного домена был незначительным или, точнее, не могло идти речи о специфичности терапевтического действия атипичных антипсихотиков на негативный домен. При этом следует понимать, что разделение на позитивные и негативные домены – это часть теоретической концепции, которая определила единственно верный, но медленный путь к горизонтам, которых мы еще не увидели.
Этот период в фармакотерапии шизофрении можно назвать периодом новой веры во II поколение антипсихотиков. Нельзя не заметить, что теоретические описания механизма действия атипичных антипсихотиков с селективной блокадой дофаминовых рецепторов в противовес широкому спектру действия и опосредованным влиянием через серотониновые рецепторы на повышение дофаминергической активности в лобных отделах (мишени негативных симптомов) были важной вехой и якорем надежды в «реках» попыток вмешаться в процесс болезни, сравнимый не только со стихией сопротивляющегося и необъятностью живущего своей жизнью океана, но и с теми подводными камнями и скалами, которые так и не позволяют выбраться на берег и прочно ощутить опору под ногами.
В рамках предложенного направления NIMH научные гипотезы продолжали разрабатываться, а доказательства – накапливаться, все четче очерчивая тему уникальности домена негативных симптомов и обозначая актуальность и целесообразность поиска новых терапевтических вмешательств, подразумевавших, по всей видимости, как новые группы препаратов, так и систему нефармакологических интервенций. Посмертные морфологические и генетические исследования последних лет XXI столетия подтвердили не только роль уже описанных изменений дофаминергической трансмиссии, но и изменений серотонинергической системы, задействования определенных зон мозга в патофизиологии негативных симптомов, а ряд препаратов продемонстрировал возможности коррекции негативных симптомов.
Швейцарская группа ученых провела исследование зависимости от громкости слуховых вызванных потенциалов (the loudness dependence of auditory evoked potentials – LDAEP) – маркера центральной активности 5-HT-серотонинергических рецепторов, которое показало, что у больных шизофренией отмечаются значительно более высокие показатели LDAEP в обоих полушариях по сравнению с контрольной группой здоровых лиц. Показатель LDAEP в правом полушарии у пациентов связан с более выраженным уровнем негативных симптомов, в то время как корреляции с позитивными симптомами выявлено не было. Данное исследование доказало снижение центральной серотонинергической нейротрансмиссии у больных с преобладанием негативных симптомов в клинике болезни (C.Wyss и соавт., 2013).
В исследовании, проведенном группой китайских ученых под руководством профессора T.Mwansisya и опубликованном в ведущем журнале «Schizophrenia Research» в 2013 г., на основании сравнения данных функциональной магнитно-резонансной томографии у 41 пациента с первым психотическим эпизодом шизофрении и 33 здоровых лиц группы контроля было доказано наличие нарушений межполушарных связей в состоянии покоя в бледном шаре, медиальной лобной извилине и нижней височной извилине. При этом найдены позитивные корреляции между данными по шкале Векслера для оценки интеллекта у взрослых (Wechsler Adult Intelligence Scale – WAIS) и нарушением межполушарных связей в палеостриатуме (rho=0,335; p=0,003) и медиальной лобной извилине (rho=0,260; p=0,025). Кроме того, было обнаружено, что нарушения связей в палеостриатуме находятся в позитивной корреляции с фактором длительности заболевания (rho=-0,407; p=0,009), нарушенные межполушарные нейрональные связи в нижней височной извилине коррелируют с баллом по шкале для оценки негативных симптомов SANS (rho=0,393; p=0,012). Авторы делают выводы о том, что нарушенные межполушарные связи, в частности в палеостриатуме, благодаря его тесным анатомическим и функциональным связям с другими отделами, включая корковые представительства, могут рассматриваться в качестве того самого первичного изменения, которое предрасполагает к формированию когнитивных расстройств, негативных симптомов и хроническому течению шизофрении (T.Mwansisya и соавт., 2013). Результаты исследования объясняют, что развитие когнитивных и негативных расстройств, а также хронификация процесса болезни связаны с одними и теми же морфофункциональными субстратами.
Последние исследования показывают, что у пациентов с шизофренией снижена амплитуда волны P300, что отражает патофизиологические изменения и тяжесть симптоматики болезни, в частности соотносимую с выраженностью негативных симптомов (D.Kim и соавт., 2013).
Нарушения потенциала P300 при шизофрении изучались в ракурсе взаимосвязи снижения активности источника потенциала и тяжести симптомов у пациентов. Запись волны P300 проводили у 34 пациентов с шизофренией и здоровых группы контроля, используя так называемую auditory odd ball paradigm (auditory odd ball paradigm – это метод, используемый для исследования вызванных потенциалов, с помощью которых изучают нейрональные реакции на непредсказуемые, но узнаваемые события, предъявляя испытуемому череду стимулов, обычно слуховых или визуальных. Субъекта исследования просят реагировать, либо подсчитывая, либо нажимая на кнопку, при появлении определенных стимулов-мишеней, скрытых в серии общих стимулов, которые в эксперименте обычно не требуют какого-то иного ответа на них. Было обнаружено, что вызванные потенциалы от теменно-центральной области приблизительно составляют 300 ms и увеличиваются в ответ на стимулы-мишени, эти потенциалы и были названы P300. Вызванный потенциал P300 представляет собой электрическую реакцию мозга на внешний раздражитель или на выполнение умственной (когнитивной) задачи. Волна P300 – это эндогенный потенциал, так как его возникновение связано не с физическим проявлением стимула, а с реакцией человека на него. – Прим. авт.).
Исследователи обнаружили, что амплитуда волны P300 значимо снижена относительно срединных электродов и в обеих билатеральных височных зонах у больных шизофренией по сравнению со здоровыми. Относительно параметра источника активности потенциала выяснилось, что у больных шизофренией отмечается снижение его активности преимущественно в левом полушарии, включая поясную, нижнюю затылочную, среднюю затылочную, среднюю височную, заднюю поясную, верхнюю затылочную извилины и предклинье больших полушарий. Кроме того, метод контрастирования областей активации волны продемонстрировал негативную корреляцию изменений в средней височной, задней поясной, верхней затылочной извилинах и предклинье больших полушарий с уровнем негативной симптоматики по шкале позитивной и негативной симптоматики (Positive and Negative Syndrome Scale – PANSS), в то время как сниженная активность источника волны P300 у больных шизофренией с негативной симптоматикой, как делают выводы ученые, может быть отражением дефицита в лобно-височно-теменной зоне (D.Kim и соавт., 2013).
Накоплены обширные данные о функциональных нарушениях NMDA-рецепторов в лимбических отделах головного мозга, так называемой NMDA-гипофункции, которая объясняет многие аспекты молекулярных, клеточных и поведенческих нарушений, наблюдаемых при шизофрении (C.Tamminga, 1999; J.Coyle, 2006). Исследования показывают, что NMDA-гипофункция (NMDA-рецепторы участвуют в процессах памяти и обучения) играет роль в формировании нейропрогрессирующего характера болезни, негативных симптомов и когнитивного дефицита. Работы ученых показывают важное значение генетических и эпигенетических (средовых) факторов в развитии этого феномена.
Так, M.Snyder и соавт. (2013 г.) описывают общие сигнальные пути, объединяющие гены риска развития шизофрении DISC1 (Disrupted In Schizophrenia 1 – нарушенный при шизофрении-1 ген), нейрорегулина 1 и дисбиндина, обращая внимание на путь AKT/GSK3b и то, что данные мутации и генетические взаимодействия приводят к формированию NMDA-гипофункции в процессе развития.
При подавлении экспрессии дисбиндина в эксперименте in vitro в нейронах повышается экспрессия дофаминовых D2-рецепторов (Y.Iizuka и соавт., 2007). AKT – это ген, кодирующий a-серин/треониновую протеинкиназу (протеинкиназа В) и участвующий в путях, которые обеспечивают выживание клеток путем ингибирования апоптоза, играет ключевую роль в таких клеточных процессах, как метаболизм глюкозы, клеточная пролиферация, транскрипция и миграция клеток. AKT требуется для инсулин-индуцируемой транслокации транспортера глюкозы 4 (GLUT 4) в плазматическую мембрану. GSK3b – ген, кодирующий киназу-3 гликогенсинтетазы, которая может быть ингибирована фосфорилированием AKT, что вызывает синтез гликогена. Показано, что стимуляция дофаминовых D3-рецепторов в животных моделях на мышах также активизирует путь AKT/GSK3b в шипиковых нейронах средних размеров в прилежащем ядре и в задней части скорлупы, и этот феномен рассматривают в ракурсе инновационного терапевтического влияния лигандов D3-рецепторов на процессы подкрепления, когнитивные функции, нарушенные при шизофрении (M.Salles и соавт., 2013).
Интересной также представляется работа швейцарской группы ученых под руководством M.Schneider (2013 г.), посвященная преобладанию негативных симптомов при синдроме делеции 22q11.2 хромосомы (22q11.2 deletionsyndrome, 22q11.2DS) и его взаимосвязи с когнитивным функционированием и общим функциональным прогнозом у больных шизофренией. Синдром делеции 22q11.2DS уже был описан в рамках нейрогенетических состояний, которые связаны с повышенным риском развития шизофрении. При этом не было получено данных о том, в какой мере позитивные и негативные симптомы психоза представлены у лиц с данным синдромом и могут ли быть выявлены симптоматические паттерны, соотнесенные с ним.
В исследовании применялся кластерный анализ, который позволил выделить группы пациентов с определенными симптоматическими паттернами, чтобы впоследствии сравнить больных из разных кластеров по ряду когнитивных показателей и функциональному прогнозу. Исследование показало, что среди 63 подростков и молодых людей с синдромом 22q11.2DS 1/3 часть обнаружили преобладание негативных симптомов, сопряженных со специфическим когнитивным дефицитом и функциональным прогнозом. Из 3 выделенных групп – с низким уровнем выраженности симптомов, преобладанием негативных симптомов и высоким уровнем выраженности симптомов – в кластере с преобладанием негативных симптомов были обнаружены более низкие показатели зрительной памяти и скорости обработки информации по сравнению с группой с низким уровнем выраженности симптомов, а также наиболее низкий уровень функционирования и трудового прогноза (M.Schneider и соавт., 2013).
В DSM V (2013 г.), где рубрика «295.0 (F 20.9) Шизофрения» в разделе «Расстройства шизофренического спектра и другие психотические расстройства» утратила формы шизофрении и апеллирует в большей мере к спецификации течения, и критерий негативного домена претерпел изменения и в связи с данными об отсутствии специфичности других симптомов включает только два феномена – уменьшение эмоциональной выразительности (diminished emotional expression, снижение эмоциональной экспрессии) и абулию (avolition, безволие).
Таким образом, теоретические описания N.Andreasen и дихотомическая концепция T.Crow повели за собой целый ряд морфологических, патофизиологических, биохимических и генетических исследований, которые «позволили объяснить клинические феномены с современных… позиций субстратных мозговых нарушений» и «выступили в роли связующего звена между клиническим и нейробиологическим подходами при изучении шизофрении» (С.Н.Мосолов, 2001). Вместе с промежуточной оценкой успехов фармакотерапии они в свою очередь также простимулировали целенаправленную исследовательскую активность в отношении разработки новых фармакотерапевтических подходов и моделей комплексного лечения больных шизофренией.
Необходимо отметить, что конкретную базу для развития терапевтического направления заложили результаты конференции NIMH в связи с ее четко установленной областью соглашения – консенсусом по 11 основным пунктам, опубликованным в материалах статьи рабочей группы под руководством B.Kirkpatrick в журнале «Schizophrenia Bulletin» в 2006 г.:
Последний пункт соглашения, с одной стороны, еще раз методологически уточнил формулировку концепции ожидаемых на том этапе исследований, а с другой стороны – внес диссонанс и расширил границы изучения. Шкала SANS и критерии N.Andreasen очень четко определяли негативный домен, практически сепарируя его от когнитивных симптомов, в то время как шкала PANSS в субшкале негативных синдромов включала перекрытия негативного и когнитивного доменов (Н1 – притупленный аффект, Н2 – эмоциональная отгороженность, Н3 – обедненный раппорт, Н4 – пассивно-апатическая социальная отгороженность, Н5 – нарушения абстрактного мышления, Н6 – нарушения спонтанности и плавности диалога, Н7 – стереотипное мышление), как бы намекая на теорию T.Crow о типах шизофрении, где 2-й тип с преобладанием негативной симптоматики характеризовался и выраженным нейрокогнитивным дефицитом. Кроме того, как отметил профессор D.Taylor (Лондонский королевский колледж, Великобритания), в шкале PANSS субшкала общей психопатологии также апеллирует к негативным симптомам – например: в пунктах О13 – абулия и О16 – активное социальное избегание и, возможно, в пунктах О5 – манерность и позирование и О7 – моторная заторможенность.
Таким образом, благодаря формулировке 11-го пункта искусственный консенсус NIMH стал утверждать не только, на первый взгляд, исключительно исследовательскую перспективу – «мы должны приложить все усилия, чтобы научиться выявлять и лечить негативные симптомы», но и очень важную клиническую реальность – «мы должны осуществить новую попытку научиться лечить “негативный тип” шизофрении и шизофрению в целом».
Метаанализ, целью которого являлось сравнение эффективности II поколения антипсихотиков в терапии негативных симптомов шизофрении, показал, что большинство атипичных антипсихотиков достоверно эффективно в отношении негативных симптомов, но их эффективность является продуктзависимой и несколько меньше эффективности в отношении всей симптоматики в целом (J.Darbà и соавт., 2013).
Работа испанских ученых состояла из двух разделов – анализа двойных слепых рандомизированных клинических исследований, опубликованных на английском языке в ведущих базах данных PubMed, the Cochrane Central Register of Controlled Trials (CENTRAL), Proquest Health and Medical Complete, Science Citation Index Expanded, и Current Contents Connect в период с 1966 по 2006 г., посвященных сравнению монотерапии атипичным антипсихотиком с плацебо (из 43 исследований отобрано по критериям включения 18 работ, терапия от 6 до 52 нед) и с галоперидолом (из 26 исследований отобрано 10, продолжительность терапии 6–28 нед) на популяции 4 тыс. пациентов. Оценка негативных симптомов в проанализированных работах проводилась с помощью шкал SANS, модифицированной версии SANS summary (сумма общих оценок субшкал SANS), субшкалы негативных симптомов PANSS (PANSS-N) и Краткой психиатрической оценочной шкалы (Brief Psychiatric Rating Scale – BPRS), в частности – фактора ретардации, определяемого суммой баллов по пунктам 3 (эмоциональная отгороженность), 13 (моторная заторможенность) и 16 (притупленный аффект). Результаты сравнения с плацебо указали на то, что отдельные атипичные антипсихотики эффективны в терапии негативных симптомов по сравнению с плацебо, хотя и сила эффекта является средней или низкой (значения статистического показателя силы эффекта d Кохена: амисульприд – 0,52, оланзапин – 0,43, зипразидон – 0,46, рисперидон – 0,40, кветиапин – 0,36).
Кроме того, метаанализ показал, что галоперидол оказался также эффективным в терапии негативной симптоматики в сравнении с плацебо, а также сравнимым по эффективности с кветиапином и превышающим эффективность зотепина. Однако амисульприд, зипразидон, оланзапин и рисперидон являются более эффективными в отношении редукции негативных симптомов, чем галоперидол. Из всех исследованных атипичных антипсихотиков амисульприд и зипразидон оказались наиболее эффективны. Сравнение антипсихотиков с галоперидолом продемонстрировало наличие лишь общей тенденции к их большей эффективности за исключением кветиапина, который показал не эквивалентную, как в первой части метаанализа с плацебо, а даже меньшую его эффективность в сравнении с галоперидолом (J.Darbà соавт., 2013).
Анализ 23 рандомизированных контролируемых исследований по оценке эффективности антидепрессантов группы селективных ингибиторов обратного захвата серотонина (миртазапин, ребоксетин, миансерин, тразодон, ритансерин, циталопрам, флуоксетин, флувоксамин, пароксетин, сертралин) в качестве дополнительной терапии негативных симптомов шизофрении у 819 больных (из 455 публикаций 5 ведущих баз данных были отобраны 22 работы) показал статистические значимые различия в пользу антидепрессанта (SMD=-0,48) (S.Singh соавт., 2010). Значение статистического показателя силы эффекта d Кохена составило -0,48, что соответствует уровню средней силы. Однако нужно отметить, что предыдущий метаанализ показал большую силу эффекта (SMD=-0,71) (C.Rummel и соавт., 2005). Антидепрессанты в качестве дополнительной терапии показывают не только статистическую, но и демонстрируют клиническую значимость, хотя до сих пор продолжается дискуссия на тему того, является ли редукция негативных симптомов шизофрении вторичной по отношению к коррекции собственно депрессивных расстройств. Ограничением метаанализа является отсутствие оценки работ по применению трициклических антидепрессантов, венлафаксина и ингибиторов моноаминоксидазы. Из рассмотренных в исследованиях препаратов группы селективных ингибиторов обратного захвата серотонина наибольшую эффективность продемонстрировали флуоксетин, тразодон и ритансерин. При этом 3 из 4 работ по флуоксетину показали отрицательный результат, и сила эффекта была ниже по сравнению с тразодоном и ритансерином (S.Singh соавт., 2010). В работах по применению тразодона в сочетании с антипсихотиком указывается на его эффективность в отношении редукции тяжести негативных симптомов резидуальной шизофрении, в частности аффективного притупления, уплощения и алогии, а также безопасность применения тразодона и отсутствие экзацербации психоза на его фоне. Ритансерин как антагонист 5-НТ2С-рецепторов имеет дополнительный существенный антидофаминергический эффект, на который авторы ссылаются, объясняя активность препарата в отношении негативных симптомов шизофрении.
В моделях на животных было показано, что антагонисты a2-адренергических рецепторов способны увеличивать дофаминергическую активность в префронтальной коре, снижение которой коррелирует с негативной симптоматикой при шизофрении. В метаанализе E.Hecht (2012 г.) из Университета Майами было оценено влияние антагонистов a2-адренергических рецепторов (миансерин, миртазапин) на негативные расстройства в качестве дополнения к основной терапии с помощью антагонистов D2-рецепторов. Анализ 8 рандомизированных плацебо-контролируемых исследований из базы PubMed, включавших от 18 до 41 больных и продолжавшихся от 4 до 8 нед, показал разницу относительно редукции позитивных симптомов 0,16 (95% доверительный интервал – ДИ -0,30 до 0,62), негативных симптомов – 0,84 (95% ДИ 0,17–1,51), по шкале общей психопатологии – 0,28 (95% ДИ -0,08–0,64) и в целом – 80 (95% ДИ 0,15–1,46). При этом улучшение в отношении негативных симптомов было независимым от улучшения в рамках депрессивных расстройств, что было доказаноданными шкалы для оценки депрессии Гамильтона (Hamilton Psychiatric Rating Scale for Depression – HDRS) в 3 из 5 исследований. Выводы метаанализа указывают на то, что антагонисты a2-адренергических рецепторов повышают эффективность антагонистов D2-рецепторов в лечении шизофрении благодаря редукции негативной симптоматики (E.Hecht и соавт., 2012).
Учитывая гипотезу о роли антиоксидантов в патофизиологии шизофрении, метаанализ V.Singh и соавт. (2010 г.) оценил 6 рандомизированных исследований из ведущих баз данных (PubMed, Cochrane Library, EMBASE, CINAHL, PsycINFOи AMED) о влиянии гинкго и его дериватов в роли дополнительной терапии. Всего было проанализировано 466 случаев с применением гинкго и 362 случая с добавлением плацебо, при этом уровень симптомов до и после терапии оценивался по шкалам SANS, а также BPRS и по шкале оценки выраженности физиологических нарушений (Simplified Acute Physiology Score – SAPS). Статистически значимая разница (SMD=-0,50) свидетельствовала в пользу улучшения как по показателю общей симптоматики, так и по шкале негативных симптомов при хронической шизофрении (S.Singh соавт., 2010).
Не менее интересным представляется исследование V.Levkovitz и соавт. (2010 г.) по включению в терапию шизофрении полусинтетического антибиотика из группы тетрациклинов – миноциклина. Известно, что миноциклин применяется при ряде неврологических расстройств, оказывает влияние на дофаминергическую систему и ингибирует активность микроглии. Гипотеза о его потенциале в лечении шизофрении и влиянии на глутаматергическую систему через ингибирование синтазы оксида азота, участвующего в процессах нейротрансмиссии, и препятствование развитию нейротоксичности, вызываемой окисью азота, была доказана в моделировании на животных. В двойном слепом рандомизированном плацебо-контролируемом исследовании приняли участие 70 пациентов с начальной стадией шизофрении. Всем пациентам было назначено лечение антипсихотиками (рисперидон, оланзапин, кветиапин или клозапин в дозе, эквивалентной 200–600 мг хлорпромазина в сутки) за 14 дней или менее до присоединения к терапии миноциклина в дозе 200 мг/сут. Негативные симптомы оценивались с помощью шкалы SANS, также проводилась оценка клиники, когнитивных функций и общего функционирования (шкала общего клинического впечатления – Clinical Global Impressions scale, CGI). Миноциклин продемонстрировал хорошую переносимость, существенную эффективность в отношении негативных симптомов и общего функционирования, а также когнитивных, исполнительных функций, таких как рабочая память, переключаемость и планирование (Y.Levkovitz соавт., 2010).
Другой метаанализ S.Singh и соавт. (2011 г.) был посвящен сравнительной оценке эффективности модуляторов NMDA-рецепторов (D-серин, N-ацетилцистеин, глицин, саркозин). Из баз данных PubMed, Cochrane Library, EMBASE, CINAHL® и PsycINFO были отобраны 1253 случая по материалам 29 двойных слепых рандомизированных плацебо-контролируемых исследований. Было доказано, что эффективность модуляторов NMDA-рецепторов является небольшой по силе выраженности в отношении негативных симптомов (SMD=-0,27) и средней для общих симптомов (SMD=-0,40). Межгрупповое сравнение показало, что D-серин и N-ацетилцистеин оказывают средний по силе эффект в отношении негативных (SMD=-0,53 и -0,45 соответственно) и общих (SMD=-0,40 и -0,64) симптомов, а глицин (SMD=-0,66) и саркозин (SMD=-0,41) – только для общих симптомов. Интересно, что в качестве дополнения к группе антипсихотиков, исключающих клозапин, была обнаружена эффективность модуляторов NMDA-рецепторов (SMD=-0,14) и глицина (SMD=-0,54) в отношении позитивных симптомов, D-серина (SMD=-0,54) N-ацетилцистеина (SMD=-0,45) и саркозина (SMD=-0,39) в отношении негативных симптомов и модуляторов NMDA-рецепторов (SMD=-0,38), D-серина (SMD=-0,40), глицина (SMD=-1,12), N-ацетилцистеина (SMD=-0,64) и саркозина (SMD=-0,53) – для всех симптомов в целом. При комбинации с клозапином ни один из препаратов не продемонстрировал терапевтический потенциал, а глицин даже усугубил позитивные симптомы (SMD=+0,56). Таким образом, комбинация D-серина, N-ацетилцистеина и саркозина с антипсихотиками за исключением клозапина терапевтически более эффективна в отношении негативных симптомов и симптомов в целом при хронической шизофрении, чем монотерапия антипсихотиками, однако комбинация глицина с антипсихотиками за исключением клозапина способствует редукции позитивных и симптомов в целом, но ухудшает эффективность клозапина (S.Singh и соавт., 2011).
Двойное слепое плацебо-контролируемое исследование пациентов с резистентной шизофренией, проведенное D. de Lucena и соавт. (2009 г.), оценивало эффективность комбинации мемантина (слабого неселективного антагониста NMDA-рецепторов) в дозе 20 мг/сут и клозапина на протяжении 12 нед. По сравнению с плацебо мемантин продемонстрировал значимое улучшение состояния пациентов по общему баллу BPRS, субшкалам позитивных симптомов (-1,38) и особенно негативных симптомов (-3,33), баллу CGI (1,56), данным Краткой шкалы для оценки психического состояния (Mini-Mental State Examination – MMSE). Различий с плацебо по показателю экстрапирамидных симптомов по шкале Симпсона–Ангуса (Simpson–Angus Scale – SAS) выявлено не было (D. de Lucena и соавт., 2009).
le – SAS) выявлено не было (D. de Lucena и соавт., 2009). Учитывая, что некоторые избирательные антагонисты серотониновых рецепторов 5НТ3 (ондансетрон) показали свою эффективность в отношении негативных симптомов, M.Khodaie-Ardakani и соавт. (2013 г.) изучили влияние комбинации гранисетрона (1 мг 2 раза в сутки) с рисперидоном (до 6 мг/сут) по сравнению с плацебо в течение 8 нед у 38 пациентов со стабильной шизофренией. Группа с гранисетроном продемонстрировала значимое улучшение по субшкале для оценки негативных симптомов PANSS [t(38)=6,046, среднее значение (±95% ДИ)=3,2 (1,8–3,7), p<0,001] и по общему баллу [t(38)=4,168, среднее значение (95% ДИ)=3,2 (1,6–4,7), p<0,001] по сравнению с плацебо. Однако в отношении позитивных и общих симптомов, а также депрессивных симптомов по HDRS различий между гранисетроном и плацебо выявлено не было. Балл по шкале для оценки экстрапирамидных симптомов (Extrapyramidal Symptom Rating Scale – ESRS) значимо снизился в группе гранисетрона на 4-й неделе, но сравнялся с плацебо на 8-й неделе терапии. На основании полученных данных авторы делают вывод о том, что гранисетрон может влиять на первичные негативные симптомы у больных шизофренией (M.Khodaie-Ardakani и соавт., 2013).
Таким образом, было проведено достаточно много исследований оценки статистической значимости эффективности влияния разных групп препаратов на негативные симптомы, однако не менее важным остается аспект клинической значимости эффективности терапии негативного домена.
Второе важное сообщение было посвящено глутаматовой теории шизофрении. Известно, что высвобождение глутамата у пациентов на ранней стадии шизофрении в продромальный период повышено, в то время как в процессе хронификации отмечается снижение содержания глутамата (передняя часть поясной извилины), что подтверждает факт о дисфункции в системе глутаматовой нейромедиации, ее изменениях на разных стадиях болезни (Théberge и соавт., 2003), а препараты, влияющие на NMDA-рецепторы (глицин, D-серин, D-аланин, D-циклосерин, саркозин), в комбинации с антипсихотиками более эффективны в отношении редукции негативных симптомов.
В настоящее время целый ряд новых препаратов находится на II и III стадиях клинических испытаний (ингибиторы обратного захвата глицина – Битопертин, Roche; молекула AMG-747, Amgen), агонисты метаботропных глутаматовых рецепторов типа 2/3 – MGluR2/3 (молекула LY2140023 – помаглуметадметионил, Lilly), позитивные аллостерические модуляторы метаботропных глутаматовых рецепторов типа 2 – MGluR2 (молекула JNJ-40411813 – ADX-71149, J&J/Addex), ГАМКергический антипсихотик (молекула CYP-1020, BioLineRx), психостимуляторы (Vivanse – лиздексамфетамин, Shire), агонисты a7-никотиновых ацетилхолинергических (a7-nACh) рецепторов (TC-5619, Targacept; EVP-6124, EnVivo). Дизайны исследований TC-5619, Битопертина и JNJ-40411813 (ADX-71149) ориентированы на показания негативных симптомов.
Один из новейших подходов в рамках глутаматовой гипотезы шизофрении – это ингибирование обратного захвата глицина. Повышение концентрации глицина в синаптической щели приводит к повышению связывания глицина с NMDA-рецепторами, через которые увеличивается синаптический эффект глутамата. Так, например, дизайн исследования Битопертина отражает важные критерии включения: выраженность негативных симптомов (более 40/84 по субшкале негативных симптомов PANSS и дезорганизация мышления, когнитивных функций), незначительная выраженность позитивных симптомов (менее 28/48 по субшкале позитивных симптомов PANSS, балл 4 не более чем для 2 из пунктов P1, P3, P6, G9 и отсутствие оценки в 5 баллов), отсутствие депрессивных симптомов, стабильный уровень экстрапирамидной симптоматики. Эти критерии позволяют избежать выявления «псевдоспецифичности», т.е. влияния изменений позитивных симптомов на уровень негативных симптомов, минимизировать вклад за счет изменения экстрапирамидной симптоматики и оценить чувствительность относительно изменений именно негативных симптомов. Битопертин в дозировке 10 и 30 мг в день эффективен в отношении негативных расстройств по сравнению с плацебо, а в дозировке 60 мг не имеет отличий от плацебо, что требует дальнейшего изучения. Результаты остальных испытаний планируют получить в 2014 г.
фективна (D.Lutgens и соавт., 2013). Можно сделать вывод о том, что до сих пор невелика трансляция результатов исследования в клиническую практику и, хотя негативные симптомы считаются в среде практикующих врачей важным фактором формирования плохого прогноза и функционирования больных, о чем свидетельствуют и исследования по сравнению негативного домена с другими клиническими дименсиями (Rabinowitz и соавт., 2012), негативные симптомы недостаточно распознаются, прицельно не оцениваются клиницистами, не попадают в фокус отдельных мишеней для терапии, и в том числе терапевтическая тактика остается прежней.
В реальности симптоматическая ремиссия при шизофрении не всегда подразумевает существенное улучшение функционирования пациента во всех сферах его жизни, как утверждают А.Karow и соавт. из рабочей группы по Ремиссиям при шизофрении (2012 г.). В рамках рабочего проекта Европейской группы по функциональным исходам и ремиссиям при шизофрении (EGOFORS) изучались психопатологическая симптоматика (PANSS), уровень функционирования – по шкале оценки функциональной ремиссии общей шизофрении (Functional Remission of General Schizophrenia Scale – FROGS), шкале глобального функционирования (the Global Assessment of Functioning – GAF) и субъективное благополучие – по шкале оценки субъективного благополучия на фоне приема нейролептиков (the Subjective Well-being under Neuroleptic scale – SWN-K).
Поперечное исследование 131 пациента с шизофренией на стадии симптоматической ремиссии выявило, что в соответствии с критериями N.Andreasen 58 больных характеризовались высоким уровнем функционирования (A.Karow и соавт., 2012). При этом из их числа 40% больных не испытывали интереса к эмоциональной стороне отношений, 30% не вернулись к профессиональной деятельности, 20% имели низкий уровень бытового функционирования, 11% – низкий уровень ассертивности в контексте социальных отношений (снижение способности человека не зависеть от внешних влияний и оценок, самостоятельно регулировать собственное поведение и отвечать за него) (A.Karow и соавт., 2012).
Еще один раздел работы в рамках проекта EGOFORS включал перекрестное исследование, целью которого явилось изучение влияния разных клинических доменов на функционирование больных шизофренией и его разные составляющие (P.Llorca и соавт., 2012). Данные, полученные от когорты из 296 пациентов с шизофренией, состояние которых оценивалось с применением шкал PANSS, FROGS, SWN-K, QLS, подвергались многофакторному статистическому анализу и анализу с помощью метода математического моделирования с латентными переменными (в качестве латентной переменной был взят показатель функционирования больных, в качестве показателей – подуровни шкал FROGS, SWN-K, QLS, а в качестве экзогенной переменной – симптоматика, продолжительность нелеченного психоза и уровень образования). Среди 5 клинических дименсий по шкале PANSS (позитивные симптомы, негативные симптомы, когнитивные нарушения, тревога/депрессия и возбуждение) негативная и когнитивная дименсии опосредованно через латентную переменную функционирования продемонстрировали высокие показатели корреляции с тремя дименсиями по шкале FROGS (повседневная жизнь, социальное функционирование и лечение) и подуровнями шкалы QLS (межличностные отношения, общее качество жизни, производительная активность). Показатель образовательного уровня положительно коррелировал с уровнем функционирования, но не с показателем продолжительности нелеченного психоза. Авторы подчеркивают, что негативные симптомы отрицательно влияют на функционирование больных преимущественно в аспектах социализации и межличностных отношений, что является мишенью для соответствующей терапевтической коррекции (P.Llorca и соавт., 2012).
Отдельный интерес представляет работа P.Milev и соавт. (2005 г.), которая была посвящена не только исследованию влияния нейрокогнитивного дефицита на прогноз заболевания, но и изучению вопроса о том, имеет ли влияние тяжесть негативных симптомов на прогноз и функционирование больных шизофренией вне зависимости от показателей нейрокогнитивного домена. Авторы разработали развернутую батарею когнитивных тестов и оценки клинического состояния и проспективно исследовали 99 пациентов, начиная с первого эпизода психоза и в катамнезе в течение периода времени, равного в среднем 7 годам. Показатели вербальной памяти, скорости обработки информации и внимания, а также тяжесть негативных симптомов продемонстрировали свою прогностическую значимость. Общее психосоциальное функционирование предопределялось негативной симптоматикой и параметрами нарушения внимания. Показатель вербальной памяти был оценен как значимый предиктор степени нарушения в вопросах проведения досуга. Нарушение межличностных отношений предопределялось негативными симптомами и показателями памяти, в то время как внимание и негативные симптомы были значимыми факторами, определяющими сложности трудоустройства. Авторы сделали вывод о том, что многие аспекты прогноза объясняются не независимыми факторами, а в большей мере перекрытием переменных когнитивного и негативного домена.
Однако степень выраженности негативных симптомов была одним из доказанных предикторов нарушенного общего психосоциального функционирования, который следовал только лишь за показателем внимания как первого важного фактора прогноза. Ученые указывают на то, что вербальная память, скорость обработки информации и внимание являются важными потенциальными мишенями для психосоциальных интервенций, которые могут позволить уменьшить выраженность негативных и когнитивных нарушений и улучшить общий прогноз функционирования больных (P.Milev и соавт., 2005).
Некоторые работы с небольшими выборками пациентов указывают на взаимосвязь мотивационного дефицита и функционального прогноза у больных шизофренией (G.Foussias и соавт., 2011; G.Fervaha и соавт., 2013). G.Foussias и соавт. (2011 г.) утверждают, что дефицит мотивации является центральным компонентом среди негативных симптомов шизофрении. Отсутствие мотивации в 74% случаев оказывает влияние на функционирование больных и является предиктором прогноза. G.Fervaha, G.Foussias и соавт. (2013 г.) новыми работами подтверждают, что такие негативные симптомы, как отсутствие мотивации или апатия по шкале для оценки апатии (клиническая версия) (Apathy Evaluation Scale, Clinical version – AES-C), тесно связаны с функциональным прогнозом и влияют на течение заболевания у пациентов на начальной стадии болезни.
G.Fervaha, O.Agid и соавт. (2013 г.) изучали субъективные показатели самочувствия и удовлетворенности качеством жизни у 1437 пациентов с хронической шизофренией, которые принимали участие в исследовании клинической эффективности антипсихотической терапии (Clinical Antipsychotic Trial of Intervention Effectiveness – CATIE). Результаты анализа данных показали, что клинические симптомы оказывают неблагоприятное влияние на субъективное ощущение благополучия, при этом симптомы депрессии были наиболее выраженным индикатором неудовлетворенности жизнью, которая в свою очередь коррелировала с наихудшим психосоциальным функционированием, наиболее выраженными симптомами тревоги, апатии и побочными эффектами от приема лекарств. Таким образом, симптомы апатии и отсутствия мотивации у пациентов связаны с субъективным ощущением неудовлетворенности жизнью (F.Fervaha, O.Agid и соавт., 2013).
В своей следующей работе рабочая группа под руководством G.Fervaha (2013 г.) показала, что нарушения мотивации у больных шизофренией связаны с затруднением рассчитывать затрачиваемые усилия в требующих решения и сопряженных с вознаграждением заданиях. По сравнению со здоровыми в условиях, когда большие усилия вознаграждались большим денежным эквивалентом, больные шизофренией делали выбор в пользу затраты меньших усилий. Сложности побуждения мотивационной активности также были сопряжены с фактором импульсивности. Авторы предлагают учитывать полученные данные при разработке терапевтических интервенций в отношении мишени мотивационного дефицита (G.Fervaha и соавт., 2013).
Перекрестное ретроспективное многоцентровое исследование с участием 1704 больных шизофренией, шизофреноформным и шизоаффективным расстройством, получающих антипсихотическую терапию в режиме амбулаторного лечения, показало, что у 57,6% пациентов отмечаются те или иные негативные симптомы, в том числе 12,9% являются первичными (J.Bobes и соавт., 2010). Наиболее часто представленными в клинике негативными симптомами были социальная отгороженность (45,8%), эмоциональная отгороженность (39,1%), бедный раппорт (35,8%) и притупленный аффект (33,1%). Наблюдавшиеся негативные симптомы (1 – притупленный аффект, 2 – эмоциональная отгороженность, 3 – бедный раппорт, 4 – социальная отгороженность, 5 – вербальная беглость) четко коррелировали с фактором мужского пола (симптом 4), возраста старше 40/45 лет (женщины и мужчины, симптомы 1, 2, 4), со статусом вне брака (симптомы 2–4), безработицей (симптомы 3, 4), более высоким показателем по шкале общего клинического впечатления CGI и общим баллом PANSS (симптомы 1–5), более низким уровнем по субшкале позитивных симптомов PANSS (симптомы 1, 3), продолжительностью лечения более 52 нед (симптомы 1–3, 5) и высокой дозой антипсихотического препарата (симптом 2).
Авторы подчеркивают, что наибольшее отрицательное воздействие, которое оказывают негативные симптомы в связи с нарушением социального взаимодействия, формируется в отношении аспектов трудоустройства (J.Bobes и соавт., 2010). Как добавил в своем докладе профессор P.-M.Llorka, такие негативные симптомы, как притупленный аффект и социальная отгороженность, определяют общий социальный прогноз, а недостаток спонтанности коррелирует с показателем повседневного функционирования.
Двумя десятилетиями раньше группа под руководством J.Brekke (1993 г.) из Университета Южной Калифорнии (г. Лос-Анджелес) изучала взаимосвязь между психосоциальным функционированием (показатели функционирования на работе, социального функционирования, жизненной ситуации) и субъективным опытом (показатели самооценки, удовлетворенности жизнью, субъективного дистресса) у 193 больных шизофренией. Многофакторный анализ позволил выявить два основных феномена. Первый описывает модель психосоциального функционирования, которую можно определить как переменные, ассоциированные с болезнью (симптоматика и внутрипсихический дефицит), и переменные функционального статуса (ситуация на работе, в социуме, в жизни). Вторая важная находка – двухуровневая модель, связывающая психосоциальное функционирование и субъективный опыт. Модель указывает на первичную и глубокую взаимосвязь между ассоциированными с болезнью переменными и субъективным опытом и вторичную, менее выраженную связь между показателями социального функционирования и субъективным опытом. Так, между собой четко коррелируют показатели функционирования (трудоустройство, ситуация в социуме и в жизни), негативные симптомы и самооценка. Ученые отмечают, что субъективный опыт больных представляется очень важным для понимания болезни и ее лечения, а интервенции, направленные на редукцию негативных симптомов и коррекцию указанных переменных функционирования, могут повысить улучшить субъективные ощущения жизни (J.Brekke и соавт., 1993).
Как показывает работа D.Ukpong (2012 г.), негативные симптомы являются одним из основных факторов, определяющих бремя и дистресс и у родственников пациентов – в частности, такие клинические реальности, как ангедония, затруднения в социализации и притупленный аффект, являлись четким предиктором тяжести бремени (Интервью для оценки бремени Зарита – Zarit Burden Interview, ZBI) у 101 родственника и опекуна больных шизофренией. Высокий уровень психологического дистресса у лиц, осуществляющих заботу о больных шизофренией, оцененный по Опроснику общего здоровья (General Health Questionnaire – GHQ-30), коррелировал с такими симптомами, как нарушение внимания и абулия. Высокий уровень бремени у опекунов коррелировал с факторами безработицы и низким уровнем образования у опекуна, а высокий уровень эмоционального дистресса – с фактором женского пола больных и их низким образовательным уровнем.
Работа показала важность включения коррекционных и образовательных интервенций для родственников и опекунов в общую программу лечебных мероприятий для больных шизофренией (D.Ukpong и соавт., 2012). В своем докладе профессор P.-M.Llorka упомянул очень важную и интересную статью под названием «Негативные симптомы и эмоции при шизофрении», опубликованную доктором J.Bouricius в издании «Schizophrenia Bulletin» в 1989 г. В ней автор описывает случай больного шизофренией и его поэзию через призму его негативной симптоматики и субъективных эмоциональных переживаний. Ниже представлен фрагмент стихотворения, содержание которого интерпретируется как проявления симптомов алогии и абулии в субъективном контексте больного (пер. Д.А.Смирновой).

Профессор подчеркнул, что внимательное отношение к тому, что говорят сами больные и члены их семей, а также творчество больных и их интерпретации своего состояния являются не менее важными аспектами для детального изучения с целью формирования верной и мишень-ориентированной тактики терапевтических вмешательств.
Доклад профессора X.Amador из государственного университета Нью-Йорка (США) был посвящен актуальным аспектам способов оценки негативных симптомов и важности феноменов нарушенного инсайта или анозогнозии (отрицания факта болезни) и дефицита мотивации у больных шизофренией. По мнению профессора, именно эти два негативных симптома являются наиболее значимыми предикторами нарушения функционирования, так как влияют на отношения больных с медицинскими работниками, членами семей, работодателями, – являются «теми стеклянными стенами», которые отделяют больных от окружающего мира.
Больные шизофренией игнорируют те дефицитарные нарушения, которые возникают у них в связи с болезнью, и тот неблагоприятный эффект, который болезнь оказывает на их жизнь. Недостаток осознания болезни является частью феноменологии шизофрении, отражается в ее патофизиологии и вносит свой вклад в нарушение комплаенса при терапии этих пациентов (X.Amador и соавт., 1991). Доказательства свидетельствуют в пользу того, что нарушение осознания факта болезни в большей мере отражает собственно манифестацию психоза подобно анозогнозии при инсульте, а не копинг-стратегию пациента. В исследованиях показано, что недостаточный инсайт коррелирует с повышением частоты обострений, числа недобровольных госпитализаций, плохим психосоциальным функционированием и неблагоприятным течением болезни. Устойчивый дефицит осознания болезни был признан симптомом шизофрении в DSM IV-TR.
Несмотря на то что были доказаны корреляции дефицита мотивации и функционального прогноза больных, а мотивация рассматривалась как важный опосредующий фактор, связывающий нейрокогниции и психосоциальное функционирование, мотивационный дефицит недостаточно адекватно оценивался с помощью SANS и PANSS, в связи с чем была разработана отдельная шкала внутренней мотивации для исследования шизофрении (Intrinsic Motivation Inventory for Schizophrenia Research – IMI-SR) (J.Choi и соавт., 2010). Шкала позволяет оценить центральные мотивационные структуры, выделенные в рамках теории селф-детерминизма (выполнение когнитивных задач, усвоение навыков, соблюдение режима лечения – терапевтический комплаенс, и результат реабилитации).
В исследовании по валидизации шкалы принимали участие 58 больных шизофренией, находившихся на амбулаторном лечении и проходивших курс когнитивной реабилитации, 15 больных со стабильной шизофренией и 22 здоровых. Шкала продемонстрировала хорошую внутреннюю логику, последовательность (a=0,92) и тест-ретестовую надежность (внутриклассовая корреляция 0,77). 24 пункта опросника были сведены в три основных домена, соответствующих фокусам мотивации в терапевтическом аспекте: интерес/удовольствие, осуществление выбора, ценность/полезность. Важным преимуществом шкалы является возможность с помощью нее оценить тех больных, у которых наступает и не наступает улучшение в отношении когнитивных задач и актуальных обучающих упражнений, разделить высокую и низкую степени участия в терапии и, собственно, продемонстрировать чувствительность изменений мотивации в ответ на вариации интервенций. Шкала IMI-SR представляется важным инструментом, который рекомендуется использовать в протоколах ведения больных в рамках курса когнитивной реабилитации и программ психосоциальной реабилитации (J.Choi и соавт., 2010).
Таким образом, негативные симптомы дефицит осознания болезни (снижение критики) и дефицит мотивации, связанные с ними изменения социального функционирования и субъективные переживания больных требуют прицельного внимания как при разработке программы терапевтических мероприятий, так и при проведении оценки их эффективности. Профессиональное внимание к этим симптомам может помочь пациентам «продвинуться сквозь стеклянные стены навстречу миру».
Сведения об авторе
Дарья Александровна Смирнова – канд. мед. наук, ассист. каф. психиатрии, наркологии, психотерапии и клинической психологии ГБОУ ВПО СамГМУ Минздрава России. E-mail: daria.smirnova.phd@gmail.com
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№02 2014
Негативные симптомы шизофрении в фокусе исследователя, клинициста и пациента (по материалам 26-го Конгресса Европейской коллегии нейропсихофармакологии) №02 2014
Номера страниц в выпуске:7-18
Данные обзоры подготовлены по материалам 26-го Конгресса Европейской коллегии нейропсихофармакологии (октябрь 2013 года, Барселона) участниками проекта «Восточноевропейская академия Всемирной психиатрической ассоциации и компании «Сервье» специально для психиатрических журналов
Зоны 10 ВПА (East European Educational WPA-Servier Academy – «EEE WPA-Servier Academy»)
Зоны 10 ВПА (East European Educational WPA-Servier Academy – «EEE WPA-Servier Academy»)
Данные обзоры подготовлены по материалам 26-го Конгресса Европейской коллегии нейропсихофармакологии (октябрь 2013 года, Барселона) участниками проекта «Восточноевропейская академия Всемирной психиатрической ассоциации и компании «Сервье» специально для психиатрических журналов
Зоны 10 ВПА (East European Educational WPA-Servier Academy – «EEE WPA-Servier Academy»)
Резюме. В статье отражены аспекты развития современной концепции негативных симптомов шизофрении. Обзор охватывает последние данные о патофизиологии, генетических детерминантах, нейробиологии дефицитарных расстройств, а также связанных с ними нарушениях психосоциального функционирования больных. В деталях обсуждаются вопросы разработки оценочного инструментария и новые подходы фармакотерапии в рамках комплексного лечения шизофрении с преобладанием негативных симптомов.
Ключевые слова: негативные симптомы, психофармакотерапия, социальное функционирование, шизофрения.
Negative symptoms in schizophrenia in a focus of researcher, clinician and patient (upon materials of the 26th Congress of the European college of neuropsychopharmacology)
D.A.Smirnova
Psychiatry, Narcology, Psychotherapy and Clinical Psychology Department of Samara State Medical University
Summary. The article describes the modern aspects of the concept of negative symptoms in schizophrenia. Review includes the recent information on the pathophysiology, genetic determinants, neurobiology of deficitary symptoms and related impairment in psychosocial functioning in patients. The issues of development of tools for evaluation of negative symptoms and new approaches in pharmacotherapy within the complex treatment of schizophrenia with a predominance of negative symptoms are discussed in details.
Key words: functional outcome, negative symptoms, schizophrenia, psychopharmacotherapy.
В рамках 26-го Конгресса Европейской коллегии нейропсихофармакологии целый ряд докладов был посвящен проблеме негативной симптоматики при шизофрении. Так, один из симпозиумов носил название «Проливая свет на негативные симптомы: клиническое значение для практикующих психиатров». Ведущие международные эксперты в области психиатрии, освещая вопросы влияния негативных расстройств на клиническую динамику, качество жизни и социальное функционирование пациентов с шизофренией, поделились своим профессиональным мнением по поводу перспектив решения проблем, с которыми имеют дело врачи, пациенты и их близкие в повседневной практике, сталкиваясь с такими сложными для диагностики и истощающими психическую деятельность симптомами. Пристальный исследовательский взгляд на негативные симптомы шизофрении позволяет сформировать вызов традиционному мышлению клиницистов и по-новому определить тактику и мишени лечения этой социально значимой группы заболеваний.
Актуальность и историческая ретроспектива проблемы изучения негативных расстройств при шизофрении
Профессор J.Haro, директор научного и образовательного направления Parc Sanitari Sant Joande Deu (г. Барселона, Испания), отметил особенную актуальность дальнейшего изучения вопроса негативной симптоматики при шизофрении. Председатель симпозиума напомнил аудитории, что негативные симптомы могут не выявляться, но они присутствуют в клинической картине болезни, так как включены в психопатологическую закономерность развития продуктивных расстройств. Отражая выпадение психических функций, негативная симптоматика приводит к значительным изменениям функционирования больных, деменции и четко ассоциирована с плохим прогнозом (T.Crow, 1995).Обозначая исторический экскурс с его основными вехами в развитии теории о негативных симптомах, профессор упомянул понятия абулии E.Kraepelin (1898 г.), правила четырех «А» E.Bleuler (1911 г.), «динамического опустошения» W.Janzarik (1959 г.), первичных и вторичных негативных расстройств в работах J.Strauss, W.Carpenter, J.Bartko (1974 г.). Именно E.Bleuler, определив термин «шизофрения», предложил в большей мере акцентировать внимание на диагностике основных симптомов, которыми он считал «минус-симптомы», симптомы «выпадения» и утраты психический функций, в то время как продуктивные расстройства, по его мнению, являлись дополнительными и неспецифическими (табл. 1).

При этом негативные симптомы подразделялись на первичные и вторичные. К первичным относили ядерные нарушения шизофрении в форме так называемого дефицитарного синдрома, который проявляется еще в доманифестный период, существенно влияет на социальное функционирование больных и является камнем преткновения в терапии шизофрении. Вторичные симптомы являются следствием болезненного процесса, искаженной адаптации в болезни, влияния средовых факторов и медикаментозной терапии (J.Strauss и соавт., 1974). Например, паранойя или погружение в психотические переживания может спровоцировать социальную изоляцию, депрессия может вызвать ангедонию, снижение мотивации и социальную отгороженность, антипсихотическое лечение – акинезию и уплощенный аффект, а уменьшение контроля за пациентами в больничных учреждениях – проблемы мотивации и снижение инициативности.
Более подробно профессор J.Haro остановился на современной концепции, в рамках которой, по его мнению, до сих пор свежи взгляды N.Andreasen (1979 г.) и T.Crow (1980 г.). В 1979 г. профессор Университета Айовы (США) N.Andreasen выделила типы шизофрении с преимущественной позитивной, преимущественной негативной и смешанной симптоматикой и разработала шкалу для оценки негативных симптомов (Scale for the Assessment of Negative Symptoms – SANS, 1982). В первоисточнике шкала состояла из 30 признаков, впоследствии 5 из них были удалены в связи с низкой надежностью. Конечная версия валидизированной шкалы SANS включает 25 признаков (общий балл – 0–125), описывающих 5 негативных симптомов (табл. 2). Вступая в эру доказательной медицины, профессор N.Andreasen своими практическими разработками положила важное начало операциональной диагностике негативных симптомов. Одновременно с этим профессор T.Crow (1980 г.) из Клинического исследовательского центра г. Мидлсекс (Великобритания), основываясь на фактах корреляции негативных симптомов и когнитивных нарушений при шизофрении с нейробиологическими находками расширения желудочков мозга, отсутствия терапевтического влияния типичных дофаминблокирующих нейролептиков на негативную симптоматику и отрицательной корреляции повышения плотности дофаминовых рецепторов с негативными расстройствами, предложил выделять два базовых процесса при шизофрении и два типа шизофрении: 1-й тип – с позитивной симптоматикой, 2-й тип – с преобладанием негативной симптоматики и нарастающими когнитивными расстройствами (не реагирующий на терапию, с нарушением поведения, неврологической симптоматикой и моторными нарушениями).
В рамках диагностических критериев Руководства по диагностике и статистике психических расстройств 4-го издания (Diagnostic and Statistical Manual of mental disorders, 4th edition, Text Revision – DSM IV-TR, 2000 г.) к негативным симптомам стали относить 3 основных психопатологических признака: аффективное уплощение, алогию и абулию. В структуре аффективного уплощения описывали характерные обеднение мимических реакций, обездвиженность лица, недостаточный зрительный контакт (избегание взгляда в глаза), невыразительность пантомимики и движений. Алогию определяли как бедность речи, при которой ответы пациентов становились короткими и утрачивали содержание, а абулию – как безынициативность и утрату устойчивой целенаправленной деятельности. Дополнительными негативными симптомами считались когнитивные нарушения, ангедония, неадекватный аффект. В то же время в комментариях к классификации указывались сложности диагностики данных негативных симптомов и их неспецифичность, возможность их вторичного возникновения за счет эффектов психотропных препаратов, других психопатологических нарушений, факторов окружающей среды, в связи с которыми их не рассматривали в рамках критерия диагностики. В Международной классификации болезней 10-го пересмотра (МКБ-10) негативные симптомы представлены апатией, бедностью речи, неадекватностью или сглаженностью эмоциональных реакций и социальной отгороженностью.
Значимость проблемы негативной симптоматики до настоящего периода времени подчеркивает выраженный и растущий публикационный интерес. По данным англоязычной текстовой базы данных медицинских и биологических публикаций PubMed, созданной Национальным центром биотехнологической информации (National Center for Biotechnological Information – NCBI) на основе раздела «биотехнология» Национальной медицинской библиотеки США (National Library of Medicine – NLM), количество полнотекстовых статей, посвященных негативным симптомам, выросло с 1100 в 1980 г., что составляет 5%, до показателя 4600 в 2012 г., что соответствует 20% от числа всех статей, опубликованных по теме шизофрении (PubMed search, 2012).
Основные патофизиологические нарушения, ассоциированные с негативным доменом
Еще в 1980-х годах негативные симптомы стали рассматривать как отдельный домен, ссылаясь при его выделении не только на ранее описанные клинические характеристики, но и на свойственные им определенные патофизиологические изменения, а также наблюдаемый недостаточный ответ на антипсихотическую терапию (J.Strauss и соавт., 1974). Негативная симптоматика в отличие от продуктивных расстройств обнаружила взаимосвязь с преобладанием гиподофаминергической активности во фронтальной коре (T.Crow, 1980), со снижением уровня дофамина в префронтальной коре (K.Davis и соавт., 1991), с измененным соотношением активности дофаминергической и холинергической систем (R.Tandon и соавт., 1989), снижением плотности рецепторов N-метил-D-аспартата (NMDA) в области височных долей и гиппокампа, повышением их плотности в лобных долях и снижением плотности глутаматзависимых рецепторов в лобных областях мозга, уменьшающих ингибирующий эффект систем g-аминомасляной кислоты (ГАМК) и формирующих глутаматергическую гиперреактивность (J.Olney и соавт., 1995).В исследованиях с использованием позитронно-эмиссионной томографии было выявлено, что у больных шизофренией с преобладанием негативной симптоматики (алогия, эмоциональное уплощение, абулия и нарушения внимания) по сравнению с пациентами с преобладанием позитивных симптомов имеются более выраженные метаболические нарушения, в частности в лобной, височной и мозжечковой областях. Негативные симптомы ассоциированы с низким уровнем метаболизма глюкозы в правом полушарии, особенно в коре височной доли и вентральной области префронтальной коры; повышенный уровень метаболизма в коре мозжечка и сниженный – в нижних глубоких ядрах мозжечка (S.Potkin и соавт., 2002). Существенное уменьшение толщины слоя серого вещества в орбитофронтальной области статистически значимо коррелирует с более тяжелой негативной симптоматикой (rs=-0,76; p=0,006), дефицитом зрительной памяти, вербальной памяти и снижением показателя семантической беглости у больных шизофренией (W.Baaré и соавт., 1999).
Ассоциированные с искаженным метаболизмом изменения дофаминовой нейротрансмиссии в кортико-кортикальных, кортико-базальных ганглиях и мезокортикальной области, низкий уровень проведения импульсов по мозжечково-таламо-фронтальному пути и дисфукция кортико-таламо-мозжечково-кортикальной петли обратной связи (S.Potkin и соавт., 2002) подтвердили связанный с негативными симптомами феномен когнитивной дисметрии (N.Andreasen и соавт., 1999), проявляющийся в нарушении синхронизации психических процессов, в том числе «обеспечения своевременно быстрого, в должной мере плавного выполнения сложных моторных актов» и реализации «контроля и согласования постоянно меняющейся психической активности».
Постановка проблемы мишеней фармакотерапии негативных расстройств
В работах конца XX в. было доказано, что у пациентов с более выраженными негативными симптомами, опрошенных по шкале для оценки негативных симптомов SANS и шкале качества жизни (the Quality of Life Scale – SQL), отмечаются более худший прогноз, более низкий уровень социального функционирования, качества жизни и степень расстройства мышления по сравнению с лицами с менее выраженными негативными симптомами (K.Mueser и соавт., 1991), а также установлены сильные корреляции, демонстрирующие взаимосвязь между развитием негативной симптоматики и ее предикторами – факторами плохого преморбидного функционирования, мужского пола и низкого интеллектуального уровня (C.Tamminga и соавт., 1998).Несмотря на то что внимание проблеме негативных расстройств со стороны исследователей и клиницистов было уделено достаточно, ни один лекарственный препарат к 2000 г. так и не получил одобрения со стороны Управления по контролю качества пищевых продуктов и лекарственных препаратов Министерства здравоохранения и социальных служб США (Food and Drug Administration – FDA) на внесение в список такого показания для назначения, как «негативные симптомы» (B.Kirkpatrick и соавт., 2006).
Исследования последнего десятилетия XX в. не подтвердили первичной гипотезы о достаточной эффективности антипсихотиков II поколения в отношении редукции негативной симптоматики (R.Keefe и соавт., 1999). Важно отметить, что выводы в работах по атипичным нейролептикам преувеличивали возможности влияния нового поколения антипсихотиков на собственно негативные симптомы, в основном ссылаясь на те факты, что атипичные антипсихотики были более благополучны в отношении вторичных негативных симптомов и разница с I поколением антипсихотиков в их влиянии на негативные симптомы могла быть объяснена именно эффектом в рамках вторичных негативных симптомов, в то время как удельный вес терапевтического влияния в отношении суммарного негативного домена был незначительным или, точнее, не могло идти речи о специфичности терапевтического действия атипичных антипсихотиков на негативный домен. При этом следует понимать, что разделение на позитивные и негативные домены – это часть теоретической концепции, которая определила единственно верный, но медленный путь к горизонтам, которых мы еще не увидели.
Этот период в фармакотерапии шизофрении можно назвать периодом новой веры во II поколение антипсихотиков. Нельзя не заметить, что теоретические описания механизма действия атипичных антипсихотиков с селективной блокадой дофаминовых рецепторов в противовес широкому спектру действия и опосредованным влиянием через серотониновые рецепторы на повышение дофаминергической активности в лобных отделах (мишени негативных симптомов) были важной вехой и якорем надежды в «реках» попыток вмешаться в процесс болезни, сравнимый не только со стихией сопротивляющегося и необъятностью живущего своей жизнью океана, но и с теми подводными камнями и скалами, которые так и не позволяют выбраться на берег и прочно ощутить опору под ногами.
Инициатива Национального института психического здоровья по разработке направления терапии негативной симптоматики шизофрении и сопряженные с ней современные нейробиологические исследования
В связи с тем, что эффективность лечения негативных симптомов можно было связать с очень ограниченным прогрессом, профессора S.Marder, W.Fenton, W.Carpenter Jr. и B.Kirkpatrick объединились в рабочую группу и под эгидой Национального института психического здоровья (National Institute of Mental Health – NIMH) инициировали развитие направления терапии негативной симптоматики шизофрении (B.Kirkpatrick и соавт., 2006). Если до того этапа NIMH преимущественно фокусировал внимание на мишени нейрокогнитивного дефицита в рамках проекта под названием «Исследование оценки и терапии для улучшения когнитивного функционирования при шизофрении» (Measurement and Treatment Research to Improve Cognitionin Schizophrenia – MATRICS Project), то цели и задачи конференции NIMH, состоявшейся в Центре нейронаук в г. Роквилль (штат Мэриленд, США) 26–27 января 2005 г., звучали следующим образом:- пересмотреть данные относительно факта существования отдельного домена негативных симптомов как предпосылку для выбора соответствующей системы оценки негативных симптомов при проведении клинических исследований;
- инициировать процесс разработки или выявления имеющихся, применимых в широкой практике и основанных на системе научных доказательств методов, требующихся для оценки эффективности терапии негативных симптомов.
В рамках предложенного направления NIMH научные гипотезы продолжали разрабатываться, а доказательства – накапливаться, все четче очерчивая тему уникальности домена негативных симптомов и обозначая актуальность и целесообразность поиска новых терапевтических вмешательств, подразумевавших, по всей видимости, как новые группы препаратов, так и систему нефармакологических интервенций. Посмертные морфологические и генетические исследования последних лет XXI столетия подтвердили не только роль уже описанных изменений дофаминергической трансмиссии, но и изменений серотонинергической системы, задействования определенных зон мозга в патофизиологии негативных симптомов, а ряд препаратов продемонстрировал возможности коррекции негативных симптомов.
Швейцарская группа ученых провела исследование зависимости от громкости слуховых вызванных потенциалов (the loudness dependence of auditory evoked potentials – LDAEP) – маркера центральной активности 5-HT-серотонинергических рецепторов, которое показало, что у больных шизофренией отмечаются значительно более высокие показатели LDAEP в обоих полушариях по сравнению с контрольной группой здоровых лиц. Показатель LDAEP в правом полушарии у пациентов связан с более выраженным уровнем негативных симптомов, в то время как корреляции с позитивными симптомами выявлено не было. Данное исследование доказало снижение центральной серотонинергической нейротрансмиссии у больных с преобладанием негативных симптомов в клинике болезни (C.Wyss и соавт., 2013).
В исследовании, проведенном группой китайских ученых под руководством профессора T.Mwansisya и опубликованном в ведущем журнале «Schizophrenia Research» в 2013 г., на основании сравнения данных функциональной магнитно-резонансной томографии у 41 пациента с первым психотическим эпизодом шизофрении и 33 здоровых лиц группы контроля было доказано наличие нарушений межполушарных связей в состоянии покоя в бледном шаре, медиальной лобной извилине и нижней височной извилине. При этом найдены позитивные корреляции между данными по шкале Векслера для оценки интеллекта у взрослых (Wechsler Adult Intelligence Scale – WAIS) и нарушением межполушарных связей в палеостриатуме (rho=0,335; p=0,003) и медиальной лобной извилине (rho=0,260; p=0,025). Кроме того, было обнаружено, что нарушения связей в палеостриатуме находятся в позитивной корреляции с фактором длительности заболевания (rho=-0,407; p=0,009), нарушенные межполушарные нейрональные связи в нижней височной извилине коррелируют с баллом по шкале для оценки негативных симптомов SANS (rho=0,393; p=0,012). Авторы делают выводы о том, что нарушенные межполушарные связи, в частности в палеостриатуме, благодаря его тесным анатомическим и функциональным связям с другими отделами, включая корковые представительства, могут рассматриваться в качестве того самого первичного изменения, которое предрасполагает к формированию когнитивных расстройств, негативных симптомов и хроническому течению шизофрении (T.Mwansisya и соавт., 2013). Результаты исследования объясняют, что развитие когнитивных и негативных расстройств, а также хронификация процесса болезни связаны с одними и теми же морфофункциональными субстратами.
Последние исследования показывают, что у пациентов с шизофренией снижена амплитуда волны P300, что отражает патофизиологические изменения и тяжесть симптоматики болезни, в частности соотносимую с выраженностью негативных симптомов (D.Kim и соавт., 2013).
Нарушения потенциала P300 при шизофрении изучались в ракурсе взаимосвязи снижения активности источника потенциала и тяжести симптомов у пациентов. Запись волны P300 проводили у 34 пациентов с шизофренией и здоровых группы контроля, используя так называемую auditory odd ball paradigm (auditory odd ball paradigm – это метод, используемый для исследования вызванных потенциалов, с помощью которых изучают нейрональные реакции на непредсказуемые, но узнаваемые события, предъявляя испытуемому череду стимулов, обычно слуховых или визуальных. Субъекта исследования просят реагировать, либо подсчитывая, либо нажимая на кнопку, при появлении определенных стимулов-мишеней, скрытых в серии общих стимулов, которые в эксперименте обычно не требуют какого-то иного ответа на них. Было обнаружено, что вызванные потенциалы от теменно-центральной области приблизительно составляют 300 ms и увеличиваются в ответ на стимулы-мишени, эти потенциалы и были названы P300. Вызванный потенциал P300 представляет собой электрическую реакцию мозга на внешний раздражитель или на выполнение умственной (когнитивной) задачи. Волна P300 – это эндогенный потенциал, так как его возникновение связано не с физическим проявлением стимула, а с реакцией человека на него. – Прим. авт.).
Исследователи обнаружили, что амплитуда волны P300 значимо снижена относительно срединных электродов и в обеих билатеральных височных зонах у больных шизофренией по сравнению со здоровыми. Относительно параметра источника активности потенциала выяснилось, что у больных шизофренией отмечается снижение его активности преимущественно в левом полушарии, включая поясную, нижнюю затылочную, среднюю затылочную, среднюю височную, заднюю поясную, верхнюю затылочную извилины и предклинье больших полушарий. Кроме того, метод контрастирования областей активации волны продемонстрировал негативную корреляцию изменений в средней височной, задней поясной, верхней затылочной извилинах и предклинье больших полушарий с уровнем негативной симптоматики по шкале позитивной и негативной симптоматики (Positive and Negative Syndrome Scale – PANSS), в то время как сниженная активность источника волны P300 у больных шизофренией с негативной симптоматикой, как делают выводы ученые, может быть отражением дефицита в лобно-височно-теменной зоне (D.Kim и соавт., 2013).
Накоплены обширные данные о функциональных нарушениях NMDA-рецепторов в лимбических отделах головного мозга, так называемой NMDA-гипофункции, которая объясняет многие аспекты молекулярных, клеточных и поведенческих нарушений, наблюдаемых при шизофрении (C.Tamminga, 1999; J.Coyle, 2006). Исследования показывают, что NMDA-гипофункция (NMDA-рецепторы участвуют в процессах памяти и обучения) играет роль в формировании нейропрогрессирующего характера болезни, негативных симптомов и когнитивного дефицита. Работы ученых показывают важное значение генетических и эпигенетических (средовых) факторов в развитии этого феномена.
Так, M.Snyder и соавт. (2013 г.) описывают общие сигнальные пути, объединяющие гены риска развития шизофрении DISC1 (Disrupted In Schizophrenia 1 – нарушенный при шизофрении-1 ген), нейрорегулина 1 и дисбиндина, обращая внимание на путь AKT/GSK3b и то, что данные мутации и генетические взаимодействия приводят к формированию NMDA-гипофункции в процессе развития.
При подавлении экспрессии дисбиндина в эксперименте in vitro в нейронах повышается экспрессия дофаминовых D2-рецепторов (Y.Iizuka и соавт., 2007). AKT – это ген, кодирующий a-серин/треониновую протеинкиназу (протеинкиназа В) и участвующий в путях, которые обеспечивают выживание клеток путем ингибирования апоптоза, играет ключевую роль в таких клеточных процессах, как метаболизм глюкозы, клеточная пролиферация, транскрипция и миграция клеток. AKT требуется для инсулин-индуцируемой транслокации транспортера глюкозы 4 (GLUT 4) в плазматическую мембрану. GSK3b – ген, кодирующий киназу-3 гликогенсинтетазы, которая может быть ингибирована фосфорилированием AKT, что вызывает синтез гликогена. Показано, что стимуляция дофаминовых D3-рецепторов в животных моделях на мышах также активизирует путь AKT/GSK3b в шипиковых нейронах средних размеров в прилежащем ядре и в задней части скорлупы, и этот феномен рассматривают в ракурсе инновационного терапевтического влияния лигандов D3-рецепторов на процессы подкрепления, когнитивные функции, нарушенные при шизофрении (M.Salles и соавт., 2013).
Интересной также представляется работа швейцарской группы ученых под руководством M.Schneider (2013 г.), посвященная преобладанию негативных симптомов при синдроме делеции 22q11.2 хромосомы (22q11.2 deletionsyndrome, 22q11.2DS) и его взаимосвязи с когнитивным функционированием и общим функциональным прогнозом у больных шизофренией. Синдром делеции 22q11.2DS уже был описан в рамках нейрогенетических состояний, которые связаны с повышенным риском развития шизофрении. При этом не было получено данных о том, в какой мере позитивные и негативные симптомы психоза представлены у лиц с данным синдромом и могут ли быть выявлены симптоматические паттерны, соотнесенные с ним.
В исследовании применялся кластерный анализ, который позволил выделить группы пациентов с определенными симптоматическими паттернами, чтобы впоследствии сравнить больных из разных кластеров по ряду когнитивных показателей и функциональному прогнозу. Исследование показало, что среди 63 подростков и молодых людей с синдромом 22q11.2DS 1/3 часть обнаружили преобладание негативных симптомов, сопряженных со специфическим когнитивным дефицитом и функциональным прогнозом. Из 3 выделенных групп – с низким уровнем выраженности симптомов, преобладанием негативных симптомов и высоким уровнем выраженности симптомов – в кластере с преобладанием негативных симптомов были обнаружены более низкие показатели зрительной памяти и скорости обработки информации по сравнению с группой с низким уровнем выраженности симптомов, а также наиболее низкий уровень функционирования и трудового прогноза (M.Schneider и соавт., 2013).
В DSM V (2013 г.), где рубрика «295.0 (F 20.9) Шизофрения» в разделе «Расстройства шизофренического спектра и другие психотические расстройства» утратила формы шизофрении и апеллирует в большей мере к спецификации течения, и критерий негативного домена претерпел изменения и в связи с данными об отсутствии специфичности других симптомов включает только два феномена – уменьшение эмоциональной выразительности (diminished emotional expression, снижение эмоциональной экспрессии) и абулию (avolition, безволие).
Таким образом, теоретические описания N.Andreasen и дихотомическая концепция T.Crow повели за собой целый ряд морфологических, патофизиологических, биохимических и генетических исследований, которые «позволили объяснить клинические феномены с современных… позиций субстратных мозговых нарушений» и «выступили в роли связующего звена между клиническим и нейробиологическим подходами при изучении шизофрении» (С.Н.Мосолов, 2001). Вместе с промежуточной оценкой успехов фармакотерапии они в свою очередь также простимулировали целенаправленную исследовательскую активность в отношении разработки новых фармакотерапевтических подходов и моделей комплексного лечения больных шизофренией.
Необходимо отметить, что конкретную базу для развития терапевтического направления заложили результаты конференции NIMH в связи с ее четко установленной областью соглашения – консенсусом по 11 основным пунктам, опубликованным в материалах статьи рабочей группы под руководством B.Kirkpatrick в журнале «Schizophrenia Bulletin» в 2006 г.:
- негативные симптомы представляют собой отдельное показание для терапевтических назначений;
- негативные симптомы и когнитивные нарушения представляют собой отдельные домены. Аспекты взаимодействия и перекрытия этих доменов могут быть определены в будущем (отношения между когнитивными нарушениями и негативными симптомами подробно рассмотрены в статье P.Harvey и соавт., 2006), но текущая документация настаивает на разделении доменов;
- негативные симптомы имеют очевидную валидность как проявления болезни и представляют собой утрату или уменьшение нормальной психической функции;
- стойкие и клинически значимые негативные симптомы являются нерешенной терапевтической задачей в большинстве случаев. Обзор распространенности негативных расстройств является серьезной задачей, реализация которой позволит оценить объем необходимых лечебных вмешательств. Лонгитюдные исследования, которые могут представить информацию об устойчивости/персистенции негативных симптомов, являются особенно значимыми;
- проведение различий между первичными и вторичными негативными симптомами не является значимой задачей в ракурсе клинических исследований препаратов для лечения негативных симптомов;
- парадигма дизайна клинических исследований препаратов для терапии персистирующих негативных симптомов должна включать группу клинически стабильных пациентов, у которых негативные симптомы устойчивы на фоне лечения антипсихотическими препаратами. Образцом исследования в рамках данной парадигмы представляется двойное слепое плацебо-контролируемое исследование по сравнению параллельных групп, в которых предполагаемые способы лечения негативных симптомов назначаются в качестве дополнительной терапии, сопутствующей основному лечению с применением антипсихотика II поколения;
- парадигма дизайна исследования должна учитывать, что назначаемый в качестве дополнительной терапии препарат не должен быть успешным в отношении широкого спектра антипсихотического действия, т.е. одновременно эффективным в купировании негативных и позитивных симптомов.
- определение уровня клинически значимого эффекта для негативных симптомов требует дальнейшего рассмотрения;
- продолжительность клинического исследования варьируется в зависимости от цели исследования. Исследования по доказательству общей концепции могут быть короткими. Исследования, ориентированные на выявление предварительных показателей эффективности, могут быть ограничены сроком 4–12 нед. Исследования, ориентированные на регистрацию препарата и показания, предполагают существенно более выраженную продолжительность (в диапазоне 6 мес), для того чтобы стойкая эффективность могла быть задокументирована;
- согласно текущему состоянию вопроса домен негативных симптомов включает состояние аффективного уплощения, алогию, асоциальность, ангедонию и абулию. Между этими симптомами имеются существенные взаимосвязи, но они могут базироваться на разных нейробиологических субстратах и, соответственно, определять разные терапевтические мишени. Структура взаимосвязей между этими симптомами и их прогностическая валидность требуют дальнейшего изучения;
- шкала для оценки негативных симптомов SANS (N.Andreasen, 1982) является более предпочтительной, чем шкала для оценки позитивных и негативных симптомов PANSS (S.Kay и соавт., 1987), так как в ее структуре расписаны составляющие элементы каждого из негативных симптомов, т.е. содержательно раскрыты конструкты негативных симптомов. В то же время шкалы PANSS, SANS и, возможно, другие подходы к оценке негативных симптомов приветствуются для рассмотрения и использования в клинических исследованиях.
Если пациенты демонстрируют максимальный ответ на антипсихотическую терапию, то такая выборка пациентов является подходящей в рамках предлагаемой нами парадигмы. В таком варианте исследования преимущество влияния препарата на негативные симптомы может быть оценено в том случае, если спектр действия препарата был ограничен негативными симптомами, притом что психоз и другие ведущие симптомы оставались стабильными и такими же, как на препарате сравнения.
Если экспериментальный препарат превосходит препарат сравнения по эффективности и перекрывает по спектру действия разные домены симптомов, включая негативные симптомы, то его претензия на преимущество в эффективности оправданна, однако регистрация показания для назначения в отношении негативных симптомов проблематична по причине недостаточной специфичности;
Последний пункт соглашения, с одной стороны, еще раз методологически уточнил формулировку концепции ожидаемых на том этапе исследований, а с другой стороны – внес диссонанс и расширил границы изучения. Шкала SANS и критерии N.Andreasen очень четко определяли негативный домен, практически сепарируя его от когнитивных симптомов, в то время как шкала PANSS в субшкале негативных синдромов включала перекрытия негативного и когнитивного доменов (Н1 – притупленный аффект, Н2 – эмоциональная отгороженность, Н3 – обедненный раппорт, Н4 – пассивно-апатическая социальная отгороженность, Н5 – нарушения абстрактного мышления, Н6 – нарушения спонтанности и плавности диалога, Н7 – стереотипное мышление), как бы намекая на теорию T.Crow о типах шизофрении, где 2-й тип с преобладанием негативной симптоматики характеризовался и выраженным нейрокогнитивным дефицитом. Кроме того, как отметил профессор D.Taylor (Лондонский королевский колледж, Великобритания), в шкале PANSS субшкала общей психопатологии также апеллирует к негативным симптомам – например: в пунктах О13 – абулия и О16 – активное социальное избегание и, возможно, в пунктах О5 – манерность и позирование и О7 – моторная заторможенность.
Таким образом, благодаря формулировке 11-го пункта искусственный консенсус NIMH стал утверждать не только, на первый взгляд, исключительно исследовательскую перспективу – «мы должны приложить все усилия, чтобы научиться выявлять и лечить негативные симптомы», но и очень важную клиническую реальность – «мы должны осуществить новую попытку научиться лечить “негативный тип” шизофрении и шизофрению в целом».
Исследования по оценке эффективности фармакологической терапии негативных расстройств
Метаанализ, целью которого являлось сравнение эффективности II поколения антипсихотиков в терапии негативных симптомов шизофрении, показал, что большинство атипичных антипсихотиков достоверно эффективно в отношении негативных симптомов, но их эффективность является продуктзависимой и несколько меньше эффективности в отношении всей симптоматики в целом (J.Darbà и соавт., 2013).
Работа испанских ученых состояла из двух разделов – анализа двойных слепых рандомизированных клинических исследований, опубликованных на английском языке в ведущих базах данных PubMed, the Cochrane Central Register of Controlled Trials (CENTRAL), Proquest Health and Medical Complete, Science Citation Index Expanded, и Current Contents Connect в период с 1966 по 2006 г., посвященных сравнению монотерапии атипичным антипсихотиком с плацебо (из 43 исследований отобрано по критериям включения 18 работ, терапия от 6 до 52 нед) и с галоперидолом (из 26 исследований отобрано 10, продолжительность терапии 6–28 нед) на популяции 4 тыс. пациентов. Оценка негативных симптомов в проанализированных работах проводилась с помощью шкал SANS, модифицированной версии SANS summary (сумма общих оценок субшкал SANS), субшкалы негативных симптомов PANSS (PANSS-N) и Краткой психиатрической оценочной шкалы (Brief Psychiatric Rating Scale – BPRS), в частности – фактора ретардации, определяемого суммой баллов по пунктам 3 (эмоциональная отгороженность), 13 (моторная заторможенность) и 16 (притупленный аффект). Результаты сравнения с плацебо указали на то, что отдельные атипичные антипсихотики эффективны в терапии негативных симптомов по сравнению с плацебо, хотя и сила эффекта является средней или низкой (значения статистического показателя силы эффекта d Кохена: амисульприд – 0,52, оланзапин – 0,43, зипразидон – 0,46, рисперидон – 0,40, кветиапин – 0,36).
Кроме того, метаанализ показал, что галоперидол оказался также эффективным в терапии негативной симптоматики в сравнении с плацебо, а также сравнимым по эффективности с кветиапином и превышающим эффективность зотепина. Однако амисульприд, зипразидон, оланзапин и рисперидон являются более эффективными в отношении редукции негативных симптомов, чем галоперидол. Из всех исследованных атипичных антипсихотиков амисульприд и зипразидон оказались наиболее эффективны. Сравнение антипсихотиков с галоперидолом продемонстрировало наличие лишь общей тенденции к их большей эффективности за исключением кветиапина, который показал не эквивалентную, как в первой части метаанализа с плацебо, а даже меньшую его эффективность в сравнении с галоперидолом (J.Darbà соавт., 2013).
Анализ 23 рандомизированных контролируемых исследований по оценке эффективности антидепрессантов группы селективных ингибиторов обратного захвата серотонина (миртазапин, ребоксетин, миансерин, тразодон, ритансерин, циталопрам, флуоксетин, флувоксамин, пароксетин, сертралин) в качестве дополнительной терапии негативных симптомов шизофрении у 819 больных (из 455 публикаций 5 ведущих баз данных были отобраны 22 работы) показал статистические значимые различия в пользу антидепрессанта (SMD=-0,48) (S.Singh соавт., 2010). Значение статистического показателя силы эффекта d Кохена составило -0,48, что соответствует уровню средней силы. Однако нужно отметить, что предыдущий метаанализ показал большую силу эффекта (SMD=-0,71) (C.Rummel и соавт., 2005). Антидепрессанты в качестве дополнительной терапии показывают не только статистическую, но и демонстрируют клиническую значимость, хотя до сих пор продолжается дискуссия на тему того, является ли редукция негативных симптомов шизофрении вторичной по отношению к коррекции собственно депрессивных расстройств. Ограничением метаанализа является отсутствие оценки работ по применению трициклических антидепрессантов, венлафаксина и ингибиторов моноаминоксидазы. Из рассмотренных в исследованиях препаратов группы селективных ингибиторов обратного захвата серотонина наибольшую эффективность продемонстрировали флуоксетин, тразодон и ритансерин. При этом 3 из 4 работ по флуоксетину показали отрицательный результат, и сила эффекта была ниже по сравнению с тразодоном и ритансерином (S.Singh соавт., 2010). В работах по применению тразодона в сочетании с антипсихотиком указывается на его эффективность в отношении редукции тяжести негативных симптомов резидуальной шизофрении, в частности аффективного притупления, уплощения и алогии, а также безопасность применения тразодона и отсутствие экзацербации психоза на его фоне. Ритансерин как антагонист 5-НТ2С-рецепторов имеет дополнительный существенный антидофаминергический эффект, на который авторы ссылаются, объясняя активность препарата в отношении негативных симптомов шизофрении.
В моделях на животных было показано, что антагонисты a2-адренергических рецепторов способны увеличивать дофаминергическую активность в префронтальной коре, снижение которой коррелирует с негативной симптоматикой при шизофрении. В метаанализе E.Hecht (2012 г.) из Университета Майами было оценено влияние антагонистов a2-адренергических рецепторов (миансерин, миртазапин) на негативные расстройства в качестве дополнения к основной терапии с помощью антагонистов D2-рецепторов. Анализ 8 рандомизированных плацебо-контролируемых исследований из базы PubMed, включавших от 18 до 41 больных и продолжавшихся от 4 до 8 нед, показал разницу относительно редукции позитивных симптомов 0,16 (95% доверительный интервал – ДИ -0,30 до 0,62), негативных симптомов – 0,84 (95% ДИ 0,17–1,51), по шкале общей психопатологии – 0,28 (95% ДИ -0,08–0,64) и в целом – 80 (95% ДИ 0,15–1,46). При этом улучшение в отношении негативных симптомов было независимым от улучшения в рамках депрессивных расстройств, что было доказаноданными шкалы для оценки депрессии Гамильтона (Hamilton Psychiatric Rating Scale for Depression – HDRS) в 3 из 5 исследований. Выводы метаанализа указывают на то, что антагонисты a2-адренергических рецепторов повышают эффективность антагонистов D2-рецепторов в лечении шизофрении благодаря редукции негативной симптоматики (E.Hecht и соавт., 2012).
Учитывая гипотезу о роли антиоксидантов в патофизиологии шизофрении, метаанализ V.Singh и соавт. (2010 г.) оценил 6 рандомизированных исследований из ведущих баз данных (PubMed, Cochrane Library, EMBASE, CINAHL, PsycINFOи AMED) о влиянии гинкго и его дериватов в роли дополнительной терапии. Всего было проанализировано 466 случаев с применением гинкго и 362 случая с добавлением плацебо, при этом уровень симптомов до и после терапии оценивался по шкалам SANS, а также BPRS и по шкале оценки выраженности физиологических нарушений (Simplified Acute Physiology Score – SAPS). Статистически значимая разница (SMD=-0,50) свидетельствовала в пользу улучшения как по показателю общей симптоматики, так и по шкале негативных симптомов при хронической шизофрении (S.Singh соавт., 2010).
Не менее интересным представляется исследование V.Levkovitz и соавт. (2010 г.) по включению в терапию шизофрении полусинтетического антибиотика из группы тетрациклинов – миноциклина. Известно, что миноциклин применяется при ряде неврологических расстройств, оказывает влияние на дофаминергическую систему и ингибирует активность микроглии. Гипотеза о его потенциале в лечении шизофрении и влиянии на глутаматергическую систему через ингибирование синтазы оксида азота, участвующего в процессах нейротрансмиссии, и препятствование развитию нейротоксичности, вызываемой окисью азота, была доказана в моделировании на животных. В двойном слепом рандомизированном плацебо-контролируемом исследовании приняли участие 70 пациентов с начальной стадией шизофрении. Всем пациентам было назначено лечение антипсихотиками (рисперидон, оланзапин, кветиапин или клозапин в дозе, эквивалентной 200–600 мг хлорпромазина в сутки) за 14 дней или менее до присоединения к терапии миноциклина в дозе 200 мг/сут. Негативные симптомы оценивались с помощью шкалы SANS, также проводилась оценка клиники, когнитивных функций и общего функционирования (шкала общего клинического впечатления – Clinical Global Impressions scale, CGI). Миноциклин продемонстрировал хорошую переносимость, существенную эффективность в отношении негативных симптомов и общего функционирования, а также когнитивных, исполнительных функций, таких как рабочая память, переключаемость и планирование (Y.Levkovitz соавт., 2010).
Другой метаанализ S.Singh и соавт. (2011 г.) был посвящен сравнительной оценке эффективности модуляторов NMDA-рецепторов (D-серин, N-ацетилцистеин, глицин, саркозин). Из баз данных PubMed, Cochrane Library, EMBASE, CINAHL® и PsycINFO были отобраны 1253 случая по материалам 29 двойных слепых рандомизированных плацебо-контролируемых исследований. Было доказано, что эффективность модуляторов NMDA-рецепторов является небольшой по силе выраженности в отношении негативных симптомов (SMD=-0,27) и средней для общих симптомов (SMD=-0,40). Межгрупповое сравнение показало, что D-серин и N-ацетилцистеин оказывают средний по силе эффект в отношении негативных (SMD=-0,53 и -0,45 соответственно) и общих (SMD=-0,40 и -0,64) симптомов, а глицин (SMD=-0,66) и саркозин (SMD=-0,41) – только для общих симптомов. Интересно, что в качестве дополнения к группе антипсихотиков, исключающих клозапин, была обнаружена эффективность модуляторов NMDA-рецепторов (SMD=-0,14) и глицина (SMD=-0,54) в отношении позитивных симптомов, D-серина (SMD=-0,54) N-ацетилцистеина (SMD=-0,45) и саркозина (SMD=-0,39) в отношении негативных симптомов и модуляторов NMDA-рецепторов (SMD=-0,38), D-серина (SMD=-0,40), глицина (SMD=-1,12), N-ацетилцистеина (SMD=-0,64) и саркозина (SMD=-0,53) – для всех симптомов в целом. При комбинации с клозапином ни один из препаратов не продемонстрировал терапевтический потенциал, а глицин даже усугубил позитивные симптомы (SMD=+0,56). Таким образом, комбинация D-серина, N-ацетилцистеина и саркозина с антипсихотиками за исключением клозапина терапевтически более эффективна в отношении негативных симптомов и симптомов в целом при хронической шизофрении, чем монотерапия антипсихотиками, однако комбинация глицина с антипсихотиками за исключением клозапина способствует редукции позитивных и симптомов в целом, но ухудшает эффективность клозапина (S.Singh и соавт., 2011).
Двойное слепое плацебо-контролируемое исследование пациентов с резистентной шизофренией, проведенное D. de Lucena и соавт. (2009 г.), оценивало эффективность комбинации мемантина (слабого неселективного антагониста NMDA-рецепторов) в дозе 20 мг/сут и клозапина на протяжении 12 нед. По сравнению с плацебо мемантин продемонстрировал значимое улучшение состояния пациентов по общему баллу BPRS, субшкалам позитивных симптомов (-1,38) и особенно негативных симптомов (-3,33), баллу CGI (1,56), данным Краткой шкалы для оценки психического состояния (Mini-Mental State Examination – MMSE). Различий с плацебо по показателю экстрапирамидных симптомов по шкале Симпсона–Ангуса (Simpson–Angus Scale – SAS) выявлено не было (D. de Lucena и соавт., 2009).
le – SAS) выявлено не было (D. de Lucena и соавт., 2009). Учитывая, что некоторые избирательные антагонисты серотониновых рецепторов 5НТ3 (ондансетрон) показали свою эффективность в отношении негативных симптомов, M.Khodaie-Ardakani и соавт. (2013 г.) изучили влияние комбинации гранисетрона (1 мг 2 раза в сутки) с рисперидоном (до 6 мг/сут) по сравнению с плацебо в течение 8 нед у 38 пациентов со стабильной шизофренией. Группа с гранисетроном продемонстрировала значимое улучшение по субшкале для оценки негативных симптомов PANSS [t(38)=6,046, среднее значение (±95% ДИ)=3,2 (1,8–3,7), p<0,001] и по общему баллу [t(38)=4,168, среднее значение (95% ДИ)=3,2 (1,6–4,7), p<0,001] по сравнению с плацебо. Однако в отношении позитивных и общих симптомов, а также депрессивных симптомов по HDRS различий между гранисетроном и плацебо выявлено не было. Балл по шкале для оценки экстрапирамидных симптомов (Extrapyramidal Symptom Rating Scale – ESRS) значимо снизился в группе гранисетрона на 4-й неделе, но сравнялся с плацебо на 8-й неделе терапии. На основании полученных данных авторы делают вывод о том, что гранисетрон может влиять на первичные негативные симптомы у больных шизофренией (M.Khodaie-Ardakani и соавт., 2013).
Таким образом, было проведено достаточно много исследований оценки статистической значимости эффективности влияния разных групп препаратов на негативные симптомы, однако не менее важным остается аспект клинической значимости эффективности терапии негативного домена.
Сведения о новейших фармакологических разработках в лечении негативных расстройств
оклад профессора Philip Tibbo из Университета Далхаузи, Канада, был посвящен новым терапевтическим разработкам и моделям фармакологического лечения негативных симптомов. Прежде всего он отметил, что современные антипсихотики неэффективны в отношении негативных симптомов по сравнению с их эффективностью относительно продуктивных расстройств. По данным R.Tandon (2010 г.), антипсихотики не эффективны в отношении первичных негативных симптомов, редуцируют вторичные негативные относительно позитивных симптомов и провоцируют вторичные относительно экстрапирамидных расстройств.Второе важное сообщение было посвящено глутаматовой теории шизофрении. Известно, что высвобождение глутамата у пациентов на ранней стадии шизофрении в продромальный период повышено, в то время как в процессе хронификации отмечается снижение содержания глутамата (передняя часть поясной извилины), что подтверждает факт о дисфункции в системе глутаматовой нейромедиации, ее изменениях на разных стадиях болезни (Théberge и соавт., 2003), а препараты, влияющие на NMDA-рецепторы (глицин, D-серин, D-аланин, D-циклосерин, саркозин), в комбинации с антипсихотиками более эффективны в отношении редукции негативных симптомов.
В настоящее время целый ряд новых препаратов находится на II и III стадиях клинических испытаний (ингибиторы обратного захвата глицина – Битопертин, Roche; молекула AMG-747, Amgen), агонисты метаботропных глутаматовых рецепторов типа 2/3 – MGluR2/3 (молекула LY2140023 – помаглуметадметионил, Lilly), позитивные аллостерические модуляторы метаботропных глутаматовых рецепторов типа 2 – MGluR2 (молекула JNJ-40411813 – ADX-71149, J&J/Addex), ГАМКергический антипсихотик (молекула CYP-1020, BioLineRx), психостимуляторы (Vivanse – лиздексамфетамин, Shire), агонисты a7-никотиновых ацетилхолинергических (a7-nACh) рецепторов (TC-5619, Targacept; EVP-6124, EnVivo). Дизайны исследований TC-5619, Битопертина и JNJ-40411813 (ADX-71149) ориентированы на показания негативных симптомов.
Один из новейших подходов в рамках глутаматовой гипотезы шизофрении – это ингибирование обратного захвата глицина. Повышение концентрации глицина в синаптической щели приводит к повышению связывания глицина с NMDA-рецепторами, через которые увеличивается синаптический эффект глутамата. Так, например, дизайн исследования Битопертина отражает важные критерии включения: выраженность негативных симптомов (более 40/84 по субшкале негативных симптомов PANSS и дезорганизация мышления, когнитивных функций), незначительная выраженность позитивных симптомов (менее 28/48 по субшкале позитивных симптомов PANSS, балл 4 не более чем для 2 из пунктов P1, P3, P6, G9 и отсутствие оценки в 5 баллов), отсутствие депрессивных симптомов, стабильный уровень экстрапирамидной симптоматики. Эти критерии позволяют избежать выявления «псевдоспецифичности», т.е. влияния изменений позитивных симптомов на уровень негативных симптомов, минимизировать вклад за счет изменения экстрапирамидной симптоматики и оценить чувствительность относительно изменений именно негативных симптомов. Битопертин в дозировке 10 и 30 мг в день эффективен в отношении негативных расстройств по сравнению с плацебо, а в дозировке 60 мг не имеет отличий от плацебо, что требует дальнейшего изучения. Результаты остальных испытаний планируют получить в 2014 г.
Трансляция результатов исследований в клиническую практику (взгляд клиницистов на диагностику и терапию негативной симптоматики)
Канадские ученые провели опрос 206 психиатров, чтобы уточнить мнение клиницистов, которые в ежедневной рутинной практике сталкиваются с пациентами, имеющими персистирующие негативные симптомы (D.Lutgens и соавт., 2013). 83% респондентов отметили высокую распространенность негативных симптомов, которые не отечают достаточным образом на терапию. 46% отмечают у своих больных в большей мере нарушения социализации, 45% – абулию, 36% – уплощение аффекта. 44% считают частыми расстройствами ангедонию и 36% – алогию. 76% клиницистов считают, что они могут достоверно отличать проявления негативных симптомов и перекрывающих их симптомов депрессии и экстрапирамидных проявлений. 96,5% врачей уверены, что негативные симптомы оказывают основательное влияние на функциональный прогноз больных и наносят ущерб семье. При этом только 43% считают необходимым регулярно оценивать негативные симптомы у своих больных и 30% делают это, так как 50% врачей считают, что главной мишенью терапии являются позитивные симптомы, а их выраженность и отсутствие лечения непосредственно связаны с формированием негативных симптомов. Только 13,5% опрошенных канадских психиатров считают, что II поколение атипичных антипсихотиков эффективно у 50–74% больных, и лишь 5,3% – что они очень эффективны. 48% клиницистов уверены, что антидепрессанты неэффективны в терапии негативных симптомов (эффективны только у 11–24% больных или слабо эффективны у 25–49% больных). 60% психиатров считают, что когнитивно-поведенческая терапия малоэффективна у 25–49%, и лишь 17% уверены, что когнитивно-поведенческая терапия эффективна или даже очень эффективна (D.Lutgens и соавт., 2013).фективна (D.Lutgens и соавт., 2013). Можно сделать вывод о том, что до сих пор невелика трансляция результатов исследования в клиническую практику и, хотя негативные симптомы считаются в среде практикующих врачей важным фактором формирования плохого прогноза и функционирования больных, о чем свидетельствуют и исследования по сравнению негативного домена с другими клиническими дименсиями (Rabinowitz и соавт., 2012), негативные симптомы недостаточно распознаются, прицельно не оцениваются клиницистами, не попадают в фокус отдельных мишеней для терапии, и в том числе терапевтическая тактика остается прежней.
Связанные с негативной симптоматикой показатели социального функционирования и субъективные переживания больных и их родственников
Говоря о необходимости повышения качества функционирования пациентов, страдающих от негативной симптоматики, заведующий отделением психиатрии Университетской клиники г. Клермон-Ферран (Франция), профессор P.-M.Llorka расставил акценты в своем докладе на тех феноменах и факторах, которые имеют не только и не столько клиническое, сколько субъективное значение для пациента и его близких.В реальности симптоматическая ремиссия при шизофрении не всегда подразумевает существенное улучшение функционирования пациента во всех сферах его жизни, как утверждают А.Karow и соавт. из рабочей группы по Ремиссиям при шизофрении (2012 г.). В рамках рабочего проекта Европейской группы по функциональным исходам и ремиссиям при шизофрении (EGOFORS) изучались психопатологическая симптоматика (PANSS), уровень функционирования – по шкале оценки функциональной ремиссии общей шизофрении (Functional Remission of General Schizophrenia Scale – FROGS), шкале глобального функционирования (the Global Assessment of Functioning – GAF) и субъективное благополучие – по шкале оценки субъективного благополучия на фоне приема нейролептиков (the Subjective Well-being under Neuroleptic scale – SWN-K).
Поперечное исследование 131 пациента с шизофренией на стадии симптоматической ремиссии выявило, что в соответствии с критериями N.Andreasen 58 больных характеризовались высоким уровнем функционирования (A.Karow и соавт., 2012). При этом из их числа 40% больных не испытывали интереса к эмоциональной стороне отношений, 30% не вернулись к профессиональной деятельности, 20% имели низкий уровень бытового функционирования, 11% – низкий уровень ассертивности в контексте социальных отношений (снижение способности человека не зависеть от внешних влияний и оценок, самостоятельно регулировать собственное поведение и отвечать за него) (A.Karow и соавт., 2012).
Еще один раздел работы в рамках проекта EGOFORS включал перекрестное исследование, целью которого явилось изучение влияния разных клинических доменов на функционирование больных шизофренией и его разные составляющие (P.Llorca и соавт., 2012). Данные, полученные от когорты из 296 пациентов с шизофренией, состояние которых оценивалось с применением шкал PANSS, FROGS, SWN-K, QLS, подвергались многофакторному статистическому анализу и анализу с помощью метода математического моделирования с латентными переменными (в качестве латентной переменной был взят показатель функционирования больных, в качестве показателей – подуровни шкал FROGS, SWN-K, QLS, а в качестве экзогенной переменной – симптоматика, продолжительность нелеченного психоза и уровень образования). Среди 5 клинических дименсий по шкале PANSS (позитивные симптомы, негативные симптомы, когнитивные нарушения, тревога/депрессия и возбуждение) негативная и когнитивная дименсии опосредованно через латентную переменную функционирования продемонстрировали высокие показатели корреляции с тремя дименсиями по шкале FROGS (повседневная жизнь, социальное функционирование и лечение) и подуровнями шкалы QLS (межличностные отношения, общее качество жизни, производительная активность). Показатель образовательного уровня положительно коррелировал с уровнем функционирования, но не с показателем продолжительности нелеченного психоза. Авторы подчеркивают, что негативные симптомы отрицательно влияют на функционирование больных преимущественно в аспектах социализации и межличностных отношений, что является мишенью для соответствующей терапевтической коррекции (P.Llorca и соавт., 2012).
Отдельный интерес представляет работа P.Milev и соавт. (2005 г.), которая была посвящена не только исследованию влияния нейрокогнитивного дефицита на прогноз заболевания, но и изучению вопроса о том, имеет ли влияние тяжесть негативных симптомов на прогноз и функционирование больных шизофренией вне зависимости от показателей нейрокогнитивного домена. Авторы разработали развернутую батарею когнитивных тестов и оценки клинического состояния и проспективно исследовали 99 пациентов, начиная с первого эпизода психоза и в катамнезе в течение периода времени, равного в среднем 7 годам. Показатели вербальной памяти, скорости обработки информации и внимания, а также тяжесть негативных симптомов продемонстрировали свою прогностическую значимость. Общее психосоциальное функционирование предопределялось негативной симптоматикой и параметрами нарушения внимания. Показатель вербальной памяти был оценен как значимый предиктор степени нарушения в вопросах проведения досуга. Нарушение межличностных отношений предопределялось негативными симптомами и показателями памяти, в то время как внимание и негативные симптомы были значимыми факторами, определяющими сложности трудоустройства. Авторы сделали вывод о том, что многие аспекты прогноза объясняются не независимыми факторами, а в большей мере перекрытием переменных когнитивного и негативного домена.
Однако степень выраженности негативных симптомов была одним из доказанных предикторов нарушенного общего психосоциального функционирования, который следовал только лишь за показателем внимания как первого важного фактора прогноза. Ученые указывают на то, что вербальная память, скорость обработки информации и внимание являются важными потенциальными мишенями для психосоциальных интервенций, которые могут позволить уменьшить выраженность негативных и когнитивных нарушений и улучшить общий прогноз функционирования больных (P.Milev и соавт., 2005).
Некоторые работы с небольшими выборками пациентов указывают на взаимосвязь мотивационного дефицита и функционального прогноза у больных шизофренией (G.Foussias и соавт., 2011; G.Fervaha и соавт., 2013). G.Foussias и соавт. (2011 г.) утверждают, что дефицит мотивации является центральным компонентом среди негативных симптомов шизофрении. Отсутствие мотивации в 74% случаев оказывает влияние на функционирование больных и является предиктором прогноза. G.Fervaha, G.Foussias и соавт. (2013 г.) новыми работами подтверждают, что такие негативные симптомы, как отсутствие мотивации или апатия по шкале для оценки апатии (клиническая версия) (Apathy Evaluation Scale, Clinical version – AES-C), тесно связаны с функциональным прогнозом и влияют на течение заболевания у пациентов на начальной стадии болезни.
G.Fervaha, O.Agid и соавт. (2013 г.) изучали субъективные показатели самочувствия и удовлетворенности качеством жизни у 1437 пациентов с хронической шизофренией, которые принимали участие в исследовании клинической эффективности антипсихотической терапии (Clinical Antipsychotic Trial of Intervention Effectiveness – CATIE). Результаты анализа данных показали, что клинические симптомы оказывают неблагоприятное влияние на субъективное ощущение благополучия, при этом симптомы депрессии были наиболее выраженным индикатором неудовлетворенности жизнью, которая в свою очередь коррелировала с наихудшим психосоциальным функционированием, наиболее выраженными симптомами тревоги, апатии и побочными эффектами от приема лекарств. Таким образом, симптомы апатии и отсутствия мотивации у пациентов связаны с субъективным ощущением неудовлетворенности жизнью (F.Fervaha, O.Agid и соавт., 2013).
В своей следующей работе рабочая группа под руководством G.Fervaha (2013 г.) показала, что нарушения мотивации у больных шизофренией связаны с затруднением рассчитывать затрачиваемые усилия в требующих решения и сопряженных с вознаграждением заданиях. По сравнению со здоровыми в условиях, когда большие усилия вознаграждались большим денежным эквивалентом, больные шизофренией делали выбор в пользу затраты меньших усилий. Сложности побуждения мотивационной активности также были сопряжены с фактором импульсивности. Авторы предлагают учитывать полученные данные при разработке терапевтических интервенций в отношении мишени мотивационного дефицита (G.Fervaha и соавт., 2013).
Перекрестное ретроспективное многоцентровое исследование с участием 1704 больных шизофренией, шизофреноформным и шизоаффективным расстройством, получающих антипсихотическую терапию в режиме амбулаторного лечения, показало, что у 57,6% пациентов отмечаются те или иные негативные симптомы, в том числе 12,9% являются первичными (J.Bobes и соавт., 2010). Наиболее часто представленными в клинике негативными симптомами были социальная отгороженность (45,8%), эмоциональная отгороженность (39,1%), бедный раппорт (35,8%) и притупленный аффект (33,1%). Наблюдавшиеся негативные симптомы (1 – притупленный аффект, 2 – эмоциональная отгороженность, 3 – бедный раппорт, 4 – социальная отгороженность, 5 – вербальная беглость) четко коррелировали с фактором мужского пола (симптом 4), возраста старше 40/45 лет (женщины и мужчины, симптомы 1, 2, 4), со статусом вне брака (симптомы 2–4), безработицей (симптомы 3, 4), более высоким показателем по шкале общего клинического впечатления CGI и общим баллом PANSS (симптомы 1–5), более низким уровнем по субшкале позитивных симптомов PANSS (симптомы 1, 3), продолжительностью лечения более 52 нед (симптомы 1–3, 5) и высокой дозой антипсихотического препарата (симптом 2).
Авторы подчеркивают, что наибольшее отрицательное воздействие, которое оказывают негативные симптомы в связи с нарушением социального взаимодействия, формируется в отношении аспектов трудоустройства (J.Bobes и соавт., 2010). Как добавил в своем докладе профессор P.-M.Llorka, такие негативные симптомы, как притупленный аффект и социальная отгороженность, определяют общий социальный прогноз, а недостаток спонтанности коррелирует с показателем повседневного функционирования.
Двумя десятилетиями раньше группа под руководством J.Brekke (1993 г.) из Университета Южной Калифорнии (г. Лос-Анджелес) изучала взаимосвязь между психосоциальным функционированием (показатели функционирования на работе, социального функционирования, жизненной ситуации) и субъективным опытом (показатели самооценки, удовлетворенности жизнью, субъективного дистресса) у 193 больных шизофренией. Многофакторный анализ позволил выявить два основных феномена. Первый описывает модель психосоциального функционирования, которую можно определить как переменные, ассоциированные с болезнью (симптоматика и внутрипсихический дефицит), и переменные функционального статуса (ситуация на работе, в социуме, в жизни). Вторая важная находка – двухуровневая модель, связывающая психосоциальное функционирование и субъективный опыт. Модель указывает на первичную и глубокую взаимосвязь между ассоциированными с болезнью переменными и субъективным опытом и вторичную, менее выраженную связь между показателями социального функционирования и субъективным опытом. Так, между собой четко коррелируют показатели функционирования (трудоустройство, ситуация в социуме и в жизни), негативные симптомы и самооценка. Ученые отмечают, что субъективный опыт больных представляется очень важным для понимания болезни и ее лечения, а интервенции, направленные на редукцию негативных симптомов и коррекцию указанных переменных функционирования, могут повысить улучшить субъективные ощущения жизни (J.Brekke и соавт., 1993).
Как показывает работа D.Ukpong (2012 г.), негативные симптомы являются одним из основных факторов, определяющих бремя и дистресс и у родственников пациентов – в частности, такие клинические реальности, как ангедония, затруднения в социализации и притупленный аффект, являлись четким предиктором тяжести бремени (Интервью для оценки бремени Зарита – Zarit Burden Interview, ZBI) у 101 родственника и опекуна больных шизофренией. Высокий уровень психологического дистресса у лиц, осуществляющих заботу о больных шизофренией, оцененный по Опроснику общего здоровья (General Health Questionnaire – GHQ-30), коррелировал с такими симптомами, как нарушение внимания и абулия. Высокий уровень бремени у опекунов коррелировал с факторами безработицы и низким уровнем образования у опекуна, а высокий уровень эмоционального дистресса – с фактором женского пола больных и их низким образовательным уровнем.
Работа показала важность включения коррекционных и образовательных интервенций для родственников и опекунов в общую программу лечебных мероприятий для больных шизофренией (D.Ukpong и соавт., 2012). В своем докладе профессор P.-M.Llorka упомянул очень важную и интересную статью под названием «Негативные симптомы и эмоции при шизофрении», опубликованную доктором J.Bouricius в издании «Schizophrenia Bulletin» в 1989 г. В ней автор описывает случай больного шизофренией и его поэзию через призму его негативной симптоматики и субъективных эмоциональных переживаний. Ниже представлен фрагмент стихотворения, содержание которого интерпретируется как проявления симптомов алогии и абулии в субъективном контексте больного (пер. Д.А.Смирновой).

Профессор подчеркнул, что внимательное отношение к тому, что говорят сами больные и члены их семей, а также творчество больных и их интерпретации своего состояния являются не менее важными аспектами для детального изучения с целью формирования верной и мишень-ориентированной тактики терапевтических вмешательств.
Доклад профессора X.Amador из государственного университета Нью-Йорка (США) был посвящен актуальным аспектам способов оценки негативных симптомов и важности феноменов нарушенного инсайта или анозогнозии (отрицания факта болезни) и дефицита мотивации у больных шизофренией. По мнению профессора, именно эти два негативных симптома являются наиболее значимыми предикторами нарушения функционирования, так как влияют на отношения больных с медицинскими работниками, членами семей, работодателями, – являются «теми стеклянными стенами», которые отделяют больных от окружающего мира.
Больные шизофренией игнорируют те дефицитарные нарушения, которые возникают у них в связи с болезнью, и тот неблагоприятный эффект, который болезнь оказывает на их жизнь. Недостаток осознания болезни является частью феноменологии шизофрении, отражается в ее патофизиологии и вносит свой вклад в нарушение комплаенса при терапии этих пациентов (X.Amador и соавт., 1991). Доказательства свидетельствуют в пользу того, что нарушение осознания факта болезни в большей мере отражает собственно манифестацию психоза подобно анозогнозии при инсульте, а не копинг-стратегию пациента. В исследованиях показано, что недостаточный инсайт коррелирует с повышением частоты обострений, числа недобровольных госпитализаций, плохим психосоциальным функционированием и неблагоприятным течением болезни. Устойчивый дефицит осознания болезни был признан симптомом шизофрении в DSM IV-TR.
Несмотря на то что были доказаны корреляции дефицита мотивации и функционального прогноза больных, а мотивация рассматривалась как важный опосредующий фактор, связывающий нейрокогниции и психосоциальное функционирование, мотивационный дефицит недостаточно адекватно оценивался с помощью SANS и PANSS, в связи с чем была разработана отдельная шкала внутренней мотивации для исследования шизофрении (Intrinsic Motivation Inventory for Schizophrenia Research – IMI-SR) (J.Choi и соавт., 2010). Шкала позволяет оценить центральные мотивационные структуры, выделенные в рамках теории селф-детерминизма (выполнение когнитивных задач, усвоение навыков, соблюдение режима лечения – терапевтический комплаенс, и результат реабилитации).
В исследовании по валидизации шкалы принимали участие 58 больных шизофренией, находившихся на амбулаторном лечении и проходивших курс когнитивной реабилитации, 15 больных со стабильной шизофренией и 22 здоровых. Шкала продемонстрировала хорошую внутреннюю логику, последовательность (a=0,92) и тест-ретестовую надежность (внутриклассовая корреляция 0,77). 24 пункта опросника были сведены в три основных домена, соответствующих фокусам мотивации в терапевтическом аспекте: интерес/удовольствие, осуществление выбора, ценность/полезность. Важным преимуществом шкалы является возможность с помощью нее оценить тех больных, у которых наступает и не наступает улучшение в отношении когнитивных задач и актуальных обучающих упражнений, разделить высокую и низкую степени участия в терапии и, собственно, продемонстрировать чувствительность изменений мотивации в ответ на вариации интервенций. Шкала IMI-SR представляется важным инструментом, который рекомендуется использовать в протоколах ведения больных в рамках курса когнитивной реабилитации и программ психосоциальной реабилитации (J.Choi и соавт., 2010).
Таким образом, негативные симптомы дефицит осознания болезни (снижение критики) и дефицит мотивации, связанные с ними изменения социального функционирования и субъективные переживания больных требуют прицельного внимания как при разработке программы терапевтических мероприятий, так и при проведении оценки их эффективности. Профессиональное внимание к этим симптомам может помочь пациентам «продвинуться сквозь стеклянные стены навстречу миру».
Заключение
Несмотря на развитие теоретических моделей, касающихся психопатологии и нейробиологии негативных симптомов, разработку инструментария для оценки негативных симптомов, практическая проблема эффективности терапии дефицитарных расстройств до сих пор далека от разрешения. Одна из последних работ ученых из университетов Питтсбурга и Гарварда, отражающая результаты двухлетнего исследования эффективности терапии когнитивных функций (Cognitive Enhancement Therapy), заслуживает внимания, так как демонстрирует значимые улучшения в отношении негативных симптомов (повышение мотивации, упорядочивание и повышение активности мышления, расширение спектра когнитивных стратегий, формирование более здорового режима дня, уменьшение социальной изоляции) у больных, проходивших курс когнитивной психотерапии, когнитивного корректирующего обучения и реабилитационных мероприятий (S.Eack и соавт., 2013). Учитывая сложности в успехах фармакотерапии в рамках комплексного подхода к лечению негативных симптомов и шизофрении в целом, на сегодняшнем этапе развития медицины необходимо правильно оценивать состояние вопроса и обращаться к психотерапевтическим и реабилитационным интервенциям, уделяя внимание направлению поддерживающей терапии и работая в психообразовательном ключе как с больными, так и с людьми, которые оказывают им помощь.Благодарности
Автор выражает благодарность компании «Сервье» в лице доктора F.Camus, секретаря V.Ribeaux и главного менеджера Д.П.Морозова, а также куратору образовательного проекта WPA-Servier, региональному представителю Всемирной психиатрической ассоциации в Зоне 10 Восточная Европа за возможность посещения 26-го Конгресса Европейской коллегии нейропсихофармакологии.Сведения об авторе
Дарья Александровна Смирнова – канд. мед. наук, ассист. каф. психиатрии, наркологии, психотерапии и клинической психологии ГБОУ ВПО СамГМУ Минздрава России. E-mail: daria.smirnova.phd@gmail.com
Список исп. литературыСкрыть список1. Мосолов С.Н. Шкалы психометрической оценки симптоматики шизофрении и концепция позитивных и негативных расстройств. М.: Новый цвет, 2001.
2. Amador XF, Strauss DH, Yale SA, Gorman JM. Awareness of illness in schizophrenia. Schizophr Bull 1991; 17 (1): 113–32.
3. Andreasen NC. Negative symptoms in schizophrenia: definition and reliability. Arch Gen Psychiatry 1982; 39: 784–8.
4. Andreasen NC, Nopoulos P, O’Leary DS et al. Defining the phenotype of schizophrenia: cognitive dysmetria and its neural mechanisms. Biol Psychiatry 1999; 46 (7): 908–20.
5. Baaré WF, Hulshoff Pol HE, Hijman R et al. Volumetric analysis of frontal lobe regions in schizophrenia: relation to cognitive function and symptomatology. Biol Psychiatry 1999; 45 (12): 1597–605.
6. Bleuler E. Dementia Praecox Or The Group Of Schizophrenias. New York, NY: International Universities Press, 1950. (Bleuler E. Dementia praecox oder Gruppe der Schizophrenien. Deutike, Leipzig, 1911.)
7. Bobes J, Arango C, Garcia-Garcia M, Rejas J. CLAMORS Study Collaborative Group. Prevalence of negative symptoms in outpatients with schizophrenia spectrum disorders treated with antipsychotics in routine clinical practice: findings from the CLAMORS study. J Clin Psychiatry 2010; 71 (3): 280–6.
8. Bouricius JK. Negative symptoms and emotions in schizophrenia. Schizophr Bull 1989; 15 (2): 201–8.
9. Brekke JS, Levin S, Wolkon GH et al. Psychosocial functioning and subjective experience in schizophrenia. Schizophr Bull 1993; 19 (3): 599–608.
10. Choi J, Mogami T, Medalia A. Intrinsic motivation inventory: an adapted measure for schizophrenia research. Schizophr Bull 2010; 36 (5): 966–76.
11. Coyle JT. Glutamate and schizophrenia: beyond the dopamine hypothesis. Cell Mo lNeurobiol 2006; 26 (4–6): 365–84.
12. Crow TJ. Brain changes and negative symptoms in schizophrenia. Psychopathology 1995; 28 (1): 18–21.
13. Crow TJ. Positive and negative schizophrenic symptoms and the role of dopamine. Br J Psychiatry 1980; 137: 383–6.
14. Darbà J, Minoves A, Rojo E et al. Efficacy of second-generation-antipsychotics in the treatment of negative symptoms of schizophrenia: a meta-analysis of randomized clinical trials. Rev Psiquiatr Salud Ment 2011; 4 (3): 126–43.
15. Davis KL, Kahn RS, Ko G, Davidson M. Dopamine in schizophrenia: a review and reconceptualization.Am J Psychiatry 1991; 148 (11): 1474–86.
16. de Lucena D, Fernandes BS, Berk M et al. Improvement of negative and positive symptoms in treatment-refractory schizophrenia: a double-blind, randomized, placebo-controlled trial with memantine as add-on therapy to clozapine. J Clin Psychiatry 2009; 70 (10): 1416–23.
17. Donohoe G, Morris DW, De Sanctis P et al. Early visual processing deficits in dysbindin-associated schizophrenia. Biol Psychiatry 2008; 63 (5): 484–9.
18. Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition (DSM-5TM). American Psychiatric Association, 2013.
19. Eack SM, Mesholam-Gately RI, Greenwald DP et al. Negative symptom improvement during cognitive rehabilitation: results from 2-year trial of Cognitive Enhancement Therapy. Psychiatry Res 2013; 209 (1): 21–6.
20. Fervaha G, Agid O, Takeuchi H et al. Clinical determinants of life satisfaction in chronic schizophrenia: Data from the CATIE study. Schizophr Res 2013. Pii: S0920-9964(13)00568-9. doi: 10.1016/j.schres.2013.10.021. [Epub ahead of print]
21. Fervaha G, Graff-Guerrero A, Zakzanis KK et al. Incentive motivation deficits in schizophrenia reflect effort computation impairments during cost-benefit decision-making. J Psychiatr Res 2013; 47 (11): 1590–6.
22. Fervaha G, Foussias G, Agid O, Remington G. A motivation and functional outcomes in early schizophrenia. Psychiatry Res 2013; 210 (2): 665–8.
23. Foussias G, Mann S, Zakzanis KK et al. Prediction of longitudinal functional outcomes in schizophrenia: the impact of baseline motivational deficits. Schizophr Res 2011; 132 (1): 24–7.
24. Harvey PD, Koren D, Reichenberg A, Bowie CR. Negative Symptoms and Cognitive Deficits: What Is the Nature of Their Relationship? Schizophr Bull 2006.
25. Hecht EM, Landy DC. Alpha-2 receptor antagonist add-on therapy in the treatment of schizophrenia; a meta-analysis. Schizophr Res 2012; 134 (2–3): 202–6.
26. Iizuka Y, Sei Y, Weinberger DR, Straub RE. Evidence that the BLOC-1 protein dysbindin modulates dopamine D2-receptor internalization and signaling but not D1 internalization. J Neurosci 2007; 27 (45): 12390–5.
27. Janzarik W. Basic dynamic states in endogenous psychoses, with special reference to the pharmacotherapy of depressive states. Can Psychiatr Assoc J 1959; 4 (Suppl.): 195–7.
28. Karow A, Moritz S, Lambert M et al.; EGOFORS Initiative. Remitted but still impaired? Symptomatic versus functional remission in patients with schizophrenia. Eur Psychiatry 2012; 27 (6): 401–5.
29. Kay SR, Fiszbein A, Opler LA. The Positive and Negative Syndrome Scale (PANSS) for schizophrenia. Schizophr Bull 1987; 13: 261–76.
30. Keefe RS, Harvey PD, Lenzenweger MF et al. Efficacy and extrapyramidal side-effects of the new antipsychotics olanzapine, quetaipaine, risperidone, and sertindole compared to conventional antipsychotics and placebo: a meta-analysis of randomized controlled trials. Schizophr Res 1999; 35: 51–68.
31. Khodaie-Ardakani MR, Seddighi S, Modabbernia A et al. Granisetron as an add-on to risperidone for treatment of negative symptoms in patients with stable schizophrenia: randomized double-blind placebo-controlled study. J Psychiatr Res 2013; 47 (4): 472–8.
32. Kim DW, Shim M, Kim JI et al. Source Activation of P300 Correlates with Negative Symptom Severity in Patients with Schizophrenia. Brain Topogr 2013. [Epub ahead of print]
33. Kirkpatrick B, Fenton WS, Carpenter WT Jr, Marder SR. The NIMH-MATRICS consensus statement on negative symptoms. Schizophr Bull 2006; 32 (2): 214–9.
34. Kraepelin E. Dementia Praecox and Paraphrenia. Edinburgh, UK: E. & S. Livingston, 1919.
35. Kvajo M, McKellar H, Arguello PA et al. A mutation in mouse Disc1 that models a schizophrenia risk allele leads to specific alterations in neuronal architecture and cognition. Proc Natl Acad Sci USA 2008; 105 (19): 7076–81.
36. Levkovitz Y, Mendlovich S, Riwkes S et al. A double-blind, randomized study of minocycline for the treatment of negative and cognitive symptoms in early-phase schizophrenia. J Clin Psychiatry 2010; 71 (2): 138–49.
37. Li D, Collier DA, He L. Meta-analysis shows strong positive association of the neuregulin 1 (NRG1) gene with schizophrenia. Hum Mol Genet 2006; 15 (12): 1995–2002.
38. Llorca PM, Blanc O, Samalin L et al.; EGOFORS Initiative. Factors involved in the level of functioning of patients with schizophrenia according to latent variable modeling. Eur Psychiatry 2012; 27 (6): 396–400.
39. Lutgens D, Lepage M, Manchanda R, Malla A. Persistent negative symptoms in schizophrenia: survey of Canadian psychiatrists. Int Psychiatry 2013; 10 (3): 69–72.
40. Milev P, Ho BC, Arndt S, Andreasen NC. Predictive values of neurocognition and negative symptoms on functional outcome in schizophrenia: a longitudinal first-episode study with 7-year follow-up. Am J Psychiatry 2005; 162 (3): 495–506.
41. Mueser KT, Douglas MS, Bellack AS, Morrison RL. Assessment of enduring deficit and negative symptom subtypes in schizophrenia. Schizophr Bull 1991; 17 (4): 565–82.
42. Mwansisya TE, Wang Z, Tao H et al. The diminished interhemispheric connectivity correlates with negative symptoms and cognitive impairment in first-episode schizophrenia. Schizophr Res 2013; 150 (1): 144–50.
43. Olney JW, Farber NB. Glutamate receptor dysfunction and schizophrenia. Arch Gen Psychiatry 1995; 52 (12): 998–1007.
44. Potkin SG, Alva G, Fleming K et al. A PET study of the pathophysiology of negative symptoms in schizophrenia.Positron emission tomography.
10 июня 2014
Количество просмотров: 9101


