Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03 2014
В поиске оптимальных персональных исходов при первом психотическом эпизоде: от нейробиологических симптомов до принятия клинических решений №03 2014
Номера страниц в выпуске:36-40
В статье изложены материалы, посвященные проблеме оказания помощи пациентам с первичным психотическим эпизодом (ППЭ), которые были представлены на 26-м Конгрессе Европейской коллегии по нейропсихофармакологии (ECNP) в Барселоне (Испания) 5–9 октября 2013 г. Результаты исследований убедительно показывают, что раннее вмешательство с использованием комплексных воздействий (фармакотерапия, психообразование и психосоциальная реабилитация) помогает добиться высокого уровня ответа на лечение, снижает риск обострения, повышает доверие и уровень лояльности к службам, оказывающим помощь, помогает вовлечь семью в лечебный процесс и реабилитацию, что существенно улучшает исходы заболевания.
Резюме. В статье изложены материалы, посвященные проблеме оказания помощи пациентам с первичным психотическим эпизодом (ППЭ), которые были представлены на 26-м Конгрессе Европейской коллегии по нейропсихофармакологии (ECNP) в Барселоне (Испания) 5–9 октября 2013 г. Отмечено, что негативная симптоматика у пациентов с ППЭ является препятствием к восстановлению социального функционирования. Вместе с тем результаты исследований убедительно показывают, что раннее вмешательство с использованием комплексных воздействий (фармакотерапия, психообразование и психосоциальная реабилитация) помогает добиться высокого уровня ответа на лечение, снижает риск обострения, повышает доверие и уровень лояльности к службам, оказывающим помощь, помогает вовлечь семью в лечебный процесс и реабилитацию, что существенно улучшает исходы заболевания. Перспективным направлением фармакологического вмешательства у пациентов со стойкой негативной симптоматикой является применение агентов – предшественников глутатиона, главного устранителя свободных радикалов в мозге – N-ацетилцистеина. Подтвержден его позитивный эффект при шизофрении (более мощный на ранних стадиях) на редукцию негативной симптоматики, снижение экстрапирамидных побочных эффектов, улучшение функционирования и качества жизни. Экстрапирамидные и метаболические побочные эффекты приема антипсихотиков обусловлены индивидуальными факторами, которые должны учитываться в процессе антипсихотической терапии. Все изложенное позволяет сделать вывод о том, что оптимизация исходов психоза базируется на персонификации диагностики и терапии этой патологии.
Ключевые слова: первичный психотический эпизод, рецидив, психосоциальная реабилитация, исход, антипсихотическая терапия, негативная симптоматика, экстрапирамидные и метаболические побочные эффекты.
Searching optimal personal outcomes in the first episode of psychosis:
from neurobiological symptoms to making clinical decisions
M.M.Denysenko
Institute of Neurology, Psychiatry and Narcology of the NAMS of Ukraine SI, Kharkiv, Ukraine
Summary. The article describes materials on problems of medical care for patients with the first episode of psychosis (FEP) which were presented on 26th ECNP Congress in Barcelona, Spain, October 5–9, 2013. It is pointed out that in patients with FEP negative symptoms hinder a recovery in terms of a social functioning. Along with this, results of investigations demonstrate obviously that an early intervention with integrated approaches (pharmacological treatment, psychoeducation, and psychosocial rehabilitation) helps in achieving of high treatment responses, decreases a risk of exacerbation, increases confidence and loyalty levels to health care services, promotes an involvement of family into treatment and rehabilitation. All of these improve substantially outcomes of the disease. For patients with steady negative symptoms a promising direction of pharmacological intervention is usage of a precursor agent of glutathione, a leading brain free radical scavenger, – N-acetyl-cysteine. It was supported its positive effects on reduction of negative symptoms, decreasing of extrapyramidal side effects, and functioning and quality of life improvement in schizophrenia (more prominent on early stages). Extrapyramidal and metabolic side effects of the antipsychotic medications intake are stipulated by individual factors, which should be taking into account in the antipsychotic treatment process. All the mentioned above allow us to conclude that optimization of psychosis outcomes is based on a personification of diagnosis and therapy of this pathology.
Key words: first episode of psychosis, recurrence, psychosocial rehabilitation, outcome, antipsychotic therapy, negative symptoms, extrapyramidal and metabolic side effects.
В статье изложены материалы, посвященные проблеме оказания помощи пациентам с первичным психотическим эпизодом (ППЭ), которые были представлены на 26-м Конгрессе Европейской коллегии по нейропсихофармакологии (ECNP) в Барселоне (Испания) 5–9 октября 2013 г.
Проблема оказания помощи больным с ППЭ имеет огромное медико-социальное значение. Установлено, что раннее вмешательство приводит к снижению тяжести заболевания, обеспечивает ускорение наступления ремиссии, снижает риск развития когнитивного дефицита и суицидального поведения, обеспечивает восстановление социального функционирования, предотвращает хронизацию патологии, уменьшает количество госпитализаций и их продолжительность [1, 2].
Социальный аспект проблемы обусловлен тем, что, по данным Всемирной организации здравоохранения, острый психоз является третьим из наиболее инвалидизирующих состояний, а основные психотические расстройства приводят к уменьшению продолжительности жизни в среднем на 10 лет. Начало заболевания приходится, как правило, на молодой возраст, что нарушает общественную, профессиональную и семейную активность, формирует значительное бремя для семьи и общества. Депрессивные расстройства, наркотическая зависимость и личностные дисфункции, сопровождающие ППЭ, существенно ухудшают исход состояния, что обусловливает необходимость раннего вмешательства [3–5].
К наиболее важным и проблемным моментам оказания помощи пациентам с ППЭ относятся эффективность купирования негативных симптомов, результативная профилактика рецидивов, комплексность проводимого лечения и обеспечение его безопасности. Эти проблемы являются зеркальным отражением аналогичных сложностей, возникающих в процессе оказания помощи пациентам с шизофренией.
Нейробиологической основой современных фармакологических стратегий ППЭ является дофаминовая гипотеза, отражающая повышение активности пресинаптического синтеза дофамина. Функциональная активность современных антипсихотиков сопряжена с блокадой D2-рецепторов, что и обусловливает редукцию психотических симптомов. При этом практический опыт и проведенные научные исследования показали, что блокада D2-рецепторов в большой степени способствует купированию позитивных симптомов, в то время как негативная симптоматика в меньшей мере поддается обратному развитию.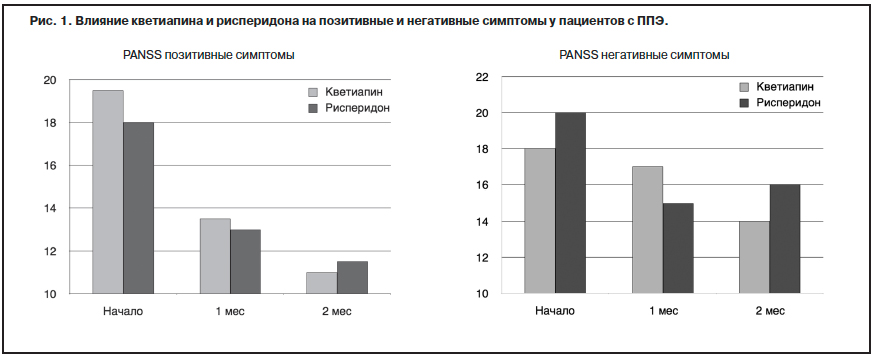
Все больше доказательств отражает преимущественное влияние современных антипсихотиков на позитивную симптоматику (рис. 1).
На рис. 1 представлена динамика позитивной и негативной симптоматики в течение 2-месячного периода под действием рисперидона и кветиапина.
Представленные данные свидетельствуют о том, что в момент первичного обследования средняя выраженность позитивной и негативной симптоматики составляла 18–19 и 18–20 баллов соответственно. После лечения указанными антипсихотиками в течение 1 мес уровень позитивной симптоматики снизился до 13–14, негативной – до 15–16 баллов. После 2 мес терапии уровень
позитивной симптоматики составлял уже 11, а негативной – 14–16 баллов, что свидетельствует об ее определенной устойчивости к антипсихотической терапии – АТ
(Gufoor и соавт., 2010).
Негативная симптоматика является одной из главных психопатологических причин, нарушающих восстановление социального функционирования пациентов с ППЭ. Особое место при этом отводится стойким негативным симптомам (СНС). В процессе исследования проведено сравнение пациентов с СНС и пациентов с наличием хотя бы одного негативного симптома умеренной или повышенной тяжести на момент начала лечения и после 1 года лечения. С этой целью обследованы 345 пациентов с ППЭ (рис. 2).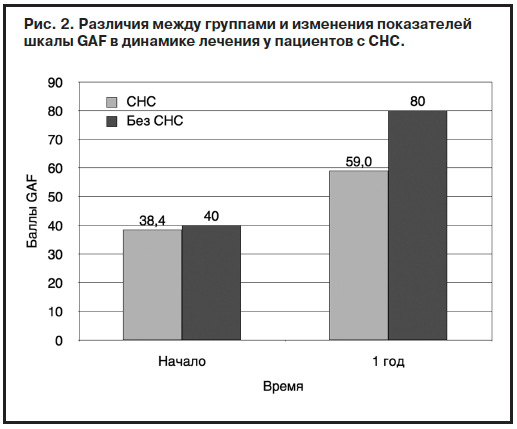
Как видно из рис. 2, на момент начала лечения средний балл по шкале GAF в группе СНС составлял 38,4 балла, без СНС – 40,0 балла. После 12 мес лечения средний балл по шкале GAF в группе СНС составлял 59,0 балла, без СНС – 80,0 балла, что отображает ограничение социального функционирования у пациентов с СНС.
Также установлено, что пациенты с ППЭ, у которых присутствуют СНС, чаще подвержены самостоятельному прекращению лечения, чем пациенты без СНС (65 и 30% соответственно; p<0,01). Представленные данные еще раз подтверждают тот факт, что негативные симптомы в наибольшей степени влияют на социальное функционирование, основными составляющими которого являются самостоятельное проживание, межличностные взаимодействия, активный отдых, работа или учеба [4, 6].
Одно из наиболее перспективных современных направлений коррекции негативных симптомов базируется на теории нарушенного обмена глутатиона у больных шизофренией. Основой теории являются данные о том, что у пациентов с шизофренией уровень глутатиона в крови в
3 раза ниже по сравнению с контролем, аналогичное снижение выявлено у пациентов с биполярным расстройством и депрессией (рис. 3).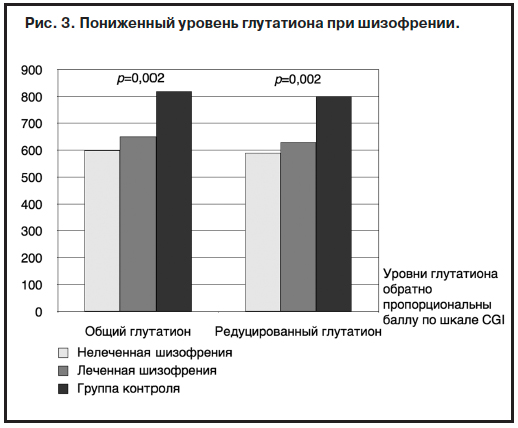
В этом же исследовании показано, что уровень глутатиона обратно пропорционален общему баллу шкалы общего клинического впечатления (CGI).
Анализ причин снижения уровня глутатиона позволил выделить основной фактор, приводящий к его истощению. Таким фактором является N-ацетилцистеин.
Нейробиологические свойства N-ацетилцистеина включают его влияние на предотвращение апоптоза, восстановление массы клеточных мембран, редукцию негативного влияния оксидантного стресса. Клиническими коррелятами описанных выше свойств является устранение когнитивного дефицита, индуцированного митохондриальной дисфункцией, улучшение рабочей памяти, устранение социальной изоляции [7]. Эти свойства N-ацетилцистеина были подтверждены на экспериментальных моделях, что позволило перейти к их клиническому применению.
В проведенном рандомизированном двойном слепом многоцентровом плацебо-контролируемом исследовании, в котором изучалась эффективность N-ацетилцистеина (в дозе 1 грамм 2 раза в день, в течение 24 нед в качестве дополнительной терапии к существующим антипсихотическим препаратам, с последующим 4-недельным вымыванием), приняли участие 140 пациентов.
Для оценки результатов исследования применялись: шкала PANSS (позитивных и негативных симптомов), шкала CGI-S (общего клинического впечатления тяжести заболевания) и шкала CGI-I (общего клинического впечатления улучшения течения заболевания). Также оценивались экстрапирамидные побочные эффекты и общее функционирование.
На рис. 4 показана эффективность применения N-ацетилцистеина при шизофрении.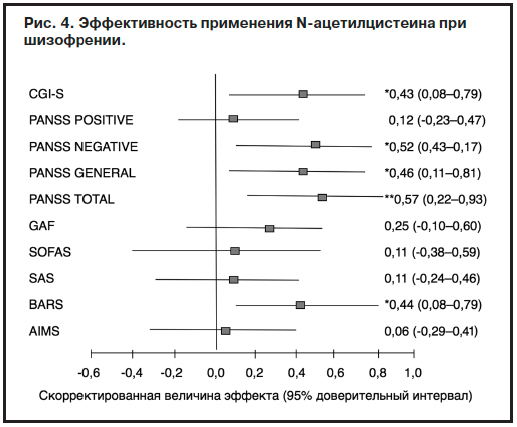
Как видно из рис. 4, у пациентов под влиянием N-ацетилцистеина отмечалось достоверное улучшение по таким параметрам, как CGI-S, PANSS (негативная и общая симптоматика, а также общий балл), проявления акатизии в сравнении с плацебо.
В рандомизированном контролируемом исследовании (РКИ) у больных биполярным расстройством под влиянием N-ацетилцистеина получена редукция депрессивной симптоматики (снижение общего балла MADRS на 8 баллов) и улучшение жизнедеятельности (на 9 баллов по шкале GAF). Также имеются данные об эффективности N-ацетилцистеина при аутизме и рефрактерном обсессивно-компульсивном расстройстве (в качестве дополнительной терапии).
РКИ, посвященные изучению N-ацетилцистеина при черепно-мозговой травме, показали, что у 86% участников эксперимента, принимавших препарат, улучшение наступило в течение 24 ч в отличие от 42% пациентов, принимавших плацебо.
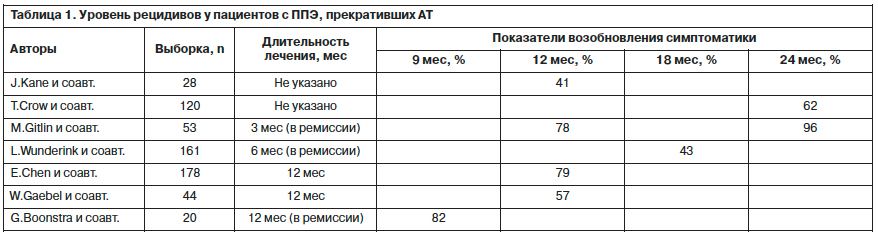
Представленные данные показывают, что частота рецидивов зависит от длительности приема и сроков прекращения АТ. Через 9 мес рецидивы регистрировались у 82% пациентов, через 12 мес – в диапазоне от 41 до 79%, через 18 мес – у 43%, через 24 мес – от 62 до 96%. В целом полученные результаты показывают, что частота развития рецидивов после прекращения АТ у пациентов с ППЭ является высокой. У многих пациентов рецидив возникает сразу после отмены АП, при этом длительность предшествующей терапии не снижает риск рецидивирования. Тяжесть симптомов быстро возвращается к исходной, а эффективность повторных воздействий часто бывает сниженной [8].
В рамках исследования проводилось изучение эффективности пероральной формы АТ при ППЭ. Основным критерием оценки был временной показатель в месяцах, в течение которого принимался препарат, т.е. период времени до прекращения лечения. Было отмечено, что после 12 мес лечения прекращение терапии происходило значительно реже среди пациентов, которые принимали антипсихотики II поколения, чем в группе принимавших галоперидол [9, 10].
Важность комплексного вмешательства при данной патологии подтверждается представленными ниже данными.
Проведенные в течение года исследования 2 групп пациентов, одна из которых (n=39) получала комплексную терапию (фармакотерапия, психообразование и психосоциальное воздействие), а вторая (n=34) – только медикаментозное лечение, позволило сопоставить эффективность терапевтического вмешательства (табл. 2).
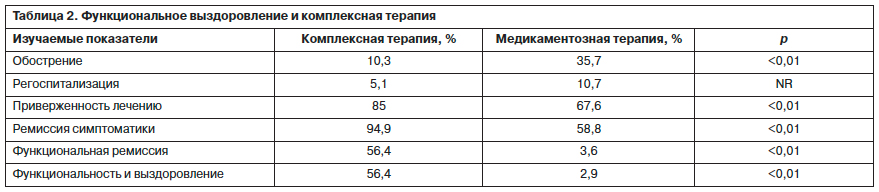
Анализируя представленные в табл. 2 данные, необходимо отметить, что в группе пациентов, получивших комплексную терапию, обострения зарегистрированы в 10,3% (в группе сравнения – 35,7%; p<0,01), регоспитализация – у 5,1% (в группе сравнения – 10,7%), приверженность лечению сохраняли 85,0% (67,6%; p<0,01), ремиссия выявлена у 94,9% (58,8%), восстановление функционирования и выздоровления отмечалось у 56,4% (3,6 и 2,9%; p<0,01). Следовательно, комплексная терапия с применением психообразовательных и психосоциальных воздействий существенно повышает эффективность лечения, способствует не только развитию систематической ремиссии, но и восстановлению социального функционирования [11].
В исследовании подчеркивается, что пациенты часто не рассматривают самих себя в качестве равноправных партнеров и не чувствуют себя полномочными в принятии решений, в то время как им хотелось бы активно участвовать в процессе выбора тактики лечения. Однако психиатры часто расценивают способность пациентов к коллективному (совместному) принятию решения по проведению лечения как неуместную. Поэтому большинство медицинских рекомендаций по терапии психозов предлагает включать пациентов в процесс планирования методов лечения, так как это является одним из необходимых условий для формирования модели выздоровления [1].
К факторам, существенно ухудшающим прогноз терапии, относятся побочные эффекты, прежде всего экстрапирамидные (экстрапирамидный синдром – ЭПС) и метаболические.
Побочные эффекты не только ухудшают эффективность и безопасность АТ, но и нарушают соблюдение режима приема медикаментов, негативно влияют на терапевтический альянс [12].
Лечение проводилось с помощью следующих антипсихотических препаратов: галоперидол (1–4 мг/сут), амисульприд (200–800 мг/сут), оланзапин (5–20 мг/сут), кветиапин (200–750 мг/сут) и зипрасидон (40–160 мг/сут). Оценка ЭПС проводилась с использованием шкалы SHRS, состоящей из 4 субшкал, для изучения проявлений паркинсонизма, акатизии, дистонии и дискинезии (Gerlah и соавт., 1993).
На начальном этапе исследования у пациентов с ППЭ выявлены следующие ЭПС: дискинезия (1%), дистония (2%), акатизия (10%), паркинсонизм (11%). Через 1 мес приема АТ симптомы паркинсонизма были выявлены у 26,0% пациентов, принимавших галоперидол; у 13,4% пациентов, принимавших зипрасидон; у 11,0% – принимавших амисульприд; у 8,5% – принимавших кветиапин;
у 4,1% – принимавших оланзапин.
Симптомы акатизии после 1 мес приема АТ регистрировались у пациентов, получивших зипрасидон, – в 23,9% случаев, галоперидол – в 20,6%, амисульприд – в 9,9%, кветиапин – в 7,3%, оланзапин – в 3,1%.
При изучении динамики паркинсонизма и акатизии в течение 12 мес терапии установлено, что средний уровень этих ЭПС среди обследуемых возрастал в первые месяцы терапии, а затем снижался, достоверно не отличаясь от начального периода, среднее число случаев паркинсонизма и акатизии среди пациентов с ППЭ, принимавших АТ, составляет 3,0%. При этом наиболее часто к развитию паркинсонизма приводил прием галоперидола (9,1%), прием оланзапина не сопровождался развитием симптомов паркинсонизма. Акатизия чаще всего была ассоциирована с приемом кветиапина (7,3%), прием оланзапина и амисульприда не сопровождался развитием акатизии.
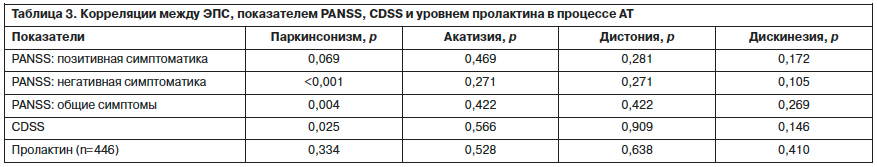
Проведенный корреляционный анализ между ЭПС, шкалами PANSS, CDSS (Calgary Depression Scale for Schizophrenia) и уровнем пролактина показали, что достоверными оказались корреляции симптомов паркинсонизма с негативными, общепатологическими симптомами PANSS, а также баллами по шкале CDSS (табл. 3).
О выраженности ЭПС у пациентов с ППЭ свидетельствует назначение антихолинергических препаратов, принимаемых для их коррекции (табл. 4).

Представленные данные табл. 4 убедительно показывают, что через 1 мес приема АТ наибольшее число пациентов, нуждавшихся в корректорах, зарегистрировано при приеме галоперидола (24,1%), наименьшее – при приеме кветиапина (2,2%).
Через 12 мес приема АТ число пациентов, применявших корректоры, уменьшилось в отношении всех антипсихотиков. При этом максимальное число пациентов, применявших антихолинэстеразные препараты, отмечалось при приеме галоперидола (10,5%), при приеме кветиапина через 12 мес от начала терапии корректоры не применялись [13].
Для оценки метаболических нарушений использовались дополнительные методы обследования, включающие в себя контроль массы тела, окружности талии, уровня холестерола, триглицеридов, глюкозы и инсулина [14].
Было установлено, что метаболический синдром наблюдался у 40% пациентов. При сравнении со здоровыми в гендерном аспекте показано, что метаболический синдром у мужчин с ППЭ выявлен в 1,4 раза чаще, а у женщин – в 2,5 раза чаще.
Изменение массы тела у пациентов с ППЭ в процессе АТ представлено в табл. 5.
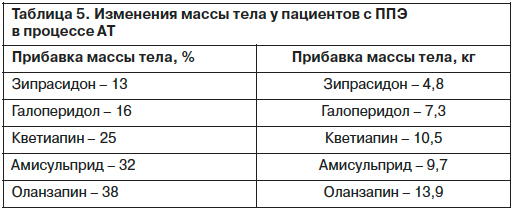
Как свидетельствуют представленные данные, наибольшее увеличение массы тела у пациентов с ППЭ выявлено при приеме оланзапина (13,9 кг) и кветиапина (10,5 кг).
У больных, принимавших галоперидол и зипрасидон, масса тела возросла на 7,3 и 4,8 кг соответственно.
Изучение метаболических факторов риска в гендерном аспекте показало, что АТ у женщин сопровождается высоким риском увеличения окружности талии и снижением уровня холестерола. У мужчин к таким рискам относится возрастание уровня триглицеридов. Различий в повышении уровня глюкозы у мужчин и женщин выявлено не было.
По результатам проведенных исследований необходимо отметить, что проявления паркинсонизма преобладали в группе пациентов с ППЭ, принимавших галоперидол, достоверно более высокой (по сравнению с другими группами) частота паркинсонизма была через 1 мес приема препарата. Частота применения антихолинергических препаратов также преобладала у пациентов, принимающих галоперидол, и по сравнению с другими препаратами сохранялась высокой в динамике (через 12 мес). Проявления акатизии достоверно чаще регистрировались у больных, принимавших зипрасидон (как через 1 мес, так и через
12 мес). В группах пациентов, принимавших оланзапин и амисульприд, через 12 мес терапии акатизия не наблюдалась. Проявления дистонии и дискинезии редко встречалась у обследованных (дискинезия – 0,6%, дистония – 1,8%). В динамике 12-месячной терапии данные проявления полностью регрессировали.
Обобщая представленные данные, необходимо отметить, что негативная симптоматика у пациентов с ППЭ является препятствием к восстановлению социального функционирования. Вместе с тем результаты исследований убедительно показывают, что раннее вмешательство с использованием комплексных воздействий (фармакотерапия, психообразование и психосоциальная реабилитация) помогает добиться высокого уровня ответа на лечение, снижает риск обострения, повышает доверие и уровень лояльности к службам, оказывающим помощь, помогает вовлечь семью в лечебный процесс и реабилитацию, что существенно улучшает исходы заболевания.
Перспективным направлением фармакологического вмешательства у пациентов со стойкой негативной симптоматикой является применение агентов – предшественников глутатиона, главного устранителя свободных радикалов в мозге – N-ацетилцистеина. Подтвержден его позитивный эффект при шизофрении (более мощный на ранних стадиях) на редукцию негативной симптоматики, снижение экстрапирамидных побочных эффектов, улучшение функционирования и качества жизни. Экстрапирамидные и метаболические побочные эффекты приема АТ обусловлены индивидуальными факторами, которые должны учитываться в процессе назначения терапии.
Все изложенное позволяет сделать вывод о том, что оптимизация исходов психоза базируется на персонификации диагностики и терапии этой патологии.
Сведения об авторе
М.М.Денисенко – канд. мед. наук, ст. науч. сотр. отд. неотложной психиатрии и наркологии ГУ Институт неврологии, психиатрии и наркологии Национальной академии медицинских наук Украины, Харьков. E-mail: mdenisenko@ukr.net
Ключевые слова: первичный психотический эпизод, рецидив, психосоциальная реабилитация, исход, антипсихотическая терапия, негативная симптоматика, экстрапирамидные и метаболические побочные эффекты.
Searching optimal personal outcomes in the first episode of psychosis:
from neurobiological symptoms to making clinical decisions
M.M.Denysenko
Institute of Neurology, Psychiatry and Narcology of the NAMS of Ukraine SI, Kharkiv, Ukraine
Summary. The article describes materials on problems of medical care for patients with the first episode of psychosis (FEP) which were presented on 26th ECNP Congress in Barcelona, Spain, October 5–9, 2013. It is pointed out that in patients with FEP negative symptoms hinder a recovery in terms of a social functioning. Along with this, results of investigations demonstrate obviously that an early intervention with integrated approaches (pharmacological treatment, psychoeducation, and psychosocial rehabilitation) helps in achieving of high treatment responses, decreases a risk of exacerbation, increases confidence and loyalty levels to health care services, promotes an involvement of family into treatment and rehabilitation. All of these improve substantially outcomes of the disease. For patients with steady negative symptoms a promising direction of pharmacological intervention is usage of a precursor agent of glutathione, a leading brain free radical scavenger, – N-acetyl-cysteine. It was supported its positive effects on reduction of negative symptoms, decreasing of extrapyramidal side effects, and functioning and quality of life improvement in schizophrenia (more prominent on early stages). Extrapyramidal and metabolic side effects of the antipsychotic medications intake are stipulated by individual factors, which should be taking into account in the antipsychotic treatment process. All the mentioned above allow us to conclude that optimization of psychosis outcomes is based on a personification of diagnosis and therapy of this pathology.
Key words: first episode of psychosis, recurrence, psychosocial rehabilitation, outcome, antipsychotic therapy, negative symptoms, extrapyramidal and metabolic side effects.
В статье изложены материалы, посвященные проблеме оказания помощи пациентам с первичным психотическим эпизодом (ППЭ), которые были представлены на 26-м Конгрессе Европейской коллегии по нейропсихофармакологии (ECNP) в Барселоне (Испания) 5–9 октября 2013 г.
Проблема оказания помощи больным с ППЭ имеет огромное медико-социальное значение. Установлено, что раннее вмешательство приводит к снижению тяжести заболевания, обеспечивает ускорение наступления ремиссии, снижает риск развития когнитивного дефицита и суицидального поведения, обеспечивает восстановление социального функционирования, предотвращает хронизацию патологии, уменьшает количество госпитализаций и их продолжительность [1, 2].
Социальный аспект проблемы обусловлен тем, что, по данным Всемирной организации здравоохранения, острый психоз является третьим из наиболее инвалидизирующих состояний, а основные психотические расстройства приводят к уменьшению продолжительности жизни в среднем на 10 лет. Начало заболевания приходится, как правило, на молодой возраст, что нарушает общественную, профессиональную и семейную активность, формирует значительное бремя для семьи и общества. Депрессивные расстройства, наркотическая зависимость и личностные дисфункции, сопровождающие ППЭ, существенно ухудшают исход состояния, что обусловливает необходимость раннего вмешательства [3–5].
К наиболее важным и проблемным моментам оказания помощи пациентам с ППЭ относятся эффективность купирования негативных симптомов, результативная профилактика рецидивов, комплексность проводимого лечения и обеспечение его безопасности. Эти проблемы являются зеркальным отражением аналогичных сложностей, возникающих в процессе оказания помощи пациентам с шизофренией.
Нейробиологической основой современных фармакологических стратегий ППЭ является дофаминовая гипотеза, отражающая повышение активности пресинаптического синтеза дофамина. Функциональная активность современных антипсихотиков сопряжена с блокадой D2-рецепторов, что и обусловливает редукцию психотических симптомов. При этом практический опыт и проведенные научные исследования показали, что блокада D2-рецепторов в большой степени способствует купированию позитивных симптомов, в то время как негативная симптоматика в меньшей мере поддается обратному развитию.

Все больше доказательств отражает преимущественное влияние современных антипсихотиков на позитивную симптоматику (рис. 1).
На рис. 1 представлена динамика позитивной и негативной симптоматики в течение 2-месячного периода под действием рисперидона и кветиапина.
Представленные данные свидетельствуют о том, что в момент первичного обследования средняя выраженность позитивной и негативной симптоматики составляла 18–19 и 18–20 баллов соответственно. После лечения указанными антипсихотиками в течение 1 мес уровень позитивной симптоматики снизился до 13–14, негативной – до 15–16 баллов. После 2 мес терапии уровень
позитивной симптоматики составлял уже 11, а негативной – 14–16 баллов, что свидетельствует об ее определенной устойчивости к антипсихотической терапии – АТ
(Gufoor и соавт., 2010).
Негативная симптоматика является одной из главных психопатологических причин, нарушающих восстановление социального функционирования пациентов с ППЭ. Особое место при этом отводится стойким негативным симптомам (СНС). В процессе исследования проведено сравнение пациентов с СНС и пациентов с наличием хотя бы одного негативного симптома умеренной или повышенной тяжести на момент начала лечения и после 1 года лечения. С этой целью обследованы 345 пациентов с ППЭ (рис. 2).

Как видно из рис. 2, на момент начала лечения средний балл по шкале GAF в группе СНС составлял 38,4 балла, без СНС – 40,0 балла. После 12 мес лечения средний балл по шкале GAF в группе СНС составлял 59,0 балла, без СНС – 80,0 балла, что отображает ограничение социального функционирования у пациентов с СНС.
Также установлено, что пациенты с ППЭ, у которых присутствуют СНС, чаще подвержены самостоятельному прекращению лечения, чем пациенты без СНС (65 и 30% соответственно; p<0,01). Представленные данные еще раз подтверждают тот факт, что негативные симптомы в наибольшей степени влияют на социальное функционирование, основными составляющими которого являются самостоятельное проживание, межличностные взаимодействия, активный отдых, работа или учеба [4, 6].
Одно из наиболее перспективных современных направлений коррекции негативных симптомов базируется на теории нарушенного обмена глутатиона у больных шизофренией. Основой теории являются данные о том, что у пациентов с шизофренией уровень глутатиона в крови в
3 раза ниже по сравнению с контролем, аналогичное снижение выявлено у пациентов с биполярным расстройством и депрессией (рис. 3).

В этом же исследовании показано, что уровень глутатиона обратно пропорционален общему баллу шкалы общего клинического впечатления (CGI).
Анализ причин снижения уровня глутатиона позволил выделить основной фактор, приводящий к его истощению. Таким фактором является N-ацетилцистеин.
Нейробиологические свойства N-ацетилцистеина включают его влияние на предотвращение апоптоза, восстановление массы клеточных мембран, редукцию негативного влияния оксидантного стресса. Клиническими коррелятами описанных выше свойств является устранение когнитивного дефицита, индуцированного митохондриальной дисфункцией, улучшение рабочей памяти, устранение социальной изоляции [7]. Эти свойства N-ацетилцистеина были подтверждены на экспериментальных моделях, что позволило перейти к их клиническому применению.
В проведенном рандомизированном двойном слепом многоцентровом плацебо-контролируемом исследовании, в котором изучалась эффективность N-ацетилцистеина (в дозе 1 грамм 2 раза в день, в течение 24 нед в качестве дополнительной терапии к существующим антипсихотическим препаратам, с последующим 4-недельным вымыванием), приняли участие 140 пациентов.
Для оценки результатов исследования применялись: шкала PANSS (позитивных и негативных симптомов), шкала CGI-S (общего клинического впечатления тяжести заболевания) и шкала CGI-I (общего клинического впечатления улучшения течения заболевания). Также оценивались экстрапирамидные побочные эффекты и общее функционирование.
На рис. 4 показана эффективность применения N-ацетилцистеина при шизофрении.

Как видно из рис. 4, у пациентов под влиянием N-ацетилцистеина отмечалось достоверное улучшение по таким параметрам, как CGI-S, PANSS (негативная и общая симптоматика, а также общий балл), проявления акатизии в сравнении с плацебо.
В рандомизированном контролируемом исследовании (РКИ) у больных биполярным расстройством под влиянием N-ацетилцистеина получена редукция депрессивной симптоматики (снижение общего балла MADRS на 8 баллов) и улучшение жизнедеятельности (на 9 баллов по шкале GAF). Также имеются данные об эффективности N-ацетилцистеина при аутизме и рефрактерном обсессивно-компульсивном расстройстве (в качестве дополнительной терапии).
РКИ, посвященные изучению N-ацетилцистеина при черепно-мозговой травме, показали, что у 86% участников эксперимента, принимавших препарат, улучшение наступило в течение 24 ч в отличие от 42% пациентов, принимавших плацебо.

Представленные данные показывают, что частота рецидивов зависит от длительности приема и сроков прекращения АТ. Через 9 мес рецидивы регистрировались у 82% пациентов, через 12 мес – в диапазоне от 41 до 79%, через 18 мес – у 43%, через 24 мес – от 62 до 96%. В целом полученные результаты показывают, что частота развития рецидивов после прекращения АТ у пациентов с ППЭ является высокой. У многих пациентов рецидив возникает сразу после отмены АП, при этом длительность предшествующей терапии не снижает риск рецидивирования. Тяжесть симптомов быстро возвращается к исходной, а эффективность повторных воздействий часто бывает сниженной [8].
В рамках исследования проводилось изучение эффективности пероральной формы АТ при ППЭ. Основным критерием оценки был временной показатель в месяцах, в течение которого принимался препарат, т.е. период времени до прекращения лечения. Было отмечено, что после 12 мес лечения прекращение терапии происходило значительно реже среди пациентов, которые принимали антипсихотики II поколения, чем в группе принимавших галоперидол [9, 10].
Важность комплексного вмешательства при данной патологии подтверждается представленными ниже данными.
Проведенные в течение года исследования 2 групп пациентов, одна из которых (n=39) получала комплексную терапию (фармакотерапия, психообразование и психосоциальное воздействие), а вторая (n=34) – только медикаментозное лечение, позволило сопоставить эффективность терапевтического вмешательства (табл. 2).

Анализируя представленные в табл. 2 данные, необходимо отметить, что в группе пациентов, получивших комплексную терапию, обострения зарегистрированы в 10,3% (в группе сравнения – 35,7%; p<0,01), регоспитализация – у 5,1% (в группе сравнения – 10,7%), приверженность лечению сохраняли 85,0% (67,6%; p<0,01), ремиссия выявлена у 94,9% (58,8%), восстановление функционирования и выздоровления отмечалось у 56,4% (3,6 и 2,9%; p<0,01). Следовательно, комплексная терапия с применением психообразовательных и психосоциальных воздействий существенно повышает эффективность лечения, способствует не только развитию систематической ремиссии, но и восстановлению социального функционирования [11].
В исследовании подчеркивается, что пациенты часто не рассматривают самих себя в качестве равноправных партнеров и не чувствуют себя полномочными в принятии решений, в то время как им хотелось бы активно участвовать в процессе выбора тактики лечения. Однако психиатры часто расценивают способность пациентов к коллективному (совместному) принятию решения по проведению лечения как неуместную. Поэтому большинство медицинских рекомендаций по терапии психозов предлагает включать пациентов в процесс планирования методов лечения, так как это является одним из необходимых условий для формирования модели выздоровления [1].
К факторам, существенно ухудшающим прогноз терапии, относятся побочные эффекты, прежде всего экстрапирамидные (экстрапирамидный синдром – ЭПС) и метаболические.
Побочные эффекты не только ухудшают эффективность и безопасность АТ, но и нарушают соблюдение режима приема медикаментов, негативно влияют на терапевтический альянс [12].
Лечение проводилось с помощью следующих антипсихотических препаратов: галоперидол (1–4 мг/сут), амисульприд (200–800 мг/сут), оланзапин (5–20 мг/сут), кветиапин (200–750 мг/сут) и зипрасидон (40–160 мг/сут). Оценка ЭПС проводилась с использованием шкалы SHRS, состоящей из 4 субшкал, для изучения проявлений паркинсонизма, акатизии, дистонии и дискинезии (Gerlah и соавт., 1993).
На начальном этапе исследования у пациентов с ППЭ выявлены следующие ЭПС: дискинезия (1%), дистония (2%), акатизия (10%), паркинсонизм (11%). Через 1 мес приема АТ симптомы паркинсонизма были выявлены у 26,0% пациентов, принимавших галоперидол; у 13,4% пациентов, принимавших зипрасидон; у 11,0% – принимавших амисульприд; у 8,5% – принимавших кветиапин;
у 4,1% – принимавших оланзапин.
Симптомы акатизии после 1 мес приема АТ регистрировались у пациентов, получивших зипрасидон, – в 23,9% случаев, галоперидол – в 20,6%, амисульприд – в 9,9%, кветиапин – в 7,3%, оланзапин – в 3,1%.
При изучении динамики паркинсонизма и акатизии в течение 12 мес терапии установлено, что средний уровень этих ЭПС среди обследуемых возрастал в первые месяцы терапии, а затем снижался, достоверно не отличаясь от начального периода, среднее число случаев паркинсонизма и акатизии среди пациентов с ППЭ, принимавших АТ, составляет 3,0%. При этом наиболее часто к развитию паркинсонизма приводил прием галоперидола (9,1%), прием оланзапина не сопровождался развитием симптомов паркинсонизма. Акатизия чаще всего была ассоциирована с приемом кветиапина (7,3%), прием оланзапина и амисульприда не сопровождался развитием акатизии.
Проведенный корреляционный анализ между ЭПС, шкалами PANSS, CDSS (Calgary Depression Scale for Schizophrenia) и уровнем пролактина показали, что достоверными оказались корреляции симптомов паркинсонизма с негативными, общепатологическими симптомами PANSS, а также баллами по шкале CDSS (табл. 3).

О выраженности ЭПС у пациентов с ППЭ свидетельствует назначение антихолинергических препаратов, принимаемых для их коррекции (табл. 4).

Представленные данные табл. 4 убедительно показывают, что через 1 мес приема АТ наибольшее число пациентов, нуждавшихся в корректорах, зарегистрировано при приеме галоперидола (24,1%), наименьшее – при приеме кветиапина (2,2%).
Через 12 мес приема АТ число пациентов, применявших корректоры, уменьшилось в отношении всех антипсихотиков. При этом максимальное число пациентов, применявших антихолинэстеразные препараты, отмечалось при приеме галоперидола (10,5%), при приеме кветиапина через 12 мес от начала терапии корректоры не применялись [13].
Для оценки метаболических нарушений использовались дополнительные методы обследования, включающие в себя контроль массы тела, окружности талии, уровня холестерола, триглицеридов, глюкозы и инсулина [14].
Было установлено, что метаболический синдром наблюдался у 40% пациентов. При сравнении со здоровыми в гендерном аспекте показано, что метаболический синдром у мужчин с ППЭ выявлен в 1,4 раза чаще, а у женщин – в 2,5 раза чаще.
Изменение массы тела у пациентов с ППЭ в процессе АТ представлено в табл. 5.

Как свидетельствуют представленные данные, наибольшее увеличение массы тела у пациентов с ППЭ выявлено при приеме оланзапина (13,9 кг) и кветиапина (10,5 кг).
У больных, принимавших галоперидол и зипрасидон, масса тела возросла на 7,3 и 4,8 кг соответственно.
Изучение метаболических факторов риска в гендерном аспекте показало, что АТ у женщин сопровождается высоким риском увеличения окружности талии и снижением уровня холестерола. У мужчин к таким рискам относится возрастание уровня триглицеридов. Различий в повышении уровня глюкозы у мужчин и женщин выявлено не было.
По результатам проведенных исследований необходимо отметить, что проявления паркинсонизма преобладали в группе пациентов с ППЭ, принимавших галоперидол, достоверно более высокой (по сравнению с другими группами) частота паркинсонизма была через 1 мес приема препарата. Частота применения антихолинергических препаратов также преобладала у пациентов, принимающих галоперидол, и по сравнению с другими препаратами сохранялась высокой в динамике (через 12 мес). Проявления акатизии достоверно чаще регистрировались у больных, принимавших зипрасидон (как через 1 мес, так и через
12 мес). В группах пациентов, принимавших оланзапин и амисульприд, через 12 мес терапии акатизия не наблюдалась. Проявления дистонии и дискинезии редко встречалась у обследованных (дискинезия – 0,6%, дистония – 1,8%). В динамике 12-месячной терапии данные проявления полностью регрессировали.
Обобщая представленные данные, необходимо отметить, что негативная симптоматика у пациентов с ППЭ является препятствием к восстановлению социального функционирования. Вместе с тем результаты исследований убедительно показывают, что раннее вмешательство с использованием комплексных воздействий (фармакотерапия, психообразование и психосоциальная реабилитация) помогает добиться высокого уровня ответа на лечение, снижает риск обострения, повышает доверие и уровень лояльности к службам, оказывающим помощь, помогает вовлечь семью в лечебный процесс и реабилитацию, что существенно улучшает исходы заболевания.
Перспективным направлением фармакологического вмешательства у пациентов со стойкой негативной симптоматикой является применение агентов – предшественников глутатиона, главного устранителя свободных радикалов в мозге – N-ацетилцистеина. Подтвержден его позитивный эффект при шизофрении (более мощный на ранних стадиях) на редукцию негативной симптоматики, снижение экстрапирамидных побочных эффектов, улучшение функционирования и качества жизни. Экстрапирамидные и метаболические побочные эффекты приема АТ обусловлены индивидуальными факторами, которые должны учитываться в процессе назначения терапии.
Все изложенное позволяет сделать вывод о том, что оптимизация исходов психоза базируется на персонификации диагностики и терапии этой патологии.
Сведения об авторе
М.М.Денисенко – канд. мед. наук, ст. науч. сотр. отд. неотложной психиатрии и наркологии ГУ Институт неврологии, психиатрии и наркологии Национальной академии медицинских наук Украины, Харьков. E-mail: mdenisenko@ukr.net
Список исп. литературыСкрыть список1. Gaebel W, Becker T, Janssen B et al. EPA guidance o the quality of mental health services. Eur Psychiat 2012; 27 (2): 87–113.
2. McGory PD, Killackey A, Yuang E. Early intervention in psychosis: conspectus, evidence and future directions. J World Psychiat 2008; 7 (3): 148–57.
3. Bugarski-Kirola D. Future prospects in the treatment of negative symptoms. European archives of psychiatry. Clin Neuroscience 2013; 263 (1): 23.
4. Galderisi S. Improving schizophrenia outcome. European psychiatry.
J Europ Psychiat Associat. 21st European Congress of Psychiatry, 6–9 April, 2013. Nice, France. Topic 321. State of the Art: Improving Schizophrenia Outcome. Abstr. 2995.
5. Gaebel W. Mainetense treatment with risperidone or low-dose haloperidol in fist-episode schizophrenia. One-year result of a randomized controlled trial within German Research Network on Schizophrenia. J Clin Psychiat 2007; 68 (11): 1763–74.
6. Galderisi S. Negative symptoms in schizophrenia: prevalence and impact on functional outcome. European archives of psychiatry. Clin Neuroscience 2013; 263 (1): 22.
7. Berck M, Dean O. Novel mechanisms to improve negative symptoms – initial success and new directions. Europ Neuropsychopharmacol 2013; 23 (2): 132.
8. Elanjithara T, Winton-Brown T, McGuire P. Interruption of anti-psychotic treatment of first episode psychosis associated with a five-fold increased risk of relapse. European Psychiatry. J Europ Psychiatr Association. 21st European Congress of Psychiatry, 6–9 April, 2013. Nice, France. Schizophrenia 2013; 69. Abstr. 1414.
9. Fleischhacker WW, Sanchez R, Jin N et al. Personal and social performance in schizophrenia: double-blind, non-inferiority study of one monthly vs oral aripiprazole. Europ Neuropsychopharmacol 2013; 23 (2): 474.
10. Schreiner A, Svensson A, Wapenaar R et al. Long-acting injectable risperidone and oral antipsychotics in patients with schizophrenia: a prospective one-year non-interventional study (INORS). European Psychiatry. J Europ Psychiatr Association. 21st European Congress of Psychiatry, 6–9 April, 2013. Nice, France. Topic 69. Schizophrenia. Abstr. 1736.
11. Guo X, Zhai J, Liu Z et al. Effect of antipsychotic medication alone vs combined with psychosocial intervention on outcomes of early-stage schizophrenia: a randomized 1-year study. Arch Gen Psychiat 2010; 67: 895–904.
12. Rybakowski JK. Extrapyramidal and metabolic side effect of antipsychotic treatment: data from EUFEST. Europ Neuropsychopharmacol 2013; 23 (2): 126.
13. McEvoy JP, Meyer JM, Goff DC et al. Prevalence of the metabolic syndrome in patients with schizophrenia: baseline results from the Clinical Antipsychotic Trials of Intervention Effectiveness (CATIE) schizophrenia trial and comparison with national estimates from NHANES III. Schizophr Res 2005; 80 (1): 19–32.
14. Fleischhacker WW, Siu CO, Boden R et al. EUFEST Study Group. Metabolic risk factors in first-episode schizophrenia: baseline prevalence and course analyzed from the European First-Episode Schizophrenia Trial. Internation J Neuropsychopharmacol 2013; 16 (5): 987–95


