Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№05 2017
Буспирон в практике врача-психиатра: только ли анксиолитик? №05 2017
Номера страниц в выпуске:32-52
Цель исследования. Целью составления нами данного обзора было предоставить читателю подробную информацию об истории создания, фармакокинетике, фармакодинамике и механизмах действия, режимах дозирования, побочных эффектах, показаниях, противопоказаниях и доказательной базе для клинического применения нового для российского рынка небензодиазепинового анксиолитика – буспирона (Спитомин, фирма EGIS) не только при различных психических патологиях, в первую очередь тревожных и депрессивных расстройствах, но и при таких не упомянутых в инструкции к препарату заболеваниях, как шизофрения, расстройства аутистического спектра, синдром дефицита внимания, гипосексуальное расстройство у женщин (фригидность), агрессивность и раздражительность при разных состояниях, а также в качестве корректора побочных эффектов психофармакотерапии.
Методология проведения работы. Авторами данной статьи был проведен поиск литературы об истории создания, фармакокинетике, фармакодинамике, механизмах действия, побочных эффектах, показаниях и противопоказаниях, а также клиническом применении препарата буспирон (Спитомин) при разных психических патологиях и в качестве корректора побочных эффектов психофармакотерапии с использованием соответствующих ключевых слов в международных поисковых системах PubMed, Google Scholar, Elsevier Science, Web of Science, Science Direct и российской поисковой системе РИНЦ E-library. Найденные источники обработаны и представлены нами в данной статье.
Результаты. Найденные нами литературные данные свидетельствуют о большом терапевтическом потенциале и эффективности буспирона (Спитомина) в лечении различных психических патологий и коррекции побочных эффектов психофармакотерапии, а также о его хорошей переносимости, безопасности применения и низком уровне побочных эффектов. Наиболее убедительна на данный момент доказательная база для применения буспирона в лечении генерализованного тревожного расстройства, а также в потенцировании действия антидепрессантов при депрессивных расстройствах. Однако имеющиеся предварительные данные указывают на то, что буспирон также может быть эффективен при других тревожных расстройствах, расстройствах аутистического спектра, синдроме дефицита внимания, гипосексуальности, негативной симптоматике шизофрении, а также в коррекции ряда побочных эффектов психотропной терапии.
Область применения результатов. Полученные нами результаты заслуживают широкого применения в психиатрии.
Ключевые слова: буспирон, азапироны, тревожные расстройства, депрессивные расстройства, генерализованное тревожное расстройство, социальное тревожное расстройство, паническое расстройство, посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство, шизофрения, аутизм, синдром дефицита внимания, побочные эффекты психотропных средств, агрессивность.
Для цитирования: Быков Ю.В., Беккер Р.А. Буспирон в практике врача-психиатра: только ли анксиолитик? Психиатрия и психофармакотерапия. 2017; 19 (5): 32–52.
Методология проведения работы. Авторами данной статьи был проведен поиск литературы об истории создания, фармакокинетике, фармакодинамике, механизмах действия, побочных эффектах, показаниях и противопоказаниях, а также клиническом применении препарата буспирон (Спитомин) при разных психических патологиях и в качестве корректора побочных эффектов психофармакотерапии с использованием соответствующих ключевых слов в международных поисковых системах PubMed, Google Scholar, Elsevier Science, Web of Science, Science Direct и российской поисковой системе РИНЦ E-library. Найденные источники обработаны и представлены нами в данной статье.
Результаты. Найденные нами литературные данные свидетельствуют о большом терапевтическом потенциале и эффективности буспирона (Спитомина) в лечении различных психических патологий и коррекции побочных эффектов психофармакотерапии, а также о его хорошей переносимости, безопасности применения и низком уровне побочных эффектов. Наиболее убедительна на данный момент доказательная база для применения буспирона в лечении генерализованного тревожного расстройства, а также в потенцировании действия антидепрессантов при депрессивных расстройствах. Однако имеющиеся предварительные данные указывают на то, что буспирон также может быть эффективен при других тревожных расстройствах, расстройствах аутистического спектра, синдроме дефицита внимания, гипосексуальности, негативной симптоматике шизофрении, а также в коррекции ряда побочных эффектов психотропной терапии.
Область применения результатов. Полученные нами результаты заслуживают широкого применения в психиатрии.
Ключевые слова: буспирон, азапироны, тревожные расстройства, депрессивные расстройства, генерализованное тревожное расстройство, социальное тревожное расстройство, паническое расстройство, посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство, шизофрения, аутизм, синдром дефицита внимания, побочные эффекты психотропных средств, агрессивность.
Для цитирования: Быков Ю.В., Беккер Р.А. Буспирон в практике врача-психиатра: только ли анксиолитик? Психиатрия и психофармакотерапия. 2017; 19 (5): 32–52.
Цель исследования. Целью составления нами данного обзора было предоставить читателю подробную информацию об истории создания, фармакокинетике, фармакодинамике и механизмах действия, режимах дозирования, побочных эффектах, показаниях, противопоказаниях и доказательной базе для клинического применения нового для российского рынка небензодиазепинового анксиолитика – буспирона (Спитомин, фирма EGIS) не только при различных психических патологиях, в первую очередь тревожных и депрессивных расстройствах, но и при таких не упомянутых в инструкции к препарату заболеваниях, как шизофрения, расстройства аутистического спектра, синдром дефицита внимания, гипосексуальное расстройство у женщин (фригидность), агрессивность и раздражительность при разных состояниях, а также в качестве корректора побочных эффектов психофармакотерапии.
Методология проведения работы. Авторами данной статьи был проведен поиск литературы об истории создания, фармакокинетике, фармакодинамике, механизмах действия, побочных эффектах, показаниях и противопоказаниях, а также клиническом применении препарата буспирон (Спитомин) при разных психических патологиях и в качестве корректора побочных эффектов психофармакотерапии с использованием соответствующих ключевых слов в международных поисковых системах PubMed, Google Scholar, Elsevier Science, Web of Science, Science Direct и российской поисковой системе РИНЦ E-library. Найденные источники обработаны и представлены нами в данной статье.
Результаты. Найденные нами литературные данные свидетельствуют о большом терапевтическом потенциале и эффективности буспирона (Спитомина) в лечении различных психических патологий и коррекции побочных эффектов психофармакотерапии, а также о его хорошей переносимости, безопасности применения и низком уровне побочных эффектов. Наиболее убедительна на данный момент доказательная база для применения буспирона в лечении генерализованного тревожного расстройства, а также в потенцировании действия антидепрессантов при депрессивных расстройствах. Однако имеющиеся предварительные данные указывают на то, что буспирон также может быть эффективен при других тревожных расстройствах, расстройствах аутистического спектра, синдроме дефицита внимания, гипосексуальности, негативной симптоматике шизофрении, а также в коррекции ряда побочных эффектов психотропной терапии.
Область применения результатов. Полученные нами результаты заслуживают широкого применения в психиатрии.
Ключевые слова: буспирон, азапироны, тревожные расстройства, депрессивные расстройства, генерализованное тревожное расстройство, социальное тревожное расстройство, паническое расстройство, посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство, шизофрения, аутизм, синдром дефицита внимания, побочные эффекты психотропных средств, агрессивность.
Для цитирования: Быков Ю.В., Беккер Р.А. Буспирон в практике врача-психиатра: только ли анксиолитик? Психиатрия и психофармакотерапия. 2017; 19 (5): 32–52.
Yu.V.Bykov1, R.A.Bekker2
1Stavropol State Medical University of the Ministry of Health of the Russian Federation. 355017, Russian Federation, Stavropol, ul. Mira, d. 310;
2David Ben-Gurion University in Negev. 8410501, Israel, Be’er Sheba.
yubykov@gmail.com
Purpose. The purpose of this review was to provide the reader with detailed information about the history of the development, pharmacokinetics, pharmacodynamics and mechanisms of action, dosage regimens, side effects, indications and contraindications, and existing evidence base for the clinical use of the nonbenzodiazepine anxiolytic buspirone. We describe its use not just in the officially approved fashion as an anxiolytic for generalized anxiety disorder and as an augmenting agent to antidepressant for depressive disorders, but also in non-traditional areas like diminishing negative and cognitive symptoms of schizophrenia, treat OCD spectrum disorders and anxiety disorders other than generalized anxiety disorder, improve different aspects of autism spectrum disorders, and also in attention deficit hyperactivity disorder, female hyposexual desire disorder (frigidity), for non-specific correction of aggressiveness and irritability in different mental diseases, and as a corrective agent for several side effects of psychotropic drugs.
Methodology. The authors have searched for the literature on the history of discovery, pharmacokinetics, pharmacodynamics, mechanisms of action, side effects, indications and contraindications, as well as on the clinical use of buspirone in various mental disorders, using relevant keywords in international search engines PubMed, Google Scholar, Elsevier Science, Web of Science, Science Direct, and in the Russian search engine E-library. The sources found were processed and presented by us in this article.
Results. The literature data we have found indicate that buspirone has great therapeutic potential and effectiveness in the treatment of various mental diseases. The literature presented also documents its good tolerability, safety of use, and low side effect burden. The most convincing at this time is the evidence base for the use of buspirone in the treatment of generalized anxiety disorder, as well as an augmenting agent for antidepressants in depressive disorders. However, available data indicate that buspirone can also be effective in other anxiety disorders, autism spectrum disorders, attention deficit hyperactivity disorder, female hyposexual desire disorder, in diminishing negative and cognitive symptoms of schizophrenia, and as a corrective agent for a number of side effects of psychotropic drugs.
Practical implications. The results obtained by us deserve wide application in psychiatry.
Key words: buspirone, azapirones, anxiety disorders, depressive disorders, generalized anxiety disorder, social anxiety disorder, panic disorder, posttraumatic stress disorder, obsessive-compulsive disorder, schizophrenia, autism, attention deficit hyperactivity disorder, aggressiveness.
For citation: Bykov Yu.V., Bekker R.A. Buspirone in psychiatric practice: is it only an anxiolytic? Psychiatry and Psychopharmacotherapy. 2017; 19 (5): 32–52.
В химический класс азапиронов входит целый ряд фармакологических агентов. Некоторые из них доступны на мировых рынках (кроме буспирона это также тандоспирон, гепирон, пероспирон), а некоторые так и остались сугубо исследовательскими препаратами либо их разработка была прекращена (например, ипсапирон, ревоспирон и др.). Общим свойством всех азапиронов является их высокое сродство к серотониновым 5-НТ1А-рецепторам, которые располагаются на теле и в окончаниях серотонинергических нейронов, а также дендритах постсинаптических нейронов (О.С.Левин, 2015). Различные азапироны применяются в клинической практике либо как анксиолитики и антидепрессанты, как буспирон и тандоспирон, гепирон, либо как атипичные антипсихотики, как пероспирон (S.Onrust, K.McClellan, 2001). В Российской Федерации буспирон производится и поставляется фирмой EGIS под торговым названием Спитомин (О.С.Левин, 2015).
Буспирон является высокоэффективным анксиолитиком при лечении наиболее сложных и резистентных форм различных тревожных расстройств, в первую очередь генерализованного тревожного расстройства. Он стал первым небензодиазепиновым анксиолитиком, который был одобрен Управлением по контролю пищевых продуктов и лекарств в США (Food and Drug Administration – FDA) в 1986 г. для лечения пациентов с этой патологией (C.Loane, M.Politis, 2012). Буспирон занимает особое место среди психотропных препаратов в связи с тем, что является не только анксиолитиком, но и антидепрессантом (А.Т.Дзампаев и соавт., 2014). В настоящее время буспирон в РФ разрешен к применению также в качестве потенцирующего агента в дополнение к антидепрессантам при терапии большого депрессивного расстройства (Инструкция по медицинскому применению препарата Спитомин, 2014).
Однако буспирон оказался неэффективным в экспериментальных моделях психозов на животных. Из-за этого компания на некоторое время «положила препарат на полку», и долгое время не патентовала структуру его молекулы, считая его бесперспективным для дальнейшей разработки и рассматривая его только в качестве очередного отвергнутого потенциального антипсихотика (C.Loane, M.Politis, 2012; R.Howland, 2015). Лишь гораздо позже, в 1975 г., благодаря настойчивости Меада Джонсона, предложившего исследовать буспирон на наличие у него других видов фармакологической активности и сумевшего доказать, что буспирон эффективен в экспериментальных моделях тревоги и депрессии на животных, буспирон был переопределен компанией как потенциальный новый анксиолитик и антидепрессант, а его молекула – запатентована ею (L.Allen и соавт., 1972; US Patent, 1975; C.Loane, M.Politis, 2012; R.Howland, 2015).
В 1986 г., после завершения серии двойных слепых рандомизированных клинических исследований III фазы, доказавших эффективность буспирона для лечения генерализованного тревожного расстройства, буспирон получил разрешение FDA для лечения генерализованного тревожного расстройства у взрослых и стал продаваться в США под торговым названием Buspar (C.Loane, M.Politis, 2012; R.Howland, 2015).
Как мы покажем ниже в разделе о применении буспирона при расстройствах шизофренического спектра, история создания данного препарата и его изначально планировавшееся позиционирование на рынке в качестве антипсихотика – это не просто любопытный исторический факт, а момент, имеющий самое прямое отношение к спектру его фармакологической активности. Дело в том, что буспирон оказывает модулирующее воздействие на активность дофаминергических систем мозга. И, хотя он оказался неэффективен и в экспериментальных моделях психозов на животных, и в устранении продуктивной психотической симптоматики у человека, у него позднее была обнаружена эффективность в уменьшении негативной, когнитивной и депрессивной симптоматики при расстройствах шизофренического спектра (D.Piskulic и соавт., 2009; A.Ghaleiha и соавт., 2010; М.Ю.Дробижев и соавт., 2014; F.Sheikhmoonesi и соавт., 2015).
Патентная монополия компании Bristol-Myers Squibb на буспирон истекла в 2001 г. В настоящее время этот препарат доступен также в качестве генерика. На российском рынке, как мы уже упоминали, буспирон представлен единственным производителем – компанией EGIS, под торговым названием Спитомин (О.С.Левин, 2015).
Буспирон имеет объем распределения 5,3 л/кг, системный клиренс около 1,7 л/ч на 1 кг (I.Mahmood, C.Sahaiwalla, 1999). Средний период полувыведения буспирона после однократного введения колеблется от 2 до 3 ч, в среднем 2,5 ч (M.Jann, 1988; C.Loane, M.Politis, 2012). Однако при многократных повторных введениях период полувыведения буспирона удлиняется, и его конечный (терминальный) период полувыведения при постоянном приеме, по данным 14 разных исследователей, колеблется от 2 до 11 ч (R.Gammans, 1986). В одном из исследований даже получено значение терминального периода полувыведения буспирона в 33 ч (R.Gammans, 1986).
Буспирон интенсивно метаболизируется в печени, в основном при участии изофермента цитохрома CYP450 3A4, при этом образуются в основном различные гидроксилированные метаболиты (I.Mahmood, C.Sahaiwalla, 1999; M.Zhu и соавт., 2005). Основными метаболитами буспирона являются 5-гидрокси-буспирон, 6-гидрокси-буспирон, 8-гидрокси-буспирон и 1-(2-пиримидинил)-пиперазин (R.Gammans, 1986; H.Wong и соавт., 2007; A.Schatzberg, C.Nemeroff, 2009).
У человека одним из основных метаболитов буспирона является 6-гидрокси-буспирон, уровень которого в плазме в 40 раз превышает уровень самого буспирона. Важно отметить, что этот метаболит (6-гидрокси-буспирон) является высокоаффинным парциальным агонистом 5-HT1A-рецепторов с Ki=25 nM, что сопоставимо с аффинитетом к 5-HT1A-рецепторам у самого буспирона: Ki=20 nM. Показано, что
6-гидрокси-буспирон занимает большую долю 5-HT1A-рецепторов, чем сам буспирон, при введении буспирона в организм и, по всей видимости, играет важную, если не основную, роль в реализации терапевтического эффекта буспирона (H.Wong и соавт., 2007; A.Schatzberg, C.Nemeroff, 2009).
Другой метаболит буспирона, 1-(2-пиримидинил)-пиперазин, также фармакологически активен (в частности, он является антагонистом пресинаптических a2-адренорецепторов с KD=40 nM). Он также обнаруживается в крови в более высоких концентрациях, чем сам буспирон. Предполагается, что фармакологическая активность 1-(2-пиримидинил)-пиперазина тоже вносит значительный вклад в реализацию антидепрессивного и анксиолитического эффектов буспирона (G.Tunnicliff, 1991; M.Fava, 2007). Кроме того, 1-(2-пиримидинил)-пиперазин также обладает более длительным периодом полувыведения, чем сам буспирон. Средний период полувыведения 1-(2-пиримидинил)-пиперазина составляет 6,1 ч, что в 2–3 раза больше периода полувыведения родительского соединения (буспирона), составляющего 2–3 ч, в среднем 2,5 ч (M.Jann, 1988).
Относительно короткий период полувыведения буспирона обусловливает необходимость приема препарата 2–3 раза в сутки. В диапазоне разовых доз от 10 до 40 мг фармакокинетика буспирона подчиняется линейному закону (I.Mahmood, C.Sahaiwalla, 1999).
Буспирон выводится в основном с мочой в виде метаболитов (от 29 до 63% введенной дозы выводится с ней в первые 24 ч). С калом выводится за тот же срок от 18 до 38% введенной дозы (Buspirone monograph, 1996).
У пациентов с печеночной недостаточностью период полувыведения буспирона удлиняется в 2 раза и более по сравнению со здоровыми людьми, а площадь под кривой «концентрация–время» буспирона увеличивается в 13 раз. При почечной недостаточности (клиренс креатинина от 10 до 70 мл/мин при площади поверхности тела 1,73 м2) кривая «концентрация–время» буспирона повышается в 4 раза по сравнению со здоровыми людьми – клиренс креатинина более 80 мл/мин (I.Mahmood, C.Sahaiwalla, 1999; M.Zhu и соавт., 2005; Buspirone monograph, 1996).
Фармакокинетика буспирона не зависит от расы, возраста или пола (Buspirone monograph, 1996).
В связи с тем, что ингибиторы изофермента цитохрома CYP450 3A4, такие как дилтиазем, верапамил, итраконазол, кетоконазол, эритромицин, ингибиторы ВИЧ-протеаз, способны значительно замедлять выведение буспирона из организма, снижать его клиренс и резко повышать его концентрацию в плазме крови, при таких сочетаниях возрастает риск проявления побочных эффектов буспирона. В то же время ингибиторы CYP450 3A4 замедляют образование активных метаболитов буспирона – 6-гидрокси-буспирона и 1-(2-пиримидинил)-пиперазина и снижают их уровень в крови (I.Mahmood, C.Sahaiwalla, 1999; M.Zhu и соавт., 2005; О.С.Левин, 2015). Это может снизить терапевтическую эффективность буспирона. Поэтому при таких сочетаниях требуются особая осторожность и тщательный мониторинг как побочных эффектов, так и основного терапевтического эффекта буспирона (О.С.Левин, 2015).
При приеме буспирона следует также избегать одновременного употребления большого количества мякоти грейпфрута и грейпфрутового сока (О.С.Левин, 2015). Дело в том, что мякоть грейпфрута и грейпфрутовый сок содержат бергамоттин, природный фуранокумарин, который является сильным ингибитором изофермента цитохрома CYP450 3A4, ответственного за метаболизм многих лекарств, в том числе и буспирона (Buspirone monograph, 1996; D.Bailey и соавт., 2013). Поэтому употребление мякоти грейпфрута или грейпфрутового сока приводит к замедлению биотрансформации и выведения из организма лекарств, метаболизирующихся через этот фермент (в том числе и буспирона). А это, в свою очередь, может приводить к резкому повышению концентрации таких лекарств (в том числе буспирона), к удлинению их периода полувыведения и как следствие – к появлению выраженных побочных эффектов или даже признаков интоксикации препаратом, передозировки препарата, в нашем случае – буспирона. Замедление же образования активных метаболитов лекарств [в случае буспирона – замедление образования 6-гидрокси-буспирона и 1-(2-пиримидинил)-пиперазина] на фоне приема грейпфрута или грейпфрутового сока может приводить к снижению или исчезновению их терапевтического эффекта (Buspirone monograph, 1996; J.Lilja и соавт., 1998; D.Bailey и соавт., 2013).
Напротив, сильные индукторы изофермента CYP450 3A4, такие как рифампицин (рифампин) и его аналоги, карбамазепин (финлепсин, тегретол), фенитоин (дифенин), фенобарбитал, а также курение и употребление алкоголя способны значительно снизить концентрацию буспирона в плазме крови (в случае рифампицина почти в 10 раз), что может приводить к снижению или утрате его терапевтической эффективности (Buspirone monograph, 1996; I.Mahmood, C.Sahaiwalla, 1999; M.Zhu и соавт., 2005; О.С.Левин, 2015).
Одновременное применение буспирона с ингибиторами моноаминоксидазы, включая обратимые, или с препаратами, обладающими побочной активностью ингибиторов моноаминоксидазы, такими как антибиотики линезолид и фуразолидон, противоопухолевый препарат прокарбазин, метиленовый синий, может привести к развитию серотонинового синдрома или гипертонического криза, и поэтому строго запрещено (Buspirone monograph, 1996).
Одновременное применение буспирона с серотонинергическими антидепрессантами (селективными ингибиторами обратного захвата серотонина, селективными ингибиторами обратного захвата серотонина и норадреналина, кломипрамином), триптанами, применяемыми для лечения мигрени, и другими серотонинергическими препаратами или препаратами с побочной серотонинергической активностью, такими как трамадол, способно привести к повышению риска развития серотонинового синдрома. Такая комбинация не противопоказана и часто применяется в клинике, но требует внимательного наблюдения за больным и отслеживания возможных первых признаков развивающегося серотонинового синдрома (Buspirone monograph, 1996).
Исследования показывают, что буспирон не нарушает способность к вождению машины или работе с опасными механизмами, не проявляет клинически значимого взаимодействия с алкоголем, не усиливает его седативное и опьяняющее действие и вызываемые им нарушения концентрации внимания и координации движений. Тем не менее рекомендуется в период лечения буспироном по возможности воздерживаться от употребления алкоголя (Buspirone monograph, 1996).
К клинически важным фармакокинетическим взаимодействиям буспирона относится также его способность повышать уровень в крови N-дезметилдиазепама (нордиазепама), основного активного метаболита диазепама. Это может привести к усилению его побочных эффектов, таких как миорелаксация, головокружение, чувство опьянения, головная боль, тошнота.
Имеет значение в механизмах реализации анксиолитического эффекта буспирона и опосредованное его 5-HT1A-агонистическими свойствами уменьшение выделения холецистокинина – эндогенного анксиогенного (вызывающего тревогу и панические атаки) пептидного гормона. Особенно важно при этом то, что буспирон в большей мере ослабляет повышение выделения холецистокинина в ответ на стресс или воздействие a-адренергических агонистов, таких как йохимбин, адреналин, чем его базальную секрецию (C.Becker и соавт., 1999).
Важно, что воздействие буспирона на пресинаптические и постсинаптические 5-HT1A-рецепторы различно. Для пресинаптических 5-HT1A-рецепторов, которые являются ауторегуляторными (т.е. тормозящими дальнейшее выделение серотонина в синапс), буспирон является преференциальным почти полным агонистом, с внутренней агонистической активностью, приближающейся к 100% от активности эндогенного их лиганда – серотонина. Для постсинаптических же 5-HT1A-рецепторов буспирон является парциальным (частичным) агонистом. То есть буспирон стимулирует их слабее, менее эффективно, чем серотонин, с внутренней агонистической активностью приблизительно 30% от активности серотонина (C.Loane, M.Politis, 2012; S.Stahl, 2013).
Выделенное нами выше слово «преференциальный» означает, что буспирон, при прочих равных условиях, предпочтительно связывается с пресинаптическими, а не постсинаптическими 5-HT1A-рецепторами и проявляет к ним более высокий аффинитет, т.е. воздействует на них в меньших концентрациях, чем на постсинаптические 5-HT1A-рецепторы (C.Loane, M.Politis, 2012; S.Stahl, 2013).
Сильная и преференциальная агонистическая стимуляция буспироном пресинаптических ауторегуляторных
5-HT1A-рецепторов по механизму отрицательной обратной связи вызывает торможение дальнейшего выделения серотонина в синапс и как следствие – начальное ослабление серотонинергической нейропередачи (C.Loane, M.Politis, 2012; S.Stahl, 2013; А.Т.Дзампаев и соавт, 2014). Однако при длительном, хроническом воздействии буспирона пресинаптические 5-HT1A-рецепторы десенситизируются, их чувствительность (патологически повышенная при депрессиях и тревожных состояниях) снижается, как это и должно быть при длительном воздействии любого агониста на рецептор, и подобно тому, как это происходит при длительном лечении антидепрессантами (например, группы селективных ингибиторов обратного захвата серотонина), под влиянием повышенных на фоне их действия концентраций серотонина в синапсе. В результате этой десенситизации пресинаптических 5-HT1A-рецепторов нарушенная при депрессиях и тревожных состояниях серотонинергическая нейропередача восстанавливается, приходит в норму. Предполагается, что именно этот механизм постепенной десенситизации пресинаптических ауторегуляторных 5-HT1A-рецепторов при длительном хроническом воздействии лежит в основе отсроченного на
2–4 нед, как у антидепрессантов, начала проявления антидепрессивного и анксиолитического эффектов буспирона (C.Loane, M.Politis, 2012; S.Stahl, 2013).
Что же касается постсинаптических серотониновых 5-HT1A-рецепторов, через которые реализуются многие из основных физиологических эффектов серотонина, то конечный результат воздействия на них буспирона, как и любого парциального (частичного) агониста, зависит от исходного состояния серотонинергической нейропередачи в конкретной области мозга. В условиях исходно высокой концентрации серотонина (патологически усиленной серотонинергической нейропередачи), которая наблюдается в некоторых областях мозга, например при ряде тревожных расстройств или при приеме селективных ингибиторов обратного захвата серотонина, буспирон, будучи более слабым парциальным агонистом, чем серотонин, срабатывает как его фактический антагонист, ослабляя патологически усиленную серотонинергическую нейропередачу. Это наряду с пресинаптическим действием способствует реализации анксиолитического эффекта буспирона, а также коррекции побочных эффектов от серотонинергических антидепрессантов (C.Loane, M.Politis, 2012; S.Stahl, 2013).
В условиях же исходно низкой концентрации серотонина в синапсах, которая наблюдается, например, при депрессивных состояниях, даже относительно слабая (30% от активности серотонина) парциальная агонистическая активность буспирона по отношению к постсинаптическим 5-HT1A-рецепторам срабатывает именно как агонистическая, приводя тем самым к усилению патологически ослабленной серотонинергической нейропередачи, способствуя десенситизации патологически гиперчувствительных постсинаптических 5-HT1A-рецепторов и внося наряду с пресинаптическим его действием свой вклад в антидепрессивный эффект буспирона (C.Loane, M.Politis, 2012; S.Stahl, 2013).
Таким образом, можно сказать, что буспирон оказывает в целом регулирующее, модулирующее и нормализующее влияние на серотонинергическую нейропередачу, в зависимости от ее исходного состояния, подобно тому, как арипипразол (парциальный агонист дофаминергических D2-рецепторов) оказывает регулирующее, модулирующее и нормализующее влияние на дофаминергические системы мозга, также зависящее от их исходного состояния (S.Stahl, 2013).
В экспериментах на животных показано, что введение буспирона приводит к дозозависимому снижению концентрации серотонина и повышению концентраций дофамина и норадреналина в мозге: в дозах, эквивалентных обычным терапевтическим для человека, уровень серотонина снижается в среднем на 50%, в то время как уровни дофамина и норадреналина повышаются в среднем на 100 и 140% соответственно (C.Loane, M.Politis, 2012; М.Ю.Дробижев и соавт., 2014).
Кроме того, буспирон также оказывает умеренное антагонистическое, блокирующее действие на дофаминергические D2-рецепторы: Ki=240 nM, что приблизительно в 15 раз меньше его аффинности к 5-HT1A-рецепторам (A.Hamik и соавт., 1990; C.Loane, M.Politis, 2012; М.Ю.Дробижев и соавт., 2014). Однако буспирон имеет гораздо более высокую аффинность к пресинаптическим ауторегуляторным D2-рецепторам, тормозящим дальнейшее выделение дофамина в синапс, чем к постсинаптическим, эффекторным D2-рецепторам. Благодаря этому в низких дозах, при низких концентрациях в крови и нервной ткани буспирон усиливает дофаминергическую нейропередачу в центральную нервную систему, в том числе в нигростриарном пути (C.Loane, M.Politis, 2012; М.Ю.Дробижев и соавт., 2014). Это положительное продофаминергическое действие, по-видимому, вносит вклад в антидепрессивную и прокогнитивную активность буспирона, а также объясняет его способность уменьшать экстрапирамидный синдром, вызываемые применением антипсихотика, его просексуальное действие и способность корректировать сексуальные побочные эффекты от антидепрессантов, таких как селективные ингибиторы обратного захвата серотонина и селективные ингибиторы обратного захвата серотонина и норадреналина, уменьшать вызываемую селективными ингибиторами обратного захвата серотонина вялость, утомляемость и апатию (SSRI apathy syndrome), а также его антинегативное действие при шизофрении (C.Loane, M.Politis, 2012).
Только в высоких дозах и концентрациях, клинически не применяемых у человека, буспирон оказывает антидофаминергическое действие, проявляющееся снижением двигательной активности, спонтанности и инициативы у экспериментальных животных, уменьшением вызванных амфетамином или кокаином стереотипий. Однако даже в высоких дозах буспирон не вызывает у экспериментальных животных свойственной антипсихотикам каталепсии, что свидетельствует о низком риске возникновения экстрапирамидного синдрома при его применении (C.Loane, M.Politis, 2012).
Как уже упоминалось, буспирон также обладает достаточно сильными D3- и D4-блокирующими свойствами с Ki=98 и 29 nM соответственно, уступающими по аффинности только его сродству к 5-HT1A-рецепторам (Ki=20 nM). Однако клиническое значение блокады им этих подтипов дофаминовых рецепторов неизвестно, хотя не исключено, что оно вносит вклад в его антинегативное действие при шизофрении (C.Loane, M.Politis, 2012).
Буспирон также оказывает умеренное 5-HT6-блокирующее действие – Ki=398,1 nM (J.Plassat и соавт., 1993) и умеренное 5-HT7-блокирующее действие – Ki=375 nM (T.Lovenberg и соавт., 1993; M.Ruat и соавт., 1993). Сочетание этих рецепторных свойств также может вносить свой вклад в антидепрессивную, анксиолитическую и прокогнитивную активность буспирона (T.Stern и соавт., 2015).
Кроме того, буспирон также обладает слабыми 5-HT2A- и 5-HT2C-блокирующими свойствами (Ki=1300 и 1100 nM соответственно). Это приблизительно в 60 раз меньше его аффинитета к 5-HT1A-рецепторам (M.Fava, 2007). Считается маловероятным, что эти рецепторные свойства в силу довольно низкого аффинитета буспирона к этим рецепторам вносят какой-либо вклад в общую фармакологическую активность буспирона (A.Hamik и соавт., 1990; C.Loane, M.Politis, 2012). Однако некоторые авторы приводят для буспирона более высокие значения аффинитета к 5-HT2A- и 5-HT2C-рецепторам – Ki=138 и 489,7 nM соответственно (D.Bonhaus и соавт., 1997). При таких значениях аффинитета, если они верны, эти рецепторные свойства буспирона также могут вносить некоторый вклад в его общую антидепрессивную, анксиолитическую и прокогнитивную активность и способность уменьшать экстрапирамидный синдром от антипсихотиков и сексуальные побочные эффекты от антидепрессантов, по аналогии с соответствующими рецепторными свойствами атипичных антипсихотиков (S.Stahl, 2013; T.Stern и соавт., 2015).
Один из основных активных метаболитов буспирона, 1-(2-пиримидинил)-пиперазин, циркулирующий в крови в количествах более высоких, чем сам буспирон, является сильным антагонистом пресинаптических тормозных a2-адренорецепторов, подобным миртазапину или миансерину, с аффинностью KD=40 nM (G.Tunnicliff, 1991; K.Zuideveld и соавт., 2002; М.Ю.Дробижев и соавт., 2014). Благодаря эффекту блокады 1-(2-пиримидинил)-пиперазином пресинаптических тормозных a2-адренорецепторов теоретически должно увеличиваться выделение нейромедиаторов, таких как серотонин, дофамин, норадреналин, в синаптическую щель. Вероятно, именно этим пресинаптическим a2-адреноблокирующим эффектом 1-(2-пиримидинил)-пиперазина опосредуется уже упоминавшееся нами увеличение концентраций дофамина и норадреналина в центральную нервную систему экспериментальных животных при воздействии буспирона (G.Tunnicliff, 1991; M.Fava, 2007). Также вероятно, что пресинаптические a2-адреноблокирующие свойства 1-(2-пиримидинил)-пиперазина вносят значительный вклад в общую антидепрессивную, анксиолитическую и прокогнитивную активность буспирона (M.Fava, 2007).
Сам буспирон имеет также слабый аффинитет к a1-адренорецепторам (Ki=1000 nM) и еще более слабый – к a2-адренорецепторам и b-адренорецепторам – Ki=6000 и 8800 nM соответственно (A.Hamik и соавт., 1990; T.Stern и соавт., 2015). Клиническое значение этого факта неизвестно. Однако возможно, что это свойство вносит небольшой вклад в способность буспирона несколько снижать артериальное давление и частоту сердечных сокращений. Это может быть полезным при тревожных состояниях и депрессиях, часто сопровождающихся гиперсимпатикотонией, тахикардией и наклонностью к артериальной гипертензии. Но более вероятно, что это действие буспирона на артериальное давление и частоту сердечных сокращений реализуется непрямым путем, через активацию 5-HT1A-рецепторов вагальных ядер (T.Stern и соавт., 2015).
Также буспирон и некоторые другие азапироны, в частности амиспирон (umespirone), умеренно связываются с s1-рецепторами (для буспирона Ki=558 nM), проявляя по отношению к ним агонистические свойства (Y.Itzhak и соавт., 1990). Между тем, агонизм к s1-рецепторам, как принято считать, приводит к проявлению антидепрессивного, анксиолитического и/или прокогнитивного, нейропротективного действия и может вносить свой вклад в наличие указанных свойств у таких разных препаратов, как сертралин, флувоксамин, мемантин, кетамин, декстрометорфан, метилфенидат (S.Stahl, 2013). По всей видимости, в случае буспирона и амиспирона их агонизм к s1-рецепторам также вносит свой вклад в их антидепрессивное и анксиолитическое действие и наличие у них способности улучшать когнитивные функции (Y.Itzhak и соавт., 1990).
Все прочие рецепторные свойства буспирона столь слабы, что клинического значения заведомо не имеют. В частности, буспирон практически не связывается с M-холинергическими рецепторами (Ki=38 000 nM). Это обусловливает отсутствие у него седативного эффекта, антихолинергических побочных эффектов, негативного влияния на когнитивные функции, присущих, например, такому небензодиазепиновому анксиолитику, как гидроксизин – Атаракс. Буспирон также не связывается с рецепторами
g-аминомасляной кислоты, в частности с их бензодиазепиновым или барбитуровым сайтом (Ki к ним превышает 100 мкМ). Это обусловливает отсутствие у буспирона способности вызывать седацию, миорелаксацию, нарушения памяти и когнитивных функций, свойственные бензодиазепинам и барбитуратам, а также отсутствие у него зависимого потенциала, риска привыкания и пристрастия (T.Stern и соавт., 2015).
Как видно, общий механизм действия буспирона достаточно сложен и не сводится лишь к парциальному 5-HT1A-агонистическому действию (М.Ю.Дробижев и соавт., 2014; T.Stern и соавт., 2015).
Также практическому врачу важно знать, что буспирон не является прямым замещением бензодиазепинов или барбитуратов, прегабалина или габапентина и имеет принципиально другой, отличный от них, механизм анксиолитического действия. Более того, в отличие от некоторых других небензодиазепиновых анксиолитиков или, например, вальпроатов, карбамазепина, буспирон не способен смягчать синдром отмены алкоголя, бензодиазепинов или барбитуратов, прегабалина или габапентина. Поэтому резкая, одномоментная замена бензодиазепинового анксиолитика, прегабалина или габапентина на буспирон не рекомендуется и может привести к развитию выраженного синдрома отмены указанных препаратов (Buspirone monograph, 1996). При планировании такой замены рекомендуется сначала добавить к принимаемому бензодиазепиновому анксиолитику или прегабалину, габапентину буспирон, а к ожидаемому сроку развертывания его анксиолитического эффекта начать постепенно, плавно снижать и отменять бензодиазепиновый анксиолитик или прегабалин, габапентин, возможно, с кратковременным использованием на этом этапе препаратов, смягчающих их синдром отмены (Buspirone monograph, 1996).
Во избежание развития побочных эффектов рекомендуется начало приема буспирона с малых доз: 5 мг 2–3 раза в сутки, т.е. 10–15 мг/сут. В дальнейшем доза буспирона постепенно увеличивается до терапевтической, составляющей обычно 20–30 мг/сут (10 мг 2–3 раза в сутки), до дозы, которая чаще всего оказывалась терапевтически эффективной в большинстве исследований (А.Т.Дзампаев и соавт., 2014). При недостаточной эффективности или полном отсутствии эффекта от этой дозы, спустя 4–6–8 нед, необходимых для оценки ее эффекта, доза буспирона может быть постепенно увеличена до максимальной суточной, составляющей 60 мг/сут – 20 мг 3 раза или 30 мг 2 раза в сутки (А.Т.Дзампаев и соавт., 2014; О.С.Левин, 2015).
В некоторых случаях, например при off-label-применении буспирона для купирования агрессивности и раздражительности, его разовые и суточные дозы могут превышать указанные в инструкции максимальные. В литературе описано его применение по таким показаниям в дозах 90–120 и даже 180 мг/сут – 30–40 мг 3–4 раза в сутки или 60–90 мг 2 раза в сутки (C.Loane, M.Politis, 2012).
Короткий период полувыведения буспирона, линейность его фармакокинетики во всем диапазоне терапевтических доз, а также хорошая его переносимость и малое количество побочных эффектов позволяют при необходимости наращивать его суточные дозы достаточно быстро. Рекомендуется прибавлять по 5 мг/сут каждые 2–3 дня (C.Loane, M.Politis, 2012; М.Ю.Дробижев и соавт., 2014; О.С.Левин, 2015).
При недостаточности анксиолитического эффекта после 4–6–8 нед приема полных терапевтических доз буспирона для усиления его действия можно добавлять другой небензодиазепиновый анксиолитик, или антидепрессант, или, при сохраняющейся бессоннице, снотворное или седативное средство. В ряде случаев, как уже указывалось, подобная комбинация имеет смысл с самого начала терапии (О.С.Левин, 2015).
При полном отсутствии терапевтического эффекта от буспирона после 4–6–8 нед приема полных терапевтических доз подобное комбинирование или потенцирование его действия добавлением антидепрессанта или другого небензодиазепинового анксиолитика также может принести пользу. Вместе с тем, в некоторых случаях полное отсутствие эффекта от буспирона в монотерапии в максимально переносимых дозах в ожидаемые сроки (4–6–8 нед) может свидетельствовать о резистентности к нему и бесперспективности его дальнейшего применения, в том числе в составе комбинаций (О.С.Левин, 2015).
К важным преимуществам буспирона перед другими анксиолитиками относятся его высокая безопасность
(в частности, низкий риск тяжелой передозировки или летального исхода), хорошая переносимость, малое количество побочных эффектов, отсутствие зависимого потенциала, риска развития синдрома отмены при его резкой отмене, отсутствие у него эйфоризирующего действия, выраженной седативности и влияния на поведение и повседневную активность больных, а также отсутствие у него способности давать нарушения сексуальной функции и прибавку массы тела (О.С.Левин, 2015).
В связи с уже упоминавшимися в разделе о фармакокинетике буспирона особенностями его фармакокинетики у больных с почечной и печеночной недостаточностью, у больных с почечной и печеночной недостаточностью легкой и средней степени, циррозом печени, а также у больных с сердечной недостаточностью и пожилых пациентов препарат следует использовать с осторожностью и в меньших дозах, отслеживая его эффективность и наличие побочных эффектов (О.С.Левин, 2015).
И, наконец, напомним, что доза буспирона, как и всякого психотропного препарата, для каждого пациента должна подбираться строго индивидуально, в соответствии с динамикой терапевтического эффекта, переносимостью, уровнем побочных эффектов, характером патологии, при которой он применяется и др. (А.Т.Дзампаев и соавт., 2014).
В отличие от гидроксизина (атаракса) буспирон не обладает М-холинолитическими и H1-гистаминоблокирующими свойствами. Поэтому он обычно не вызывает сухости во рту, пареза аккомодации глаз, запоров и других антихолинергических побочных эффектов (T.Stern и соавт., 2015).
Побочные эффекты при применении буспирона возникают редко, обычно только в начале терапии, и редко бывают тяжелыми. Обычно затем они уменьшаются и проходят по мере адаптации к препарату, несмотря на продолжение его приема. Препарат обычно хорошо переносится. В некоторых случаях для уменьшения или снятия побочных эффектов необходимо снижение дозы препарата или более медленное наращивание его доз (О.С.Левин, 2015).
Наиболее частыми (>10%) побочными эффектами буспирона являются головокружение, головная боль, сонливость. Реже (с частотой от 1 до 10%) встречаются нервозность, нарушения сна, бессонница, нарушения концентрации внимания, раздражительность, тахикардия, парестезии, затуманивание зрения, спутанность сознания, нарушения координации движений, сухость во рту, потливость, тошнота и рвота, тремор, кожный зуд, усталость или чувство утомляемости, диарея, запоры, различные боли: в животе, грудной клетке, мышечно-суставные боли (M.Jann, 1988; Buspirone monograph, 1996; О.С.Левин, 2015).
К редким побочным эффектам буспирона (возникающим с частотой от 0,1 до 1%) относятся гипертензия или гипотензия, ортостатические обмороки, экстрапирамидный синдром, акатизия, нарушения мочеиспускания, изменения массы тела и аппетита в ту или другую сторону (снижение или повышение), гиперсаливация, изменения восприятия вкуса, инъекция сосудов конъюнктивы, мышечная ригидность, затруднения дыхания, отеки, нарушения сексуальной функции, ятрогенная деперсонализация и дереализация, парадоксальное усиление тревоги и др. (M.Jann, 1988; Buspirone monograph, 1996; О.С.Левин, 2015).
Крайне редкие побочные эффекты, возникающие с частотой менее 0,1%, по данным литературы, мы здесь перечислять не будем, тем более что, как указывается, их связь с приемом буспирона в большинстве случаев достоверно не установлена. При передозировке до 375 мг/сут отмечались тошнота и рвота, головокружение, миоз, раздражение желудочно-кишечного тракта, умеренное угнетение сознания (сонливость). Буспирон считается относительно безопасным при передозировке только им одним (M.Jann, 1988).
Как уже указывалось, совместное применение буспирона с ингибиторами моноаминоксидазы может приводить к развитию серотонинового синдрома или гипертонического криза. В связи с этим такая комбинация прямо запрещена инструкцией по медицинскому применению буспирона (M.Jann, 1988; Buspirone monograph, 1996; О.С.Левин, 2015). Это касается также одновременного применения с буспироном таких препаратов, обладающих побочным эффектом ингибирования моноаминоксидазы, как антибиотики линезолид и фуразолидон, противоопухолевый препарат прокарбазин, метиленовый синий (Buspirone monograph, 1996).
Сочетание буспирона с серотонинергическими антидепрессантами (селективными ингибиторами обратного захвата серотонина, селективными ингибиторами обратного захвата серотонина и норадреналина, кломипрамином) потенциально способно повысить риск возникновения серотонинового синдрома. Поэтому, хотя такая комбинация часто применяется в клинической практике, как для потенцирования действия антидепрессантов, так и для коррекции их побочных эффектов (например, сексуальных), при таком сочетании необходимы осторожность и внимательное наблюдение за больным (Buspirone monograph, 1996).
• Повышенная индивидуальная чувствительность или аллергические реакции на буспирон, другие производные азапирона (возможность перекрестных аллергических реакций) или любые другие компоненты таблеток Спитомин.
• Метаболический ацидоз, как, например, при сахарном диабете.
• Прием ингибиторов моноаминоксидазы.
• Тяжелая печеночная или почечная недостаточность.
Согласно действующей в РФ инструкции по применению препарата Спитомин, его применение у детей и подростков до 18 лет также противопоказано, так как в РФ не проводились исследования его эффективности и безопасности у этой категории больных (О.С.Левин, 2015). Вместе с тем, в официальной инструкции FDA по применению буспирона, а также в аналогичных инструкциях, действующих в Евросоюзе, подобного ограничения нет. Более того, в них содержится прямое указание на то, что эффективность и безопасность применения буспирона при тревожных расстройствах установлены на Западе в нескольких хорошо контролируемых рандомизированных клинических исследованиях у детей и подростков от 6 до 18 лет (Buspirone monograph, 1996). Также на Западе имеется ряд исследований по применению буспирона при таких частых психических патологиях детского и подросткового возраста, как расстройства аутистического спектра (D.Chugani и соавт., 2016), синдром дефицита внимания с гиперактивностью или без (R.Davari-Ashtiani и соавт., 2010; M.Mohammadi и соавт., 2012).
Беременность и кормление грудью также являются противопоказаниями к применению буспирона, хотя прямых доказательств его тератогенного, эмбриотоксического или фетотоксического действия нет (О.С.Левин, 2015).
Буспирон не противопоказан, но должен с осторожностью применяться у пациентов, одновременно получающих антипсихотики, сердечные гликозиды, антигипертензивные или противодиабетические препараты. Совместное применение буспирона с пероральными контрацептивами, по некоторым данным, может приводить к ослаблению контрацептивного действия (О.С.Левин, 2015).
Завершая общее описание фармакологии буспирона, перейдем к рассмотрению имеющейся доказательной базы для его применения при различных психических патологиях.
Генерализованное тревожное расстройство. Наибольший опыт применения буспирона накоплен при генерализованном тревожном расстройстве (О.С.Левин, 2015). Кохрановский обзор, опубликованный в 2006 г. и посвященный применению буспирона в лечении генерализованного тревожного расстройства, сообщает о 36 исследованиях с участием 5908 пациентов (C.Chessick и соавт., 2006). Доказательства эффективности буспирона при терапии генерализованного тревожного расстройства основаны на результатах 10 двойных слепых плацебо-контролируемых рандомизированных клинических исследований, включая 8 исследований терапии генерализованного тревожного расстройства у взрослых пациентов (4–6 нед), одно 8-недельное исследование у пожилых пациентов и одно 6-месячное исследование безопасности длительной терапии буспироном. Буспирон продемонстрировал высокую эффективность в дозировках 30 и 45 мг/сут. В одном из исследований уже при дозировке 15 мг/сут его эффект значимо превосходил плацебо и препарат сравнения. Во всех исследованиях отмечалась быстрота наступления анксиолитического эффекта буспирона.
Анксиолитический эффект буспирона, его влияние на психический, соматический и вегетативный компоненты тревоги были четко подтверждены в работах K.Rickels и соавт. (1982 г.) и М.Strand и соавт. (1990 г.). Исследователи отметили, что диазепам лучше влияет на соматические симптомы, а буспирон более эффективен при когнитивных и межличностных проблемах. Эффективность терапии буспироном была подтверждена и в другом сравнительном 6-недельном исследовании с участием 230 пациентов с генерализованным тревожным расстройством (М.Strand и соавт., 1990).
По результатам данных исследований был сделан вывод, что буспирон эффективен в терапии генерализованного тревожного расстройства и обладает выраженным анксиолитическим действием, начинающимся уже со 2-й недели лечения, что сопоставимо со скоростью наступления эффекта при терапии бензодиазепинами, и характеризующимся редукцией как психического, так и соматического (в том числе вегетативного) компонента тревоги, без развития толерантности.
Следует заметить, что в силу своего механизма действия буспирон эффективен не во всех случаях генерализованного тревожного расстройства (A.Berger и соавт., 2009). Препарат особенно эффективен в случаях сочетания генерализованного тревожного расстройства с депрессией, особенно с симптомами «норадренергической и/или дофаминергической недостаточности», такими как подавленность, апатия и анергия, ангедония (C.Campbell Burton и соавт., 2011).
Социальное тревожное расстройство. Давно известно из экспериментальных данных, полученных на животных, что стимуляция 5-HT1A-рецепторов различными экспериментальными агонистами, такими как 8-OH-DPAT или флезиноксан, приводит не только к снижению общего уровня тревожности и купированию экспериментальной депрессии, но и к улучшению социального взаимодействия животных в моделях, имитирующих социальную тревожность у человека. В свете этого, разумеется, не мог не привлечь внимания специалистов, занимающихся лечением социального тревожного расстройства, клинически доступный парциальный 5-HT1A-агонист буспирон. Известно также, что социальную тревожность животных в этих моделях, как и социальное тревожное расстройство у человека, уменьшает также введение экзогенного окситоцина. Между тем, 5-HT1A-агонисты, включая буспирон, способствуют усилению секреции эндогенного окситоцина. Все это послужило теоретической основой для начала изучения потенциальной эффективности буспирона при социальном тревожном расстройстве у людей (D.Munjack и соавт., 1991; F.Schneier и соавт., 1993).
Данные исследований свидетельствуют о возможной эффективности буспирона в лечении социального тревожного расстройства. Впервые это было показано в открытых пилотных исследованиях в 1991 и 1993 г. (D.Munjack и соавт., 1991; F.Schneier и соавт., 1993). Так, в 12-недельном открытом пилотном исследовании F.Schneier и соавт., которое было слепым для пациентов, но не для исследователей, участвовал 21 пациент с диагнозом социального тревожного расстройства по критериям DSM-III-R, не отреагировавший на предварительное недельное слепое для них использование плацебо. Из 21 пациента 17 человек удержались в исследовании более 2 нед. Из этих 17 человек к сроку 12 нед значительное или очень значительное клиническое улучшение по шкале общего клинического впечатления (CGI) было зарегистрировано у 8 (47%). При этом авторы обратили внимание на то, что у 12 из 17 пациентов, соответствующих критериям генерализованной формы социального тревожного расстройства, результаты лечения буспироном оказались лучше, чем у остальных 5, страдающих изолированными социальными фобиями (когда тревога возникает лишь в некоторых социальных ситуациях, но не возникает в других). Также они обратили внимание на то, что высокие дозы буспирона при социальном тревожном расстройстве могут оказаться эффективнее, чем более низкие: среди 12 пациентов, которые смогли переносить дозу 45 мг/сут буспирона или более, очень значительное клиническое улучшение по шкале CGI было достигнуто у 9 (67%) [F.Schneier и соавт., 1993].
Важно отметить, что в упомянутом открытом пилотном исследовании было также показано, что терапевтический эффект буспирона при социальном тревожном расстройстве специфичен и не зависит от его влияния на коморбидные проявления депрессии и генерализованного тревожного расстройства, эффективность в отношении которых у буспирона давно официально установлена: снижение показателей социальной тревожности у больных в этом исследовании не коррелировало со снижением показателей генерализованного тревожного расстройства или депрессии, которые были в отобранной группе изначально низкими, т.е. отбирались пациенты с «чистым» социальным тревожным расстройством, без значимых коморбидных депрессий или генерализованного тревожного расстройства (F.Schneier и соавт., 1993).
Большой интерес представляет также вопрос о том, не может ли буспирон служить эффективным потенцирующим агентом к антидепрессантам при социальном тревожном расстройстве, резистентном к монотерапии антидепрессантами. Это предположение подверглось проверке в небольшом (n=10) 8-недельном открытом исследовании, в котором участвовали пациенты, у которых был достигнут частичный ответ на монотерапию селективными ингибиторами обратного захвата серотонина в течение предыдущих 8 нед (M. Van Ameringen и соавт., 1996). Всем этим пациентам был назначен в качестве потенцирующего агента буспирон (30, 45 или 60 мг/сут). К сроку 8 нед значительное или очень значительное клиническое улучшение продемонстрировали 7 (70%) из 10 пациентов, причем у пациентов, получавших 45 мг/сут и более, оно было более выраженным. Из 3 (30%) пациентов, оказавшихся нон-респондерами по отношению к потенцированию селективных ингибиторов обратного захвата серотонина буспироном, все получали буспирон в дозе лишь 30 мг/сут из-за неспособности переносить более высокую дозу. Авторы констатировали, что буспирон в целом хорошо переносится этими больными, безопасен и является перспективным потенцирующим агентом при социальном тревожном расстройстве, резистентном к монотерапии селективными ингибиторами обратного захвата серотонина, особенно при высоких дозах, и призвали к его изучению в этом качестве в формате крупных многоцентровых рандомизированных клинических исследований (M. Van Ameringen и соавт., 1996).
В двух последних метаобзорах, посвященных описанию возможностей психофармакотерапии при социальном тревожном расстройстве, включая ее резистентные формы, констатируется, что, в отличие от ситуации с терапевтически резистентными депрессиями, методов лечения терапевтически резистентных форм социального тревожного расстройства, прошедших проверку доказательной медициной на уровне рандомизированных клинических исследований, почти нет. При этом в качестве потенциальных способов преодоления резистентности к антидепрессантам при социальном тревожном расстройстве, имеющих доказательную базу хотя бы на уровне открытых исследований, упоминаются добавление буспирона, вальпроатов, интраназального окситоцина и др. (A.Halaby и соавт., 2013; V.Masdrakis и соавт., 2013).
Паническое расстройство. Буспирон как перспективный анксиолитик широкого спектра действия изучался не только при генерализованном тревожном расстройстве, но и при других тревожных расстройствах, в частности при паническом расстройстве.
Эффективность буспирона при паническом расстройстве изучалась и российскими исследователями. В одном из таких рандомизированных клинических исследований проводилось сопоставление эффективности буспирона (препарата Спитомин) в сочетании с краткосрочной когнитивно-поведенческой терапией в течение 6 нед по сравнению с монотерапией когнитивно-поведенческой плюс плацебо. В исследовании участвовали 30 пациентов с диагнозом панического расстройства согласно критериям Международной классификации болезней 10-го пересмотра (А.В.Васильева и соавт., 2015). Одной группе пациентов (15 человек) назначался буспирон в фиксированной дозе 30 мг/сут (10 мг 3 раза в день) в сочетании с коротким курсом когнитивно-поведенческой терапии. Второй же группе пациентов (также 15 человек) назначалось плацебо в сочетании с таким же курсом краткосрочной когнитивно-поведенческой терапии. Обе группы были сопоставимы по основным демографическим характеристикам, а также по тяжести и длительности заболевания. В качестве оценочных шкал в этом исследовании использовались шкала тревоги Гамильтона (HAM-A), шкала ситуационной и личностной тревожности Спилбергера–Ханина (STAI-A), шкала депрессии Монтгомери–Асберга (MADRS) и шкала общего клинического впечатления – CGI (А.В.Васильева и соавт., 2015).
Авторами данного исследования было показано, что буспирон в сочетании с когнитивно-поведенческой терапией статистически достоверно эффективнее монотерапии когнитивно-поведенческой плюс плацебо и добавление буспирона к проводимой когнитивно-поведенческой терапией улучшает ее результаты и облегчает ее проведение, снижая уровень межприступной тревоги, повышая гибкость психики пациентов и их готовность к восприятию установок психотерапевта и выполнению его заданий, модификации устоявшихся негативных паттернов мышления и поведения. Обращает на себя внимание статистически достоверное, хотя и небольшое, уменьшение показателей личностной тревожности по шкале Спилберга–Ханина, отражающее упомянутое повышение гибкости психики пациентов (А.В.Васильева и соавт., 2015).
Применение буспирона в сочетании с когнитивно-поведенческой терапией при паническом расстройстве также привело к статистически достоверному снижению уровней ситуационной тревожности по шкале STAI-A, снижению общего уровня тревоги по шкале HAM-A и уровня коморбидной депрессии по шкале MADRS, уменьшению инвалидизации больных и улучшению общего клинического впечатления по шкале CGI по сравнению с комбинацией плацебо и когнитивно-поведенческой терапии. Уровни ситуационной и личностной тревожности пациентов, хотя и снизились к концу исследования, все же оставались достаточно высокими. Среднее снижение общего уровня тревоги по шкале HAM-A превысило 50% от исходного уровня – 9,73 балла (А.В.Васильева и соавт., 2015).
Важно отметить, что пациенты с паническим расстройством нередко плохо переносят психотропные лекарства, испытывают выраженную фармакофобию, нередко дают ноцебо-реакции на различные препараты (в том числе на плацебо), склонны давать начальное обострение тревоги и учащение панических атак при применении антидепрессантов. В свете этого большое клиническое значение имеет установленная авторами цитируемого исследования хорошая переносимость буспирона у этой категории больных, отсутствие у него склонности вызывать начальное обострение тревоги и учащение панических атак. Благодаря хорошей переносимости препарата все участники исследования смогли его завершить без досрочного выбытия (А.В.Васильева и соавт., 2015).
Сходные результаты, показывающие эффективность добавления буспирона к когнитивно-поведенческой терапии при паническом расстройстве, были ранее получены и западными исследователями (J.Cottraux и соавт., 1995).
В систематическом обзоре 2002 г., посвященном изучению возможностей психофармакотерапии при паническом расстройстве, резистентном к терапии 1-й линии (антидепрессанты группы селективных ингибиторов обратного захвата серотонина), указывается, что возможности справиться с резистентностью при паническом расстройстве, в отличие от ситуации с резистентными депрессиями, практически не изучались в формате рандомизированных клинических исследований. При этом среди методов потенцирования антидепрессантов при резистентном паническом расстройстве, имеющих доказательную базу хотя бы на уровне открытых пилотных исследований, упоминается добавление буспирона, вальпроатов, b-адреноблокаторов (M.Zamorski, R.Albucher, 2002).
Посттравматическое стрессовое расстройство. По данным ряда открытых исследований, буспирон эффективен также в терапии посттравматического стрессового расстройства, как в монотерапии (B.Wells и соавт., 1991; L.LaPorta, M.Ware, 1992; J.Duffy, P.Malloy, 1994), так и в качестве потенцирующего агента в дополнение к антидепрессанту (M.Hamner и соавт., 1997).
При применении буспирона у пациентов с посттравматическим стрессовым расстройством отмечалось уменьшение не только тревожности, но и таких симптомов посттравматического стрессового расстройства, как панические атаки, бессонница, кошмары, нарушения фазовой структуры сна, «флэшбэки» (болезненные психотравмирующие воспоминания). Улучшались также настроение больных, их уровень энергии и повседневной активности, уменьшалась выраженность депрессивной симптоматики (B.Wells и соавт., 1991; L.LaPorta, M.Ware, 1992; J.Duffy, P.Malloy, 1994).
В частности, в открытом исследовании показано, что буспирон эффективен в терапии посттравматического стрессового расстройства у американских военных, пострадавших в результате боевых действий в Ираке (C.Fichtner, J.Crayton, 1994).
В относительно свежем обзоре от 2012 г., посвященном изучению тенденций в выписке психотропных лекарств при лечении посттравматического стрессового расстройства, отмечается, что в связи с высоким риском развития бензодиазепиновой зависимости именно у пациентов с посттравматическим стрессовым расстройством по сравнению с пациентами с другими формами тревожных расстройств частота назначения им бензодиазепинов за последние 10 лет стабильно снижалась, в то время как частота назначения буспирона наряду с празозином и доксазозином, антидепрессантами группы селективных ингибиторов обратного захвата серотонина и селективных ингибиторов обратного захвата серотонина и норадреналина, как препаратами, имеющими наиболее убедительную доказательную базу для применения при посттравматическом стрессовом расстройстве, стабильно росла (N.Bernardy и соавт, 2012).
Расстройства обсессивно-компульсивного спектра
Расстройства обсессивно-компульсивного спектра, как сегодня считают, связаны с нарушениями в балансе серотонинергической и дофаминергической нейропередачи в кортико-таламо-стриатальных цепях. Эта теория подтверждается, в частности, тем, что расстройства обсессивно-компульсивного спектра специфически отвечают на применение только серотонинергических антидепрессантов (селективных ингибиторов обратного захвата серотонина, селективных ингибиторов обратного захвата серотонина и норадреналина, кломипрамина), но не других классов антидепрессантов. Поэтому при резистентности расстройств обсессивно-компульсивного спектра к терапии 1-й линии (серотонинергическим антидепрессантам) пытаются применять для их потенцирования различные серотонинергические и антидофаминергические агенты, в частности фенфлюрамин, литий, различные антипсихотики и др. (S.Stahl, 2013). Безусловно, не мог не привлечь внимания исследователей, занимающихся лечением расстройств обсессивно-компульсивного спектра, и такой серотонинергический и дофаминорегулирующий (в зависимости от дозы дофаминергический или антидофаминергический) агент, как буспирон. Ниже мы опишем результаты его исследования при этих патологиях.
Обсессивно-компульсивное расстройство. Данные об эффективности буспирона при обсессивно-компульсивном расстройстве противоречивы, но в некоторых исследованиях показан положительный эффект препарата, особенно при его комбинации с другими психофармакологическими препаратами, прежде всего антидепрессантами (О.С.Левин, 2015). В открытых исследованиях показано, что присоединение буспирона в дозе 30–90 мг/сут к селективным ингибиторам обратного захвата серотонина повышает эффективность лечения обсессивно-компульсивного расстройства почти у 1/2 пациентов, в основном у тех, кто имел частичный ответ на серотонинергические антидепрессанты (T.Grady и соавт., 1993; M.Gross, 1995).
Буспирон, по предварительным данным, способен усиливать действие флуоксетина у резистентных к проводимой терапии больных с обсессивно-компульсивным расстройством (T.Grady и соавт., 1993; C.McDougle и соавт., 1993).
Трихотилломания. Буспирон оказался эффективен в дополнение к кломипрамину и психотерапии у девочки с расстройством аутистического спектра и коморбидной трихотилломанией, у которой изолированное применение кломипрамина, буспирона и психотерапии в качестве монотерапий оказалось неэффективным. При этом уменьшились как проявления расстройств аутистического спектра, такие как раздражительность, агрессивность, неконтактность, стереотипность и негибкость поведения, так и проявления трихотилломании (J.Holttum и соавт., 1994).
В другом описанном в литературе случае буспирон оказался эффективен в потенцировании действия селективных ингибиторов обратного захвата серотонина флуоксетина и психотерапии у 23-летнего юноши с трихотилломанией и дисморфофобией. Оба расстройства не поддавались ни монотерапии флуоксетином, ни психотерапии до добавления к терапии буспирона (J.Tanquary, 1994).
Третий интересный случай описывает 31-летнюю женщину с генерализованным тревожным расстройством и коморбидной трихотилломанией, с частичным ответом обоих расстройств на селективный ингибитор обратного захвата серотонина флувоксамин. После добавления к терапии 30 мг/сут буспирона спустя 4 нед эпизоды трихотилломании (навязчивого выдергивания волос) прекратились полностью, а проявления генерализованного тревожного расстройства значительно уменьшились, до уровня, позволившего женщине возобновить выполнение профессиональных обязанностей (T.Reid, 1992).
Клептомания. Клептомания также относится к расстройствам обсессивно-компульсивного спектра, хотя некоторые специалисты выделяют ее и ряд других расстройств обсессивно-компульсивного спектра в отдельную подгруппу «расстройств контроля влечений» (impulse control disorders). Учитывая имеющиеся данные об эффективности буспирона в терапии «классического» обсессивно-компульсивного расстройства, а также таких расстройств обсессивно-компульсивного спектра, как трихотилломания, дисморфофобия, и данные о его способности уменьшать импульсивность при различных психических заболеваниях, авторами одного небольшого рандомизированного клинического исследования была предпринята попытка использования буспирона в качестве потенцирующего агента к селективному ингибитору обратного захвата серотонина флувоксамину у небольшой группы больных клептоманией в сравнении с плацебо (n=17, средний возраст 24,5 года, все мужского пола). При этом было показано, что в группе буспирона 30 мг/сут отмечалось статистически достоверное урежение количества эпизодов клептоманического поведения по сравнению с плацебо (R.Durst и соавт., 1997, a).
В более позднем обзоре тех же израильских авторов, посвященном рассмотрению феноменологических, клинических и медико-юридических аспектов клептомании как таковой, указывается, что эффективность буспирона в качестве потенцирующего агента к селективным ингибиторам обратного захвата серотонина (в их случае, к флувоксамину) при клептомании не просто заслуживает дальнейшего изучения в формате масштабных и хорошо контролируемых рандомизированных клинических исследований, но и позволила уже сейчас в ряде случаев избежать весьма неблагоприятных социальных и юридических последствий клептоманических поступков для их пациентов. Поэтому изучение буспирона в качестве перспективного потенцирующего агента при клептомании имеет важное социальное и медико-легальное значение (R.Durst и соавт., 1997, б).
Дисморфофобия. Это расстройство (body dysmorphic disorder) также относится к расстройствам обсессивно-компульсивного спектра. В одном небольшом пилотном открытом исследовании изучали эффективность потенцирования буспироном серотонинергических антидепрессантов (препаратов группы селективных ингибиторов обратного захвата серотонина или кломипрамина) у 13 пациентов с диагнозом «дисморфофобия» согласно критериям DSM-IV, с частичным ответом или отсутствием ответа на монотерапию серотонинергическим антидепрессантом. При этом у 6 (46%) из 13 пациентов был получен положительный ответ на добавление буспирона в качестве потенцирующего агента. У 3 из этих 6 пациентов, которые впоследствии отменили буспирон или снизили его дозу, симптомы дисморфофобии вновь усилились или вернулись. У 1 пациента, который в результате этого ухудшения согласился вернуть прежнюю дозу буспирона, снова наступило улучшение. Авторы данного исследования заключили, что буспирон является перспективным потенцирующим агентом при дисморфофобии с недостаточным ответом на стандартную терапию и что он заслуживает дальнейшего изучения в формате рандомизированных клинических исследований при этой патологии (K.Phillips, 1996).
В 2001 г. описан интересный клинический случай эффективности потенцирования буспироном селективного ингибитора обратного захвата серотонина сертралина у 14-летней девочки-подростка с дисморфофобией бредового уровня, резистентной к применению антипсихотика пимозида, мощного серотонинергического антидепрессанта класса трициклических антидепрессантов кломипрамина и к монотерапии сертралином (H.Duggal и соавт., 2001).
В двух последующих систематических обзорах от 2001 и 2008 г., посвященных изучению эффективности психофармакотерапии при дисморфофобии как таковой, констатируется, что буспирон может быть эффективен в качестве потенцирующего агента при дисморфофобии, не отвечающей или недостаточно отвечающей на монотерапию серотонинергическими антидепрессантами (K.Phillips и соавт., 2001; K.Phillips, E.Hollander, 2008).
Депрессивные расстройства
Известно, что антидепрессивное действие таких классов антидепрессантов, как селективные ингибиторы обратного захвата серотонина, селективные ингибиторы обратного захвата серотонина и норадреналина, трициклические антидепрессанты, ингибиторы моноаминоксидазы, во многом опосредуется вызываемой повышением уровня серотонина в синапсах непрямой стимуляцией именно 5-HT1A-постсинаптических серотониновых рецепторов, в то время как стимуляция таких подтипов серотониновых рецепторов, как 5-HT2A/C или 5-HT3, считается скорее вредной в лечении депрессий, и именно с ней связывают такие побочные эффекты в начале терапии антидепрессантами, как тошнота и рвота, головная боль, бессонница, обострение тревоги (S.Stahl, 2013). Также известно, что именно наблюдаемая при депрессиях патологическая гиперчувствительность пресинаптических ауторегуляторных 5-HT1A-рецепторов, ограничивающая дальнейшее выделение серотонина в синапс, препятствует быстрому наступлению антидепрессивного эффекта «классических» антидепрессантов (возникает своеобразное «сопротивление» клетки, стремящейся восстановить исходный гомеостаз на низком уровне серотонина). А с патологической гиперчувствительностью постсинаптических рецепторов связывают выраженность начальных побочных эффектов при терапии антидепрессантами. В то же время прямые 5-HT1A-парциальные агонисты, такие как буспирон, флезиноксан, «обходят» это начальное ауторегуляторное ограничение выброса серотонина, непосредственно стимулируя постсинаптические серотониновые рецепторы, и одновременно способствуют более быстрой десенситизации как пре-, так и постсинаптических рецепторов, уменьшают начальные побочные эффекты от антидепрессантов и ускоряют наступление их антидепрессивного эффекта. В экспериментах на животных 5-HT1A-агонисты вызывают значительно более быстрый антидепрессивный эффект, чем «классические» антидепрессанты (S.Stahl, 2013).
В свете всего сказанного неудивительно, что буспирон привлекает большое внимание специалистов в качестве перспективного средства лечения депрессий как в монотерапии, так и в особенности в роли потенцирующего агента к антидепрессантам. По данным литературы, буспирон особенно эффективен в качестве потенцирующего агента при лечении депрессивных состояний, которые протекают с симптомами «норадренергической и/или дофаминергической недостаточности», с подавленностью, безрадостностью, безнадежностью, неуверенностью, утратой интересов и способности испытывать удовольствие; замедлением информационных процессов, моторной заторможенностью и утратой энергии (М.Ю.Дробижев и соавт., 2014).
Большой интерес в этом плане представляют работы J.Davidson и соавт. (1999 г.) и N.Mokhber и соавт. (2010 г.), в рамках которых были проведены сравнительные 8-недельные исследования эффективности буспирона и антидепрессанта венлафаксина (J.Davidson и соавт., 1999) и сертралина (N.Mokhber и соавт., 2010). В работе европейских ученых, J.Davidson и соавт., исследуемую популяцию составили 365 пациентов, которые были рандомизированы в группу терапии буспироном (30 мг/сут) и венлафаксином (75 и 150 мг/сут). Уместно отметить, что венлафаксин является первым антидепрессантом из группы селективных ингибиторов обратного захвата серотонина и норадреналина, одобренным FDA для лечения генерализованного тревожного расстройства. К моменту завершения 8 нед терапии по основному критерию оценки – уменьшению симптомов тревоги и депрессии – эффективность буспирона была сопоставима с венлафаксином в дозе 75 мг/сут, но несколько уступала по эффективности венлафаксину в дозе 150 мг. Другое исследование, выполненное в 2010 г. N.Mokhber и соавт., имело две особенности. Во-первых, эффективность буспирона была продемонстрирована в минимальной дозе (15 мг/сут). Во-вторых, в это исследование были включены пожилые пациенты с генерализованным тревожным расстройством, средний возраст которых составил 66,5 года. Буспирон в суточной дозе 15 мг оказался статистически достоверно значительно эффективнее сертралина (50–100 мг/сут), как в отношении уменьшения клинических симптомов, так и быстроты развития анксиолитического и антидепрессивного эффектов: на 2-й неделе терапии уменьшение симптомов тревоги и депрессии было более существенным в группе буспирона.
Наглядным примером достаточного потенциала буспирона в лечении тревожных и депрессивных расстройств стали исследование, проведенное J.Sramek и соавт. (1996 г.), и более поздний метаанализ 8 клинических исследований у пациентов с генерализованным тревожным расстройством и депрессией, проведенный C.Chessick и соавт. (2006 г.). В 6-недельное плацебо-контролируемое исследование были включены 162 пациента с подтвержденным диагнозом генерализованного тревожного расстройства и субсиндромальной депрессией, у которых суммарная оценка по шкале HAM-D не превышала 17 баллов (J.Sramek и соавт., 1996). Пациентам, рандомизированным в группу терапии буспироном, препарат назначался в суточной дозе 15 мг/сут с последующей титрацией дозы на 5 мг каждые 2 дня до достижения 45 мг/сут. Другая часть пациентов была рандомизирована в группу терапии плацебо. На момент окончания исследования и терапии эффективность лечения буспироном превосходила плацебо как в плане уменьшения симптомов тревоги, оцененных по шкале HAM-A, так и в плане уменьшения симптомов депрессии по шкале HAM-D. Результаты метаанализа 8 двойных слепых плацебо-контролируемых рандомизированных клинических исследований с суммарным числом участников 520 человек, по поводу применения буспирона в дозах до 45 мг/сут у пациентов с генерализованным тревожным расстройством и депрессией, продемонстрировали эффективность и положительное влияние терапии буспироном на симптомы как тревоги, так и депрессии. По оценке лечащих врачей, на фоне терапии буспироном также происходило улучшение общего состояния пациента. Особенностью данного метаанализа явилось и то, что у значительной части пациентов (44,6%) тяжесть депрессивных симптомов на момент включения в исследование была оценена как значительная и очень значительная (C.Chessick и соавт., 2006). Результаты данного исследования и метаанализа позволяют сделать вывод об эффективности буспирона у пациентов с генерализованным тревожным расстройством и депрессией. Это свидетельствует о наличии двух параллельных независимых клинических эффектов препарата – анксиолитического и антидепрессивного.
В настоящее время накоплен значительный клинический опыт, подтверждающий эффективность включения буспирона в схему терапии при неэффективности антидепрессантов или терапевтически резистентной депрессии. Доказательства эффективности потенцирования антидепрессантов буспироном основаны на результатах 7 рандомизированных клинических исследований (K.Harvey, R.Balon, 1995). Все включенные в исследования пациенты имели подтвержденный диагноз большого депрессивного расстройства и получали трициклические антидепрессанты (имипрамин и кломипрамин) или селективные ингибиторы обратного захвата серотонина с недостаточным эффектом. Буспирон назначался в дозах 30–90 мг/сут в
3 приема в течение 6–8 нед. В одном 4-недельном исследовании (E.Schweizer и соавт., 1986) была изучена эффективность потенцирования антидепрессантов буспироном у 30 пациентов с большим депрессивным расстройством, получавших серотонинергические антидепрессанты с недостаточным эффектом. Буспирон добавлялся в схему терапии в дозе 30 мг/сут. В результате комбинированной терапии было достигнуто значительное уменьшение симптоматики, в отличие от пациентов, получавших монотерапию антидепрессантами. Также положительными оказались результаты другого исследования (F.Jacobsen, 1990), у включенных в которое пациентов с большим депрессивным расстройством наблюдалась недостаточная эффективность терапии селективными ингибиторами обратного захвата серотонина (флуоксетин) и трициклическими антидепрессантами (имипрамин). Буспирон назначался совместно с терапией антидепрессантами в дозе 10 мг 3 раза в сутки, к концу исследования было также достигнуто значительное снижение выраженности депрессивной симптоматики. В двух других исследованиях (D.Robinson, K.Rickels, 1990; K.Rickels и соавт., 1991) также было показано усиление терапевтического эффекта селективных ингибиторов обратного захвата серотонина при присоединении к схеме лечения буспирона у 155 пациентов с терапевтически резистентной депрессией. Результаты, полученные в более ранних исследованиях, дали весомые основания полагать, что буспирон в сочетании со стандартной терапией антидепрессантами позволяет существенно повысить эффективность терапии депрессии, а также ускорить наступление эффекта антидепрессантов и уменьшить выраженность их начальных побочных эффектов.
В дальнейшем работы в этом направлении были продолжены, и полученные результаты были подтверждены в более масштабных, тщательно спланированных рандомизированных клинических исследованиях. Большой интерес представляет работа (E.Dimitriou, C.Dimitriou, 1998), в рамках которой была оценена эффективность потенцирования антидепрессантов буспироном у пациентов с большим депрессивным расстройством, недостаточной эффективностью терапии трициклическими антидепрессантами (кломипрамин в дозе 125–175 мг/сут) и селективными ингибиторами обратного захвата серотонина (флуоксетин 20–40 мг/сут, пароксетин 20–30 мг/сут, циталопрам 20–40 мг/сут). Пациенты, у которых не наступал положительный эффект в течение 6 нед терапии антидепрессантами, были рандомизированы в две группы, в каждой из которых к неизменным дозировкам назначенных ранее антидепрессантов добавлялся буспирон в дозе 15 мг/сут, которая была повышена со 2-й недели до 30 мг/сут. Оценка эффективности потенцирования буспироном антидепрессантов была проведена на 4 и 5-й неделях лечения. Средняя доза буспирона на момент окончания терапии составила 27 мг/сут и значимо не различалась в группах больных, принимавших разные антидепрессанты. Результаты исследования продемонстрировали отчетливые преимущества в показателях эффективности терапии при добавлении к антидепрессантам буспирона по сравнению с монотерапией антидепрессантами. На момент окончания исследования 59,1% пациентов достигли ремиссии в группе сочетанной терапии селективными ингибиторами обратного захвата серотонина и буспироном и 62,5% – в группе терапии трициклическими антидепрессантами и буспироном. В целом показатель ремиссии к концу исследования в обеих группах составил 60%. К концу наблюдения суммарные значения по шкале оценки депрессии HAM-D статистически значимо снизились относительно исходных: в начале исследования – 25,4, по его окончании – 11,8 балла (E.Dimitriou, C.Dimitriou, 1998).
Расстройства шизофренического спектра
Как мы уже упоминали в разделе об истории создания буспирона, изначально он синтезировался в качестве антипсихотика. В разделе о его фармакодинамических свойствах и механизмах действия мы упоминали о том, что буспирон наряду с прочими своими рецепторными свойствами обладает преференциальной пресинаптической D2-блокирующей активностью и в малых (обычно применяемых в клинической практике) дозах повышает выделение дофамина в синапс и что его применение приводит к повышению концентраций дофамина в таких областях мозга, как нигростриарная система, префронтальная кора (О.С.Левин, 2015). Между тем именно со снижением концентрации дофамина в префронтальной коре связывают негативную и когнитивную симптоматику шизофрении и другие расстройства шизофренического спектра, в то время как с повышенной дофаминергической активностью в мезолимбических проводящих путях связывают продуктивную симптоматику. С избыточной блокадой D2-рецепторов нигростриарной системы под влиянием антипсихотиков связывают возникновение при лечении ими экстрапирамидного синдрома и акатизии, а с избыточной блокадой ими D2-рецепторов префронтальной коры – вызываемую ими вторичную ятрогенную негативную симптоматику (neuroleptic induced deficit syndrome – NIDS), вторичные ятрогенные когнитивные нарушения («отупение»). С избыточной блокадой D2-рецепторов лимбической системы связывают ангедонию, притупление эмоций, нейролептическую депрессию (S.Stahl, 2013).
Немаловажное значение в контексте лечения расстройств шизофренического спектра имеет также наличие у буспирона таких рецепторных свойств, как сильный парциальный 5-HT1A-агонизм, слабый или умеренный антагонизм к 5-HT2A/C, 5-HT6, 5-HT7-рецепторам. Именно с этими рецепторными свойствами атипичных антипсихотиков связывают их меньшую по сравнению с типичными антипсихотиками способность вызывать экстрапирамидный синдром и акатизию, NIDS, нейролептические депрессии, меньшее негативное влияние на когнитивные функции больных и даже наличие у многих из них прокогнитивных, антидепрессивных и антинегативных свойств. Между тем давно известно, что именно негативная, когнитивная и депрессивная симптоматика шизофрении в гораздо большей мере, чем продуктивная, предопределяет долгосрочные функциональные исходы больных шизофренией, их работоспособность и социализацию (S.Stahl, 2013).
В свете всего сказанного неудивительно, что внимание специалистов, занимающихся лечением расстройств шизофренического спектра, привлекла идея комбинирования буспирона с антипсихотиками с целью «повысить их атипичность», приблизить спектр рецепторной активности такой комбинации к спектру рецепторной активности наиболее современных из атипичных антипсихотиков, уменьшить их побочные эффекты (в частности, экстрапирамидный синдром, акатизию, проявления NIDS, нейролептическую депрессию, когнитивное снижение) [D.Piskulic и соавт., 2009]. С теоретических позиций это должно способствовать значительному расширению возможностей психофармакотерапии при расстройствах шизофренического спектра, усилению влияния психофармакотерапии на такие трудно поддающиеся лечению аспекты расстройств шизофренического спектра, как негативная симптоматика, когнитивные нарушения, депрессия, улучшению переносимости антипсихотиков (М.Ю.Дробижев и соавт., 2014).
В одном двойном слепом рандомизированном клиническом исследовании участвовали 50 пациентов с хроническим течением шизофрении. Половина пациентов были рандомизированы в группу, которая в дополнение к получаемому ими стандартному антипсихотику (типичному или атипичному) получала буспирон в дозе 30 мг/сут. Другая половина пациентов получали в дополнение к уже получаемому ими стандартному антипсихотику плацебо. Авторам этого исследования удалось показать, что адъювантное применение буспирона в дополнение к антипсихотику приводит к статистически достоверному уменьшению выраженности негативной и когнитивной симптоматики шизофрении по шкале PANSS и уменьшению выраженности депрессивной симптоматики по шкале HAM-D по сравнению с плацебо (F.Sheikhmoonesi и соавт., 2015).
Важно учитывать также фармакокинетическое потенцирование буспироном некоторых антипсихотиков. Так, в частности, одновременное применение буспирона и галоперидола приводит к повышению концентрации галоперидола в плазме почти на 26% после 6 нед терапии (D.Goff и соавт., 1991).
В еще одном двойном слепом рандомизированном клиническом исследовании, куда вошли 46 пациентов с шизофренией, больные были рандомизированы следующим образом: 23 пациента получали рисперидон в дозе 6 мг/сут плюс буспирон 60 мг/сут, а 20 пациентов – рисперидон в дозе 6 мг/сут плюс плацебо. При этом в той группе пациентов, которая получала в дополнение к рисперидону буспирон, была отмечена статистически достоверная редукция не только негативной и когнитивной, но и продуктивной симптоматики по шкале PANSS по сравнению с группой, которая получала в дополнение к рисперидону плацебо (A.Ghaleiha и соавт., 2010).
В третьем двойном слепом рандомизированном клиническом исследовании участвовали 18 пациентов с шизофренией, которые получали либо буспирон в дозах 15–30 мг/сут, либо плацебо в дополнение к антипсихотику. В этом исследовании изучалась эффективность добавления буспирона к антипсихотику в отношении только когнитивной симптоматики (эффективность в отношении негативной, продуктивной или аффективной симптоматики не исследовалась). При этом в группе буспирона не было отмечено статистически достоверного улучшения когнитивного функционирования больных по сравнению с плацебо. Авторы связали это с тем, что многие пациенты, включенные в исследование, получали в качестве антипсихотика арипипразол – атипичный антипсихотик, сам по себе весьма сильно стимулирующий 5-HT1A-рецепторы. В таких условиях маловероятно, что дополнительная стимуляция 5-HT1A-рецепторов буспироном способна привести к клинически значимому улучшению когнитивного функционирования больных, по сравнению с уже достигнутым на таком атипичном антипсихотике. Это, однако, не означает, что буспирон не может быть эффективен в данном отношении в комбинации с другим атипичным антипсихотиком, не обладающим столь сильными 5-HT1A-агонистическими свойствами (D.Piskulic и соавт., 2009).
В систематическом обзоре 2015 г., посвященном возможностям фармакотерапии коморбидной тревожности у пациентов с шизофренией, буспирон упоминается в качестве более безопасной альтернативы применению бензодиазепинов или прегабалина (сопряженному с риском развития патологического привыкания и пристрастия) или применению антидепрессантов (сопряженному с риском обострения психоза или развития маниакального состояния, нежелательными фармакокинетическими взаимодействиями между рядом антидепрессантов и антипсихотиков, риском выраженных побочных эффектов от антидепрессантов или употребления некоторых антидепрессантов, например трициклических антидепрессантов, с суицидальными целями) [H.Temmingh, D.Stein, 2015].
Синдром дефицита внимания с гиперактивностью или без таковой
Согласно имеющимся на сегодня гипотезам об этиологии и патогенезе синдрома дефицита внимания с гиперактивностью или без, в развитии этого заболевания ключевую роль играет относительный дефицит дофаминергической и норадренергической медиации в префронтальной коре. Это послужило основанием для применения при лечении синдрома дефицита внимания с гиперактивностью таких продофаминергических и пронорадренергических агентов, как антидепрессант бупропион, психостимуляторы (метилфенидат, амфетамин), некоторые антидепрессанты группы трициклических антидепрессантов (имипрамин, дезипрамин, нортриптилин), а также новый препарат для лечения синдрома дефицита внимания с гиперактивностью атомоксетин (S.Stahl, 2013).
Однако применение всех этих препаратов сопряжено с целым рядом проблем. Прежде всего препараты группы трициклических антидепрессантов достаточно плохо переносятся, имеют много побочных эффектов и относятся поэтому к средствам 2-й линии терапии при синдроме дефицита внимания с гиперактивностью. Бупропион потенциально способен вызывать судороги, атомоксетин обладает гепатотоксичностью и очень дорог, а психостимуляторы имеют риск развития психической и физической зависимости и злоупотребления ими, риск передачи или перепродажи. Кроме того, все эти препараты эффективны лишь у части пациентов с синдромом дефицита внимания с гиперактивностью, и их терапевтический эффект при этом заболевании часто бывает неполным (S.Stahl, 2013).
Все сказанное обусловливает необходимость поиска новых терапевтических подходов в лечении синдрома дефицита внимания с гиперактивностью, в частности, новых фармакологических агентов, способных оказать положительный эффект при этом заболевании, а также необходимость в изучении возможностей комбинированной терапии при синдроме дефицита внимания с гиперактивностью.
В свете этого наличие у буспирона способности косвенным механизмом, через парциальный агонизм к 5-HT1A-рецепторам, повышать содержание дофамина и норадреналина в префронтальной коре, не могло не привлечь внимания исследователей, занимающихся лечением синдрома дефицита внимания с гиперактивностью (S.Stahl, 2013).
Интерес к буспирону в лечении синдрома дефицита внимания с гиперактивностью подогревался также тем, что у D-метилфенидата, ранее считавшегося «чистым» психостимулятором, также подобно буспирону были обнаружены слабая парциальная 5-HT1A-агонистическая активность – Ki=3400 nM (J.Markowitz и соавт., 2009) и умеренная агонистическая активность по отношению к s1-рецепторам – Ki=350 nM (C.Zhang и соавт., 2012). Более того, было показано, что эти рецепторные свойства играют важную роль в механизмах реализации терапевтического эффекта метилфенидата (J.Markowitz и соавт., 2009; C.Zhang и соавт., 2012).
Первое пилотное открытое исследование эффективности буспирона в лечении синдрома дефицита внимания с гиперактивностью было проведено в 1998 г. В нем участвовали 12 детей и подростков с синдромом дефицита внимания с гиперактивностью. Буспирон использовался только в монотерапии. При этом были получены обнадеживающие предварительные результаты: буспирон оказался эффективен в уменьшении всех симптомов синдрома дефицита внимания с гиперактивностью, как гиперактивности, импульсивности и раздражительности, так и нарушений концентрации внимания, памяти и когнитивных функций (S.Malhotra, P.Santosh, 1998).
В последующем в двух рандомизированных клинических исследованиях изучалась эффективность буспирона в сопоставлении с метилфенидатом и комбинацией буспирона и метилфенидата в уменьшении симптомов синдрома дефицита внимания с гиперактивностью у детей и подростков. При этом было показано, что буспирон несколько менее эффективен в устранении симптомов синдрома дефицита внимания с гиперактивностью, чем метилфенидат, однако он лучше переносится, вызывает меньше побочных эффектов по сравнению с метилфенидатом, а комбинация буспирона и метилфенидата эффективнее монотерапии любым из них (R.Davari-Ashtiani и соавт., 2010; M.Mohammadi и соавт., 2012).
Важно отметить, что терапевтический эффект буспирона на симптоматику синдрома дефицита внимания с гиперактивностью в этих исследованиях распространялся на все субдомены симптоматики, в частности на уменьшение гиперактивности, импульсивности, раздражительности, агрессивности, нарушений концентрации внимания, когнитивных нарушений и нарушений памяти. Статистически достоверно уменьшались также проявления коморбидных с синдромом дефицита внимания с гиперактивностью депрессии и тревоги, наблюдался числовой тренд к уменьшению выраженности коморбидных тикозных и обсессивно-компульсивных проявлений (R.Davari-Ashtiani и соавт., 2010; M.Mohammadi и соавт., 2012).
В 2012 г. было проведено первое рандомизированное клиническое исследование по применению буспирона при синдроме дефицита внимания с гиперактивностью у взрослых – состоянии, при котором, как известно, эффективность психостимулятора, атомоксетина и других «традиционных» методов лечения синдрома дефицита внимания с гиперактивностью гораздо ниже, чем у детей и подростков. В этом рандомизированном клиническом исследовании было 4 группы: группа, получавшая атомоксетин + плацебо, группа, получавшая буспирон + плацебо, группа, получавшая комбинацию атомоксетина и буспирона, и группа, получавшая только плацебо (S.Sutherland и соавт., 2012).
В упомянутом исследовании участвовал 241 взрослый пациент с синдромом дефицита внимания с гиперактивностью в возрасте от 18 до 45 лет (средний возраст участников 24,5 года), в том числе 124 мужчины и 117 женщин. Исследование проводилось на протяжении 8 нед, изменения выраженности симптоматики синдрома дефицита внимания с гиперактивностью оценивались еженедельно по шкале AISRS – ADHD Adult Investigator Symptom Rating Scale (S.Sutherland и соавт., 2012).
В этом исследовании было показано, что буспирон эффективнее плацебо в уменьшении всех симптомов синдрома дефицита внимания с гиперактивностью у взрослых и сопоставим по эффективности с атомоксетином, незначительно ему уступая. Было также показано, что комбинация буспирона с атомоксетином эффективнее монотерапии любым из них в лечении синдрома дефицита внимания с гиперактивностью взрослых. Важно отметить, что терапевтический эффект буспирона или аугментации буспироном атомоксетина наступал быстро: статистически достоверные отличия от плацебо и монотерапии атомоксетином, соответственно, наблюдались с 1-й недели лечения и сохранялись до конца исследования (S.Sutherland и соавт., 2012).
Синдром Туретта и другие тикозные расстройства
В открытых пилотных исследованиях получены предварительные результаты, показывающие, что буспирон может быть эффективен в уменьшении тиков и вокализаций при синдроме Туретта и других тикозных расстройствах (S.Dursun и соавт., 1995). Также показано, что при расстройствах обсессивно-компульсивного спектра, сочетающихся с тикозными расстройствами или синдромом Туретта, добавление буспирона к серотонинергическим антидепрессантам (селективным ингибиторам обратного захвата серотонина или кломипрамину) позволяет эффективно уменьшить как обсессивно-компульсивные, так и тикозные проявления и вокализации, что авторы статьи связывают с влиянием буспирона на дофаминергические системы мозга (C.McDougle, 1994).
В относительно недавнем (2013 г.) систематическом обзоре возможностей фармакологического лечения синдрома Туретта и других тикозных расстройств указывается, что, хотя средствами 1-й линии терапии этих расстройств, безусловно, являются антипсихотики (типичные и атипичные), а также такие D2-дофаминергические антагонисты, как метоклопрамид, и такие a2-адреностимуляторы, как клонидин (клофелин), – значительная часть больных с синдромом Туретта и другими тикозными расстройствами не отвечают на терапию средствами 1-й линии, получают недостаточный, неполный эффект от них либо плохо переносят их. В этих случаях необходимо применение альтернативных средств терапии или же потенцирование (аугментация) средств 1-й линии. В качестве таких альтернативных или дополнительных средств терапии синдрома Туретта и других тикозных расстройств наряду с такими препаратами, как мемантин, центральные ингибиторы ацетилхолинэстеразы (физостигмин, галантамин, донепезил и др.), тетрабеназин и другие, рассматривается как перспективный и полезный препарат также и буспирон (C.Termine и соавт., 2013).
Расстройства аутистического спектра
Давно известно, что активация 5-HT1A-рецепторов и связанное с ней выделение окситоцина задней долей гипофиза опосредуют просоциальные эффекты «экстази» (метилендиоксиамфетамина) – мощного релизера серотонина (M.Thompson и соавт., 2007).
Между тем известно, что дефицит окситоцина, наблюдаемый при расстройствах аутистического спектра, является одной из причин нарушения социального взаимодействия, развития отгороженности и пониженной эмоциональности, а также агрессивности при них. Известно также, что интраназальное введение экзогенного окситоцина больным с расстройствами аутистического спектра частично исправляет эти нарушения и способствует улучшению их социализации и более яркому проявлению эмоций, а также лучшему распознаванию ими эмоций других людей, например по выражениям их лиц (M.Fukai и соавт., 2017).
Известно, что буспирон за счет своего парциального агонизма к 5-HT1A-рецепторам тоже вызывает усиление выделения окситоцина (P.Chiodera и соавт., 1996; K.Uvnäs-Moberg и соавт., 1996). В экспериментах на животных, как в моделях аутизма на животных, так и у интактных животных, введение буспирона приводит к повышению общительности животных, уменьшению их агрессивности, более частому проявлению дружелюбия и положительного социального взаимодействия (K.Uvnäs-Moberg и соавт., 1996).
Все сказанное дало теоретические основания для того, чтобы попытаться применить буспирон при расстройствах аутистического спектра у человека. Так, в недавнем (2016 г.) рандомизированном клиническом исследовании по применению буспирона для коррекции функционально ограниченного, стереотипного (однообразного) или навязчивого (обсессивно-компульсивного) поведения у маленьких детей с различными формами расстройства аутистического спектра, было показано, что буспирон в малой дозе (2,5 мг 2 раза в сутки) статистически достоверно эффективнее плацебо в отношении коррекции этих форм поведения, в то время как буспирон в относительно большой для данного возраста дозе (5 мг 2 раза в сутки) не показал отличий от плацебо. Дети, получавшие буспирон в дозе 2,5 мг 2 раза в сутки, в среднем проявляли более гибкое и адаптивное, более социально приемлемое, менее функционально ограниченное, менее стереотипное и однообразное поведение, чем дети, получавшие плацебо или 5 мг буспирона 2 раза в сутки. Одновременно у них улучшились социализация и общительность, дружелюбие, способность к эмоциональному реагированию и сопереживанию. Однако результаты в отношении показателей общей шкалы аутизма, а также результаты по развитию речи, когнитивных функций, уменьшению сенсорных нарушений, свойственных расстройствам аутистического спектра, в обеих дозовых группах буспирона не отличались от плацебо (D.Chugani и соавт., 2016).
Авторы данного исследования связали эту необычную дозозависимость с нелинейностью действия буспирона на серотонинергические и дофаминергические системы мозга в различных дозировках и в том числе с нелинейностью его влияния на высвобождение окситоцина (D.Chugani и соавт., 2016).
В другом рандомизированном клиническом исследовании от 2015 г. оценивали влияние буспирона на проявления агрессивности и раздражительности у детей с расстройствами аутистического спектра по сравнению с плацебо и антипсихотиком рисперидоном, а также с комбинацией буспирона и рисперидона. В этом исследовании было показано, что буспирон в отношении коррекции раздражительности и агрессивности при расстройствах аутистического спектра статистически достоверно превосходит плацебо, но уступает рисперидону, а комбинация буспирона и рисперидона эффективнее монотерапии любым из них (A.Ghanizadeh, A.Ayoobzadehshirazi, 2015).
В систематическом обзоре от 2014 г., посвященном возможностям фармакотерапии тревожности и депрессии у больных с расстройствами аутистического спектра, а также возможностям фармакотерапии тревожных расстройств и депрессивных состояний, коморбидных с расстройствами аутистического спектра, указывается, что буспирон, будучи эффективным анксиолитиком и антидепрессантом вообще, эффективен и в уменьшении тревожных и депрессивных проявлений у больных с расстройствами аутистического спектра, и в лечении нередких у них коморбидных тревожных расстройств и депрессий. При этом буспирон в отличие от бензодиазепинов не ассоциируется с нередкими у больных с расстройствами аутистического спектра парадоксальными реакциями поведенческого растормаживания, дезингибирования, с парадоксальным увеличением агрессивности и импульсивности, опьянением или миорелаксацией и не ухудшает память и когнитивные функции больных с расстройствами аутистического спектра (R.Vasa и соавт., 2014).
Кроме того, применение буспирона у больных с расстройствами аутистического спектра позволяет кроме уменьшения тревожности и депрессии также добиться уменьшения раздражительности, агрессивности, импульсивности, улучшить социализацию больных, повысить их эмоциональную реактивность, сделать их поведение более гибким и адаптивным, менее ригидным, уменьшить обсессивно-компульсивные проявления (R.Vasa и соавт., 2014).
В еще одном рандомизированном клиническом исследовании от 2014 г. сравнивали эффективность буспирона и рисперидона и их комбинации в сопоставлении с плацебо в уменьшении аутистических симптомов, раздражительности, агрессивности и антисоциального поведения у детей с фенилкетонурией. При этом было показано, что буспирон и рисперидон оба статистически достоверно эффективнее плацебо в уменьшении агрессивности, импульсивности и раздражительности, гиперактивности, стереотипий у детей с фенилкетонурией и не отличаются по эффективности между собой, а их комбинация эффективнее монотерапии любым из них. Применение буспирона ассоциировалось с меньшим количеством побочных эффектов и лучшей переносимостью, чем применение рисперидона, и, кроме того, приводило к уменьшению не только агрессивности, импульсивности и раздражительности, стереотипий, гиперактивности, но и симптомов аутизации, к улучшению социального взаимодействия детей с фенилкетонурией. Поэтому буспирон может быть предложен как альтернатива рисперидону или дополнение к рисперидону при коррекции поведенческих нарушений аутистического спектра, ассоциированных с фенилкетонурией (A.Fayyazi и соавт., 2014).
Буспирон как корректор поведения при агрессивности и раздражительности
Буспирон обладает также антиагрессивным эффектом, проявляющимся при ажитации, раздражительности и агрессивных действиях на фоне самых различных психических патологий, в частности у больных с деменцией, синдромом дефицита внимания с гиперактивностью, расстройствами аутистического спектра, черепно-мозговой травмой и др. (M.Gross, 1995). Эффективность буспирона в дозах 15–60 мг/сут отмечена как в отношении вербальной (60%), так и физической (90%) агрессии (N.Herrmannm, G.Eryavec, 1991; I. van Vliet и соавт., 1997; S.Lee и соавт., 2005; M.Levy и соавт., 2005).
Описан интересный клинический случай женщины с тяжелым расстройством аутистического спектра, глубокой умственной отсталостью и эпилепсией, проявлявшей крайне агрессивное и разрушительное поведение и находившейся на пожизненном государственном обеспечении в психиатрическом интернате. В связи с декомпенсацией и усилением агрессивности эта больная была госпитализирована в другую психиатрическую больницу. На момент госпитализации она получала высокие дозы сразу трех антипсихотиков: клозапина, арипипразола и рисперидона, что, однако, не позволяло уменьшить ее агрессивность и опасность для персонала. В процессе лечения больная была постепенно переведена на монотерапию рисперидоном, а затем на буспирон, и, когда доза буспирона была доведена до 90 мг/сут, агрессивность и раздражительность у этой больной практически полностью купировались (N.Brahm и соавт, 2008).
Буспирон как корректор когнитивных нарушений разного генеза
Данные о влиянии буспирона на когнитивные функции противоречивы. В некоторых исследованиях показано умеренное позитивное действие буспирона на когнитивные функции, в других – явного эффекта не было отмечено (J.Apter, L.Allen, 1999). В любом случае в отличие от бензодиазепинов и седативных средств буспирон не оказывает негативного влияния на когнитивные функции, что выгодно отличает его от других средств, применяемых для коррекции тревожных расстройств (S.Chamberlain и соавт., 2007).
Коррекция буспироном побочных эффектов психофармакотерапии
Экстрапирамидный синдром (псевдопаркинсонизм). Теоретической основой для применения буспирона в коррекции экстрапирамидного синдрома послужила его продофаминергическая активность, а также то, что суммарный рецепторный профиль сочетания антипсихотика и буспирона приближается к рецепторным профилям современных атипичных антипсихотиков. И действительно, в ряде открытых исследований показано, что буспирон может быть эффективен в уменьшении проявлений экстрапирамидного синдрома (лекарственного паркинсонизма), вызываемых применением антипсихотиков, в том числе у больных, получавших антипсихотики много лет и имеющих поздние дискинезии (C.Ross, 1987; L.Moss и соавт., 1993). Также попутное уменьшение проявлений экстрапирамидного синдрома и акатизии отмечалось в рандомизированном клиническом исследовании, в котором изучалась эффективность добавления к антипсихотику буспирона в уменьшении негативной и когнитивной симптоматики шизофрении (F.Sheikhmoonesi и соавт., 2015).
Акатизия. По данным открытых исследований и в опубликованных сериях случаев, буспирон может быть эффективен в коррекции акатизии, вызванной применением антипсихотиков или антидепрессантов (D.D'Mello и соавт., 1989; M.Sabaawi и соавт., 1994; M.Poyurovsky, A.Weizman, 1997). Уменьшение проявлений акатизии наряду с уменьшением экстрапирамидного синдрома и улучшением по линии негативной и когнитивной симптоматики при добавлении буспирона к антипсихотикам впоследствии подтверждено в рандомизированном клиническом исследовании (F.Sheikhmoonesi и соавт., 2015).
В нескольких вышедших в разное время систематических обзорах, посвященных возможностям фармакологической коррекции акатизии, указывается, что серотонинергические агенты, такие как парциальный 5-HT1A-агонист буспирон, 5-HT2A-антагонисты ципрогептадин, тразодон, миансерин, миртазапин, приближают суммарный рецепторный профиль при их сочетании с антипсихотиками к наиболее атипичным из них и могут быть эффективны в случаях акатизии, резистентной к стандартной терапии: холинолитическим корректорам, b-адреноблокаторам, бензодиазепинам (G.Blaisdell, 1994; J.Lohr и соавт., 2015).
В то же время описаны случаи, когда буспирон сам вызывал акатизию или усугублял ее (J.Patterson, 1988). В свете этого его применение для коррекции акатизии должно тщательно отслеживаться на предмет эффективности (J.Lohr и соавт., 2015).
Поздние дискинезии. Еще в самом начале клинического применения буспирона в психиатрии было эмпирически отмечено, что иногда его использование приводит к уменьшению или исчезновению поздних дискинезий у пациентов, подвергавшихся длительному лечению антипсихотиками (C.Ross, 1987). Впоследствии это наблюдение неоднократно подтверждалось в ряде открытых исследований. Так, в одном таком 12-недельном исследовании 1993 г., в котором участвовали 8 пациентов с тяжелыми формами поздней дискинезии, буспирон, применяемый в высоких дозах (до 180 мг/сут), оказался эффективен в подавлении или уменьшении выраженности поздних дискинезий у всех 8 (100%) пациентов. Среднее уменьшение выраженности поздних дискинезий по шкале аномальных движений составило 4,4 балла. Параллельно отмечалось уменьшение выраженности экстрапирамидного синдрома и акатизии (L.Moss и соавт., 1993). Авторы данного исследования призвали к изучению эффективности буспирона при поздних дискинезиях в формате масштабных хорошо контролируемых рандомизированных клинических исследований.
Вместе с тем те же авторы предостерегают от трактовки этих результатов как чрезмерно обнадеживающих. В частности, они отмечают, что буспирон сам является слабым D2-антагонистом и в применявшихся ими довольно высоких дозах может терять селективность к пресинаптическим D2-рецепторам. Поэтому авторы не могут исключить, что эффективность буспирона в подавлении поздних дискинезий имеет сходство с эффектом временного подавления поздних дискинезий при увеличении дозы антипсихотика. Если это так, то со временем состояние такого больного может стать еще хуже, а поздняя дискинезия еще более выраженной. Поэтому они призвали к изучению эффективности и безопасности буспирона в лечении поздних дискинезий также в лонгитудинальном, на протяжении нескольких лет, разрезе (L.Moss и соавт., 1993).
В свежем (2017 г.) систематическом обзоре возможностей лечения поздних дискинезий указывается, что общепринятых, стандартных методов лечения поздних дискинезий, прошедших проверку доказательной медициной на уровне рандомизированных клинических исследований, на данный момент не существует. Буспирон наряду с такими фармакологическими агентами, как витамин E, мелатонин, баклофен, местные инъекции ботулинического токсина в затронутые поздней дискинезией мышцы и другие, рассматривается авторами обзора как одна из приемлемых альтернатив, имеющих доказательную базу хотя бы на уровне открытых исследований. Авторы призвали к организации рандомизированных клинических исследований по лечению поздних дискинезий (H.Bergman и соавт., 2017).
Ночной бруксизм. Многие психофармакологические препараты, в частности антидепрессанты класса селективных ингибиторов обратного захвата серотонина и селективных ингибиторов обратного захвата серотонина и норадреналина, а также антипсихотики, психостимуляторы (амфетамин, метилфенидат) и атомоксетин, способны вызывать ночной бруксизм (спазм мышц нижней челюсти, вызывающий скрежетание зубов). Этот побочный эффект далеко не безобиден. Он может приводить к повреждению или преждевременному истиранию зубов, возникновению хронических головных болей напряжения, заболеваний десен, развитию дисфункции височно-нижнечелюстного сустава. Известны даже случаи самоубийства больных из-за невыносимых болей в височно-нижнечелюстном углу, вызванных наличием бруксизма (R.Çolak Sivri, Ö.Akça, 2016).
Природа этого явления остается загадочной. Одни авторы связывают этот побочный эффект с непрямой антидофаминергической активностью селективных ингибиторов обратного захвата серотонина и селективных ингибиторов обратного захвата серотонина и норадреналина или прямым антидофаминергическим действием антипсихотиков, снижением дофаминергической активности в нигростриарной системе под влиянием повышенного уровня серотонина или в результате блокады D2-рецепторов и рассматривают его как одно из проявлений экстрапирамидного синдрома или как некий аналог акатизии (R.Çolak Sivri, Ö.Akça, 2016). Другие же авторы придают большее значение способности упомянутых психотропных препаратов нарушать фазовую структуру сна, в частности изменять соотношение REM-фазы и фазы глубокого сна без движений глаз, и рассматривают ночной бруксизм как вариант диссомнического расстройства (A.Milanlıoglu, 2012).
Общепринятых и стандартных методов коррекции этого побочного эффекта, прошедших проверку доказательной медициной на уровне рандомизированных клинических исследований, пока не существует (R.Çolak Sivri, Ö.Akça, 2016). Поэтому разные специалисты эмпирически с определенным успехом пытаются применять для коррекции ночного бруксизма, вызываемого применением психофармакотерапии, различные препараты, в частности бензодиазепины, b-адреноблокаторы, баклофен, прегабалин или габапентин, антихолинергические и дофаминергические препараты и др. (M.Yüce и соавт., 2013). Внимание специалистов, сталкивающихся с этим побочным эффектом, в качестве перспективного корректора привлек также буспирон, обладающий одновременно как продофаминергическими свойствами и способностью уменьшать экстрапирамидный синдром и акатизию, так и нормализующим влиянием на фазовую структуру сна, способностью уменьшать количество и длительность REM-фаз в течение ночи (A.Milanlıoglu, 2012; R.Çolak Sivri, Ö.Akça, 2016).
В литературе описаны серии случаев, показывающие, что буспирон может быть эффективен в коррекции ночного бруксизма, вызываемого приемом самых разных селективных ингибиторов обратного захвата серотонина и селективных ингибиторов обратного захвата серотонина и норадреналина, в частности флуоксетина (R.Çolak Sivri, Ö.Akça, 2016), пароксетина (A.Milanlıoglu, 2012), сертралина (J.Bostwick, M.Jaffee, 1999), циталопрама (M.Wise, 2001), дулоксетина (O.Şahin, F.Malas, 2015), венлафаксина (M.Kuloglu и соавт., 2010).
Буспирон также эффективен в коррекции ночного бруксизма, вызываемого приемом атомоксетина или психостимуляторов (M.Yüce и соавт., 2013).
В одном из последних систематических обзоров, посвященных правильному выбору антидепрессанта при депрессиях и тревожных расстройствах при уже имеющемся у пациента коморбидном ночном бруксизме или темпоро-мандибулярном синдроме, указывается, что селективные ингибиторы обратного захвата серотонина и селективные ингибиторы обратного захвата серотонина и норадреналина не являются оптимальным выбором в этой клинической ситуации и что у таких больных предпочтительно применять альтернативные антидепрессанты из классов трициклических антидепрессантов, обратимых ингибиторов моноаминоксидазы или атипичных антидепрессантов, применение которых не ассоциируется с усилением или появлением бруксизма. Эти же авторы указывают, что если все же возникает клиническая необходимость применения у такого пациента именно селективных ингибиторов обратного захвата серотонина или селективных ингибиторов обратного захвата серотонина и норадреналина (например, вследствие отсутствия эффекта или непереносимости альтернативных антидепрессантов), то разумной стратегией является добавление к селективным ингибиторам обратного захвата серотонина или селективным ингибиторам обратного захвата серотонина и норадреналина буспирона с самого начала, с тем чтобы предотвратить возможное усугубление бруксизма или болей в височно-нижнечелюстном углу (R.Rajan, Y.Sun, 2017).
Сексуальные расстройства. Еще в самом начале клинического применения буспирона при тревожных расстройствах, уже в 1987 г. (всего через 1 год после его регистрации FDA для генерализованного тревожного расстройства), западные специалисты обратили внимание на то, что сам по себе буспирон в отличие от многих антидепрессантов (в частности, от препаратов класса селективных ингибиторов обратного захвата серотонина) не только не дает сексуальных побочных эффектов, но и нередко приводит к повышению либидо и улучшению сексуального функционирования больных (E.Othmer, S.Othmer, 1987).
Уже в 1999 г. в одном из первых рандомизированных клинических исследований, посвященных изучению эффективности буспирона в качестве корректора сексуальных побочных эффектов от селективных ингибиторов обратного захвата серотонина и селективных ингибиторов обратного захвата серотонина и норадреналина, было показано, что буспирон статистически достоверно эффективнее плацебо в этом качестве. Его положительное воздействие распространяется на все параметры сексуального функционирования, в частности на уровень либидо, качество и яркость оргазма, силу эрекции у мужчин, качество любрикации у женщин, возможность достижения оргазма. Предполагается, что механизм этого просексуального действия буспирона связан с его продофаминергическим действием и регулирующим воздействием на серотонинергическую нейропередачу, уменьшением ее при вызванной селективными ингибиторами обратного захвата серотонина гиперактивности (M.Landen и соавт., 1999).
Последующие исследования это неоднократно подтверждали. В нескольких последних систематических обзорах, посвященных способам коррекции сексуальных побочных эффектов при применении селективных ингибиторов обратного захвата серотонина и селективных ингибиторов обратного захвата серотонина и норадреналина, буспирону наряду с такими препаратами, как тразодон (Триттико), миртазапин (Ремерон), ципрогептадин (Перитол), йохимбин, дофаминергические препараты, отводится одно из первых мест как в отношении эффективности коррекции сексуальных побочных эффектов, так и в отношении переносимости и количества собственных побочных эффектов корректора (A.Clayton и соавт., 2014; R.Howland, 2015).
Важно отметить также, что комбинированное применение буспирона с 5-HT2A/С-антагонистами, такими как упомянутые тразодон или миртазапин, или с дофаминергическими препаратами, такими как бупропион или прамипексол, повышает эффективность коррекции сексуальных побочных эффектов от селективных ингибиторов обратного захвата серотонина или селективных ингибиторов обратного захвата серотонина и норадреналина и позволяет устранить их у пациентов, резистентных к монокоррекции (A.Clayton и соавт., 2014; R.Howland, 2015).
Тошнота, рвота, анорексия. Серотониновые 5-HT1A-рецепторы в триггерной зоне и рвотном центре мозга колокализованы рядом с 5-HT3-рецепторами и рецепторами к нейрокинину-1 (NK1-рецепторами) на поверхности одних и тех же клеток. При этом стимуляция 5-HT1A-рецепторов приводит к реципрокному угнетению активности 5-HT3- и NK1-рецепторов (P.Kranke и соавт., 2012).
В связи с этим 5-HT1A-агонисты, в частности буспирон, обладают противорвотной активностью, реализующейся в таких разных клинических ситуациях, как послеоперационная тошнота и рвота (P.Kranke и соавт., 2012), тошнота и рвота при химиотерапии и радиотерапии опухолей и др.
(A.Alfieri, L.Cubeddu, 1995). Между тем применение антидепрессантов, в частности таких как селективные ингибиторы обратного захвата серотонина и селективные ингибиторы обратного захвата серотонина и норадреналина, нередко приводит к развитию в начале терапии тошноты, рвоты, снижения аппетита вплоть до анорексии вследствие чрезмерной стимуляции гиперчувствительных при депрессивных и тревожных состояниях 5-HT3-рецепторов. По мере их десенситизации при продолжении терапии тошнота, рвота и снижение аппетита постепенно проходят (S.Stahl, 2013).
В свете сказанного буспирон наряду с другими возможными корректорами тошноты, рвоты и анорексии, такими как оланзапин или метоклопрамид, может использоваться в том числе для профилактики тошноты, рвоты и анорексии в начале терапии селективными ингибиторами обратного захвата серотонина или селективными ингибиторами обратного захвата серотонина и норадреналина (S.Stahl, 2013).
Головная боль. Данный побочный эффект является нередким (>10%) в начале терапии селективными ингибиторами обратного захвата серотонина или селективными ингибиторами обратного захвата серотонина и норадреналина, достаточно специфичным именно для этой группы антидепрессантов и достаточно редко отмечающимся при применении трициклических антидепрессантов. Предполагаемым патофизиологическим механизмом развития головной боли в начале терапии селективными ингибиторами обратного захвата серотонина или селективными ингибиторами обратного захвата серотонина и норадреналина является то, что нисходящие серотонинергические проводящие пути, в зависимости от их типа, обладают двояким воздействием на уровень восприятия болевого сигнала – антиноцицептивным или, наоборот, усиливающим восприятие боли. Поэтому селективные ингибиторы обратного захвата серотонина или селективные ингибиторы обратного захвата серотонина и норадреналина, усиливая активность как тех, так и других проводящих путей, в начале терапии могут усиливать восприятие боли. В сочетании с вызываемым ими повышением мышечного тонуса (в том числе тонуса мышц шеи, волосистой части головы, мимических мышц лица) это может способствовать возникновению или учащению головных болей напряжения. Для реализации же анальгетического эффекта необходима одновременная и сбалансированная стимуляция серотонинергических и норадренергических проводящих путей (S.Stahl, 2013).
В то же время буспирон как препарат, обладающий способностью уменьшать избыточную серотонинергическую активность в центральную нервную систему, косвенно усиливать норадренергическую и дофаминергическую нейропередачу, а также увеличивать секрецию b-эндорфина, эффективен в профилактике головных болей напряжения, как спонтанных, так и вызванных началом применения селективных ингибиторов обратного захвата серотонина или селективных ингибиторов обратного захвата серотонина и норадреналина, пероральных контрацептивов и других известных провокаторов головных болей напряжения (D.Mitsikostas и соавт., 1997).
Вялость, утомляемость, анергия и другие проявления апатии, вызванной селективными ингибиторами обратного захвата серотонина. Известно, что селективные ингибиторы обратного захвата серотонина при длительном приеме нередко вызывают апатию (SSRI apathy syndrome), проявляющуюся такими симптомами, как вялость, утомляемость, апатия, сонливость, снижение энергии, мотивации, повседневной активности при нередко формально «неплохом» настроении и отсутствии видимых признаков депрессии (что отличает данный синдром от недолеченной резидуальной депрессии). Этот побочный эффект данного класса препаратов так же, как и их сексуальные побочные эффекты, связывают с ограниченностью их нейрохимического эффекта – с их влиянием только на серотонинергическую нейропередачу и реципрокным подавлением под влиянием избытка серотонина норадренергической и дофаминергической нейропередачи (S.Stahl, 2013).
В полном соответствии с этой теорией для купирования данного побочного эффекта, а также для усиления антидепрессивного эффекта селективных ингибиторов обратного захвата серотонина и расширения спектра их нейрохимического действия с определенным успехом добавляют к селективным ингибиторам обратного захвата серотонина различные норадренергические (например, ребоксетин, миртазапин или малые дозы трициклических антидепрессантов) или дофаминергические (например, бупропион, психостимуляторы) препараты (S.Stahl, 2013).
Буспирон как препарат, обладающий способностью косвенным механизмом повышать норадренергическую и дофаминергическую нейропередачу в центральную нервную систему и оказывать регулирующее влияние на серотонинергическую, уменьшая ее при вызванной селективными ингибиторами обратного захвата серотонина гиперактивности, тоже предложен для уменьшения или устранения апатии, вызванной селективными ингибиторами обратного захвата серотонина, вялости, утомляемости и сонливости на фоне приема селективных ингибиторов обратного захвата серотонина или селективных ингибиторов обратного захвата серотонина и норадреналина (T.Green, 1997; S.Stahl, 2013) и для повышения эффективности терапии селективными ингибиторами обратного захвата серотонина и селективными ингибиторами обратного захвата серотонина и норадреналина и расширения спектра их действия (Y.Fang и соавт., 2011; P.Bech и соавт., 2012). Опять-таки применение буспирона в сочетании с другим корректором позволяет преодолеть апатию, вызванную селективными ингибиторами обратного захвата серотонина, в случаях, резистентных к монокоррекции (S.Stahl, 2013).
Завершая обзор имеющейся доказательной базы по применению буспирона при различных психических расстройствах, а также в качестве корректора побочных эффектов от психофармакотерапии, для удобства читателя мы приводим сводные табл. 1, 2 с уровнями доказательности для применения буспирона в разных клинических ситуациях.
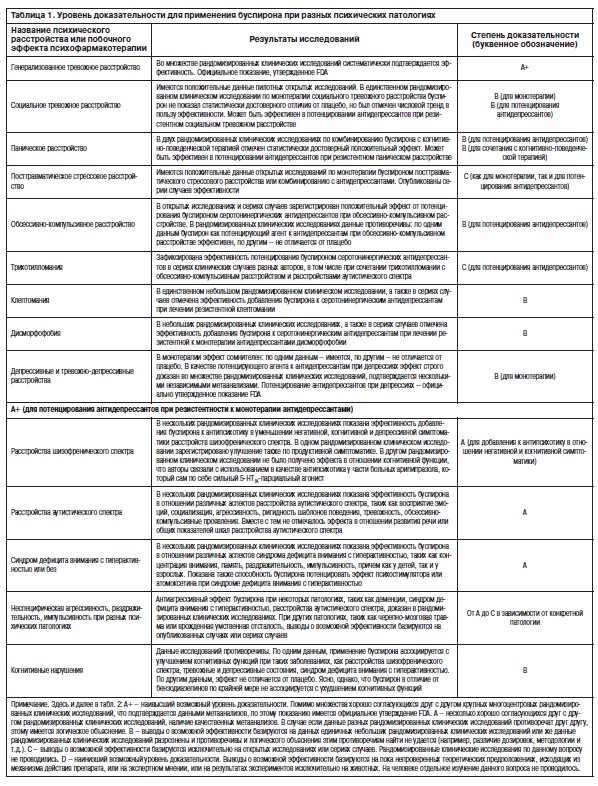
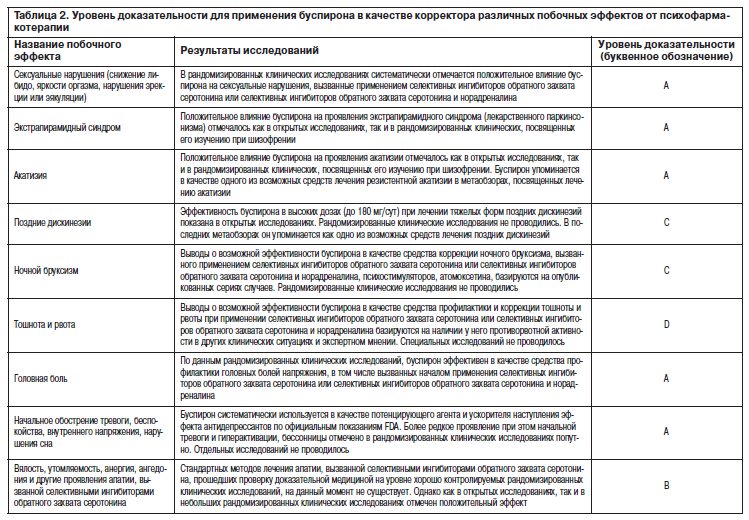
Кроме того, убедительная доказательная база имеется также для применения буспирона в качестве потенцирующего агента к антидепрессантам при депрессивных и тревожно-депрессивных расстройствах.
Буспирон может быть эффективен и в качестве потенцирующего агента к антидепрессантам при обсессивно-компульсивном расстройстве и ряде других расстройств обсессивно-компульсивного спектра, в частности при трихотилломании, дисморфофобии, клептомании.
Имеющиеся данные указывают также на возможную эффективность буспирона в уменьшении негативной, когнитивной, тревожной и депрессивной симптоматики в рамках шизофрении и других расстройств шизофренического спектра, в коррекции таких побочных эффектов от психофармакотерапии, как сексуальные расстройства, экстрапирамидный синдром, акатизия, бруксизм, тошнота и рвота, головные боли, апатия, вызванная селективными ингибиторами обратного захвата серотонина в лечении синдрома дефицита внимания с гиперактивностью, уменьшении ряда проявлений расстройств аутистического спектра, неспецифическом купировании проявлений агрессивности, раздражительности и импульсивности на фоне разных психических расстройств.
Беккер Роман Александрович – исследователь в области психофармакотерапии, Университет им. Давида Бен-Гуриона в Негеве
Методология проведения работы. Авторами данной статьи был проведен поиск литературы об истории создания, фармакокинетике, фармакодинамике, механизмах действия, побочных эффектах, показаниях и противопоказаниях, а также клиническом применении препарата буспирон (Спитомин) при разных психических патологиях и в качестве корректора побочных эффектов психофармакотерапии с использованием соответствующих ключевых слов в международных поисковых системах PubMed, Google Scholar, Elsevier Science, Web of Science, Science Direct и российской поисковой системе РИНЦ E-library. Найденные источники обработаны и представлены нами в данной статье.
Результаты. Найденные нами литературные данные свидетельствуют о большом терапевтическом потенциале и эффективности буспирона (Спитомина) в лечении различных психических патологий и коррекции побочных эффектов психофармакотерапии, а также о его хорошей переносимости, безопасности применения и низком уровне побочных эффектов. Наиболее убедительна на данный момент доказательная база для применения буспирона в лечении генерализованного тревожного расстройства, а также в потенцировании действия антидепрессантов при депрессивных расстройствах. Однако имеющиеся предварительные данные указывают на то, что буспирон также может быть эффективен при других тревожных расстройствах, расстройствах аутистического спектра, синдроме дефицита внимания, гипосексуальности, негативной симптоматике шизофрении, а также в коррекции ряда побочных эффектов психотропной терапии.
Область применения результатов. Полученные нами результаты заслуживают широкого применения в психиатрии.
Ключевые слова: буспирон, азапироны, тревожные расстройства, депрессивные расстройства, генерализованное тревожное расстройство, социальное тревожное расстройство, паническое расстройство, посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство, шизофрения, аутизм, синдром дефицита внимания, побочные эффекты психотропных средств, агрессивность.
Для цитирования: Быков Ю.В., Беккер Р.А. Буспирон в практике врача-психиатра: только ли анксиолитик? Психиатрия и психофармакотерапия. 2017; 19 (5): 32–52.
Buspirone in psychiatric practice: is it only an anxiolytic?
Yu.V.Bykov1, R.A.Bekker2
1Stavropol State Medical University of the Ministry of Health of the Russian Federation. 355017, Russian Federation, Stavropol, ul. Mira, d. 310;
2David Ben-Gurion University in Negev. 8410501, Israel, Be’er Sheba.
yubykov@gmail.com
Purpose. The purpose of this review was to provide the reader with detailed information about the history of the development, pharmacokinetics, pharmacodynamics and mechanisms of action, dosage regimens, side effects, indications and contraindications, and existing evidence base for the clinical use of the nonbenzodiazepine anxiolytic buspirone. We describe its use not just in the officially approved fashion as an anxiolytic for generalized anxiety disorder and as an augmenting agent to antidepressant for depressive disorders, but also in non-traditional areas like diminishing negative and cognitive symptoms of schizophrenia, treat OCD spectrum disorders and anxiety disorders other than generalized anxiety disorder, improve different aspects of autism spectrum disorders, and also in attention deficit hyperactivity disorder, female hyposexual desire disorder (frigidity), for non-specific correction of aggressiveness and irritability in different mental diseases, and as a corrective agent for several side effects of psychotropic drugs.
Methodology. The authors have searched for the literature on the history of discovery, pharmacokinetics, pharmacodynamics, mechanisms of action, side effects, indications and contraindications, as well as on the clinical use of buspirone in various mental disorders, using relevant keywords in international search engines PubMed, Google Scholar, Elsevier Science, Web of Science, Science Direct, and in the Russian search engine E-library. The sources found were processed and presented by us in this article.
Results. The literature data we have found indicate that buspirone has great therapeutic potential and effectiveness in the treatment of various mental diseases. The literature presented also documents its good tolerability, safety of use, and low side effect burden. The most convincing at this time is the evidence base for the use of buspirone in the treatment of generalized anxiety disorder, as well as an augmenting agent for antidepressants in depressive disorders. However, available data indicate that buspirone can also be effective in other anxiety disorders, autism spectrum disorders, attention deficit hyperactivity disorder, female hyposexual desire disorder, in diminishing negative and cognitive symptoms of schizophrenia, and as a corrective agent for a number of side effects of psychotropic drugs.
Practical implications. The results obtained by us deserve wide application in psychiatry.
Key words: buspirone, azapirones, anxiety disorders, depressive disorders, generalized anxiety disorder, social anxiety disorder, panic disorder, posttraumatic stress disorder, obsessive-compulsive disorder, schizophrenia, autism, attention deficit hyperactivity disorder, aggressiveness.
For citation: Bykov Yu.V., Bekker R.A. Buspirone in psychiatric practice: is it only an anxiolytic? Psychiatry and Psychopharmacotherapy. 2017; 19 (5): 32–52.
Буспирон: общая характеристика
Буспирон – это анксиолитик, который ни по химическому строению, ни по механизмам действия не имеет отношения ни к одному из других известных классов анксиолитиков – ни к барбитуратам, ни к бензодиазепинам, ни к карбаматам (мепротан и др.), ни к производным дифенилметана (гидроксизин – атаракс, амизил, метамизил и др.). По химическому строению он относится к производным азапирона (О.С.Левин, 2015). А по механизмам действия буспирон является представителем особого нового класса серотонинергических анксиолитиков (А.Т.Дзампаев и соавт, 2014; И.В.Дамулин, И.А.Суворова, 2015).В химический класс азапиронов входит целый ряд фармакологических агентов. Некоторые из них доступны на мировых рынках (кроме буспирона это также тандоспирон, гепирон, пероспирон), а некоторые так и остались сугубо исследовательскими препаратами либо их разработка была прекращена (например, ипсапирон, ревоспирон и др.). Общим свойством всех азапиронов является их высокое сродство к серотониновым 5-НТ1А-рецепторам, которые располагаются на теле и в окончаниях серотонинергических нейронов, а также дендритах постсинаптических нейронов (О.С.Левин, 2015). Различные азапироны применяются в клинической практике либо как анксиолитики и антидепрессанты, как буспирон и тандоспирон, гепирон, либо как атипичные антипсихотики, как пероспирон (S.Onrust, K.McClellan, 2001). В Российской Федерации буспирон производится и поставляется фирмой EGIS под торговым названием Спитомин (О.С.Левин, 2015).
Буспирон является высокоэффективным анксиолитиком при лечении наиболее сложных и резистентных форм различных тревожных расстройств, в первую очередь генерализованного тревожного расстройства. Он стал первым небензодиазепиновым анксиолитиком, который был одобрен Управлением по контролю пищевых продуктов и лекарств в США (Food and Drug Administration – FDA) в 1986 г. для лечения пациентов с этой патологией (C.Loane, M.Politis, 2012). Буспирон занимает особое место среди психотропных препаратов в связи с тем, что является не только анксиолитиком, но и антидепрессантом (А.Т.Дзампаев и соавт., 2014). В настоящее время буспирон в РФ разрешен к применению также в качестве потенцирующего агента в дополнение к антидепрессантам при терапии большого депрессивного расстройства (Инструкция по медицинскому применению препарата Спитомин, 2014).
Исторические сведения
Буспирон был впервые синтезирован командой химика-фармаколога Меада Джонсона (Mead Johnson) для компании Bristol-Myers Squibb в 1968 г. (R.Howland, 2015). Изначально он разрабатывался компанией как потенциальный новый антипсихотик, так же, как и другие антипсихотики, воздействующий на D2-дофаминовые рецепторы, но с более низким, чем у других известных в то время типичных антипсихотиков, потенциалом вызывания экстрапирамидного синдрома. Интересно отметить, что такая задача ставилась компанией задолго до появления современной концепции атипичных антипсихотиков как препаратов, вызывающих мало экстрапирамидных синдромов (L.Allen и соавт., 1972; C.Loane, M.Politis, 2012; R.Howland, 2015).Однако буспирон оказался неэффективным в экспериментальных моделях психозов на животных. Из-за этого компания на некоторое время «положила препарат на полку», и долгое время не патентовала структуру его молекулы, считая его бесперспективным для дальнейшей разработки и рассматривая его только в качестве очередного отвергнутого потенциального антипсихотика (C.Loane, M.Politis, 2012; R.Howland, 2015). Лишь гораздо позже, в 1975 г., благодаря настойчивости Меада Джонсона, предложившего исследовать буспирон на наличие у него других видов фармакологической активности и сумевшего доказать, что буспирон эффективен в экспериментальных моделях тревоги и депрессии на животных, буспирон был переопределен компанией как потенциальный новый анксиолитик и антидепрессант, а его молекула – запатентована ею (L.Allen и соавт., 1972; US Patent, 1975; C.Loane, M.Politis, 2012; R.Howland, 2015).
В 1986 г., после завершения серии двойных слепых рандомизированных клинических исследований III фазы, доказавших эффективность буспирона для лечения генерализованного тревожного расстройства, буспирон получил разрешение FDA для лечения генерализованного тревожного расстройства у взрослых и стал продаваться в США под торговым названием Buspar (C.Loane, M.Politis, 2012; R.Howland, 2015).
Как мы покажем ниже в разделе о применении буспирона при расстройствах шизофренического спектра, история создания данного препарата и его изначально планировавшееся позиционирование на рынке в качестве антипсихотика – это не просто любопытный исторический факт, а момент, имеющий самое прямое отношение к спектру его фармакологической активности. Дело в том, что буспирон оказывает модулирующее воздействие на активность дофаминергических систем мозга. И, хотя он оказался неэффективен и в экспериментальных моделях психозов на животных, и в устранении продуктивной психотической симптоматики у человека, у него позднее была обнаружена эффективность в уменьшении негативной, когнитивной и депрессивной симптоматики при расстройствах шизофренического спектра (D.Piskulic и соавт., 2009; A.Ghaleiha и соавт., 2010; М.Ю.Дробижев и соавт., 2014; F.Sheikhmoonesi и соавт., 2015).
Патентная монополия компании Bristol-Myers Squibb на буспирон истекла в 2001 г. В настоящее время этот препарат доступен также в качестве генерика. На российском рынке, как мы уже упоминали, буспирон представлен единственным производителем – компанией EGIS, под торговым названием Спитомин (О.С.Левин, 2015).
Фармакокинетика
После перорального приема буспирона в дозе 20 мг препарат быстро абсорбируется из желудочно-кишечного тракта. Средняя пиковая концентрация в плазме после приема 20 мг внутрь составляет приблизительно 2,5 мкг/л, а время достижения пика колеблется от 0,9 до 1,5 ч, в среднем чуть менее 1 ч (C.Loane, M.Politis, 2012). Буспирон обладает низкой абсолютной биодоступностью, поскольку подвергается интенсивному печеночному метаболизму при первом прохождении через печень. Биодоступность буспирона при пероральном приеме составляет около 3,9–4% от введенной дозы (C.Loane, M.Politis, 2012). В плазме крови буспирон находится в основном в связанном с белками состоянии (86%), причем основными связывающими белками для него являются альбумин и a1-кислый гликопротеин (M.Jann, 1988; Buspirone monograph, 1996). Ацетилсалициловая кислота увеличивает концентрацию свободной, не связанной с белками фракции буспирона на 23%, в то время как флуразепам снижает ее на 20% (Buspirone monograph, 1996). Буспирон не вытесняет из связи с белками плазмы крови такие сильно связывающиеся с ними препараты, как фенитоин, варфарин, пропранолол, однако способен вытеснять из связи с белками плазмы дигоксин, что может привести к повышению уровня его свободной фракции в крови и проявлениям гликозидной интоксикации (Buspirone monograph, 1996).Буспирон имеет объем распределения 5,3 л/кг, системный клиренс около 1,7 л/ч на 1 кг (I.Mahmood, C.Sahaiwalla, 1999). Средний период полувыведения буспирона после однократного введения колеблется от 2 до 3 ч, в среднем 2,5 ч (M.Jann, 1988; C.Loane, M.Politis, 2012). Однако при многократных повторных введениях период полувыведения буспирона удлиняется, и его конечный (терминальный) период полувыведения при постоянном приеме, по данным 14 разных исследователей, колеблется от 2 до 11 ч (R.Gammans, 1986). В одном из исследований даже получено значение терминального периода полувыведения буспирона в 33 ч (R.Gammans, 1986).
Буспирон интенсивно метаболизируется в печени, в основном при участии изофермента цитохрома CYP450 3A4, при этом образуются в основном различные гидроксилированные метаболиты (I.Mahmood, C.Sahaiwalla, 1999; M.Zhu и соавт., 2005). Основными метаболитами буспирона являются 5-гидрокси-буспирон, 6-гидрокси-буспирон, 8-гидрокси-буспирон и 1-(2-пиримидинил)-пиперазин (R.Gammans, 1986; H.Wong и соавт., 2007; A.Schatzberg, C.Nemeroff, 2009).
У человека одним из основных метаболитов буспирона является 6-гидрокси-буспирон, уровень которого в плазме в 40 раз превышает уровень самого буспирона. Важно отметить, что этот метаболит (6-гидрокси-буспирон) является высокоаффинным парциальным агонистом 5-HT1A-рецепторов с Ki=25 nM, что сопоставимо с аффинитетом к 5-HT1A-рецепторам у самого буспирона: Ki=20 nM. Показано, что
6-гидрокси-буспирон занимает большую долю 5-HT1A-рецепторов, чем сам буспирон, при введении буспирона в организм и, по всей видимости, играет важную, если не основную, роль в реализации терапевтического эффекта буспирона (H.Wong и соавт., 2007; A.Schatzberg, C.Nemeroff, 2009).
Другой метаболит буспирона, 1-(2-пиримидинил)-пиперазин, также фармакологически активен (в частности, он является антагонистом пресинаптических a2-адренорецепторов с KD=40 nM). Он также обнаруживается в крови в более высоких концентрациях, чем сам буспирон. Предполагается, что фармакологическая активность 1-(2-пиримидинил)-пиперазина тоже вносит значительный вклад в реализацию антидепрессивного и анксиолитического эффектов буспирона (G.Tunnicliff, 1991; M.Fava, 2007). Кроме того, 1-(2-пиримидинил)-пиперазин также обладает более длительным периодом полувыведения, чем сам буспирон. Средний период полувыведения 1-(2-пиримидинил)-пиперазина составляет 6,1 ч, что в 2–3 раза больше периода полувыведения родительского соединения (буспирона), составляющего 2–3 ч, в среднем 2,5 ч (M.Jann, 1988).
Относительно короткий период полувыведения буспирона обусловливает необходимость приема препарата 2–3 раза в сутки. В диапазоне разовых доз от 10 до 40 мг фармакокинетика буспирона подчиняется линейному закону (I.Mahmood, C.Sahaiwalla, 1999).
Буспирон выводится в основном с мочой в виде метаболитов (от 29 до 63% введенной дозы выводится с ней в первые 24 ч). С калом выводится за тот же срок от 18 до 38% введенной дозы (Buspirone monograph, 1996).
У пациентов с печеночной недостаточностью период полувыведения буспирона удлиняется в 2 раза и более по сравнению со здоровыми людьми, а площадь под кривой «концентрация–время» буспирона увеличивается в 13 раз. При почечной недостаточности (клиренс креатинина от 10 до 70 мл/мин при площади поверхности тела 1,73 м2) кривая «концентрация–время» буспирона повышается в 4 раза по сравнению со здоровыми людьми – клиренс креатинина более 80 мл/мин (I.Mahmood, C.Sahaiwalla, 1999; M.Zhu и соавт., 2005; Buspirone monograph, 1996).
Фармакокинетика буспирона не зависит от расы, возраста или пола (Buspirone monograph, 1996).
Межлекарственные взаимодействия
Одновременное введение буспирона с такими сильными ингибиторами цитохрома CYP450 3A4, как верапамил, дилтиазем, эритромицин, итраконазол, приводит к существенному повышению концентрации буспирона в плазме. Менее сильные ингибиторы CYP450 3A4, такие как циметидин, алпразолам, оказывают меньшее влияние на концентрацию буспирона в плазме крови (I.Mahmood, C.Sahaiwalla, 1999; M.Zhu и соавт., 2005).В связи с тем, что ингибиторы изофермента цитохрома CYP450 3A4, такие как дилтиазем, верапамил, итраконазол, кетоконазол, эритромицин, ингибиторы ВИЧ-протеаз, способны значительно замедлять выведение буспирона из организма, снижать его клиренс и резко повышать его концентрацию в плазме крови, при таких сочетаниях возрастает риск проявления побочных эффектов буспирона. В то же время ингибиторы CYP450 3A4 замедляют образование активных метаболитов буспирона – 6-гидрокси-буспирона и 1-(2-пиримидинил)-пиперазина и снижают их уровень в крови (I.Mahmood, C.Sahaiwalla, 1999; M.Zhu и соавт., 2005; О.С.Левин, 2015). Это может снизить терапевтическую эффективность буспирона. Поэтому при таких сочетаниях требуются особая осторожность и тщательный мониторинг как побочных эффектов, так и основного терапевтического эффекта буспирона (О.С.Левин, 2015).
При приеме буспирона следует также избегать одновременного употребления большого количества мякоти грейпфрута и грейпфрутового сока (О.С.Левин, 2015). Дело в том, что мякоть грейпфрута и грейпфрутовый сок содержат бергамоттин, природный фуранокумарин, который является сильным ингибитором изофермента цитохрома CYP450 3A4, ответственного за метаболизм многих лекарств, в том числе и буспирона (Buspirone monograph, 1996; D.Bailey и соавт., 2013). Поэтому употребление мякоти грейпфрута или грейпфрутового сока приводит к замедлению биотрансформации и выведения из организма лекарств, метаболизирующихся через этот фермент (в том числе и буспирона). А это, в свою очередь, может приводить к резкому повышению концентрации таких лекарств (в том числе буспирона), к удлинению их периода полувыведения и как следствие – к появлению выраженных побочных эффектов или даже признаков интоксикации препаратом, передозировки препарата, в нашем случае – буспирона. Замедление же образования активных метаболитов лекарств [в случае буспирона – замедление образования 6-гидрокси-буспирона и 1-(2-пиримидинил)-пиперазина] на фоне приема грейпфрута или грейпфрутового сока может приводить к снижению или исчезновению их терапевтического эффекта (Buspirone monograph, 1996; J.Lilja и соавт., 1998; D.Bailey и соавт., 2013).
Напротив, сильные индукторы изофермента CYP450 3A4, такие как рифампицин (рифампин) и его аналоги, карбамазепин (финлепсин, тегретол), фенитоин (дифенин), фенобарбитал, а также курение и употребление алкоголя способны значительно снизить концентрацию буспирона в плазме крови (в случае рифампицина почти в 10 раз), что может приводить к снижению или утрате его терапевтической эффективности (Buspirone monograph, 1996; I.Mahmood, C.Sahaiwalla, 1999; M.Zhu и соавт., 2005; О.С.Левин, 2015).
Одновременное применение буспирона с ингибиторами моноаминоксидазы, включая обратимые, или с препаратами, обладающими побочной активностью ингибиторов моноаминоксидазы, такими как антибиотики линезолид и фуразолидон, противоопухолевый препарат прокарбазин, метиленовый синий, может привести к развитию серотонинового синдрома или гипертонического криза, и поэтому строго запрещено (Buspirone monograph, 1996).
Одновременное применение буспирона с серотонинергическими антидепрессантами (селективными ингибиторами обратного захвата серотонина, селективными ингибиторами обратного захвата серотонина и норадреналина, кломипрамином), триптанами, применяемыми для лечения мигрени, и другими серотонинергическими препаратами или препаратами с побочной серотонинергической активностью, такими как трамадол, способно привести к повышению риска развития серотонинового синдрома. Такая комбинация не противопоказана и часто применяется в клинике, но требует внимательного наблюдения за больным и отслеживания возможных первых признаков развивающегося серотонинового синдрома (Buspirone monograph, 1996).
Исследования показывают, что буспирон не нарушает способность к вождению машины или работе с опасными механизмами, не проявляет клинически значимого взаимодействия с алкоголем, не усиливает его седативное и опьяняющее действие и вызываемые им нарушения концентрации внимания и координации движений. Тем не менее рекомендуется в период лечения буспироном по возможности воздерживаться от употребления алкоголя (Buspirone monograph, 1996).
К клинически важным фармакокинетическим взаимодействиям буспирона относится также его способность повышать уровень в крови N-дезметилдиазепама (нордиазепама), основного активного метаболита диазепама. Это может привести к усилению его побочных эффектов, таких как миорелаксация, головокружение, чувство опьянения, головная боль, тошнота.
Фармакодинамика и механизм действия
Буспирон является высокоаффинным агонистом 5-HT1A-рецепторов с Ki=20 nM (A.Hamik и соавт., 1990; C.Loane, M.Politis, 2012). Его аффинность к этим рецепторам намного выше его аффинитета к любым другим подтипам рецепторов, кроме D3- и D4-дофаминовых рецепторов, к которым он также имеет высокую аффинность связывания (Ki к ним составляет соответственно 98 и 29 nM). Это позволяет называть его относительно селективным агонистом 5-HT1A-рецепторов. Предполагается, что основные клинические эффекты буспирона реализуются именно через его взаимодействие с 5-HT1A-серотониновыми рецепторами мозга (C.Loane, M.Politis, 2012). Некоторую роль в антидепрессивных, анксиолитических и просоциальных эффектах буспирона играют, по-видимому, опосредованные стимуляцией 5-HT1A-рецепторов гипоталамуса и гипофиза повышение секреции окситоцина и увеличение его выброса в кровь (K.Uvnäs-Moberg и соавт., 1996; P.Chiodera и соавт., 1996). В реализации антидепрессивного, анксиолитического и анальгетического эффектов буспирона играет роль также опосредованное стимуляцией 5-HT1A-рецепторов гипоталамуса и гипофиза усиление секреции b-эндорфина (R.Navinés и соавт., 2008).Имеет значение в механизмах реализации анксиолитического эффекта буспирона и опосредованное его 5-HT1A-агонистическими свойствами уменьшение выделения холецистокинина – эндогенного анксиогенного (вызывающего тревогу и панические атаки) пептидного гормона. Особенно важно при этом то, что буспирон в большей мере ослабляет повышение выделения холецистокинина в ответ на стресс или воздействие a-адренергических агонистов, таких как йохимбин, адреналин, чем его базальную секрецию (C.Becker и соавт., 1999).
Важно, что воздействие буспирона на пресинаптические и постсинаптические 5-HT1A-рецепторы различно. Для пресинаптических 5-HT1A-рецепторов, которые являются ауторегуляторными (т.е. тормозящими дальнейшее выделение серотонина в синапс), буспирон является преференциальным почти полным агонистом, с внутренней агонистической активностью, приближающейся к 100% от активности эндогенного их лиганда – серотонина. Для постсинаптических же 5-HT1A-рецепторов буспирон является парциальным (частичным) агонистом. То есть буспирон стимулирует их слабее, менее эффективно, чем серотонин, с внутренней агонистической активностью приблизительно 30% от активности серотонина (C.Loane, M.Politis, 2012; S.Stahl, 2013).
Выделенное нами выше слово «преференциальный» означает, что буспирон, при прочих равных условиях, предпочтительно связывается с пресинаптическими, а не постсинаптическими 5-HT1A-рецепторами и проявляет к ним более высокий аффинитет, т.е. воздействует на них в меньших концентрациях, чем на постсинаптические 5-HT1A-рецепторы (C.Loane, M.Politis, 2012; S.Stahl, 2013).
Сильная и преференциальная агонистическая стимуляция буспироном пресинаптических ауторегуляторных
5-HT1A-рецепторов по механизму отрицательной обратной связи вызывает торможение дальнейшего выделения серотонина в синапс и как следствие – начальное ослабление серотонинергической нейропередачи (C.Loane, M.Politis, 2012; S.Stahl, 2013; А.Т.Дзампаев и соавт, 2014). Однако при длительном, хроническом воздействии буспирона пресинаптические 5-HT1A-рецепторы десенситизируются, их чувствительность (патологически повышенная при депрессиях и тревожных состояниях) снижается, как это и должно быть при длительном воздействии любого агониста на рецептор, и подобно тому, как это происходит при длительном лечении антидепрессантами (например, группы селективных ингибиторов обратного захвата серотонина), под влиянием повышенных на фоне их действия концентраций серотонина в синапсе. В результате этой десенситизации пресинаптических 5-HT1A-рецепторов нарушенная при депрессиях и тревожных состояниях серотонинергическая нейропередача восстанавливается, приходит в норму. Предполагается, что именно этот механизм постепенной десенситизации пресинаптических ауторегуляторных 5-HT1A-рецепторов при длительном хроническом воздействии лежит в основе отсроченного на
2–4 нед, как у антидепрессантов, начала проявления антидепрессивного и анксиолитического эффектов буспирона (C.Loane, M.Politis, 2012; S.Stahl, 2013).
Что же касается постсинаптических серотониновых 5-HT1A-рецепторов, через которые реализуются многие из основных физиологических эффектов серотонина, то конечный результат воздействия на них буспирона, как и любого парциального (частичного) агониста, зависит от исходного состояния серотонинергической нейропередачи в конкретной области мозга. В условиях исходно высокой концентрации серотонина (патологически усиленной серотонинергической нейропередачи), которая наблюдается в некоторых областях мозга, например при ряде тревожных расстройств или при приеме селективных ингибиторов обратного захвата серотонина, буспирон, будучи более слабым парциальным агонистом, чем серотонин, срабатывает как его фактический антагонист, ослабляя патологически усиленную серотонинергическую нейропередачу. Это наряду с пресинаптическим действием способствует реализации анксиолитического эффекта буспирона, а также коррекции побочных эффектов от серотонинергических антидепрессантов (C.Loane, M.Politis, 2012; S.Stahl, 2013).
В условиях же исходно низкой концентрации серотонина в синапсах, которая наблюдается, например, при депрессивных состояниях, даже относительно слабая (30% от активности серотонина) парциальная агонистическая активность буспирона по отношению к постсинаптическим 5-HT1A-рецепторам срабатывает именно как агонистическая, приводя тем самым к усилению патологически ослабленной серотонинергической нейропередачи, способствуя десенситизации патологически гиперчувствительных постсинаптических 5-HT1A-рецепторов и внося наряду с пресинаптическим его действием свой вклад в антидепрессивный эффект буспирона (C.Loane, M.Politis, 2012; S.Stahl, 2013).
Таким образом, можно сказать, что буспирон оказывает в целом регулирующее, модулирующее и нормализующее влияние на серотонинергическую нейропередачу, в зависимости от ее исходного состояния, подобно тому, как арипипразол (парциальный агонист дофаминергических D2-рецепторов) оказывает регулирующее, модулирующее и нормализующее влияние на дофаминергические системы мозга, также зависящее от их исходного состояния (S.Stahl, 2013).
В экспериментах на животных показано, что введение буспирона приводит к дозозависимому снижению концентрации серотонина и повышению концентраций дофамина и норадреналина в мозге: в дозах, эквивалентных обычным терапевтическим для человека, уровень серотонина снижается в среднем на 50%, в то время как уровни дофамина и норадреналина повышаются в среднем на 100 и 140% соответственно (C.Loane, M.Politis, 2012; М.Ю.Дробижев и соавт., 2014).
Кроме того, буспирон также оказывает умеренное антагонистическое, блокирующее действие на дофаминергические D2-рецепторы: Ki=240 nM, что приблизительно в 15 раз меньше его аффинности к 5-HT1A-рецепторам (A.Hamik и соавт., 1990; C.Loane, M.Politis, 2012; М.Ю.Дробижев и соавт., 2014). Однако буспирон имеет гораздо более высокую аффинность к пресинаптическим ауторегуляторным D2-рецепторам, тормозящим дальнейшее выделение дофамина в синапс, чем к постсинаптическим, эффекторным D2-рецепторам. Благодаря этому в низких дозах, при низких концентрациях в крови и нервной ткани буспирон усиливает дофаминергическую нейропередачу в центральную нервную систему, в том числе в нигростриарном пути (C.Loane, M.Politis, 2012; М.Ю.Дробижев и соавт., 2014). Это положительное продофаминергическое действие, по-видимому, вносит вклад в антидепрессивную и прокогнитивную активность буспирона, а также объясняет его способность уменьшать экстрапирамидный синдром, вызываемые применением антипсихотика, его просексуальное действие и способность корректировать сексуальные побочные эффекты от антидепрессантов, таких как селективные ингибиторы обратного захвата серотонина и селективные ингибиторы обратного захвата серотонина и норадреналина, уменьшать вызываемую селективными ингибиторами обратного захвата серотонина вялость, утомляемость и апатию (SSRI apathy syndrome), а также его антинегативное действие при шизофрении (C.Loane, M.Politis, 2012).
Только в высоких дозах и концентрациях, клинически не применяемых у человека, буспирон оказывает антидофаминергическое действие, проявляющееся снижением двигательной активности, спонтанности и инициативы у экспериментальных животных, уменьшением вызванных амфетамином или кокаином стереотипий. Однако даже в высоких дозах буспирон не вызывает у экспериментальных животных свойственной антипсихотикам каталепсии, что свидетельствует о низком риске возникновения экстрапирамидного синдрома при его применении (C.Loane, M.Politis, 2012).
Как уже упоминалось, буспирон также обладает достаточно сильными D3- и D4-блокирующими свойствами с Ki=98 и 29 nM соответственно, уступающими по аффинности только его сродству к 5-HT1A-рецепторам (Ki=20 nM). Однако клиническое значение блокады им этих подтипов дофаминовых рецепторов неизвестно, хотя не исключено, что оно вносит вклад в его антинегативное действие при шизофрении (C.Loane, M.Politis, 2012).
Буспирон также оказывает умеренное 5-HT6-блокирующее действие – Ki=398,1 nM (J.Plassat и соавт., 1993) и умеренное 5-HT7-блокирующее действие – Ki=375 nM (T.Lovenberg и соавт., 1993; M.Ruat и соавт., 1993). Сочетание этих рецепторных свойств также может вносить свой вклад в антидепрессивную, анксиолитическую и прокогнитивную активность буспирона (T.Stern и соавт., 2015).
Кроме того, буспирон также обладает слабыми 5-HT2A- и 5-HT2C-блокирующими свойствами (Ki=1300 и 1100 nM соответственно). Это приблизительно в 60 раз меньше его аффинитета к 5-HT1A-рецепторам (M.Fava, 2007). Считается маловероятным, что эти рецепторные свойства в силу довольно низкого аффинитета буспирона к этим рецепторам вносят какой-либо вклад в общую фармакологическую активность буспирона (A.Hamik и соавт., 1990; C.Loane, M.Politis, 2012). Однако некоторые авторы приводят для буспирона более высокие значения аффинитета к 5-HT2A- и 5-HT2C-рецепторам – Ki=138 и 489,7 nM соответственно (D.Bonhaus и соавт., 1997). При таких значениях аффинитета, если они верны, эти рецепторные свойства буспирона также могут вносить некоторый вклад в его общую антидепрессивную, анксиолитическую и прокогнитивную активность и способность уменьшать экстрапирамидный синдром от антипсихотиков и сексуальные побочные эффекты от антидепрессантов, по аналогии с соответствующими рецепторными свойствами атипичных антипсихотиков (S.Stahl, 2013; T.Stern и соавт., 2015).
Один из основных активных метаболитов буспирона, 1-(2-пиримидинил)-пиперазин, циркулирующий в крови в количествах более высоких, чем сам буспирон, является сильным антагонистом пресинаптических тормозных a2-адренорецепторов, подобным миртазапину или миансерину, с аффинностью KD=40 nM (G.Tunnicliff, 1991; K.Zuideveld и соавт., 2002; М.Ю.Дробижев и соавт., 2014). Благодаря эффекту блокады 1-(2-пиримидинил)-пиперазином пресинаптических тормозных a2-адренорецепторов теоретически должно увеличиваться выделение нейромедиаторов, таких как серотонин, дофамин, норадреналин, в синаптическую щель. Вероятно, именно этим пресинаптическим a2-адреноблокирующим эффектом 1-(2-пиримидинил)-пиперазина опосредуется уже упоминавшееся нами увеличение концентраций дофамина и норадреналина в центральную нервную систему экспериментальных животных при воздействии буспирона (G.Tunnicliff, 1991; M.Fava, 2007). Также вероятно, что пресинаптические a2-адреноблокирующие свойства 1-(2-пиримидинил)-пиперазина вносят значительный вклад в общую антидепрессивную, анксиолитическую и прокогнитивную активность буспирона (M.Fava, 2007).
Сам буспирон имеет также слабый аффинитет к a1-адренорецепторам (Ki=1000 nM) и еще более слабый – к a2-адренорецепторам и b-адренорецепторам – Ki=6000 и 8800 nM соответственно (A.Hamik и соавт., 1990; T.Stern и соавт., 2015). Клиническое значение этого факта неизвестно. Однако возможно, что это свойство вносит небольшой вклад в способность буспирона несколько снижать артериальное давление и частоту сердечных сокращений. Это может быть полезным при тревожных состояниях и депрессиях, часто сопровождающихся гиперсимпатикотонией, тахикардией и наклонностью к артериальной гипертензии. Но более вероятно, что это действие буспирона на артериальное давление и частоту сердечных сокращений реализуется непрямым путем, через активацию 5-HT1A-рецепторов вагальных ядер (T.Stern и соавт., 2015).
Также буспирон и некоторые другие азапироны, в частности амиспирон (umespirone), умеренно связываются с s1-рецепторами (для буспирона Ki=558 nM), проявляя по отношению к ним агонистические свойства (Y.Itzhak и соавт., 1990). Между тем, агонизм к s1-рецепторам, как принято считать, приводит к проявлению антидепрессивного, анксиолитического и/или прокогнитивного, нейропротективного действия и может вносить свой вклад в наличие указанных свойств у таких разных препаратов, как сертралин, флувоксамин, мемантин, кетамин, декстрометорфан, метилфенидат (S.Stahl, 2013). По всей видимости, в случае буспирона и амиспирона их агонизм к s1-рецепторам также вносит свой вклад в их антидепрессивное и анксиолитическое действие и наличие у них способности улучшать когнитивные функции (Y.Itzhak и соавт., 1990).
Все прочие рецепторные свойства буспирона столь слабы, что клинического значения заведомо не имеют. В частности, буспирон практически не связывается с M-холинергическими рецепторами (Ki=38 000 nM). Это обусловливает отсутствие у него седативного эффекта, антихолинергических побочных эффектов, негативного влияния на когнитивные функции, присущих, например, такому небензодиазепиновому анксиолитику, как гидроксизин – Атаракс. Буспирон также не связывается с рецепторами
g-аминомасляной кислоты, в частности с их бензодиазепиновым или барбитуровым сайтом (Ki к ним превышает 100 мкМ). Это обусловливает отсутствие у буспирона способности вызывать седацию, миорелаксацию, нарушения памяти и когнитивных функций, свойственные бензодиазепинам и барбитуратам, а также отсутствие у него зависимого потенциала, риска привыкания и пристрастия (T.Stern и соавт., 2015).
Как видно, общий механизм действия буспирона достаточно сложен и не сводится лишь к парциальному 5-HT1A-агонистическому действию (М.Ю.Дробижев и соавт., 2014; T.Stern и соавт., 2015).
Особенности клинического применения и рекомендуемый режим дозирования
Для практического применения буспирона важно знать, что его противотревожное и вегетостабилизирующее действие, подобно таковому у «классических» антидепрессантов, начинает проявляться не сразу, а только спустя 2–3 нед приема в полных терапевтических дозах и развертывается до максимума спустя 4–6–8 нед приема. Поэтому у больных с высоким уровнем тревожности, выраженными вегетативными нарушениями, выраженным беспокойством, бессонницей, возбуждением, которым нужен быстрый анксиолитический, вегетостабилизирующий, снотворный и седативный эффект, рекомендуется в начале терапии одновременно с буспироном применять быстродействующие анксиолитики и вегетостабилизирующие препараты (например, тофизопам) или снотворные препараты, соответственно, с последующим их постепенным снижением и отменой ко времени ожидаемого развертывания анксиолитического эффекта буспирона (О.С.Левин, 2017).Также практическому врачу важно знать, что буспирон не является прямым замещением бензодиазепинов или барбитуратов, прегабалина или габапентина и имеет принципиально другой, отличный от них, механизм анксиолитического действия. Более того, в отличие от некоторых других небензодиазепиновых анксиолитиков или, например, вальпроатов, карбамазепина, буспирон не способен смягчать синдром отмены алкоголя, бензодиазепинов или барбитуратов, прегабалина или габапентина. Поэтому резкая, одномоментная замена бензодиазепинового анксиолитика, прегабалина или габапентина на буспирон не рекомендуется и может привести к развитию выраженного синдрома отмены указанных препаратов (Buspirone monograph, 1996). При планировании такой замены рекомендуется сначала добавить к принимаемому бензодиазепиновому анксиолитику или прегабалину, габапентину буспирон, а к ожидаемому сроку развертывания его анксиолитического эффекта начать постепенно, плавно снижать и отменять бензодиазепиновый анксиолитик или прегабалин, габапентин, возможно, с кратковременным использованием на этом этапе препаратов, смягчающих их синдром отмены (Buspirone monograph, 1996).
Во избежание развития побочных эффектов рекомендуется начало приема буспирона с малых доз: 5 мг 2–3 раза в сутки, т.е. 10–15 мг/сут. В дальнейшем доза буспирона постепенно увеличивается до терапевтической, составляющей обычно 20–30 мг/сут (10 мг 2–3 раза в сутки), до дозы, которая чаще всего оказывалась терапевтически эффективной в большинстве исследований (А.Т.Дзампаев и соавт., 2014). При недостаточной эффективности или полном отсутствии эффекта от этой дозы, спустя 4–6–8 нед, необходимых для оценки ее эффекта, доза буспирона может быть постепенно увеличена до максимальной суточной, составляющей 60 мг/сут – 20 мг 3 раза или 30 мг 2 раза в сутки (А.Т.Дзампаев и соавт., 2014; О.С.Левин, 2015).
В некоторых случаях, например при off-label-применении буспирона для купирования агрессивности и раздражительности, его разовые и суточные дозы могут превышать указанные в инструкции максимальные. В литературе описано его применение по таким показаниям в дозах 90–120 и даже 180 мг/сут – 30–40 мг 3–4 раза в сутки или 60–90 мг 2 раза в сутки (C.Loane, M.Politis, 2012).
Короткий период полувыведения буспирона, линейность его фармакокинетики во всем диапазоне терапевтических доз, а также хорошая его переносимость и малое количество побочных эффектов позволяют при необходимости наращивать его суточные дозы достаточно быстро. Рекомендуется прибавлять по 5 мг/сут каждые 2–3 дня (C.Loane, M.Politis, 2012; М.Ю.Дробижев и соавт., 2014; О.С.Левин, 2015).
При недостаточности анксиолитического эффекта после 4–6–8 нед приема полных терапевтических доз буспирона для усиления его действия можно добавлять другой небензодиазепиновый анксиолитик, или антидепрессант, или, при сохраняющейся бессоннице, снотворное или седативное средство. В ряде случаев, как уже указывалось, подобная комбинация имеет смысл с самого начала терапии (О.С.Левин, 2015).
При полном отсутствии терапевтического эффекта от буспирона после 4–6–8 нед приема полных терапевтических доз подобное комбинирование или потенцирование его действия добавлением антидепрессанта или другого небензодиазепинового анксиолитика также может принести пользу. Вместе с тем, в некоторых случаях полное отсутствие эффекта от буспирона в монотерапии в максимально переносимых дозах в ожидаемые сроки (4–6–8 нед) может свидетельствовать о резистентности к нему и бесперспективности его дальнейшего применения, в том числе в составе комбинаций (О.С.Левин, 2015).
К важным преимуществам буспирона перед другими анксиолитиками относятся его высокая безопасность
(в частности, низкий риск тяжелой передозировки или летального исхода), хорошая переносимость, малое количество побочных эффектов, отсутствие зависимого потенциала, риска развития синдрома отмены при его резкой отмене, отсутствие у него эйфоризирующего действия, выраженной седативности и влияния на поведение и повседневную активность больных, а также отсутствие у него способности давать нарушения сексуальной функции и прибавку массы тела (О.С.Левин, 2015).
В связи с уже упоминавшимися в разделе о фармакокинетике буспирона особенностями его фармакокинетики у больных с почечной и печеночной недостаточностью, у больных с почечной и печеночной недостаточностью легкой и средней степени, циррозом печени, а также у больных с сердечной недостаточностью и пожилых пациентов препарат следует использовать с осторожностью и в меньших дозах, отслеживая его эффективность и наличие побочных эффектов (О.С.Левин, 2015).
И, наконец, напомним, что доза буспирона, как и всякого психотропного препарата, для каждого пациента должна подбираться строго индивидуально, в соответствии с динамикой терапевтического эффекта, переносимостью, уровнем побочных эффектов, характером патологии, при которой он применяется и др. (А.Т.Дзампаев и соавт., 2014).
Побочные эффекты
Как уже указывалось, буспирон непосредственно не взаимодействует с рецепторами g-аминомасляной кислоты и, в частности, с их бензодиазепиновым, барбитуровым и нейростероидным сайтами. Поэтому он не обладает снотворно-седативным, противосудорожным и миорелаксирующим эффектами, не вызывает сонливости, вялости, заторможенности, апатии, не приводит к развитию атаксии, смазанности речи, повышению риска падений и переломов вследствие миорелаксации, что свойственно бензодиазепинам и барбитуратам. Буспирон также не вызывает лекарственной зависимости или развития синдрома отмены при резкой отмене, не обладает эйфоризирующим или опьяняющим действием, не влияет на повседневную активность больных, имеет низкую поведенческую токсичность (А.Т.Дзампаев и соавт., 2014).В отличие от гидроксизина (атаракса) буспирон не обладает М-холинолитическими и H1-гистаминоблокирующими свойствами. Поэтому он обычно не вызывает сухости во рту, пареза аккомодации глаз, запоров и других антихолинергических побочных эффектов (T.Stern и соавт., 2015).
Побочные эффекты при применении буспирона возникают редко, обычно только в начале терапии, и редко бывают тяжелыми. Обычно затем они уменьшаются и проходят по мере адаптации к препарату, несмотря на продолжение его приема. Препарат обычно хорошо переносится. В некоторых случаях для уменьшения или снятия побочных эффектов необходимо снижение дозы препарата или более медленное наращивание его доз (О.С.Левин, 2015).
Наиболее частыми (>10%) побочными эффектами буспирона являются головокружение, головная боль, сонливость. Реже (с частотой от 1 до 10%) встречаются нервозность, нарушения сна, бессонница, нарушения концентрации внимания, раздражительность, тахикардия, парестезии, затуманивание зрения, спутанность сознания, нарушения координации движений, сухость во рту, потливость, тошнота и рвота, тремор, кожный зуд, усталость или чувство утомляемости, диарея, запоры, различные боли: в животе, грудной клетке, мышечно-суставные боли (M.Jann, 1988; Buspirone monograph, 1996; О.С.Левин, 2015).
К редким побочным эффектам буспирона (возникающим с частотой от 0,1 до 1%) относятся гипертензия или гипотензия, ортостатические обмороки, экстрапирамидный синдром, акатизия, нарушения мочеиспускания, изменения массы тела и аппетита в ту или другую сторону (снижение или повышение), гиперсаливация, изменения восприятия вкуса, инъекция сосудов конъюнктивы, мышечная ригидность, затруднения дыхания, отеки, нарушения сексуальной функции, ятрогенная деперсонализация и дереализация, парадоксальное усиление тревоги и др. (M.Jann, 1988; Buspirone monograph, 1996; О.С.Левин, 2015).
Крайне редкие побочные эффекты, возникающие с частотой менее 0,1%, по данным литературы, мы здесь перечислять не будем, тем более что, как указывается, их связь с приемом буспирона в большинстве случаев достоверно не установлена. При передозировке до 375 мг/сут отмечались тошнота и рвота, головокружение, миоз, раздражение желудочно-кишечного тракта, умеренное угнетение сознания (сонливость). Буспирон считается относительно безопасным при передозировке только им одним (M.Jann, 1988).
Как уже указывалось, совместное применение буспирона с ингибиторами моноаминоксидазы может приводить к развитию серотонинового синдрома или гипертонического криза. В связи с этим такая комбинация прямо запрещена инструкцией по медицинскому применению буспирона (M.Jann, 1988; Buspirone monograph, 1996; О.С.Левин, 2015). Это касается также одновременного применения с буспироном таких препаратов, обладающих побочным эффектом ингибирования моноаминоксидазы, как антибиотики линезолид и фуразолидон, противоопухолевый препарат прокарбазин, метиленовый синий (Buspirone monograph, 1996).
Сочетание буспирона с серотонинергическими антидепрессантами (селективными ингибиторами обратного захвата серотонина, селективными ингибиторами обратного захвата серотонина и норадреналина, кломипрамином) потенциально способно повысить риск возникновения серотонинового синдрома. Поэтому, хотя такая комбинация часто применяется в клинической практике, как для потенцирования действия антидепрессантов, так и для коррекции их побочных эффектов (например, сексуальных), при таком сочетании необходимы осторожность и внимательное наблюдение за больным (Buspirone monograph, 1996).
Противопоказания к применению
Буспирон имеет следующие противопоказания (Buspirone Monograph, 1996):• Повышенная индивидуальная чувствительность или аллергические реакции на буспирон, другие производные азапирона (возможность перекрестных аллергических реакций) или любые другие компоненты таблеток Спитомин.
• Метаболический ацидоз, как, например, при сахарном диабете.
• Прием ингибиторов моноаминоксидазы.
• Тяжелая печеночная или почечная недостаточность.
Согласно действующей в РФ инструкции по применению препарата Спитомин, его применение у детей и подростков до 18 лет также противопоказано, так как в РФ не проводились исследования его эффективности и безопасности у этой категории больных (О.С.Левин, 2015). Вместе с тем, в официальной инструкции FDA по применению буспирона, а также в аналогичных инструкциях, действующих в Евросоюзе, подобного ограничения нет. Более того, в них содержится прямое указание на то, что эффективность и безопасность применения буспирона при тревожных расстройствах установлены на Западе в нескольких хорошо контролируемых рандомизированных клинических исследованиях у детей и подростков от 6 до 18 лет (Buspirone monograph, 1996). Также на Западе имеется ряд исследований по применению буспирона при таких частых психических патологиях детского и подросткового возраста, как расстройства аутистического спектра (D.Chugani и соавт., 2016), синдром дефицита внимания с гиперактивностью или без (R.Davari-Ashtiani и соавт., 2010; M.Mohammadi и соавт., 2012).
Беременность и кормление грудью также являются противопоказаниями к применению буспирона, хотя прямых доказательств его тератогенного, эмбриотоксического или фетотоксического действия нет (О.С.Левин, 2015).
Буспирон не противопоказан, но должен с осторожностью применяться у пациентов, одновременно получающих антипсихотики, сердечные гликозиды, антигипертензивные или противодиабетические препараты. Совместное применение буспирона с пероральными контрацептивами, по некоторым данным, может приводить к ослаблению контрацептивного действия (О.С.Левин, 2015).
Завершая общее описание фармакологии буспирона, перейдем к рассмотрению имеющейся доказательной базы для его применения при различных психических патологиях.
Доказательная база для применения буспирона при различных психических патологиях
Тревожные расстройстваГенерализованное тревожное расстройство. Наибольший опыт применения буспирона накоплен при генерализованном тревожном расстройстве (О.С.Левин, 2015). Кохрановский обзор, опубликованный в 2006 г. и посвященный применению буспирона в лечении генерализованного тревожного расстройства, сообщает о 36 исследованиях с участием 5908 пациентов (C.Chessick и соавт., 2006). Доказательства эффективности буспирона при терапии генерализованного тревожного расстройства основаны на результатах 10 двойных слепых плацебо-контролируемых рандомизированных клинических исследований, включая 8 исследований терапии генерализованного тревожного расстройства у взрослых пациентов (4–6 нед), одно 8-недельное исследование у пожилых пациентов и одно 6-месячное исследование безопасности длительной терапии буспироном. Буспирон продемонстрировал высокую эффективность в дозировках 30 и 45 мг/сут. В одном из исследований уже при дозировке 15 мг/сут его эффект значимо превосходил плацебо и препарат сравнения. Во всех исследованиях отмечалась быстрота наступления анксиолитического эффекта буспирона.
Анксиолитический эффект буспирона, его влияние на психический, соматический и вегетативный компоненты тревоги были четко подтверждены в работах K.Rickels и соавт. (1982 г.) и М.Strand и соавт. (1990 г.). Исследователи отметили, что диазепам лучше влияет на соматические симптомы, а буспирон более эффективен при когнитивных и межличностных проблемах. Эффективность терапии буспироном была подтверждена и в другом сравнительном 6-недельном исследовании с участием 230 пациентов с генерализованным тревожным расстройством (М.Strand и соавт., 1990).
По результатам данных исследований был сделан вывод, что буспирон эффективен в терапии генерализованного тревожного расстройства и обладает выраженным анксиолитическим действием, начинающимся уже со 2-й недели лечения, что сопоставимо со скоростью наступления эффекта при терапии бензодиазепинами, и характеризующимся редукцией как психического, так и соматического (в том числе вегетативного) компонента тревоги, без развития толерантности.
Следует заметить, что в силу своего механизма действия буспирон эффективен не во всех случаях генерализованного тревожного расстройства (A.Berger и соавт., 2009). Препарат особенно эффективен в случаях сочетания генерализованного тревожного расстройства с депрессией, особенно с симптомами «норадренергической и/или дофаминергической недостаточности», такими как подавленность, апатия и анергия, ангедония (C.Campbell Burton и соавт., 2011).
Социальное тревожное расстройство. Давно известно из экспериментальных данных, полученных на животных, что стимуляция 5-HT1A-рецепторов различными экспериментальными агонистами, такими как 8-OH-DPAT или флезиноксан, приводит не только к снижению общего уровня тревожности и купированию экспериментальной депрессии, но и к улучшению социального взаимодействия животных в моделях, имитирующих социальную тревожность у человека. В свете этого, разумеется, не мог не привлечь внимания специалистов, занимающихся лечением социального тревожного расстройства, клинически доступный парциальный 5-HT1A-агонист буспирон. Известно также, что социальную тревожность животных в этих моделях, как и социальное тревожное расстройство у человека, уменьшает также введение экзогенного окситоцина. Между тем, 5-HT1A-агонисты, включая буспирон, способствуют усилению секреции эндогенного окситоцина. Все это послужило теоретической основой для начала изучения потенциальной эффективности буспирона при социальном тревожном расстройстве у людей (D.Munjack и соавт., 1991; F.Schneier и соавт., 1993).
Данные исследований свидетельствуют о возможной эффективности буспирона в лечении социального тревожного расстройства. Впервые это было показано в открытых пилотных исследованиях в 1991 и 1993 г. (D.Munjack и соавт., 1991; F.Schneier и соавт., 1993). Так, в 12-недельном открытом пилотном исследовании F.Schneier и соавт., которое было слепым для пациентов, но не для исследователей, участвовал 21 пациент с диагнозом социального тревожного расстройства по критериям DSM-III-R, не отреагировавший на предварительное недельное слепое для них использование плацебо. Из 21 пациента 17 человек удержались в исследовании более 2 нед. Из этих 17 человек к сроку 12 нед значительное или очень значительное клиническое улучшение по шкале общего клинического впечатления (CGI) было зарегистрировано у 8 (47%). При этом авторы обратили внимание на то, что у 12 из 17 пациентов, соответствующих критериям генерализованной формы социального тревожного расстройства, результаты лечения буспироном оказались лучше, чем у остальных 5, страдающих изолированными социальными фобиями (когда тревога возникает лишь в некоторых социальных ситуациях, но не возникает в других). Также они обратили внимание на то, что высокие дозы буспирона при социальном тревожном расстройстве могут оказаться эффективнее, чем более низкие: среди 12 пациентов, которые смогли переносить дозу 45 мг/сут буспирона или более, очень значительное клиническое улучшение по шкале CGI было достигнуто у 9 (67%) [F.Schneier и соавт., 1993].
Важно отметить, что в упомянутом открытом пилотном исследовании было также показано, что терапевтический эффект буспирона при социальном тревожном расстройстве специфичен и не зависит от его влияния на коморбидные проявления депрессии и генерализованного тревожного расстройства, эффективность в отношении которых у буспирона давно официально установлена: снижение показателей социальной тревожности у больных в этом исследовании не коррелировало со снижением показателей генерализованного тревожного расстройства или депрессии, которые были в отобранной группе изначально низкими, т.е. отбирались пациенты с «чистым» социальным тревожным расстройством, без значимых коморбидных депрессий или генерализованного тревожного расстройства (F.Schneier и соавт., 1993).
Большой интерес представляет также вопрос о том, не может ли буспирон служить эффективным потенцирующим агентом к антидепрессантам при социальном тревожном расстройстве, резистентном к монотерапии антидепрессантами. Это предположение подверглось проверке в небольшом (n=10) 8-недельном открытом исследовании, в котором участвовали пациенты, у которых был достигнут частичный ответ на монотерапию селективными ингибиторами обратного захвата серотонина в течение предыдущих 8 нед (M. Van Ameringen и соавт., 1996). Всем этим пациентам был назначен в качестве потенцирующего агента буспирон (30, 45 или 60 мг/сут). К сроку 8 нед значительное или очень значительное клиническое улучшение продемонстрировали 7 (70%) из 10 пациентов, причем у пациентов, получавших 45 мг/сут и более, оно было более выраженным. Из 3 (30%) пациентов, оказавшихся нон-респондерами по отношению к потенцированию селективных ингибиторов обратного захвата серотонина буспироном, все получали буспирон в дозе лишь 30 мг/сут из-за неспособности переносить более высокую дозу. Авторы констатировали, что буспирон в целом хорошо переносится этими больными, безопасен и является перспективным потенцирующим агентом при социальном тревожном расстройстве, резистентном к монотерапии селективными ингибиторами обратного захвата серотонина, особенно при высоких дозах, и призвали к его изучению в этом качестве в формате крупных многоцентровых рандомизированных клинических исследований (M. Van Ameringen и соавт., 1996).
В двух последних метаобзорах, посвященных описанию возможностей психофармакотерапии при социальном тревожном расстройстве, включая ее резистентные формы, констатируется, что, в отличие от ситуации с терапевтически резистентными депрессиями, методов лечения терапевтически резистентных форм социального тревожного расстройства, прошедших проверку доказательной медициной на уровне рандомизированных клинических исследований, почти нет. При этом в качестве потенциальных способов преодоления резистентности к антидепрессантам при социальном тревожном расстройстве, имеющих доказательную базу хотя бы на уровне открытых исследований, упоминаются добавление буспирона, вальпроатов, интраназального окситоцина и др. (A.Halaby и соавт., 2013; V.Masdrakis и соавт., 2013).
Паническое расстройство. Буспирон как перспективный анксиолитик широкого спектра действия изучался не только при генерализованном тревожном расстройстве, но и при других тревожных расстройствах, в частности при паническом расстройстве.
Эффективность буспирона при паническом расстройстве изучалась и российскими исследователями. В одном из таких рандомизированных клинических исследований проводилось сопоставление эффективности буспирона (препарата Спитомин) в сочетании с краткосрочной когнитивно-поведенческой терапией в течение 6 нед по сравнению с монотерапией когнитивно-поведенческой плюс плацебо. В исследовании участвовали 30 пациентов с диагнозом панического расстройства согласно критериям Международной классификации болезней 10-го пересмотра (А.В.Васильева и соавт., 2015). Одной группе пациентов (15 человек) назначался буспирон в фиксированной дозе 30 мг/сут (10 мг 3 раза в день) в сочетании с коротким курсом когнитивно-поведенческой терапии. Второй же группе пациентов (также 15 человек) назначалось плацебо в сочетании с таким же курсом краткосрочной когнитивно-поведенческой терапии. Обе группы были сопоставимы по основным демографическим характеристикам, а также по тяжести и длительности заболевания. В качестве оценочных шкал в этом исследовании использовались шкала тревоги Гамильтона (HAM-A), шкала ситуационной и личностной тревожности Спилбергера–Ханина (STAI-A), шкала депрессии Монтгомери–Асберга (MADRS) и шкала общего клинического впечатления – CGI (А.В.Васильева и соавт., 2015).
Авторами данного исследования было показано, что буспирон в сочетании с когнитивно-поведенческой терапией статистически достоверно эффективнее монотерапии когнитивно-поведенческой плюс плацебо и добавление буспирона к проводимой когнитивно-поведенческой терапией улучшает ее результаты и облегчает ее проведение, снижая уровень межприступной тревоги, повышая гибкость психики пациентов и их готовность к восприятию установок психотерапевта и выполнению его заданий, модификации устоявшихся негативных паттернов мышления и поведения. Обращает на себя внимание статистически достоверное, хотя и небольшое, уменьшение показателей личностной тревожности по шкале Спилберга–Ханина, отражающее упомянутое повышение гибкости психики пациентов (А.В.Васильева и соавт., 2015).
Применение буспирона в сочетании с когнитивно-поведенческой терапией при паническом расстройстве также привело к статистически достоверному снижению уровней ситуационной тревожности по шкале STAI-A, снижению общего уровня тревоги по шкале HAM-A и уровня коморбидной депрессии по шкале MADRS, уменьшению инвалидизации больных и улучшению общего клинического впечатления по шкале CGI по сравнению с комбинацией плацебо и когнитивно-поведенческой терапии. Уровни ситуационной и личностной тревожности пациентов, хотя и снизились к концу исследования, все же оставались достаточно высокими. Среднее снижение общего уровня тревоги по шкале HAM-A превысило 50% от исходного уровня – 9,73 балла (А.В.Васильева и соавт., 2015).
Важно отметить, что пациенты с паническим расстройством нередко плохо переносят психотропные лекарства, испытывают выраженную фармакофобию, нередко дают ноцебо-реакции на различные препараты (в том числе на плацебо), склонны давать начальное обострение тревоги и учащение панических атак при применении антидепрессантов. В свете этого большое клиническое значение имеет установленная авторами цитируемого исследования хорошая переносимость буспирона у этой категории больных, отсутствие у него склонности вызывать начальное обострение тревоги и учащение панических атак. Благодаря хорошей переносимости препарата все участники исследования смогли его завершить без досрочного выбытия (А.В.Васильева и соавт., 2015).
Сходные результаты, показывающие эффективность добавления буспирона к когнитивно-поведенческой терапии при паническом расстройстве, были ранее получены и западными исследователями (J.Cottraux и соавт., 1995).
В систематическом обзоре 2002 г., посвященном изучению возможностей психофармакотерапии при паническом расстройстве, резистентном к терапии 1-й линии (антидепрессанты группы селективных ингибиторов обратного захвата серотонина), указывается, что возможности справиться с резистентностью при паническом расстройстве, в отличие от ситуации с резистентными депрессиями, практически не изучались в формате рандомизированных клинических исследований. При этом среди методов потенцирования антидепрессантов при резистентном паническом расстройстве, имеющих доказательную базу хотя бы на уровне открытых пилотных исследований, упоминается добавление буспирона, вальпроатов, b-адреноблокаторов (M.Zamorski, R.Albucher, 2002).
Посттравматическое стрессовое расстройство. По данным ряда открытых исследований, буспирон эффективен также в терапии посттравматического стрессового расстройства, как в монотерапии (B.Wells и соавт., 1991; L.LaPorta, M.Ware, 1992; J.Duffy, P.Malloy, 1994), так и в качестве потенцирующего агента в дополнение к антидепрессанту (M.Hamner и соавт., 1997).
При применении буспирона у пациентов с посттравматическим стрессовым расстройством отмечалось уменьшение не только тревожности, но и таких симптомов посттравматического стрессового расстройства, как панические атаки, бессонница, кошмары, нарушения фазовой структуры сна, «флэшбэки» (болезненные психотравмирующие воспоминания). Улучшались также настроение больных, их уровень энергии и повседневной активности, уменьшалась выраженность депрессивной симптоматики (B.Wells и соавт., 1991; L.LaPorta, M.Ware, 1992; J.Duffy, P.Malloy, 1994).
В частности, в открытом исследовании показано, что буспирон эффективен в терапии посттравматического стрессового расстройства у американских военных, пострадавших в результате боевых действий в Ираке (C.Fichtner, J.Crayton, 1994).
В относительно свежем обзоре от 2012 г., посвященном изучению тенденций в выписке психотропных лекарств при лечении посттравматического стрессового расстройства, отмечается, что в связи с высоким риском развития бензодиазепиновой зависимости именно у пациентов с посттравматическим стрессовым расстройством по сравнению с пациентами с другими формами тревожных расстройств частота назначения им бензодиазепинов за последние 10 лет стабильно снижалась, в то время как частота назначения буспирона наряду с празозином и доксазозином, антидепрессантами группы селективных ингибиторов обратного захвата серотонина и селективных ингибиторов обратного захвата серотонина и норадреналина, как препаратами, имеющими наиболее убедительную доказательную базу для применения при посттравматическом стрессовом расстройстве, стабильно росла (N.Bernardy и соавт, 2012).
Расстройства обсессивно-компульсивного спектра
Расстройства обсессивно-компульсивного спектра, как сегодня считают, связаны с нарушениями в балансе серотонинергической и дофаминергической нейропередачи в кортико-таламо-стриатальных цепях. Эта теория подтверждается, в частности, тем, что расстройства обсессивно-компульсивного спектра специфически отвечают на применение только серотонинергических антидепрессантов (селективных ингибиторов обратного захвата серотонина, селективных ингибиторов обратного захвата серотонина и норадреналина, кломипрамина), но не других классов антидепрессантов. Поэтому при резистентности расстройств обсессивно-компульсивного спектра к терапии 1-й линии (серотонинергическим антидепрессантам) пытаются применять для их потенцирования различные серотонинергические и антидофаминергические агенты, в частности фенфлюрамин, литий, различные антипсихотики и др. (S.Stahl, 2013). Безусловно, не мог не привлечь внимания исследователей, занимающихся лечением расстройств обсессивно-компульсивного спектра, и такой серотонинергический и дофаминорегулирующий (в зависимости от дозы дофаминергический или антидофаминергический) агент, как буспирон. Ниже мы опишем результаты его исследования при этих патологиях.
Обсессивно-компульсивное расстройство. Данные об эффективности буспирона при обсессивно-компульсивном расстройстве противоречивы, но в некоторых исследованиях показан положительный эффект препарата, особенно при его комбинации с другими психофармакологическими препаратами, прежде всего антидепрессантами (О.С.Левин, 2015). В открытых исследованиях показано, что присоединение буспирона в дозе 30–90 мг/сут к селективным ингибиторам обратного захвата серотонина повышает эффективность лечения обсессивно-компульсивного расстройства почти у 1/2 пациентов, в основном у тех, кто имел частичный ответ на серотонинергические антидепрессанты (T.Grady и соавт., 1993; M.Gross, 1995).
Буспирон, по предварительным данным, способен усиливать действие флуоксетина у резистентных к проводимой терапии больных с обсессивно-компульсивным расстройством (T.Grady и соавт., 1993; C.McDougle и соавт., 1993).
Трихотилломания. Буспирон оказался эффективен в дополнение к кломипрамину и психотерапии у девочки с расстройством аутистического спектра и коморбидной трихотилломанией, у которой изолированное применение кломипрамина, буспирона и психотерапии в качестве монотерапий оказалось неэффективным. При этом уменьшились как проявления расстройств аутистического спектра, такие как раздражительность, агрессивность, неконтактность, стереотипность и негибкость поведения, так и проявления трихотилломании (J.Holttum и соавт., 1994).
В другом описанном в литературе случае буспирон оказался эффективен в потенцировании действия селективных ингибиторов обратного захвата серотонина флуоксетина и психотерапии у 23-летнего юноши с трихотилломанией и дисморфофобией. Оба расстройства не поддавались ни монотерапии флуоксетином, ни психотерапии до добавления к терапии буспирона (J.Tanquary, 1994).
Третий интересный случай описывает 31-летнюю женщину с генерализованным тревожным расстройством и коморбидной трихотилломанией, с частичным ответом обоих расстройств на селективный ингибитор обратного захвата серотонина флувоксамин. После добавления к терапии 30 мг/сут буспирона спустя 4 нед эпизоды трихотилломании (навязчивого выдергивания волос) прекратились полностью, а проявления генерализованного тревожного расстройства значительно уменьшились, до уровня, позволившего женщине возобновить выполнение профессиональных обязанностей (T.Reid, 1992).
Клептомания. Клептомания также относится к расстройствам обсессивно-компульсивного спектра, хотя некоторые специалисты выделяют ее и ряд других расстройств обсессивно-компульсивного спектра в отдельную подгруппу «расстройств контроля влечений» (impulse control disorders). Учитывая имеющиеся данные об эффективности буспирона в терапии «классического» обсессивно-компульсивного расстройства, а также таких расстройств обсессивно-компульсивного спектра, как трихотилломания, дисморфофобия, и данные о его способности уменьшать импульсивность при различных психических заболеваниях, авторами одного небольшого рандомизированного клинического исследования была предпринята попытка использования буспирона в качестве потенцирующего агента к селективному ингибитору обратного захвата серотонина флувоксамину у небольшой группы больных клептоманией в сравнении с плацебо (n=17, средний возраст 24,5 года, все мужского пола). При этом было показано, что в группе буспирона 30 мг/сут отмечалось статистически достоверное урежение количества эпизодов клептоманического поведения по сравнению с плацебо (R.Durst и соавт., 1997, a).
В более позднем обзоре тех же израильских авторов, посвященном рассмотрению феноменологических, клинических и медико-юридических аспектов клептомании как таковой, указывается, что эффективность буспирона в качестве потенцирующего агента к селективным ингибиторам обратного захвата серотонина (в их случае, к флувоксамину) при клептомании не просто заслуживает дальнейшего изучения в формате масштабных и хорошо контролируемых рандомизированных клинических исследований, но и позволила уже сейчас в ряде случаев избежать весьма неблагоприятных социальных и юридических последствий клептоманических поступков для их пациентов. Поэтому изучение буспирона в качестве перспективного потенцирующего агента при клептомании имеет важное социальное и медико-легальное значение (R.Durst и соавт., 1997, б).
Дисморфофобия. Это расстройство (body dysmorphic disorder) также относится к расстройствам обсессивно-компульсивного спектра. В одном небольшом пилотном открытом исследовании изучали эффективность потенцирования буспироном серотонинергических антидепрессантов (препаратов группы селективных ингибиторов обратного захвата серотонина или кломипрамина) у 13 пациентов с диагнозом «дисморфофобия» согласно критериям DSM-IV, с частичным ответом или отсутствием ответа на монотерапию серотонинергическим антидепрессантом. При этом у 6 (46%) из 13 пациентов был получен положительный ответ на добавление буспирона в качестве потенцирующего агента. У 3 из этих 6 пациентов, которые впоследствии отменили буспирон или снизили его дозу, симптомы дисморфофобии вновь усилились или вернулись. У 1 пациента, который в результате этого ухудшения согласился вернуть прежнюю дозу буспирона, снова наступило улучшение. Авторы данного исследования заключили, что буспирон является перспективным потенцирующим агентом при дисморфофобии с недостаточным ответом на стандартную терапию и что он заслуживает дальнейшего изучения в формате рандомизированных клинических исследований при этой патологии (K.Phillips, 1996).
В 2001 г. описан интересный клинический случай эффективности потенцирования буспироном селективного ингибитора обратного захвата серотонина сертралина у 14-летней девочки-подростка с дисморфофобией бредового уровня, резистентной к применению антипсихотика пимозида, мощного серотонинергического антидепрессанта класса трициклических антидепрессантов кломипрамина и к монотерапии сертралином (H.Duggal и соавт., 2001).
В двух последующих систематических обзорах от 2001 и 2008 г., посвященных изучению эффективности психофармакотерапии при дисморфофобии как таковой, констатируется, что буспирон может быть эффективен в качестве потенцирующего агента при дисморфофобии, не отвечающей или недостаточно отвечающей на монотерапию серотонинергическими антидепрессантами (K.Phillips и соавт., 2001; K.Phillips, E.Hollander, 2008).
Депрессивные расстройства
Известно, что антидепрессивное действие таких классов антидепрессантов, как селективные ингибиторы обратного захвата серотонина, селективные ингибиторы обратного захвата серотонина и норадреналина, трициклические антидепрессанты, ингибиторы моноаминоксидазы, во многом опосредуется вызываемой повышением уровня серотонина в синапсах непрямой стимуляцией именно 5-HT1A-постсинаптических серотониновых рецепторов, в то время как стимуляция таких подтипов серотониновых рецепторов, как 5-HT2A/C или 5-HT3, считается скорее вредной в лечении депрессий, и именно с ней связывают такие побочные эффекты в начале терапии антидепрессантами, как тошнота и рвота, головная боль, бессонница, обострение тревоги (S.Stahl, 2013). Также известно, что именно наблюдаемая при депрессиях патологическая гиперчувствительность пресинаптических ауторегуляторных 5-HT1A-рецепторов, ограничивающая дальнейшее выделение серотонина в синапс, препятствует быстрому наступлению антидепрессивного эффекта «классических» антидепрессантов (возникает своеобразное «сопротивление» клетки, стремящейся восстановить исходный гомеостаз на низком уровне серотонина). А с патологической гиперчувствительностью постсинаптических рецепторов связывают выраженность начальных побочных эффектов при терапии антидепрессантами. В то же время прямые 5-HT1A-парциальные агонисты, такие как буспирон, флезиноксан, «обходят» это начальное ауторегуляторное ограничение выброса серотонина, непосредственно стимулируя постсинаптические серотониновые рецепторы, и одновременно способствуют более быстрой десенситизации как пре-, так и постсинаптических рецепторов, уменьшают начальные побочные эффекты от антидепрессантов и ускоряют наступление их антидепрессивного эффекта. В экспериментах на животных 5-HT1A-агонисты вызывают значительно более быстрый антидепрессивный эффект, чем «классические» антидепрессанты (S.Stahl, 2013).
В свете всего сказанного неудивительно, что буспирон привлекает большое внимание специалистов в качестве перспективного средства лечения депрессий как в монотерапии, так и в особенности в роли потенцирующего агента к антидепрессантам. По данным литературы, буспирон особенно эффективен в качестве потенцирующего агента при лечении депрессивных состояний, которые протекают с симптомами «норадренергической и/или дофаминергической недостаточности», с подавленностью, безрадостностью, безнадежностью, неуверенностью, утратой интересов и способности испытывать удовольствие; замедлением информационных процессов, моторной заторможенностью и утратой энергии (М.Ю.Дробижев и соавт., 2014).
Большой интерес в этом плане представляют работы J.Davidson и соавт. (1999 г.) и N.Mokhber и соавт. (2010 г.), в рамках которых были проведены сравнительные 8-недельные исследования эффективности буспирона и антидепрессанта венлафаксина (J.Davidson и соавт., 1999) и сертралина (N.Mokhber и соавт., 2010). В работе европейских ученых, J.Davidson и соавт., исследуемую популяцию составили 365 пациентов, которые были рандомизированы в группу терапии буспироном (30 мг/сут) и венлафаксином (75 и 150 мг/сут). Уместно отметить, что венлафаксин является первым антидепрессантом из группы селективных ингибиторов обратного захвата серотонина и норадреналина, одобренным FDA для лечения генерализованного тревожного расстройства. К моменту завершения 8 нед терапии по основному критерию оценки – уменьшению симптомов тревоги и депрессии – эффективность буспирона была сопоставима с венлафаксином в дозе 75 мг/сут, но несколько уступала по эффективности венлафаксину в дозе 150 мг. Другое исследование, выполненное в 2010 г. N.Mokhber и соавт., имело две особенности. Во-первых, эффективность буспирона была продемонстрирована в минимальной дозе (15 мг/сут). Во-вторых, в это исследование были включены пожилые пациенты с генерализованным тревожным расстройством, средний возраст которых составил 66,5 года. Буспирон в суточной дозе 15 мг оказался статистически достоверно значительно эффективнее сертралина (50–100 мг/сут), как в отношении уменьшения клинических симптомов, так и быстроты развития анксиолитического и антидепрессивного эффектов: на 2-й неделе терапии уменьшение симптомов тревоги и депрессии было более существенным в группе буспирона.
Наглядным примером достаточного потенциала буспирона в лечении тревожных и депрессивных расстройств стали исследование, проведенное J.Sramek и соавт. (1996 г.), и более поздний метаанализ 8 клинических исследований у пациентов с генерализованным тревожным расстройством и депрессией, проведенный C.Chessick и соавт. (2006 г.). В 6-недельное плацебо-контролируемое исследование были включены 162 пациента с подтвержденным диагнозом генерализованного тревожного расстройства и субсиндромальной депрессией, у которых суммарная оценка по шкале HAM-D не превышала 17 баллов (J.Sramek и соавт., 1996). Пациентам, рандомизированным в группу терапии буспироном, препарат назначался в суточной дозе 15 мг/сут с последующей титрацией дозы на 5 мг каждые 2 дня до достижения 45 мг/сут. Другая часть пациентов была рандомизирована в группу терапии плацебо. На момент окончания исследования и терапии эффективность лечения буспироном превосходила плацебо как в плане уменьшения симптомов тревоги, оцененных по шкале HAM-A, так и в плане уменьшения симптомов депрессии по шкале HAM-D. Результаты метаанализа 8 двойных слепых плацебо-контролируемых рандомизированных клинических исследований с суммарным числом участников 520 человек, по поводу применения буспирона в дозах до 45 мг/сут у пациентов с генерализованным тревожным расстройством и депрессией, продемонстрировали эффективность и положительное влияние терапии буспироном на симптомы как тревоги, так и депрессии. По оценке лечащих врачей, на фоне терапии буспироном также происходило улучшение общего состояния пациента. Особенностью данного метаанализа явилось и то, что у значительной части пациентов (44,6%) тяжесть депрессивных симптомов на момент включения в исследование была оценена как значительная и очень значительная (C.Chessick и соавт., 2006). Результаты данного исследования и метаанализа позволяют сделать вывод об эффективности буспирона у пациентов с генерализованным тревожным расстройством и депрессией. Это свидетельствует о наличии двух параллельных независимых клинических эффектов препарата – анксиолитического и антидепрессивного.
В настоящее время накоплен значительный клинический опыт, подтверждающий эффективность включения буспирона в схему терапии при неэффективности антидепрессантов или терапевтически резистентной депрессии. Доказательства эффективности потенцирования антидепрессантов буспироном основаны на результатах 7 рандомизированных клинических исследований (K.Harvey, R.Balon, 1995). Все включенные в исследования пациенты имели подтвержденный диагноз большого депрессивного расстройства и получали трициклические антидепрессанты (имипрамин и кломипрамин) или селективные ингибиторы обратного захвата серотонина с недостаточным эффектом. Буспирон назначался в дозах 30–90 мг/сут в
3 приема в течение 6–8 нед. В одном 4-недельном исследовании (E.Schweizer и соавт., 1986) была изучена эффективность потенцирования антидепрессантов буспироном у 30 пациентов с большим депрессивным расстройством, получавших серотонинергические антидепрессанты с недостаточным эффектом. Буспирон добавлялся в схему терапии в дозе 30 мг/сут. В результате комбинированной терапии было достигнуто значительное уменьшение симптоматики, в отличие от пациентов, получавших монотерапию антидепрессантами. Также положительными оказались результаты другого исследования (F.Jacobsen, 1990), у включенных в которое пациентов с большим депрессивным расстройством наблюдалась недостаточная эффективность терапии селективными ингибиторами обратного захвата серотонина (флуоксетин) и трициклическими антидепрессантами (имипрамин). Буспирон назначался совместно с терапией антидепрессантами в дозе 10 мг 3 раза в сутки, к концу исследования было также достигнуто значительное снижение выраженности депрессивной симптоматики. В двух других исследованиях (D.Robinson, K.Rickels, 1990; K.Rickels и соавт., 1991) также было показано усиление терапевтического эффекта селективных ингибиторов обратного захвата серотонина при присоединении к схеме лечения буспирона у 155 пациентов с терапевтически резистентной депрессией. Результаты, полученные в более ранних исследованиях, дали весомые основания полагать, что буспирон в сочетании со стандартной терапией антидепрессантами позволяет существенно повысить эффективность терапии депрессии, а также ускорить наступление эффекта антидепрессантов и уменьшить выраженность их начальных побочных эффектов.
В дальнейшем работы в этом направлении были продолжены, и полученные результаты были подтверждены в более масштабных, тщательно спланированных рандомизированных клинических исследованиях. Большой интерес представляет работа (E.Dimitriou, C.Dimitriou, 1998), в рамках которой была оценена эффективность потенцирования антидепрессантов буспироном у пациентов с большим депрессивным расстройством, недостаточной эффективностью терапии трициклическими антидепрессантами (кломипрамин в дозе 125–175 мг/сут) и селективными ингибиторами обратного захвата серотонина (флуоксетин 20–40 мг/сут, пароксетин 20–30 мг/сут, циталопрам 20–40 мг/сут). Пациенты, у которых не наступал положительный эффект в течение 6 нед терапии антидепрессантами, были рандомизированы в две группы, в каждой из которых к неизменным дозировкам назначенных ранее антидепрессантов добавлялся буспирон в дозе 15 мг/сут, которая была повышена со 2-й недели до 30 мг/сут. Оценка эффективности потенцирования буспироном антидепрессантов была проведена на 4 и 5-й неделях лечения. Средняя доза буспирона на момент окончания терапии составила 27 мг/сут и значимо не различалась в группах больных, принимавших разные антидепрессанты. Результаты исследования продемонстрировали отчетливые преимущества в показателях эффективности терапии при добавлении к антидепрессантам буспирона по сравнению с монотерапией антидепрессантами. На момент окончания исследования 59,1% пациентов достигли ремиссии в группе сочетанной терапии селективными ингибиторами обратного захвата серотонина и буспироном и 62,5% – в группе терапии трициклическими антидепрессантами и буспироном. В целом показатель ремиссии к концу исследования в обеих группах составил 60%. К концу наблюдения суммарные значения по шкале оценки депрессии HAM-D статистически значимо снизились относительно исходных: в начале исследования – 25,4, по его окончании – 11,8 балла (E.Dimitriou, C.Dimitriou, 1998).
Расстройства шизофренического спектра
Как мы уже упоминали в разделе об истории создания буспирона, изначально он синтезировался в качестве антипсихотика. В разделе о его фармакодинамических свойствах и механизмах действия мы упоминали о том, что буспирон наряду с прочими своими рецепторными свойствами обладает преференциальной пресинаптической D2-блокирующей активностью и в малых (обычно применяемых в клинической практике) дозах повышает выделение дофамина в синапс и что его применение приводит к повышению концентраций дофамина в таких областях мозга, как нигростриарная система, префронтальная кора (О.С.Левин, 2015). Между тем именно со снижением концентрации дофамина в префронтальной коре связывают негативную и когнитивную симптоматику шизофрении и другие расстройства шизофренического спектра, в то время как с повышенной дофаминергической активностью в мезолимбических проводящих путях связывают продуктивную симптоматику. С избыточной блокадой D2-рецепторов нигростриарной системы под влиянием антипсихотиков связывают возникновение при лечении ими экстрапирамидного синдрома и акатизии, а с избыточной блокадой ими D2-рецепторов префронтальной коры – вызываемую ими вторичную ятрогенную негативную симптоматику (neuroleptic induced deficit syndrome – NIDS), вторичные ятрогенные когнитивные нарушения («отупение»). С избыточной блокадой D2-рецепторов лимбической системы связывают ангедонию, притупление эмоций, нейролептическую депрессию (S.Stahl, 2013).
Немаловажное значение в контексте лечения расстройств шизофренического спектра имеет также наличие у буспирона таких рецепторных свойств, как сильный парциальный 5-HT1A-агонизм, слабый или умеренный антагонизм к 5-HT2A/C, 5-HT6, 5-HT7-рецепторам. Именно с этими рецепторными свойствами атипичных антипсихотиков связывают их меньшую по сравнению с типичными антипсихотиками способность вызывать экстрапирамидный синдром и акатизию, NIDS, нейролептические депрессии, меньшее негативное влияние на когнитивные функции больных и даже наличие у многих из них прокогнитивных, антидепрессивных и антинегативных свойств. Между тем давно известно, что именно негативная, когнитивная и депрессивная симптоматика шизофрении в гораздо большей мере, чем продуктивная, предопределяет долгосрочные функциональные исходы больных шизофренией, их работоспособность и социализацию (S.Stahl, 2013).
В свете всего сказанного неудивительно, что внимание специалистов, занимающихся лечением расстройств шизофренического спектра, привлекла идея комбинирования буспирона с антипсихотиками с целью «повысить их атипичность», приблизить спектр рецепторной активности такой комбинации к спектру рецепторной активности наиболее современных из атипичных антипсихотиков, уменьшить их побочные эффекты (в частности, экстрапирамидный синдром, акатизию, проявления NIDS, нейролептическую депрессию, когнитивное снижение) [D.Piskulic и соавт., 2009]. С теоретических позиций это должно способствовать значительному расширению возможностей психофармакотерапии при расстройствах шизофренического спектра, усилению влияния психофармакотерапии на такие трудно поддающиеся лечению аспекты расстройств шизофренического спектра, как негативная симптоматика, когнитивные нарушения, депрессия, улучшению переносимости антипсихотиков (М.Ю.Дробижев и соавт., 2014).
В одном двойном слепом рандомизированном клиническом исследовании участвовали 50 пациентов с хроническим течением шизофрении. Половина пациентов были рандомизированы в группу, которая в дополнение к получаемому ими стандартному антипсихотику (типичному или атипичному) получала буспирон в дозе 30 мг/сут. Другая половина пациентов получали в дополнение к уже получаемому ими стандартному антипсихотику плацебо. Авторам этого исследования удалось показать, что адъювантное применение буспирона в дополнение к антипсихотику приводит к статистически достоверному уменьшению выраженности негативной и когнитивной симптоматики шизофрении по шкале PANSS и уменьшению выраженности депрессивной симптоматики по шкале HAM-D по сравнению с плацебо (F.Sheikhmoonesi и соавт., 2015).
Важно учитывать также фармакокинетическое потенцирование буспироном некоторых антипсихотиков. Так, в частности, одновременное применение буспирона и галоперидола приводит к повышению концентрации галоперидола в плазме почти на 26% после 6 нед терапии (D.Goff и соавт., 1991).
В еще одном двойном слепом рандомизированном клиническом исследовании, куда вошли 46 пациентов с шизофренией, больные были рандомизированы следующим образом: 23 пациента получали рисперидон в дозе 6 мг/сут плюс буспирон 60 мг/сут, а 20 пациентов – рисперидон в дозе 6 мг/сут плюс плацебо. При этом в той группе пациентов, которая получала в дополнение к рисперидону буспирон, была отмечена статистически достоверная редукция не только негативной и когнитивной, но и продуктивной симптоматики по шкале PANSS по сравнению с группой, которая получала в дополнение к рисперидону плацебо (A.Ghaleiha и соавт., 2010).
В третьем двойном слепом рандомизированном клиническом исследовании участвовали 18 пациентов с шизофренией, которые получали либо буспирон в дозах 15–30 мг/сут, либо плацебо в дополнение к антипсихотику. В этом исследовании изучалась эффективность добавления буспирона к антипсихотику в отношении только когнитивной симптоматики (эффективность в отношении негативной, продуктивной или аффективной симптоматики не исследовалась). При этом в группе буспирона не было отмечено статистически достоверного улучшения когнитивного функционирования больных по сравнению с плацебо. Авторы связали это с тем, что многие пациенты, включенные в исследование, получали в качестве антипсихотика арипипразол – атипичный антипсихотик, сам по себе весьма сильно стимулирующий 5-HT1A-рецепторы. В таких условиях маловероятно, что дополнительная стимуляция 5-HT1A-рецепторов буспироном способна привести к клинически значимому улучшению когнитивного функционирования больных, по сравнению с уже достигнутым на таком атипичном антипсихотике. Это, однако, не означает, что буспирон не может быть эффективен в данном отношении в комбинации с другим атипичным антипсихотиком, не обладающим столь сильными 5-HT1A-агонистическими свойствами (D.Piskulic и соавт., 2009).
В систематическом обзоре 2015 г., посвященном возможностям фармакотерапии коморбидной тревожности у пациентов с шизофренией, буспирон упоминается в качестве более безопасной альтернативы применению бензодиазепинов или прегабалина (сопряженному с риском развития патологического привыкания и пристрастия) или применению антидепрессантов (сопряженному с риском обострения психоза или развития маниакального состояния, нежелательными фармакокинетическими взаимодействиями между рядом антидепрессантов и антипсихотиков, риском выраженных побочных эффектов от антидепрессантов или употребления некоторых антидепрессантов, например трициклических антидепрессантов, с суицидальными целями) [H.Temmingh, D.Stein, 2015].
Синдром дефицита внимания с гиперактивностью или без таковой
Согласно имеющимся на сегодня гипотезам об этиологии и патогенезе синдрома дефицита внимания с гиперактивностью или без, в развитии этого заболевания ключевую роль играет относительный дефицит дофаминергической и норадренергической медиации в префронтальной коре. Это послужило основанием для применения при лечении синдрома дефицита внимания с гиперактивностью таких продофаминергических и пронорадренергических агентов, как антидепрессант бупропион, психостимуляторы (метилфенидат, амфетамин), некоторые антидепрессанты группы трициклических антидепрессантов (имипрамин, дезипрамин, нортриптилин), а также новый препарат для лечения синдрома дефицита внимания с гиперактивностью атомоксетин (S.Stahl, 2013).
Однако применение всех этих препаратов сопряжено с целым рядом проблем. Прежде всего препараты группы трициклических антидепрессантов достаточно плохо переносятся, имеют много побочных эффектов и относятся поэтому к средствам 2-й линии терапии при синдроме дефицита внимания с гиперактивностью. Бупропион потенциально способен вызывать судороги, атомоксетин обладает гепатотоксичностью и очень дорог, а психостимуляторы имеют риск развития психической и физической зависимости и злоупотребления ими, риск передачи или перепродажи. Кроме того, все эти препараты эффективны лишь у части пациентов с синдромом дефицита внимания с гиперактивностью, и их терапевтический эффект при этом заболевании часто бывает неполным (S.Stahl, 2013).
Все сказанное обусловливает необходимость поиска новых терапевтических подходов в лечении синдрома дефицита внимания с гиперактивностью, в частности, новых фармакологических агентов, способных оказать положительный эффект при этом заболевании, а также необходимость в изучении возможностей комбинированной терапии при синдроме дефицита внимания с гиперактивностью.
В свете этого наличие у буспирона способности косвенным механизмом, через парциальный агонизм к 5-HT1A-рецепторам, повышать содержание дофамина и норадреналина в префронтальной коре, не могло не привлечь внимания исследователей, занимающихся лечением синдрома дефицита внимания с гиперактивностью (S.Stahl, 2013).
Интерес к буспирону в лечении синдрома дефицита внимания с гиперактивностью подогревался также тем, что у D-метилфенидата, ранее считавшегося «чистым» психостимулятором, также подобно буспирону были обнаружены слабая парциальная 5-HT1A-агонистическая активность – Ki=3400 nM (J.Markowitz и соавт., 2009) и умеренная агонистическая активность по отношению к s1-рецепторам – Ki=350 nM (C.Zhang и соавт., 2012). Более того, было показано, что эти рецепторные свойства играют важную роль в механизмах реализации терапевтического эффекта метилфенидата (J.Markowitz и соавт., 2009; C.Zhang и соавт., 2012).
Первое пилотное открытое исследование эффективности буспирона в лечении синдрома дефицита внимания с гиперактивностью было проведено в 1998 г. В нем участвовали 12 детей и подростков с синдромом дефицита внимания с гиперактивностью. Буспирон использовался только в монотерапии. При этом были получены обнадеживающие предварительные результаты: буспирон оказался эффективен в уменьшении всех симптомов синдрома дефицита внимания с гиперактивностью, как гиперактивности, импульсивности и раздражительности, так и нарушений концентрации внимания, памяти и когнитивных функций (S.Malhotra, P.Santosh, 1998).
В последующем в двух рандомизированных клинических исследованиях изучалась эффективность буспирона в сопоставлении с метилфенидатом и комбинацией буспирона и метилфенидата в уменьшении симптомов синдрома дефицита внимания с гиперактивностью у детей и подростков. При этом было показано, что буспирон несколько менее эффективен в устранении симптомов синдрома дефицита внимания с гиперактивностью, чем метилфенидат, однако он лучше переносится, вызывает меньше побочных эффектов по сравнению с метилфенидатом, а комбинация буспирона и метилфенидата эффективнее монотерапии любым из них (R.Davari-Ashtiani и соавт., 2010; M.Mohammadi и соавт., 2012).
Важно отметить, что терапевтический эффект буспирона на симптоматику синдрома дефицита внимания с гиперактивностью в этих исследованиях распространялся на все субдомены симптоматики, в частности на уменьшение гиперактивности, импульсивности, раздражительности, агрессивности, нарушений концентрации внимания, когнитивных нарушений и нарушений памяти. Статистически достоверно уменьшались также проявления коморбидных с синдромом дефицита внимания с гиперактивностью депрессии и тревоги, наблюдался числовой тренд к уменьшению выраженности коморбидных тикозных и обсессивно-компульсивных проявлений (R.Davari-Ashtiani и соавт., 2010; M.Mohammadi и соавт., 2012).
В 2012 г. было проведено первое рандомизированное клиническое исследование по применению буспирона при синдроме дефицита внимания с гиперактивностью у взрослых – состоянии, при котором, как известно, эффективность психостимулятора, атомоксетина и других «традиционных» методов лечения синдрома дефицита внимания с гиперактивностью гораздо ниже, чем у детей и подростков. В этом рандомизированном клиническом исследовании было 4 группы: группа, получавшая атомоксетин + плацебо, группа, получавшая буспирон + плацебо, группа, получавшая комбинацию атомоксетина и буспирона, и группа, получавшая только плацебо (S.Sutherland и соавт., 2012).
В упомянутом исследовании участвовал 241 взрослый пациент с синдромом дефицита внимания с гиперактивностью в возрасте от 18 до 45 лет (средний возраст участников 24,5 года), в том числе 124 мужчины и 117 женщин. Исследование проводилось на протяжении 8 нед, изменения выраженности симптоматики синдрома дефицита внимания с гиперактивностью оценивались еженедельно по шкале AISRS – ADHD Adult Investigator Symptom Rating Scale (S.Sutherland и соавт., 2012).
В этом исследовании было показано, что буспирон эффективнее плацебо в уменьшении всех симптомов синдрома дефицита внимания с гиперактивностью у взрослых и сопоставим по эффективности с атомоксетином, незначительно ему уступая. Было также показано, что комбинация буспирона с атомоксетином эффективнее монотерапии любым из них в лечении синдрома дефицита внимания с гиперактивностью взрослых. Важно отметить, что терапевтический эффект буспирона или аугментации буспироном атомоксетина наступал быстро: статистически достоверные отличия от плацебо и монотерапии атомоксетином, соответственно, наблюдались с 1-й недели лечения и сохранялись до конца исследования (S.Sutherland и соавт., 2012).
Синдром Туретта и другие тикозные расстройства
В открытых пилотных исследованиях получены предварительные результаты, показывающие, что буспирон может быть эффективен в уменьшении тиков и вокализаций при синдроме Туретта и других тикозных расстройствах (S.Dursun и соавт., 1995). Также показано, что при расстройствах обсессивно-компульсивного спектра, сочетающихся с тикозными расстройствами или синдромом Туретта, добавление буспирона к серотонинергическим антидепрессантам (селективным ингибиторам обратного захвата серотонина или кломипрамину) позволяет эффективно уменьшить как обсессивно-компульсивные, так и тикозные проявления и вокализации, что авторы статьи связывают с влиянием буспирона на дофаминергические системы мозга (C.McDougle, 1994).
В относительно недавнем (2013 г.) систематическом обзоре возможностей фармакологического лечения синдрома Туретта и других тикозных расстройств указывается, что, хотя средствами 1-й линии терапии этих расстройств, безусловно, являются антипсихотики (типичные и атипичные), а также такие D2-дофаминергические антагонисты, как метоклопрамид, и такие a2-адреностимуляторы, как клонидин (клофелин), – значительная часть больных с синдромом Туретта и другими тикозными расстройствами не отвечают на терапию средствами 1-й линии, получают недостаточный, неполный эффект от них либо плохо переносят их. В этих случаях необходимо применение альтернативных средств терапии или же потенцирование (аугментация) средств 1-й линии. В качестве таких альтернативных или дополнительных средств терапии синдрома Туретта и других тикозных расстройств наряду с такими препаратами, как мемантин, центральные ингибиторы ацетилхолинэстеразы (физостигмин, галантамин, донепезил и др.), тетрабеназин и другие, рассматривается как перспективный и полезный препарат также и буспирон (C.Termine и соавт., 2013).
Расстройства аутистического спектра
Давно известно, что активация 5-HT1A-рецепторов и связанное с ней выделение окситоцина задней долей гипофиза опосредуют просоциальные эффекты «экстази» (метилендиоксиамфетамина) – мощного релизера серотонина (M.Thompson и соавт., 2007).
Между тем известно, что дефицит окситоцина, наблюдаемый при расстройствах аутистического спектра, является одной из причин нарушения социального взаимодействия, развития отгороженности и пониженной эмоциональности, а также агрессивности при них. Известно также, что интраназальное введение экзогенного окситоцина больным с расстройствами аутистического спектра частично исправляет эти нарушения и способствует улучшению их социализации и более яркому проявлению эмоций, а также лучшему распознаванию ими эмоций других людей, например по выражениям их лиц (M.Fukai и соавт., 2017).
Известно, что буспирон за счет своего парциального агонизма к 5-HT1A-рецепторам тоже вызывает усиление выделения окситоцина (P.Chiodera и соавт., 1996; K.Uvnäs-Moberg и соавт., 1996). В экспериментах на животных, как в моделях аутизма на животных, так и у интактных животных, введение буспирона приводит к повышению общительности животных, уменьшению их агрессивности, более частому проявлению дружелюбия и положительного социального взаимодействия (K.Uvnäs-Moberg и соавт., 1996).
Все сказанное дало теоретические основания для того, чтобы попытаться применить буспирон при расстройствах аутистического спектра у человека. Так, в недавнем (2016 г.) рандомизированном клиническом исследовании по применению буспирона для коррекции функционально ограниченного, стереотипного (однообразного) или навязчивого (обсессивно-компульсивного) поведения у маленьких детей с различными формами расстройства аутистического спектра, было показано, что буспирон в малой дозе (2,5 мг 2 раза в сутки) статистически достоверно эффективнее плацебо в отношении коррекции этих форм поведения, в то время как буспирон в относительно большой для данного возраста дозе (5 мг 2 раза в сутки) не показал отличий от плацебо. Дети, получавшие буспирон в дозе 2,5 мг 2 раза в сутки, в среднем проявляли более гибкое и адаптивное, более социально приемлемое, менее функционально ограниченное, менее стереотипное и однообразное поведение, чем дети, получавшие плацебо или 5 мг буспирона 2 раза в сутки. Одновременно у них улучшились социализация и общительность, дружелюбие, способность к эмоциональному реагированию и сопереживанию. Однако результаты в отношении показателей общей шкалы аутизма, а также результаты по развитию речи, когнитивных функций, уменьшению сенсорных нарушений, свойственных расстройствам аутистического спектра, в обеих дозовых группах буспирона не отличались от плацебо (D.Chugani и соавт., 2016).
Авторы данного исследования связали эту необычную дозозависимость с нелинейностью действия буспирона на серотонинергические и дофаминергические системы мозга в различных дозировках и в том числе с нелинейностью его влияния на высвобождение окситоцина (D.Chugani и соавт., 2016).
В другом рандомизированном клиническом исследовании от 2015 г. оценивали влияние буспирона на проявления агрессивности и раздражительности у детей с расстройствами аутистического спектра по сравнению с плацебо и антипсихотиком рисперидоном, а также с комбинацией буспирона и рисперидона. В этом исследовании было показано, что буспирон в отношении коррекции раздражительности и агрессивности при расстройствах аутистического спектра статистически достоверно превосходит плацебо, но уступает рисперидону, а комбинация буспирона и рисперидона эффективнее монотерапии любым из них (A.Ghanizadeh, A.Ayoobzadehshirazi, 2015).
В систематическом обзоре от 2014 г., посвященном возможностям фармакотерапии тревожности и депрессии у больных с расстройствами аутистического спектра, а также возможностям фармакотерапии тревожных расстройств и депрессивных состояний, коморбидных с расстройствами аутистического спектра, указывается, что буспирон, будучи эффективным анксиолитиком и антидепрессантом вообще, эффективен и в уменьшении тревожных и депрессивных проявлений у больных с расстройствами аутистического спектра, и в лечении нередких у них коморбидных тревожных расстройств и депрессий. При этом буспирон в отличие от бензодиазепинов не ассоциируется с нередкими у больных с расстройствами аутистического спектра парадоксальными реакциями поведенческого растормаживания, дезингибирования, с парадоксальным увеличением агрессивности и импульсивности, опьянением или миорелаксацией и не ухудшает память и когнитивные функции больных с расстройствами аутистического спектра (R.Vasa и соавт., 2014).
Кроме того, применение буспирона у больных с расстройствами аутистического спектра позволяет кроме уменьшения тревожности и депрессии также добиться уменьшения раздражительности, агрессивности, импульсивности, улучшить социализацию больных, повысить их эмоциональную реактивность, сделать их поведение более гибким и адаптивным, менее ригидным, уменьшить обсессивно-компульсивные проявления (R.Vasa и соавт., 2014).
В еще одном рандомизированном клиническом исследовании от 2014 г. сравнивали эффективность буспирона и рисперидона и их комбинации в сопоставлении с плацебо в уменьшении аутистических симптомов, раздражительности, агрессивности и антисоциального поведения у детей с фенилкетонурией. При этом было показано, что буспирон и рисперидон оба статистически достоверно эффективнее плацебо в уменьшении агрессивности, импульсивности и раздражительности, гиперактивности, стереотипий у детей с фенилкетонурией и не отличаются по эффективности между собой, а их комбинация эффективнее монотерапии любым из них. Применение буспирона ассоциировалось с меньшим количеством побочных эффектов и лучшей переносимостью, чем применение рисперидона, и, кроме того, приводило к уменьшению не только агрессивности, импульсивности и раздражительности, стереотипий, гиперактивности, но и симптомов аутизации, к улучшению социального взаимодействия детей с фенилкетонурией. Поэтому буспирон может быть предложен как альтернатива рисперидону или дополнение к рисперидону при коррекции поведенческих нарушений аутистического спектра, ассоциированных с фенилкетонурией (A.Fayyazi и соавт., 2014).
Буспирон как корректор поведения при агрессивности и раздражительности
Буспирон обладает также антиагрессивным эффектом, проявляющимся при ажитации, раздражительности и агрессивных действиях на фоне самых различных психических патологий, в частности у больных с деменцией, синдромом дефицита внимания с гиперактивностью, расстройствами аутистического спектра, черепно-мозговой травмой и др. (M.Gross, 1995). Эффективность буспирона в дозах 15–60 мг/сут отмечена как в отношении вербальной (60%), так и физической (90%) агрессии (N.Herrmannm, G.Eryavec, 1991; I. van Vliet и соавт., 1997; S.Lee и соавт., 2005; M.Levy и соавт., 2005).
Описан интересный клинический случай женщины с тяжелым расстройством аутистического спектра, глубокой умственной отсталостью и эпилепсией, проявлявшей крайне агрессивное и разрушительное поведение и находившейся на пожизненном государственном обеспечении в психиатрическом интернате. В связи с декомпенсацией и усилением агрессивности эта больная была госпитализирована в другую психиатрическую больницу. На момент госпитализации она получала высокие дозы сразу трех антипсихотиков: клозапина, арипипразола и рисперидона, что, однако, не позволяло уменьшить ее агрессивность и опасность для персонала. В процессе лечения больная была постепенно переведена на монотерапию рисперидоном, а затем на буспирон, и, когда доза буспирона была доведена до 90 мг/сут, агрессивность и раздражительность у этой больной практически полностью купировались (N.Brahm и соавт, 2008).
Буспирон как корректор когнитивных нарушений разного генеза
Данные о влиянии буспирона на когнитивные функции противоречивы. В некоторых исследованиях показано умеренное позитивное действие буспирона на когнитивные функции, в других – явного эффекта не было отмечено (J.Apter, L.Allen, 1999). В любом случае в отличие от бензодиазепинов и седативных средств буспирон не оказывает негативного влияния на когнитивные функции, что выгодно отличает его от других средств, применяемых для коррекции тревожных расстройств (S.Chamberlain и соавт., 2007).
Коррекция буспироном побочных эффектов психофармакотерапии
Экстрапирамидный синдром (псевдопаркинсонизм). Теоретической основой для применения буспирона в коррекции экстрапирамидного синдрома послужила его продофаминергическая активность, а также то, что суммарный рецепторный профиль сочетания антипсихотика и буспирона приближается к рецепторным профилям современных атипичных антипсихотиков. И действительно, в ряде открытых исследований показано, что буспирон может быть эффективен в уменьшении проявлений экстрапирамидного синдрома (лекарственного паркинсонизма), вызываемых применением антипсихотиков, в том числе у больных, получавших антипсихотики много лет и имеющих поздние дискинезии (C.Ross, 1987; L.Moss и соавт., 1993). Также попутное уменьшение проявлений экстрапирамидного синдрома и акатизии отмечалось в рандомизированном клиническом исследовании, в котором изучалась эффективность добавления к антипсихотику буспирона в уменьшении негативной и когнитивной симптоматики шизофрении (F.Sheikhmoonesi и соавт., 2015).
Акатизия. По данным открытых исследований и в опубликованных сериях случаев, буспирон может быть эффективен в коррекции акатизии, вызванной применением антипсихотиков или антидепрессантов (D.D'Mello и соавт., 1989; M.Sabaawi и соавт., 1994; M.Poyurovsky, A.Weizman, 1997). Уменьшение проявлений акатизии наряду с уменьшением экстрапирамидного синдрома и улучшением по линии негативной и когнитивной симптоматики при добавлении буспирона к антипсихотикам впоследствии подтверждено в рандомизированном клиническом исследовании (F.Sheikhmoonesi и соавт., 2015).
В нескольких вышедших в разное время систематических обзорах, посвященных возможностям фармакологической коррекции акатизии, указывается, что серотонинергические агенты, такие как парциальный 5-HT1A-агонист буспирон, 5-HT2A-антагонисты ципрогептадин, тразодон, миансерин, миртазапин, приближают суммарный рецепторный профиль при их сочетании с антипсихотиками к наиболее атипичным из них и могут быть эффективны в случаях акатизии, резистентной к стандартной терапии: холинолитическим корректорам, b-адреноблокаторам, бензодиазепинам (G.Blaisdell, 1994; J.Lohr и соавт., 2015).
В то же время описаны случаи, когда буспирон сам вызывал акатизию или усугублял ее (J.Patterson, 1988). В свете этого его применение для коррекции акатизии должно тщательно отслеживаться на предмет эффективности (J.Lohr и соавт., 2015).
Поздние дискинезии. Еще в самом начале клинического применения буспирона в психиатрии было эмпирически отмечено, что иногда его использование приводит к уменьшению или исчезновению поздних дискинезий у пациентов, подвергавшихся длительному лечению антипсихотиками (C.Ross, 1987). Впоследствии это наблюдение неоднократно подтверждалось в ряде открытых исследований. Так, в одном таком 12-недельном исследовании 1993 г., в котором участвовали 8 пациентов с тяжелыми формами поздней дискинезии, буспирон, применяемый в высоких дозах (до 180 мг/сут), оказался эффективен в подавлении или уменьшении выраженности поздних дискинезий у всех 8 (100%) пациентов. Среднее уменьшение выраженности поздних дискинезий по шкале аномальных движений составило 4,4 балла. Параллельно отмечалось уменьшение выраженности экстрапирамидного синдрома и акатизии (L.Moss и соавт., 1993). Авторы данного исследования призвали к изучению эффективности буспирона при поздних дискинезиях в формате масштабных хорошо контролируемых рандомизированных клинических исследований.
Вместе с тем те же авторы предостерегают от трактовки этих результатов как чрезмерно обнадеживающих. В частности, они отмечают, что буспирон сам является слабым D2-антагонистом и в применявшихся ими довольно высоких дозах может терять селективность к пресинаптическим D2-рецепторам. Поэтому авторы не могут исключить, что эффективность буспирона в подавлении поздних дискинезий имеет сходство с эффектом временного подавления поздних дискинезий при увеличении дозы антипсихотика. Если это так, то со временем состояние такого больного может стать еще хуже, а поздняя дискинезия еще более выраженной. Поэтому они призвали к изучению эффективности и безопасности буспирона в лечении поздних дискинезий также в лонгитудинальном, на протяжении нескольких лет, разрезе (L.Moss и соавт., 1993).
В свежем (2017 г.) систематическом обзоре возможностей лечения поздних дискинезий указывается, что общепринятых, стандартных методов лечения поздних дискинезий, прошедших проверку доказательной медициной на уровне рандомизированных клинических исследований, на данный момент не существует. Буспирон наряду с такими фармакологическими агентами, как витамин E, мелатонин, баклофен, местные инъекции ботулинического токсина в затронутые поздней дискинезией мышцы и другие, рассматривается авторами обзора как одна из приемлемых альтернатив, имеющих доказательную базу хотя бы на уровне открытых исследований. Авторы призвали к организации рандомизированных клинических исследований по лечению поздних дискинезий (H.Bergman и соавт., 2017).
Ночной бруксизм. Многие психофармакологические препараты, в частности антидепрессанты класса селективных ингибиторов обратного захвата серотонина и селективных ингибиторов обратного захвата серотонина и норадреналина, а также антипсихотики, психостимуляторы (амфетамин, метилфенидат) и атомоксетин, способны вызывать ночной бруксизм (спазм мышц нижней челюсти, вызывающий скрежетание зубов). Этот побочный эффект далеко не безобиден. Он может приводить к повреждению или преждевременному истиранию зубов, возникновению хронических головных болей напряжения, заболеваний десен, развитию дисфункции височно-нижнечелюстного сустава. Известны даже случаи самоубийства больных из-за невыносимых болей в височно-нижнечелюстном углу, вызванных наличием бруксизма (R.Çolak Sivri, Ö.Akça, 2016).
Природа этого явления остается загадочной. Одни авторы связывают этот побочный эффект с непрямой антидофаминергической активностью селективных ингибиторов обратного захвата серотонина и селективных ингибиторов обратного захвата серотонина и норадреналина или прямым антидофаминергическим действием антипсихотиков, снижением дофаминергической активности в нигростриарной системе под влиянием повышенного уровня серотонина или в результате блокады D2-рецепторов и рассматривают его как одно из проявлений экстрапирамидного синдрома или как некий аналог акатизии (R.Çolak Sivri, Ö.Akça, 2016). Другие же авторы придают большее значение способности упомянутых психотропных препаратов нарушать фазовую структуру сна, в частности изменять соотношение REM-фазы и фазы глубокого сна без движений глаз, и рассматривают ночной бруксизм как вариант диссомнического расстройства (A.Milanlıoglu, 2012).
Общепринятых и стандартных методов коррекции этого побочного эффекта, прошедших проверку доказательной медициной на уровне рандомизированных клинических исследований, пока не существует (R.Çolak Sivri, Ö.Akça, 2016). Поэтому разные специалисты эмпирически с определенным успехом пытаются применять для коррекции ночного бруксизма, вызываемого применением психофармакотерапии, различные препараты, в частности бензодиазепины, b-адреноблокаторы, баклофен, прегабалин или габапентин, антихолинергические и дофаминергические препараты и др. (M.Yüce и соавт., 2013). Внимание специалистов, сталкивающихся с этим побочным эффектом, в качестве перспективного корректора привлек также буспирон, обладающий одновременно как продофаминергическими свойствами и способностью уменьшать экстрапирамидный синдром и акатизию, так и нормализующим влиянием на фазовую структуру сна, способностью уменьшать количество и длительность REM-фаз в течение ночи (A.Milanlıoglu, 2012; R.Çolak Sivri, Ö.Akça, 2016).
В литературе описаны серии случаев, показывающие, что буспирон может быть эффективен в коррекции ночного бруксизма, вызываемого приемом самых разных селективных ингибиторов обратного захвата серотонина и селективных ингибиторов обратного захвата серотонина и норадреналина, в частности флуоксетина (R.Çolak Sivri, Ö.Akça, 2016), пароксетина (A.Milanlıoglu, 2012), сертралина (J.Bostwick, M.Jaffee, 1999), циталопрама (M.Wise, 2001), дулоксетина (O.Şahin, F.Malas, 2015), венлафаксина (M.Kuloglu и соавт., 2010).
Буспирон также эффективен в коррекции ночного бруксизма, вызываемого приемом атомоксетина или психостимуляторов (M.Yüce и соавт., 2013).
В одном из последних систематических обзоров, посвященных правильному выбору антидепрессанта при депрессиях и тревожных расстройствах при уже имеющемся у пациента коморбидном ночном бруксизме или темпоро-мандибулярном синдроме, указывается, что селективные ингибиторы обратного захвата серотонина и селективные ингибиторы обратного захвата серотонина и норадреналина не являются оптимальным выбором в этой клинической ситуации и что у таких больных предпочтительно применять альтернативные антидепрессанты из классов трициклических антидепрессантов, обратимых ингибиторов моноаминоксидазы или атипичных антидепрессантов, применение которых не ассоциируется с усилением или появлением бруксизма. Эти же авторы указывают, что если все же возникает клиническая необходимость применения у такого пациента именно селективных ингибиторов обратного захвата серотонина или селективных ингибиторов обратного захвата серотонина и норадреналина (например, вследствие отсутствия эффекта или непереносимости альтернативных антидепрессантов), то разумной стратегией является добавление к селективным ингибиторам обратного захвата серотонина или селективным ингибиторам обратного захвата серотонина и норадреналина буспирона с самого начала, с тем чтобы предотвратить возможное усугубление бруксизма или болей в височно-нижнечелюстном углу (R.Rajan, Y.Sun, 2017).
Сексуальные расстройства. Еще в самом начале клинического применения буспирона при тревожных расстройствах, уже в 1987 г. (всего через 1 год после его регистрации FDA для генерализованного тревожного расстройства), западные специалисты обратили внимание на то, что сам по себе буспирон в отличие от многих антидепрессантов (в частности, от препаратов класса селективных ингибиторов обратного захвата серотонина) не только не дает сексуальных побочных эффектов, но и нередко приводит к повышению либидо и улучшению сексуального функционирования больных (E.Othmer, S.Othmer, 1987).
Уже в 1999 г. в одном из первых рандомизированных клинических исследований, посвященных изучению эффективности буспирона в качестве корректора сексуальных побочных эффектов от селективных ингибиторов обратного захвата серотонина и селективных ингибиторов обратного захвата серотонина и норадреналина, было показано, что буспирон статистически достоверно эффективнее плацебо в этом качестве. Его положительное воздействие распространяется на все параметры сексуального функционирования, в частности на уровень либидо, качество и яркость оргазма, силу эрекции у мужчин, качество любрикации у женщин, возможность достижения оргазма. Предполагается, что механизм этого просексуального действия буспирона связан с его продофаминергическим действием и регулирующим воздействием на серотонинергическую нейропередачу, уменьшением ее при вызванной селективными ингибиторами обратного захвата серотонина гиперактивности (M.Landen и соавт., 1999).
Последующие исследования это неоднократно подтверждали. В нескольких последних систематических обзорах, посвященных способам коррекции сексуальных побочных эффектов при применении селективных ингибиторов обратного захвата серотонина и селективных ингибиторов обратного захвата серотонина и норадреналина, буспирону наряду с такими препаратами, как тразодон (Триттико), миртазапин (Ремерон), ципрогептадин (Перитол), йохимбин, дофаминергические препараты, отводится одно из первых мест как в отношении эффективности коррекции сексуальных побочных эффектов, так и в отношении переносимости и количества собственных побочных эффектов корректора (A.Clayton и соавт., 2014; R.Howland, 2015).
Важно отметить также, что комбинированное применение буспирона с 5-HT2A/С-антагонистами, такими как упомянутые тразодон или миртазапин, или с дофаминергическими препаратами, такими как бупропион или прамипексол, повышает эффективность коррекции сексуальных побочных эффектов от селективных ингибиторов обратного захвата серотонина или селективных ингибиторов обратного захвата серотонина и норадреналина и позволяет устранить их у пациентов, резистентных к монокоррекции (A.Clayton и соавт., 2014; R.Howland, 2015).
Тошнота, рвота, анорексия. Серотониновые 5-HT1A-рецепторы в триггерной зоне и рвотном центре мозга колокализованы рядом с 5-HT3-рецепторами и рецепторами к нейрокинину-1 (NK1-рецепторами) на поверхности одних и тех же клеток. При этом стимуляция 5-HT1A-рецепторов приводит к реципрокному угнетению активности 5-HT3- и NK1-рецепторов (P.Kranke и соавт., 2012).
В связи с этим 5-HT1A-агонисты, в частности буспирон, обладают противорвотной активностью, реализующейся в таких разных клинических ситуациях, как послеоперационная тошнота и рвота (P.Kranke и соавт., 2012), тошнота и рвота при химиотерапии и радиотерапии опухолей и др.
(A.Alfieri, L.Cubeddu, 1995). Между тем применение антидепрессантов, в частности таких как селективные ингибиторы обратного захвата серотонина и селективные ингибиторы обратного захвата серотонина и норадреналина, нередко приводит к развитию в начале терапии тошноты, рвоты, снижения аппетита вплоть до анорексии вследствие чрезмерной стимуляции гиперчувствительных при депрессивных и тревожных состояниях 5-HT3-рецепторов. По мере их десенситизации при продолжении терапии тошнота, рвота и снижение аппетита постепенно проходят (S.Stahl, 2013).
В свете сказанного буспирон наряду с другими возможными корректорами тошноты, рвоты и анорексии, такими как оланзапин или метоклопрамид, может использоваться в том числе для профилактики тошноты, рвоты и анорексии в начале терапии селективными ингибиторами обратного захвата серотонина или селективными ингибиторами обратного захвата серотонина и норадреналина (S.Stahl, 2013).
Головная боль. Данный побочный эффект является нередким (>10%) в начале терапии селективными ингибиторами обратного захвата серотонина или селективными ингибиторами обратного захвата серотонина и норадреналина, достаточно специфичным именно для этой группы антидепрессантов и достаточно редко отмечающимся при применении трициклических антидепрессантов. Предполагаемым патофизиологическим механизмом развития головной боли в начале терапии селективными ингибиторами обратного захвата серотонина или селективными ингибиторами обратного захвата серотонина и норадреналина является то, что нисходящие серотонинергические проводящие пути, в зависимости от их типа, обладают двояким воздействием на уровень восприятия болевого сигнала – антиноцицептивным или, наоборот, усиливающим восприятие боли. Поэтому селективные ингибиторы обратного захвата серотонина или селективные ингибиторы обратного захвата серотонина и норадреналина, усиливая активность как тех, так и других проводящих путей, в начале терапии могут усиливать восприятие боли. В сочетании с вызываемым ими повышением мышечного тонуса (в том числе тонуса мышц шеи, волосистой части головы, мимических мышц лица) это может способствовать возникновению или учащению головных болей напряжения. Для реализации же анальгетического эффекта необходима одновременная и сбалансированная стимуляция серотонинергических и норадренергических проводящих путей (S.Stahl, 2013).
В то же время буспирон как препарат, обладающий способностью уменьшать избыточную серотонинергическую активность в центральную нервную систему, косвенно усиливать норадренергическую и дофаминергическую нейропередачу, а также увеличивать секрецию b-эндорфина, эффективен в профилактике головных болей напряжения, как спонтанных, так и вызванных началом применения селективных ингибиторов обратного захвата серотонина или селективных ингибиторов обратного захвата серотонина и норадреналина, пероральных контрацептивов и других известных провокаторов головных болей напряжения (D.Mitsikostas и соавт., 1997).
Вялость, утомляемость, анергия и другие проявления апатии, вызванной селективными ингибиторами обратного захвата серотонина. Известно, что селективные ингибиторы обратного захвата серотонина при длительном приеме нередко вызывают апатию (SSRI apathy syndrome), проявляющуюся такими симптомами, как вялость, утомляемость, апатия, сонливость, снижение энергии, мотивации, повседневной активности при нередко формально «неплохом» настроении и отсутствии видимых признаков депрессии (что отличает данный синдром от недолеченной резидуальной депрессии). Этот побочный эффект данного класса препаратов так же, как и их сексуальные побочные эффекты, связывают с ограниченностью их нейрохимического эффекта – с их влиянием только на серотонинергическую нейропередачу и реципрокным подавлением под влиянием избытка серотонина норадренергической и дофаминергической нейропередачи (S.Stahl, 2013).
В полном соответствии с этой теорией для купирования данного побочного эффекта, а также для усиления антидепрессивного эффекта селективных ингибиторов обратного захвата серотонина и расширения спектра их нейрохимического действия с определенным успехом добавляют к селективным ингибиторам обратного захвата серотонина различные норадренергические (например, ребоксетин, миртазапин или малые дозы трициклических антидепрессантов) или дофаминергические (например, бупропион, психостимуляторы) препараты (S.Stahl, 2013).
Буспирон как препарат, обладающий способностью косвенным механизмом повышать норадренергическую и дофаминергическую нейропередачу в центральную нервную систему и оказывать регулирующее влияние на серотонинергическую, уменьшая ее при вызванной селективными ингибиторами обратного захвата серотонина гиперактивности, тоже предложен для уменьшения или устранения апатии, вызванной селективными ингибиторами обратного захвата серотонина, вялости, утомляемости и сонливости на фоне приема селективных ингибиторов обратного захвата серотонина или селективных ингибиторов обратного захвата серотонина и норадреналина (T.Green, 1997; S.Stahl, 2013) и для повышения эффективности терапии селективными ингибиторами обратного захвата серотонина и селективными ингибиторами обратного захвата серотонина и норадреналина и расширения спектра их действия (Y.Fang и соавт., 2011; P.Bech и соавт., 2012). Опять-таки применение буспирона в сочетании с другим корректором позволяет преодолеть апатию, вызванную селективными ингибиторами обратного захвата серотонина, в случаях, резистентных к монокоррекции (S.Stahl, 2013).
Завершая обзор имеющейся доказательной базы по применению буспирона при различных психических расстройствах, а также в качестве корректора побочных эффектов от психофармакотерапии, для удобства читателя мы приводим сводные табл. 1, 2 с уровнями доказательности для применения буспирона в разных клинических ситуациях.


Выводы
Как видно из приведенных нами данных литературы, буспирон является высокоэффективным анксиолитиком при широком спектре тревожных расстройств. Наиболее убедительна на сегодняшний день доказательная база для применения буспирона при генерализованном тревожном расстройстве. Однако имеющиеся данные свидетельствуют о том, что буспирон также может быть эффективен в качестве анксиолитика и при других тревожных расстройствах, в частности социальном тревожном расстройстве, паническом расстройстве, посттравматическом стрессовом расстройстве.Кроме того, убедительная доказательная база имеется также для применения буспирона в качестве потенцирующего агента к антидепрессантам при депрессивных и тревожно-депрессивных расстройствах.
Буспирон может быть эффективен и в качестве потенцирующего агента к антидепрессантам при обсессивно-компульсивном расстройстве и ряде других расстройств обсессивно-компульсивного спектра, в частности при трихотилломании, дисморфофобии, клептомании.
Имеющиеся данные указывают также на возможную эффективность буспирона в уменьшении негативной, когнитивной, тревожной и депрессивной симптоматики в рамках шизофрении и других расстройств шизофренического спектра, в коррекции таких побочных эффектов от психофармакотерапии, как сексуальные расстройства, экстрапирамидный синдром, акатизия, бруксизм, тошнота и рвота, головные боли, апатия, вызванная селективными ингибиторами обратного захвата серотонина в лечении синдрома дефицита внимания с гиперактивностью, уменьшении ряда проявлений расстройств аутистического спектра, неспецифическом купировании проявлений агрессивности, раздражительности и импульсивности на фоне разных психических расстройств.
Сведения об авторах
Быков Юрий Витальевич – ФГБОУ ВО СтГМУ. E-mail: yubykov@gmail.comБеккер Роман Александрович – исследователь в области психофармакотерапии, Университет им. Давида Бен-Гуриона в Негеве
Список исп. литературыСкрыть список1. Арана Д, Розенбаум Д. Фармакотерапия психических расстройств. Пер. с англ. под ред. С.Н.Мосолова. М.: БИНОМ. Лаборатория знаний, 2004. / Arana D, Rozenbaum D. Farmakoterapiia psikhicheskikh rasstroistv. Per. s angl. pod red. S.N.Mosolova.
M.: BINOM. Laboratoriia znanii, 2004. [in Russian]
2. Васильева А.В. и др. Применение спитомина (буспирон) в комбинированной терапии панического расстройства. Журн. неврологии и психиатрии им. C.C.Корсакова. 2015; 115 (11): 63–71. / Vasil'eva A.V. i dr. Primenenie spitomina (buspiron) v kombinirovannoi terapii panicheskogo rasstroistva. Zhurn. nevrologii i psikhiatrii im. C.C.Korsakova. 2015; 115 (11): 63–71. [in Russian]
3. Дамулин И.В., Суворова И.А. Современная концепция повышения эффективности терапии антидепрессантами. Журн. неврологии и психиатрии им. C.C.Корсакова. 2015; 115 (3): 106–12. / Damulin I.V., Suvorova I.A. Sovremennaia kontseptsiia povysheniia effektivnosti terapii antidepressantami. Zhurn. nevrologii i psikhiatrii im. C.C.Korsakova. 2015; 115 (3): 106–12. [in Russian]
4. Дзампаев А.Т., Суворова И.А., Дамулин И.В. Клинический потенциал и перспективы применения препарата буспирон в терапии тревожных расстройств. Журн. неврологии и психиатрии им. C.C.Корсакова. 2014; 114 (8): 94–104. / Dzampaev A.T., Suvorova I.A., Damulin I.V. Klinicheskii potentsial i perspektivy primeneniia preparata buspiron v terapii trevozhnykh rasstroistv. Zhurn. nevrologii i psikhiatrii im. C.C.Korsakova. 2014; 114 (8): 94–104. [in Russian]
5. Дробижев М.Ю. и др. Рациональный выбор препарата на основе представлений о патогенезе психического расстройства и механизме его действия. Журн. неврологии и психиатрии им. C.C.Корсакова. Спецвып. 2014; 114 (11): 15–21. / Drobizhev M.Iu. i dr. Ratsional'nyi vybor preparata na osnove predstavlenii o patogeneze psikhicheskogo rasstroistva i mekhanizme ego deistviia. Zhurn. nevrologii i psikhiatrii im. C.C.Korsakova. Spetsvyp. 2014; 114 (11): 15–21. [in Russian]
6. Инструкция по медицинскому применению препарата спитомин (буспирон), 2014. / Instruktsiia po meditsinskomu primeneniiu preparata spitomin (buspiron), 2014. [in Russian]
7. Левин О.С. Применение буспирона в клинической практике. Журн. неврологии и психиатрии им. C.C.Корсакова. 2015; 115 (4): 83–7. / Levin O.S. Primenenie buspirona v klinicheskoi praktike. Zhurn. nevrologii i psikhiatrii im. C.C.Korsakova. 2015; 115 (4): 83–7. [in Russian]
8. Alfieri AB, Cubeddu LX. Comparative efficacy of a single oral dose of ondansetron and of buspirone against cisplatin-induced emesis in cancer patients. Br J Cancer 1995; 72 (4): 1013–5.
9. Allen LE, Ferguson HC, Kissel JW. Psychosedative agents. 2. 8-(4-Substituted 1-piperazinylalkyl)-8-azaspiro (4.5) decane-7, 9-diones.
J Med Chem 1972; 15 (5): 477–9.
10. Apter JT, Allen LA. Buspirone: future directions. J Clin Psychopharmacol 1999; 19 (1): 86–93.
11. Bailey DG, Dresser G, Arnold JMO. Grapefruit-medication interactions: forbidden fruit or avoidable consequences? Can Med Assoc
J 2013; 185 (4): 309–16.
12. Baldwin DS et al. Evidence-based guidelines for the pharmacological treatment of anxiety disorders: recommendations from the British Association for Psychopharmacology. J Psychopharmacol 2005; 19 (6): 567–96.
13. Bech P et al. Outcomes on the pharmacopsychometric triangle in bupropion‐SR vs. buspirone augmentation of citalopram in the STAR* D trial. Acta Psychiatr Scand 2012; 125(4): 342–8.
14. Becker C, Hamon M, Benoliel JJ. Prevention by 5-HT1A receptor agonists of restraint stress-and yohimbine-induced release of cholecystokinin in the frontal cortex of the freely moving rat. Neuropharmacology 1999; 38 (4): 525–32.
15. Berger A et al. Magnitude of potentially inappropriate prescribing in Germany among older patients with generalized anxiety disorder. BMC Geriatr 2009; 9 (1): 31.
16. Bergman H et al. Systematic review of interventions for treating or preventing antipsychotic-induced tardive dyskinesia. Health Technol Assess 2017; 21 (43): 1–248.
17. Bernardy NC et al. Prescribing trends in veterans with posttraumatic stress disorder. J Сlin Psychiatry 2012; 73 (3): 297–303.
18. Blaisdell GD. Akathisia: a comprehensive review and treatment summary. Pharmacopsychiatry 1994; 27 (4): 139–46.
19. Blier P, Ward NM. Is there a role for 5-HT1A agonists in the treatment of depression? Biol Psychiatry 2003; 53 (3): 193–203.
20. Bonhaus DW et al. RS-102221: a novel high affinity and selective,
5-HT2C receptor antagonist. Neuropharmacology 1997; 36 (4): 621–9.
21. Bostwick JM, Jaffee MS. Buspirone as an antidote to SSRI-induced bruxism in 4 cases. J Clin Psychiatry 1999; 60 (12): 857–60.
22. Brahm NC, Fast GA, Brown RC. Buspirone for autistic disorder in a woman with an intellectual disability. Ann Pharmacother 2008; 42 (1): 131–7.
23. Buspirone monograph. Drugs.com. 1986. FDA Approval Committee.
24. Campbell BCA et al. Interventions for treating anxiety after stroke. Cochrane Database Syst Rev 2011; 12: CD008860.
25. Chamberlain SR et al. Lack of deleterious effects of buspirone on cognition in healthy male volunteers.J Psychopharmacol 2007;
21 (2): 210–5.
26. Chessick CA et al. Azapirones for generalized anxiety disorder. Cochrane Database Syst Rev (Online) 2006; 3: CD006115.
27. Chiodera P et al. Different effects of the serotonergic agonists buspirone and sumatriptan on the posterior pituitary hormonal responses to hypoglycemia in humans. Neuropeptides 1996; 30 (2): 187–92.
28. Chugani DC et al. Efficacy of low-dose Buspirone for restricted and repetitive behavior in young children with autism spectrum disorder. A Randomized Trial. J Pediatr 2016; 170: 45–53, e1–4.
29. Clayton AH et al. Sexual dysfunction associated with major depressive disorder and antidepressant treatment. Exp Opinion Drug Saf 2014; 13 (10): 1361–74.
30. Çolak Sivri R, Akça ÖF. Buspirone in the Treatment of Fluoxetine-Induced Sleep Bruxism. J Child Adolesc Psychopharmacol 2016; 26 (8): 762–3.
31. Cottraux J et al. A controlled study of cognitive behaviour therapy with buspirone or placebo in panic disorder with agoraphobia. Br
J Psychiatr 1995; 167 (5): 635–41.
32. Davari-Ashtiani R et al. Buspirone versus methylphenidate in the treatment of attention deficit hyperactivity disorder: a double-blind and randomized trial. Child Psychiatry Hum Dev 2010; 41 (6): 641–8.
33. Davidson JR et al. Efficacy, safety, and tolerability of venlafaxine extended release and buspirone in outpatients with generalized anxiety disorder. J Сlin Psychiatry 1999; 60 (8): 528.
34. Dimitriou EC, Dimitriou CE. Buspirone augmentation of antidepressant therapy. J Сlin Psychopharmacol 1998; 18 (6): 465.
35. D'Mello DA, McNeil JA, Harris W. Buspirone suppression of neuroleptic-induced akathisia: multiple case reports. J Сlin Psychopharmacol 1989; 9 (2): 151–2.
36. Duffy JD, Malloy PF. Efficacy of buspirone in the treatment of posttraumatic stress disorder: an open trial. Ann Clinical Psychiatry 1994; 6 (1): 33–7.
37. Duggal HS et al. Sertraline and buspirone in adolescent delusional body dysmorphic disorder. Indian J Psychiatr 2001; 43 (4): 370–1.
38. Durst R et al. Kleptomania: phenomenological, clinical and legal aspects. Harefuah 1997; 33 (10): 441–4, 502–3.
39. Durst R, Katz G, Knobler HY. Buspirone augmentation of fluvoxamine in the treatment of kleptomania. J Nerv Ment Dis 1997; 185 (9): 586–7.
40. Dursun SM, Burke JG, Reveley MA. Buspirone treatment of Tourette's syndrome. Lancet 1995; 345 (8961): 1366–7.
41. Fang Y et al. A pilot study of the efficacy and safety of paroxetine augmented with risperidone, valproate, buspirone, trazodone, or thyroid hormone in adult Chinese patients with treatment-resistant major depression. J Clin Psychopharmacol 2011; 31 (5): 638–42.
42. Fava M. The combination of buspirone and bupropion in the treatment of depression. Psychother Psychosom 2007; 76 (5): 311–2.
43. Fayyazi A et al. A Comparison of Risperidone and Buspirone for Treatment of Behavior Disorders in Children with Phenylketonuria.
Ir J Child Neurology 2014; 8 (4): 33–8.
44. Fichtner CG, Crayton JW. Buspirone in combat-related posttraumatic stress disorder. J Clin Psychopharmacol 1994; 14 (1): 79–81.
45. Fukai M et al. Oxytocin effects on emotional response to others' faces via serotonin system in autism: A pilot study. Psychiatry Res 2017; 267: 45–50.
46. Gammans RE, Mayol RF, Labudde JA. Metabolism and disposition of buspirone. Am J Med 1986; 80 (3): 41–51.
47. Ghaleiha A et al. A double-blind, randomized, and placebo-controlled trial of buspirone added to risperidone in patients with chronic schizophrenia. J Clin Psychopharmacol 2010; 30 (6): 678–82.
48. Ghanizadeh A, Ayoobzadehshirazi A. A randomized double-blind placebo-controlled clinical trial of adjuvant buspirone for irritability in autism. Pediatr Neurol 2015; 52 (1): 77–81.
49. Goff DC et al. An open trial of buspirone added to neuroleptics in schizophrenic patients. J Сlin Psychopharmacol 1991; 11 (3): 193–7.
50. Goldberg HL. Buspirone – a new antianxiety agent not chemically related to any presently marketed drugs (proceedings). Psychopharmacol Bull 1979; 15 (2): 90–2.
51. Grady TA et al. Double-blind study of adjuvant buspirone for fluoxetine-treated patients with obsessive-compulsive disorder. Am
J Psychiatry 1993; 150: 819.
52. Green TR. Bupropion for SSRI-induced fatigue. J Clin Psychiatry 1997; 58 (4): 174.
53. Gross MD. Buspirone in ADHD with ODD. J Am Acad Child Adolescent Psychiatry 1995; 34 (10): 1260.
54. Halaby A, Haddad R, Naja W. Non-Antidepressant Treatment of Social Anxiety Disorder: A Review. Curr Clin Pharmacology 2015;
10 (2): 126–30.
55. Hamik A et al. Analysis of tandospirone (SM-3997) interactions with neurotransmitter receptor binding sites. Biol Psychiatry 1990; 28 (2): 99–109.
56. Hamner M, Ulmer H, Horne D. Buspirone potentiation of antidepressants in the treatment of PTSD. Depress Anxiety 1997; 5 (3): 137–9.
57. Harvey KV, Balon R. Augmentation with buspirone: a review. Ann Clin Psychiatry 1995; 7 (3): 143–7.
58. Herrmann N, Eryavec G. Buspirone in the management of agitation and aggression associated with dementia. Am J Geriatr Psychiatry 1993; 1 (3): 249–53.
59. Holttum JR, Lubetsky MJ, Eastman LE. Comprehensive management of trichotillomania in a young autistic girl. J Am Acad Child Adolesc Psychiatry 1994; 33 (4): 577–81.
60. Howland RH. Buspirone: back to the future. J Psychosoc Nurs Ment Health Servic 2015; 53 (11): 21–4.
61. Itzhak Y, Ruhland M, Krähling H. Binding of umespirone to the σ receptor: Evidence for multiple affinity states. Neuropharmacology 1990; 29 (2): 181–4.
62. Jacobsen FM. Possible augmentation of antidepressant response by buspirone. J Clin Psychiatry 1991; 52 (5): 217–20.
63. Jann MW. Buspirone: an update on a unique anxiolytic agent. Pharmacotherapy: J Hum Pharmacol Drug Ther 1988; 8 (2): 100–16.
64. Kranke P et al. Intravenous buspirone for the prevention of postoperative nausea and vomiting. Euro J Clin Pharmacol 2012; 68 (11): 1465–72.
65. Kuloglu M, Ekinci O, Caykoylu A. Venlafaxine-associated nocturnal bruxism in a depressive patient successfully treated with buspirone. J Psychopharmacol 2010; 24 (4): 627–8.
66. Landen M et al. Effect of buspirone on sexual dysfunction in depressed patients treated with selective serotonin reuptake inhibitors.
J Clin Pharmacol 1999; 19 (3): 268–71.
67. LaPorta LD, Ware MR. Buspirone in the Treatment of Posttraumatic Stress Disorder. J Clin Pharmacol 1992; 12 (2): 133–4.
68. Lee ST, Park JH, Kim M. Efficacy of the 5‐HT1A Agonist, Buspirone Hydrochloride, in Migraineurs With Anxiety: A Randomized, Prospective, Parallel Group, Double‐Blind, Placebo‐Controlled Study. Headache: J Head Face Pain 2005; 45 (8): 1004–11.
69. Levy M et al. Treatment of agitation following traumatic brain injury: a review of the literature. NeuroRehabilitation 2005; 20 (4): 279–306.
70. Lilja JJ et al. Grapefruit juice substantially increases plasma concentrations of buspirone. Clin Pharmacol Ther 1998; 64 (6): 655–60.
71. Loane C, Politis M. Buspirone: what is it all about? Br Res 2012; 1461: 111–8.
72. Lohr JB et al. The clinical challenges of akathisia. CNS Spectrums 2015; 20: (S1): 1–16.
73. Lovenberg TW et al. A novel adenylyl cyclase-activating serotonin receptor (5-HT7) implicated in the regulation of mammalian circadian rhythms. Neuron 1993; 11 (3): 449–58.
74. Mahmood I, Sahajwalla C. Clinical pharmacokinetics and pharmacodynamics of buspirone, an anxiolytic drug. Clin Pharmacokinet 1999; 36 (4): 277–87.
75. Malhotra S, Santosh PJ. An Open Clinical Trial of Buspirone in Children With Attention‐Deficit/Hyperactivity Disorder. J Am Acad Child Adolesc Psychiatry 1998; 37 (4): 364–71.
76. Markowitz JS et al. The psychostimulant d-threo-(R, R)-methylphenidate binds as an agonist to the 5HT1A receptor. Die Pharmazie – Int J Pharmaceutic Sci 2009; 64 (2): 123–5.
77. Masdrakis VG, Turic D, Baldwin DS. Pharmacological treatment of social anxiety disorder. Anxiety Dis Karger Publishers 2013; 29: 144–53.
78. McDougle CJ, Goodman WK, Leckman JF. Limited therapeutic effect of addition of buspirone in fluvoxamine-refractory obsessive-compulsive disorder. Am J Psychiatry 1993; 150: 647–9.
79. McDougle C. J., Goodman W. K., Price L. H. Dopamine antagonists in tic-related and psychotic spectrum obsessive compulsive disorder.
J Clin Psychiatry 1994; 55: 24–31.
80. Milanlıoglu A. Paroxetine-induced severe sleep bruxism successfully treated with buspirone. Clinics 2012; 67 (2): 191–2.
81. Mitsikostas DD et al. Buspirone vs amitriptyline in the treatment of chronic tension‐type headache. Acta Neurol Scand 1997; 96 (4): 247–51.
82. Mohammadi MR et al. Buspirone versus Methylphenidate in the Treatment of Children with Attention-Deficit/Hyperactivity Disorder: Randomized Double-Blind Study. Acta Med Ir 2012; 50 (11): 723–8.
83. Mokhber N et al. Randomized, single‐blind, trial of sertraline and buspirone for treatment of elderly patients with generalized anxiety disorder. Psychiatr Сlin Neuroscienc 2010; 64 (2): 128–33.
84. Moss LE, Neppe VM, Drevets WC. Buspirone in the treatment of tardive dyskinesia. J Clin Psychopharmacol 1993; 13 (3): 204–9.
85. Munjack DJ et al. A pilot study of buspirone in the treatment of social phobia. J Anxiety Disorders 1991; 5 (1): 87–98.
86. Navinés R et al. Interaction between serotonin 5-HT1A receptors and b-endorphins modulates antidepressant response. Progress in Neuro-Psychopharmacology and Biological Psychiatry 2008; 32 (8): 1804–9.
87. Onrust SV, McClellan K. Perospirone. CNS Drugs 2001; 15 (4): 329–37.
88. Othmer E, Othmer SC. Effect of buspirone on sexual dysfunction in patients with generalized anxiety disorder. J Clin Psychiatry 1987; 48 (5): 201–3.
89. Patterson JF. Akathisia associated with buspirone. J Clin Psychopharmacol 1988; 8 (4): 296–7.
90. Phillips KA. An open study of buspirone augmentation of serotonin-reuptake inhibitors in body dysmorphic disorder. Psychopharmacol Bull 1996; 32 (1): 175–80.
91. Phillips KA et al. Effectiveness of pharmacotherapy for body dysmorphic disorder: a chart-review study. J Clin Psychiatry 2001;
62 (9): 721–7.
92. Phillips KA, Hollander E. Treating body dysmorphic disorder with medication: evidence, misconceptions, and a suggested approach. Body Image 2008; 5 (1): 13–27.
93. Piškulić D et al. Treatment of cognitive dysfunction in chronic schizophrenia by augmentation of atypical antipsychotics with buspirone, a partial 5‐HT1A receptor agonist. Hum Psychopharmacol: Clin Exp 2009; 24 (6): 437–46.
94. Plassat JL, Amlaiky N, Hen R. Molecular cloning of a mammalian serotonin receptor that activates adenylate cyclase. Mol Pharmacol 1993; 44 (2): 229–36.
95. Poyurovsky M, Weizman A. Serotonergic agents in the treatment of acute neuroleptic-induced akathisia: open-label study of buspirone and mianserin. Int Clin Psychopharmacol 1997; 12 (5): 263–8.
96. Rajan R, Sun Y. Reevaluating Antidepressant Selection in Patients With Bruxism and Temporomandibular Joint Disorder. J Psychiatr Practice 2017; 23 (3): 173–9.
97. Rajewski A, Rybakowski F. Efficacy of buspirone and fluoxetine in short-term treatment of bulimia nervosa. Psychiatr Pol 2006;
40 (1): 75–82.
98. Reid TL. Treatment of generalized anxiety disorder and trichotillomania with buspirone. Am J Psychiatry 1992; 149 (4): 573–4.
99. Rickels K et al. Buspirone and diazepam in anxiety: a controlled study. J Clin Psychiatry 1982; 43 (12 Pt. 2): 81–6.
100. Rickels K et al. Buspirone in major depression: a controlled study.
J Clin Psychiatry 1991; 52 (1): 34–8.
101. Robinson DS et al. Clinical effects of the 5-HT1A partial agonists in depression: a composite analysis of buspirone in the treatment of depression. J Clin Psychopharmacol 1990; 10 (Suppl. 3): 67S–76S.
102. Ross C. A. Buspirone in the treatment of tardive dyskinesia. Med Hypotheses 1987; 22 (3): 321–8.
103. Ruat M et al. Molecular cloning, characterization, and localization of a high-affinity serotonin receptor (5-HT7) activating cAMP formation. Proc Nat Acad Sci USA 1993; 90 (18): 8547–51.
104. Sabaawi M, Holmes TF, Fragala MR. Drug-induced akathisia: subjective experience and objective findings. Mil Med 1994; 159 (4): 286–91.
105. Şahin OS, Malas FÜ. Duloxetine-induced Sleep Bruxism in Fibromyalgia Successfully Treated With Amitriptyline. Acta Reumatol Port 2015; 40 (4): 391.
106. Schatzberg AF, Nemeroff CB. The American psychiatric publishing textbook of psychopharmacology. Am Psychiatric Pub 2009.
107. Schneier FR et al. Buspirone in social phobia. J Clin Psychopharmacol 1993; 13 (4): 251–6.
108. Schweizer EE et al. Open trial of buspirone in the treatment of major depressive disorder. Psychopharmacol Bull 1986; 22 (1): 183–5.
109. Sheehan DV et al. The relative efficacy of high‐dose buspirone and alprazolam in the treatment of panic disorder: a double‐blind placebo‐controlled study. Acta Psychiatr Scand 1993; 88 (1): 1–11.
110. Sheikhmoonesi F et al. A triple-blinded, randomized, placebo-controlled trial to examine the efficacy of buspirone added to typical antipsychotic drugs in patients with chronic schizophrenia. J Res Med Sci: Official J Isfahan Univer Med Sci 2015; 20 (2): 140–5.
111. Sramek JJ et al. Efficacy of buspirone in generalized anxiety disorder with coexisting mild depressive symptoms. J Clin Psychiatry 1996; 57 (7): 287–91.
112. Stahl SM. Stahl's essential psychopharmacology: neuroscientific basis and practical applications. Camb Univer Press 2013.
113. Stern TA et al. Massachusetts General Hospital Psychopharmacology and Neurotherapeutics E-Book. Elsevier Health Sci 2015.
114. Strand M. et al. A double-blind, controlled trial in primary care patients with generalized anxiety: a comparison between buspirone and oxazepam. J Clin Psychiatry 1990; 51: 40–5.
115. Sumiyoshi T et al. Effect of buspirone, a serotonin 1A partial agonist, on cognitive function in schizophrenia: a randomized, double-blind, placebo-controlled study. Schizophr Res 2007; 95 (1–3): 158–68.
5 декабря 2017
Количество просмотров: 11737


