Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№02 2012
Влияние гопантеновой кислоты и глицина на эффективность галоперидола при терапии пациентов с параноидной шизофренией №02 2012
Номера страниц в выпуске:23-29
Изучалось влияние адъювантного применения гопантеновой кислоты и глицина на психотропную активность галоперидола при лечении параноидной шизофрении. В результате проведенного исследования было установлено положительное действие обоих адъювантных средств на когнитивное функционирование пациентов.
Резюме. Изучалось влияние адъювантного применения гопантеновой кислоты и глицина на психотропную активность галоперидола при лечении параноидной шизофрении. В результате проведенного исследования было установлено положительное действие обоих адъювантных средств на когнитивное функционирование пациентов. При этом гопантеновая кислота потенцировала терапевтические эффекты галоперидола, определяя формирование реципрокных отношений между динамикой позитивных и негативных симптомов, а глицин оказывал более сбалансированное действие на симптоматику, значимо не влияя на терапевтический потенциал галоперидола. Полученные данные определяют перспективы дифференцированного применения адъювантных препаратов: гопантеновой кислоты – при обострении шизофрении, глицина – в стадии ремиссии.
Ключевые слова: шизофрения, когнитивные нарушения, гопантеновая кислота, глицин, галоперидол.
The influence of hopantenic acid and glycine on haloperidol efficacy in patients
with paranoid schizophrenia
N.P.Dzhuga, V.L.Kozlovskiy, M.Y.Popov
St.-Petersburg V.M.Bekhterev psychoneurological research institute
Summary. The influence of adjunctive use of hopantenic acid and glycine on therapeutic effects of haloperidol in patients with paranoid schizophrenia was studied. It was demonstrated that both adjuncts improved patients’ cognitive functioning. Hopantenic acid potentiated haloperidol efficacy and determined reciprocal changes in positive and negative symptoms. Glycine demonstrated more balanced action on symptoms, not affecting significantly therapeutic potential of haloperidol. Results of the study assume differentiated use of adjunctive medications: hopantenic acid – during exacerbations of schizophrenia, and glycine – in remission.
Key words: schizophrenia, cognitive dysfunction, hopantenic acid, glycine, haloperidol.
Введение
Проблема коррекции когнитивных расстройств при лечении шизофрении имеет важнейшее значение, поскольку именно их тяжесть, а не наличие тех или иных психотических симптомов, в наибольшей степени
предопределяет качество ремиссии и уровень социальной адаптации пациентов [1, 2].
Принято различать так называемые первичные и вторичные когнитивные расстройства. В основе первичных нарушений лежат специфические изменения нейрофизиологической активности мозга, обусловленные патогенезом шизофрении [3], тогда как одним из основных факторов формирования вторичных когнитивных расстройств является действие антипсихотических препаратов (в частности, блокада дофаминовых рецепторов в мезокортикальном дофаминергическом пути) [4].
В наибольшей степени когнитивную дисфункцию усугубляют классические нейролептики (бутирофеноны, пиперазиновые фенотиазины, тиоксантены), которые в то же время являются не менее эффективными, чем средства 2-й генерации, а порой и превосходят их при терапии в острой стадии заболевания [5–8]. Причем именно в этих ситуациях способность препаратов угнетать когнитивное функционирование приобретает положительное значение, способствуя более быстрой дезактуализации психотических переживаний. У препаратов 2-й генерации (атипичных антипсихотиков), более безопасных с точки зрения развития побочных эффектов, подобное действие отсутствует. В идеале антипсихотический препарат должен быстро вызывать дезактуализацию психоза, предупреждать его рецидивы, а кроме того, компенсировать первичные когнитивные нарушения, не вызывая вторичных расстройств. Поскольку к настоящему времени подобных препаратов пока не создано, коррекцию когнитивной недостаточности как на этапе обострения заболевания, так и в ходе поддерживающего лечения в периоде ремиссии приходится проводить посредством использования средств адъювантной терапии.
С этой целью применяют (в основном эмпирически) препараты различных классов. Очевидно, что поиск средств, способных корригировать симптомы когнитивной недостаточности при терапии шизофрении, следует вести среди соединений, механизм действия которых исключает их конкурентные взаимодействия с антипсихотическими препаратами (в противном случае существует риск снижения терапевтического действия базовой антипсихотической терапии и провокации обострения позитивной симптоматики). Среди подобных средств особый интерес представляют препараты, способные воздействовать на аминокислотергические системы головного мозга ввиду их потенциального влияния на известные нейрохимические звенья патогенеза шизофрении.
Нами было проведено исследование, основной целью которого являлось изучение возможности оптимизации базовой антипсихотической терапии галоперидолом при адъювантном применении гопантеновой кислоты (Пантогама) и глицина – препаратов, обладающих ноотропной активностью и различающихся механизмом действия.
Хотя эти препараты и не являются прямыми стимуляторами аминокислотергических систем, действие гопантеновой кислоты может быть связано с усилением метаболотропных и, возможно, отдельных медиаторотропных эффектов g-аминомасляной кислоты (ГАМК) [9, 10], а глицина – с активацией системы возбуждающих аминокислот (ВАК) [11].
Материал и методы исследования
В исследование включались пациенты с диагнозом параноидной шизофрении в соответствии с критериями Международной классификации болезней 10-го пересмотра (F20.0), у которых суммарная оценка по шкале PANSS [12] составляла не менее 70 баллов. Не включались пациенты с органическими заболеваниями центральной нервной системы, острыми или декомпенсированными хроническими соматическими заболеваниями, а также с артериальной гипотонией и другой патологией сердечно-сосудистой системы в анамнезе.
Пациенты в случайном порядке распределялись в одну из 3 групп, получая галоперидол, комбинацию галоперидола с глицином или комбинацию галоперидола с гопантеновой кислотой. Лечение проводилось в стационарных условиях, препараты назначались в следующих суточных дозировках: галоперидол 20 мг внутрь, глицин 600 мг сублингвально, гопантеновая кислота (пантогам) 1500 мг внутрь. Длительность терапии составляла 10 нед. В качестве сопутствующей терапии при бессоннице, возбуждении, тревоге допускалось кратковременное применение транквилизаторов бензодиазепинового ряда, для коррекции экстрапирамидной симптоматики – тригексифенидила.
Исходная оценка состояния пациентов проводилась после отмены предшествующей терапии, а последняя – по завершении лечения (на 10-й неделе). Для оценки психопатологической симптоматики применялась шкала PANSS. Когнитивные расстройства измерялись по шкале «Оценка функций, связанных с когнитивными нарушениями при шизофрении» (Schizophrenia Cognition Rating Scale – SCRS) [13], состоящей из ряда субшкал, отражающих выраженность нарушений в следующих сферах: оперативная память, внимание/уровень бодрствования, вербальное обучение и память, пространственное обучение и память, логическое рассуждение и решение задач, скорость обработки информации, социальное познание. При статистической обработке результатов значимость различий между группами определяли посредством непараметрического метода Kruskal–Wallis ANOVA с последующим post hoc сравнением с использованием U-критерия Манна–Уитни. Для дополнительного анализа полученных данных применяли ранговый корреляционный анализ по методу Спирмена и методы многомерной статистики: факторный анализ (главные компоненты) и кластерный анализ (метод К-средних). Для всех тестов был установлен порог статистической значимости p<0,05.
Исследование проводили на базе Санкт-Петербургского государственного учреждения здравоохранения Городская психиатрическая больницы №3 им. И.И.Скворцова-Степанова. Авторы выражают свою искреннюю признательность администрации больницы, заведующим отделениями №25 и №7 В.А.Добеку и Н.С.Случевской, а также медицинскому персоналу этих отделений за оказанную помощь при проведении данного исследования.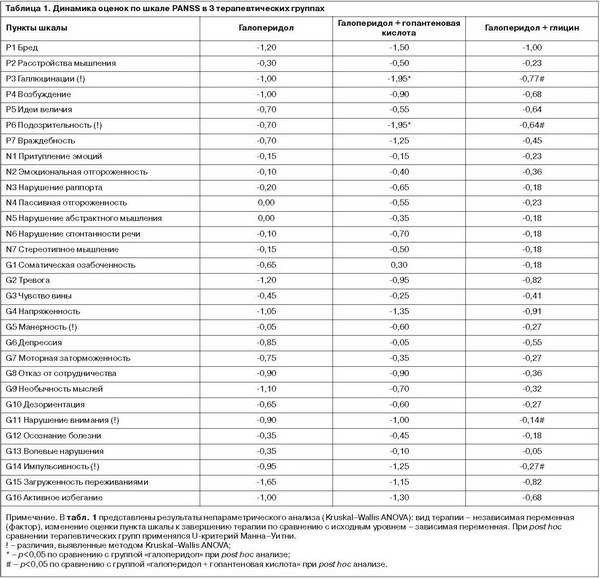
Результаты и их обсуждение
Всего в исследование было включено 62 пациента. Галоперидол получали 20 пациентов, галоперидол в комбинации с глицином – 22, галоперидол в комбинации с гопантеновой кислотой – 20. Терапевтические группы были сопоставимы по основным демографическим характеристикам.
На первом этапе работы изучалось влияние двух вариантов адъювантной терапии на когнитивное функционирование пациентов на фоне терапии галоперидолом. Для этого проводилось сопоставление динамики показателей шкалы SCRS к моменту завершения исследования по сравнению с исходным уровнем в 3 терапевтических группах. Динамика оценок субшкал SCRS отражена на рис. 1.
Обработка данных методом Kruskal–Wallis ANOVA выявила значимые различия только по субшкале «Вербальное обучение и память»: H(2, n=62)=8,367, p=0,015. При этом при post hoc сравнении (по критерию Манна–Уитни) было обнаружено статистически значимое превосходство комбинации галоперидола с глицином над монотерапией галоперидолом (Z=-2,493, p=0,013). По остальным субшкалам SCRS значимых различий между группами выявлено не было.
Среднее изменение суммарного показателя шкалы SCRS (суммы баллов всех субшкал) при монотерапии галоперидолом составило -1,95 балла, при адъювантном назначении гопантеновой кислоты – -4,25 балла и при адъювантном применении глицина – -4,82 балла. При этом сравнение методом Kruskal–Wallis ANOVA обнаружило различия между группами на уровне тенденции к статистической значимости: H(2, n=62)=5,497, p=0,064. В результате дальнейшего анализа различий между комбинированным лечением и монотерапией (по критерию Манна–Уитни) были получены следующие результаты: для гопантеновой кислоты Z=-1,826, p=0,068; для глицина Z=-2,115, p=0,034. Иными словами, по редукции суммарного балла шкалы SCRS обе терапевтические схемы, включавшие адъювантные препараты, превосходили монотерапию галоперидолом (при применении глицина – значимо, а гопантеновой кислоты – на уровне тенденции к статистической значимости).
Далее изучалось влияние адъювантной терапии на динамику психопатологической симптоматики в процессе терапии галоперидолом. Средние изменения суммарной оценки шкалы PANSS и ее субшкал отражены на рис. 2.
Анализ Kruskal–Wallis ANOVA выявил статистически значимые различия только по позитивной субшкале: H(2, n=62)=7,500, p=0,024. При post hoc сравнении (с применением U-критерия Манна–Уитни) было обнаружено превосходство комбинации галоперидола с гопантеновой кислотой над комбинацией галоперидола с глицином – значимо (Z=-2,682, p=0,007) и над монотерапией галоперидолом – на уровне тенденции к статистической значимости (Z=-1,948, p=0,051). Межгрупповое сравнение по остальным субшкалам PANSS и по суммарному баллу этой шкалы не выявило статистически значимых различий.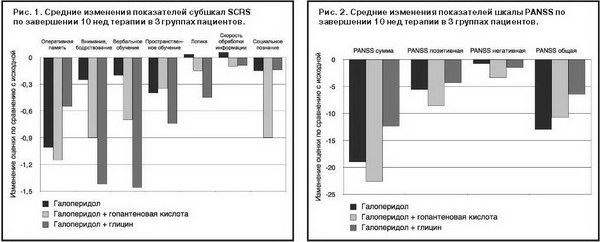 При сравнении различных схем терапии по отдельным пунктам шкалы PANSS (табл. 1) было выявлено, что у пациентов, принимавших адъювантно гопантеновую кислоту, редукция позитивных симптомов P3 (Галлюцинации) и P6 (Подозрительность) статистически значимо превосходила таковую в других терапевтических группах. Кроме того, комбинация галоперидола с гопантеновой кислотой оказывала более выраженное воздействие на показатели G11 (Нарушение внимания) и G14 (Импульсивность) по сравнению с комбинацией галоперидола с глицином. Несмотря на то что результаты Kruskal–Wallis ANOVA указали на межгрупповые различия в динамике оценок по пункту G5 (Манерность), при post hoc анализе значимых различий между терапевтическими схемами по этому показателю обнаружено не было. По всем остальным пунктам шкалы PANSS статистически значимые межгрупповые различия отсутствовали.
При сравнении различных схем терапии по отдельным пунктам шкалы PANSS (табл. 1) было выявлено, что у пациентов, принимавших адъювантно гопантеновую кислоту, редукция позитивных симптомов P3 (Галлюцинации) и P6 (Подозрительность) статистически значимо превосходила таковую в других терапевтических группах. Кроме того, комбинация галоперидола с гопантеновой кислотой оказывала более выраженное воздействие на показатели G11 (Нарушение внимания) и G14 (Импульсивность) по сравнению с комбинацией галоперидола с глицином. Несмотря на то что результаты Kruskal–Wallis ANOVA указали на межгрупповые различия в динамике оценок по пункту G5 (Манерность), при post hoc анализе значимых различий между терапевтическими схемами по этому показателю обнаружено не было. По всем остальным пунктам шкалы PANSS статистически значимые межгрупповые различия отсутствовали.
Суммируя результаты этой части исследования, можно говорить, что адъювантное применение гопантеновой кислоты приводило к более выраженной редукции симптоматики (в первую очередь позитивной) по сравнению с монотерапией галоперидолом. Комбинация галоперидола с глицином, напротив, уступала по эффективности галоперидолу, хотя в целом клинически и статистически незначимо.
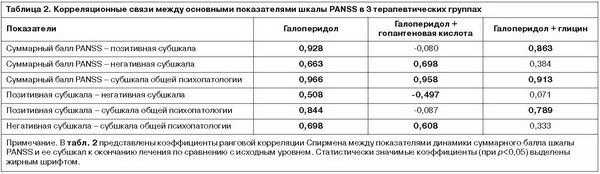
На следующем этапе работы проводилось сравнение характера связей между динамикой психопатологических симптомов в процессе лечения в 3 терапевтических группах. Корреляционные связи между изменением суммарной оценки шкалы PANSS и ее субшкал представлены в табл. 2.
В группе пациентов, получавших монотерапию галоперидолом, выявлены статистически значимые положительные корреляции между суммарным показателем PANSS и всеми субшкалами, а также положительные связи между всеми субшкалами попарно.
У пациентов, получавших гопантеновую кислоту, установлены значимые положительные корреляции между суммарным баллом PANSS и показателями негативной субшкалы и субшкалы общей психопатологии, которые, в свою очередь, были связаны между собой. Позитивная субшкала была отрицательно связана с негативной субшкалой и не имела статистически значимых корреляций ни с общей суммой PANSS, ни с субшкалой общей психопатологии.
Корреляционный анализ в группе пациентов, получавших адъювантно глицин, выявил значимые положительные связи между суммарным баллом шкалы PANSS, позитивной субшкалой и субшкалой общей психопатологии. При этом динамика негативной субшкалы не коррелировала ни с одним из показателей.
Представленные результаты указывают на то, что, во-первых, действие монотерапии галоперидолом проявлялось диффузно с вовлечением позитивных симптомов, а вторично и других психопатологических проявлений. Хорошо известно, что при обострении психоза развитие эффекта галоперидола связано в первую очередь с влиянием на позитивную симптоматику, что и нашло подтверждение в проведенном исследовании. Во-вторых, адъювантное применение гопантеновой кислоты вызывало реципрокные изменения выраженности позитивных и негативных симптомов. В-третьих, глицин оказывал более сбалансированное действие на динамику позитивных и негативных нарушений, при этом можно предположить его избирательное влияние на структуру именно негативной симптоматики.
Далее изучались корреляционные связи между отдельными пунктами шкалы PANSS в 3 терапевтических группах. Поскольку рассчитанные корреляционные матрицы слишком громоздки (три таблицы 30х30), нами будут указаны лишь наиболее существенные различия в действии двух вариантов адъювантной терапии. При применении гопантеновой кислоты (Пантогама) на фоне терапии галоперидолом выявлена обратная корреляция между изменением пунктов P1 (Бред), P3 (Галлюцинации), P4 (Возбуждение), P5 (Идеи величия) и динамикой большинства показателей негативной субшкалы, что подтверждает способность препарата изменять выраженность позитивной и негативной симптоматики реципрокно. Выявленная реципрокность отражает следующую зависимость: при росте позитивной симптоматики снижаются негативные проявления, и, соответственно, усиление негативных проявлений не сопровождается обострением психической продукции, что полностью согласуется с естественным течением заболевания, при котором со временем рост негативной симптоматики становится доминирующим и уже не приводит к клиническим обострениям болезни. Исход вполне предсказуем – рост дефицитарных симптомов.
При применении гопантеновой кислоты (Пантогама) на фоне терапии галоперидолом выявлена обратная корреляция между изменением пунктов P1 (Бред), P3 (Галлюцинации), P4 (Возбуждение), P5 (Идеи величия) и динамикой большинства показателей негативной субшкалы, что подтверждает способность препарата изменять выраженность позитивной и негативной симптоматики реципрокно. Выявленная реципрокность отражает следующую зависимость: при росте позитивной симптоматики снижаются негативные проявления, и, соответственно, усиление негативных проявлений не сопровождается обострением психической продукции, что полностью согласуется с естественным течением заболевания, при котором со временем рост негативной симптоматики становится доминирующим и уже не приводит к клиническим обострениям болезни. Исход вполне предсказуем – рост дефицитарных симптомов.
Иной спектр клинической активности определялся при анализе адъювантного действия глицина. Так, большинство пунктов позитивной субшкалы PANSS, за исключением P2 (Расстройства мышления), были прямо и статистически значимо связаны между собой. Кроме того, динамика позитивных симптомов оказалась положительным образом связана и с динамикой показателей субшкалы общей психопатологии, сопряженных с позитивными расстройствами: G2 (Тревога), G11 (Нарушение внимания), G12 (Осознание болезни), G14 (Импульсивность), G15 (Загруженность переживаниями), G16 (Активное избегание).
Поскольку терапевтические группы существенно различались характером выявленных корреляционных зависимостей, более детальное изучение эффектов адъювантной терапии проводилось с применением факторного анализа, а также с графическим построением дендрограмм по результатам кластерного анализа.
Факторный анализ (методом выделения главных компонент) проводился при загрузке в матрицу только пунктов позитивной и негативной субшкал PANSS (их динамики к окончанию терапии по сравнению с исходным уровнем) и предустановленном выделении двух факторов, что описывало до 70% всей дисперсии исследуемых показателей. При загрузке всех пунктов шкалы PANSS и выделении трех факторов (в соответствии с добавлением субшкалы общей психопатологии) величина объясняемой дисперсии не возрастала, в связи с чем анализ проводился только по пунктам позитивной и негативной субшкал. Вычисление коэффициентов факторных нагрузок осуществлялось при вращении дисперсии Varimax normalized.
При загрузке данных, полученных при монотерапии галоперидолом, в первом выделенном факторе (объяснившем 32% дисперсии) максимальные нагрузки с положительным значением получили показатели P3 (Галлюцинации), P5 (Идеи величия), P6 (Подозрительность) и P7 (Враждебность). Во втором факторе (22% дисперсии) высокие факторные нагрузки выделялись для пунктов N2 (Эмоциональная отгороженность) и N1 (Притупление эмоций).
Аналогичная обработка результатов в группе пациентов, лечившихся комбинацией галоперидола и гопантеновой кислоты, показала, что два предустановленных фактора описывали свыше 70% дисперсии показателей. При выделении значимых нагрузок в первом факторе обнаружилось 52% дисперсии, и с высокими отрицательными значениями коэффициента загружались показатели P1 (Бред), P3 (Галлюцинации), P5 (Идеи величия), а с положительными – N1 (Притупление эмоций), N2 (Эмоциональная отгороженность), N3 (Нарушение раппорта), N5 (Нарушение абстрактного мышления) и N6 (Нарушение спонтанности речи). Во втором факторе (19% дисперсии) со значимыми нагрузками присутствовали показатели N4 (Пассивная отгороженность) и N7 (Стереотипность мышления), загружавшиеся с положительными значениями, а также P2 (Расстройства мышления) с отрицательным знаком.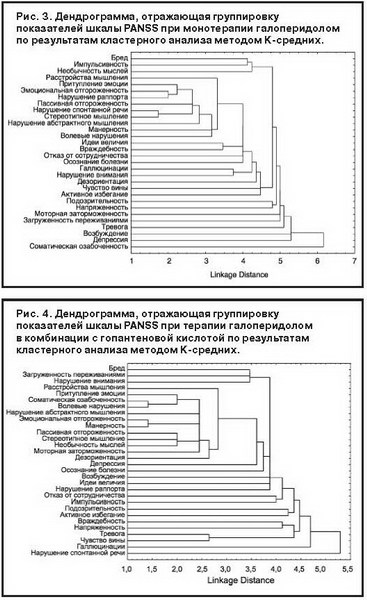 Результаты обработки матрицы группы больных, получавших комбинированную терапию галоперидолом и глицином, при выделении двух факторов описывали около 61% дисперсии показателей. В первом факторе (34% дисперсии) максимальные положительные коэффициенты имели все показатели позитивной субшкалы, за исключением пункта P2 (Расстройства мышления). Во втором факторе (27% дисперсии) также с положительными высокими значениями нагрузок были представлены показатели N5 (Нарушение абстрактного мышления), N6 (Нарушение спонтанности речи), N7 (Стереотипное мышление) и N3 (Нарушение раппорта).
Результаты обработки матрицы группы больных, получавших комбинированную терапию галоперидолом и глицином, при выделении двух факторов описывали около 61% дисперсии показателей. В первом факторе (34% дисперсии) максимальные положительные коэффициенты имели все показатели позитивной субшкалы, за исключением пункта P2 (Расстройства мышления). Во втором факторе (27% дисперсии) также с положительными высокими значениями нагрузок были представлены показатели N5 (Нарушение абстрактного мышления), N6 (Нарушение спонтанности речи), N7 (Стереотипное мышление) и N3 (Нарушение раппорта).
В целом достаточно четкое и однонаправленное разделение факторных нагрузок в соответствии с субшкалами PANSS определялось в статистических матрицах групп пациентов, получавших монотерапию галоперидолом и его комбинацию с глицином: первый фактор – позитивные симптомы, второй – негативные. Результаты пациентов, получавших гопантеновую кислоту, оказались не столь однозначны. К примеру, в первом выделенном факторе присутствовали пункты обеих субшкал, при этом коэффициенты пунктов позитивной субшкалы имели отрицательные значения, а негативной – положительные. Нагрузки второго фактора также оказались неоднородны: отрицательное значение имел пункт P2 (Расстройства мышления), положительное – N4 (Пассивная отгороженность) и N7 (Стереотипное мышление). При этом обращает внимание низкая значимость второго выделенного фактора, объяснившего всего 19% дисперсии, тогда как основная доля дисперсии показателей описывалась первым фактором.
Кластерный анализ проводился с учетом всех 30 пунктов шкалы PANSS (динамики к окончанию терапии по сравнению с исходным уровнем). Дендрограммы, построенные по данным кластерного анализа, представлены на рис. 3–5.
В дендрограммах, построенных для групп пациентов, получавших монотерапию галоперидолом (см. рис. 3) и его комбинацию с гопантеновой кислотой (см. рис. 4), в роли кластерообразующего фактора выступает показатель P1 (Бред). Однако наполненность этого кластера различается. Если в группе монотерапии галоперидолом в его формировании принимают участие такие показатели, как G9 (Необычность мыслей) и G14 (Импульсивность), то в группе пациентов, получавших адъювантно гопантеновую кислоту, эту роль выполняют пункты G11 (Нарушение внимания) и G15 (Загруженность переживаниями). Остальные части дендрограмм этих групп различаются весьма значительно, что и понятно, так как разные составляющие первого кластера должны определять и последующие различия.
Дендрограмма, отражающая группировку пунктов шкалы PANSS у пациентов, получавших адъювантно глицин (см. рис. 5), свидетельствует, что пункт P1 (Бред) с трудом может быть включен в кластерные группы. При этом в одном из выделенных кластеров фигурируют в основном симптомы негативной субшкалы, тогда как в другом в относительно большей степени представлены симптомы позитивного ряда. Обращает внимание, что в группах глицина и монотерапии галоперидолом отмечается сходство кластеров, включающих пункты G6 (Депрессия) и G1 (Соматическая озабоченность), причем за небольшими вариациями эта часть дендрограмм совпадает.
Итак, во всех дендрограммах верхнюю часть формирует показатель P1 (Бред), тогда как нижняя существенно различается. При этом большее сходство, на наш взгляд, имеют дендрограммы, построенные для пациентов, получавших монотерапию галоперидолом и его комбинацию с глицином, поскольку они отражают в целом гомогенную представленность симптомов негативного и позитивного ряда. В дендрограмме, построенной по данным пациентов, получавших комбинацию галоперидола с гопантеновой кислотой, определяются четко очерченные кластеры, однако представленные в них «наборы симптомов» неоднородны.
Здесь же уместно отметить, что превосходящая терапевтическая активность комбинации галоперидола с гопантеновой кислотой, выявленная в нашем исследовании, может быть связана с тем, что при сравнении терапевтических групп анализировались изменения абсолютных показателей (оценка «после лечения» минус оценка «до лечения»). Вместе с тем сопоставление исходных оценок показало, что в группе пациентов, получавших в дальнейшем гопантеновую кислоту, изначально отмечались более высокие показатели шкалы PANSS (особенно ее позитивной субшкалы) по сравнению с другими группами. Очевидно, что различия в исходных оценках не позволяют сделать однозначный вывод о более высокой эффективности терапевтической схемы, включавшей гопантеновую кислоту, однако эти различия не могут значимым образом сказаться на данных, отражающих характер связей между показателями (корреляционный, факторный и кластерный анализ).
Итак, результаты проведенного исследования свидетельствуют, что и гопантеновая кислота, и глицин оказывают влияние на состояние пациентов с параноидной шизофренией, улучшая когнитивное функционирование и изменяя спектр клинической активности базовой терапии галоперидолом.
Глицин не усиливает терапевтическое действие галоперидола, а по некоторым показателям, возможно, даже ослабляет его. Однако характер влияния глицина на показатели шкалы PANSS и когнитивные нарушения может свидетельствовать о его способности воздействовать непосредственно на патогенетические механизмы развития болезни. Это подтверждается анализом сопряженных изменений отдельных показателей шкалы, определяющих специфику/особенности влияния глицина на эффекты галоперидола, суть которых сводится к отсутствию реципрокности в динамике изменений показателей позитивного и негативного ряда. Результаты многомерной статистики также свидетельствуют об упорядоченном воздействии глицина на позитивную и негативную симптоматику.
В отличие от глицина гопантеновая кислота (Пантогам®), вполне возможно, потенцирует терапевтическую эффективность галоперидола. При этом углубленный статистический анализ показывает, что действие этого препарата скорее всего неспецифично в отношении влияния на симптомы шизофрении, поскольку оценка сопряженности изменений пунктов позитивной и негативной субшкал PANSS выявляет обратную зависимость динамики показателей. Можно полагать, что гопантеновая кислота, вероятно, оказывает общее тонизирующее действие, мобилизуя все системы мозга, но в отличие от глицина по-видимому, не имеет точкой приложения патогенетические механизмы развития болезни.
Известно, что по механизму действия на медиаторные системы гопантеновая кислота усиливает тормозное влияние, облегчая ГАМКергические процессы [9], тогда как глицин, напротив, облегчает ВАКергическую передачу, аллостерически потенцируя действие глутамата [14]. Тем самым исследуемые препараты в целом являются антагонистами по влиянию на системы возбуждения/торможения. Вполне вероятно, что усиление процессов торможения на определенном этапе развития болезни не может быть эффективным, поскольку эти процессы всегда инициированы предшествующей активацией и могут уже находиться в состоянии тонического возбуждения, в связи с чем их диффузная стимуляция не приводит к значимому для патогенеза модулирующему действию. Селективное в патогенетически важных звеньях усиление активности ВАКергических систем, напротив, способно нивелировать нейрохимические изменения, вызванные патологическим процессом. С усилением возбуждающих влияний на уровне нейрохимических систем префронтальной коры мозга, вероятно, и связано действие глицина. Результаты проведенного исследования позволяют говорить о перспективах дифференцированного применения адъювантной терапии, направленной на коррекцию нейрокогнитивного дефицита, при лечении пациентов с шизофренией.
Результаты проведенного исследования позволяют говорить о перспективах дифференцированного применения адъювантной терапии, направленной на коррекцию нейрокогнитивного дефицита, при лечении пациентов с шизофренией.
На основании полученных данных адъювантное применение гопантеновой кислоты представляется наиболее целесообразным в фазе обострения заболевания, когда необходимо усилить действие базовой антипсихотической терапии, параллельно предупреждая появление нежелательных побочных эффектов, включая вторичную когнитивную недостаточность, а также экстрапирамидную симптоматику, в отношении которой указанный препарат обладает известным корригирующим эффектом [15]. Благоприятным при терапии острой психотической симптоматики оказывается и небольшое депримирующее действие гопантеновой кислоты, обусловленное стимуляцией тормозных систем мозга.
Адъювантная терапия глицином представляется более перспективной в тех ситуациях, когда на первый план в клинической картине выступает симптоматика негативного круга, в частности при проведении поддерживающей терапии в ремиссии. По всей вероятности, адъювантное применение глицина не повышает антипсихотический потенциал базового лечения, но при этом может оказывать влияние на патогенетические механизмы развития шизофрении.
Выводы
1. Применение глицина и гопантеновой кислоты в качестве адъювантных средств позволяет оптимизировать терапевтический процесс при использовании галоперидола для лечения пациентов с параноидной шизофренией.
2. Каждый из указанных адъювантных препаратов уменьшает выраженность когнитивных расстройств у пациентов с параноидной шизофренией, получающих галоперидол.
3. Гопантеновая кислота потенцирует терапевтические эффекты галоперидола и определяет формирование реципрокных отношений между динамикой симптоматики позитивного и негативного круга.
4. Глицин оказывает сбалансированное действие в отношении позитивных и негативных симптомов, значимо не снижая терапевтический потенциал галоперидола.
5. Адъювантное использование гопантеновой кислоты показано при обострении шизофрении, тогда как применение глицина целесообразно при проведении поддерживающей терапии в стадии ремиссии.
Сведения об авторах
Джуга Наталья Павловна – мл. науч. сотр. отд-ния клинико-экспериментальных исследований новых психотропных средств НИПНИ им. В.М.Бехтерева. E-mail: dzhuga.natalia@mail.ru
Козловский Владимир Леонидович – д-р мед. наук, руководитель отд-ния клинико-экспериментальных исследований новых психотропных средств НИПНИ им. В.М.Бехтерева. E-mail: kvl1958@mail.ru
Попов Михаил Юрьевич – канд. мед. наук, вед. науч. сотр. отд-ния клинико-экспериментальных исследований новых психотропных средств НИПНИ им. В.М.Бехтерева. E-mail: popovmikhail@mail.ru
Ключевые слова: шизофрения, когнитивные нарушения, гопантеновая кислота, глицин, галоперидол.
The influence of hopantenic acid and glycine on haloperidol efficacy in patients
with paranoid schizophrenia
N.P.Dzhuga, V.L.Kozlovskiy, M.Y.Popov
St.-Petersburg V.M.Bekhterev psychoneurological research institute
Summary. The influence of adjunctive use of hopantenic acid and glycine on therapeutic effects of haloperidol in patients with paranoid schizophrenia was studied. It was demonstrated that both adjuncts improved patients’ cognitive functioning. Hopantenic acid potentiated haloperidol efficacy and determined reciprocal changes in positive and negative symptoms. Glycine demonstrated more balanced action on symptoms, not affecting significantly therapeutic potential of haloperidol. Results of the study assume differentiated use of adjunctive medications: hopantenic acid – during exacerbations of schizophrenia, and glycine – in remission.
Key words: schizophrenia, cognitive dysfunction, hopantenic acid, glycine, haloperidol.
Введение
Проблема коррекции когнитивных расстройств при лечении шизофрении имеет важнейшее значение, поскольку именно их тяжесть, а не наличие тех или иных психотических симптомов, в наибольшей степени
предопределяет качество ремиссии и уровень социальной адаптации пациентов [1, 2].
Принято различать так называемые первичные и вторичные когнитивные расстройства. В основе первичных нарушений лежат специфические изменения нейрофизиологической активности мозга, обусловленные патогенезом шизофрении [3], тогда как одним из основных факторов формирования вторичных когнитивных расстройств является действие антипсихотических препаратов (в частности, блокада дофаминовых рецепторов в мезокортикальном дофаминергическом пути) [4].
В наибольшей степени когнитивную дисфункцию усугубляют классические нейролептики (бутирофеноны, пиперазиновые фенотиазины, тиоксантены), которые в то же время являются не менее эффективными, чем средства 2-й генерации, а порой и превосходят их при терапии в острой стадии заболевания [5–8]. Причем именно в этих ситуациях способность препаратов угнетать когнитивное функционирование приобретает положительное значение, способствуя более быстрой дезактуализации психотических переживаний. У препаратов 2-й генерации (атипичных антипсихотиков), более безопасных с точки зрения развития побочных эффектов, подобное действие отсутствует. В идеале антипсихотический препарат должен быстро вызывать дезактуализацию психоза, предупреждать его рецидивы, а кроме того, компенсировать первичные когнитивные нарушения, не вызывая вторичных расстройств. Поскольку к настоящему времени подобных препаратов пока не создано, коррекцию когнитивной недостаточности как на этапе обострения заболевания, так и в ходе поддерживающего лечения в периоде ремиссии приходится проводить посредством использования средств адъювантной терапии.
С этой целью применяют (в основном эмпирически) препараты различных классов. Очевидно, что поиск средств, способных корригировать симптомы когнитивной недостаточности при терапии шизофрении, следует вести среди соединений, механизм действия которых исключает их конкурентные взаимодействия с антипсихотическими препаратами (в противном случае существует риск снижения терапевтического действия базовой антипсихотической терапии и провокации обострения позитивной симптоматики). Среди подобных средств особый интерес представляют препараты, способные воздействовать на аминокислотергические системы головного мозга ввиду их потенциального влияния на известные нейрохимические звенья патогенеза шизофрении.
Нами было проведено исследование, основной целью которого являлось изучение возможности оптимизации базовой антипсихотической терапии галоперидолом при адъювантном применении гопантеновой кислоты (Пантогама) и глицина – препаратов, обладающих ноотропной активностью и различающихся механизмом действия.
Хотя эти препараты и не являются прямыми стимуляторами аминокислотергических систем, действие гопантеновой кислоты может быть связано с усилением метаболотропных и, возможно, отдельных медиаторотропных эффектов g-аминомасляной кислоты (ГАМК) [9, 10], а глицина – с активацией системы возбуждающих аминокислот (ВАК) [11].
Материал и методы исследования
В исследование включались пациенты с диагнозом параноидной шизофрении в соответствии с критериями Международной классификации болезней 10-го пересмотра (F20.0), у которых суммарная оценка по шкале PANSS [12] составляла не менее 70 баллов. Не включались пациенты с органическими заболеваниями центральной нервной системы, острыми или декомпенсированными хроническими соматическими заболеваниями, а также с артериальной гипотонией и другой патологией сердечно-сосудистой системы в анамнезе.
Пациенты в случайном порядке распределялись в одну из 3 групп, получая галоперидол, комбинацию галоперидола с глицином или комбинацию галоперидола с гопантеновой кислотой. Лечение проводилось в стационарных условиях, препараты назначались в следующих суточных дозировках: галоперидол 20 мг внутрь, глицин 600 мг сублингвально, гопантеновая кислота (пантогам) 1500 мг внутрь. Длительность терапии составляла 10 нед. В качестве сопутствующей терапии при бессоннице, возбуждении, тревоге допускалось кратковременное применение транквилизаторов бензодиазепинового ряда, для коррекции экстрапирамидной симптоматики – тригексифенидила.
Исходная оценка состояния пациентов проводилась после отмены предшествующей терапии, а последняя – по завершении лечения (на 10-й неделе). Для оценки психопатологической симптоматики применялась шкала PANSS. Когнитивные расстройства измерялись по шкале «Оценка функций, связанных с когнитивными нарушениями при шизофрении» (Schizophrenia Cognition Rating Scale – SCRS) [13], состоящей из ряда субшкал, отражающих выраженность нарушений в следующих сферах: оперативная память, внимание/уровень бодрствования, вербальное обучение и память, пространственное обучение и память, логическое рассуждение и решение задач, скорость обработки информации, социальное познание. При статистической обработке результатов значимость различий между группами определяли посредством непараметрического метода Kruskal–Wallis ANOVA с последующим post hoc сравнением с использованием U-критерия Манна–Уитни. Для дополнительного анализа полученных данных применяли ранговый корреляционный анализ по методу Спирмена и методы многомерной статистики: факторный анализ (главные компоненты) и кластерный анализ (метод К-средних). Для всех тестов был установлен порог статистической значимости p<0,05.
Исследование проводили на базе Санкт-Петербургского государственного учреждения здравоохранения Городская психиатрическая больницы №3 им. И.И.Скворцова-Степанова. Авторы выражают свою искреннюю признательность администрации больницы, заведующим отделениями №25 и №7 В.А.Добеку и Н.С.Случевской, а также медицинскому персоналу этих отделений за оказанную помощь при проведении данного исследования.


Результаты и их обсуждение
Всего в исследование было включено 62 пациента. Галоперидол получали 20 пациентов, галоперидол в комбинации с глицином – 22, галоперидол в комбинации с гопантеновой кислотой – 20. Терапевтические группы были сопоставимы по основным демографическим характеристикам.
На первом этапе работы изучалось влияние двух вариантов адъювантной терапии на когнитивное функционирование пациентов на фоне терапии галоперидолом. Для этого проводилось сопоставление динамики показателей шкалы SCRS к моменту завершения исследования по сравнению с исходным уровнем в 3 терапевтических группах. Динамика оценок субшкал SCRS отражена на рис. 1.
Обработка данных методом Kruskal–Wallis ANOVA выявила значимые различия только по субшкале «Вербальное обучение и память»: H(2, n=62)=8,367, p=0,015. При этом при post hoc сравнении (по критерию Манна–Уитни) было обнаружено статистически значимое превосходство комбинации галоперидола с глицином над монотерапией галоперидолом (Z=-2,493, p=0,013). По остальным субшкалам SCRS значимых различий между группами выявлено не было.
Среднее изменение суммарного показателя шкалы SCRS (суммы баллов всех субшкал) при монотерапии галоперидолом составило -1,95 балла, при адъювантном назначении гопантеновой кислоты – -4,25 балла и при адъювантном применении глицина – -4,82 балла. При этом сравнение методом Kruskal–Wallis ANOVA обнаружило различия между группами на уровне тенденции к статистической значимости: H(2, n=62)=5,497, p=0,064. В результате дальнейшего анализа различий между комбинированным лечением и монотерапией (по критерию Манна–Уитни) были получены следующие результаты: для гопантеновой кислоты Z=-1,826, p=0,068; для глицина Z=-2,115, p=0,034. Иными словами, по редукции суммарного балла шкалы SCRS обе терапевтические схемы, включавшие адъювантные препараты, превосходили монотерапию галоперидолом (при применении глицина – значимо, а гопантеновой кислоты – на уровне тенденции к статистической значимости).
Далее изучалось влияние адъювантной терапии на динамику психопатологической симптоматики в процессе терапии галоперидолом. Средние изменения суммарной оценки шкалы PANSS и ее субшкал отражены на рис. 2.
Анализ Kruskal–Wallis ANOVA выявил статистически значимые различия только по позитивной субшкале: H(2, n=62)=7,500, p=0,024. При post hoc сравнении (с применением U-критерия Манна–Уитни) было обнаружено превосходство комбинации галоперидола с гопантеновой кислотой над комбинацией галоперидола с глицином – значимо (Z=-2,682, p=0,007) и над монотерапией галоперидолом – на уровне тенденции к статистической значимости (Z=-1,948, p=0,051). Межгрупповое сравнение по остальным субшкалам PANSS и по суммарному баллу этой шкалы не выявило статистически значимых различий.
 При сравнении различных схем терапии по отдельным пунктам шкалы PANSS (табл. 1) было выявлено, что у пациентов, принимавших адъювантно гопантеновую кислоту, редукция позитивных симптомов P3 (Галлюцинации) и P6 (Подозрительность) статистически значимо превосходила таковую в других терапевтических группах. Кроме того, комбинация галоперидола с гопантеновой кислотой оказывала более выраженное воздействие на показатели G11 (Нарушение внимания) и G14 (Импульсивность) по сравнению с комбинацией галоперидола с глицином. Несмотря на то что результаты Kruskal–Wallis ANOVA указали на межгрупповые различия в динамике оценок по пункту G5 (Манерность), при post hoc анализе значимых различий между терапевтическими схемами по этому показателю обнаружено не было. По всем остальным пунктам шкалы PANSS статистически значимые межгрупповые различия отсутствовали.
При сравнении различных схем терапии по отдельным пунктам шкалы PANSS (табл. 1) было выявлено, что у пациентов, принимавших адъювантно гопантеновую кислоту, редукция позитивных симптомов P3 (Галлюцинации) и P6 (Подозрительность) статистически значимо превосходила таковую в других терапевтических группах. Кроме того, комбинация галоперидола с гопантеновой кислотой оказывала более выраженное воздействие на показатели G11 (Нарушение внимания) и G14 (Импульсивность) по сравнению с комбинацией галоперидола с глицином. Несмотря на то что результаты Kruskal–Wallis ANOVA указали на межгрупповые различия в динамике оценок по пункту G5 (Манерность), при post hoc анализе значимых различий между терапевтическими схемами по этому показателю обнаружено не было. По всем остальным пунктам шкалы PANSS статистически значимые межгрупповые различия отсутствовали.
Суммируя результаты этой части исследования, можно говорить, что адъювантное применение гопантеновой кислоты приводило к более выраженной редукции симптоматики (в первую очередь позитивной) по сравнению с монотерапией галоперидолом. Комбинация галоперидола с глицином, напротив, уступала по эффективности галоперидолу, хотя в целом клинически и статистически незначимо.
На следующем этапе работы проводилось сравнение характера связей между динамикой психопатологических симптомов в процессе лечения в 3 терапевтических группах. Корреляционные связи между изменением суммарной оценки шкалы PANSS и ее субшкал представлены в табл. 2.
В группе пациентов, получавших монотерапию галоперидолом, выявлены статистически значимые положительные корреляции между суммарным показателем PANSS и всеми субшкалами, а также положительные связи между всеми субшкалами попарно.
У пациентов, получавших гопантеновую кислоту, установлены значимые положительные корреляции между суммарным баллом PANSS и показателями негативной субшкалы и субшкалы общей психопатологии, которые, в свою очередь, были связаны между собой. Позитивная субшкала была отрицательно связана с негативной субшкалой и не имела статистически значимых корреляций ни с общей суммой PANSS, ни с субшкалой общей психопатологии.
Корреляционный анализ в группе пациентов, получавших адъювантно глицин, выявил значимые положительные связи между суммарным баллом шкалы PANSS, позитивной субшкалой и субшкалой общей психопатологии. При этом динамика негативной субшкалы не коррелировала ни с одним из показателей.
Представленные результаты указывают на то, что, во-первых, действие монотерапии галоперидолом проявлялось диффузно с вовлечением позитивных симптомов, а вторично и других психопатологических проявлений. Хорошо известно, что при обострении психоза развитие эффекта галоперидола связано в первую очередь с влиянием на позитивную симптоматику, что и нашло подтверждение в проведенном исследовании. Во-вторых, адъювантное применение гопантеновой кислоты вызывало реципрокные изменения выраженности позитивных и негативных симптомов. В-третьих, глицин оказывал более сбалансированное действие на динамику позитивных и негативных нарушений, при этом можно предположить его избирательное влияние на структуру именно негативной симптоматики.
Далее изучались корреляционные связи между отдельными пунктами шкалы PANSS в 3 терапевтических группах. Поскольку рассчитанные корреляционные матрицы слишком громоздки (три таблицы 30х30), нами будут указаны лишь наиболее существенные различия в действии двух вариантов адъювантной терапии.
 При применении гопантеновой кислоты (Пантогама) на фоне терапии галоперидолом выявлена обратная корреляция между изменением пунктов P1 (Бред), P3 (Галлюцинации), P4 (Возбуждение), P5 (Идеи величия) и динамикой большинства показателей негативной субшкалы, что подтверждает способность препарата изменять выраженность позитивной и негативной симптоматики реципрокно. Выявленная реципрокность отражает следующую зависимость: при росте позитивной симптоматики снижаются негативные проявления, и, соответственно, усиление негативных проявлений не сопровождается обострением психической продукции, что полностью согласуется с естественным течением заболевания, при котором со временем рост негативной симптоматики становится доминирующим и уже не приводит к клиническим обострениям болезни. Исход вполне предсказуем – рост дефицитарных симптомов.
При применении гопантеновой кислоты (Пантогама) на фоне терапии галоперидолом выявлена обратная корреляция между изменением пунктов P1 (Бред), P3 (Галлюцинации), P4 (Возбуждение), P5 (Идеи величия) и динамикой большинства показателей негативной субшкалы, что подтверждает способность препарата изменять выраженность позитивной и негативной симптоматики реципрокно. Выявленная реципрокность отражает следующую зависимость: при росте позитивной симптоматики снижаются негативные проявления, и, соответственно, усиление негативных проявлений не сопровождается обострением психической продукции, что полностью согласуется с естественным течением заболевания, при котором со временем рост негативной симптоматики становится доминирующим и уже не приводит к клиническим обострениям болезни. Исход вполне предсказуем – рост дефицитарных симптомов.
Иной спектр клинической активности определялся при анализе адъювантного действия глицина. Так, большинство пунктов позитивной субшкалы PANSS, за исключением P2 (Расстройства мышления), были прямо и статистически значимо связаны между собой. Кроме того, динамика позитивных симптомов оказалась положительным образом связана и с динамикой показателей субшкалы общей психопатологии, сопряженных с позитивными расстройствами: G2 (Тревога), G11 (Нарушение внимания), G12 (Осознание болезни), G14 (Импульсивность), G15 (Загруженность переживаниями), G16 (Активное избегание).
Поскольку терапевтические группы существенно различались характером выявленных корреляционных зависимостей, более детальное изучение эффектов адъювантной терапии проводилось с применением факторного анализа, а также с графическим построением дендрограмм по результатам кластерного анализа.
Факторный анализ (методом выделения главных компонент) проводился при загрузке в матрицу только пунктов позитивной и негативной субшкал PANSS (их динамики к окончанию терапии по сравнению с исходным уровнем) и предустановленном выделении двух факторов, что описывало до 70% всей дисперсии исследуемых показателей. При загрузке всех пунктов шкалы PANSS и выделении трех факторов (в соответствии с добавлением субшкалы общей психопатологии) величина объясняемой дисперсии не возрастала, в связи с чем анализ проводился только по пунктам позитивной и негативной субшкал. Вычисление коэффициентов факторных нагрузок осуществлялось при вращении дисперсии Varimax normalized.
При загрузке данных, полученных при монотерапии галоперидолом, в первом выделенном факторе (объяснившем 32% дисперсии) максимальные нагрузки с положительным значением получили показатели P3 (Галлюцинации), P5 (Идеи величия), P6 (Подозрительность) и P7 (Враждебность). Во втором факторе (22% дисперсии) высокие факторные нагрузки выделялись для пунктов N2 (Эмоциональная отгороженность) и N1 (Притупление эмоций).
Аналогичная обработка результатов в группе пациентов, лечившихся комбинацией галоперидола и гопантеновой кислоты, показала, что два предустановленных фактора описывали свыше 70% дисперсии показателей. При выделении значимых нагрузок в первом факторе обнаружилось 52% дисперсии, и с высокими отрицательными значениями коэффициента загружались показатели P1 (Бред), P3 (Галлюцинации), P5 (Идеи величия), а с положительными – N1 (Притупление эмоций), N2 (Эмоциональная отгороженность), N3 (Нарушение раппорта), N5 (Нарушение абстрактного мышления) и N6 (Нарушение спонтанности речи). Во втором факторе (19% дисперсии) со значимыми нагрузками присутствовали показатели N4 (Пассивная отгороженность) и N7 (Стереотипность мышления), загружавшиеся с положительными значениями, а также P2 (Расстройства мышления) с отрицательным знаком.
 Результаты обработки матрицы группы больных, получавших комбинированную терапию галоперидолом и глицином, при выделении двух факторов описывали около 61% дисперсии показателей. В первом факторе (34% дисперсии) максимальные положительные коэффициенты имели все показатели позитивной субшкалы, за исключением пункта P2 (Расстройства мышления). Во втором факторе (27% дисперсии) также с положительными высокими значениями нагрузок были представлены показатели N5 (Нарушение абстрактного мышления), N6 (Нарушение спонтанности речи), N7 (Стереотипное мышление) и N3 (Нарушение раппорта).
Результаты обработки матрицы группы больных, получавших комбинированную терапию галоперидолом и глицином, при выделении двух факторов описывали около 61% дисперсии показателей. В первом факторе (34% дисперсии) максимальные положительные коэффициенты имели все показатели позитивной субшкалы, за исключением пункта P2 (Расстройства мышления). Во втором факторе (27% дисперсии) также с положительными высокими значениями нагрузок были представлены показатели N5 (Нарушение абстрактного мышления), N6 (Нарушение спонтанности речи), N7 (Стереотипное мышление) и N3 (Нарушение раппорта).
В целом достаточно четкое и однонаправленное разделение факторных нагрузок в соответствии с субшкалами PANSS определялось в статистических матрицах групп пациентов, получавших монотерапию галоперидолом и его комбинацию с глицином: первый фактор – позитивные симптомы, второй – негативные. Результаты пациентов, получавших гопантеновую кислоту, оказались не столь однозначны. К примеру, в первом выделенном факторе присутствовали пункты обеих субшкал, при этом коэффициенты пунктов позитивной субшкалы имели отрицательные значения, а негативной – положительные. Нагрузки второго фактора также оказались неоднородны: отрицательное значение имел пункт P2 (Расстройства мышления), положительное – N4 (Пассивная отгороженность) и N7 (Стереотипное мышление). При этом обращает внимание низкая значимость второго выделенного фактора, объяснившего всего 19% дисперсии, тогда как основная доля дисперсии показателей описывалась первым фактором.
Кластерный анализ проводился с учетом всех 30 пунктов шкалы PANSS (динамики к окончанию терапии по сравнению с исходным уровнем). Дендрограммы, построенные по данным кластерного анализа, представлены на рис. 3–5.
В дендрограммах, построенных для групп пациентов, получавших монотерапию галоперидолом (см. рис. 3) и его комбинацию с гопантеновой кислотой (см. рис. 4), в роли кластерообразующего фактора выступает показатель P1 (Бред). Однако наполненность этого кластера различается. Если в группе монотерапии галоперидолом в его формировании принимают участие такие показатели, как G9 (Необычность мыслей) и G14 (Импульсивность), то в группе пациентов, получавших адъювантно гопантеновую кислоту, эту роль выполняют пункты G11 (Нарушение внимания) и G15 (Загруженность переживаниями). Остальные части дендрограмм этих групп различаются весьма значительно, что и понятно, так как разные составляющие первого кластера должны определять и последующие различия.
Дендрограмма, отражающая группировку пунктов шкалы PANSS у пациентов, получавших адъювантно глицин (см. рис. 5), свидетельствует, что пункт P1 (Бред) с трудом может быть включен в кластерные группы. При этом в одном из выделенных кластеров фигурируют в основном симптомы негативной субшкалы, тогда как в другом в относительно большей степени представлены симптомы позитивного ряда. Обращает внимание, что в группах глицина и монотерапии галоперидолом отмечается сходство кластеров, включающих пункты G6 (Депрессия) и G1 (Соматическая озабоченность), причем за небольшими вариациями эта часть дендрограмм совпадает.
Итак, во всех дендрограммах верхнюю часть формирует показатель P1 (Бред), тогда как нижняя существенно различается. При этом большее сходство, на наш взгляд, имеют дендрограммы, построенные для пациентов, получавших монотерапию галоперидолом и его комбинацию с глицином, поскольку они отражают в целом гомогенную представленность симптомов негативного и позитивного ряда. В дендрограмме, построенной по данным пациентов, получавших комбинацию галоперидола с гопантеновой кислотой, определяются четко очерченные кластеры, однако представленные в них «наборы симптомов» неоднородны.
Здесь же уместно отметить, что превосходящая терапевтическая активность комбинации галоперидола с гопантеновой кислотой, выявленная в нашем исследовании, может быть связана с тем, что при сравнении терапевтических групп анализировались изменения абсолютных показателей (оценка «после лечения» минус оценка «до лечения»). Вместе с тем сопоставление исходных оценок показало, что в группе пациентов, получавших в дальнейшем гопантеновую кислоту, изначально отмечались более высокие показатели шкалы PANSS (особенно ее позитивной субшкалы) по сравнению с другими группами. Очевидно, что различия в исходных оценках не позволяют сделать однозначный вывод о более высокой эффективности терапевтической схемы, включавшей гопантеновую кислоту, однако эти различия не могут значимым образом сказаться на данных, отражающих характер связей между показателями (корреляционный, факторный и кластерный анализ).
Итак, результаты проведенного исследования свидетельствуют, что и гопантеновая кислота, и глицин оказывают влияние на состояние пациентов с параноидной шизофренией, улучшая когнитивное функционирование и изменяя спектр клинической активности базовой терапии галоперидолом.
Глицин не усиливает терапевтическое действие галоперидола, а по некоторым показателям, возможно, даже ослабляет его. Однако характер влияния глицина на показатели шкалы PANSS и когнитивные нарушения может свидетельствовать о его способности воздействовать непосредственно на патогенетические механизмы развития болезни. Это подтверждается анализом сопряженных изменений отдельных показателей шкалы, определяющих специфику/особенности влияния глицина на эффекты галоперидола, суть которых сводится к отсутствию реципрокности в динамике изменений показателей позитивного и негативного ряда. Результаты многомерной статистики также свидетельствуют об упорядоченном воздействии глицина на позитивную и негативную симптоматику.
В отличие от глицина гопантеновая кислота (Пантогам®), вполне возможно, потенцирует терапевтическую эффективность галоперидола. При этом углубленный статистический анализ показывает, что действие этого препарата скорее всего неспецифично в отношении влияния на симптомы шизофрении, поскольку оценка сопряженности изменений пунктов позитивной и негативной субшкал PANSS выявляет обратную зависимость динамики показателей. Можно полагать, что гопантеновая кислота, вероятно, оказывает общее тонизирующее действие, мобилизуя все системы мозга, но в отличие от глицина по-видимому, не имеет точкой приложения патогенетические механизмы развития болезни.
Известно, что по механизму действия на медиаторные системы гопантеновая кислота усиливает тормозное влияние, облегчая ГАМКергические процессы [9], тогда как глицин, напротив, облегчает ВАКергическую передачу, аллостерически потенцируя действие глутамата [14]. Тем самым исследуемые препараты в целом являются антагонистами по влиянию на системы возбуждения/торможения. Вполне вероятно, что усиление процессов торможения на определенном этапе развития болезни не может быть эффективным, поскольку эти процессы всегда инициированы предшествующей активацией и могут уже находиться в состоянии тонического возбуждения, в связи с чем их диффузная стимуляция не приводит к значимому для патогенеза модулирующему действию. Селективное в патогенетически важных звеньях усиление активности ВАКергических систем, напротив, способно нивелировать нейрохимические изменения, вызванные патологическим процессом. С усилением возбуждающих влияний на уровне нейрохимических систем префронтальной коры мозга, вероятно, и связано действие глицина.
 Результаты проведенного исследования позволяют говорить о перспективах дифференцированного применения адъювантной терапии, направленной на коррекцию нейрокогнитивного дефицита, при лечении пациентов с шизофренией.
Результаты проведенного исследования позволяют говорить о перспективах дифференцированного применения адъювантной терапии, направленной на коррекцию нейрокогнитивного дефицита, при лечении пациентов с шизофренией.
На основании полученных данных адъювантное применение гопантеновой кислоты представляется наиболее целесообразным в фазе обострения заболевания, когда необходимо усилить действие базовой антипсихотической терапии, параллельно предупреждая появление нежелательных побочных эффектов, включая вторичную когнитивную недостаточность, а также экстрапирамидную симптоматику, в отношении которой указанный препарат обладает известным корригирующим эффектом [15]. Благоприятным при терапии острой психотической симптоматики оказывается и небольшое депримирующее действие гопантеновой кислоты, обусловленное стимуляцией тормозных систем мозга.
Адъювантная терапия глицином представляется более перспективной в тех ситуациях, когда на первый план в клинической картине выступает симптоматика негативного круга, в частности при проведении поддерживающей терапии в ремиссии. По всей вероятности, адъювантное применение глицина не повышает антипсихотический потенциал базового лечения, но при этом может оказывать влияние на патогенетические механизмы развития шизофрении.
Выводы
1. Применение глицина и гопантеновой кислоты в качестве адъювантных средств позволяет оптимизировать терапевтический процесс при использовании галоперидола для лечения пациентов с параноидной шизофренией.
2. Каждый из указанных адъювантных препаратов уменьшает выраженность когнитивных расстройств у пациентов с параноидной шизофренией, получающих галоперидол.
3. Гопантеновая кислота потенцирует терапевтические эффекты галоперидола и определяет формирование реципрокных отношений между динамикой симптоматики позитивного и негативного круга.
4. Глицин оказывает сбалансированное действие в отношении позитивных и негативных симптомов, значимо не снижая терапевтический потенциал галоперидола.
5. Адъювантное использование гопантеновой кислоты показано при обострении шизофрении, тогда как применение глицина целесообразно при проведении поддерживающей терапии в стадии ремиссии.
Сведения об авторах
Джуга Наталья Павловна – мл. науч. сотр. отд-ния клинико-экспериментальных исследований новых психотропных средств НИПНИ им. В.М.Бехтерева. E-mail: dzhuga.natalia@mail.ru
Козловский Владимир Леонидович – д-р мед. наук, руководитель отд-ния клинико-экспериментальных исследований новых психотропных средств НИПНИ им. В.М.Бехтерева. E-mail: kvl1958@mail.ru
Попов Михаил Юрьевич – канд. мед. наук, вед. науч. сотр. отд-ния клинико-экспериментальных исследований новых психотропных средств НИПНИ им. В.М.Бехтерева. E-mail: popovmikhail@mail.ru
Список исп. литературыСкрыть список1. Аведисова А.С., Вериго Н.Н. Шизофрения и когнитивный дефицит. Психиатр. и психофармакотер. 2001; 6: 202–4.
2. Green MF. What are the functional consequences of neurocognitive deficits in schizophrenia? Am J Psychiat 1996; 153: 321–30.
3. Meltzer HY, Stahl SM. The dopamine hypothesis of schizophrenia. Schizophr Bull 1976; 2: 19–76.
4. Stahl SM. Antipsychotics and mood stabilizers. Cambridge University Press 2002.
5. Козловский В.Л., Незнанов Н.Г. Комбинированная терапия антипсихотиками и антидепрессантами: рациональность, стратегия, тактика (сообщ. 1). Обозр. психиатр. и мед. психологии им. В.М.Бехтерева. 2008; 3: 4–8.
6. Козловский В.Л. Лекарственная резистентность в психиатрии – проблема патофизиологии или фармакологии? Журн. неврол. и психиатр. им. С.С.Корсакова. 2009; 1: 86–90.
7. Chouinard G, Jones B, Remington G et al. A Canadian multicenter placebo-controlled study of fixed doses of risperidone and haloperidol in the treatment of chronic schizophrenic patients. J Clin Psychopharmacol 1993; 13: 25–40.
8. Purdon S, Jones B, Stip E et al. Neuropsychological change in early phase schizophrenia during 12 months of treatment with olanzapine, risperidone or haloperidol. Arch Gen Psychiat 2000; 57: 249–58.
9. Воронина Т.А. Перспективы применения препаратов с ноотропным, нейропротекторным действием. В кн.: Фундаментальные проблемы реаниматологии (избранные лекции и обзоры). Под ред. В.В.Мороз. Т. 4. М.: Ин-т реаниматологии РАМН, 2005; с. 84–113.
10. Ковалев Г.В. Ноотропные средства. Волгоград, 1990.
11. Javitt DC. Glutamate as a therapeutic target in psychiatric disorders. Mol Psychiat 2004; 9: 984–97.
12. Kay SR, Opler LA, Fiszbein A. Positive and negative syndrome scale (PANSS). Rating manual. NY 1986.
13. Richard SE, Keefe PD, Margaret Poe MA et al. The schizophrenia cognition rating scale: an interview-based assessment and its relationship to cognition, real-world functioning, and functional capacity. Am J Psychiat 2006; 163 (3): 426–32.
14. Olney JW, Newcomer JW, Farber BB. NMDA-receptor hypofunction model of schizophrenia. J Psych Res 1999; 33: 523–33.
15. Малин Д.И., Козырев В.В., Равилов Р.С. Экстрапирамидные побочные эффекты нейролептиков: классификация и современные способы коррекции. Психиатр. и психофармакотер. 2001; 6: 198–202.

