Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
 Резюме. В статье рассматриваются вопросы дифференциации современных атипичных антипсихотиков по показателям клинической эффективности. Обсуждаются результаты основных сравнительных исследований, выполненных методом метаанализа и проспективного длительного наблюдения в условиях, приближенных к рутинной клинической практике. Результаты исследований позволяют рассматривать оланзапин в ряду атипичных антипсихотиков первого выбора для терапии шизофрении и расстройств шизофренического спектра.
Резюме. В статье рассматриваются вопросы дифференциации современных атипичных антипсихотиков по показателям клинической эффективности. Обсуждаются результаты основных сравнительных исследований, выполненных методом метаанализа и проспективного длительного наблюдения в условиях, приближенных к рутинной клинической практике. Результаты исследований позволяют рассматривать оланзапин в ряду атипичных антипсихотиков первого выбора для терапии шизофрении и расстройств шизофренического спектра.
Ключевые слова: атипичные антипсихотики, шизофрения, эффективность.
Clinical characteristics of atypical antipsychotics: results from comparative studies
in schizophrenia
S.V.Ivanov
Mental Health Research Center RAMS, Moscow
Summary. Questions of differentiation of atypical antipsychotics in terms of effectiveness are discussed. The data from main contemporary meta-analyses and long-term large-scale prospective comparative studies in conditions close to routine clinical practice are presented. The results confirm the place of olanzapine among antipsychotics of first choice for patients with schizophrenia and schizophrenic spectrum disorders.
Key words: atypical antipsychotics, schizophrenia, effectiveness.
Введение
 Внушительный арсенал используемых в современной клинической практике атипичных антипсихотиков (ААП), насчитывающий восемь препаратов (амисульприд, арипипразол, зипрасидон, кветиапин, клозапин, оланзапин, рисперидон, сертиндол)1, определяет актуальность проблемы выбора оптимального средства для фармакотерапии больных шизофренией. Однако решение этого вопроса представляется сложной задачей. При сопоставимости показателей эффективности в опубликованных рандомизированных исследованиях монотерапии каждым из ААП накопленный опыт их клинического применения противоречит представлению об эквивалентности ААП по всем основным параметрам, включая степень редукции симптомов в рамках каждой дименсиональной категории шизофрении (позитивные, негативные, аффективные и когнитивные расстройства), а также профилям переносимости и безопасности. В связи с этим возникает необходимость восполнения дефицита научной информации в аспекте сравнительных характеристик ААП. Очные сравнительные рандомизированные исследования, как правило, ограничиваются двумя ААП и не позволяют сделать глобальных выводов по всем представителям этого класса психо-тропных средств. Поэтому для решения этой проблемы в современной клинической психиатрии приоритетными становятся два направления исследований:
Внушительный арсенал используемых в современной клинической практике атипичных антипсихотиков (ААП), насчитывающий восемь препаратов (амисульприд, арипипразол, зипрасидон, кветиапин, клозапин, оланзапин, рисперидон, сертиндол)1, определяет актуальность проблемы выбора оптимального средства для фармакотерапии больных шизофренией. Однако решение этого вопроса представляется сложной задачей. При сопоставимости показателей эффективности в опубликованных рандомизированных исследованиях монотерапии каждым из ААП накопленный опыт их клинического применения противоречит представлению об эквивалентности ААП по всем основным параметрам, включая степень редукции симптомов в рамках каждой дименсиональной категории шизофрении (позитивные, негативные, аффективные и когнитивные расстройства), а также профилям переносимости и безопасности. В связи с этим возникает необходимость восполнения дефицита научной информации в аспекте сравнительных характеристик ААП. Очные сравнительные рандомизированные исследования, как правило, ограничиваются двумя ААП и не позволяют сделать глобальных выводов по всем представителям этого класса психо-тропных средств. Поэтому для решения этой проблемы в современной клинической психиатрии приоритетными становятся два направления исследований:
2) масштабные натуралистические сравнительные исследования в условиях, приближенных к рутинной клинической практике. В данной публикации представлены основные результаты сравнительных метаанализов и сравнительных натуралистических исследований эффективности и переносимости ААП в терапии шизофрении. Основное внимание будет уделяться исследованиям, в которых использовались более адекватные для рутинной практики критерии клинической ценности антипсихотика (АП), в первую очередь – отмена АП по любой причине.
Такой подход, который все чаще используется в современных исследованиях, основан на том, что критерий преждевременной отмены АП, как по решению врача, так и пациента, интегрирует все основные аспекты неудовлетворительной терапии (недостаточная эффективность и, соответственно, риск рецидива заболевания, плохая переносимость, опасные для здоровья побочные эффекты и др.), и поддается количественному измерению (частота преждевременной отмены или период времени до отмены) (M.Herz, W.Glazer, M.Mostert и соавт., 1991; H.Liu-Seifert, D.Adams, B.Kinon, 2005; J.Haro, D.Suarez, D.Novick и соавт., 2007; F.Zhao, H.Ascher-Svanum, C.Mitchell и соавт., 2005). Причем такие количественные показатели достаточно валидны. Так, по данным рандомизированных двойных слепых сравнительных исследований, более длительный период времени до отмены АП по любой причине коррелирует с более выраженной редукцией психопатологической симптоматики (F.Zhao, H.Ascher-Svanum, C.Mitchell и соавт., 2005).
Метаанализы
Выполнено несколько метаанализов объединенных баз данных рандомизированных исследований ААП, включая работы J.Davis и соавт. (2003 г.) (17 исследований), J.Geddes и соавт. (2000 г.) (30 исследований), S.Leucht и соавт. (2009 г.) (150 исследований) и др. Авторы использовали сравнительные исследования каждого из ААП с галоперидолом, а в качестве основы для сравнения ААП между собой использовались их отличия от галоперидола по степени редукции стартовых суммарных баллов PANSS. Несмотря на вариабельность статистических методов, количества сравниваемых АП и исследований, данные которых использовались, результаты таких метаанализов достаточно однородны. Достоверное превосходство по эффективности над типичным АП галоперидолом стабильно обнаруживали четыре ААП – амисульприд, клозапин, оланзапин и рисперидон. Так, по данным метаанализа S.Leucht и соавт. (2009 г.), в который были включены данные 21 533 пациентов с шизофренией, участвовавших в 150 кратковременных двойных слепых рандомизированных исследованиях, показано преимущество именно этих четырех ААП перед типичными АП с малым/умеренным размером эффекта: амисульприд -0,31 (95% доверительный интервал – ДИ -0,44–-0,19; p<0,0001), клозапин -0,52 (-0,75–-0,29; p<0,0001), оланзапин -0,28 (-0,38–-0,18; p<0,0001), рисперидон -0,13 (-0,22–-0,05; p=0,002). Другие ААП не превосходили препараты прошлого поколения даже в эффективности редукции негативных симптомов.
Несколько иной метод был использован в метаанализе C.Beasley и соавт. (2007 г.), хотя результаты во многом сопоставимы с данными, полученными в цитированных выше работах. Авторы выполнили анализ объединенных данных 13 очных сравнительных двойных слепых рандомизированных исследований оланзапина длительностью не менее 12 нед (в 3 исследованиях было более двух препаратов сравнения) и с не менее 20 пациентами в каждой терапевтической группе. В отобранных для анализа исследованиях в качестве препаратов сравнения использовались ААП рисперидон, зипрасидон, клозапин, амисуль-прид, кветиапин и типичные АП галоперидол и перфеназин, которые назначались для лечения расстройств шизофренического спектра (шизофрении, шизофреноформного или шизоаффективного расстройства по критериям DSM-IV-TR). В качестве основного критерия для сравнительной оценки эффективности в метаанализе использовался показатель отмены АП.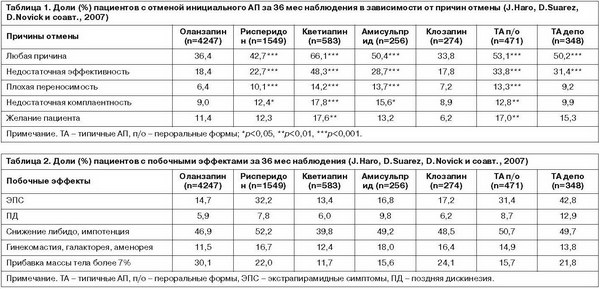 В результате сравнительного анализа ААП установлено, что при назначении оланзапина вероятность преждевременной отмены (отношение рисков – ОР [95% ДИ]) такая же, как при терапии клозапином (1,2 [0,9–1,6]), амисуль-придом (1,1 [0,8–1,6]), но значительно меньше в сравнении с рисперидоном (1,3 [1,1–1,6]), зипрасидоном (1,6 [1,4–2,0]) и кветиапином (1,4 [1,1–1,9]). Что касается типичных АП, то по анализируемому показателю оланзапин был сопоставим с перфеназином (1,3 [0,7–2,1]), но превосходил галоперидол (1,4 [1,2–1,7]).
В результате сравнительного анализа ААП установлено, что при назначении оланзапина вероятность преждевременной отмены (отношение рисков – ОР [95% ДИ]) такая же, как при терапии клозапином (1,2 [0,9–1,6]), амисуль-придом (1,1 [0,8–1,6]), но значительно меньше в сравнении с рисперидоном (1,3 [1,1–1,6]), зипрасидоном (1,6 [1,4–2,0]) и кветиапином (1,4 [1,1–1,9]). Что касается типичных АП, то по анализируемому показателю оланзапин был сопоставим с перфеназином (1,3 [0,7–2,1]), но превосходил галоперидол (1,4 [1,2–1,7]).
Масштабные сравнительные исследования
В отличие от метаанализов результаты длительных проспективных исследований с очной сравнительной оценкой нескольких ААП в условиях, приближенных к рутинной клинической практике, представляются более валидными и ценными, в связи с чем заслуживают более детального рассмотрения.
Исследование CATIE
В рамках крупного проспективного сравнительного исследования CATIE2, спонсированного Национальным институтом психического здоровья США (NIMH), показатель отмены препарата по любой причине использовался в качестве главного критерия для сравнительной оценки АП. Основные характеристики и результаты исследования освещены в публикации (J.Lieberman, T.Stroup, J.McEvoy и соавт., 2005). Целью исследования была сравнительная оценка четырех ААП и одного типичного АП в терапии пациентов с шизофренией (DSM-IV) на протяжении 18 мес. В исследование не включались пациенты с первым эпизодом или резистентные к фармакотерапии, а также с зависимостью от психоактивных веществ и тяжелыми соматическими заболеваниями. В исследовании были две основные фазы двойной слепой рандомизированной терапии, за которыми следовала дополнительная фаза открытой терапии.
В исследование было включено 1493 пациента. Средняя суточная доза АП составила 112,8 мг для зипрасидона, 543,4 мг для кветиапина, 20,1 мг для оланзапина, 3,9 мг для рисперидона и 20,8 мг для перфеназина. Доза каждого АП была максимальной у 40–48% пациентов.
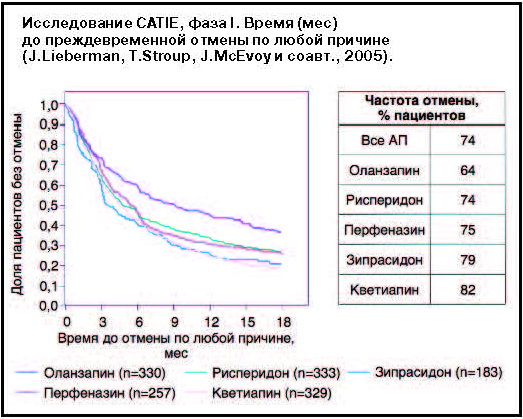
У 74% из 1493 включенных пациентов первый АП (назначенный в фазе I) был отменен до истечения 18 мес наблюдения. В результате сравнительного анализа установлено, что наиболее стабильную длительную терапию 1-го курса терапии обеспечивал оланзапин, преждевременная отмена которого потребовалась в 64% случаев. Частота отмены других АП составила (в порядке нарастания): оланзапин – 64%, рисперидон – 74%, перфеназин – 75%, зипрасидон – 79% и кветиапин – 82%. Длительность лечения оланзапином до отмены по любым причинам также была значительно больше в сравнении с кветиапином (ОР 0,63; p=0,001), рисперидоном
(ОР 0,75; p=0,002), зипрасидоном (ОР 0,76; p=0,028) и перфеназином (ОР 0,78; p=0,021) (см. рисунок).
Медиана (ДИ) длительности 1-го курса терапии оланзапином составила 9,2 (6,9–12,1) мес против 3,5 (3,1–5,4) мес для зипрасидона, 4,6 (3,9–5,5) мес для кветиапина, 4,8 (4,0–6,1) мес для рисперидона, 5,6 (4,5–6,3) мес для перфеназина.
При этом превосходство оланзапина в стабильности и длительности терапии определялось его преимуществом по основным категориям причин отмены. Например, время до отмены терапии из-за недостаточной эффективности после назначения оланзапина было достоверно больше в сравнении с перфеназином (p<0,0001), кветиапином (p<0,001) и рисперидоном (p<0,001), хотя примерно таким же, как в группе зипрасидона (p=0,026). Отличия оланзапина от других АП по времени до преждевременной отмены по решению пациента были примерно такими же, как при сравнении показателей отмены по любой причине.
В рамках дополнительных сравнительных анализов эффективности использовались показатели шкалы общего клинического впечатления (CGI) и шкалы позитивного и негативного синдрома шизофрении (PANSS). В целом при терапии каждым из АП отмечались примерно одинаковое снижение тяжести заболевания пациентов по CGI (p=0,004) и достоверная редукция суммарных баллов PANSS (p=0,002).
Тем не менее длительность эффективной терапии (балл тяжести по шкале общего клинического впечатления – CGI не более 3 или равен 4 при условии улучшения минимум на 2 балла относительно стартовых значений) была достоверно больше при терапии оланзапином в сравнении с кветиапином (p<0,001), рисперидоном (p=0,002) и перфеназином (p=0,013). В свою очередь, достоверно превосходил кветиапин по этому показателю (p=0,021).
Кроме того, пациенты, получавшие оланзапин, достоверно реже госпитализировались в связи с обострениями шизофрении в сравнении с другими АП (p<0,001 для всех сравнений): 11% при терапии оланзапином против 20% после назначения кветиапина, 15% – рисперидона, 15% – зипрасидона и 18% – перфеназина.
Хотя в интервалах времени до преждевременной отмены побочных эффектов не обнаружено (p=0,054), сравниваемые АП существенно различались по показателям частоты отмены, причем отчасти с противоположными тенденциями: реже всего нежелательные явления становились причиной отмены рисперидона (10%), а чаще других АП – оланзапина (18%).
Относительно других побочных эффектов авторы сообщают о значительно более высокой частоте экстрапирамидных расстройств при терапии перфеназином (8% пациентов) в сравнении с ААП (p=0,002).
Исследование SOHO3
Результаты 3-летнего межконтинентального проспективного наблюдательного исследования SOHO, в котором проводилась сравнительная оценка ААП и типичных АП в амбулаторной терапии шизофрении (J.Haro, D.Suarez, D.Novick и соавт., 2007), во многом сопоставимы с данными исследования CATIE. В исследование включались пациенты, которым требовались назначение или замена АП.
В ходе исследования не предусматривалось никаких ограничений по терапии, выбор препаратов, доз и ведение больных были целиком на усмотрение лечащих врачей.
Главным критерием оценки результатов лечения был период до отмены назначенного при включении в исследование АП по любым причинам: недостаточная эффективность, непереносимость, недостаточная комплаентность или желание пациента. Ниже представлены окончательные результаты 3-летнего исследования в 10 европейских странах. Данные 7728 больных были использованы для анализа. Все пациенты получали монотерапию АП. Вследствие особенностей дизайна исследования примерно половина пациентов получали оланзапин (n=4247; 55%), средняя доза 11,8±6,2 мг/сут. В остальных случаях назначался рисперидон (n=1549), 4,8±2,8 мг/сут, кветиапин (n=583), 377±222 мг/сут, амисульприд (n=256), 407±271 мг/сут, клозапин (n=274), 239±149 мг/сут. Кроме того, назначались пероральные типичные АП (n=471; 12 препаратов, включая галоперидол, хлорпромазин, трифлуоперазин, перфеназин, тиоридазин, флупентиксол, сульпирид и др.) и депонированные формы типичных АП (n=348; галоперидол, флупентиксол, флуфеназин цуклопентиксол).
Выявлены значительные различия между АП по долям пациентов с отменой терапии по любым причинам. Наиболее высокие показатели установлены в группах оланзапина и клозапина, в которых 64 и 66% пациентов соответственно продолжали прием инициального АП на протяжении всех 36 мес наблюдения. В группах рисперидона, амисульприда и кветиапина этот показатель был достоверно ниже: 57, 50 и 34% соответственно (p<0,05) (табл. 1). Причем сопоставимость оланзапина и кветиапина и их достоверное превосходство над другими АП сохраняются при сопоставлении долей пациентов с отменой из-за недостаточной эффективности и плохой переносимости терапии, а также неудовлетворительной комплаентности пациента (см. табл. 1).
Также выявлены определенные различия в профилях переносимости АП, но без оценки их статистической достоверности (табл. 2).
Экстрапирамидные расстройства чаще развивались при терапии рисперидоном и типичными АП в сравнении с другими АП. Частота поздней дискинезии была существенно выше у пациентов, получавших рисперидон, амисуль-прид и типичные АП. Симптомы гиперпролактинемии (утрата либидо, импотенция, гинекомастия, галакторея, аменорея) примерно с одинаковой частотой развивались во всех терапевтических группах. Прибавка массы тела, как и в исследовании CATIE, была более выраженной при терапии оланзапином и составила в среднем 3,6 кг за 36 мес исследования.
В рамках выполненного в США 3-летнего сравнительного проспективного натуралистического исследования US SCAP оценивалась эффективность ААП и типичных АП у 2327 пациентов с расстройствами шизофренического спектра (M.Swartz, B.Zhu, H.Ascher-Svanum и соавт., 2005). Примерно половина пациентов (n=1028) ранее получали терапию различными АП (60% – 1 курс, 28% – 2 курса, остальные 3 курса и более). Главным критерием оценки эффективности в исследовании был период времени до отмены препарата по любым причинам. В ходе исследования пациенты получали следующие АП (с указанием средних доз): клозапин (364,4 мг/сут), оланзапин (14,0 мг/сут), рисперидон (4,3 мг/сут), кветиапин (340,2 мг/сут), зипрасидон (107,6 мг/сут) и перфеназин (14,8 мг/сут).
В результате исследования показано, что интервал времени до отмены по любой причине ААП был значительно больше, чем длительность применения типичных АП (p<0,001).
По результатам статистических сравнительных анализов каждого ААП с перфеназином только клозапин и оланзапин достоверно превосходили перфеназин по длительности терапии до отмены по любой причине, тогда как рисперидон, кветиапин и зипрасидон обнаруживали сходные с перфеназином показатели (M.Swartz, B.Zhu, H.Ascher-Svanum и соавт., 2005).
Заключение
Результаты сравнительных оценок эффективности современных ААП, выполненных в рамках метаанализов и масштабных проспективных клинических исследований, свидетельствуют о значительных различиях между препаратами этого класса. В совокупности приведенные данные, основанные на глобальном критерии отмены терапии по любым причинам, отражают сопоставимость двух ААП – оланзапина и клозапина – и превосходство оланзапина над другими ААП, широко используемыми в современной клинической практике. Однако очевидно, что несмотря на ценность такого критерия с точки зрения практического применения АП, он все-таки не охватывает всех значимых факторов, влияющих на выбор АП в каждом конкретном случае. Как минимум остается мало разработанной проблема дифференциации ААП по спектрам предпочтительных симптомов-мишеней для каждого из представителей этого класса АП, решение которой в значительной мере способствовало бы выбору оптимального препарата в зависимости от индивидуальных синдромальных особенностей и этапа заболевания (экзацербация, ремиссия). Тем не менее на основании приведенных данных можно рассматривать оланзапин в ряду препаратов первого выбора среди ААП для терапии пациентов с шизофренией и расстройствами шизофренического спектра. Такое положение также подкрепляется благоприятным профилем переносимости и преимуществом полного спектра фармакологических форм оланзапина (стандартная пероральная таблетка, раствор для внутримышечных инъекций короткого действия, быстрорастворимая пероральная таблетка и инъекционная форма депо), полностью обеспечивающих преемственность лечения оланзапином во всех фазах терапии шизофрении, включая купирующую и длительную поддерживающую терапию.
От редакции
В настоящее время компания «Гедеон Рихтер» выпустила препарат Парнасан МНН Оланзапина. Препарат имеет таблетированную форму выпуска в дозировках 5 мг №30 и 10 мг №30.
Сведения об авторе
С.В.Иванов – д-р мед. наук, зав. отд-нием соматогенной психической патологии ФГБУ НЦПЗ РАМН. E-mail: stanislvi@gmail.com
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№02 2012
Клинические характеристики атипичных антипсихотиков: результаты сравнительных исследований при шизофрении №02 2012
Номера страниц в выпуске:45-49
В статье рассматриваются вопросы дифференциации современных атипичных антипсихотиков по показателям клинической эффективности. Обсуждаются результаты основных сравнительных исследований, выполненных методом метаанализа и проспективного длительного наблюдения в условиях, приближенных к рутинной клинической практике. Результаты исследований позволяют рассматривать оланзапин в ряду атипичных антипсихотиков первого выбора для терапии шизофрении и расстройств шизофренического спектра.
 Резюме. В статье рассматриваются вопросы дифференциации современных атипичных антипсихотиков по показателям клинической эффективности. Обсуждаются результаты основных сравнительных исследований, выполненных методом метаанализа и проспективного длительного наблюдения в условиях, приближенных к рутинной клинической практике. Результаты исследований позволяют рассматривать оланзапин в ряду атипичных антипсихотиков первого выбора для терапии шизофрении и расстройств шизофренического спектра.
Резюме. В статье рассматриваются вопросы дифференциации современных атипичных антипсихотиков по показателям клинической эффективности. Обсуждаются результаты основных сравнительных исследований, выполненных методом метаанализа и проспективного длительного наблюдения в условиях, приближенных к рутинной клинической практике. Результаты исследований позволяют рассматривать оланзапин в ряду атипичных антипсихотиков первого выбора для терапии шизофрении и расстройств шизофренического спектра.
Ключевые слова: атипичные антипсихотики, шизофрения, эффективность.
Clinical characteristics of atypical antipsychotics: results from comparative studies
in schizophrenia
S.V.Ivanov
Mental Health Research Center RAMS, Moscow
Summary. Questions of differentiation of atypical antipsychotics in terms of effectiveness are discussed. The data from main contemporary meta-analyses and long-term large-scale prospective comparative studies in conditions close to routine clinical practice are presented. The results confirm the place of olanzapine among antipsychotics of first choice for patients with schizophrenia and schizophrenic spectrum disorders.
Key words: atypical antipsychotics, schizophrenia, effectiveness.
Введение
 Внушительный арсенал используемых в современной клинической практике атипичных антипсихотиков (ААП), насчитывающий восемь препаратов (амисульприд, арипипразол, зипрасидон, кветиапин, клозапин, оланзапин, рисперидон, сертиндол)1, определяет актуальность проблемы выбора оптимального средства для фармакотерапии больных шизофренией. Однако решение этого вопроса представляется сложной задачей. При сопоставимости показателей эффективности в опубликованных рандомизированных исследованиях монотерапии каждым из ААП накопленный опыт их клинического применения противоречит представлению об эквивалентности ААП по всем основным параметрам, включая степень редукции симптомов в рамках каждой дименсиональной категории шизофрении (позитивные, негативные, аффективные и когнитивные расстройства), а также профилям переносимости и безопасности. В связи с этим возникает необходимость восполнения дефицита научной информации в аспекте сравнительных характеристик ААП. Очные сравнительные рандомизированные исследования, как правило, ограничиваются двумя ААП и не позволяют сделать глобальных выводов по всем представителям этого класса психо-тропных средств. Поэтому для решения этой проблемы в современной клинической психиатрии приоритетными становятся два направления исследований:
Внушительный арсенал используемых в современной клинической практике атипичных антипсихотиков (ААП), насчитывающий восемь препаратов (амисульприд, арипипразол, зипрасидон, кветиапин, клозапин, оланзапин, рисперидон, сертиндол)1, определяет актуальность проблемы выбора оптимального средства для фармакотерапии больных шизофренией. Однако решение этого вопроса представляется сложной задачей. При сопоставимости показателей эффективности в опубликованных рандомизированных исследованиях монотерапии каждым из ААП накопленный опыт их клинического применения противоречит представлению об эквивалентности ААП по всем основным параметрам, включая степень редукции симптомов в рамках каждой дименсиональной категории шизофрении (позитивные, негативные, аффективные и когнитивные расстройства), а также профилям переносимости и безопасности. В связи с этим возникает необходимость восполнения дефицита научной информации в аспекте сравнительных характеристик ААП. Очные сравнительные рандомизированные исследования, как правило, ограничиваются двумя ААП и не позволяют сделать глобальных выводов по всем представителям этого класса психо-тропных средств. Поэтому для решения этой проблемы в современной клинической психиатрии приоритетными становятся два направления исследований: 2) масштабные натуралистические сравнительные исследования в условиях, приближенных к рутинной клинической практике. В данной публикации представлены основные результаты сравнительных метаанализов и сравнительных натуралистических исследований эффективности и переносимости ААП в терапии шизофрении. Основное внимание будет уделяться исследованиям, в которых использовались более адекватные для рутинной практики критерии клинической ценности антипсихотика (АП), в первую очередь – отмена АП по любой причине.
Такой подход, который все чаще используется в современных исследованиях, основан на том, что критерий преждевременной отмены АП, как по решению врача, так и пациента, интегрирует все основные аспекты неудовлетворительной терапии (недостаточная эффективность и, соответственно, риск рецидива заболевания, плохая переносимость, опасные для здоровья побочные эффекты и др.), и поддается количественному измерению (частота преждевременной отмены или период времени до отмены) (M.Herz, W.Glazer, M.Mostert и соавт., 1991; H.Liu-Seifert, D.Adams, B.Kinon, 2005; J.Haro, D.Suarez, D.Novick и соавт., 2007; F.Zhao, H.Ascher-Svanum, C.Mitchell и соавт., 2005). Причем такие количественные показатели достаточно валидны. Так, по данным рандомизированных двойных слепых сравнительных исследований, более длительный период времени до отмены АП по любой причине коррелирует с более выраженной редукцией психопатологической симптоматики (F.Zhao, H.Ascher-Svanum, C.Mitchell и соавт., 2005).
Метаанализы
Выполнено несколько метаанализов объединенных баз данных рандомизированных исследований ААП, включая работы J.Davis и соавт. (2003 г.) (17 исследований), J.Geddes и соавт. (2000 г.) (30 исследований), S.Leucht и соавт. (2009 г.) (150 исследований) и др. Авторы использовали сравнительные исследования каждого из ААП с галоперидолом, а в качестве основы для сравнения ААП между собой использовались их отличия от галоперидола по степени редукции стартовых суммарных баллов PANSS. Несмотря на вариабельность статистических методов, количества сравниваемых АП и исследований, данные которых использовались, результаты таких метаанализов достаточно однородны. Достоверное превосходство по эффективности над типичным АП галоперидолом стабильно обнаруживали четыре ААП – амисульприд, клозапин, оланзапин и рисперидон. Так, по данным метаанализа S.Leucht и соавт. (2009 г.), в который были включены данные 21 533 пациентов с шизофренией, участвовавших в 150 кратковременных двойных слепых рандомизированных исследованиях, показано преимущество именно этих четырех ААП перед типичными АП с малым/умеренным размером эффекта: амисульприд -0,31 (95% доверительный интервал – ДИ -0,44–-0,19; p<0,0001), клозапин -0,52 (-0,75–-0,29; p<0,0001), оланзапин -0,28 (-0,38–-0,18; p<0,0001), рисперидон -0,13 (-0,22–-0,05; p=0,002). Другие ААП не превосходили препараты прошлого поколения даже в эффективности редукции негативных симптомов.
Несколько иной метод был использован в метаанализе C.Beasley и соавт. (2007 г.), хотя результаты во многом сопоставимы с данными, полученными в цитированных выше работах. Авторы выполнили анализ объединенных данных 13 очных сравнительных двойных слепых рандомизированных исследований оланзапина длительностью не менее 12 нед (в 3 исследованиях было более двух препаратов сравнения) и с не менее 20 пациентами в каждой терапевтической группе. В отобранных для анализа исследованиях в качестве препаратов сравнения использовались ААП рисперидон, зипрасидон, клозапин, амисуль-прид, кветиапин и типичные АП галоперидол и перфеназин, которые назначались для лечения расстройств шизофренического спектра (шизофрении, шизофреноформного или шизоаффективного расстройства по критериям DSM-IV-TR). В качестве основного критерия для сравнительной оценки эффективности в метаанализе использовался показатель отмены АП.
 В результате сравнительного анализа ААП установлено, что при назначении оланзапина вероятность преждевременной отмены (отношение рисков – ОР [95% ДИ]) такая же, как при терапии клозапином (1,2 [0,9–1,6]), амисуль-придом (1,1 [0,8–1,6]), но значительно меньше в сравнении с рисперидоном (1,3 [1,1–1,6]), зипрасидоном (1,6 [1,4–2,0]) и кветиапином (1,4 [1,1–1,9]). Что касается типичных АП, то по анализируемому показателю оланзапин был сопоставим с перфеназином (1,3 [0,7–2,1]), но превосходил галоперидол (1,4 [1,2–1,7]).
В результате сравнительного анализа ААП установлено, что при назначении оланзапина вероятность преждевременной отмены (отношение рисков – ОР [95% ДИ]) такая же, как при терапии клозапином (1,2 [0,9–1,6]), амисуль-придом (1,1 [0,8–1,6]), но значительно меньше в сравнении с рисперидоном (1,3 [1,1–1,6]), зипрасидоном (1,6 [1,4–2,0]) и кветиапином (1,4 [1,1–1,9]). Что касается типичных АП, то по анализируемому показателю оланзапин был сопоставим с перфеназином (1,3 [0,7–2,1]), но превосходил галоперидол (1,4 [1,2–1,7]).
Масштабные сравнительные исследования
В отличие от метаанализов результаты длительных проспективных исследований с очной сравнительной оценкой нескольких ААП в условиях, приближенных к рутинной клинической практике, представляются более валидными и ценными, в связи с чем заслуживают более детального рассмотрения.
Исследование CATIE
В рамках крупного проспективного сравнительного исследования CATIE2, спонсированного Национальным институтом психического здоровья США (NIMH), показатель отмены препарата по любой причине использовался в качестве главного критерия для сравнительной оценки АП. Основные характеристики и результаты исследования освещены в публикации (J.Lieberman, T.Stroup, J.McEvoy и соавт., 2005). Целью исследования была сравнительная оценка четырех ААП и одного типичного АП в терапии пациентов с шизофренией (DSM-IV) на протяжении 18 мес. В исследование не включались пациенты с первым эпизодом или резистентные к фармакотерапии, а также с зависимостью от психоактивных веществ и тяжелыми соматическими заболеваниями. В исследовании были две основные фазы двойной слепой рандомизированной терапии, за которыми следовала дополнительная фаза открытой терапии.
В исследование было включено 1493 пациента. Средняя суточная доза АП составила 112,8 мг для зипрасидона, 543,4 мг для кветиапина, 20,1 мг для оланзапина, 3,9 мг для рисперидона и 20,8 мг для перфеназина. Доза каждого АП была максимальной у 40–48% пациентов.
У 74% из 1493 включенных пациентов первый АП (назначенный в фазе I) был отменен до истечения 18 мес наблюдения. В результате сравнительного анализа установлено, что наиболее стабильную длительную терапию 1-го курса терапии обеспечивал оланзапин, преждевременная отмена которого потребовалась в 64% случаев. Частота отмены других АП составила (в порядке нарастания): оланзапин – 64%, рисперидон – 74%, перфеназин – 75%, зипрасидон – 79% и кветиапин – 82%. Длительность лечения оланзапином до отмены по любым причинам также была значительно больше в сравнении с кветиапином (ОР 0,63; p=0,001), рисперидоном
(ОР 0,75; p=0,002), зипрасидоном (ОР 0,76; p=0,028) и перфеназином (ОР 0,78; p=0,021) (см. рисунок).
Медиана (ДИ) длительности 1-го курса терапии оланзапином составила 9,2 (6,9–12,1) мес против 3,5 (3,1–5,4) мес для зипрасидона, 4,6 (3,9–5,5) мес для кветиапина, 4,8 (4,0–6,1) мес для рисперидона, 5,6 (4,5–6,3) мес для перфеназина.
При этом превосходство оланзапина в стабильности и длительности терапии определялось его преимуществом по основным категориям причин отмены. Например, время до отмены терапии из-за недостаточной эффективности после назначения оланзапина было достоверно больше в сравнении с перфеназином (p<0,0001), кветиапином (p<0,001) и рисперидоном (p<0,001), хотя примерно таким же, как в группе зипрасидона (p=0,026). Отличия оланзапина от других АП по времени до преждевременной отмены по решению пациента были примерно такими же, как при сравнении показателей отмены по любой причине.
В рамках дополнительных сравнительных анализов эффективности использовались показатели шкалы общего клинического впечатления (CGI) и шкалы позитивного и негативного синдрома шизофрении (PANSS). В целом при терапии каждым из АП отмечались примерно одинаковое снижение тяжести заболевания пациентов по CGI (p=0,004) и достоверная редукция суммарных баллов PANSS (p=0,002).
Тем не менее длительность эффективной терапии (балл тяжести по шкале общего клинического впечатления – CGI не более 3 или равен 4 при условии улучшения минимум на 2 балла относительно стартовых значений) была достоверно больше при терапии оланзапином в сравнении с кветиапином (p<0,001), рисперидоном (p=0,002) и перфеназином (p=0,013). В свою очередь, достоверно превосходил кветиапин по этому показателю (p=0,021).
Кроме того, пациенты, получавшие оланзапин, достоверно реже госпитализировались в связи с обострениями шизофрении в сравнении с другими АП (p<0,001 для всех сравнений): 11% при терапии оланзапином против 20% после назначения кветиапина, 15% – рисперидона, 15% – зипрасидона и 18% – перфеназина.
Хотя в интервалах времени до преждевременной отмены побочных эффектов не обнаружено (p=0,054), сравниваемые АП существенно различались по показателям частоты отмены, причем отчасти с противоположными тенденциями: реже всего нежелательные явления становились причиной отмены рисперидона (10%), а чаще других АП – оланзапина (18%).
Относительно других побочных эффектов авторы сообщают о значительно более высокой частоте экстрапирамидных расстройств при терапии перфеназином (8% пациентов) в сравнении с ААП (p=0,002).
Исследование SOHO3
Результаты 3-летнего межконтинентального проспективного наблюдательного исследования SOHO, в котором проводилась сравнительная оценка ААП и типичных АП в амбулаторной терапии шизофрении (J.Haro, D.Suarez, D.Novick и соавт., 2007), во многом сопоставимы с данными исследования CATIE. В исследование включались пациенты, которым требовались назначение или замена АП.
В ходе исследования не предусматривалось никаких ограничений по терапии, выбор препаратов, доз и ведение больных были целиком на усмотрение лечащих врачей.
Главным критерием оценки результатов лечения был период до отмены назначенного при включении в исследование АП по любым причинам: недостаточная эффективность, непереносимость, недостаточная комплаентность или желание пациента. Ниже представлены окончательные результаты 3-летнего исследования в 10 европейских странах. Данные 7728 больных были использованы для анализа. Все пациенты получали монотерапию АП. Вследствие особенностей дизайна исследования примерно половина пациентов получали оланзапин (n=4247; 55%), средняя доза 11,8±6,2 мг/сут. В остальных случаях назначался рисперидон (n=1549), 4,8±2,8 мг/сут, кветиапин (n=583), 377±222 мг/сут, амисульприд (n=256), 407±271 мг/сут, клозапин (n=274), 239±149 мг/сут. Кроме того, назначались пероральные типичные АП (n=471; 12 препаратов, включая галоперидол, хлорпромазин, трифлуоперазин, перфеназин, тиоридазин, флупентиксол, сульпирид и др.) и депонированные формы типичных АП (n=348; галоперидол, флупентиксол, флуфеназин цуклопентиксол).
Выявлены значительные различия между АП по долям пациентов с отменой терапии по любым причинам. Наиболее высокие показатели установлены в группах оланзапина и клозапина, в которых 64 и 66% пациентов соответственно продолжали прием инициального АП на протяжении всех 36 мес наблюдения. В группах рисперидона, амисульприда и кветиапина этот показатель был достоверно ниже: 57, 50 и 34% соответственно (p<0,05) (табл. 1). Причем сопоставимость оланзапина и кветиапина и их достоверное превосходство над другими АП сохраняются при сопоставлении долей пациентов с отменой из-за недостаточной эффективности и плохой переносимости терапии, а также неудовлетворительной комплаентности пациента (см. табл. 1).
Также выявлены определенные различия в профилях переносимости АП, но без оценки их статистической достоверности (табл. 2).
Экстрапирамидные расстройства чаще развивались при терапии рисперидоном и типичными АП в сравнении с другими АП. Частота поздней дискинезии была существенно выше у пациентов, получавших рисперидон, амисуль-прид и типичные АП. Симптомы гиперпролактинемии (утрата либидо, импотенция, гинекомастия, галакторея, аменорея) примерно с одинаковой частотой развивались во всех терапевтических группах. Прибавка массы тела, как и в исследовании CATIE, была более выраженной при терапии оланзапином и составила в среднем 3,6 кг за 36 мес исследования.
В рамках выполненного в США 3-летнего сравнительного проспективного натуралистического исследования US SCAP оценивалась эффективность ААП и типичных АП у 2327 пациентов с расстройствами шизофренического спектра (M.Swartz, B.Zhu, H.Ascher-Svanum и соавт., 2005). Примерно половина пациентов (n=1028) ранее получали терапию различными АП (60% – 1 курс, 28% – 2 курса, остальные 3 курса и более). Главным критерием оценки эффективности в исследовании был период времени до отмены препарата по любым причинам. В ходе исследования пациенты получали следующие АП (с указанием средних доз): клозапин (364,4 мг/сут), оланзапин (14,0 мг/сут), рисперидон (4,3 мг/сут), кветиапин (340,2 мг/сут), зипрасидон (107,6 мг/сут) и перфеназин (14,8 мг/сут).
В результате исследования показано, что интервал времени до отмены по любой причине ААП был значительно больше, чем длительность применения типичных АП (p<0,001).
По результатам статистических сравнительных анализов каждого ААП с перфеназином только клозапин и оланзапин достоверно превосходили перфеназин по длительности терапии до отмены по любой причине, тогда как рисперидон, кветиапин и зипрасидон обнаруживали сходные с перфеназином показатели (M.Swartz, B.Zhu, H.Ascher-Svanum и соавт., 2005).
Заключение
Результаты сравнительных оценок эффективности современных ААП, выполненных в рамках метаанализов и масштабных проспективных клинических исследований, свидетельствуют о значительных различиях между препаратами этого класса. В совокупности приведенные данные, основанные на глобальном критерии отмены терапии по любым причинам, отражают сопоставимость двух ААП – оланзапина и клозапина – и превосходство оланзапина над другими ААП, широко используемыми в современной клинической практике. Однако очевидно, что несмотря на ценность такого критерия с точки зрения практического применения АП, он все-таки не охватывает всех значимых факторов, влияющих на выбор АП в каждом конкретном случае. Как минимум остается мало разработанной проблема дифференциации ААП по спектрам предпочтительных симптомов-мишеней для каждого из представителей этого класса АП, решение которой в значительной мере способствовало бы выбору оптимального препарата в зависимости от индивидуальных синдромальных особенностей и этапа заболевания (экзацербация, ремиссия). Тем не менее на основании приведенных данных можно рассматривать оланзапин в ряду препаратов первого выбора среди ААП для терапии пациентов с шизофренией и расстройствами шизофренического спектра. Такое положение также подкрепляется благоприятным профилем переносимости и преимуществом полного спектра фармакологических форм оланзапина (стандартная пероральная таблетка, раствор для внутримышечных инъекций короткого действия, быстрорастворимая пероральная таблетка и инъекционная форма депо), полностью обеспечивающих преемственность лечения оланзапином во всех фазах терапии шизофрении, включая купирующую и длительную поддерживающую терапию.
От редакции
В настоящее время компания «Гедеон Рихтер» выпустила препарат Парнасан МНН Оланзапина. Препарат имеет таблетированную форму выпуска в дозировках 5 мг №30 и 10 мг №30.
Сведения об авторе
С.В.Иванов – д-р мед. наук, зав. отд-нием соматогенной психической патологии ФГБУ НЦПЗ РАМН. E-mail: stanislvi@gmail.com
Список исп. литературыСкрыть список1. Beasley CM Jr, Stauffer VL, Liu-Seifert H et al. All-cause treatment discontinuation in schizophrenia during treatment with olanzapine relative to other antipsychotics: an integrated analysis. J Clin Psychopharmacol 2007; 27 (3): 252–8.
2. Davis JM, Chen N, Glick ID. A meta-analysis of the efficacy of second-generation antipsychotics. Arch Gen Psychiat 2003; 60 (6): 553–64.
3. Geddes J, Freemantle N, Harrison P, Bebbington P. Atypical antipsychotics in the treatment of schizophrenia: systematic overview and meta-regression analysis. Br Med J 2000; 321: 1371–6.
4. Haro JM, Suarez D, Novick D et al. SOHO Study Group. Three-year antipsychotic effectiveness in the outpatient care of schizophrenia: observational versus randomized studies results. Eur Neuropsychopharmacol 2007; 17 (4): 235–44.
5. Herz MI, Glazer WM, Mostert MA et al. Intermittent vs maintenance medication in schizophrenia: two-year results. Arch Gen Psychiat 1991; 48: 333–9.
6. Leucht S, Corves C, Arbter D et al. Second-generation versus first-generation antipsychotic drugs for schizophrenia: a meta-analysis. The Lancet 2009; 373 (9657): 31–41.
7. Lieberman JA, Stroup TS, McEvoy JP et al. Effectiveness of antipsychotic drugs in patients with chronic schizophrenia. N Engl J Med 2005; 353: 1209–23.
8. Liu-Seifert H, Adams DH, Kinon BJ. Discontinuation of treatment of schizophrenic patients is driven by poor symptom response: a pooled post-hoc analysis of four atypical antipsychotic drugs. BMC Med 2005; 23 (3): 21.
9. Swartz M, Zhu B, Ascher-Svanum H et al. Time to all-cause discontinuation of atypical versus typical antipsychotics in the naturalistic treatment of schizophrenia. Schizophr Bull 2005; 31 (2): 551.
10. Zhao F, Ascher-Svanum H, Mitchell CP et al. Increased time to all-cause antipsychotic trial discontinuation is associated with better schizophrenia treatment outcomes. Schizophr Bull 2005; 31 (2): 508.

