Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Абстракт
Психические расстройства, протекающие с разнообразными соматическими симптомами, известны человечеству с незапамятных времён. Исторически первое описание того, что позже было названо «истерией», а сегодня зовётся конверсионным расстройством или функциональным неврологическим расстройством, – содержится ещё в древнеегипетском Папирусе Эберса, авторство оригинала которого безымянный переписчик приписывает вице-фараону Имхотепу (ок. 2700 г. до нашей эры). А исторически первое описание «меланхолии» (то есть депрессии с выраженными витальными, соматическими симптомами) было дано ещё Гиппократом (ок. 460–370 г. до нашей эры). Впоследствии изучение и попытки лечения обоих этих расстройств сыграли огромную роль в истории психиатрии.
Как показывают современные эпидемиологические данные, различные соматоформные, соматизированные и конверсионные расстройства встречаются в популяции намного чаще, чем было принято считать ранее. В то же время эти разновидности психических расстройств часто приводят к инвалидизации пациентов, в среднем плохо поддаются лечению, часто проявляют признаки терапевтической резистентности или, наоборот, «отрицательной терапевтической резистентности» (интолерантности к психотропным лекарствам) и часто бывают коморбидны с депрессивными и тревожными расстройствами, часто осложняются присоединением тех или иных химических зависимостей, в том числе, порой, ятрогенных. Всё это обуславливает актуальность проблемы их лечения.
В данной статье мы обосновываем, почему, вследствие ряда особенностей его рецепторного профиля, атипичный антидепрессант (ААД) тразодон может во многих случаях оказаться наиболее подходящим выбором для психофармакотерапии (ПФТ) этих расстройств, рассматриваем имеющуюся доказательную базу для его применения в этом качестве, а затем представляем два клинических случая эффективности тразодона при лечении соматоформных расстройств из нашей собственной практики.
Ключевые слова: истерия, конверсионное расстройство, соматоформное расстройство, соматизированное расстройство, ипохондрия, соматоформный болевой синдром.
Для цитирования: Р.А. Беккер, Ю.В. Быков. Об эффективности и безопасности тразодона при расстройствах с соматическими симптомами (Обзор литературы и представление двух клинических случаев). Психиатрия и психофармакотерапия. 2022; 2: 15–32.
On the efficacy and safety of trazodone in somatic symptom disorders (A Literature Review with Presentation of Two Clinical Cases)
R.A. Bekker1, Yu.V. Bykov2
Abstract
Mental disorders with a variety of somatic symptoms have been known to mankind since prehistoric times. Historically, the first description of what was later called «hysteria» and what today is called a conversion disorder or a functional neurological disorder is contained in the ancient Egyptian Ebers Papyrus, the authorship of the original of which is attributed by an unnamed scribe to the Vice-Pharaoh Imhotep (c. 2700 BC). Also historically the first description of so-called «melancholy» (that is, depression with pronounced vital, somatic symptoms) was given by Hippocrates (c. 460—370 BC). Subsequently, the scientific study and attempts to treat both of these disorders played a huge role in the history of psychiatry.
As modern epidemiological data show, various somatoform, somatization and conversion disorders occur in the population much more often than previously thought. At the same time, these types of mental disorders often lead to severe disability, are often difficult to treat, often show signs of therapeutic resistance or, conversely, «negative therapeutic resistance» (intolerance to psychotropic drugs). Those disorders also are often comorbid with depressive and anxiety disorders. Their lifetime course is often complicated by the development of certain chemical dependencies, including, at times, iatrogenic ones. All this said, the actuality of having an effective treatment for those disorders should be evident to the reader.
In this article, we justify why, due to a number of distinctive features of its receptor profile, the atypical antidepressant trazodone may in many cases be the most appropriate choice for psychopharmacotherapy of those disorders. Then we briefly review the available evidence base for the use of trazodone to treat those disorders. Then we present two clinical cases which illustrate the effectiveness and safety of trazodone in the treatment of somatoform disorders in our own practice.
Keywords: hysteria, conversion disorder, somatoform disorder, somatization disorder, hypochondriasis, somatoform pain syndrome, somatoform autonomic dysfunction, alpha-1 adrenoceptor, 5-HT1A receptor, 5-HT2A receptor, trazodone.
For citation: R.A. Bekker, Yu.V. Bykov. On the efficacy and safety of trazodone in somatic symptom disorders (A Literature Review with Presentation of Two Clinical Cases). Psychiatry and psychopharmacotherapy. 2022; 2: 15–32.
Введение (Немного об истории психосоматических расстройств)
Психические расстройства, протекающие с многообразными соматическими симптомами, известны человечеству с глубокой древности. И с древнейших же времён человечеством предпринимались попытки их классификации и лечения [Dollie F, 1974; Okasha A, 2001].
Ещё древнеегипетские врачи в знаменитом «Папирусе Эберса», который датируется 1550 годом до нашей эры и авторство которого безымянный его копировщик приписывает вице-фараону Имхотепу, жившему ещё намного раньше (около 2700 года до нашей эры) и впоследствии провозглашённому древнеегипетскими жрецами богом-покровителем медицины, впервые описали некое психическое расстройство, поразительно напоминающее по своим симптомам то расстройство, которое позднее знаменитый древнегреческий врач, Гиппократ из Коса (живший между 460 и 370 годами до нашей эры), назовёт «истерией». Более того, древние египтяне задолго до Гиппократа выдвинули теорию о том, что, якобы, природа этого расстройства связана с «блужданием матки» [Dollie F, 1974; Okasha A, 2001].
Позднее Гиппократ из Коса, наряду с повторным описанием «истерии» и введением для неё этого наименования, описал в своих трудах классическую картину тяжёлой «эндогенной», меланхолической формы депрессии, и предложил для неё название «меланхолия». При этом он особо выделил и подчеркнул наличие в картине этой болезни, наряду с психическими симптомами, такими как тяжёлая тоска и подавленность, нежелание жить, отсутствие способности радоваться и испытывать удовольствие от жизни, выраженная тревожность, также целого ряда характерных соматических симптомов, таких, как снижение или отсутствие аппетита, бессонница, исхудание, физическая слабость, разнообразные телесные боли, запоры, учащённое сердцебиение, потливость, тремор [Bourgeois ML, 2002; Crocq MA, 2015].
Как само описание меланхолической формы депрессии, впервые данное Гиппократом из Коса, так и выделение этой формы депрессии из прочих возможных форм её протекания по сей день сохраняют свою актуальность. В МКБ-10 и в DSM-IV-TR эта форма депрессии называется «депрессия с соматическими симптомами». Это наименование ещё раз подчёркивает важность выделения и изучения именно соматических симптомов в общей картине депрессивного расстройства, как для правильной диагностики и дифференциальной диагностики, так и для планирования адекватного лечения [Bourgeois ML, 2002; Crocq MA, 2015; Мазо ГЭ, Незнанов НГ, 2012].
Так называемая «атипичная» форма депрессии, в свою очередь, отличается от «классической меланхолической» её формы – не чем иным, как именно инвертированными соматовегетативными признаками – повышением аппетита (гиперфагией) вместо его снижения или полного исчезновения (гипорексии или даже полной анорексии), прибавкой массы тела вместо исхудания, повышенной сонливостью или увеличением суточного количества сна (гиперсомнией) вместо бессонницы (инсомнии), свинцовой тяжестью или болями в конечностях (то есть в дистальных концах тела) вместо сдавливания, тяжести или болей в центре тела – за грудиной («витальной тоски», «сердечной тоски») [Bourgeois ML, 2002; Crocq MA, 2015; Мазо ГЭ, Незнанов НГ, 2012].
Часто наблюдаемая при депрессивных и тревожных расстройствах триада соматовегетативных симптомов, отражающая гиперактивность симпато-адреналовой части вегетативной нервной системы (ВНС) при этих заболеваниях, – расширение зрачков (мидриаз), тахикардия и спастические запоры (при депрессиях) либо склонность к метеоризму и диарее (при тревожных состояниях) – настолько характерна, что даже получила в своё время название «триада Протопопова». Однако нередко наблюдаются при депрессиях и тревожных расстройствах и другие симптомы гиперактивности симпато-адреналового отдела ВНС, в частности такие, как тошнота, сухость во рту, колебания артериального давления с наклонностью к его повышению и большой пульсовой разницей, бледность кожных покровов, холодные руки и ноги, потливость (гипергидроз), тремор, напряжение скелетных мышц, спонтанная акатизия (непоседливость, неусидчивость, потребность постоянно менять позу) в отсутствие предшествующего приёма психотропных препаратов, способных вызвать акатизию [Gupta RK, 2009; Мазо ГЭ, Незнанов НГ, 2012].
В совсем недавнем историческом прошлом многие учёные, в частности выдающийся швейцарский психиатр Поль Кильхольц, посвятили много времени изучению и поиску способов лечения так называемых «маскированных», или соматизированных депрессий, а также состояний «маскированной», или соматизированной тревоги, то есть – таких состояний, при которых пациент, возможно, вообще не ощущает или в сравнительно малой степени ощущает субъективное чувство тревоги или тоски, подавленности, депрессии – однако эти состояния, тем не менее, проявляются определёнными соматовегетативными симптомами, иногда очень обильными, очень разнообразными и имеющими тяжёлый, даже инвалидизирующий пациента характер [Беккер РА с соавт, 2019].
С другой же стороны, исследование и попытки лечения того расстройства, которое Гиппократ, описав, впервые предложил назвать «истерией», – тоже сыграло огромную роль в истории зарождения и развития всей современной психиатрии, не меньшую, чем исследование депрессивных расстройств. Именно из изучения и попыток лечения пациенток с «истерией» – выросли сначала медицинский гипноз, принесённый в психиатрию и неврологию знаменитым французским неврологом Жаном Мартеном Шарко, а затем – теория и практика психоанализа Зигмунда Фрейда – ставшая исторически первой попыткой поставить известную ещё с догиппократовских времён наивную эмпирическую практику психотерапии («лечения ободряющим словом») на прочную научную и идейно-философскую основу [Морозов ПВ с соавт, 2020].
Между тем, как мы сегодня знаем, «все мы вышли из фрейдовской шинели». Все направления современной психотерапии выросли либо из дальнейшего развития и обогащения «классического фрейдизма» (неофрейдизм), либо из отрицания его отдельных догматов при сохранении общего психоаналитического, психодинамического подхода (юнгианская, адлерианская и другие психоаналитические и психодинамические школы), либо из отрицания самой идеи психоанализа и поиска других, более практичных и эффективных и более быстродействующих методов психотерапии (такова, например, когнитивно-поведенческая психотерапия – КПТ) [Морозов ПВ с соавт, 2020].
В последующем, по мере продолжения изучения «истерии», стало понятно, что это – не одно какое-то расстройство, а большая и весьма гетерогенная по клинической картине и степени тяжести группа психических расстройств с различным патогенезом, разным течением и прогнозом. Кроме того, само название этой болезни – «истерия», которое ещё со времён Гиппократа было исторически сопряжено с представлением о «бешенстве матки» и о недостатке сексуальной активности как причине этой болезни (это отражено даже в самой этимологии древнегреческого слова hysteria), – со временем стало восприниматься как оскорбительное, стигматизирующее, дискриминационное и сексистское. Более того, оно научно некорректно, так как ещё Зигмунд Фрейд доказал, что «истерией» могут страдать вовсе не только женщины [Морозов ПВ
с соавт, 2020].
На основании новых научных данных ту гетерогенную группу расстройств, которые раньше обобщённо называли «истерией», в МКБ-10 и в DSM-IV разделили на конверсионные расстройства – conversion disorders (или, по более новой терминологии, функциональные расстройства с неврологическими симптомами – functional neurological symptom disorders), соматоформные расстройства (somatoform disorders), соматизированные расстройства (somatization disorders) и ипохондрическое расстройство – hypochondriasis (или, по более новой терминологии, тревожное расстройство болезни – illness anxiety disorder) [Maj M et al, 2005; Charis C, Panayiotou G, 2018].
В общей группе соматоформных расстройств (somatoform disorders) обе классификации выделяют такие важные их частные случаи, как соматоформное болевое расстройство (somatoform pain disorder) и соматоформная вегетативная дисфункция (СВД) – somatoform autonomic dysfunction [Maj M et al, 2005; Charis C, Panayiotou G, 2018].
Забегая немного вперёд, сообщим, что представленные в настоящем обзоре два клинических примера эффективности тразодона при соматоформных расстройствах из нашей собственной практики – относятся как раз к этим двум частным разновидностям соматоформных расстройств. Клинический пример № 1 описывает пациента с тяжёлым хроническим соматоформным болевым расстройством, у которого тразодон оказался одним из ключевых компонентов эффективной комбинации лекарств, а клинический пример № 2 – описывает пациента с СВД, у которого тразодон оказался эффективен в монотерапии. Более поздняя классификация DSM-5, а также во многом идеологически наследующая ей МКБ-11 – устранили разделение на соматизированные расстройства (somatization disorders) и соматоформные расстройства (somatoform disorders), которое оказалось во многом искусственным и натянутым, а кроме того – клинически бесполезным и поэтому не нужным. Вся категория соматоформных расстройств теперь называется «расстройства с соматическими симптомами» (somatic symptom disorders). Вместе с тем выделение таких частных случаев, как психосоматическое болевое расстройство (psychosomatic pain disorder), сохранило актуальность и в новой классификации [Charis C, Panayiotou G, 2018].
Близко к этой группе расстройств примыкает также дисморфическое расстройство тела (body dysmorphic disorder), которое ранее называли дисморфофобией (dysmorphophobia) [Maj M et al, 2005; Charis C, Panayiotou G, 2018].
Ряд авторов обращают внимание на то, что ипохондрическое расстройство (тревожное расстройство болезни) и дисморфическое расстройство тела – имеют, по их мнению, гораздо большее феноменологическое сходство с классическим обсессивно-компульсивным расстройством (ОКР), чем с другими соматоформными или соматизированными расстройствами, или, например, чем с другими тревожными расстройствами. Они, в частности, указывают, что ипохондрическое расстройство сопровождается преоккупацией, патологической фиксацией на мыслях о возможной тяжёлой или неизлечимой болезни, а также компульсивным поиском и отслеживанием симптомов подозреваемых болезней, а дисморфическое расстройство тела сопровождается точно такой же патологической фиксацией на мыслях о возможном уродстве, недостатке или дефекте внешности, и компульсивным поиском путей и способов его обнаружения и исправления (либо же путей и способов его сокрытия от посторонних взглядов) [Pittenger С, 2017; Abramowitz JS et al, 2017].
В обоих случаях очевидно сходство данных проявлений с обсессиями и компульсиями при классическом ОКР. На этом основании данные авторы предлагают перенести ипохондрическое расстройство и дисморфическое расстройство тела из раздела соматоформных расстройств (или, по-новому, «расстройств с соматическими симптомами») в раздел расстройств обсессивно-компульсивного спектра (РОКС), по аналогии с такими ныне уже общепризнанными РОКС, как компульсивный шоппинг, патологическое накопительство, патологический гемблинг [Pittenger С, 2017; Abramowitz JS et al, 2017].
В качестве дополнительных обоснований для своей точки зрения данные авторы указывают, что ипохондрическое расстройство и дисморфическое расстройство тела имеют сходство с ОКР не только на уровне феноменологии, но и на уровне патофизиологии мозга (например, паттернов активации определённых зон мозга в ответ на определённый триггер, по сравнению со здоровым контролем), и на уровне ответа на психофармакотерапию (ПФТ), поскольку при обоих типах психических расстройств – и при ипохондрическом расстройстве, и при дисморфическом телесном расстройстве – эффективны те же лекарства, что и при ОКР [Pittenger С, 2017; Abramowitz JS et al, 2017].
Обоснование актуальности проблемы
Соматоформные, соматизированные и конверсионные расстройства, а также ипохондрическое расстройство, судя по всему, встречаются в повседневной клинической практике врачей разных специальностей гораздо чаще, чем было принято думать ранее [Haller H et al, 2015].
Так, по разным данным, от 26,2% до 34,8% пациентов, регулярно посещающих семейного врача или участкового терапевта, соответствовали строгим диагностическим критериям МКБ-10 либо DSM-IV для постановки диагноза как минимум одного из соматоформных расстройств. От 40,2% до 49% пациентов, регулярно посещающих семейного врача, предъявляли жалобы как минимум на один предположительно соматоформный по своему происхождению симптом, не имевший объективной медицинской причины или объяснения для своего развития [Haller H et al, 2015].
Общую распространённость всей совокупности соматоформных и соматизированных расстройств в популяции разные авторы оценивают от 0,8% до 5,9%. По-видимому, вторая оценка гораздо ближе к действительности [Haller H et al, 2015].
Аналогичным образом, когда-то полагали, что «классическое» конверсионное расстройство (та самая «классическая истерия», красочно описанная ещё Жаном-Мартеном Шарко, с её типичными псевдоневрологическими симптомами, наподобие «истерических параличей и парезов», внезапных падений, истерической астазии-абазии, истерической слепоты или глухоты, истерических псевдосудорог) – ныне практически ушло в прошлое. Распространённость «классического» конверсионного расстройства в популяции в наше время оценивали как очень низкую – по разным данным, от 0,011% до 0,5% [Stefánsson JG et al, 1976; Stone J et al, 2005].
Однако более внимательный анализ сегодняшней эпидемиологической обстановки доказывает, что всё далеко не так радужно, и что «классическое» конверсионное расстройство с его типичными псевдоневрологическими симптомами не только никуда не исчезло, но и встречается гораздо чаще, чем было принято думать ранее. Так, в 2007 году группа турецких авторов доказала, что реальная распространённость конверсионного расстройства с псевдо-неврологическими симптомами в городской турецкой популяции составляет вовсе не 0,5%, а шокирующие 5,6% [Deveci A et al, 2007].
Несколькими группами авторов было отмечено, что от 30% до 60% пациентов, обращающихся к неврологам de novo, имеют хотя бы один медицински необъяснимый псевдоневрологический симптом предположительно конверсионного происхождения [Carson AJ et al, 2000; Nimnuan С et al, 2001; Snijders TJ et al, 2004].
Однако лишь очень малая часть (буквально единицы) этих пациентов, первично обратившихся к неврологам и получивших от невролога рекомендацию обратиться за консультацией, обследованием и лечением к психиатру и/или психотерапевту, – доходит в итоге до соответствующих специалистов и получает диагноз конверсионного или соматоформного расстройства. Тому есть множество причин – как общих для всех психических расстройств (страх перед стигматизацией в психиатрии, перед психотропным лечением и его ПЭ, недоверие к врачам, недостаточный уровень критики к своему состоянию, недостаточный уровень осознания болезни и необходимости лечения и т. д.), так и специфических именно для пациентов с конверсионными и соматоформными расстройствами (имманентно присущая этой болезни тенденция к подсознательному извлечению первичных и вторичных выгод из болезни и проистекающая отсюда низкая объективная заинтересованность пациента в лечении и в собственном выздоровлении, присущее многим из таких пациентов априорное представление о том, что врачи, якобы, недооценивают или обесценивают их страдания, серьёзность и тяжесть их заболевания, относятся к ним поверхностно и наплевательски, и т. д.) [Crimlisk HL et al, 2000].
По-видимому, именно фактор очень низкой обращаемости пациентов с соматоформными и конверсионными расстройствами к психиатрам и психотерапевтам, а не к неврологам или к другим соматическим врачам, создал у психиатров и психотерапевтов ложное впечатление о том, что «классическое» конверсионное расстройство с типичными для него псевдоневрологическими симптомами, будто бы, сегодня редко встречается. Между тем неврологи как видели множество таких пациентов каждый день во времена Шарко, так и продолжают видеть их каждый день в немалом количестве и сейчас [Crimlisk HL et al, 2000].
Весьма важно отметить также, что как соматоформные и конверсионные расстройства, так и маскированные или соматизированные депрессивные и тревожные расстройства, в целом, гораздо хуже поддаются лечению, чем «классические» формы депрессий и тревожных расстройств, не имеющие соматических масок. Все эти типы психических расстройств часто проявляют выраженную терапевтическую резистентность или же, наоборот, плохую переносимость ПФТ. К тому же часто эти типы психических расстройств бывают трудно отличимы друг от друга. Они также часто бывают коморбидны друг с другом и с ипохондрическим расстройством. Всё это создаёт дополнительные трудности и путаницу как в их диагностике и дифференциальной диагностике, так и в планировании их лечения и контроле хода лечения [Мазо ГЭ, Незнанов НГ, 2012; Быков ЮВ с соавт, 2013].
Это обстоятельство нередко вынуждает практических врачей, занимающихся лечением маскированных и соматизированных депрессивных и тревожных расстройств, а также соматоформных и конверсионных расстройств, выходить за пределы официально утверждённых протоколов, стандартов и пошаговых алгоритмов лечения, или за пределы официально рекомендованных дозовых диапазонов (в ме́ньшую сторону при плохой переносимости стандартных минимальных доз лекарств, или же в бо́льшую сторону при недостаточной эффективности, но хорошей переносимости стандартных максимальных доз лекарств), или же изобретать нестандартные лекарственные комбинации, которые со стороны могут показаться необоснованной полипрагмазией, если не знать, каким образом к такой схеме пришли в итоге [Мазо ГЭ, Незнанов НГ, 2012; Быков ЮВ с соавт, 2013].
В совокупности все эти обстоятельства – высокая распространённость соматоформных, соматизированных и конверсионных расстройств, а также ипохондрического расстройства, в сегодняшней человеческой популяции, их частая коморбидность как друг с другом, так и с депрессиями и тревожными расстройствами, расстройствами личности (РЛ), объективные большие трудности с диагностикой, дифференциальной диагностикой и лечением этой группы расстройств, частое проявление при них терапевтической резистентности или, наоборот, «отрицательной терапевтической резистентности» (интолерантности к ПФТ), большой полиморфизм их клинической картины – обуславливают особую актуальность темы нашей сегодняшней статьи.
Рецепторный профиль тразодона в контексте лечения расстройств с соматическими симптомами
Препарат тразодон – это атипичный антидепрессант (ААД), ранее уже дважды, в 2018 и 2021 годах, становившийся героем наших обзоров [Беккер РА, Быков ЮВ, 2018; 2021].
Первый из этих обзоров был посвящён тразодону в целом, второй – эффективности и безопасности применения тразодона в лечении нейропсихиатрических последствий постковидного синдрома. В обоих случаях мы подробно рассматривали вопрос о том, каким образом рецепторный профиль тразодона обуславливает те или иные его клинические свойства (например, как во второй статье – те его свойства, которые могут оказаться полезными при постковидном синдроме). Не изменим своей традиции мы и сейчас.
В 2020 году на постерной сессии, проходившей в рамках 33-го конгресса ECNP, компания Angelini Pharma (первооткрыватель и производитель тразодона) представила обновлённые данные о его рецепторном профиле. А в 2021 году эти обновлённые данные о рецепторном профиле тразодона были интегрированы как в обзор проф. Н. Н. Петровой, канд. мед. наук Ф. Ш. Шагиахметова и Р. Р. Борукаева, посвящённый применению тразодона по «неклассическим» показаниям (например, при хронических болевых синдромах, при акатизии или для торможения прогрессирования деменции), так и в наш собственный обзор о применении тразодона при постковидном синдроме [ECNP Poster Session, 2020; Петрова НН с соавт, 2021; Беккер РА, Быков ЮВ, 2021].
Обновлённые данные о рецепторном профиле тразодона схематически представлены нами на рисунке № 1 ниже [ECNP Poster Session, 2020].
В рамках настоящей статьи мы подробно остановимся только на тех рецепторных свойствах тразодона, которые имеют или могут иметь отношение к его потенциальной эффективности при расстройствах с соматическими симптомами. Итак, первое, на что мы бы хотели обратить внимание читателя в данном контексте, – это наличие у тразодона сильного, высокоаффинного антагонизма к α1B подтипу адренергических рецепторов (с Ki порядка 153 nM) [Cusack B et al, 1994; Owens MJ et al, 1997].
Уже при дозе тразодона 50 мг/сут процент оккупации α1B адренергических рецепторов составляет 88%, при дозе тразодона 100 мг/сут – 94%, а при дозе 150 мг/сут – 96%. Таким образом, α1B адреноблокада начинает играть клинически значимую роль в общем механизме действия тразодона, уже начиная с его дозы 50 мг/сут [Settimo L, Taylor D, 2018; Pyke RE, 2000].
Между тем хорошо известно, какую роль играет гиперсимпатикотония и гиперкатехоламинемия, чрезмерная стимуляция центральных и периферических α- и β-адренорецепторов – как в общих, системных механизмах этиопатогенеза тревожных и депрессивных расстройств, так и непосредственно в развитии целого ряда их типичных клинических симптомов и признаков. Так, гиперстимуляция β1 адренорецепторов миокарда обуславливает такие частые симптомы депрессии и тревожности, как тахикардия и экстрасистолы, гиперстимуляция β2 адренорецепторов печени обуславливает часто наблюдаемую при депрессиях и тревожных состояниях гипергликемию, а гиперстимуляция периферических α1 адренергических рецепторов обуславливает такие, например, симптомы, как бледность кожных покровов (вследствие спазма поверхностных сосудов кожи), холодные руки и ноги (вследствие спазма сосудов дистальных концов конечностей), сухость во рту (вследствие спазма сосудов слизистой оболочки полости рта и снижения секреции слюны), повышение артериального давления, дизурические симптомы (задержка мочи или, наоборот, учащённое мочеиспускание – нейрогенная дисфункция мочевого пузыря (НДМП) из-за спазма гладкой мускулатуры шейки мочевого пузыря и простаты), сексуальная дисфункция (из-за спазма сосудов половых органов и нарушения эрекции) [Stahl SM, 2013 (b)].
В полном соответствии с этими наблюдениями, как центральные α-адреноблокаторы (например, празозин, доксазозин, пророксан), так и липофильные (способные преодолевать гематоэнцефалический барьер (ГЭБ), и благодаря этому проникать в ЦНС) блокаторы β-адренорецепторов (например, пропранолол) – уже давно и успешно применяются в качестве противотревожных и вегетостабилизирующих средств в составе комплексного лечения самых разных тревожных расстройств, в том числе состояний соматизированной тревоги, в комплексном лечении панического расстройства (ПР), а также в комплексном лечении СВД [Жиляев АГ, 2016; Быков ЮВ, Беккер РА, 2017 (a), (b); Боброва ВИ, Демченко АВ, 2017; Чухловина МЛ, 2020; Шабанов ПД, 2020; Наумов КМ с соавт, 2020].
Так, в частности, α1 адреноблокаторы с центральным и периферическим действием празозин и доксазозин, изначально предназначавшиеся только для лечения артериальной гипертензии и для устранения задержки мочи (например, при гиперплазии простаты у мужчин), – на Западе активно используются off-label для лечения кошмаров и нарушений засыпания и поддержания сна при посттравматическом стрессовом расстройстве (ПТСР), для купирования острой стрессовой инсомнии и предотвращения развития ПТСР после перенесённой психической травмы, для уменьшения стресс-индуцированного влечения к алкоголю, а также в качестве адъювантных средств при фармакорезистентных тревожных расстройствах, или в качестве альтернативы бензодиазепинам и β-адреноблокаторам у пациентов с миастенией и тревожными либо диссомническими состояниями, которым нельзя бензодиазепины и β-адреноблокаторы из-за риска усиления мышечной слабости [Skelly MJ, Weiner JL, 2014; Ammar G et al, 2015; Lipinska G et al, 2016; Back SE et al, 2018; Jordan H, Ortiz N, 2019].
В этом контексте важно отметить также, что наличие у того или иного психотропного препарата, будь то АП или АД, выраженных α1 адреноблокирующих свойств – ранее считалось безусловно негативным его рецепторным свойством, от которого желательно было бы избавиться при разработке более новых препаратов аналогичного класса, так как именно это рецепторное свойство (α1 адреноблокада) обуславливает такие частые нежелательные побочные эффекты (ПЭ) от применения некоторых психотропных средств, как ортостатическая гипотензия и тахикардия, и может также вносить свой вклад в развитие сонливости и седации при их применении [Stahl SM, 2013 (b)].
Сообразно этому, усилия химиков-фармакологов всего мира долгое время были направлены на синтез всё более и более рецепторно селективных психотропных препаратов, по возможности максимально лишённых α1 адреноблокирующих, H1 гистаминоблокирующих и других считавшихся «однозначно нежелательными» рецепторных свойств (то есть препаратов, более высокопотентных и селективных по отношению к D2 дофаминовым рецепторам в случае АП, или более высокопотентных и селективных по отношению к белкам-транспортёрам серотонина и/или норадреналина (SERT и/или NET) – в случае АД) [Stahl SM, 2013 (a), (b)].
Однако в последнее время к специалистам постепенно стало приходить осознание того, что «не всё так просто и однозначно» с α1 адренорецепторами и их подтипами, и что наличие у того или иного психотропного препарата сильной α1 адреноблокирующей активности – имеет не только очевидные недостатки (повышенный риск развития ортостатической гипотензии и тахикардии при его применении, по сравнению с препаратами с меньшей аффинностью к α1 адренорецепторам), но и целый ряд плюсов [Stahl SM, 2013 (a), (b)].
Так, в частности, кроме уже упоминавшегося нами выше положительного влияния α1 адреноблокады на уровень тревожности, на качество и фазовую структуру сна, на устранение ночных кошмаров, на соматовегетативную стабилизацию – показано также, что именно сильная α1 адреноблокирующая активность нового ААП илоперидона – частично объясняет (точнее, вносит свой вклад) в то, что илоперидон вызывает очень мало проявлений экстрапирамидного синдрома (ЭПС) и акатизии, за счёт того, что блокада α1 адренорецепторов префронтальной коры косвенно приводит к увеличению выделения дофамина в нигростриарной системе [Stahl SM, 2013 (a), (b)].
На этом основании некоторые авторы даже предложили попробовать применять илоперидон, как препарат с наибольшей среди всех известных на сегодняшний день АП аффинностью к α1 адренорецепторам, – для лечения ПТСР, по аналогии с уже упоминавшимися празозином и доксазозином [Shuman MD, Mcgrane IR, 2014].
Безусловно, всё сказанное нами выше о положительном вкладе сильного α1B антагонизма в общую противотревожную, вегетостабилизирующую и седативную активность, в способность нормализовывать сон и его фазовую структуру, в эффективность при ПТСР, в способность уменьшать акатизию – в полной мере относится и к тразодону [Stahl SM, 2013 (b); Петрова НН с соавт, 2021].
Второе рецепторное свойство тразодона, которое представляется нам важным в контексте его применения для лечения соматоформных расстройств, – это наличие у него сильной парциальной 5-HT1A агонистической активности (с Ki, по разным данным, в диапазоне от 96 до 118 nM, и притом с большей внутренней агонистической активностью, чем у буспирона и тандоспирона) [Raffa RB et al, 1992; Cusack B et al, 1994; Owens MJ et al, 1997; Odagaki Y et al, 2005].
Показано, что уже в дозе 50 мг/сут тразодон занимает 91% доступных 5-HT1A серотониновых рецепторов, в дозе 100 мг/сут – 95%, а в дозе 150 мг/сут – 97% [Stahl SM, 2009; Jaffer KY et al, 2017].
Между тем о роли парциального 5-HT1A агонизма у таких препаратов, как небензодиазепиновые анксиолитики буспирон и тандоспирон, некоторые ААП, например арипипразол или карипразин, некоторые АД, такие как тразодон, вилазодон или вортиоксетин – в общем механизме их антидепрессивного и анксиолитического действия, а также о той роли, которую играет парциальный 5-HT1A агонизм в «атипичности» вышеупомянутых и некоторых других ААП, в уменьшении частоты вызывания ими ЭПС и акатизии, в усилении их антинегативного и прокогнитивного действия за счёт косвенного усиления высвобождения дофамина в префронтальной коре – уже давно и хорошо известно [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Не менее хорошо сегодня известно и то, что косвенная стимуляция именно 5-HT1A подтипа серотониновых рецепторов за счёт увеличения содержания серотонина в синаптической щели, и последующая десенситизация пресинаптических ауторегуляторных 5-HT1A рецепторов – критически необходима для реализации антидепрессивного и анксиолитического эффекта вообще любых известных на сегодня классов моноаминергических АД, будь то селективные ингибиторы обратного захвата серотонина (СИОЗС), селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСиН), трициклические антидепрессанты (ТЦА) или же ингибиторы моноаминоксидазы (ИМАО) [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Однако, поскольку данная наша статья посвящена психосоматическим расстройствам и применению при них тразодона, то мы бы хотели здесь сосредоточиться на рассмотрении соматотропных и вегетотропных эффектов стимуляции 5-HT1A серотониновых рецепторов, а не на их хорошо известном вкладе в антидепрессивную и анксиолитическую эффективность тразодона [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Итак, показано, что 5-HT1A серотониновые рецепторы в ростральной вентролатеральной части ствола мозга и спинного мозга – принимают активное участие в регуляции артериального давления и частоты сердечных сокращений (ЧСС), а также в регуляции общего симпато-адреналового тонуса и, в частности, тонуса сосудов. Стимуляция 5-HT1A серотониновых рецепторов в этих областях мозга оказывает косвенное симпатолитическое и вегетостабилизирующее действие, снижает артериальное давление и ЧСС, способствует расширению сосудов, снижению выброса катехоламинов мозговым слоем надпочечников и симпатическими ганглиями брюшной полости [Dabiré H, 1991].
Показано, в частности, что центральный парциальный 5-HT1A агонизм, наряду с α1-адреноблокирующими свойствами, играет важную роль в общем механизме гипотензивного действия такого α1-адреноблокатора, как урапидил [Kolassa N et al, 1989; Ramage AG, 1991].
Эти же рецепторные свойства, наряду с β-адреноблокирующими свойствами, играют важную роль в общем механизме гипотензивного, брадикардического и вегетостабилизирующего действия такого β-адреноблокатора, как пиндолол [Clifford EM et al, 1998; Newman-Tancredi A et al, 1998].
Кроме того, стимуляция 5-HT1A серотониновых рецепторов ростральной части ядер шва, вызывая расширение кожных сосудов и увеличение теплоотдачи с поверхности кожи и одновременно угнетая активность центра терморегуляции гипоталамуса и теплопродукцию, – способствует снижению температуры тела, купирует озноб (шиверинг) и холодовой тремор [Ootsuka Y, Blessing WW, 2006; Rusyniak DE et al, 2007].
Стимуляция 5-HT1A серотониновых рецепторов ядер шва, косвенно модулируя активность постсинаптических α2-адренорецепторов ядра Эдингера-Вестфаля, эффективно устраняет также другой частый симптом гиперсимпатикотонии и тревожности, нередко беспокоящий пациентов с косметической точки зрения, – а именно мидриаз [Fanciullacci M et al, 1995].
На функцию внешнего дыхания стимуляция центральных 5-HT1A серотониновых рецепторов оказывает интересное двоякое действие – с одной стороны, она эффективно устраняет центральную нейрогенную гипервентиляцию, снижает патологически повышенную при тревоге, стрессе возбудимость парабрахиального ядра гипоталамуса, а с другой – уменьшает вызванное опиоидами угнетение дыхания [Meyer LR et al, 2006].
Интерес в контексте психосоматических расстройств, часто сопровождающихся психогенной тошнотой и рвотой на фоне тревоги, представляет также то, что 5-HT1A серотониновые рецепторы в рвотном центре колокализованы с нейрокининовыми NK1 рецепторами, и что их стимуляция (буспироном, тандоспироном, тразодоном) – оказывает противорвотное действие [Lucot JB, 1994; Oshima T et al, 2002; Kranke P et al, 2012].
Противорвотное действие тразодона, наряду с прочими его свойствами, полезными в анестезиологии (его седативной, анксиолитической, анальгетической и вегетостабилизирующей активностями), – настолько существенно, что даже позволяет использовать его в качестве премедикации перед хирургическими операциями, чреватыми тошнотой и рвотой [Bonazzi M et al, 1994; Murphy LA et al, 2017].
Таким образом, косвенное, непрямое симпатолитическое и вегетостабилизирующее действие тразодона, реализующееся через его парциальный агонизм к 5-HT1A подтипу серотониновых рецепторов в определённых зонах мозга, – выгодно дополняет и усиливает его прямое α-адренолитическое и вегетостабилизирующее действие, которое реализуется через блокаду центральных и периферических α1B адренорецепторов. А с учётом того, как часто встречаются при психосоматических расстройствах такие симптомы гиперсимпатикотонии и тревожности, как тахикардия, экстрасистолы, колебания артериального давления с тенденцией к его повышению, спазм сосудов кожи (бледность кожных покровов, холодные руки и ноги, субфебрильная температура тела, термоневроз), мидриаз, гипервентиляция и тахипноэ, тошнота и рвота, – вполне очевидно, что прямое и косвенное вегетостабилизирующее, гипотензивное, гипотермическое, противорвотное, прямое адрено- и косвенное симпатолитическое действие тразодона, реализующееся отчасти через его парциальный агонизм к центральным 5-HT1A серотониновым рецепторам, отчасти через блокаду им центральных и периферических α1B адренорецепторов, – вносит важный вклад в его общую клиническую эффективность при этих расстройствах [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
В контексте лечения соматоформного болевого синдрома важно также наличие у тразодона выраженного анальгетического действия, которое, опять-таки, реализуется в первую очередь через его парциальный агонизм к 5-HT1A подтипу серотониновых рецепторов, через косвенную активацию им эндогенной опиоидной системы и (при дозах 300 мг/сут и выше) – также через его антагонизм к 5-HT7 подтипу серотониновых рецепторов [ECNP Poster Session, 2020; Петрова НН с соавт, 2021; Беккер РА, Быков ЮВ, 2021].
В контексте лечения тразодоном соматоформных расстройств важно подчеркнуть, что, хотя анксиолитическое и антидепрессивное действие парциального 5-HT1A агонизма у тразодона, как и у любых других парциальных 5-HT1A агонистов (буспирон, тандоспирон) и у всех прочих моноаминергических АД, косвенно стимулирующих этот подтип серотониновых рецепторов, развёртывается постепенно, в течение нескольких недель его постоянного приёма (и в эти же сроки, как и в случае с буспироном или с другими АД, становится очевидным «вторичное» вегетостабилизирующее действие тразодона, связанное с редукцией тревожности и депрессии), но прямые, непосредственные положительные вегетотропные и соматотропные эффекты стимуляции 5-HT1A рецепторов, такие как снижение артериального давления, уменьшение мидриаза, гипервентиляции, озноба, тремора, противорвотное действие, редукция болевого синдрома, – могут быть очевидны уже вскоре после приёма первых его доз [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Третье рецепторное свойство тразодона, которое представляется нам важным в контексте применения его для лечения соматоформных и психосоматических расстройств, – это его сильный, высокоаффинный антагонизм (точнее, инверсный агонизм) к 5-HT2A подтипу серотониновых рецепторов (с Ki в диапазоне 20-45 nM, по разным данным) и умеренный антагонизм к 5-HT2C подтипу их (с Ki в диапазоне 224-402 nM, по разным данным) [Cusack B et al, 1994; Tatsumi M et al, 1997; Owens MJ et al, 1997].
Показано, что в первую очередь именно сильным инверсным агонизмом тразодона к 5-HT2A подтипу серотониновых рецепторов обуславливается его выраженное снотворно-седативное и быстро наступающее неспецифическое анксиолитическое действие, которое становится клинически заметным уже начиная с дозы тразодона 25 мг/сут. Этим тразодон отличается от многих других психотропных препаратов, тоже сочетающих в своём рецепторном профиле H1 гистаминоблокирующее действие и способность блокировать 5-HT2A подтип серотониновых рецепторов, и тоже традиционно применяемых off-label в малых дозах для нормализации сна – таких, как миртазапин, кветиапин, миансерин, доксепин, хлорпротиксен, амитриптилин, гидроксизин и др. [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
У всех упомянутых альтернативных препаратов при малых (снотворно-седативных) их дозах на первый план в рецепторном профиле выступает H1 гистаминовая блокада, а не блокада 5-HT2A подтипа серотониновых рецепторов, хотя соотношение этих эффектов в каждом отдельном случае разное [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Аффинность тразодона к 5-HT2A подтипу серотониновых рецепторов настолько велика, что уже в клинически не релевантной дозе – всего 1 мг/сут – он занимает более 50% от всех доступных 5-HT2A серотониновых рецепторов мозга, а уже в дозе всего 10 мг/сут занятость 5-HT2A серотониновых рецепторов близка к насыщению. При дозе 50 мг/сут процент оккупации 5-HT2A рецепторов тразодоном составляет 97%, при дозе 100 мг/сут – 98%, а при дозе 150 мг/сут – 99% [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Несмотря на сравнительно низкую (Ki от 224 до 402 nM) аффинность к 5-HT2C подтипу серотониновых рецепторов in vitro [Cusack B et al, 1994; Tatsumi M et al, 1997; Owens MJ et al, 1997], показано, что in vivo тразодон уже при дозе 100 мг/сут занимает 91% доступных 5-HT2C серотониновых рецепторов, а при дозе 150 мг/сут – 94% [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
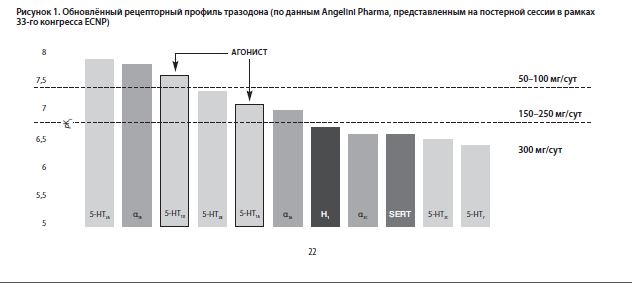 В то же время антигистаминная (H1 гистаминоблокирующая) активность у тразодона, хотя и имеет место быть, но в гораздо меньшей степени, чем, например, у миртазапина, алимемазина или кветиапина. Ki тразодона к H1 гистаминовому рецептору, по разным данным, находится в диапазоне от 220 до 1100 nM, тогда как, например, у миртазапина – от 0,14 до 1,6 nM, а, скажем, у кветиапина – от 2,2 до 11 nM [Richelson E, Nelson A, 1984; Cusack B et al, 1994; Schotte A et al, 1996; Anttila SA, Leinonen EV, 2001; Jensen NH et al, 2008; Appl H et al, 2012; Krystal AD et al, 2013].
В то же время антигистаминная (H1 гистаминоблокирующая) активность у тразодона, хотя и имеет место быть, но в гораздо меньшей степени, чем, например, у миртазапина, алимемазина или кветиапина. Ki тразодона к H1 гистаминовому рецептору, по разным данным, находится в диапазоне от 220 до 1100 nM, тогда как, например, у миртазапина – от 0,14 до 1,6 nM, а, скажем, у кветиапина – от 2,2 до 11 nM [Richelson E, Nelson A, 1984; Cusack B et al, 1994; Schotte A et al, 1996; Anttila SA, Leinonen EV, 2001; Jensen NH et al, 2008; Appl H et al, 2012; Krystal AD et al, 2013].
В полном соответствии с этим, показано, что процент занятости H1 гистаминовых рецепторов ЦНС при малых дозах тразодона сравнительно невысокий – при дозе тразодона 50 мг/сут он составляет всего 84%. И только при дозах тразодона 100-150 мг/сут и выше процент занятости H1 гистаминовых рецепторов ЦНС становится выше клинически значимого порога в 90% (он составляет 91% при дозе 100 мг/сут, 94% при дозе 150 мг/сут) [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Блокада тразодоном гистаминовых H1 и серотониновых 5-HT2A и 5-HT2C рецепторов кожи, наряду с центральной их блокадой, обеспечивающей седацию и анксиолизис, – обуславливает его выраженное противозудное действие и его эффективность при психогенном кожном зуде [Belinskaia DA et al, 2019].
Хорошо известно, что блокада 5-HT2A подтипа серотониновых рецепторов ЦНС, косвенно повышая содержание дофамина в мезокортикальной, нигростриарной и тубероинфундибулярной системах мозга – вносит свой вклад в «атипичность» многих ААП и способствует уменьшению вызываемых блокадой D2 дофаминовых рецепторов в этих путях симптомов ЭПС и акатизии, гиперпролактинемии, вторичной негативной симптоматики, сексуальных нарушений, попутно уменьшая тревожность. Известно также и то, что блокада 5-HT2C подтипа серотониновых рецепторов повышает содержание ряда моноаминов в префронтальной коре, и оказывает антидепрессивное, противотревожное и прокогнитивное действие [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Отсюда видно, что сильные 5-HT2A и умеренные 5-HT2C блокирующие свойства тразодона, наряду с уже упоминавшимся нами ранее его сильным парциальным 5-HT1A агонизмом, – тоже вносят значительный вклад в такие его клинически наблюдаемые эффекты, как антидепрессивный, прокогнитивный, противотревожный, а также в его способность уменьшать проявления ЭПС и акатизии при применении АП, оказывать антинегативное действие [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Также хорошо известно, что неизбирательная стимуляция разных подтипов серотониновых рецепторов ответственна за многие ПЭ первых дней терапии АД из групп СИОЗС и СИОЗСиН – а именно такие их типичные ПЭ, как тошнота, рвота, анорексия, аноргазмия, задержка эякуляции, снижение либидо, нарушения сна, головные боли. И что наличие у того или иного АД способности блокировать 5-HT2A и/или 5-HT2C подтипы серотониновых рецепторов и/или парциального агонизма к 5-HT1A подтипу серотониновых рецепторов, косвенно ограничивающего избыточное высвобождение серотонина, – способствует уменьшению частоты развития подобных ПЭ в начале терапии данным АД. Это справедливо и для миртазапина, и для миансерина, и для тразодона, и для новейших мультимодальных АД вортиоксетина, вилазодона [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Однако нас, в контексте лечения тразодоном именно психосоматических расстройств, особенно интересуют прямые соматотропные и вегетотропные эффекты блокады тразодоном 5-HT2A и 5-HT2C подтипов серотониновых рецепторов. И здесь тоже имеется немало интересных фактов. Во-первых, показано, что стимуляция центральных и периферических 5-HT2A серотониновых рецепторов (будь то прямая их стимуляция экзогенным агонистом, как в случае приёма диэтиламида лизергиновой кислоты (ЛСД) или 2,5-диметокси-4-бромоамфетамина (ДОБ), или же косвенная их стимуляция за счёт усиления выброса эндогенного агониста – серотонина, как это имеет место быть на фоне приёма такого релизера серотонина, как 3,4-метилендиокси-N-метамфетамин (МДМА), или же на фоне тревоги, страха, стресса, на фоне ПА) – в значительной степени ответственна за такие типичные симптомы тревоги, страха, стресса или ПА (они же – типичные симптомы интоксикации данными серотонинергическими психоактивными веществами (ПАВ)), как стрессовая гипертермия, тахикардия, экстрасистолы, артериальная гипертензия, вазоконстрикция (бледность кожных покровов, холодные руки и ноги, сухость во рту), стрессовая диарея [Centurión D et al, 2002; Kaumann AJ, Levy FO, 2006; Sinh S, Ootsuka Y, 2019].
Также показано, что именно стимуляция центральных и периферических 5-HT2A серотониновых рецепторов, наряду с прямой или косвенной активацией симпато-адреналовой системы, ответственна за значительную часть сердечно-сосудистых катастроф (острых инфарктов миокарда, инсультов), случающихся при употреблении данных ПАВ или на фоне острого стресса [Centurión D et al, 2002; Kaumann AJ, Levy FO, 2006; Sinh S, Ootsuka Y, 2019].
И наоборот, показано, что блокада центральных и периферических 5-HT2A серотониновых рецепторов – оказывает гипотензивное, сосудорасширяющее, кардио- и ангиопротективное, вегетостабилизирующее, антиаритмическое, антитромботическое действие, способствует снижению температуры тела. Показано также, что центральные и периферические 5-HT2A блокирующие свойства, наряду с α1 адренергической блокадой, – играют важную роль в общем механизме гипотензивного, вегетостабилизирующего и сосудорасширяющего действия таких α1 адреноблокаторов, как кетансерин и феноксибензамин [Pazos A et al, 1987; Doggrell SA, 1995; Centurión D et al, 2002; Kaumann AJ, Levy FO, 2006; Elbers PG et al, 2009; Sinh S, Ootsuka Y, 2019].
Таким образом, здесь мы видим, что сильные центральные и периферические 5-HT2A блокирующие свойства тразодона – дополнительно усиливают опосредованную его центральной и периферической α1B адренергической блокадой, а также центральным парциальным 5-HT1A агонизмом вегетостабилизирующую, гипотензивную, сосудорасширяющую и гипотермическую активность этого препарата, независимо от редукции им тревоги (то есть вносят свой вклад в его прямое соматотропное и вегетотропное действие) [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Кроме того, показано вовлечение центральных и периферических 5-HT2A и 5-HT2C серотониновых рецепторов также в патогенез хронических болевых синдромов. Показано, что блокада этих подтипов серотониновых рецепторов способствует редукции боли [Grégoire S, Neugebauer V, 2013; Xu WJ et al, 2020].
Таким образом, можно утверждать, что способность тразодона сильно блокировать центральные и периферические 5-HT2A и 5-HT2C серотониновые рецепторы, наряду с его сильным парциальным агонизмом к 5-HT1A подтипу серотониновых рецепторов и (становящимся клинически значимым при высоких дозах, выше 300 мг/сут) его умеренным антагонизмом к 5-HT7 серотониновым рецепторам, – тоже вносит свой вклад в его общий анальгетический эффект и, в частности, в его эффективность при соматоформных болевых расстройствах [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Завершая рассмотрение рецепторных свойств тразодона, имеющих отношение к его эффективности при соматоформных и психосоматических расстройствах, нельзя не упомянуть тот факт, что тразодон, в отличие от СИОЗС и СИОЗСиН, обладает сравнительно низкой аффинностью к белку-транспортёру серотонина (SERT) – по разным данным, его Ki к этому белку лежит в диапазоне от 160 nM до 1000 nM [Cusack B et al, 1994; Tatsumi M et al, 1997; Owens MJ et al, 1997].
Сообразно этому, связывание тразодона с белком SERT становится клинически значимым и начинает играть существенную роль в общем механизме его антидепрессивного и анксиолитического действия только при его высоких дозах. При дозе тразодона 100 мг/сут процент занятости SERT составляет около 86% (значительно меньше, чем процент занятости 5-HT1A, 5-HT2A и даже 5-HT2C серотониновых рецепторов на этой же дозе), и только при дозе 150 мг/сут – достигает порога клинической значимости в 90% [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Сочетание сравнительно низкой аффинности тразодона к белку SERT с его сильным и высокоаффинным парциальным агонизмом к 5-HT1A подтипу серотониновых рецепторов, сильным и высокоаффинным инверсным агонизмом к 5-HT2A подтипу серотониновых рецепторов и с умеренным его антагонизмом к 5-HT2C подтипу этих рецепторов – в сумме обуславливает редкость возникновения при терапии им таких типичных «серотониновых» – и очень плохо переносимых и воспринимаемых именно психосоматическими пациентами – ПЭ первых дней терапии многими другими АД (СИОЗС, СИОЗСиН, ТЦА…), как тошнота, рвота, анорексия, аноргазмия, задержка эякуляции, снижение либидо, нарушения сна, головные боли. Напротив, благодаря именно этим особенностям своего рецепторного профиля, тразодон склонен с первых дней терапии давать выраженный анксиолитический эффект, нормализовывать сон и его фазовую структуру, улучшать либидо и сексуальную функцию, уменьшать тошноту и анорексию, не вызывая в то же время повышения аппетита и прибавки массы тела [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Сопоставление тразодона с некоторыми другими препаратами, применяемыми в качестве «дневных седатиков», анксиолитиков и вегетативных стабилизаторов
Для того, чтобы мы могли объективно ответить на вопрос «почему вообще стоит рассматривать целесообразность применения для лечения соматоформных расстройств именно тразодона?», важно провести сопоставление спектра фармакологической активности и спектра ПЭ тразодона с таковыми показателями у ряда альтернативных препаратов, которые в России и странах СНГ традиционно имеют широкое применение в качестве «дневных седатиков», анксиолитиков и вегетативных стабилизаторов.
В этом качестве в России и в странах СНГ, помимо тразодона, применяют, с различной частотой и разной степенью успешности, несколько классов препаратов:
1) ГАМКергические препараты (бензодиазепины, прегабалин, габапентин, фенибут) [Монтгомери СА, 2010; Беккер РА, Быков ЮВ, 2017];
2) Так называемые «небензодиазепиновые анксиолитики», например, буспирон, гидроксизин, этифоксин и др. [Морозов ПВ, Никитин ЗА, 2009];
3) Липофильные (способные преодолевать ГЭБ) β-адреноблокаторы, например, пропранолол, бисопролол, метопролол [Stahl SM, 2013 (b); Sadock BJ et al, 2017];
4) Центральные α-адреноблокаторы (пророксан, доксазозин) [Боброва ВИ, Демченко АВ, 2017];
5) Малые дозы некоторых АП, которые обладают выраженным «дневным» седативным, быстро наступающим неспецифическим анксиолитическим и/или вегетостабилизирующим действием, например, малые дозы хлорпротиксена, тиоридазина, алимемазина, перициазина, сульпирида; в последнее время на эту же рыночную нишу нацеливаются также малые дозы кветиапина (12,5-25-50 мг до 2-3 раз в сутки), и даже малые дозы оланзапина (1,25-2,5-5 мг/сут) [Быков ЮВ, Беккер РА, 2016; 2017; Беккер РА, Быков ЮВ, 2016; 2018];
6) Малые дозы некоторых АД, которые обладают выраженным «дневным» седативным, быстро наступающим неспецифическим анксиолитическим и/или вегетостабилизирующим действием, например малые дозы амитриптилина, миртазапина, миансерина [Stahl SM, 2013 (b); Беккер РА, Быков ЮВ, 2019].
Итак, рассмотрим поподробнее каждый из этих классов препаратов, в сопоставлении с тразодоном. Все упомянутые ГАМКергические препараты (бензодиазепины, прегабалин, габапентин, фенибут) – безусловно, высокоэффективны как в подавлении тревоги, так и в устранении сопутствующих ей соматовегетативных нарушений. Однако все они имеют два существенных недостатка – риск нарастания толерантности к их анксиолитическому и вегетостабилизирующему действию и, соответственно, риск снижения их эффективности при их длительном приёме, а также риск развития патологического привыкания и пристрастия, лекарственной зависимости при длительном лечении ими. Это ограничивает сроки их возможного эффективного применения – несколькими неделями. Кроме того, бензодиазепины и габапентиноиды нельзя применять у пациентов с миастенией из-за риска усиления мышечной слабости [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
В то же время тразодон, в отличие от всех упомянутых препаратов ГАМКергического действия, не ассоциируется с феноменом роста толерантности или с необходимостью повышения дозы со временем, не имеет риска развития патологического привыкания и пристрастия, лекарственной зависимости. Он может при необходимости применяться длительно, даже пожизненно, и не имеет противопоказаний у пациентов с миастенией [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Липофильные β-адреноблокаторы имеют весьма ограниченную эффективность при тревожных расстройствах и сопутствующих тревоге соматовегетативных нарушениях. В основном они оказываются эффективны при так называемой performance anxiety, а также (обычно – вместе с бензодиазепинами) при купировании ПА или при устранении акатизии. Кроме того, длительное применение β-адреноблокаторов ассоциируется с целым рядом неприятных ПЭ, таких как снижение либидо у обоих полов, нарушение эрекции у мужчин, периферическая вазоконстрикция (холодные руки и ноги), нарушения сна, ночные кошмары. Иногда при их длительном приёме наблюдается депрессогенный эффект [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Центральные α-адреноблокаторы (празозин, доксазозин, пророксан) – тоже имеют, на самом деле, достаточно ограниченную эффективность как в лечении тревожных расстройств, так и в устранении сопутствующих тревоге соматовегетативных нарушений. Их эффективность в настоящее время строго научно доказана только в отношении устранения кошмаров при ПТСР, а также в уменьшении стресс-индуцированного влечения к спиртному. Кроме того, применение центральных α-адреноблокаторов тоже ассоциируется с рядом проблематичных ПЭ, таких как снижение либидо у обоих полов, нарушение эрекции у мужчин из-за перераспределения крови (изредка, наоборот, наблюдается приапизм), периферические отёки, ортостатическая гипотензия, тахикардия. Иногда при длительном приёме центральных α-адреноблокаторов, так же как и при длительном приёме липофильных β-блокаторов, – наблюдается депрессогенный эффект [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Все эти типичные ПЭ центральных α-адреноблокаторов особенно проблематичны именно в психиатрии, по той причине, что дозы празозина или доксазозина, необходимые для достижения терапевтического эффекта при ПТСР и других тревожных расстройствах, – как правило, оказываются значительно выше, чем дозы этих же препаратов, обычно применяемые при лечении артериальной гипертензии или задержки мочеиспускания [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
В противоположность как центральным α-адреноблокаторам, так и липофильным β-адреноблокаторам, тразодон обладает широким спектром анксиолитической и вегето-стабилизирующей активности. Он эффективен при самых разных тревожных и соматовегетативных расстройствах. Это обусловлено гораздо большей, по сравнению с обоими этими классами препаратов, широтой спектра нейрохимического действия тразодона. В отличие от них, тразодон влияет не только на α-адренорецепторы, но также и на 5-HT1A, 5-HT1D, 5-HT2A, 5-HT2C и, в некоторой степени, также на 5-HT7 серотониновые рецепторы, на H1 гистаминовые рецепторы и на обратный захват серотонина. В противоположность обеим этим подгруппам селективных блокаторов адренорецепторов, тразодон не только не обладает депрессогенными свойствами, не нарушает сон, не снижает либидо и не ухудшает половую функцию – но, напротив, оказывает выраженное антидепрессивное действие, нормализует сон и его фазовую структуру, улучшает либидо и эректильную функцию [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Если же рассматривать применение в качестве «дневных седатиков», анксиолитиков и вегетативных стабилизаторов малых доз таких АП, как хлорпротиксен, алимемазин, тиоридазин, перициазин, кветиапин или оланзапин, в сопоставлении с применением тразодона для этих же целей – то обращает на себя внимание то, что, хотя у всех этих препаратов, так же как и у тразодона, в рецепторном профиле имеется то или иное сочетание блокады α-адренорецепторов, H1 гистаминовых рецепторов, блокады 5-HT2A и, иногда, также 5-НТ2С и/или 5-HT7 подтипов серотониновых рецепторов, и что некоторые из этих препаратов, так же как и тразодон, имеют свойства парциальных агонистов 5-HT1A подтипа серотониновых рецепторов – но у них всех, в отличие от тразодона, при малых их дозах выступает на первый план вовсе не 5-HT2A серотонинергическая блокада и не их парциальный агонизм к 5-HT1A серотониновым рецепторам, а H1 гистаминовая блокада. Это связано с различиями в их аффинностях к данным подтипам рецепторов [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Это различие в профилях связывания тразодона и вышеупомянутых седативных АП с разными подтипами рецепторов при малых их дозах – даёт нам основания утверждать, что все вышеуказанные препараты, в отличие от тразодона, при малых дозах дают значительно больше нежелательной дневной седации и сонливости, чем истинного противотревожного и вегетостабилизирующего эффекта. Грубо говоря, лечить тревожность и вегетативные нарушения алимемазином или тиоридазином, хлорпротиксеном или пусть даже современным кветиапином – не намного эффективнее, чем лечить эти же расстройства такими седативными антигистаминами, как дифенгидрамин, прометазин или хлоропирамин [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Это же замечание – о значительно большей вероятности получения выраженной дневной седации и сонливости, чем вероятность достижения истинного противотревожного и вегетостабилизирующего эффекта при лечении им, – справедливо и для такого седативного антигистамина, традиционно позиционируемого в качестве «небензодиазепинового анксиолитика», как гидроксизин. Для него H1 гистаминоблокирующая активность является основной
(Ki этого препарата к H1 гистаминовому рецептору лежит в диапазоне от 2,0 до 19 nM), тогда как 5-HT2A блокирующая и α1 адреноблокирующая активности в его рецепторном профиле играют второстепенную роль (его Ki к этим рецепторам, соответственно, 170 и 460 nM) [Snowman AM, Snyder SH, 1990].
Кроме того, у всех вышеупомянутых седативных АП (в большей степени – у таких из них, как перициазин, оланзапин, хлорпротиксен, в сравнительно меньшей – у таких, как тиоридазин, алимемазин, кветиапин), а также у часто применяемого с анксиолитической и вегетостабилизирующей целью «неседативного», дофамин-селективного АП сульпирида, и даже у вышеупомянутых гидроксизина, буспирона, формально не относящихся к классу АП, – имеется в той или иной степени выраженное блокирующее действие на D2 подтип дофаминергических рецепторов. А это рецепторное свойство – совершенно не нужно, нежелательно и даже вредно в «малой психиатрии». Именно оно обуславливает не только вероятность развития при лечении данными препаратами гиперпролактинемии, острых дискинезий, острой акатизии или лекарственного паркинсонизма (более высокую при использовании более высокопотентных по D2 рецептору препаратов, таких как перициазин, оланзапин или хлорпротиксен, но ненулевую даже для буспирона и гидроксизина, которые формально не относятся к группе АП) [Ritchie EC et al, 1988; Patterson JF, 1988; Esen I et al, 2008; Stahl SM, 2013 (b); Sadock BJ et al, 2017], но и гораздо более проблематичную вероятность развития при длительном лечении ими необратимых поздних дискинезий – в том числе и у пациентов, не проявлявших признаков острых экстрапирамидных нарушений в процессе лечения данными препаратами. Этот риск, согласно данным литературы, отнюдь не равен нулю даже при длительном применении гидроксизина или буспирона, не говоря уже о таковом риске при длительном применении препаратов из группы АП [Clark BG et al, 1982; LeWitt PA et al, 1993; Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Риск развития как острых, так и поздних, отсроченных экстрапирамидных нарушений, естественно, влияет не только на «сиюминутную» переносимость вышеупомянутых «малых АП», а также гидроксизина и буспирона, но и ограничивает возможность и целесообразность их длительного применения в качестве «дневных седатиков», анксиолитиков и вегетативных стабилизаторов. В противоположность им, тразодон полностью лишён даже слабого блокирующего действия на D2 подтип дофаминовых рецепторов. Он не ассоциируется с риском развития поздних дискинезий, и может применяться длительно, при необходимости – даже пожизненно [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Кроме того, все вышеупомянутые «седативные АП», традиционно применяемые в РФ в качестве вегетативных стабилизаторов и анксиолитиков (будь то хлорпротиксен, тиоридазин, перициазин, или более новые кветиапин и оланзапин), а также ряд вышеупомянутых «седативных АД», тоже применяемых в РФ в малых дозах с этой целью (прежде всего, конечно, амитриптилин, но также миртазапин, миансерин и гидроксизин), – в той или иной степени обладают М-холиноблокирующими свойствами. А это означает риск развития при лечении ими таких нежелательных ПЭ, как сухость во рту, запоры, задержка мочеиспускания, мидриаз, парез аккомодации глаз, тахикардия, сексуальные нарушения, нарушения памяти и когнитивных функций, кошмарные сновидения. В противоположность этим препаратам, тразодон полностью лишён сколько-нибудь значимого М-холиноблокирующего действия (его Ki к любым подтипам М-холинорецепторов превышает 10 000 nM). Это тоже важно для сопоставления и оценки переносимости тразодона при соматоформных расстройствах в сравнении с вышеупомянутыми альтернативами [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Ещё одно важное отличие в переносимости состоит в том, что у таких препаратов, как миртазапин, миансерин, амитриптилин, гидроксизин или как все упомянутые ранее АП, имеется также риск нежелательного повышения аппетита, прибавки массы тела, развития ожирения и метаболических нарушений (гиперхолестеринемии, дислипидемии, нарушения толерантности к глюкозе и даже сахарного диабета 2-го типа) при их длительном применении в качестве «дневных седатиков», анксиолитиков и вегетативных стабилизаторов [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
В то же время тразодон такими свойствами не обладает – он, как правило, нейтрален в отношении влияния на аппетит, массу тела и метаболические параметры [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
В отличие от этифоксина, тразодон не обладает клинически значимой гепатотоксичностью, имеет низкий риск возникновения кожных аллергических реакций, и не имеет ограничения в инструкции на длительное (свыше 2 месяцев) применение [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Сопоставление тразодона с некоторыми другими препаратами, применяемыми в качестве «ночных седатиков» (снотворных средств)
Поскольку при различных соматоформных и соматизированных расстройствах, включая СВД, соматоформные болевые расстройства, соматизированные депрессии, соматизированные тревожные состояния и др., часто наблюдается инсомния, вторичная по отношению к тревоге, депрессии, болевому синдрому или соматовегетативным нарушениям, то в этом контексте представляет большой интерес также сопоставление тразодона с некоторыми другими препаратами, традиционно применяемыми для нормализации сна.
Итак, в качестве «ночных седатиков» (снотворных средств) в России и странах СНГ тоже традиционно имеют широкое применение несколько классов препаратов. Их список частично пересекается с обсуждавшимися нами разделом выше классами препаратов, которые традиционно имеют в России и странах СНГ широкое применение в качестве «дневных седатиков, анксиолитиков и вегетативных стабилизаторов»:
1) ГАМКергические препараты (бензодиазепины, Z-лекарства, прегабалин, габапентин, фенибут) [Монтгомери СА, 2010; Беккер РА, Быков ЮВ, 2017];
2) Малые дозы некоторых АП, обладающих выраженным снотворно-седативным действием, например малые дозы хлорпротиксена, тиоридазина, алимемазина, перициазина, а в последнее время – также малые дозы кветиапина или оланзапина, изредка (в основном при инсомнии в рамках тяжёлых психических расстройств, то есть – обычно за пределами так называемой «малой психиатрии») – малые дозы хлорпромазина, промазина, левомепромазина или клозапина [Быков ЮВ, Беккер РА, 2016; 2017; Беккер РА, Быков ЮВ, 2016; 2018];
3) Малые дозы некоторых АД, обладающих выраженным снотворно-седативным действием, например миртазапина, миансерина, амитриптилина [Беккер РА, Быков ЮВ, 2019];
4) Седативные антигистамины, например гидроксизин, доксиламин [Медведев ВЭ, Морозов ПВ, 2006; Морозов ПВ, Никитин ЗА, 2009].
К каждому из этих классов препаратов тоже применимы все те соображения о преимуществах тразодона перед ними, которые были высказаны нами выше, в разделе о сопоставлении тразодона с рядом других препаратов, традиционно применяемых в России и странах СНГ в качестве «дневных седатиков», вегетативных стабилизаторов и анксиолитиков.
Так, в частности, к Z-лекарствам, так же как и к бензодиазепинам, тоже относится высказанное нами разделом выше соображение о высоком риске развития привыкания, патологического пристрастия и лекарственной зависимости, и о нежелательности их длительного применения, хотя для Z-лекарств этот риск несколько ниже, чем для бензодиазепинов. Кроме того, эту группу препаратов, так же как и группу бензодиазепинов, нельзя применять при сопутствующем синдроме ночного апноэ или при миастении [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Кроме того, как мы сами, так и другие авторы неоднократно упоминали в статьях и докладах, посвящённых тразодону, об уникальном специфическом нормализующем действии этого препарата на фазовую структуру и архитектонику сна, выгодно отличающем его от многих других препаратов, традиционно применяемых в качестве снотворных [ECNP Poster Session, 2020; Петрова НН с соавт, 2021; Беккер РА, Быков ЮВ, 2021].
В основе этой уникальности влияния тразодона на фазовую структуру и архитектонику сна, как предполагается, лежат уникальные особенности его рецепторного профиля, которые выгодно отличают его от всех прочих off-label применяемых со снотворно-седативными целями АП и АД, таких как миртазапин или кветиапин, хлорпротиксен, амитриптилин. А именно – то, что в снотворно-седативном эффекте тразодона значительно бо́льшую роль играет его сильный, высокоаффинный инверсный агонизм к
5-HT2A подтипу серотониновых рецепторов, в сочетании с уже ранее упоминавшимся нами высокоаффинным антагонизмом тразодона к α1B подтипу адренорецепторов (который даёт подавление кошмаров, a la празозин или доксазозин), а вовсе не его сравнительно слабые H1 гистаминоблокирующие свойства, как это имеет место быть у всех прочих упомянутых препаратов [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
В специфическом нормализующем действии тразодона на фазовую структуру и архитектонику сна (в то время как, например, миртазапин, оланзапин, кветиапин или хлорпротиксен нередко сами дают яркие цветные сны и даже кошмары) важную роль играет также то обстоятельство, что в рецепторном профиле тразодона, в отличие от всех упомянутых препаратов, полностью отсутствуют М-холиноблокирующие свойства (даже такие слабые, как у миртазапина или N-дезметил-кветиапина), зато присутствуют сильный парциальный 5-HT1A агонизм и умеренный антагонизм к 5-HT2C серотониновым рецепторам, которые оба способствуют подавлению избыточной представленности REM-фаз сна при депрессиях, а также умеренный антагонизм к 5-HT7 подтипу серотониновых рецепторов, который становится клинически значимым при высоких дозах тразодона (выше 300 мг/сут) и может способствовать нормализации циркадных ритмов [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Обзор имеющейся доказательной базы для применения тразодона при расстройствах с соматическими симптомами
К сожалению, исследованию эффективности ПФТ вообще и АД в частности (вовсе не только тразодона) при расстройствах с соматическими симптомами (то есть соматоформных, соматизированных и конверсионных расстройствах) в литературе традиционно уделяется очень-очень мало внимания. На этот счёт имеются буквально единичные исследования [Maj M et al, 2005; Charis C, Panayiotou G, 2018].
Одной из причин такого положения дел в современной психиатрии является давно сложившееся твёрдое консенсусное убеждение большинства специалистов в том, что, будто бы, «соматоформные и конверсионные расстройства практически не лечатся, и особенно – не лечатся с помощью ПФТ». Следовательно, и изучать заново вопрос об эффективности ПФТ при этих расстройствах – по мнению большинства специалистов, бесперспективно или мало перспективно с научной точки зрения [Maj M et al, 2005; Charis C, Panayiotou G, 2018].
Результатом такого положения дел является то, что, согласно нескольким свежим Кокрейновским систематическим обзорам, ни для соматоформных расстройств, ни для конверсионных расстройств пока не существует убедительных с точки зрения доказательной медицины методов эффективного и безопасного лекарственного лечения [Kleinstäuber M et al, 2014; Ganslev CA et al, 2020].
Вместе с тем отдельные разрозненные данные об эффективности той или иной ПФТ при том или ином соматоформном расстройстве найти всё-таки можно. Есть такие данные и для тразодона. Первое исследование, посвящённое изучению эффективности и безопасности применения тразодона при психосоматических, соматоформных и соматизированных расстройствах, датировано ещё 1974 годом. По своему дизайну это исследование было двойным слепым плацебо-контролируемым рандомизированным клиническим испытанием (РКИ). В нём приняли участие 100 пациентов с различными психосоматическими, соматоформными и соматизированными расстройствами и коморбидной депрессией и/или тревогой. Все они были рандомизированы к получению либо тразодона, либо плацебо [Knobel M, 1974].
Автору данного РКИ удалось показать эффективность тразодона не только в отношении редукции коморбидных депрессивных, тревожных и диссомнических нарушений в данной когорте пациентов, но и в отношении редукции проявлений их основного психосоматического или соматоформного заболевания (психогенный кожный зуд, соматоформные боли, СВД и др.). Переносимость тразодона в этом РКИ была очень хорошей. Автор обосновывает эффективность тразодона при психосоматических расстройствах наличием у него, наряду с «основным» для него, как и для любого АД, антидепрессивным и противотревожным действием, также целого ряда соматотропных и вегетотропных эффектов, таких как анальгетический, противозудный, гипотензивный, гипотермический, вегетостабилизирующий, противорвотный [Knobel M, 1974].
В 2003 году группа китайских авторов провела ещё одно двойное слепое плацебо-контролируемое РКИ, в котором сравнивалась эффективность и безопасность применения при хроническом соматоформном болевом расстройстве ААД тразодона и нестероидного противовоспалительного препарата (НПВС) ибупрофена. В исследовании приняли участие 140 пациентов с соматоформным болевым расстройством, которые были рандомизированы в 2 одинаковые группы по 70 человек. Одна группа (контрольная) получала ибупрофен в качестве фармакологически активного плацебо-контроля, а другая (группа активного лечения) получала тразодон. Оценку выраженности боли проводили по шкале TESS. Параллельно оценивали выраженность коморбидных депрессии и тревоги по шкалам Гамильтона HAM-D и HAM-A соответственно [Wang YX et al, 2003].
В этом РКИ тразодон оказался гораздо эффективнее ибупрофена: уменьшение выраженности соматоформного болевого синдрома наблюдалось в 92,8% случаев при применении тразодона, и только в 62,8% случаев при применении ибупрофена (p = 0,01). Переносимость тразодона пациентами с соматоформным болевым расстройством (а это достаточно «капризная» категория пациентов) была очень хорошей, уровень ПЭ был минимальным. Кроме того, лечение тразодоном, в отличие от лечения ибупрофеном, в данном РКИ приводило не только к редукции соматоформного болевого синдрома, но и к улучшению сна, и к редукции проявлений коморбидной депрессии и тревоги [Wang YX et al, 2003].
Давно и хорошо известно, что наличие той или иной острой или хронической боли нарушает процессы засыпания и поддержания сна и неблагоприятно влияет на его фазовую структуру, на его качество и глубину [Pieh С et al, 2011].
В то же время не менее давно и хорошо известно, что вынужденная депривация сна или диссомнические нарушения приводят к повышению болевой чувствительности, и даже могут привести к возникновению de novo тех или иных болевых синдромов у ранее не страдавшего ими человека (например, к развитию приступа головной боли напряжения (ГБН) или приступа мигрени на фоне вынужденного недосыпания, или к появлению болей в спине, конечностях на фоне общего повышения мышечного тонуса при недосыпании) [Ohayon MM, 2009].
Таким образом, связь между болью и качеством сна – двусторонняя [Pieh С et al, 2011].
В свете этих данных, в 2005 году одна из исследовательских групп заинтересовалась вопросом о том, в какой степени уменьшение болей при хроническом соматоформном болевом расстройстве под влиянием тразодона – коррелирует с улучшением фазовой структуры и архитектоники сна под его влиянием. Обнаружилась значительная положительная корреляция между этими параметрами [Saletu B et al, 2005].
Однако наличие такой корреляции в данном исследовании не позволило авторам сделать вывод о том, что именно улучшение качества сна, его фазовой структуры и архитектоники, приводит к редукции соматоформного болевого синдрома (за счёт влияния сна на болевую чувствительность). Ибо корреляция – не тождественна каузации (наличию причинно-следственной связи) [Saletu B et al, 2005].
Авторы данного исследования напоминают, что, хотя тразодон улучшает качество сна в самых разных контекстах (вовсе не только при соматоформном болевом расстройстве), но и анальгетическое действие он оказывает тоже в самых разных контекстах. А поскольку между сном и болью связь, как мы уже говорили выше, – двусторонняя (боль нарушает сон, но и нарушения сна повышают болевую чувствительность), то вполне возможно, что именно в случае купирования тразодоном нарушений фазовой структуры и архитектоники сна при хроническом соматоформном болевом синдроме – каузальная связь направлена в противоположную сторону (то есть вполне возможно, что именно в этом случае анальгетическое действие тразодона приводит к снятию боли, а сон при этом улучшается вторично, за счёт устранения мешающей нормальному засыпанию и поддержанию сна боли) [Saletu B et al, 2005].
Об эффективности и безопасности применения тразодона при таких не считающихся «сугубо психосоматическими» или соматоформными, но имеющих в своём составе значительный психосоматический компонент, расстройствах, как хроническая мигрень, фибромиалгия (ФМА), синдром хронической усталости (СХУ), хронические головные боли (ХГБН), синдром раздражённого кишечника (СРК), и недавно появившийся «постковидный синдром», – мы уже писали ранее [Петрова НН с соавт, 2021; Беккер РА, Быков ЮВ, 2021].
Завершая обзор доказательной базы по эффективности и безопасности применения тразодона при психосоматических и соматоформных расстройствах, перейдём к представлению двух клинических случаев успешного применения тразодона для лечения соматоформных расстройств в нашей собственной практике.
. Соматоформный болевой синдром в виде хронической распространённой боли, сочетающийся с ипохондрическим расстройством (онкофобией) и элементами конверсии, осложнившийся ятрогенной полихимической зависимостью. Пациент И. С., 1980 года рождения (41 год на момент обращения за консультацией к одному из авторов настоящей статьи в 2021 году). По образованию бухгалтер. Женат, детей нет. В детстве и юности рос и развивался нормально. Психические заболевания среди близких родственников отрицает. До 2016 года признаков каких-либо психических или психосоматических расстройств не обнаруживал, к врачам по этому поводу не обращался. В 2016 году, на фоне попыток рейдерского захвата фирмы, в которой данный пациент работал главным бухгалтером, и потенциальной угрозы уголовного преследования за якобы имевшую место «неуплату налогов», у пациента резко нарушился сон, ухудшилось настроение, появилась сильная тревога, беспокойство, страх перед будущим, а также разлитые неопределённого характера боли во всём теле, которые пациент позднее описывал как «выкручивание, выламывание рук и ног», «тяжесть в конечностях», «постоянное урчание и нытьё в животе», «в спину словно кол вонзили, не могу расслабиться», «частые головные боли». Кроме разлитого болевого синдрома, у данного пациента в тот период, по его словам, наблюдались также субфебрильная температура тела, тахикардия, экстрасистолы, колебания артериального давления.
На тот момент пациент не считал необходимым обращение к врачам, а своё состояние приписывал стрессу на фоне грозившего ему как главному бухгалтеру фирмы уголовного преследования. Однако по миновании острой стрессовой ситуации (ликвидации угрозы рейдерского захвата фирмы и уголовного преследования лично его) психические симптомы тревожности и депрессии у данного пациента частично редуцировались, а разлитые боли во всём теле, хронический субфебрилитет, тахикардия, экстрасистолы, колебания артериального давления – остались на прежнем уровне. Пациент был вынужден оставить работу.
С этими жалобами пациент обратился к местным врачам. Причиной своих болей во всём теле и прочих симптомов он считал «вероятно, рак». Будучи исходно довольно образованным человеком, он начитался в Википедии о паранеопластическом синдроме и о его многообразных и порой странных и необычных проявлениях. Поэтому ещё до похода к терапевту он начал с детального соматического обследования на онкологию, которое включало в себя магнито-резонансную томографию (МРТ) всего тела, сдачу множества онкомаркеров в крови, ультразвуковое исследование (УЗИ) органов брюшной полости и т. д. Поскольку после тщательного соматического обследования никаких видимых медицинских причин для этих болей врачи найти не смогли, то пациент был направлен к психиатру. Психиатром был поставлен диагноз «соматоформное болевое расстройство» (somatoform pain disorder) в виде хронической распространённой боли (chronic widespread pain), который мы впоследствии подтвердили. По этому диагнозу данный пациент получал от психиатра назначения сначала флувоксамина (с доведением дозы до 200 мг/сут) с хлорпротиксеном 15 мг на ночь, а затем – пароксетина (с доведением дозы до 40 мг/сут) с алимемазином (5 мг 3 раза в сутки). Первый же приём хлорпротиксена, несмотря на малую дозу (всего 15 мг на ночь), – вызвал у этого пациента приступ острой кривошеи, заставивший его вызвать скорую помощь. Причиной этого, вероятно, послужило сочетание трёх неблагоприятных факторов – высокой чувствительности этого пациента к экстрапирамидным ПЭ от АП, высокого уровня тревожности, и способности флувоксамина повышать концентрацию хлорпротиксена в крови за счёт торможения его печёночного метаболизма. После этого эпизода от дальнейшего приёма хлорпротиксена пациент отказался. Флувоксамин, однако, он принимать продолжил. После пяти месяцев неэффективного лечения флувоксамин 200 мг/сут был заменен тем же психиатром на пароксетин с алимемазином. Приём алимемазина вызвал у пациента неприятную сухость во рту, слабость и головокружение (вероятно, вследствие ортостатической гипотензии), усиление тахикардии. От дальнейшего приёма алимемазина данный пациент также отказался. Пароксетин принимать он, тем не менее, продолжил. Эффекта от данной терапии тоже не было, ни по линии соматоформных болей, ни по линии сопутствующей депрессии и тревоги. После трёх месяцев неэффективного лечения пароксетином 40 мг/сут данному пациенту было озвучено его тогдашним лечащим психиатром, что «соматоформные расстройства вообще-то в принципе не лечатся, а особенно они не лечатся таблетками», и что психиатр ему больше ничем помочь не может, и что ему необходима психотерапия. Пациент последовал этому совету. Однако найти грамотного психотерапевта «на месте» он не смог. По его словам, один из специалистов, к которому он обратился, занимался тем, что «делал пассы руками, зажигал ароматические свечи и пытался погрузить его в гипнотическое состояние», а второй – «пытался втирать ему какую-то мистическую чушь». После двух неудачных попыток найти психотерапевта данный пациент оставил дальнейшие попытки получить психотерапию.
Считая себя неизлечимо больным и страдая от хронических соматоформных болей, данный пациент, продолжая принимать неэффективный для него пароксетин
40 мг/сут, в отчаянии обратился к польскому психиатру, от которого получил дополнительное назначение сначала клоназепама до 4 мг/сут для расслабления мышц, в надежде уменьшить таким образом боли (клоназепам оказался неэффективным в этом отношении и был отменен, хотя, по словам пациента, «тревогу снимал хорошо»), а затем – прегабалина 150 мг/сут, потом 300 мг/сут. На этой терапии, по описанию пациента, «боли стали немного меньше», но полностью не исчезли. Затем польский специалист добавил данному пациенту комбинированный препарат Таргин (оксикодон + налоксон). Пациент добился официального разрешения на его провоз через границу.
Доза оксикодона за 4 года его применения постепенно доросла до 120 мг/сут (40 мг x 3 раза в сутки), при том, что эффект данной терапии в отношении болей во всём теле всё равно оставался неполным. На момент обращения за консультацией к одному из авторов настоящей статьи данный пациент был по-прежнему в статусе безработного, получал пароксетин 40 мг/сут, прегабалин 300 мг/сут, оксикодон 120 мг/сут в виде Таргина. Он предъявлял жалобы на разлитые боли во всём теле, а также на плохое, подавленное, тоскливое настроение, на потерю способности испытывать радость и удовольствие от жизни (ангедонию), на хроническую усталость и разбитость, апатию, нежелание ничего делать, отсутствие сил и энергии, мотивации, на импотенцию, небольшую гинекомастию, плохой сон, на эпизодически возникающие суицидальные мысли общего характера (без конкретных планов), мысли о собственной неизлечимости и безнадёжности, и на плохие, конфликтные отношения с женой. Несмотря на то, что обследования в своё время не обнаружили у данного пациента никаких соматических причин для испытываемых им сильных и разлитых хронических болей во всём теле, пациент выражал сомнение в этом и высказывал мысли о целесообразности повторного онкологического обследования. Он также высказывал мысли о том, что «это может быть какое-то митохондриальное или редкое генетическое заболевание».
Показатель шкалы депрессии Бека на момент обращения за консультацией составлял 23 балла (тяжёлая депрессия), показатель шкалы тревоги Шихана – 91 балл (крайне выраженная тревожность). Уровень боли пациент оценивал по визуальной аналоговой шкале на 7 из 10 – несмотря на приём Таргина, прегабалина и пароксетина.
Показатель шкалы соматосенсорной амплификации SSAS, отражающей степень ипохондризации пациента, – на момент обращения за консультацией составлял 49 из
50 баллов, показатель шкалы самосострадания, отражающей степень склонности пациента «жалеть себя и накручивать себя», – 52 из 60 баллов. Показатели шкалы CPAQ «принятия боли» – говорили о выраженной социальной дезадаптации пациента в связи с хронической болью, об определённом его «зацикливании» на ней, а также о его неготовности менять свой подход к жизни и к болезни, о том, что он, в целом, расценивает наличие боли как основание для того, чтобы ничего не делать по дому, не искать работу и т. д.
Пациенту были детально разъяснены природа его заболевания и план лечения. В связи с тяжестью депрессии и наличием хронического соматоформного болевого синдрома пароксетин 40 мг/сут был заменен на более мощную и обладающую анальгетическим действием комбинацию дулоксетина (с доведением до 120 мг/сут) и миртазапина (30 мг/сут). Дулоксетин, а не венлафаксин, был выбран нами в составе этой комбинации (известной в общем случае как «калифорнийское ракетное топливо») не только из-за его потенциально более сильного анальгетического действия, но и из-за лучшей в среднем переносимости дулоксетина по сравнению с венлафаксином, в частности меньшей его склонности повышать артериальное давление. Комбинирование АД с самого начала было предпринято нами как из-за тяжести депрессии и соматоформного болевого синдрома, так и из-за наличия у пациента нарушений сна, аппетита, либидо и сексуальной функции, поскольку у нас были опасения, что монотерапия дулоксетином у этого пациента может дополнительно ухудшить у него сон, аппетит, либидо и сексуальную функцию. Затем в кооперации с польским специалистом Таргин в дозе, эквивалентной 120 мг/сут оксикодона, был заменен нами на Бупраксон (бупренорфин + налоксон) в дозе, эквивалентной 8 мг/сут бупренорфина, с тем, чтобы, с одной стороны, попытаться использовать известное антидепрессивное действие бупренорфина как каппа-антагониста, с другой – попытаться улучшить контроль боли, а с третьей – создать условия для последующей плавной опиоидной детоксикации, которую легче провести на парциальном мю-агонисте с большим T1/2 (бупренорфине), чем на полном мю-агонисте с коротким T1/2 (оксикодоне). Прегабалин был нами постепенно редуцирован и отменен (с 300 мг/сут до 225, затем 150, затем 75, затем 50, 25 и 0 мг), как с целью уменьшить общее количество лекарств и стоимость лечения, так и с целью ослабить негативное влияние всей схемы на либидо и потенцию.
На этой терапии пациенту стало значительно лучше. Средняя оценка по визуальной аналоговой шкале боли снизилась с 7 баллов до 3-4 баллов. Снизились также показатели депрессии по шкале Бека и тревоги по шкале Шихана и показатель шкалы ипохондрии SSAS. Однако полной ремиссии на этой комбинации достигнуто не было. Кроме того, пациента стали беспокоить прибавка массы тела на миртазапине, а также яркие цветные сны. Для него, на фоне улучшения психического состояния, также приобрела бо́льшую личностную значимость сохранявшаяся все годы лечения проблема нарушения либидо и эректильной функции. Чтобы избавиться от этих проблем, мы попытались плавно, наложением «крест-накрест», заменить у этого пациента миртазапин 30 мг на ночь на тразодон, сначала 50 мг на ночь, с постепенным доведением дозы тразодона до 100 мг на ночь, затем до 150 мг на ночь и последующим постепенным снижением миртазапина до 15 мг на ночь, затем до 7,5 мг на ночь и затем до 0 мг после 2 недель пребывания на 150 мг/сут тразодона (с тем, чтобы его эффект успел развиться).
С учётом того, что у этого пациента в прошлом были ортостатические реакции на алимемазин, нами были заранее рекомендованы проактивные меры по предотвращению этого при приёме тразодона (увеличение потребления воды и соли, компрессионные гольфы на ноги, сон с приподнятым головным концом, медленное и плавное вставание с кровати по утрам).
Однако первая попытка замены миртазапина на тразодон окончилась неудачей – при попытке снижения и отмены миртазапина произошло усиление соматоформных болей. Ухудшилось психическое состояние также и по линии тревоги и депрессии. Возвращение миртазапина и отмена тразодона по настоянию пациента – быстро купировали это обострение.
В то же время пациент отметил, что в период кратковременного пребывания на переходной комбинации из трёх АД (дулоксетина 120 мг/сут, миртазапина 30 мг/сут и тразодона 150 мг/сут) у него улучшился сон, улучшились либидо и эрекция, исчезли появившиеся на миртазапине кошмары, а контроль боли стал лучше – по его словам, «с 3-4 до 2-3 баллов из 10». На этом основании мы решили снова попробовать добавить тразодон 150 мг/сут, но уже без намерения убрать через некоторое время после его добавления миртазапин.
Эта попытка, в отличие от предыдущей, оказалась успешной. Она привела к улучшению не только по линии хронических соматоформных болей, но и по линии депрессии и тревоги, а также по линии либидо и потенции. Улучшение по линии депрессии, в отличие от улучшения сна и уменьшения боли, в данном случае наступило очень медленно, только спустя 6 недель после добавления тразодона 150 мг/сут. На фоне этого улучшения психического состояния мы смогли, в кооперации с польским специалистом, очень плавно, постепенно, в течение 3 месяцев, редуцировать бупренорфин с 8 мг/сут до 0. При этом мы сумели избежать ярких проявлений опиоидного абстинентного синдрома (ОАС), а также избежать обострения депрессии, тревоги или соматоформных болей. Чтобы добиться дальнейшего улучшения состояния, полного купирования остаточной хронической боли («2-3 из 10») и остаточной депрессии и тревоги, мы решили попробовать плавно, крест-накрест, заменить миртазапин на оланзапин 2,5-5 мг/сут. Эта попытка, как и предыдущая попытка замены миртазапина на тразодон, – окончилась неудачей (рецидивом болей и тревоги). Миртазапин пришлось вернуть. В то же время, опять-таки, пациент отметил, что во время кратковременного пребывания на этих 4 препаратах (дулоксетин 120 мг/сут, миртазапин 30 мг/сут, тразодон 150 мг/сут и оланзапин 5 мг/сут) – его психическое состояние стало ещё лучше и стабильнее, а уровень боли, по его словам, снизился с 2-3 до 0 по визуальной аналоговой шкале. Параллельно с пошаговым подбором ПФТ данному пациенту проводилась онлайн КПТ и терапия принятия и ответственности по поводу хронической боли, депрессии и тревоги, предпринимались мероприятия по поведенческой активации, налаживанию отношений с женой (попутно отметим, что конфликты с ней сопровождались у пациента психогенным усилением боли, что и дало нам основание говорить о наличии отдельных конверсионных черт в его страдании, хотя оно и не является на 100% конверсионным – оно соматоформное), обучению пациента справляться со стрессами и тревогами повседневной жизни.
Таким образом, в итоге длительного подбора ПФТ у этого пациента мы пришли к схеме из 4 препаратов – дулоксетина 120 мг/сут, миртазапина 30 мг/сут, тразодона
150 мг/сут и оланзапина 5 мг/сут. На этой терапии у данного была достигнута полная ремиссия как по линии хронического соматоформного болевого синдрома, так и по линии тревоги, депрессии, и по линии нарушений сна. Как оказалось впоследствии, каждый из этих 4 препаратов, включая и тразодон, – критически необходим в схеме у данного пациента. Любая попытка снижения или отмены какого-либо из них ради упрощения и удешевления схемы или ради снижения ПЭ – быстро приводит к рецидиву соматоформного болевого синдрома, тревоги и/или депрессии. Проблему возможной дальнейшей прибавки массы на данной терапии мы в итоге сумели решить с помощью поведенческих методов (контроль питания и физической активности) и дополнительного назначения метформина 2000 мг/сут. Пациент восстановил социальную адаптацию, трудоспособность, в настоящее время работает главным бухгалтером на мебельной фабрике. Продолжает принимать данную схему по сей день.
Клинический случай № 2. Соматоформная вегетативная дисфункция, сочетающаяся с ипохондрическим расстройством (кардиофобией).
Пациент М. А., 1997 года рождения (23 года на момент обращения за консультацией к одному из соавторов настоящей статьи в 2020 году). По образованию учитель математики. В детстве и юности рос и развивался нормально. Психические заболевания у родственников отрицает. С детства рос тревожным и впечатлительным ребёнком, однако в период до 2020 года симптомов психического расстройства не обнаруживал, к врачам по этому поводу не обращался.
С 2015 года (с 18 лет) данный пациент страдает хроническим неврологическим заболеванием – синдромом беспокойных ног (СБН). По этому поводу получал по назначению невролога пропранолол 40 мг перед сном, с хорошим эффектом. В 2020 году, на фоне вынужденной смены места жительства и связанного с этим стресса, у данного пациента развилось тревожное состояние, со всеми типичными для него симптомами (нарушения засыпания, тахикардия, экстрасистолы, тремор рук, снижение аппетита, похудание, потливость, колебания артериального давления, периодическая тошнота, постоянное чувство внутреннего напряжения, беспокойства, постоянная готовность к самым плохим исходам любых ситуаций).
Панических атак (ПА) у этого пациента никогда не было, тревога у него носила постоянный, фоновый характер. Со временем ощущение тревоги, беспокойства и внутреннего психического напряжения у него редуцировалось, а соматовегетативные проявления тревожности, такие как тахикардия, экстрасистолы, тремор рук, потливость, слабость, быстрая утомляемость, частые головные боли напряжения (ГБН), – сохранились. Таким образом, можно говорить о том, что тревога у этого пациента соматизировалась.
Данный пациент испытывал сильный страх за состояние своего сердца в связи с «перебоями» (экстрасистолами), хронической тахикардией и гипервентиляцией, боялся развития у себя тяжёлого сердечного заболевания, например инфаркта миокарда. С этой мыслью он неоднократно обращался к кардиологам, неврологам, терапевтам, проходил многочисленные обследования (электрокардиографию, эхокардиографию, спирографию и др.). Поскольку ни одно из обследований не обнаружило у него какой-либо патологии сердца (кроме небольшого и не имеющего клинического значения пролапса митрального клапана (ПМК) 1-й степени, без регургитации), то в конечном итоге этот пациент был направлен к психиатру.
У психиатра он получил назначение сначала эсциталопрама 10 мг/сут с гидазепамом 20 мг x 3 раза в день и хлорпротиксеном 50 мг на ночь. От приёма этой терапии он сразу же отказался, так как получил с первых же доз эсциталопрама и хлорпротиксена усиление симптоматики СБН, тревогу, акатизию, тризм челюстей и тошноту; гидазепам в качестве прикрытия не сработал. Затем он получил от того же психиатра назначение пароксетина 20 мг/сут с алимемазином 5 мг × 3 раза в день, с тем же результатом. После этого данный пациент обратился за помощью к одному из соавторов настоящей статьи. На момент обращения за консультацией показатель шкалы депрессии Бека у данного пациента составлял 5 баллов (депрессия отсутствует), показатель шкалы тревоги Шихана – 87 баллов (весьма выраженная тревожность), показатель шкалы соматосенсорной амплификации SSAS – 37 баллов (выраженная ипохондризация).
Учитывая, с одной стороны, выраженную тревожность, нарушения сна, наличие в клинической картине страдания у этого пациента таких симптомов, как тошнота и снижение аппетита (и, соответственно, нежелательность назначения ему СИОЗС, которые сами имеют эти ПЭ), а также наличие у него коморбидного СБН, высокую чувствительность к СИОЗС-индуцированным экстрапирамидным ПЭ (акатизия, тризм челюстей) и важность сохранения сексуальной функции для этого молодого человека, – мы сочли, что тразодон будет наилучшим выбором следующего АД. Сообразно этому, данному пациенту был назначен тразодон, сначала 50 мг на ночь, через 3 дня – 100 мг на ночь, ещё через 3 дня – 150 мг на ночь. С целью избежать возможной рефлекторной тахикардии наутро при приёме тразодона и возможного усиления в связи с этим кардиофобии и тревожности, короткодействующий пропранолол 40 мг на ночь был заменен нами на длительно действующий бисопролол 2,5 мг утром и 2,5 мг вечером. Одновременно нами были предприняты проактивные меры по предотвращению ортостатических реакций (информационная беседа о важности плавного вставания с кровати, увеличения потребления воды и соли, спать с приподнятым головным концом). Параллельно проводилась КПТ тревоги. Данная терапия привела к становлению у пациента полной клинической ремиссии, которая в настоящее время, после 6 мес лечения тразодоном 150 мг/сут и бисопрололом 5 мг/сут, поддерживается уже без ПФТ (бисопролол он по-прежнему принимает по линии СБН).
Заключение
Как видно из приведённых нами данных литературы, тразодон, благодаря некоторым особенностям своего рецепторного профиля, обуславливающим наличие у него, наряду со снотворно-седативными, антидепрессивными и анксиолитическими свойствами, также выраженной анальгетической и вегетостабилизирующей активности, гипотермических, противорвотных и противозудных свойств, – может являться эффективным и безопасным средством лечения психических расстройств с соматическими симптомами, в том числе соматоформного болевого расстройства, соматоформных вегетативных дисфункций, конверсионного расстройства, термоневрозов, кардионеврозов и др.
Наличие у тразодона антиобсессивных свойств и его эффективность при ОКР позволяют предполагать, что он может быть также эффективен и при таких феноменологически сходных с ОКР расстройствах из соматоформного спектра, как ипохондрическое расстройство и дисморфическое телесное расстройство.
Важным преимуществом применения тразодона в качестве вегетостабилизирующего препарата перед применением в этой роли таких препаратов, как хлорпротиксен, алимемазин, тиоридазин, – является отсутствие у него D2-дофаминоблокирующей и М-холиноблокирующей активности. Это означает, соответственно, отсутствие вероятности получить при его применении острую дискинезию (как в клиническом примере № 1), острую акатизию, лекарственный паркинсонизм, усиление симптомов СБН или, например, такие «атропиноподобные» ПЭ, как запоры, задержка мочи, сухость во рту, мидриаз, парез аккомодации глаз, нарушения памяти. С другой же стороны, важным преимуществом применения тразодона перед применением СИОЗС при этих расстройствах является отсутствие у него склонности вызывать начальное обострение тревоги и беспокойства, тошноту, рвоту, поносы, снижение аппетита, отсутствие негативного влияния на либидо и эректильную функцию, на качество и яркость оргазма, на сон и его фазовую структуру (напротив, тразодон способен улучшать либидо и сексуальную функцию, а также оказывать специфическое нормализующее влияние на сон и его фазовую структуру). Это сыграло свою роль в клиническом примере № 2. С учётом особой чувствительности пациентов с психосоматическими расстройствами к различным ПЭ от психотропных препаратов, эти различия в переносимости между тразодоном и вышеуказанными альтернативными препаратами приобретают особое значение. Представленные нами в данном обзоре два клинических примера из нашей собственной практики – на наш взгляд, весьма убедительно иллюстрируют данный тезис.
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№02 2022
Об эффективности и безопасности тразодона при расстройствах с соматическими симптомами (Обзор литературы и представление двух клинических случаев) №02 2022
Абстракт
Психические расстройства, протекающие с разнообразными соматическими симптомами, известны человечеству с незапамятных времён. Исторически первое описание того, что позже было названо «истерией», а сегодня зовётся конверсионным расстройством или функциональным неврологическим расстройством, – содержится ещё в древнеегипетском Папирусе Эберса, авторство оригинала которого безымянный переписчик приписывает вице-фараону Имхотепу (ок. 2700 г. до нашей эры). А исторически первое описание «меланхолии» (то есть депрессии с выраженными витальными, соматическими симптомами) было дано ещё Гиппократом (ок. 460–370 г. до нашей эры). Впоследствии изучение и попытки лечения обоих этих расстройств сыграли огромную роль в истории психиатрии.
Как показывают современные эпидемиологические данные, различные соматоформные, соматизированные и конверсионные расстройства встречаются в популяции намного чаще, чем было принято считать ранее. В то же время эти разновидности психических расстройств часто приводят к инвалидизации пациентов, в среднем плохо поддаются лечению, часто проявляют признаки терапевтической резистентности или, наоборот, «отрицательной терапевтической резистентности» (интолерантности к психотропным лекарствам) и часто бывают коморбидны с депрессивными и тревожными расстройствами, часто осложняются присоединением тех или иных химических зависимостей, в том числе, порой, ятрогенных. Всё это обуславливает актуальность проблемы их лечения.
В данной статье мы обосновываем, почему, вследствие ряда особенностей его рецепторного профиля, атипичный антидепрессант (ААД) тразодон может во многих случаях оказаться наиболее подходящим выбором для психофармакотерапии (ПФТ) этих расстройств, рассматриваем имеющуюся доказательную базу для его применения в этом качестве, а затем представляем два клинических случая эффективности тразодона при лечении соматоформных расстройств из нашей собственной практики.
Ключевые слова: истерия, конверсионное расстройство, соматоформное расстройство, соматизированное расстройство, ипохондрия, соматоформный болевой синдром.
Для цитирования: Р.А. Беккер, Ю.В. Быков. Об эффективности и безопасности тразодона при расстройствах с соматическими симптомами (Обзор литературы и представление двух клинических случаев). Психиатрия и психофармакотерапия. 2022; 2: 15–32.
On the efficacy and safety of trazodone in somatic symptom disorders (A Literature Review with Presentation of Two Clinical Cases)
R.A. Bekker1, Yu.V. Bykov2
Abstract
Mental disorders with a variety of somatic symptoms have been known to mankind since prehistoric times. Historically, the first description of what was later called «hysteria» and what today is called a conversion disorder or a functional neurological disorder is contained in the ancient Egyptian Ebers Papyrus, the authorship of the original of which is attributed by an unnamed scribe to the Vice-Pharaoh Imhotep (c. 2700 BC). Also historically the first description of so-called «melancholy» (that is, depression with pronounced vital, somatic symptoms) was given by Hippocrates (c. 460—370 BC). Subsequently, the scientific study and attempts to treat both of these disorders played a huge role in the history of psychiatry.
As modern epidemiological data show, various somatoform, somatization and conversion disorders occur in the population much more often than previously thought. At the same time, these types of mental disorders often lead to severe disability, are often difficult to treat, often show signs of therapeutic resistance or, conversely, «negative therapeutic resistance» (intolerance to psychotropic drugs). Those disorders also are often comorbid with depressive and anxiety disorders. Their lifetime course is often complicated by the development of certain chemical dependencies, including, at times, iatrogenic ones. All this said, the actuality of having an effective treatment for those disorders should be evident to the reader.
In this article, we justify why, due to a number of distinctive features of its receptor profile, the atypical antidepressant trazodone may in many cases be the most appropriate choice for psychopharmacotherapy of those disorders. Then we briefly review the available evidence base for the use of trazodone to treat those disorders. Then we present two clinical cases which illustrate the effectiveness and safety of trazodone in the treatment of somatoform disorders in our own practice.
Keywords: hysteria, conversion disorder, somatoform disorder, somatization disorder, hypochondriasis, somatoform pain syndrome, somatoform autonomic dysfunction, alpha-1 adrenoceptor, 5-HT1A receptor, 5-HT2A receptor, trazodone.
For citation: R.A. Bekker, Yu.V. Bykov. On the efficacy and safety of trazodone in somatic symptom disorders (A Literature Review with Presentation of Two Clinical Cases). Psychiatry and psychopharmacotherapy. 2022; 2: 15–32.
Введение (Немного об истории психосоматических расстройств)
Психические расстройства, протекающие с многообразными соматическими симптомами, известны человечеству с глубокой древности. И с древнейших же времён человечеством предпринимались попытки их классификации и лечения [Dollie F, 1974; Okasha A, 2001].
Ещё древнеегипетские врачи в знаменитом «Папирусе Эберса», который датируется 1550 годом до нашей эры и авторство которого безымянный его копировщик приписывает вице-фараону Имхотепу, жившему ещё намного раньше (около 2700 года до нашей эры) и впоследствии провозглашённому древнеегипетскими жрецами богом-покровителем медицины, впервые описали некое психическое расстройство, поразительно напоминающее по своим симптомам то расстройство, которое позднее знаменитый древнегреческий врач, Гиппократ из Коса (живший между 460 и 370 годами до нашей эры), назовёт «истерией». Более того, древние египтяне задолго до Гиппократа выдвинули теорию о том, что, якобы, природа этого расстройства связана с «блужданием матки» [Dollie F, 1974; Okasha A, 2001].
Позднее Гиппократ из Коса, наряду с повторным описанием «истерии» и введением для неё этого наименования, описал в своих трудах классическую картину тяжёлой «эндогенной», меланхолической формы депрессии, и предложил для неё название «меланхолия». При этом он особо выделил и подчеркнул наличие в картине этой болезни, наряду с психическими симптомами, такими как тяжёлая тоска и подавленность, нежелание жить, отсутствие способности радоваться и испытывать удовольствие от жизни, выраженная тревожность, также целого ряда характерных соматических симптомов, таких, как снижение или отсутствие аппетита, бессонница, исхудание, физическая слабость, разнообразные телесные боли, запоры, учащённое сердцебиение, потливость, тремор [Bourgeois ML, 2002; Crocq MA, 2015].
Как само описание меланхолической формы депрессии, впервые данное Гиппократом из Коса, так и выделение этой формы депрессии из прочих возможных форм её протекания по сей день сохраняют свою актуальность. В МКБ-10 и в DSM-IV-TR эта форма депрессии называется «депрессия с соматическими симптомами». Это наименование ещё раз подчёркивает важность выделения и изучения именно соматических симптомов в общей картине депрессивного расстройства, как для правильной диагностики и дифференциальной диагностики, так и для планирования адекватного лечения [Bourgeois ML, 2002; Crocq MA, 2015; Мазо ГЭ, Незнанов НГ, 2012].
Так называемая «атипичная» форма депрессии, в свою очередь, отличается от «классической меланхолической» её формы – не чем иным, как именно инвертированными соматовегетативными признаками – повышением аппетита (гиперфагией) вместо его снижения или полного исчезновения (гипорексии или даже полной анорексии), прибавкой массы тела вместо исхудания, повышенной сонливостью или увеличением суточного количества сна (гиперсомнией) вместо бессонницы (инсомнии), свинцовой тяжестью или болями в конечностях (то есть в дистальных концах тела) вместо сдавливания, тяжести или болей в центре тела – за грудиной («витальной тоски», «сердечной тоски») [Bourgeois ML, 2002; Crocq MA, 2015; Мазо ГЭ, Незнанов НГ, 2012].
Часто наблюдаемая при депрессивных и тревожных расстройствах триада соматовегетативных симптомов, отражающая гиперактивность симпато-адреналовой части вегетативной нервной системы (ВНС) при этих заболеваниях, – расширение зрачков (мидриаз), тахикардия и спастические запоры (при депрессиях) либо склонность к метеоризму и диарее (при тревожных состояниях) – настолько характерна, что даже получила в своё время название «триада Протопопова». Однако нередко наблюдаются при депрессиях и тревожных расстройствах и другие симптомы гиперактивности симпато-адреналового отдела ВНС, в частности такие, как тошнота, сухость во рту, колебания артериального давления с наклонностью к его повышению и большой пульсовой разницей, бледность кожных покровов, холодные руки и ноги, потливость (гипергидроз), тремор, напряжение скелетных мышц, спонтанная акатизия (непоседливость, неусидчивость, потребность постоянно менять позу) в отсутствие предшествующего приёма психотропных препаратов, способных вызвать акатизию [Gupta RK, 2009; Мазо ГЭ, Незнанов НГ, 2012].
В совсем недавнем историческом прошлом многие учёные, в частности выдающийся швейцарский психиатр Поль Кильхольц, посвятили много времени изучению и поиску способов лечения так называемых «маскированных», или соматизированных депрессий, а также состояний «маскированной», или соматизированной тревоги, то есть – таких состояний, при которых пациент, возможно, вообще не ощущает или в сравнительно малой степени ощущает субъективное чувство тревоги или тоски, подавленности, депрессии – однако эти состояния, тем не менее, проявляются определёнными соматовегетативными симптомами, иногда очень обильными, очень разнообразными и имеющими тяжёлый, даже инвалидизирующий пациента характер [Беккер РА с соавт, 2019].
С другой же стороны, исследование и попытки лечения того расстройства, которое Гиппократ, описав, впервые предложил назвать «истерией», – тоже сыграло огромную роль в истории зарождения и развития всей современной психиатрии, не меньшую, чем исследование депрессивных расстройств. Именно из изучения и попыток лечения пациенток с «истерией» – выросли сначала медицинский гипноз, принесённый в психиатрию и неврологию знаменитым французским неврологом Жаном Мартеном Шарко, а затем – теория и практика психоанализа Зигмунда Фрейда – ставшая исторически первой попыткой поставить известную ещё с догиппократовских времён наивную эмпирическую практику психотерапии («лечения ободряющим словом») на прочную научную и идейно-философскую основу [Морозов ПВ с соавт, 2020].
Между тем, как мы сегодня знаем, «все мы вышли из фрейдовской шинели». Все направления современной психотерапии выросли либо из дальнейшего развития и обогащения «классического фрейдизма» (неофрейдизм), либо из отрицания его отдельных догматов при сохранении общего психоаналитического, психодинамического подхода (юнгианская, адлерианская и другие психоаналитические и психодинамические школы), либо из отрицания самой идеи психоанализа и поиска других, более практичных и эффективных и более быстродействующих методов психотерапии (такова, например, когнитивно-поведенческая психотерапия – КПТ) [Морозов ПВ с соавт, 2020].
В последующем, по мере продолжения изучения «истерии», стало понятно, что это – не одно какое-то расстройство, а большая и весьма гетерогенная по клинической картине и степени тяжести группа психических расстройств с различным патогенезом, разным течением и прогнозом. Кроме того, само название этой болезни – «истерия», которое ещё со времён Гиппократа было исторически сопряжено с представлением о «бешенстве матки» и о недостатке сексуальной активности как причине этой болезни (это отражено даже в самой этимологии древнегреческого слова hysteria), – со временем стало восприниматься как оскорбительное, стигматизирующее, дискриминационное и сексистское. Более того, оно научно некорректно, так как ещё Зигмунд Фрейд доказал, что «истерией» могут страдать вовсе не только женщины [Морозов ПВ
с соавт, 2020].
На основании новых научных данных ту гетерогенную группу расстройств, которые раньше обобщённо называли «истерией», в МКБ-10 и в DSM-IV разделили на конверсионные расстройства – conversion disorders (или, по более новой терминологии, функциональные расстройства с неврологическими симптомами – functional neurological symptom disorders), соматоформные расстройства (somatoform disorders), соматизированные расстройства (somatization disorders) и ипохондрическое расстройство – hypochondriasis (или, по более новой терминологии, тревожное расстройство болезни – illness anxiety disorder) [Maj M et al, 2005; Charis C, Panayiotou G, 2018].
В общей группе соматоформных расстройств (somatoform disorders) обе классификации выделяют такие важные их частные случаи, как соматоформное болевое расстройство (somatoform pain disorder) и соматоформная вегетативная дисфункция (СВД) – somatoform autonomic dysfunction [Maj M et al, 2005; Charis C, Panayiotou G, 2018].
Забегая немного вперёд, сообщим, что представленные в настоящем обзоре два клинических примера эффективности тразодона при соматоформных расстройствах из нашей собственной практики – относятся как раз к этим двум частным разновидностям соматоформных расстройств. Клинический пример № 1 описывает пациента с тяжёлым хроническим соматоформным болевым расстройством, у которого тразодон оказался одним из ключевых компонентов эффективной комбинации лекарств, а клинический пример № 2 – описывает пациента с СВД, у которого тразодон оказался эффективен в монотерапии. Более поздняя классификация DSM-5, а также во многом идеологически наследующая ей МКБ-11 – устранили разделение на соматизированные расстройства (somatization disorders) и соматоформные расстройства (somatoform disorders), которое оказалось во многом искусственным и натянутым, а кроме того – клинически бесполезным и поэтому не нужным. Вся категория соматоформных расстройств теперь называется «расстройства с соматическими симптомами» (somatic symptom disorders). Вместе с тем выделение таких частных случаев, как психосоматическое болевое расстройство (psychosomatic pain disorder), сохранило актуальность и в новой классификации [Charis C, Panayiotou G, 2018].
Близко к этой группе расстройств примыкает также дисморфическое расстройство тела (body dysmorphic disorder), которое ранее называли дисморфофобией (dysmorphophobia) [Maj M et al, 2005; Charis C, Panayiotou G, 2018].
Ряд авторов обращают внимание на то, что ипохондрическое расстройство (тревожное расстройство болезни) и дисморфическое расстройство тела – имеют, по их мнению, гораздо большее феноменологическое сходство с классическим обсессивно-компульсивным расстройством (ОКР), чем с другими соматоформными или соматизированными расстройствами, или, например, чем с другими тревожными расстройствами. Они, в частности, указывают, что ипохондрическое расстройство сопровождается преоккупацией, патологической фиксацией на мыслях о возможной тяжёлой или неизлечимой болезни, а также компульсивным поиском и отслеживанием симптомов подозреваемых болезней, а дисморфическое расстройство тела сопровождается точно такой же патологической фиксацией на мыслях о возможном уродстве, недостатке или дефекте внешности, и компульсивным поиском путей и способов его обнаружения и исправления (либо же путей и способов его сокрытия от посторонних взглядов) [Pittenger С, 2017; Abramowitz JS et al, 2017].
В обоих случаях очевидно сходство данных проявлений с обсессиями и компульсиями при классическом ОКР. На этом основании данные авторы предлагают перенести ипохондрическое расстройство и дисморфическое расстройство тела из раздела соматоформных расстройств (или, по-новому, «расстройств с соматическими симптомами») в раздел расстройств обсессивно-компульсивного спектра (РОКС), по аналогии с такими ныне уже общепризнанными РОКС, как компульсивный шоппинг, патологическое накопительство, патологический гемблинг [Pittenger С, 2017; Abramowitz JS et al, 2017].
В качестве дополнительных обоснований для своей точки зрения данные авторы указывают, что ипохондрическое расстройство и дисморфическое расстройство тела имеют сходство с ОКР не только на уровне феноменологии, но и на уровне патофизиологии мозга (например, паттернов активации определённых зон мозга в ответ на определённый триггер, по сравнению со здоровым контролем), и на уровне ответа на психофармакотерапию (ПФТ), поскольку при обоих типах психических расстройств – и при ипохондрическом расстройстве, и при дисморфическом телесном расстройстве – эффективны те же лекарства, что и при ОКР [Pittenger С, 2017; Abramowitz JS et al, 2017].
Обоснование актуальности проблемы
Соматоформные, соматизированные и конверсионные расстройства, а также ипохондрическое расстройство, судя по всему, встречаются в повседневной клинической практике врачей разных специальностей гораздо чаще, чем было принято думать ранее [Haller H et al, 2015].
Так, по разным данным, от 26,2% до 34,8% пациентов, регулярно посещающих семейного врача или участкового терапевта, соответствовали строгим диагностическим критериям МКБ-10 либо DSM-IV для постановки диагноза как минимум одного из соматоформных расстройств. От 40,2% до 49% пациентов, регулярно посещающих семейного врача, предъявляли жалобы как минимум на один предположительно соматоформный по своему происхождению симптом, не имевший объективной медицинской причины или объяснения для своего развития [Haller H et al, 2015].
Общую распространённость всей совокупности соматоформных и соматизированных расстройств в популяции разные авторы оценивают от 0,8% до 5,9%. По-видимому, вторая оценка гораздо ближе к действительности [Haller H et al, 2015].
Аналогичным образом, когда-то полагали, что «классическое» конверсионное расстройство (та самая «классическая истерия», красочно описанная ещё Жаном-Мартеном Шарко, с её типичными псевдоневрологическими симптомами, наподобие «истерических параличей и парезов», внезапных падений, истерической астазии-абазии, истерической слепоты или глухоты, истерических псевдосудорог) – ныне практически ушло в прошлое. Распространённость «классического» конверсионного расстройства в популяции в наше время оценивали как очень низкую – по разным данным, от 0,011% до 0,5% [Stefánsson JG et al, 1976; Stone J et al, 2005].
Однако более внимательный анализ сегодняшней эпидемиологической обстановки доказывает, что всё далеко не так радужно, и что «классическое» конверсионное расстройство с его типичными псевдоневрологическими симптомами не только никуда не исчезло, но и встречается гораздо чаще, чем было принято думать ранее. Так, в 2007 году группа турецких авторов доказала, что реальная распространённость конверсионного расстройства с псевдо-неврологическими симптомами в городской турецкой популяции составляет вовсе не 0,5%, а шокирующие 5,6% [Deveci A et al, 2007].
Несколькими группами авторов было отмечено, что от 30% до 60% пациентов, обращающихся к неврологам de novo, имеют хотя бы один медицински необъяснимый псевдоневрологический симптом предположительно конверсионного происхождения [Carson AJ et al, 2000; Nimnuan С et al, 2001; Snijders TJ et al, 2004].
Однако лишь очень малая часть (буквально единицы) этих пациентов, первично обратившихся к неврологам и получивших от невролога рекомендацию обратиться за консультацией, обследованием и лечением к психиатру и/или психотерапевту, – доходит в итоге до соответствующих специалистов и получает диагноз конверсионного или соматоформного расстройства. Тому есть множество причин – как общих для всех психических расстройств (страх перед стигматизацией в психиатрии, перед психотропным лечением и его ПЭ, недоверие к врачам, недостаточный уровень критики к своему состоянию, недостаточный уровень осознания болезни и необходимости лечения и т. д.), так и специфических именно для пациентов с конверсионными и соматоформными расстройствами (имманентно присущая этой болезни тенденция к подсознательному извлечению первичных и вторичных выгод из болезни и проистекающая отсюда низкая объективная заинтересованность пациента в лечении и в собственном выздоровлении, присущее многим из таких пациентов априорное представление о том, что врачи, якобы, недооценивают или обесценивают их страдания, серьёзность и тяжесть их заболевания, относятся к ним поверхностно и наплевательски, и т. д.) [Crimlisk HL et al, 2000].
По-видимому, именно фактор очень низкой обращаемости пациентов с соматоформными и конверсионными расстройствами к психиатрам и психотерапевтам, а не к неврологам или к другим соматическим врачам, создал у психиатров и психотерапевтов ложное впечатление о том, что «классическое» конверсионное расстройство с типичными для него псевдоневрологическими симптомами, будто бы, сегодня редко встречается. Между тем неврологи как видели множество таких пациентов каждый день во времена Шарко, так и продолжают видеть их каждый день в немалом количестве и сейчас [Crimlisk HL et al, 2000].
Весьма важно отметить также, что как соматоформные и конверсионные расстройства, так и маскированные или соматизированные депрессивные и тревожные расстройства, в целом, гораздо хуже поддаются лечению, чем «классические» формы депрессий и тревожных расстройств, не имеющие соматических масок. Все эти типы психических расстройств часто проявляют выраженную терапевтическую резистентность или же, наоборот, плохую переносимость ПФТ. К тому же часто эти типы психических расстройств бывают трудно отличимы друг от друга. Они также часто бывают коморбидны друг с другом и с ипохондрическим расстройством. Всё это создаёт дополнительные трудности и путаницу как в их диагностике и дифференциальной диагностике, так и в планировании их лечения и контроле хода лечения [Мазо ГЭ, Незнанов НГ, 2012; Быков ЮВ с соавт, 2013].
Это обстоятельство нередко вынуждает практических врачей, занимающихся лечением маскированных и соматизированных депрессивных и тревожных расстройств, а также соматоформных и конверсионных расстройств, выходить за пределы официально утверждённых протоколов, стандартов и пошаговых алгоритмов лечения, или за пределы официально рекомендованных дозовых диапазонов (в ме́ньшую сторону при плохой переносимости стандартных минимальных доз лекарств, или же в бо́льшую сторону при недостаточной эффективности, но хорошей переносимости стандартных максимальных доз лекарств), или же изобретать нестандартные лекарственные комбинации, которые со стороны могут показаться необоснованной полипрагмазией, если не знать, каким образом к такой схеме пришли в итоге [Мазо ГЭ, Незнанов НГ, 2012; Быков ЮВ с соавт, 2013].
В совокупности все эти обстоятельства – высокая распространённость соматоформных, соматизированных и конверсионных расстройств, а также ипохондрического расстройства, в сегодняшней человеческой популяции, их частая коморбидность как друг с другом, так и с депрессиями и тревожными расстройствами, расстройствами личности (РЛ), объективные большие трудности с диагностикой, дифференциальной диагностикой и лечением этой группы расстройств, частое проявление при них терапевтической резистентности или, наоборот, «отрицательной терапевтической резистентности» (интолерантности к ПФТ), большой полиморфизм их клинической картины – обуславливают особую актуальность темы нашей сегодняшней статьи.
Рецепторный профиль тразодона в контексте лечения расстройств с соматическими симптомами
Препарат тразодон – это атипичный антидепрессант (ААД), ранее уже дважды, в 2018 и 2021 годах, становившийся героем наших обзоров [Беккер РА, Быков ЮВ, 2018; 2021].
Первый из этих обзоров был посвящён тразодону в целом, второй – эффективности и безопасности применения тразодона в лечении нейропсихиатрических последствий постковидного синдрома. В обоих случаях мы подробно рассматривали вопрос о том, каким образом рецепторный профиль тразодона обуславливает те или иные его клинические свойства (например, как во второй статье – те его свойства, которые могут оказаться полезными при постковидном синдроме). Не изменим своей традиции мы и сейчас.
В 2020 году на постерной сессии, проходившей в рамках 33-го конгресса ECNP, компания Angelini Pharma (первооткрыватель и производитель тразодона) представила обновлённые данные о его рецепторном профиле. А в 2021 году эти обновлённые данные о рецепторном профиле тразодона были интегрированы как в обзор проф. Н. Н. Петровой, канд. мед. наук Ф. Ш. Шагиахметова и Р. Р. Борукаева, посвящённый применению тразодона по «неклассическим» показаниям (например, при хронических болевых синдромах, при акатизии или для торможения прогрессирования деменции), так и в наш собственный обзор о применении тразодона при постковидном синдроме [ECNP Poster Session, 2020; Петрова НН с соавт, 2021; Беккер РА, Быков ЮВ, 2021].
Обновлённые данные о рецепторном профиле тразодона схематически представлены нами на рисунке № 1 ниже [ECNP Poster Session, 2020].
В рамках настоящей статьи мы подробно остановимся только на тех рецепторных свойствах тразодона, которые имеют или могут иметь отношение к его потенциальной эффективности при расстройствах с соматическими симптомами. Итак, первое, на что мы бы хотели обратить внимание читателя в данном контексте, – это наличие у тразодона сильного, высокоаффинного антагонизма к α1B подтипу адренергических рецепторов (с Ki порядка 153 nM) [Cusack B et al, 1994; Owens MJ et al, 1997].
Уже при дозе тразодона 50 мг/сут процент оккупации α1B адренергических рецепторов составляет 88%, при дозе тразодона 100 мг/сут – 94%, а при дозе 150 мг/сут – 96%. Таким образом, α1B адреноблокада начинает играть клинически значимую роль в общем механизме действия тразодона, уже начиная с его дозы 50 мг/сут [Settimo L, Taylor D, 2018; Pyke RE, 2000].
Между тем хорошо известно, какую роль играет гиперсимпатикотония и гиперкатехоламинемия, чрезмерная стимуляция центральных и периферических α- и β-адренорецепторов – как в общих, системных механизмах этиопатогенеза тревожных и депрессивных расстройств, так и непосредственно в развитии целого ряда их типичных клинических симптомов и признаков. Так, гиперстимуляция β1 адренорецепторов миокарда обуславливает такие частые симптомы депрессии и тревожности, как тахикардия и экстрасистолы, гиперстимуляция β2 адренорецепторов печени обуславливает часто наблюдаемую при депрессиях и тревожных состояниях гипергликемию, а гиперстимуляция периферических α1 адренергических рецепторов обуславливает такие, например, симптомы, как бледность кожных покровов (вследствие спазма поверхностных сосудов кожи), холодные руки и ноги (вследствие спазма сосудов дистальных концов конечностей), сухость во рту (вследствие спазма сосудов слизистой оболочки полости рта и снижения секреции слюны), повышение артериального давления, дизурические симптомы (задержка мочи или, наоборот, учащённое мочеиспускание – нейрогенная дисфункция мочевого пузыря (НДМП) из-за спазма гладкой мускулатуры шейки мочевого пузыря и простаты), сексуальная дисфункция (из-за спазма сосудов половых органов и нарушения эрекции) [Stahl SM, 2013 (b)].
В полном соответствии с этими наблюдениями, как центральные α-адреноблокаторы (например, празозин, доксазозин, пророксан), так и липофильные (способные преодолевать гематоэнцефалический барьер (ГЭБ), и благодаря этому проникать в ЦНС) блокаторы β-адренорецепторов (например, пропранолол) – уже давно и успешно применяются в качестве противотревожных и вегетостабилизирующих средств в составе комплексного лечения самых разных тревожных расстройств, в том числе состояний соматизированной тревоги, в комплексном лечении панического расстройства (ПР), а также в комплексном лечении СВД [Жиляев АГ, 2016; Быков ЮВ, Беккер РА, 2017 (a), (b); Боброва ВИ, Демченко АВ, 2017; Чухловина МЛ, 2020; Шабанов ПД, 2020; Наумов КМ с соавт, 2020].
Так, в частности, α1 адреноблокаторы с центральным и периферическим действием празозин и доксазозин, изначально предназначавшиеся только для лечения артериальной гипертензии и для устранения задержки мочи (например, при гиперплазии простаты у мужчин), – на Западе активно используются off-label для лечения кошмаров и нарушений засыпания и поддержания сна при посттравматическом стрессовом расстройстве (ПТСР), для купирования острой стрессовой инсомнии и предотвращения развития ПТСР после перенесённой психической травмы, для уменьшения стресс-индуцированного влечения к алкоголю, а также в качестве адъювантных средств при фармакорезистентных тревожных расстройствах, или в качестве альтернативы бензодиазепинам и β-адреноблокаторам у пациентов с миастенией и тревожными либо диссомническими состояниями, которым нельзя бензодиазепины и β-адреноблокаторы из-за риска усиления мышечной слабости [Skelly MJ, Weiner JL, 2014; Ammar G et al, 2015; Lipinska G et al, 2016; Back SE et al, 2018; Jordan H, Ortiz N, 2019].
В этом контексте важно отметить также, что наличие у того или иного психотропного препарата, будь то АП или АД, выраженных α1 адреноблокирующих свойств – ранее считалось безусловно негативным его рецепторным свойством, от которого желательно было бы избавиться при разработке более новых препаратов аналогичного класса, так как именно это рецепторное свойство (α1 адреноблокада) обуславливает такие частые нежелательные побочные эффекты (ПЭ) от применения некоторых психотропных средств, как ортостатическая гипотензия и тахикардия, и может также вносить свой вклад в развитие сонливости и седации при их применении [Stahl SM, 2013 (b)].
Сообразно этому, усилия химиков-фармакологов всего мира долгое время были направлены на синтез всё более и более рецепторно селективных психотропных препаратов, по возможности максимально лишённых α1 адреноблокирующих, H1 гистаминоблокирующих и других считавшихся «однозначно нежелательными» рецепторных свойств (то есть препаратов, более высокопотентных и селективных по отношению к D2 дофаминовым рецепторам в случае АП, или более высокопотентных и селективных по отношению к белкам-транспортёрам серотонина и/или норадреналина (SERT и/или NET) – в случае АД) [Stahl SM, 2013 (a), (b)].
Однако в последнее время к специалистам постепенно стало приходить осознание того, что «не всё так просто и однозначно» с α1 адренорецепторами и их подтипами, и что наличие у того или иного психотропного препарата сильной α1 адреноблокирующей активности – имеет не только очевидные недостатки (повышенный риск развития ортостатической гипотензии и тахикардии при его применении, по сравнению с препаратами с меньшей аффинностью к α1 адренорецепторам), но и целый ряд плюсов [Stahl SM, 2013 (a), (b)].
Так, в частности, кроме уже упоминавшегося нами выше положительного влияния α1 адреноблокады на уровень тревожности, на качество и фазовую структуру сна, на устранение ночных кошмаров, на соматовегетативную стабилизацию – показано также, что именно сильная α1 адреноблокирующая активность нового ААП илоперидона – частично объясняет (точнее, вносит свой вклад) в то, что илоперидон вызывает очень мало проявлений экстрапирамидного синдрома (ЭПС) и акатизии, за счёт того, что блокада α1 адренорецепторов префронтальной коры косвенно приводит к увеличению выделения дофамина в нигростриарной системе [Stahl SM, 2013 (a), (b)].
На этом основании некоторые авторы даже предложили попробовать применять илоперидон, как препарат с наибольшей среди всех известных на сегодняшний день АП аффинностью к α1 адренорецепторам, – для лечения ПТСР, по аналогии с уже упоминавшимися празозином и доксазозином [Shuman MD, Mcgrane IR, 2014].
Безусловно, всё сказанное нами выше о положительном вкладе сильного α1B антагонизма в общую противотревожную, вегетостабилизирующую и седативную активность, в способность нормализовывать сон и его фазовую структуру, в эффективность при ПТСР, в способность уменьшать акатизию – в полной мере относится и к тразодону [Stahl SM, 2013 (b); Петрова НН с соавт, 2021].
Второе рецепторное свойство тразодона, которое представляется нам важным в контексте его применения для лечения соматоформных расстройств, – это наличие у него сильной парциальной 5-HT1A агонистической активности (с Ki, по разным данным, в диапазоне от 96 до 118 nM, и притом с большей внутренней агонистической активностью, чем у буспирона и тандоспирона) [Raffa RB et al, 1992; Cusack B et al, 1994; Owens MJ et al, 1997; Odagaki Y et al, 2005].
Показано, что уже в дозе 50 мг/сут тразодон занимает 91% доступных 5-HT1A серотониновых рецепторов, в дозе 100 мг/сут – 95%, а в дозе 150 мг/сут – 97% [Stahl SM, 2009; Jaffer KY et al, 2017].
Между тем о роли парциального 5-HT1A агонизма у таких препаратов, как небензодиазепиновые анксиолитики буспирон и тандоспирон, некоторые ААП, например арипипразол или карипразин, некоторые АД, такие как тразодон, вилазодон или вортиоксетин – в общем механизме их антидепрессивного и анксиолитического действия, а также о той роли, которую играет парциальный 5-HT1A агонизм в «атипичности» вышеупомянутых и некоторых других ААП, в уменьшении частоты вызывания ими ЭПС и акатизии, в усилении их антинегативного и прокогнитивного действия за счёт косвенного усиления высвобождения дофамина в префронтальной коре – уже давно и хорошо известно [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Не менее хорошо сегодня известно и то, что косвенная стимуляция именно 5-HT1A подтипа серотониновых рецепторов за счёт увеличения содержания серотонина в синаптической щели, и последующая десенситизация пресинаптических ауторегуляторных 5-HT1A рецепторов – критически необходима для реализации антидепрессивного и анксиолитического эффекта вообще любых известных на сегодня классов моноаминергических АД, будь то селективные ингибиторы обратного захвата серотонина (СИОЗС), селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСиН), трициклические антидепрессанты (ТЦА) или же ингибиторы моноаминоксидазы (ИМАО) [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Однако, поскольку данная наша статья посвящена психосоматическим расстройствам и применению при них тразодона, то мы бы хотели здесь сосредоточиться на рассмотрении соматотропных и вегетотропных эффектов стимуляции 5-HT1A серотониновых рецепторов, а не на их хорошо известном вкладе в антидепрессивную и анксиолитическую эффективность тразодона [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Итак, показано, что 5-HT1A серотониновые рецепторы в ростральной вентролатеральной части ствола мозга и спинного мозга – принимают активное участие в регуляции артериального давления и частоты сердечных сокращений (ЧСС), а также в регуляции общего симпато-адреналового тонуса и, в частности, тонуса сосудов. Стимуляция 5-HT1A серотониновых рецепторов в этих областях мозга оказывает косвенное симпатолитическое и вегетостабилизирующее действие, снижает артериальное давление и ЧСС, способствует расширению сосудов, снижению выброса катехоламинов мозговым слоем надпочечников и симпатическими ганглиями брюшной полости [Dabiré H, 1991].
Показано, в частности, что центральный парциальный 5-HT1A агонизм, наряду с α1-адреноблокирующими свойствами, играет важную роль в общем механизме гипотензивного действия такого α1-адреноблокатора, как урапидил [Kolassa N et al, 1989; Ramage AG, 1991].
Эти же рецепторные свойства, наряду с β-адреноблокирующими свойствами, играют важную роль в общем механизме гипотензивного, брадикардического и вегетостабилизирующего действия такого β-адреноблокатора, как пиндолол [Clifford EM et al, 1998; Newman-Tancredi A et al, 1998].
Кроме того, стимуляция 5-HT1A серотониновых рецепторов ростральной части ядер шва, вызывая расширение кожных сосудов и увеличение теплоотдачи с поверхности кожи и одновременно угнетая активность центра терморегуляции гипоталамуса и теплопродукцию, – способствует снижению температуры тела, купирует озноб (шиверинг) и холодовой тремор [Ootsuka Y, Blessing WW, 2006; Rusyniak DE et al, 2007].
Стимуляция 5-HT1A серотониновых рецепторов ядер шва, косвенно модулируя активность постсинаптических α2-адренорецепторов ядра Эдингера-Вестфаля, эффективно устраняет также другой частый симптом гиперсимпатикотонии и тревожности, нередко беспокоящий пациентов с косметической точки зрения, – а именно мидриаз [Fanciullacci M et al, 1995].
На функцию внешнего дыхания стимуляция центральных 5-HT1A серотониновых рецепторов оказывает интересное двоякое действие – с одной стороны, она эффективно устраняет центральную нейрогенную гипервентиляцию, снижает патологически повышенную при тревоге, стрессе возбудимость парабрахиального ядра гипоталамуса, а с другой – уменьшает вызванное опиоидами угнетение дыхания [Meyer LR et al, 2006].
Интерес в контексте психосоматических расстройств, часто сопровождающихся психогенной тошнотой и рвотой на фоне тревоги, представляет также то, что 5-HT1A серотониновые рецепторы в рвотном центре колокализованы с нейрокининовыми NK1 рецепторами, и что их стимуляция (буспироном, тандоспироном, тразодоном) – оказывает противорвотное действие [Lucot JB, 1994; Oshima T et al, 2002; Kranke P et al, 2012].
Противорвотное действие тразодона, наряду с прочими его свойствами, полезными в анестезиологии (его седативной, анксиолитической, анальгетической и вегетостабилизирующей активностями), – настолько существенно, что даже позволяет использовать его в качестве премедикации перед хирургическими операциями, чреватыми тошнотой и рвотой [Bonazzi M et al, 1994; Murphy LA et al, 2017].
Таким образом, косвенное, непрямое симпатолитическое и вегетостабилизирующее действие тразодона, реализующееся через его парциальный агонизм к 5-HT1A подтипу серотониновых рецепторов в определённых зонах мозга, – выгодно дополняет и усиливает его прямое α-адренолитическое и вегетостабилизирующее действие, которое реализуется через блокаду центральных и периферических α1B адренорецепторов. А с учётом того, как часто встречаются при психосоматических расстройствах такие симптомы гиперсимпатикотонии и тревожности, как тахикардия, экстрасистолы, колебания артериального давления с тенденцией к его повышению, спазм сосудов кожи (бледность кожных покровов, холодные руки и ноги, субфебрильная температура тела, термоневроз), мидриаз, гипервентиляция и тахипноэ, тошнота и рвота, – вполне очевидно, что прямое и косвенное вегетостабилизирующее, гипотензивное, гипотермическое, противорвотное, прямое адрено- и косвенное симпатолитическое действие тразодона, реализующееся отчасти через его парциальный агонизм к центральным 5-HT1A серотониновым рецепторам, отчасти через блокаду им центральных и периферических α1B адренорецепторов, – вносит важный вклад в его общую клиническую эффективность при этих расстройствах [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
В контексте лечения соматоформного болевого синдрома важно также наличие у тразодона выраженного анальгетического действия, которое, опять-таки, реализуется в первую очередь через его парциальный агонизм к 5-HT1A подтипу серотониновых рецепторов, через косвенную активацию им эндогенной опиоидной системы и (при дозах 300 мг/сут и выше) – также через его антагонизм к 5-HT7 подтипу серотониновых рецепторов [ECNP Poster Session, 2020; Петрова НН с соавт, 2021; Беккер РА, Быков ЮВ, 2021].
В контексте лечения тразодоном соматоформных расстройств важно подчеркнуть, что, хотя анксиолитическое и антидепрессивное действие парциального 5-HT1A агонизма у тразодона, как и у любых других парциальных 5-HT1A агонистов (буспирон, тандоспирон) и у всех прочих моноаминергических АД, косвенно стимулирующих этот подтип серотониновых рецепторов, развёртывается постепенно, в течение нескольких недель его постоянного приёма (и в эти же сроки, как и в случае с буспироном или с другими АД, становится очевидным «вторичное» вегетостабилизирующее действие тразодона, связанное с редукцией тревожности и депрессии), но прямые, непосредственные положительные вегетотропные и соматотропные эффекты стимуляции 5-HT1A рецепторов, такие как снижение артериального давления, уменьшение мидриаза, гипервентиляции, озноба, тремора, противорвотное действие, редукция болевого синдрома, – могут быть очевидны уже вскоре после приёма первых его доз [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Третье рецепторное свойство тразодона, которое представляется нам важным в контексте применения его для лечения соматоформных и психосоматических расстройств, – это его сильный, высокоаффинный антагонизм (точнее, инверсный агонизм) к 5-HT2A подтипу серотониновых рецепторов (с Ki в диапазоне 20-45 nM, по разным данным) и умеренный антагонизм к 5-HT2C подтипу их (с Ki в диапазоне 224-402 nM, по разным данным) [Cusack B et al, 1994; Tatsumi M et al, 1997; Owens MJ et al, 1997].
Показано, что в первую очередь именно сильным инверсным агонизмом тразодона к 5-HT2A подтипу серотониновых рецепторов обуславливается его выраженное снотворно-седативное и быстро наступающее неспецифическое анксиолитическое действие, которое становится клинически заметным уже начиная с дозы тразодона 25 мг/сут. Этим тразодон отличается от многих других психотропных препаратов, тоже сочетающих в своём рецепторном профиле H1 гистаминоблокирующее действие и способность блокировать 5-HT2A подтип серотониновых рецепторов, и тоже традиционно применяемых off-label в малых дозах для нормализации сна – таких, как миртазапин, кветиапин, миансерин, доксепин, хлорпротиксен, амитриптилин, гидроксизин и др. [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
У всех упомянутых альтернативных препаратов при малых (снотворно-седативных) их дозах на первый план в рецепторном профиле выступает H1 гистаминовая блокада, а не блокада 5-HT2A подтипа серотониновых рецепторов, хотя соотношение этих эффектов в каждом отдельном случае разное [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Аффинность тразодона к 5-HT2A подтипу серотониновых рецепторов настолько велика, что уже в клинически не релевантной дозе – всего 1 мг/сут – он занимает более 50% от всех доступных 5-HT2A серотониновых рецепторов мозга, а уже в дозе всего 10 мг/сут занятость 5-HT2A серотониновых рецепторов близка к насыщению. При дозе 50 мг/сут процент оккупации 5-HT2A рецепторов тразодоном составляет 97%, при дозе 100 мг/сут – 98%, а при дозе 150 мг/сут – 99% [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Несмотря на сравнительно низкую (Ki от 224 до 402 nM) аффинность к 5-HT2C подтипу серотониновых рецепторов in vitro [Cusack B et al, 1994; Tatsumi M et al, 1997; Owens MJ et al, 1997], показано, что in vivo тразодон уже при дозе 100 мг/сут занимает 91% доступных 5-HT2C серотониновых рецепторов, а при дозе 150 мг/сут – 94% [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
В полном соответствии с этим, показано, что процент занятости H1 гистаминовых рецепторов ЦНС при малых дозах тразодона сравнительно невысокий – при дозе тразодона 50 мг/сут он составляет всего 84%. И только при дозах тразодона 100-150 мг/сут и выше процент занятости H1 гистаминовых рецепторов ЦНС становится выше клинически значимого порога в 90% (он составляет 91% при дозе 100 мг/сут, 94% при дозе 150 мг/сут) [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Блокада тразодоном гистаминовых H1 и серотониновых 5-HT2A и 5-HT2C рецепторов кожи, наряду с центральной их блокадой, обеспечивающей седацию и анксиолизис, – обуславливает его выраженное противозудное действие и его эффективность при психогенном кожном зуде [Belinskaia DA et al, 2019].
Хорошо известно, что блокада 5-HT2A подтипа серотониновых рецепторов ЦНС, косвенно повышая содержание дофамина в мезокортикальной, нигростриарной и тубероинфундибулярной системах мозга – вносит свой вклад в «атипичность» многих ААП и способствует уменьшению вызываемых блокадой D2 дофаминовых рецепторов в этих путях симптомов ЭПС и акатизии, гиперпролактинемии, вторичной негативной симптоматики, сексуальных нарушений, попутно уменьшая тревожность. Известно также и то, что блокада 5-HT2C подтипа серотониновых рецепторов повышает содержание ряда моноаминов в префронтальной коре, и оказывает антидепрессивное, противотревожное и прокогнитивное действие [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Отсюда видно, что сильные 5-HT2A и умеренные 5-HT2C блокирующие свойства тразодона, наряду с уже упоминавшимся нами ранее его сильным парциальным 5-HT1A агонизмом, – тоже вносят значительный вклад в такие его клинически наблюдаемые эффекты, как антидепрессивный, прокогнитивный, противотревожный, а также в его способность уменьшать проявления ЭПС и акатизии при применении АП, оказывать антинегативное действие [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Также хорошо известно, что неизбирательная стимуляция разных подтипов серотониновых рецепторов ответственна за многие ПЭ первых дней терапии АД из групп СИОЗС и СИОЗСиН – а именно такие их типичные ПЭ, как тошнота, рвота, анорексия, аноргазмия, задержка эякуляции, снижение либидо, нарушения сна, головные боли. И что наличие у того или иного АД способности блокировать 5-HT2A и/или 5-HT2C подтипы серотониновых рецепторов и/или парциального агонизма к 5-HT1A подтипу серотониновых рецепторов, косвенно ограничивающего избыточное высвобождение серотонина, – способствует уменьшению частоты развития подобных ПЭ в начале терапии данным АД. Это справедливо и для миртазапина, и для миансерина, и для тразодона, и для новейших мультимодальных АД вортиоксетина, вилазодона [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Однако нас, в контексте лечения тразодоном именно психосоматических расстройств, особенно интересуют прямые соматотропные и вегетотропные эффекты блокады тразодоном 5-HT2A и 5-HT2C подтипов серотониновых рецепторов. И здесь тоже имеется немало интересных фактов. Во-первых, показано, что стимуляция центральных и периферических 5-HT2A серотониновых рецепторов (будь то прямая их стимуляция экзогенным агонистом, как в случае приёма диэтиламида лизергиновой кислоты (ЛСД) или 2,5-диметокси-4-бромоамфетамина (ДОБ), или же косвенная их стимуляция за счёт усиления выброса эндогенного агониста – серотонина, как это имеет место быть на фоне приёма такого релизера серотонина, как 3,4-метилендиокси-N-метамфетамин (МДМА), или же на фоне тревоги, страха, стресса, на фоне ПА) – в значительной степени ответственна за такие типичные симптомы тревоги, страха, стресса или ПА (они же – типичные симптомы интоксикации данными серотонинергическими психоактивными веществами (ПАВ)), как стрессовая гипертермия, тахикардия, экстрасистолы, артериальная гипертензия, вазоконстрикция (бледность кожных покровов, холодные руки и ноги, сухость во рту), стрессовая диарея [Centurión D et al, 2002; Kaumann AJ, Levy FO, 2006; Sinh S, Ootsuka Y, 2019].
Также показано, что именно стимуляция центральных и периферических 5-HT2A серотониновых рецепторов, наряду с прямой или косвенной активацией симпато-адреналовой системы, ответственна за значительную часть сердечно-сосудистых катастроф (острых инфарктов миокарда, инсультов), случающихся при употреблении данных ПАВ или на фоне острого стресса [Centurión D et al, 2002; Kaumann AJ, Levy FO, 2006; Sinh S, Ootsuka Y, 2019].
И наоборот, показано, что блокада центральных и периферических 5-HT2A серотониновых рецепторов – оказывает гипотензивное, сосудорасширяющее, кардио- и ангиопротективное, вегетостабилизирующее, антиаритмическое, антитромботическое действие, способствует снижению температуры тела. Показано также, что центральные и периферические 5-HT2A блокирующие свойства, наряду с α1 адренергической блокадой, – играют важную роль в общем механизме гипотензивного, вегетостабилизирующего и сосудорасширяющего действия таких α1 адреноблокаторов, как кетансерин и феноксибензамин [Pazos A et al, 1987; Doggrell SA, 1995; Centurión D et al, 2002; Kaumann AJ, Levy FO, 2006; Elbers PG et al, 2009; Sinh S, Ootsuka Y, 2019].
Таким образом, здесь мы видим, что сильные центральные и периферические 5-HT2A блокирующие свойства тразодона – дополнительно усиливают опосредованную его центральной и периферической α1B адренергической блокадой, а также центральным парциальным 5-HT1A агонизмом вегетостабилизирующую, гипотензивную, сосудорасширяющую и гипотермическую активность этого препарата, независимо от редукции им тревоги (то есть вносят свой вклад в его прямое соматотропное и вегетотропное действие) [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Кроме того, показано вовлечение центральных и периферических 5-HT2A и 5-HT2C серотониновых рецепторов также в патогенез хронических болевых синдромов. Показано, что блокада этих подтипов серотониновых рецепторов способствует редукции боли [Grégoire S, Neugebauer V, 2013; Xu WJ et al, 2020].
Таким образом, можно утверждать, что способность тразодона сильно блокировать центральные и периферические 5-HT2A и 5-HT2C серотониновые рецепторы, наряду с его сильным парциальным агонизмом к 5-HT1A подтипу серотониновых рецепторов и (становящимся клинически значимым при высоких дозах, выше 300 мг/сут) его умеренным антагонизмом к 5-HT7 серотониновым рецепторам, – тоже вносит свой вклад в его общий анальгетический эффект и, в частности, в его эффективность при соматоформных болевых расстройствах [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Завершая рассмотрение рецепторных свойств тразодона, имеющих отношение к его эффективности при соматоформных и психосоматических расстройствах, нельзя не упомянуть тот факт, что тразодон, в отличие от СИОЗС и СИОЗСиН, обладает сравнительно низкой аффинностью к белку-транспортёру серотонина (SERT) – по разным данным, его Ki к этому белку лежит в диапазоне от 160 nM до 1000 nM [Cusack B et al, 1994; Tatsumi M et al, 1997; Owens MJ et al, 1997].
Сообразно этому, связывание тразодона с белком SERT становится клинически значимым и начинает играть существенную роль в общем механизме его антидепрессивного и анксиолитического действия только при его высоких дозах. При дозе тразодона 100 мг/сут процент занятости SERT составляет около 86% (значительно меньше, чем процент занятости 5-HT1A, 5-HT2A и даже 5-HT2C серотониновых рецепторов на этой же дозе), и только при дозе 150 мг/сут – достигает порога клинической значимости в 90% [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Сочетание сравнительно низкой аффинности тразодона к белку SERT с его сильным и высокоаффинным парциальным агонизмом к 5-HT1A подтипу серотониновых рецепторов, сильным и высокоаффинным инверсным агонизмом к 5-HT2A подтипу серотониновых рецепторов и с умеренным его антагонизмом к 5-HT2C подтипу этих рецепторов – в сумме обуславливает редкость возникновения при терапии им таких типичных «серотониновых» – и очень плохо переносимых и воспринимаемых именно психосоматическими пациентами – ПЭ первых дней терапии многими другими АД (СИОЗС, СИОЗСиН, ТЦА…), как тошнота, рвота, анорексия, аноргазмия, задержка эякуляции, снижение либидо, нарушения сна, головные боли. Напротив, благодаря именно этим особенностям своего рецепторного профиля, тразодон склонен с первых дней терапии давать выраженный анксиолитический эффект, нормализовывать сон и его фазовую структуру, улучшать либидо и сексуальную функцию, уменьшать тошноту и анорексию, не вызывая в то же время повышения аппетита и прибавки массы тела [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Сопоставление тразодона с некоторыми другими препаратами, применяемыми в качестве «дневных седатиков», анксиолитиков и вегетативных стабилизаторов
Для того, чтобы мы могли объективно ответить на вопрос «почему вообще стоит рассматривать целесообразность применения для лечения соматоформных расстройств именно тразодона?», важно провести сопоставление спектра фармакологической активности и спектра ПЭ тразодона с таковыми показателями у ряда альтернативных препаратов, которые в России и странах СНГ традиционно имеют широкое применение в качестве «дневных седатиков», анксиолитиков и вегетативных стабилизаторов.
В этом качестве в России и в странах СНГ, помимо тразодона, применяют, с различной частотой и разной степенью успешности, несколько классов препаратов:
1) ГАМКергические препараты (бензодиазепины, прегабалин, габапентин, фенибут) [Монтгомери СА, 2010; Беккер РА, Быков ЮВ, 2017];
2) Так называемые «небензодиазепиновые анксиолитики», например, буспирон, гидроксизин, этифоксин и др. [Морозов ПВ, Никитин ЗА, 2009];
3) Липофильные (способные преодолевать ГЭБ) β-адреноблокаторы, например, пропранолол, бисопролол, метопролол [Stahl SM, 2013 (b); Sadock BJ et al, 2017];
4) Центральные α-адреноблокаторы (пророксан, доксазозин) [Боброва ВИ, Демченко АВ, 2017];
5) Малые дозы некоторых АП, которые обладают выраженным «дневным» седативным, быстро наступающим неспецифическим анксиолитическим и/или вегетостабилизирующим действием, например, малые дозы хлорпротиксена, тиоридазина, алимемазина, перициазина, сульпирида; в последнее время на эту же рыночную нишу нацеливаются также малые дозы кветиапина (12,5-25-50 мг до 2-3 раз в сутки), и даже малые дозы оланзапина (1,25-2,5-5 мг/сут) [Быков ЮВ, Беккер РА, 2016; 2017; Беккер РА, Быков ЮВ, 2016; 2018];
6) Малые дозы некоторых АД, которые обладают выраженным «дневным» седативным, быстро наступающим неспецифическим анксиолитическим и/или вегетостабилизирующим действием, например малые дозы амитриптилина, миртазапина, миансерина [Stahl SM, 2013 (b); Беккер РА, Быков ЮВ, 2019].
Итак, рассмотрим поподробнее каждый из этих классов препаратов, в сопоставлении с тразодоном. Все упомянутые ГАМКергические препараты (бензодиазепины, прегабалин, габапентин, фенибут) – безусловно, высокоэффективны как в подавлении тревоги, так и в устранении сопутствующих ей соматовегетативных нарушений. Однако все они имеют два существенных недостатка – риск нарастания толерантности к их анксиолитическому и вегетостабилизирующему действию и, соответственно, риск снижения их эффективности при их длительном приёме, а также риск развития патологического привыкания и пристрастия, лекарственной зависимости при длительном лечении ими. Это ограничивает сроки их возможного эффективного применения – несколькими неделями. Кроме того, бензодиазепины и габапентиноиды нельзя применять у пациентов с миастенией из-за риска усиления мышечной слабости [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
В то же время тразодон, в отличие от всех упомянутых препаратов ГАМКергического действия, не ассоциируется с феноменом роста толерантности или с необходимостью повышения дозы со временем, не имеет риска развития патологического привыкания и пристрастия, лекарственной зависимости. Он может при необходимости применяться длительно, даже пожизненно, и не имеет противопоказаний у пациентов с миастенией [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Липофильные β-адреноблокаторы имеют весьма ограниченную эффективность при тревожных расстройствах и сопутствующих тревоге соматовегетативных нарушениях. В основном они оказываются эффективны при так называемой performance anxiety, а также (обычно – вместе с бензодиазепинами) при купировании ПА или при устранении акатизии. Кроме того, длительное применение β-адреноблокаторов ассоциируется с целым рядом неприятных ПЭ, таких как снижение либидо у обоих полов, нарушение эрекции у мужчин, периферическая вазоконстрикция (холодные руки и ноги), нарушения сна, ночные кошмары. Иногда при их длительном приёме наблюдается депрессогенный эффект [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Центральные α-адреноблокаторы (празозин, доксазозин, пророксан) – тоже имеют, на самом деле, достаточно ограниченную эффективность как в лечении тревожных расстройств, так и в устранении сопутствующих тревоге соматовегетативных нарушений. Их эффективность в настоящее время строго научно доказана только в отношении устранения кошмаров при ПТСР, а также в уменьшении стресс-индуцированного влечения к спиртному. Кроме того, применение центральных α-адреноблокаторов тоже ассоциируется с рядом проблематичных ПЭ, таких как снижение либидо у обоих полов, нарушение эрекции у мужчин из-за перераспределения крови (изредка, наоборот, наблюдается приапизм), периферические отёки, ортостатическая гипотензия, тахикардия. Иногда при длительном приёме центральных α-адреноблокаторов, так же как и при длительном приёме липофильных β-блокаторов, – наблюдается депрессогенный эффект [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Все эти типичные ПЭ центральных α-адреноблокаторов особенно проблематичны именно в психиатрии, по той причине, что дозы празозина или доксазозина, необходимые для достижения терапевтического эффекта при ПТСР и других тревожных расстройствах, – как правило, оказываются значительно выше, чем дозы этих же препаратов, обычно применяемые при лечении артериальной гипертензии или задержки мочеиспускания [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
В противоположность как центральным α-адреноблокаторам, так и липофильным β-адреноблокаторам, тразодон обладает широким спектром анксиолитической и вегето-стабилизирующей активности. Он эффективен при самых разных тревожных и соматовегетативных расстройствах. Это обусловлено гораздо большей, по сравнению с обоими этими классами препаратов, широтой спектра нейрохимического действия тразодона. В отличие от них, тразодон влияет не только на α-адренорецепторы, но также и на 5-HT1A, 5-HT1D, 5-HT2A, 5-HT2C и, в некоторой степени, также на 5-HT7 серотониновые рецепторы, на H1 гистаминовые рецепторы и на обратный захват серотонина. В противоположность обеим этим подгруппам селективных блокаторов адренорецепторов, тразодон не только не обладает депрессогенными свойствами, не нарушает сон, не снижает либидо и не ухудшает половую функцию – но, напротив, оказывает выраженное антидепрессивное действие, нормализует сон и его фазовую структуру, улучшает либидо и эректильную функцию [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Если же рассматривать применение в качестве «дневных седатиков», анксиолитиков и вегетативных стабилизаторов малых доз таких АП, как хлорпротиксен, алимемазин, тиоридазин, перициазин, кветиапин или оланзапин, в сопоставлении с применением тразодона для этих же целей – то обращает на себя внимание то, что, хотя у всех этих препаратов, так же как и у тразодона, в рецепторном профиле имеется то или иное сочетание блокады α-адренорецепторов, H1 гистаминовых рецепторов, блокады 5-HT2A и, иногда, также 5-НТ2С и/или 5-HT7 подтипов серотониновых рецепторов, и что некоторые из этих препаратов, так же как и тразодон, имеют свойства парциальных агонистов 5-HT1A подтипа серотониновых рецепторов – но у них всех, в отличие от тразодона, при малых их дозах выступает на первый план вовсе не 5-HT2A серотонинергическая блокада и не их парциальный агонизм к 5-HT1A серотониновым рецепторам, а H1 гистаминовая блокада. Это связано с различиями в их аффинностях к данным подтипам рецепторов [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Это различие в профилях связывания тразодона и вышеупомянутых седативных АП с разными подтипами рецепторов при малых их дозах – даёт нам основания утверждать, что все вышеуказанные препараты, в отличие от тразодона, при малых дозах дают значительно больше нежелательной дневной седации и сонливости, чем истинного противотревожного и вегетостабилизирующего эффекта. Грубо говоря, лечить тревожность и вегетативные нарушения алимемазином или тиоридазином, хлорпротиксеном или пусть даже современным кветиапином – не намного эффективнее, чем лечить эти же расстройства такими седативными антигистаминами, как дифенгидрамин, прометазин или хлоропирамин [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Это же замечание – о значительно большей вероятности получения выраженной дневной седации и сонливости, чем вероятность достижения истинного противотревожного и вегетостабилизирующего эффекта при лечении им, – справедливо и для такого седативного антигистамина, традиционно позиционируемого в качестве «небензодиазепинового анксиолитика», как гидроксизин. Для него H1 гистаминоблокирующая активность является основной
(Ki этого препарата к H1 гистаминовому рецептору лежит в диапазоне от 2,0 до 19 nM), тогда как 5-HT2A блокирующая и α1 адреноблокирующая активности в его рецепторном профиле играют второстепенную роль (его Ki к этим рецепторам, соответственно, 170 и 460 nM) [Snowman AM, Snyder SH, 1990].
Кроме того, у всех вышеупомянутых седативных АП (в большей степени – у таких из них, как перициазин, оланзапин, хлорпротиксен, в сравнительно меньшей – у таких, как тиоридазин, алимемазин, кветиапин), а также у часто применяемого с анксиолитической и вегетостабилизирующей целью «неседативного», дофамин-селективного АП сульпирида, и даже у вышеупомянутых гидроксизина, буспирона, формально не относящихся к классу АП, – имеется в той или иной степени выраженное блокирующее действие на D2 подтип дофаминергических рецепторов. А это рецепторное свойство – совершенно не нужно, нежелательно и даже вредно в «малой психиатрии». Именно оно обуславливает не только вероятность развития при лечении данными препаратами гиперпролактинемии, острых дискинезий, острой акатизии или лекарственного паркинсонизма (более высокую при использовании более высокопотентных по D2 рецептору препаратов, таких как перициазин, оланзапин или хлорпротиксен, но ненулевую даже для буспирона и гидроксизина, которые формально не относятся к группе АП) [Ritchie EC et al, 1988; Patterson JF, 1988; Esen I et al, 2008; Stahl SM, 2013 (b); Sadock BJ et al, 2017], но и гораздо более проблематичную вероятность развития при длительном лечении ими необратимых поздних дискинезий – в том числе и у пациентов, не проявлявших признаков острых экстрапирамидных нарушений в процессе лечения данными препаратами. Этот риск, согласно данным литературы, отнюдь не равен нулю даже при длительном применении гидроксизина или буспирона, не говоря уже о таковом риске при длительном применении препаратов из группы АП [Clark BG et al, 1982; LeWitt PA et al, 1993; Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Риск развития как острых, так и поздних, отсроченных экстрапирамидных нарушений, естественно, влияет не только на «сиюминутную» переносимость вышеупомянутых «малых АП», а также гидроксизина и буспирона, но и ограничивает возможность и целесообразность их длительного применения в качестве «дневных седатиков», анксиолитиков и вегетативных стабилизаторов. В противоположность им, тразодон полностью лишён даже слабого блокирующего действия на D2 подтип дофаминовых рецепторов. Он не ассоциируется с риском развития поздних дискинезий, и может применяться длительно, при необходимости – даже пожизненно [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Кроме того, все вышеупомянутые «седативные АП», традиционно применяемые в РФ в качестве вегетативных стабилизаторов и анксиолитиков (будь то хлорпротиксен, тиоридазин, перициазин, или более новые кветиапин и оланзапин), а также ряд вышеупомянутых «седативных АД», тоже применяемых в РФ в малых дозах с этой целью (прежде всего, конечно, амитриптилин, но также миртазапин, миансерин и гидроксизин), – в той или иной степени обладают М-холиноблокирующими свойствами. А это означает риск развития при лечении ими таких нежелательных ПЭ, как сухость во рту, запоры, задержка мочеиспускания, мидриаз, парез аккомодации глаз, тахикардия, сексуальные нарушения, нарушения памяти и когнитивных функций, кошмарные сновидения. В противоположность этим препаратам, тразодон полностью лишён сколько-нибудь значимого М-холиноблокирующего действия (его Ki к любым подтипам М-холинорецепторов превышает 10 000 nM). Это тоже важно для сопоставления и оценки переносимости тразодона при соматоформных расстройствах в сравнении с вышеупомянутыми альтернативами [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Ещё одно важное отличие в переносимости состоит в том, что у таких препаратов, как миртазапин, миансерин, амитриптилин, гидроксизин или как все упомянутые ранее АП, имеется также риск нежелательного повышения аппетита, прибавки массы тела, развития ожирения и метаболических нарушений (гиперхолестеринемии, дислипидемии, нарушения толерантности к глюкозе и даже сахарного диабета 2-го типа) при их длительном применении в качестве «дневных седатиков», анксиолитиков и вегетативных стабилизаторов [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
В то же время тразодон такими свойствами не обладает – он, как правило, нейтрален в отношении влияния на аппетит, массу тела и метаболические параметры [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
В отличие от этифоксина, тразодон не обладает клинически значимой гепатотоксичностью, имеет низкий риск возникновения кожных аллергических реакций, и не имеет ограничения в инструкции на длительное (свыше 2 месяцев) применение [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Сопоставление тразодона с некоторыми другими препаратами, применяемыми в качестве «ночных седатиков» (снотворных средств)
Поскольку при различных соматоформных и соматизированных расстройствах, включая СВД, соматоформные болевые расстройства, соматизированные депрессии, соматизированные тревожные состояния и др., часто наблюдается инсомния, вторичная по отношению к тревоге, депрессии, болевому синдрому или соматовегетативным нарушениям, то в этом контексте представляет большой интерес также сопоставление тразодона с некоторыми другими препаратами, традиционно применяемыми для нормализации сна.
Итак, в качестве «ночных седатиков» (снотворных средств) в России и странах СНГ тоже традиционно имеют широкое применение несколько классов препаратов. Их список частично пересекается с обсуждавшимися нами разделом выше классами препаратов, которые традиционно имеют в России и странах СНГ широкое применение в качестве «дневных седатиков, анксиолитиков и вегетативных стабилизаторов»:
1) ГАМКергические препараты (бензодиазепины, Z-лекарства, прегабалин, габапентин, фенибут) [Монтгомери СА, 2010; Беккер РА, Быков ЮВ, 2017];
2) Малые дозы некоторых АП, обладающих выраженным снотворно-седативным действием, например малые дозы хлорпротиксена, тиоридазина, алимемазина, перициазина, а в последнее время – также малые дозы кветиапина или оланзапина, изредка (в основном при инсомнии в рамках тяжёлых психических расстройств, то есть – обычно за пределами так называемой «малой психиатрии») – малые дозы хлорпромазина, промазина, левомепромазина или клозапина [Быков ЮВ, Беккер РА, 2016; 2017; Беккер РА, Быков ЮВ, 2016; 2018];
3) Малые дозы некоторых АД, обладающих выраженным снотворно-седативным действием, например миртазапина, миансерина, амитриптилина [Беккер РА, Быков ЮВ, 2019];
4) Седативные антигистамины, например гидроксизин, доксиламин [Медведев ВЭ, Морозов ПВ, 2006; Морозов ПВ, Никитин ЗА, 2009].
К каждому из этих классов препаратов тоже применимы все те соображения о преимуществах тразодона перед ними, которые были высказаны нами выше, в разделе о сопоставлении тразодона с рядом других препаратов, традиционно применяемых в России и странах СНГ в качестве «дневных седатиков», вегетативных стабилизаторов и анксиолитиков.
Так, в частности, к Z-лекарствам, так же как и к бензодиазепинам, тоже относится высказанное нами разделом выше соображение о высоком риске развития привыкания, патологического пристрастия и лекарственной зависимости, и о нежелательности их длительного применения, хотя для Z-лекарств этот риск несколько ниже, чем для бензодиазепинов. Кроме того, эту группу препаратов, так же как и группу бензодиазепинов, нельзя применять при сопутствующем синдроме ночного апноэ или при миастении [Stahl SM, 2013 (b); Sadock BJ et al, 2017].
Кроме того, как мы сами, так и другие авторы неоднократно упоминали в статьях и докладах, посвящённых тразодону, об уникальном специфическом нормализующем действии этого препарата на фазовую структуру и архитектонику сна, выгодно отличающем его от многих других препаратов, традиционно применяемых в качестве снотворных [ECNP Poster Session, 2020; Петрова НН с соавт, 2021; Беккер РА, Быков ЮВ, 2021].
В основе этой уникальности влияния тразодона на фазовую структуру и архитектонику сна, как предполагается, лежат уникальные особенности его рецепторного профиля, которые выгодно отличают его от всех прочих off-label применяемых со снотворно-седативными целями АП и АД, таких как миртазапин или кветиапин, хлорпротиксен, амитриптилин. А именно – то, что в снотворно-седативном эффекте тразодона значительно бо́льшую роль играет его сильный, высокоаффинный инверсный агонизм к
5-HT2A подтипу серотониновых рецепторов, в сочетании с уже ранее упоминавшимся нами высокоаффинным антагонизмом тразодона к α1B подтипу адренорецепторов (который даёт подавление кошмаров, a la празозин или доксазозин), а вовсе не его сравнительно слабые H1 гистаминоблокирующие свойства, как это имеет место быть у всех прочих упомянутых препаратов [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
В специфическом нормализующем действии тразодона на фазовую структуру и архитектонику сна (в то время как, например, миртазапин, оланзапин, кветиапин или хлорпротиксен нередко сами дают яркие цветные сны и даже кошмары) важную роль играет также то обстоятельство, что в рецепторном профиле тразодона, в отличие от всех упомянутых препаратов, полностью отсутствуют М-холиноблокирующие свойства (даже такие слабые, как у миртазапина или N-дезметил-кветиапина), зато присутствуют сильный парциальный 5-HT1A агонизм и умеренный антагонизм к 5-HT2C серотониновым рецепторам, которые оба способствуют подавлению избыточной представленности REM-фаз сна при депрессиях, а также умеренный антагонизм к 5-HT7 подтипу серотониновых рецепторов, который становится клинически значимым при высоких дозах тразодона (выше 300 мг/сут) и может способствовать нормализации циркадных ритмов [Stahl SM, 2009; 2013; Jaffer KY et al, 2017; Cuomo A et al, 2019].
Обзор имеющейся доказательной базы для применения тразодона при расстройствах с соматическими симптомами
К сожалению, исследованию эффективности ПФТ вообще и АД в частности (вовсе не только тразодона) при расстройствах с соматическими симптомами (то есть соматоформных, соматизированных и конверсионных расстройствах) в литературе традиционно уделяется очень-очень мало внимания. На этот счёт имеются буквально единичные исследования [Maj M et al, 2005; Charis C, Panayiotou G, 2018].
Одной из причин такого положения дел в современной психиатрии является давно сложившееся твёрдое консенсусное убеждение большинства специалистов в том, что, будто бы, «соматоформные и конверсионные расстройства практически не лечатся, и особенно – не лечатся с помощью ПФТ». Следовательно, и изучать заново вопрос об эффективности ПФТ при этих расстройствах – по мнению большинства специалистов, бесперспективно или мало перспективно с научной точки зрения [Maj M et al, 2005; Charis C, Panayiotou G, 2018].
Результатом такого положения дел является то, что, согласно нескольким свежим Кокрейновским систематическим обзорам, ни для соматоформных расстройств, ни для конверсионных расстройств пока не существует убедительных с точки зрения доказательной медицины методов эффективного и безопасного лекарственного лечения [Kleinstäuber M et al, 2014; Ganslev CA et al, 2020].
Вместе с тем отдельные разрозненные данные об эффективности той или иной ПФТ при том или ином соматоформном расстройстве найти всё-таки можно. Есть такие данные и для тразодона. Первое исследование, посвящённое изучению эффективности и безопасности применения тразодона при психосоматических, соматоформных и соматизированных расстройствах, датировано ещё 1974 годом. По своему дизайну это исследование было двойным слепым плацебо-контролируемым рандомизированным клиническим испытанием (РКИ). В нём приняли участие 100 пациентов с различными психосоматическими, соматоформными и соматизированными расстройствами и коморбидной депрессией и/или тревогой. Все они были рандомизированы к получению либо тразодона, либо плацебо [Knobel M, 1974].
Автору данного РКИ удалось показать эффективность тразодона не только в отношении редукции коморбидных депрессивных, тревожных и диссомнических нарушений в данной когорте пациентов, но и в отношении редукции проявлений их основного психосоматического или соматоформного заболевания (психогенный кожный зуд, соматоформные боли, СВД и др.). Переносимость тразодона в этом РКИ была очень хорошей. Автор обосновывает эффективность тразодона при психосоматических расстройствах наличием у него, наряду с «основным» для него, как и для любого АД, антидепрессивным и противотревожным действием, также целого ряда соматотропных и вегетотропных эффектов, таких как анальгетический, противозудный, гипотензивный, гипотермический, вегетостабилизирующий, противорвотный [Knobel M, 1974].
В 2003 году группа китайских авторов провела ещё одно двойное слепое плацебо-контролируемое РКИ, в котором сравнивалась эффективность и безопасность применения при хроническом соматоформном болевом расстройстве ААД тразодона и нестероидного противовоспалительного препарата (НПВС) ибупрофена. В исследовании приняли участие 140 пациентов с соматоформным болевым расстройством, которые были рандомизированы в 2 одинаковые группы по 70 человек. Одна группа (контрольная) получала ибупрофен в качестве фармакологически активного плацебо-контроля, а другая (группа активного лечения) получала тразодон. Оценку выраженности боли проводили по шкале TESS. Параллельно оценивали выраженность коморбидных депрессии и тревоги по шкалам Гамильтона HAM-D и HAM-A соответственно [Wang YX et al, 2003].
В этом РКИ тразодон оказался гораздо эффективнее ибупрофена: уменьшение выраженности соматоформного болевого синдрома наблюдалось в 92,8% случаев при применении тразодона, и только в 62,8% случаев при применении ибупрофена (p = 0,01). Переносимость тразодона пациентами с соматоформным болевым расстройством (а это достаточно «капризная» категория пациентов) была очень хорошей, уровень ПЭ был минимальным. Кроме того, лечение тразодоном, в отличие от лечения ибупрофеном, в данном РКИ приводило не только к редукции соматоформного болевого синдрома, но и к улучшению сна, и к редукции проявлений коморбидной депрессии и тревоги [Wang YX et al, 2003].
Давно и хорошо известно, что наличие той или иной острой или хронической боли нарушает процессы засыпания и поддержания сна и неблагоприятно влияет на его фазовую структуру, на его качество и глубину [Pieh С et al, 2011].
В то же время не менее давно и хорошо известно, что вынужденная депривация сна или диссомнические нарушения приводят к повышению болевой чувствительности, и даже могут привести к возникновению de novo тех или иных болевых синдромов у ранее не страдавшего ими человека (например, к развитию приступа головной боли напряжения (ГБН) или приступа мигрени на фоне вынужденного недосыпания, или к появлению болей в спине, конечностях на фоне общего повышения мышечного тонуса при недосыпании) [Ohayon MM, 2009].
Таким образом, связь между болью и качеством сна – двусторонняя [Pieh С et al, 2011].
В свете этих данных, в 2005 году одна из исследовательских групп заинтересовалась вопросом о том, в какой степени уменьшение болей при хроническом соматоформном болевом расстройстве под влиянием тразодона – коррелирует с улучшением фазовой структуры и архитектоники сна под его влиянием. Обнаружилась значительная положительная корреляция между этими параметрами [Saletu B et al, 2005].
Однако наличие такой корреляции в данном исследовании не позволило авторам сделать вывод о том, что именно улучшение качества сна, его фазовой структуры и архитектоники, приводит к редукции соматоформного болевого синдрома (за счёт влияния сна на болевую чувствительность). Ибо корреляция – не тождественна каузации (наличию причинно-следственной связи) [Saletu B et al, 2005].
Авторы данного исследования напоминают, что, хотя тразодон улучшает качество сна в самых разных контекстах (вовсе не только при соматоформном болевом расстройстве), но и анальгетическое действие он оказывает тоже в самых разных контекстах. А поскольку между сном и болью связь, как мы уже говорили выше, – двусторонняя (боль нарушает сон, но и нарушения сна повышают болевую чувствительность), то вполне возможно, что именно в случае купирования тразодоном нарушений фазовой структуры и архитектоники сна при хроническом соматоформном болевом синдроме – каузальная связь направлена в противоположную сторону (то есть вполне возможно, что именно в этом случае анальгетическое действие тразодона приводит к снятию боли, а сон при этом улучшается вторично, за счёт устранения мешающей нормальному засыпанию и поддержанию сна боли) [Saletu B et al, 2005].
Об эффективности и безопасности применения тразодона при таких не считающихся «сугубо психосоматическими» или соматоформными, но имеющих в своём составе значительный психосоматический компонент, расстройствах, как хроническая мигрень, фибромиалгия (ФМА), синдром хронической усталости (СХУ), хронические головные боли (ХГБН), синдром раздражённого кишечника (СРК), и недавно появившийся «постковидный синдром», – мы уже писали ранее [Петрова НН с соавт, 2021; Беккер РА, Быков ЮВ, 2021].
Завершая обзор доказательной базы по эффективности и безопасности применения тразодона при психосоматических и соматоформных расстройствах, перейдём к представлению двух клинических случаев успешного применения тразодона для лечения соматоформных расстройств в нашей собственной практике.
. Соматоформный болевой синдром в виде хронической распространённой боли, сочетающийся с ипохондрическим расстройством (онкофобией) и элементами конверсии, осложнившийся ятрогенной полихимической зависимостью. Пациент И. С., 1980 года рождения (41 год на момент обращения за консультацией к одному из авторов настоящей статьи в 2021 году). По образованию бухгалтер. Женат, детей нет. В детстве и юности рос и развивался нормально. Психические заболевания среди близких родственников отрицает. До 2016 года признаков каких-либо психических или психосоматических расстройств не обнаруживал, к врачам по этому поводу не обращался. В 2016 году, на фоне попыток рейдерского захвата фирмы, в которой данный пациент работал главным бухгалтером, и потенциальной угрозы уголовного преследования за якобы имевшую место «неуплату налогов», у пациента резко нарушился сон, ухудшилось настроение, появилась сильная тревога, беспокойство, страх перед будущим, а также разлитые неопределённого характера боли во всём теле, которые пациент позднее описывал как «выкручивание, выламывание рук и ног», «тяжесть в конечностях», «постоянное урчание и нытьё в животе», «в спину словно кол вонзили, не могу расслабиться», «частые головные боли». Кроме разлитого болевого синдрома, у данного пациента в тот период, по его словам, наблюдались также субфебрильная температура тела, тахикардия, экстрасистолы, колебания артериального давления.
На тот момент пациент не считал необходимым обращение к врачам, а своё состояние приписывал стрессу на фоне грозившего ему как главному бухгалтеру фирмы уголовного преследования. Однако по миновании острой стрессовой ситуации (ликвидации угрозы рейдерского захвата фирмы и уголовного преследования лично его) психические симптомы тревожности и депрессии у данного пациента частично редуцировались, а разлитые боли во всём теле, хронический субфебрилитет, тахикардия, экстрасистолы, колебания артериального давления – остались на прежнем уровне. Пациент был вынужден оставить работу.
С этими жалобами пациент обратился к местным врачам. Причиной своих болей во всём теле и прочих симптомов он считал «вероятно, рак». Будучи исходно довольно образованным человеком, он начитался в Википедии о паранеопластическом синдроме и о его многообразных и порой странных и необычных проявлениях. Поэтому ещё до похода к терапевту он начал с детального соматического обследования на онкологию, которое включало в себя магнито-резонансную томографию (МРТ) всего тела, сдачу множества онкомаркеров в крови, ультразвуковое исследование (УЗИ) органов брюшной полости и т. д. Поскольку после тщательного соматического обследования никаких видимых медицинских причин для этих болей врачи найти не смогли, то пациент был направлен к психиатру. Психиатром был поставлен диагноз «соматоформное болевое расстройство» (somatoform pain disorder) в виде хронической распространённой боли (chronic widespread pain), который мы впоследствии подтвердили. По этому диагнозу данный пациент получал от психиатра назначения сначала флувоксамина (с доведением дозы до 200 мг/сут) с хлорпротиксеном 15 мг на ночь, а затем – пароксетина (с доведением дозы до 40 мг/сут) с алимемазином (5 мг 3 раза в сутки). Первый же приём хлорпротиксена, несмотря на малую дозу (всего 15 мг на ночь), – вызвал у этого пациента приступ острой кривошеи, заставивший его вызвать скорую помощь. Причиной этого, вероятно, послужило сочетание трёх неблагоприятных факторов – высокой чувствительности этого пациента к экстрапирамидным ПЭ от АП, высокого уровня тревожности, и способности флувоксамина повышать концентрацию хлорпротиксена в крови за счёт торможения его печёночного метаболизма. После этого эпизода от дальнейшего приёма хлорпротиксена пациент отказался. Флувоксамин, однако, он принимать продолжил. После пяти месяцев неэффективного лечения флувоксамин 200 мг/сут был заменен тем же психиатром на пароксетин с алимемазином. Приём алимемазина вызвал у пациента неприятную сухость во рту, слабость и головокружение (вероятно, вследствие ортостатической гипотензии), усиление тахикардии. От дальнейшего приёма алимемазина данный пациент также отказался. Пароксетин принимать он, тем не менее, продолжил. Эффекта от данной терапии тоже не было, ни по линии соматоформных болей, ни по линии сопутствующей депрессии и тревоги. После трёх месяцев неэффективного лечения пароксетином 40 мг/сут данному пациенту было озвучено его тогдашним лечащим психиатром, что «соматоформные расстройства вообще-то в принципе не лечатся, а особенно они не лечатся таблетками», и что психиатр ему больше ничем помочь не может, и что ему необходима психотерапия. Пациент последовал этому совету. Однако найти грамотного психотерапевта «на месте» он не смог. По его словам, один из специалистов, к которому он обратился, занимался тем, что «делал пассы руками, зажигал ароматические свечи и пытался погрузить его в гипнотическое состояние», а второй – «пытался втирать ему какую-то мистическую чушь». После двух неудачных попыток найти психотерапевта данный пациент оставил дальнейшие попытки получить психотерапию.
Считая себя неизлечимо больным и страдая от хронических соматоформных болей, данный пациент, продолжая принимать неэффективный для него пароксетин
40 мг/сут, в отчаянии обратился к польскому психиатру, от которого получил дополнительное назначение сначала клоназепама до 4 мг/сут для расслабления мышц, в надежде уменьшить таким образом боли (клоназепам оказался неэффективным в этом отношении и был отменен, хотя, по словам пациента, «тревогу снимал хорошо»), а затем – прегабалина 150 мг/сут, потом 300 мг/сут. На этой терапии, по описанию пациента, «боли стали немного меньше», но полностью не исчезли. Затем польский специалист добавил данному пациенту комбинированный препарат Таргин (оксикодон + налоксон). Пациент добился официального разрешения на его провоз через границу.
Доза оксикодона за 4 года его применения постепенно доросла до 120 мг/сут (40 мг x 3 раза в сутки), при том, что эффект данной терапии в отношении болей во всём теле всё равно оставался неполным. На момент обращения за консультацией к одному из авторов настоящей статьи данный пациент был по-прежнему в статусе безработного, получал пароксетин 40 мг/сут, прегабалин 300 мг/сут, оксикодон 120 мг/сут в виде Таргина. Он предъявлял жалобы на разлитые боли во всём теле, а также на плохое, подавленное, тоскливое настроение, на потерю способности испытывать радость и удовольствие от жизни (ангедонию), на хроническую усталость и разбитость, апатию, нежелание ничего делать, отсутствие сил и энергии, мотивации, на импотенцию, небольшую гинекомастию, плохой сон, на эпизодически возникающие суицидальные мысли общего характера (без конкретных планов), мысли о собственной неизлечимости и безнадёжности, и на плохие, конфликтные отношения с женой. Несмотря на то, что обследования в своё время не обнаружили у данного пациента никаких соматических причин для испытываемых им сильных и разлитых хронических болей во всём теле, пациент выражал сомнение в этом и высказывал мысли о целесообразности повторного онкологического обследования. Он также высказывал мысли о том, что «это может быть какое-то митохондриальное или редкое генетическое заболевание».
Показатель шкалы депрессии Бека на момент обращения за консультацией составлял 23 балла (тяжёлая депрессия), показатель шкалы тревоги Шихана – 91 балл (крайне выраженная тревожность). Уровень боли пациент оценивал по визуальной аналоговой шкале на 7 из 10 – несмотря на приём Таргина, прегабалина и пароксетина.
Показатель шкалы соматосенсорной амплификации SSAS, отражающей степень ипохондризации пациента, – на момент обращения за консультацией составлял 49 из
50 баллов, показатель шкалы самосострадания, отражающей степень склонности пациента «жалеть себя и накручивать себя», – 52 из 60 баллов. Показатели шкалы CPAQ «принятия боли» – говорили о выраженной социальной дезадаптации пациента в связи с хронической болью, об определённом его «зацикливании» на ней, а также о его неготовности менять свой подход к жизни и к болезни, о том, что он, в целом, расценивает наличие боли как основание для того, чтобы ничего не делать по дому, не искать работу и т. д.
Пациенту были детально разъяснены природа его заболевания и план лечения. В связи с тяжестью депрессии и наличием хронического соматоформного болевого синдрома пароксетин 40 мг/сут был заменен на более мощную и обладающую анальгетическим действием комбинацию дулоксетина (с доведением до 120 мг/сут) и миртазапина (30 мг/сут). Дулоксетин, а не венлафаксин, был выбран нами в составе этой комбинации (известной в общем случае как «калифорнийское ракетное топливо») не только из-за его потенциально более сильного анальгетического действия, но и из-за лучшей в среднем переносимости дулоксетина по сравнению с венлафаксином, в частности меньшей его склонности повышать артериальное давление. Комбинирование АД с самого начала было предпринято нами как из-за тяжести депрессии и соматоформного болевого синдрома, так и из-за наличия у пациента нарушений сна, аппетита, либидо и сексуальной функции, поскольку у нас были опасения, что монотерапия дулоксетином у этого пациента может дополнительно ухудшить у него сон, аппетит, либидо и сексуальную функцию. Затем в кооперации с польским специалистом Таргин в дозе, эквивалентной 120 мг/сут оксикодона, был заменен нами на Бупраксон (бупренорфин + налоксон) в дозе, эквивалентной 8 мг/сут бупренорфина, с тем, чтобы, с одной стороны, попытаться использовать известное антидепрессивное действие бупренорфина как каппа-антагониста, с другой – попытаться улучшить контроль боли, а с третьей – создать условия для последующей плавной опиоидной детоксикации, которую легче провести на парциальном мю-агонисте с большим T1/2 (бупренорфине), чем на полном мю-агонисте с коротким T1/2 (оксикодоне). Прегабалин был нами постепенно редуцирован и отменен (с 300 мг/сут до 225, затем 150, затем 75, затем 50, 25 и 0 мг), как с целью уменьшить общее количество лекарств и стоимость лечения, так и с целью ослабить негативное влияние всей схемы на либидо и потенцию.
На этой терапии пациенту стало значительно лучше. Средняя оценка по визуальной аналоговой шкале боли снизилась с 7 баллов до 3-4 баллов. Снизились также показатели депрессии по шкале Бека и тревоги по шкале Шихана и показатель шкалы ипохондрии SSAS. Однако полной ремиссии на этой комбинации достигнуто не было. Кроме того, пациента стали беспокоить прибавка массы тела на миртазапине, а также яркие цветные сны. Для него, на фоне улучшения психического состояния, также приобрела бо́льшую личностную значимость сохранявшаяся все годы лечения проблема нарушения либидо и эректильной функции. Чтобы избавиться от этих проблем, мы попытались плавно, наложением «крест-накрест», заменить у этого пациента миртазапин 30 мг на ночь на тразодон, сначала 50 мг на ночь, с постепенным доведением дозы тразодона до 100 мг на ночь, затем до 150 мг на ночь и последующим постепенным снижением миртазапина до 15 мг на ночь, затем до 7,5 мг на ночь и затем до 0 мг после 2 недель пребывания на 150 мг/сут тразодона (с тем, чтобы его эффект успел развиться).
С учётом того, что у этого пациента в прошлом были ортостатические реакции на алимемазин, нами были заранее рекомендованы проактивные меры по предотвращению этого при приёме тразодона (увеличение потребления воды и соли, компрессионные гольфы на ноги, сон с приподнятым головным концом, медленное и плавное вставание с кровати по утрам).
Однако первая попытка замены миртазапина на тразодон окончилась неудачей – при попытке снижения и отмены миртазапина произошло усиление соматоформных болей. Ухудшилось психическое состояние также и по линии тревоги и депрессии. Возвращение миртазапина и отмена тразодона по настоянию пациента – быстро купировали это обострение.
В то же время пациент отметил, что в период кратковременного пребывания на переходной комбинации из трёх АД (дулоксетина 120 мг/сут, миртазапина 30 мг/сут и тразодона 150 мг/сут) у него улучшился сон, улучшились либидо и эрекция, исчезли появившиеся на миртазапине кошмары, а контроль боли стал лучше – по его словам, «с 3-4 до 2-3 баллов из 10». На этом основании мы решили снова попробовать добавить тразодон 150 мг/сут, но уже без намерения убрать через некоторое время после его добавления миртазапин.
Эта попытка, в отличие от предыдущей, оказалась успешной. Она привела к улучшению не только по линии хронических соматоформных болей, но и по линии депрессии и тревоги, а также по линии либидо и потенции. Улучшение по линии депрессии, в отличие от улучшения сна и уменьшения боли, в данном случае наступило очень медленно, только спустя 6 недель после добавления тразодона 150 мг/сут. На фоне этого улучшения психического состояния мы смогли, в кооперации с польским специалистом, очень плавно, постепенно, в течение 3 месяцев, редуцировать бупренорфин с 8 мг/сут до 0. При этом мы сумели избежать ярких проявлений опиоидного абстинентного синдрома (ОАС), а также избежать обострения депрессии, тревоги или соматоформных болей. Чтобы добиться дальнейшего улучшения состояния, полного купирования остаточной хронической боли («2-3 из 10») и остаточной депрессии и тревоги, мы решили попробовать плавно, крест-накрест, заменить миртазапин на оланзапин 2,5-5 мг/сут. Эта попытка, как и предыдущая попытка замены миртазапина на тразодон, – окончилась неудачей (рецидивом болей и тревоги). Миртазапин пришлось вернуть. В то же время, опять-таки, пациент отметил, что во время кратковременного пребывания на этих 4 препаратах (дулоксетин 120 мг/сут, миртазапин 30 мг/сут, тразодон 150 мг/сут и оланзапин 5 мг/сут) – его психическое состояние стало ещё лучше и стабильнее, а уровень боли, по его словам, снизился с 2-3 до 0 по визуальной аналоговой шкале. Параллельно с пошаговым подбором ПФТ данному пациенту проводилась онлайн КПТ и терапия принятия и ответственности по поводу хронической боли, депрессии и тревоги, предпринимались мероприятия по поведенческой активации, налаживанию отношений с женой (попутно отметим, что конфликты с ней сопровождались у пациента психогенным усилением боли, что и дало нам основание говорить о наличии отдельных конверсионных черт в его страдании, хотя оно и не является на 100% конверсионным – оно соматоформное), обучению пациента справляться со стрессами и тревогами повседневной жизни.
Таким образом, в итоге длительного подбора ПФТ у этого пациента мы пришли к схеме из 4 препаратов – дулоксетина 120 мг/сут, миртазапина 30 мг/сут, тразодона
150 мг/сут и оланзапина 5 мг/сут. На этой терапии у данного была достигнута полная ремиссия как по линии хронического соматоформного болевого синдрома, так и по линии тревоги, депрессии, и по линии нарушений сна. Как оказалось впоследствии, каждый из этих 4 препаратов, включая и тразодон, – критически необходим в схеме у данного пациента. Любая попытка снижения или отмены какого-либо из них ради упрощения и удешевления схемы или ради снижения ПЭ – быстро приводит к рецидиву соматоформного болевого синдрома, тревоги и/или депрессии. Проблему возможной дальнейшей прибавки массы на данной терапии мы в итоге сумели решить с помощью поведенческих методов (контроль питания и физической активности) и дополнительного назначения метформина 2000 мг/сут. Пациент восстановил социальную адаптацию, трудоспособность, в настоящее время работает главным бухгалтером на мебельной фабрике. Продолжает принимать данную схему по сей день.
Клинический случай № 2. Соматоформная вегетативная дисфункция, сочетающаяся с ипохондрическим расстройством (кардиофобией).
Пациент М. А., 1997 года рождения (23 года на момент обращения за консультацией к одному из соавторов настоящей статьи в 2020 году). По образованию учитель математики. В детстве и юности рос и развивался нормально. Психические заболевания у родственников отрицает. С детства рос тревожным и впечатлительным ребёнком, однако в период до 2020 года симптомов психического расстройства не обнаруживал, к врачам по этому поводу не обращался.
С 2015 года (с 18 лет) данный пациент страдает хроническим неврологическим заболеванием – синдромом беспокойных ног (СБН). По этому поводу получал по назначению невролога пропранолол 40 мг перед сном, с хорошим эффектом. В 2020 году, на фоне вынужденной смены места жительства и связанного с этим стресса, у данного пациента развилось тревожное состояние, со всеми типичными для него симптомами (нарушения засыпания, тахикардия, экстрасистолы, тремор рук, снижение аппетита, похудание, потливость, колебания артериального давления, периодическая тошнота, постоянное чувство внутреннего напряжения, беспокойства, постоянная готовность к самым плохим исходам любых ситуаций).
Панических атак (ПА) у этого пациента никогда не было, тревога у него носила постоянный, фоновый характер. Со временем ощущение тревоги, беспокойства и внутреннего психического напряжения у него редуцировалось, а соматовегетативные проявления тревожности, такие как тахикардия, экстрасистолы, тремор рук, потливость, слабость, быстрая утомляемость, частые головные боли напряжения (ГБН), – сохранились. Таким образом, можно говорить о том, что тревога у этого пациента соматизировалась.
Данный пациент испытывал сильный страх за состояние своего сердца в связи с «перебоями» (экстрасистолами), хронической тахикардией и гипервентиляцией, боялся развития у себя тяжёлого сердечного заболевания, например инфаркта миокарда. С этой мыслью он неоднократно обращался к кардиологам, неврологам, терапевтам, проходил многочисленные обследования (электрокардиографию, эхокардиографию, спирографию и др.). Поскольку ни одно из обследований не обнаружило у него какой-либо патологии сердца (кроме небольшого и не имеющего клинического значения пролапса митрального клапана (ПМК) 1-й степени, без регургитации), то в конечном итоге этот пациент был направлен к психиатру.
У психиатра он получил назначение сначала эсциталопрама 10 мг/сут с гидазепамом 20 мг x 3 раза в день и хлорпротиксеном 50 мг на ночь. От приёма этой терапии он сразу же отказался, так как получил с первых же доз эсциталопрама и хлорпротиксена усиление симптоматики СБН, тревогу, акатизию, тризм челюстей и тошноту; гидазепам в качестве прикрытия не сработал. Затем он получил от того же психиатра назначение пароксетина 20 мг/сут с алимемазином 5 мг × 3 раза в день, с тем же результатом. После этого данный пациент обратился за помощью к одному из соавторов настоящей статьи. На момент обращения за консультацией показатель шкалы депрессии Бека у данного пациента составлял 5 баллов (депрессия отсутствует), показатель шкалы тревоги Шихана – 87 баллов (весьма выраженная тревожность), показатель шкалы соматосенсорной амплификации SSAS – 37 баллов (выраженная ипохондризация).
Учитывая, с одной стороны, выраженную тревожность, нарушения сна, наличие в клинической картине страдания у этого пациента таких симптомов, как тошнота и снижение аппетита (и, соответственно, нежелательность назначения ему СИОЗС, которые сами имеют эти ПЭ), а также наличие у него коморбидного СБН, высокую чувствительность к СИОЗС-индуцированным экстрапирамидным ПЭ (акатизия, тризм челюстей) и важность сохранения сексуальной функции для этого молодого человека, – мы сочли, что тразодон будет наилучшим выбором следующего АД. Сообразно этому, данному пациенту был назначен тразодон, сначала 50 мг на ночь, через 3 дня – 100 мг на ночь, ещё через 3 дня – 150 мг на ночь. С целью избежать возможной рефлекторной тахикардии наутро при приёме тразодона и возможного усиления в связи с этим кардиофобии и тревожности, короткодействующий пропранолол 40 мг на ночь был заменен нами на длительно действующий бисопролол 2,5 мг утром и 2,5 мг вечером. Одновременно нами были предприняты проактивные меры по предотвращению ортостатических реакций (информационная беседа о важности плавного вставания с кровати, увеличения потребления воды и соли, спать с приподнятым головным концом). Параллельно проводилась КПТ тревоги. Данная терапия привела к становлению у пациента полной клинической ремиссии, которая в настоящее время, после 6 мес лечения тразодоном 150 мг/сут и бисопрололом 5 мг/сут, поддерживается уже без ПФТ (бисопролол он по-прежнему принимает по линии СБН).
Заключение
Как видно из приведённых нами данных литературы, тразодон, благодаря некоторым особенностям своего рецепторного профиля, обуславливающим наличие у него, наряду со снотворно-седативными, антидепрессивными и анксиолитическими свойствами, также выраженной анальгетической и вегетостабилизирующей активности, гипотермических, противорвотных и противозудных свойств, – может являться эффективным и безопасным средством лечения психических расстройств с соматическими симптомами, в том числе соматоформного болевого расстройства, соматоформных вегетативных дисфункций, конверсионного расстройства, термоневрозов, кардионеврозов и др.
Наличие у тразодона антиобсессивных свойств и его эффективность при ОКР позволяют предполагать, что он может быть также эффективен и при таких феноменологически сходных с ОКР расстройствах из соматоформного спектра, как ипохондрическое расстройство и дисморфическое телесное расстройство.
Важным преимуществом применения тразодона в качестве вегетостабилизирующего препарата перед применением в этой роли таких препаратов, как хлорпротиксен, алимемазин, тиоридазин, – является отсутствие у него D2-дофаминоблокирующей и М-холиноблокирующей активности. Это означает, соответственно, отсутствие вероятности получить при его применении острую дискинезию (как в клиническом примере № 1), острую акатизию, лекарственный паркинсонизм, усиление симптомов СБН или, например, такие «атропиноподобные» ПЭ, как запоры, задержка мочи, сухость во рту, мидриаз, парез аккомодации глаз, нарушения памяти. С другой же стороны, важным преимуществом применения тразодона перед применением СИОЗС при этих расстройствах является отсутствие у него склонности вызывать начальное обострение тревоги и беспокойства, тошноту, рвоту, поносы, снижение аппетита, отсутствие негативного влияния на либидо и эректильную функцию, на качество и яркость оргазма, на сон и его фазовую структуру (напротив, тразодон способен улучшать либидо и сексуальную функцию, а также оказывать специфическое нормализующее влияние на сон и его фазовую структуру). Это сыграло свою роль в клиническом примере № 2. С учётом особой чувствительности пациентов с психосоматическими расстройствами к различным ПЭ от психотропных препаратов, эти различия в переносимости между тразодоном и вышеуказанными альтернативными препаратами приобретают особое значение. Представленные нами в данном обзоре два клинических примера из нашей собственной практики – на наш взгляд, весьма убедительно иллюстрируют данный тезис.


