Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№04 2013
Эффективность поддерживающей терапии агомелатином (Вальдоксаном) при рекуррентной депрессии и биполярном аффективном расстройстве №04 2013
Номера страниц в выпуске:30-37
Длительная поддерживающая монотерапия агомелатином может быть рекомендована как при БАР II, так и при РД. Комбинированная терапия ламотриджином показана при недостижении пациентом полной ремиссии в целях стабилизации настроения.
Резюме. Цель исследования: Сравнение эффективности и переносимости агомелатина при длительной поддерживающей терапии (ПТ) у больных с рекуррентной депрессией (РД) и биполярным аффективным расстройством II типа (БАР II) по DSM-IV-R.
Методы исследования. Обследованы в процессе длительной ПТ (более 24 мес) агомелатином в дозе 25 мг/сут 78 пациентов:
43 – с БАР II, 35 – с РД. Для оценки состояния пациентов использовались клинический метод, психометрические шкалы (HAMD-17, YMRS, CGI), визуальные аналоговые шкалы, шкала оценки качества жизни (КЖ) EQ-5D-5L.
Результаты. Полной ремиссии достигло большинство пациентов: в группе с БАР II – 90,7%, в группе с РД – 82,9%. Средняя продолжительность ремиссии составила 24,5±6,4 мес для РД и 17,4±4,3 мес для БАР II. Вторая ремиссия по продолжительности превышала первую в среднем на 3,9±1,5 мес в группе с БАР II. В группе с РД этот показатель увеличился на 3,5±1,8 мес. Через 12 мес ПТ депрессивный эпизод возник у 5,7% больных с РД и у 7% больных с БАР II. Тяжесть депрессии при БАР II снизилась с 27,1±5,3 в первом приступе до 23,4±3,1 – в третьем при РД, с 25,5±3,5 до 22,5±3,5 соответственно. Отмечены высокие показатели КЖ пациентов: доля профиля 11111 составила 90,7% в группе с БАР II, 91,4% – в группе с РД. Среднее значение EQ-VAS – 79,3±1,2 для БАР II и 82,4±3,1 для РД. На протяжении всего исследования не отмечено клинически значимой инверсии аффекта у пациентов с БАР II. Побочные эффекты регистрировались у 4 (9,3%) пациентов с БАР II и у 3 (8,6%) – с РД. Не было выявлено влияния агомелатина на массу тела, половую функцию, показатели артериального давления. Риск отказа от ПТ агомелатином пациентов с БАР II RБАР=0,046 и для РД RРД=0,029. У мужчин риск отказа от ПТ в 3 раза выше, чем у женщин: Rm=0,097, Rf=0,034.
Заключение: Длительная поддерживающая монотерапия агомелатином может быть рекомендована как при БАР II, так и при РД. Комбинированная терапия ламотриджином показана при недостижении пациентом полной ремиссии в целях стабилизации настроения.
Ключевые слова: агомелатин, биполярное аффективное расстройство, рекуррентная депрессия, поддерживающая терапия.
Efficiency of agomelatine (Valdoxan) maintenance therapy in recurrent depression
and bipolar affective disorder
N.A.Tyuvina, V.N.Smirnova
I.M.Sechenov First Moscow State Medical University, Ministry of Health of the Russian Federation
Summary. Objective: to compare the efficacy and tolerability of agomelatine during long-term maintenance therapy (MT) in patients with recurrent depression (RD) and bipolar affective disorder II (BAD II) according to the DSM-IV-R.
Methods. Seventy-eight patients, including 43 with BAD II and 35 with RD, were examined during long-term (more than 24-month) MT with agomelatine 25 mg/day. To evaluate the patients’ status, the investigators used physical examination and psychometric (HAMD-17, YMRS, and CGI), visual analogue, and quality of life – QL (EQ-5D-5L) scales.
Results. Complete remission was achieved in the majority of patients (90,7 and 82,9% in the BAD II and RD groups, respectively). The remission duration averaged 24,5±6,4 months for RD and 17,4±4,3 months for BAD II. The second remission lasted an average of 3,9±1,5 months longer in the BAD II group. In the RD group, this indicator increased by 3,5±1,8 months. Twelve months following MT, a depressive episode occurred in 5,7 and 7% of the patients with RD and BAD II, respectively. The depression severity decreased from 27,1±5,3 to 23,4±3,1 in the first episode in BAD II and from 25,5±3,5 to 22,5±3,5 in the third episode in RD. The patients exhibited high QL indicators: the proportion of the 11111 profile was 90,7 and 91,4% in the BAD II and RD groups, respectively. The mean EQ-VAS value was 79,3±1,2 for BAD II and 82,4±3,1 for RD. Throughout the investigation, no clinical significant affect inversion was noted in patients with BAD II. Side effects were recorded in 4 (9,3%) and 3 (8,6%) patients with BAD II and RD, respectively. Agomelatine was ascertained to have no effect on body weight, sexual function, or blood pressure. The risk for agomelatine MT refusal was as follows: BAD IIR=0,046 and RDR=0,029. In the males, the risk of MT refusal was 3 times higher than in the females (Rm=0,097, Rf=0,034).
Conclusion. Long-term agomelatine maintenance monotherapy may be recommended for both BAD II and RD. Combination therapy with lamotrigine is indicated to stabilize mood if the patient fails to achieve complete remission.
Key words: agomelatine, bipolar affective disorder, recurrent depression, maintenance therapy.
В современных наиболее часто употребляемых классификациях закреплено разделение рекуррентного депрессивного расстройства (РДР) и биполярного аффективного расстройства (БАР) [13, 33]. В последние десятилетия все большую популярность приобретает концепция, отделяющая РДР от спектра биполярных расстройств по целому ряду патогенетических и клинических показателей, что связано как с анализом накопленного клинического материала, так и с успехами биологических исследований [8].
Наряду с этим в литературе описана возможность перехода от монополярного к биполярному течению [9, 11]. Около 20% рекуррентных депрессий (РД) трансформируется в биполярный вариант аффективного расстройства. Самостоятельное существование маниакального униполярного расстройства считается маловероятным, а частота последующих депрессивных и смешанных эпизодов повышается с возрастом [10].
У мужчин БАР начинается раньше, чем у женщин [15], при этом первой фазой у них чаще бывает маниакальная, а у женщин – депрессивная [26]. В течение болезни эта зависимость сохраняется: доля маниакальных эпизодов у мужчин больше, чем у женщин [29]. У женщин манифестация заболевания часто связана с менструально-генеративной функцией и периодами гормональной перестройки в организме (пубертат, послеродовой период, климактерий) [4].
Несмотря на то что присутствие гипоманиакальных/маниакальных эпизодов является ключевым феноменом в клинике БАР, большую часть времени эти больные проводят именно в депрессивном состоянии [25]. Возможно, этим объясняется то, что БАР II чаще диагностируется у женщин, а БАР I одинаково часто встречается как у женщин, так и у мужчин [23]. Соответственно, чем дольше клинически выраженная мания не попадает в поле зрения врача, тем дольше эти пациенты (чаще женщины) будут получать тактически неверное лечение.
Предотвращение очередного приступа/рецидива и БАР, и РД является основной задачей поддерживающей терапии (ПТ). Соблюдение режима назначенной ПТ, очевидно, является основным условием успешной профилактики. Проблеме вовлечения пациентов в долгосрочные профилактические программы посвящено достаточно много работ. Около 1/2 пациентов не придерживаются назначенного лечения (nonadherent), другая 1/2 придерживается частично (partially adherent) [32]. По другим данным, процент несоблюдения режима ПТ среди пациентов с БАР варьирует в пределах от 12 до 64% [16]. Наиболее частые причины отказа от длительного лечения: увеличение массы тела, излишняя седация, плохая совместимость с оральными контрацептивами, молодой возраст и низкий уровень образования [35]. Исходя из этого, следует заключить, что дополнительными задачами и целями ПТ должно быть повышение приверженности лечению, поддержание удовлетворительного качества жизни (КЖ), минимизация риска нежелательных явлений (НЯ).
Эффективность, необходимость и безопасность применения антидепрессантов при БАР является одним из наиболее дискутируемых в литературе вопросов на протяжении нескольких десятков лет. Их эффективность при РД как для купирующей, так и для профилактической терапии не подвергается сомнению, несмотря на явную генетическую и этиопатогенетическую близость этих заболеваний.
Рекомендации Британской ассоциации психофармакологов говорят о необходимости комбинации селективных ингибиторов обратного захвата серотонина (СИОЗС) и противоманиакальных препаратов (литий, вальпроаты, атипичные нейролептики) при любой тяжести депрессии с самого начала терапии [22]. Эксперты Американской ассоциации психиатров считают литий и ламотриджин препаратами 1-й линии для непсихотических биполярных депрессий. Дополнительное назначение антидепрессантов рекомендовано только в случаях очень тяжелой депрессии [20, 21].
Канадские рекомендации (CANMAT guidelines) по лечению биполярной депрессии при БАР I сходны с первыми двумя. Препаратом 1-й линии при депрессии в рамках
БАР II эти авторы считают кветиапин, эффективность и хорошая переносимость которого подтверждена многими исследованиями [18]. Комбинированная терапия нормотимиками и антидепрессантами рекомендуется при его неэффективности. Монотерапия антидепрессантами рассматривается экспертами ISBD и CANMAT [18, 19] как возможный вариант лечения для особой группы пациентов – с редкими гипоманиями, как правило, не приводящими к проблемам в социальном или медицинском понимании.
С введением в клиническую практику антидепрессантов было замечено, что назначение трициклических антидепрессантов (ТЦА) опасно в плане развития мании или перехода заболевания к быстроциклическому варианту течения [12]. По данным T.Wehr и соавт. [34], вероятность причинной связи между развитием быстрых циклов в популяции пациентов с БАР и назначением ТЦА составляет 20%. Большое количество исследований убедительно показывает эффективность и безопасность краткосрочной комбинированной терапии (нормотимик + антидепрессант) депрессии как в рамках БАР I, так и БАР II.
В ряде работ показано, что СИОЗС, венлафаксин и бупропион могут применяться при БАР II как стабилизаторы настроения при ПТ, так как монотерапия этими препаратами заметно эффективнее плацебо, но и не более опасна в плане развития расстройства противоположного полюса [6, 7, 14, 30]. Сравнения в этих исследованиях проводились с нормотимиками и комбинированной терапией. Это позволяет говорить о необходимости дифференцированного подхода к терапии БАР, учитывающего особенности течения болезни у каждого отдельного пациента.
Современные исследования все больше подтверждают, что нарушениями в моноаминергической системе нельзя полностью объяснить все наблюдаемые клинические феномены расстройств настроения и эффективность разных по механизму действия препаратов, применяемых для их лечения [28]. Теоретически нарушение биологических ритмов, в частности циркадианных, может быть центральным звеном в этиопатогенезе разных вариантов депрессий [24, 27, 31].
Агомелатин, недавно вошедший в клиническую практику, является агонистом мелатонинергических рецепторов МТ1- и МТ2- и антагонистом серотониновых 5НТ2С-рецепторов. Механизм его действия объединяют нейроэндокринные и моноаминергические взаимодействия. За счет антагонизма к 5НТ2C-рецепторам он повышает уровень норадреналина и дофамина в префронтальной коре, а стимуляция мелатониновой системы усиливает антидепрессивный эффект, так как восстанавливает нарушенные циркадианные ритмы, повышает стрессоустойчивость и регулирует сон.
Агомелатин не повышает внеклеточный уровень серотонина, в связи с чем не вызывает побочных эффектов, свойственных СИОЗС (тошнота, диарея, половые дисфункции, диссомния). Кроме того, этот препарат не обладает аффинитетом к гистаминергическим Н1-, a1-адренергическим и мускариновым рецепторам, поэтому не имеет побочных эффектов, характерных для ТЦА [1–3, 17]. Опыт применения агомелатина при БАР крайне ограничен. Нами было проведено сравнительное исследование эффективности агомелатина для купирования депрессивного приступа в рамках РД и БАР [5]. В ходе этого исследования было показано, что данный препарат абсолютно безопасен относительно возникновения НЯ, риска инверсии фазы и/или возникновения транзиторной гипомании, что позволяет использовать его не только для купирующей, но и длительной ПТ, в том числе при БАР.
Полученные данные свидетельствуют о быстром и достаточно выраженном антидепрессивном эффекте агомелатина, проявляющимся с 1-й недели терапии одновременно с нормализацией циркадианных ритмов. Результаты исследования позволили предположить, что при БАР I в отличие от БАР II более эффективно использование агомелатина в сочетании с нормотимиками (вальпроаты и ламотриджин). При анализе имеющихся литературных данных не было обнаружено работ, описывавших эффекты от длительной ПТ агомелатином как при РД, так и при БАР.
Цель исследования – сравнение эффективности и переносимости агомелатина на этапе ПТ у пациентов с РДР и БАР II типа.
Исследование проводилось в амбулаторных и стационарных условиях на базе Университетской клинической больницы №3 (Клиника психиатрии им. С.С.Корсакова) Первого МГМУ им. И.М.Сеченова с 2009 по 2013 г.
Критерии включения: наличие ремиссии после купирования депрессивного эпизода агомелатином в рамках БАР II или РД; возраст старше 18 лет; добровольное информированное согласие пациента на участие в исследовании, подразумевающее согласие пациента на продолжение приема агомелатина для профилактики рецидива заболевания и согласие на регулярные беседы по телефону и/или через онлайн-средства коммуникации с исследователем, на визиты в случае приглашения.
Критерии исключения: наличие шизофрении, органических психических нарушений; пациенты с БАР I; наличие хронических соматических заболеваний, препятствующих обследованию пациентов; наличие суицидальных тенденций; возраст моложе 18 лет; отказ от участия в исследовании.
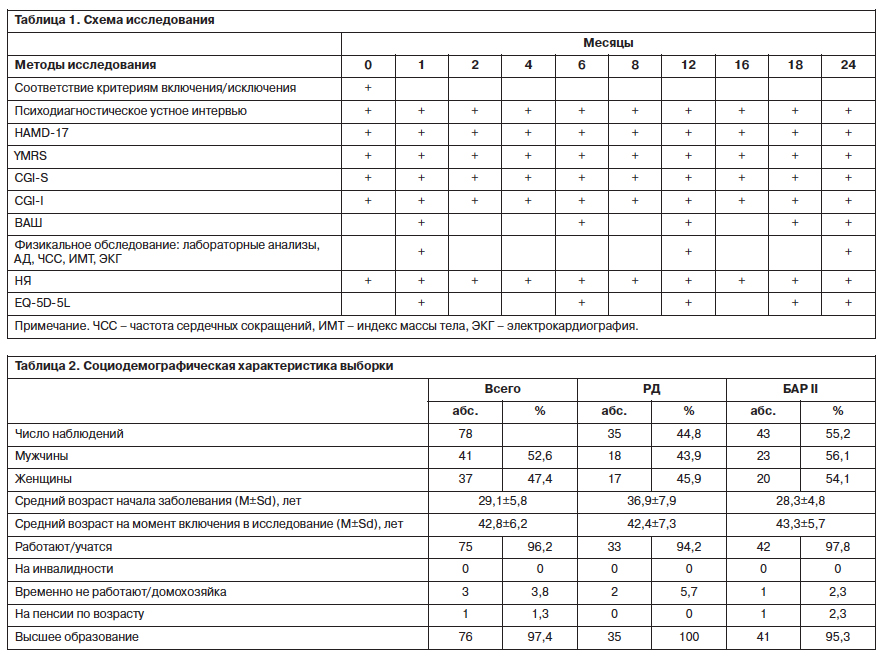
Схема исследования представлена в табл. 1.
Эффективность ПТ определяется в первую очередь продолжительностью и КЖ, продолжительностью, степенью тяжести и частотой рецидивов, КЖ пациентов в ремиссии. В немалой степени имеет значение влияние терапии на повседневную социальную активность, сочетаемость с привычным образом жизни и распорядком дня всех действий, которые необходимо предпринимать для соблюдения ПТ.
 Оценка эффективности и переносимости терапии проводилась клиническим методом с использованием психометрических инструментов для подтверждения продолжающейся ремиссии: 17-пунктовой шкалы депрессии Гамильтона (HAMD-17), шкалы мании Янга (YMRS), шкалы оценки общего клинического впечатления для оценки тяжести заболевания (CGI-S) и улучшения (CGI-I). Критериями состояния ремиссии являлось отсутствие признаков развития депрессии как по клиническим проявлениям, так и психометрическим оценкам. Развитие гипоманиакального состояния считалось очередным рецидивом в том случае, если приводило к декомпенсации коморбидных заболеваний и социальной дезадаптации.
Оценка эффективности и переносимости терапии проводилась клиническим методом с использованием психометрических инструментов для подтверждения продолжающейся ремиссии: 17-пунктовой шкалы депрессии Гамильтона (HAMD-17), шкалы мании Янга (YMRS), шкалы оценки общего клинического впечатления для оценки тяжести заболевания (CGI-S) и улучшения (CGI-I). Критериями состояния ремиссии являлось отсутствие признаков развития депрессии как по клиническим проявлениям, так и психометрическим оценкам. Развитие гипоманиакального состояния считалось очередным рецидивом в том случае, если приводило к декомпенсации коморбидных заболеваний и социальной дезадаптации.
ля представления субъективных оценок пациентов в обобщаемом виде использовались визуальные аналоговые шкалы (ВАШ). Отдельно исследовалось влияние агомелатина на качество сна (ВАШ «качество сна»), дневную активность (ВАШ «дневная активность»). Участники исследования, остававшиеся 12 мес и более в ремиссии, сравнивали степень выраженности сезонных колебаний состояния до и во время приема агомелатина (ВАШ «сезонность»). Регистрировалась степень общего удовлетворения результатами лечения (ВАШ «общий результат»), пациентам предлагалось оценить свою точность по выполнению рекомендаций врача по приему ПТ (ВАШ «я пациент»). Пациентам при осмотре предлагались распечатанные на листе формата А4 подписанные шкалы с делениями от 0 до 100, давалась инструкция отметить уровень своей оценки каждого из этих параметров на соответствующей шкале.
Возникновение НЯ фиксировалось отдельно в течение всего периода исследования.
Для получения сопоставляемых и обобщаемых результатов по КЖ пациентов был использован опросник EQ-5D-5L.
Статистическая обработка материала проводилась с использованием программы Microsoft Office Excel 2003.
Конечная выборка для оценки эффективности агомелатина составила 78 наблюдений. Из них 43 – с БАР II (по DSM-IV-R,) и 35 – с РД. Соотношение мужчин и женщин в 2 группах достоверно не различалось, средний возраст на момент включения в исследование также не отличался (43,3±5,7 и 42,4±7,3 года). Средний возраст начала заболевания был достоверно ниже в группе пациентов с БАР (28,3±4,8 против 36,9±7,9 года). В группе с БАР II преобладали пациенты с тяжелыми депрессивными приступами в анамнезе: 24 (55,8%) против 6 (17,1%) пациентов. Тяжелые депрессии в группе с БАР чаще наблюдались у пациентов с гипертимным преморбидом, а при РД – с тревожным. аким образом, обе выборки достоверно различались по возрасту начала заболевания, соотношениям разных типов личности в преморбидном состоянии и степени тяжести депрессии в течение заболевания. Обе группы не имели достоверных различий по основным социодемографическим характеристикам (табл. 2), в том числе по среднему возрасту включения в исследование.
Лечение агомелатином проводилось на протяжении всего периода наблюдения. В ремиссии препарат назначался в дозе 25 мг/сут, при обострении состояния доза увеличивалась до 50 мг/сут. На всем протяжении исследования допускалось кратковременное использование транквилизаторов в случаях выраженных тревожных реакций и антиконвульсантов – при неполных ремиссиях.
Основные результаты исследования представлены в табл. 3. Длительность лечения агомелатином до наступления ремиссии достоверно не различалась в 2 группах (рис. 1). Она составила в среднем 6,4±1,5 нед для БАР II, 6,8±1,7 нед для РД (р<0,05). Были сопоставлены данные о лечении 3 последовательных эпизодов депрессии у 30 пациентов с РД и 35 с БАР II, принимавших агомелатин с 2009–2010 гг. Обнаружена динамика снижения не только продолжительности эпизода до наступления ремиссии, но и снижения тяжести каждого последующего приступа (рис. 2). Средний балл по HAMD-17 в группе с БАР II был выше, чем в группе с РД (27,1±5,3 для БАР и 25,5±3,5 для РД, р<0,005) при первичном обращении по поводу депрессии. Третий эпизод все пациенты перенесли в амбулаторных условиях. Средний балл по HAMD-17 в группе с БАР составил 23,4±3,1, в группе с РД – 22,5±3,5, что достоверно ниже, чем во время первого эпизода. Никому не потребовалось оформление временной нетрудоспособности.

Полной ремиссии достигло большинство пациентов: в группе с БАР II – 90,7%, в группе с РД – 82,9%. В случае неполной ремиссии в группе с БАР II остаточная симптоматика была представлена упорно сохраняющимися суточными колебаниями состояния. Эти пациенты продолжали жаловаться на сохраняющуюся вялость, апатичность в утренние часы при полном благополучии в дневное и вечернее время. Например, один из пациентов с БАР II (мужчина 30 лет), несмотря на отличный карьерный рост, семью, удачную защиту кандидатской диссертации, продолжал сообщать о сохраняющихся приступах утренней тошноты, сопровождающихся мыслями о собственной «недоразвитости, ущербности». Через 1–2 ч после пробуждения эти явления неизменно проходили и пациент продолжал вести активную социальную жизнь. Подобные колебания состояния являлись показанием для дополнительного назначения стабилизаторов настроения (ламотриджина). Спустя несколько недель приема 2 препаратов выраженность и частота утренних ухудшений обычно снижалась. Эта же закономерность повторялась у остальных пациентов с сохраняющимися суточными колебаниями состояния.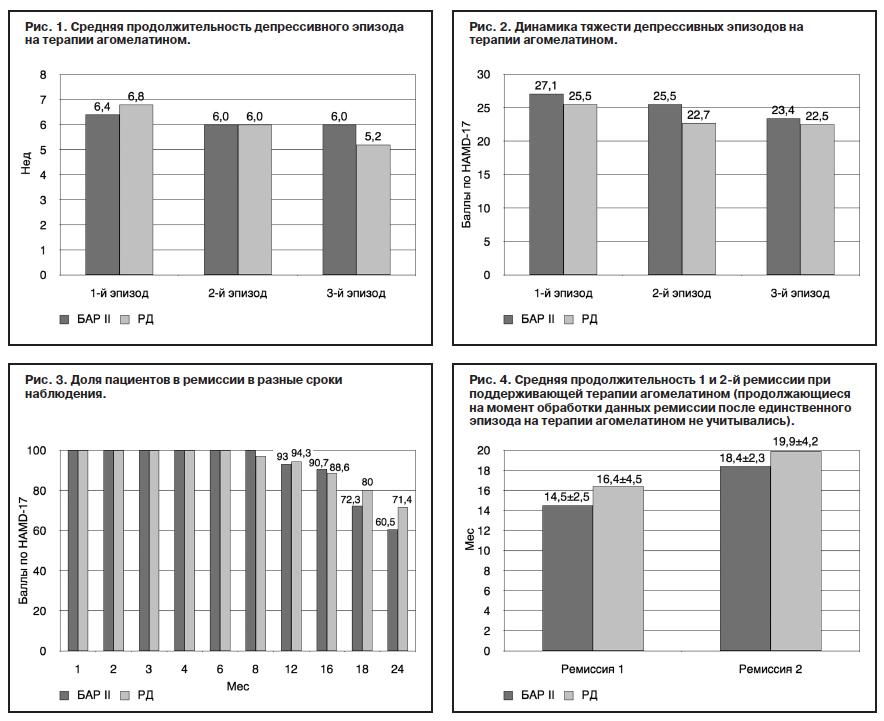
При неполной ремиссии при РД остаточная симптоматика также была представлена тревожно-фобическими ситуационными реакциями, не достигавшими уровня паники, провоцировавшимися самыми разными бытовыми обстоятельствами. Это требовало дополнительного курсового назначения анксиолитиков у 6 (17,1%) пациентов.
Все пациенты, принимавшие агомелатин, оставались в ремиссии в течение полугода. После 8 мес ПТ в группе с РД у 1 пациента был отмечен рецидив депрессивной симптоматики. После года приема ПТ только 2 (5,7%) пациента с РД и 3 (7%) пациента с БАР II были в депрессии. Доли пациентов в ремиссии в разные сроки наблюдения представлены на рис. 3. На графике видно, что более 1/2 пациентов
2 групп достигли ремиссии длительностью 2 года.
Основываясь на анализе данных больных, перенесших 3 депрессивных эпизода за период наблюдения, можно сделать вывод о тенденции к увеличению продолжительности ремиссии при длительном приеме агомелатина (рис. 4). Так, в группе пациентов с БАР II, перенесших 2 депрессивных эпизода за период наблюдения, вторая ремиссия по продолжительности превышала первую в среднем на 3,9±1,5 мес. В группе с РД этот показатель увеличился на 3,5±1,8 мес.
На рис. 5. представлена динамика средних показателей по ВАШ для пациентов с БАР II. Показатели ВАШ «качество сна» превышали 90 на всем протяжении наблюдения, в среднем за весь период качество сна составило 95,0±4,5. Дневную активность (ВАШ «дневная активность») пациенты оценивали на уровне 75,4±12,5, что достоверно ниже по сравнению с группой РД. В периоды подъема настроения этот показатель возрастал, достигая у отдельных пациентов уровня 95 пунктов, что свидетельствует в пользу существования представления о «подъеме» как о нормальном, или желаемом, уровне активности у этой группы. Участники исследования, остававшиеся 12 мес и более в ремиссии, сравнивали степень выраженности сезонных колебаний состояния до и во время приема агомелатина (ВАШ «сезонность»). В среднем выраженность сезонных колебаний состояния пациенты оценивали в 73,0±4,5 пункта. Степень общего удовлетворения результатами лечения (ВАШ «общий результат») в среднем за весь период составила 90,0±5,3. Примечательна динамика этого показателя: он увеличивался по мере увеличения периода наблюдения. Свою точность в выполнении рекомендаций врача пациенты оценивали очень высоко (92,1±5,4), несмотря на максимум отказов и обсуждения возможностей отказа в этой группе.
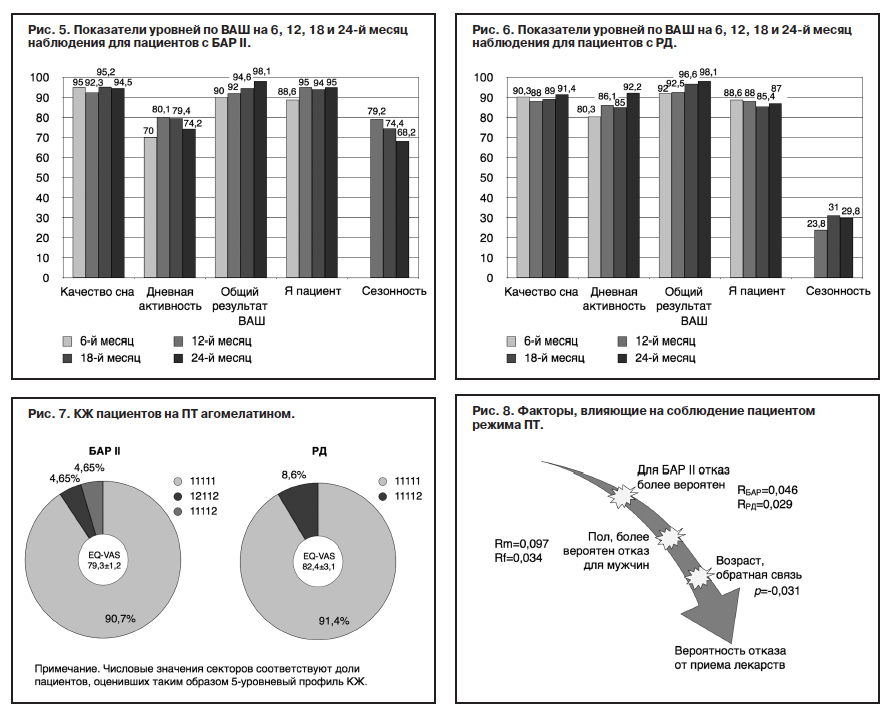
Отдельно был проведен анализ КЖ с использованием EQ-5D-5L. На рис. 7 показано, что в целом все пациенты оценивали свое КЖ по 5-пунктовой системе на первый уровень, т.е. самый высокий: 11111 – у 39 (90,7%) пациентов группы с БАР II и у 32 (91,4%) больных с РД. По EQ-VAS, представляющей собой ВАШ для оценки состояния здоровья на момент осмотра по 100-балльной системе, состояние пациентов с БАР II оценивалось в 79,3±1,2 пункта, а у пациентов с РД – 82,4±3,1. Данные приводятся в среднем за весь период исследования, так как в течение ремиссии у каждого конкретного пациента значимо они не менялись.
О НЯ в виде «какой-то заторможенности», «меньшей креативности, спонтанности» сообщали в разные сроки исследования 3 (8,6%) пациента с РД и 4 (9,3%) пациента с БАР II. Пациенты отмечали, что «это не сонливость, а как-то не так резко и быстро на все реагируешь». Субъективно это было неприятным ощущением. Двое пациентов с БАР II в связи с этим отменяли самовольно прием агомелатина на срок до месяца. В одном случае это привело к рецидиву депрессии, купированному за 4 нед после возобновления приема препарата в дозе 50 мг/сут. В другом случае прием был возобновлен самостоятельно в дозе 25 мг/сут при ощущении минимального ухудшения состояния. Жалоб на половую дисфункцию не было. При целенаправленном расспросе пациенты не отмечали какого-либо отрицательного влияния терапии на либидо, эректильно-эякуляторную функцию и сексуальное удовлетворение.
Был проведен анализ соблюдения режима терапии. Всего 2 пациента с БАР II и 1 пациент с РД самовольно отменяли агомелатин на значимый срок из-за субъективно неприятных ощущений (см. выше). Практически единственной причиной обсуждения перспектив отказа было хорошее самочувствие: 25 (58,1%) пациентов с БАР II и 9 (25,7%) – с РД. Пациенты, длительно чувствовавшие себя вполне здоровыми, при плановых визитах начинали заговаривать о рисках и преимуществах длительного приема 1 таблетки агомелатина на ночь. Однократно упоминалась высокая цена препарата (пациент с БАР II) и высказывались опасения за возможный вред здоровью (1 пациент с РД).
Был установлен риск отказа от ПТ агомелатином для пациентов с БАР II RБАР=0,046 и для пациентов с РД RРД=0,029. Для мужчин риск отказа от ПТ в 3 раза выше, чем для женщин: Rm=0,097, Rf=0,034 (рис. 8). Обнаружена обратная связь между возрастом пациентов и вероятностью отказа от приема ПТ: р=-0,031.
При сопоставлении данных физикального обследования в разные периоды наблюдения не было выявлено влияния агомелатина на массу тела, показатели артериального давления (АД). Показатели общих анализов мочи, крови, биохимических исследований крови (аланинаминотрансфераза, аспартатаминотрасфераза, g-глутамилтрансфераза, уровень билирубина, холестерина, глюкозы крови) также не претерпели значимых изменений.
Заключение
Результаты настоящего исследования свидетельствуют о высокой профилактической эффективности агомелатина как у пациентов с РД, так и с БАР II. При обоих заболеваниях наблюдается сходная тенденция к удлинению периода ремиссии и снижению тяжести и продолжительности очередного депрессивного эпизода. Пациенты 2 групп демонстрируют высокое КЖ в течение ПТ, отличную переносимость терапии, склонность соблюдать режим лечения. Препарат безопасен относительно возникновения НЯ независимо от продолжительности терапии и дозы препарата. На протяжении всего исследования не отмечено клинически значимых проявлений инверсии аффекта у пациентов с БАР II.
Длительная поддерживающая монотерапия агомелатином может быть рекомендована как при БАР II, так и при РД. Комбинированная терапия с ламотриджином показана при недостижении пациентом полной ремиссии в целях стабилизации настроения.
Методы исследования. Обследованы в процессе длительной ПТ (более 24 мес) агомелатином в дозе 25 мг/сут 78 пациентов:
43 – с БАР II, 35 – с РД. Для оценки состояния пациентов использовались клинический метод, психометрические шкалы (HAMD-17, YMRS, CGI), визуальные аналоговые шкалы, шкала оценки качества жизни (КЖ) EQ-5D-5L.
Результаты. Полной ремиссии достигло большинство пациентов: в группе с БАР II – 90,7%, в группе с РД – 82,9%. Средняя продолжительность ремиссии составила 24,5±6,4 мес для РД и 17,4±4,3 мес для БАР II. Вторая ремиссия по продолжительности превышала первую в среднем на 3,9±1,5 мес в группе с БАР II. В группе с РД этот показатель увеличился на 3,5±1,8 мес. Через 12 мес ПТ депрессивный эпизод возник у 5,7% больных с РД и у 7% больных с БАР II. Тяжесть депрессии при БАР II снизилась с 27,1±5,3 в первом приступе до 23,4±3,1 – в третьем при РД, с 25,5±3,5 до 22,5±3,5 соответственно. Отмечены высокие показатели КЖ пациентов: доля профиля 11111 составила 90,7% в группе с БАР II, 91,4% – в группе с РД. Среднее значение EQ-VAS – 79,3±1,2 для БАР II и 82,4±3,1 для РД. На протяжении всего исследования не отмечено клинически значимой инверсии аффекта у пациентов с БАР II. Побочные эффекты регистрировались у 4 (9,3%) пациентов с БАР II и у 3 (8,6%) – с РД. Не было выявлено влияния агомелатина на массу тела, половую функцию, показатели артериального давления. Риск отказа от ПТ агомелатином пациентов с БАР II RБАР=0,046 и для РД RРД=0,029. У мужчин риск отказа от ПТ в 3 раза выше, чем у женщин: Rm=0,097, Rf=0,034.
Заключение: Длительная поддерживающая монотерапия агомелатином может быть рекомендована как при БАР II, так и при РД. Комбинированная терапия ламотриджином показана при недостижении пациентом полной ремиссии в целях стабилизации настроения.
Ключевые слова: агомелатин, биполярное аффективное расстройство, рекуррентная депрессия, поддерживающая терапия.
Efficiency of agomelatine (Valdoxan) maintenance therapy in recurrent depression
and bipolar affective disorder
N.A.Tyuvina, V.N.Smirnova
I.M.Sechenov First Moscow State Medical University, Ministry of Health of the Russian Federation
Summary. Objective: to compare the efficacy and tolerability of agomelatine during long-term maintenance therapy (MT) in patients with recurrent depression (RD) and bipolar affective disorder II (BAD II) according to the DSM-IV-R.
Methods. Seventy-eight patients, including 43 with BAD II and 35 with RD, were examined during long-term (more than 24-month) MT with agomelatine 25 mg/day. To evaluate the patients’ status, the investigators used physical examination and psychometric (HAMD-17, YMRS, and CGI), visual analogue, and quality of life – QL (EQ-5D-5L) scales.
Results. Complete remission was achieved in the majority of patients (90,7 and 82,9% in the BAD II and RD groups, respectively). The remission duration averaged 24,5±6,4 months for RD and 17,4±4,3 months for BAD II. The second remission lasted an average of 3,9±1,5 months longer in the BAD II group. In the RD group, this indicator increased by 3,5±1,8 months. Twelve months following MT, a depressive episode occurred in 5,7 and 7% of the patients with RD and BAD II, respectively. The depression severity decreased from 27,1±5,3 to 23,4±3,1 in the first episode in BAD II and from 25,5±3,5 to 22,5±3,5 in the third episode in RD. The patients exhibited high QL indicators: the proportion of the 11111 profile was 90,7 and 91,4% in the BAD II and RD groups, respectively. The mean EQ-VAS value was 79,3±1,2 for BAD II and 82,4±3,1 for RD. Throughout the investigation, no clinical significant affect inversion was noted in patients with BAD II. Side effects were recorded in 4 (9,3%) and 3 (8,6%) patients with BAD II and RD, respectively. Agomelatine was ascertained to have no effect on body weight, sexual function, or blood pressure. The risk for agomelatine MT refusal was as follows: BAD IIR=0,046 and RDR=0,029. In the males, the risk of MT refusal was 3 times higher than in the females (Rm=0,097, Rf=0,034).
Conclusion. Long-term agomelatine maintenance monotherapy may be recommended for both BAD II and RD. Combination therapy with lamotrigine is indicated to stabilize mood if the patient fails to achieve complete remission.
Key words: agomelatine, bipolar affective disorder, recurrent depression, maintenance therapy.
В современных наиболее часто употребляемых классификациях закреплено разделение рекуррентного депрессивного расстройства (РДР) и биполярного аффективного расстройства (БАР) [13, 33]. В последние десятилетия все большую популярность приобретает концепция, отделяющая РДР от спектра биполярных расстройств по целому ряду патогенетических и клинических показателей, что связано как с анализом накопленного клинического материала, так и с успехами биологических исследований [8].
Наряду с этим в литературе описана возможность перехода от монополярного к биполярному течению [9, 11]. Около 20% рекуррентных депрессий (РД) трансформируется в биполярный вариант аффективного расстройства. Самостоятельное существование маниакального униполярного расстройства считается маловероятным, а частота последующих депрессивных и смешанных эпизодов повышается с возрастом [10].
У мужчин БАР начинается раньше, чем у женщин [15], при этом первой фазой у них чаще бывает маниакальная, а у женщин – депрессивная [26]. В течение болезни эта зависимость сохраняется: доля маниакальных эпизодов у мужчин больше, чем у женщин [29]. У женщин манифестация заболевания часто связана с менструально-генеративной функцией и периодами гормональной перестройки в организме (пубертат, послеродовой период, климактерий) [4].
Несмотря на то что присутствие гипоманиакальных/маниакальных эпизодов является ключевым феноменом в клинике БАР, большую часть времени эти больные проводят именно в депрессивном состоянии [25]. Возможно, этим объясняется то, что БАР II чаще диагностируется у женщин, а БАР I одинаково часто встречается как у женщин, так и у мужчин [23]. Соответственно, чем дольше клинически выраженная мания не попадает в поле зрения врача, тем дольше эти пациенты (чаще женщины) будут получать тактически неверное лечение.
Предотвращение очередного приступа/рецидива и БАР, и РД является основной задачей поддерживающей терапии (ПТ). Соблюдение режима назначенной ПТ, очевидно, является основным условием успешной профилактики. Проблеме вовлечения пациентов в долгосрочные профилактические программы посвящено достаточно много работ. Около 1/2 пациентов не придерживаются назначенного лечения (nonadherent), другая 1/2 придерживается частично (partially adherent) [32]. По другим данным, процент несоблюдения режима ПТ среди пациентов с БАР варьирует в пределах от 12 до 64% [16]. Наиболее частые причины отказа от длительного лечения: увеличение массы тела, излишняя седация, плохая совместимость с оральными контрацептивами, молодой возраст и низкий уровень образования [35]. Исходя из этого, следует заключить, что дополнительными задачами и целями ПТ должно быть повышение приверженности лечению, поддержание удовлетворительного качества жизни (КЖ), минимизация риска нежелательных явлений (НЯ).
Эффективность, необходимость и безопасность применения антидепрессантов при БАР является одним из наиболее дискутируемых в литературе вопросов на протяжении нескольких десятков лет. Их эффективность при РД как для купирующей, так и для профилактической терапии не подвергается сомнению, несмотря на явную генетическую и этиопатогенетическую близость этих заболеваний.
Рекомендации Британской ассоциации психофармакологов говорят о необходимости комбинации селективных ингибиторов обратного захвата серотонина (СИОЗС) и противоманиакальных препаратов (литий, вальпроаты, атипичные нейролептики) при любой тяжести депрессии с самого начала терапии [22]. Эксперты Американской ассоциации психиатров считают литий и ламотриджин препаратами 1-й линии для непсихотических биполярных депрессий. Дополнительное назначение антидепрессантов рекомендовано только в случаях очень тяжелой депрессии [20, 21].
Канадские рекомендации (CANMAT guidelines) по лечению биполярной депрессии при БАР I сходны с первыми двумя. Препаратом 1-й линии при депрессии в рамках
БАР II эти авторы считают кветиапин, эффективность и хорошая переносимость которого подтверждена многими исследованиями [18]. Комбинированная терапия нормотимиками и антидепрессантами рекомендуется при его неэффективности. Монотерапия антидепрессантами рассматривается экспертами ISBD и CANMAT [18, 19] как возможный вариант лечения для особой группы пациентов – с редкими гипоманиями, как правило, не приводящими к проблемам в социальном или медицинском понимании.
С введением в клиническую практику антидепрессантов было замечено, что назначение трициклических антидепрессантов (ТЦА) опасно в плане развития мании или перехода заболевания к быстроциклическому варианту течения [12]. По данным T.Wehr и соавт. [34], вероятность причинной связи между развитием быстрых циклов в популяции пациентов с БАР и назначением ТЦА составляет 20%. Большое количество исследований убедительно показывает эффективность и безопасность краткосрочной комбинированной терапии (нормотимик + антидепрессант) депрессии как в рамках БАР I, так и БАР II.
В ряде работ показано, что СИОЗС, венлафаксин и бупропион могут применяться при БАР II как стабилизаторы настроения при ПТ, так как монотерапия этими препаратами заметно эффективнее плацебо, но и не более опасна в плане развития расстройства противоположного полюса [6, 7, 14, 30]. Сравнения в этих исследованиях проводились с нормотимиками и комбинированной терапией. Это позволяет говорить о необходимости дифференцированного подхода к терапии БАР, учитывающего особенности течения болезни у каждого отдельного пациента.
Современные исследования все больше подтверждают, что нарушениями в моноаминергической системе нельзя полностью объяснить все наблюдаемые клинические феномены расстройств настроения и эффективность разных по механизму действия препаратов, применяемых для их лечения [28]. Теоретически нарушение биологических ритмов, в частности циркадианных, может быть центральным звеном в этиопатогенезе разных вариантов депрессий [24, 27, 31].
Агомелатин, недавно вошедший в клиническую практику, является агонистом мелатонинергических рецепторов МТ1- и МТ2- и антагонистом серотониновых 5НТ2С-рецепторов. Механизм его действия объединяют нейроэндокринные и моноаминергические взаимодействия. За счет антагонизма к 5НТ2C-рецепторам он повышает уровень норадреналина и дофамина в префронтальной коре, а стимуляция мелатониновой системы усиливает антидепрессивный эффект, так как восстанавливает нарушенные циркадианные ритмы, повышает стрессоустойчивость и регулирует сон.
Агомелатин не повышает внеклеточный уровень серотонина, в связи с чем не вызывает побочных эффектов, свойственных СИОЗС (тошнота, диарея, половые дисфункции, диссомния). Кроме того, этот препарат не обладает аффинитетом к гистаминергическим Н1-, a1-адренергическим и мускариновым рецепторам, поэтому не имеет побочных эффектов, характерных для ТЦА [1–3, 17]. Опыт применения агомелатина при БАР крайне ограничен. Нами было проведено сравнительное исследование эффективности агомелатина для купирования депрессивного приступа в рамках РД и БАР [5]. В ходе этого исследования было показано, что данный препарат абсолютно безопасен относительно возникновения НЯ, риска инверсии фазы и/или возникновения транзиторной гипомании, что позволяет использовать его не только для купирующей, но и длительной ПТ, в том числе при БАР.
Полученные данные свидетельствуют о быстром и достаточно выраженном антидепрессивном эффекте агомелатина, проявляющимся с 1-й недели терапии одновременно с нормализацией циркадианных ритмов. Результаты исследования позволили предположить, что при БАР I в отличие от БАР II более эффективно использование агомелатина в сочетании с нормотимиками (вальпроаты и ламотриджин). При анализе имеющихся литературных данных не было обнаружено работ, описывавших эффекты от длительной ПТ агомелатином как при РД, так и при БАР.
Цель исследования – сравнение эффективности и переносимости агомелатина на этапе ПТ у пациентов с РДР и БАР II типа.
Исследование проводилось в амбулаторных и стационарных условиях на базе Университетской клинической больницы №3 (Клиника психиатрии им. С.С.Корсакова) Первого МГМУ им. И.М.Сеченова с 2009 по 2013 г.
Критерии включения: наличие ремиссии после купирования депрессивного эпизода агомелатином в рамках БАР II или РД; возраст старше 18 лет; добровольное информированное согласие пациента на участие в исследовании, подразумевающее согласие пациента на продолжение приема агомелатина для профилактики рецидива заболевания и согласие на регулярные беседы по телефону и/или через онлайн-средства коммуникации с исследователем, на визиты в случае приглашения.
Критерии исключения: наличие шизофрении, органических психических нарушений; пациенты с БАР I; наличие хронических соматических заболеваний, препятствующих обследованию пациентов; наличие суицидальных тенденций; возраст моложе 18 лет; отказ от участия в исследовании.
Схема исследования представлена в табл. 1.

Эффективность ПТ определяется в первую очередь продолжительностью и КЖ, продолжительностью, степенью тяжести и частотой рецидивов, КЖ пациентов в ремиссии. В немалой степени имеет значение влияние терапии на повседневную социальную активность, сочетаемость с привычным образом жизни и распорядком дня всех действий, которые необходимо предпринимать для соблюдения ПТ.
 Оценка эффективности и переносимости терапии проводилась клиническим методом с использованием психометрических инструментов для подтверждения продолжающейся ремиссии: 17-пунктовой шкалы депрессии Гамильтона (HAMD-17), шкалы мании Янга (YMRS), шкалы оценки общего клинического впечатления для оценки тяжести заболевания (CGI-S) и улучшения (CGI-I). Критериями состояния ремиссии являлось отсутствие признаков развития депрессии как по клиническим проявлениям, так и психометрическим оценкам. Развитие гипоманиакального состояния считалось очередным рецидивом в том случае, если приводило к декомпенсации коморбидных заболеваний и социальной дезадаптации.
Оценка эффективности и переносимости терапии проводилась клиническим методом с использованием психометрических инструментов для подтверждения продолжающейся ремиссии: 17-пунктовой шкалы депрессии Гамильтона (HAMD-17), шкалы мании Янга (YMRS), шкалы оценки общего клинического впечатления для оценки тяжести заболевания (CGI-S) и улучшения (CGI-I). Критериями состояния ремиссии являлось отсутствие признаков развития депрессии как по клиническим проявлениям, так и психометрическим оценкам. Развитие гипоманиакального состояния считалось очередным рецидивом в том случае, если приводило к декомпенсации коморбидных заболеваний и социальной дезадаптации.
ля представления субъективных оценок пациентов в обобщаемом виде использовались визуальные аналоговые шкалы (ВАШ). Отдельно исследовалось влияние агомелатина на качество сна (ВАШ «качество сна»), дневную активность (ВАШ «дневная активность»). Участники исследования, остававшиеся 12 мес и более в ремиссии, сравнивали степень выраженности сезонных колебаний состояния до и во время приема агомелатина (ВАШ «сезонность»). Регистрировалась степень общего удовлетворения результатами лечения (ВАШ «общий результат»), пациентам предлагалось оценить свою точность по выполнению рекомендаций врача по приему ПТ (ВАШ «я пациент»). Пациентам при осмотре предлагались распечатанные на листе формата А4 подписанные шкалы с делениями от 0 до 100, давалась инструкция отметить уровень своей оценки каждого из этих параметров на соответствующей шкале.
Возникновение НЯ фиксировалось отдельно в течение всего периода исследования.
Для получения сопоставляемых и обобщаемых результатов по КЖ пациентов был использован опросник EQ-5D-5L.
Статистическая обработка материала проводилась с использованием программы Microsoft Office Excel 2003.
Конечная выборка для оценки эффективности агомелатина составила 78 наблюдений. Из них 43 – с БАР II (по DSM-IV-R,) и 35 – с РД. Соотношение мужчин и женщин в 2 группах достоверно не различалось, средний возраст на момент включения в исследование также не отличался (43,3±5,7 и 42,4±7,3 года). Средний возраст начала заболевания был достоверно ниже в группе пациентов с БАР (28,3±4,8 против 36,9±7,9 года). В группе с БАР II преобладали пациенты с тяжелыми депрессивными приступами в анамнезе: 24 (55,8%) против 6 (17,1%) пациентов. Тяжелые депрессии в группе с БАР чаще наблюдались у пациентов с гипертимным преморбидом, а при РД – с тревожным. аким образом, обе выборки достоверно различались по возрасту начала заболевания, соотношениям разных типов личности в преморбидном состоянии и степени тяжести депрессии в течение заболевания. Обе группы не имели достоверных различий по основным социодемографическим характеристикам (табл. 2), в том числе по среднему возрасту включения в исследование.
Лечение агомелатином проводилось на протяжении всего периода наблюдения. В ремиссии препарат назначался в дозе 25 мг/сут, при обострении состояния доза увеличивалась до 50 мг/сут. На всем протяжении исследования допускалось кратковременное использование транквилизаторов в случаях выраженных тревожных реакций и антиконвульсантов – при неполных ремиссиях.
Основные результаты исследования представлены в табл. 3. Длительность лечения агомелатином до наступления ремиссии достоверно не различалась в 2 группах (рис. 1). Она составила в среднем 6,4±1,5 нед для БАР II, 6,8±1,7 нед для РД (р<0,05). Были сопоставлены данные о лечении 3 последовательных эпизодов депрессии у 30 пациентов с РД и 35 с БАР II, принимавших агомелатин с 2009–2010 гг. Обнаружена динамика снижения не только продолжительности эпизода до наступления ремиссии, но и снижения тяжести каждого последующего приступа (рис. 2). Средний балл по HAMD-17 в группе с БАР II был выше, чем в группе с РД (27,1±5,3 для БАР и 25,5±3,5 для РД, р<0,005) при первичном обращении по поводу депрессии. Третий эпизод все пациенты перенесли в амбулаторных условиях. Средний балл по HAMD-17 в группе с БАР составил 23,4±3,1, в группе с РД – 22,5±3,5, что достоверно ниже, чем во время первого эпизода. Никому не потребовалось оформление временной нетрудоспособности.

Полной ремиссии достигло большинство пациентов: в группе с БАР II – 90,7%, в группе с РД – 82,9%. В случае неполной ремиссии в группе с БАР II остаточная симптоматика была представлена упорно сохраняющимися суточными колебаниями состояния. Эти пациенты продолжали жаловаться на сохраняющуюся вялость, апатичность в утренние часы при полном благополучии в дневное и вечернее время. Например, один из пациентов с БАР II (мужчина 30 лет), несмотря на отличный карьерный рост, семью, удачную защиту кандидатской диссертации, продолжал сообщать о сохраняющихся приступах утренней тошноты, сопровождающихся мыслями о собственной «недоразвитости, ущербности». Через 1–2 ч после пробуждения эти явления неизменно проходили и пациент продолжал вести активную социальную жизнь. Подобные колебания состояния являлись показанием для дополнительного назначения стабилизаторов настроения (ламотриджина). Спустя несколько недель приема 2 препаратов выраженность и частота утренних ухудшений обычно снижалась. Эта же закономерность повторялась у остальных пациентов с сохраняющимися суточными колебаниями состояния.

При неполной ремиссии при РД остаточная симптоматика также была представлена тревожно-фобическими ситуационными реакциями, не достигавшими уровня паники, провоцировавшимися самыми разными бытовыми обстоятельствами. Это требовало дополнительного курсового назначения анксиолитиков у 6 (17,1%) пациентов.
Все пациенты, принимавшие агомелатин, оставались в ремиссии в течение полугода. После 8 мес ПТ в группе с РД у 1 пациента был отмечен рецидив депрессивной симптоматики. После года приема ПТ только 2 (5,7%) пациента с РД и 3 (7%) пациента с БАР II были в депрессии. Доли пациентов в ремиссии в разные сроки наблюдения представлены на рис. 3. На графике видно, что более 1/2 пациентов
2 групп достигли ремиссии длительностью 2 года.
Основываясь на анализе данных больных, перенесших 3 депрессивных эпизода за период наблюдения, можно сделать вывод о тенденции к увеличению продолжительности ремиссии при длительном приеме агомелатина (рис. 4). Так, в группе пациентов с БАР II, перенесших 2 депрессивных эпизода за период наблюдения, вторая ремиссия по продолжительности превышала первую в среднем на 3,9±1,5 мес. В группе с РД этот показатель увеличился на 3,5±1,8 мес.
На рис. 5. представлена динамика средних показателей по ВАШ для пациентов с БАР II. Показатели ВАШ «качество сна» превышали 90 на всем протяжении наблюдения, в среднем за весь период качество сна составило 95,0±4,5. Дневную активность (ВАШ «дневная активность») пациенты оценивали на уровне 75,4±12,5, что достоверно ниже по сравнению с группой РД. В периоды подъема настроения этот показатель возрастал, достигая у отдельных пациентов уровня 95 пунктов, что свидетельствует в пользу существования представления о «подъеме» как о нормальном, или желаемом, уровне активности у этой группы. Участники исследования, остававшиеся 12 мес и более в ремиссии, сравнивали степень выраженности сезонных колебаний состояния до и во время приема агомелатина (ВАШ «сезонность»). В среднем выраженность сезонных колебаний состояния пациенты оценивали в 73,0±4,5 пункта. Степень общего удовлетворения результатами лечения (ВАШ «общий результат») в среднем за весь период составила 90,0±5,3. Примечательна динамика этого показателя: он увеличивался по мере увеличения периода наблюдения. Свою точность в выполнении рекомендаций врача пациенты оценивали очень высоко (92,1±5,4), несмотря на максимум отказов и обсуждения возможностей отказа в этой группе.

Отдельно был проведен анализ КЖ с использованием EQ-5D-5L. На рис. 7 показано, что в целом все пациенты оценивали свое КЖ по 5-пунктовой системе на первый уровень, т.е. самый высокий: 11111 – у 39 (90,7%) пациентов группы с БАР II и у 32 (91,4%) больных с РД. По EQ-VAS, представляющей собой ВАШ для оценки состояния здоровья на момент осмотра по 100-балльной системе, состояние пациентов с БАР II оценивалось в 79,3±1,2 пункта, а у пациентов с РД – 82,4±3,1. Данные приводятся в среднем за весь период исследования, так как в течение ремиссии у каждого конкретного пациента значимо они не менялись.
О НЯ в виде «какой-то заторможенности», «меньшей креативности, спонтанности» сообщали в разные сроки исследования 3 (8,6%) пациента с РД и 4 (9,3%) пациента с БАР II. Пациенты отмечали, что «это не сонливость, а как-то не так резко и быстро на все реагируешь». Субъективно это было неприятным ощущением. Двое пациентов с БАР II в связи с этим отменяли самовольно прием агомелатина на срок до месяца. В одном случае это привело к рецидиву депрессии, купированному за 4 нед после возобновления приема препарата в дозе 50 мг/сут. В другом случае прием был возобновлен самостоятельно в дозе 25 мг/сут при ощущении минимального ухудшения состояния. Жалоб на половую дисфункцию не было. При целенаправленном расспросе пациенты не отмечали какого-либо отрицательного влияния терапии на либидо, эректильно-эякуляторную функцию и сексуальное удовлетворение.
Был проведен анализ соблюдения режима терапии. Всего 2 пациента с БАР II и 1 пациент с РД самовольно отменяли агомелатин на значимый срок из-за субъективно неприятных ощущений (см. выше). Практически единственной причиной обсуждения перспектив отказа было хорошее самочувствие: 25 (58,1%) пациентов с БАР II и 9 (25,7%) – с РД. Пациенты, длительно чувствовавшие себя вполне здоровыми, при плановых визитах начинали заговаривать о рисках и преимуществах длительного приема 1 таблетки агомелатина на ночь. Однократно упоминалась высокая цена препарата (пациент с БАР II) и высказывались опасения за возможный вред здоровью (1 пациент с РД).
Был установлен риск отказа от ПТ агомелатином для пациентов с БАР II RБАР=0,046 и для пациентов с РД RРД=0,029. Для мужчин риск отказа от ПТ в 3 раза выше, чем для женщин: Rm=0,097, Rf=0,034 (рис. 8). Обнаружена обратная связь между возрастом пациентов и вероятностью отказа от приема ПТ: р=-0,031.
При сопоставлении данных физикального обследования в разные периоды наблюдения не было выявлено влияния агомелатина на массу тела, показатели артериального давления (АД). Показатели общих анализов мочи, крови, биохимических исследований крови (аланинаминотрансфераза, аспартатаминотрасфераза, g-глутамилтрансфераза, уровень билирубина, холестерина, глюкозы крови) также не претерпели значимых изменений.
Заключение
Результаты настоящего исследования свидетельствуют о высокой профилактической эффективности агомелатина как у пациентов с РД, так и с БАР II. При обоих заболеваниях наблюдается сходная тенденция к удлинению периода ремиссии и снижению тяжести и продолжительности очередного депрессивного эпизода. Пациенты 2 групп демонстрируют высокое КЖ в течение ПТ, отличную переносимость терапии, склонность соблюдать режим лечения. Препарат безопасен относительно возникновения НЯ независимо от продолжительности терапии и дозы препарата. На протяжении всего исследования не отмечено клинически значимых проявлений инверсии аффекта у пациентов с БАР II.
Длительная поддерживающая монотерапия агомелатином может быть рекомендована как при БАР II, так и при РД. Комбинированная терапия с ламотриджином показана при недостижении пациентом полной ремиссии в целях стабилизации настроения.
Список исп. литературыСкрыть список1. Иванов С.В. Вальдоксан (агомелатин) при терапии умеренных и тяжелых депрессий непсихотического уровня в амбулаторной и госпитальной практике. Психиатр. и психофармакотер. 2009; 6: 15–9.
2. Иванов С.В. Вальдоксан в терапии биполярной депрессии: результаты российского многоцентрового натуралистического исследования ХРОНОС. Обозрение психиатрии и мед. психологии им. В.М.Бехтерева. 2011; 2: 26–30.
3. Смулевич А.Б., Андрющенко А.В., Бескова Д.А. Результаты исследования РИТМ: терапия непсихотической депрессии Вальдоксаном. Психиатр. и психофармакотер. 2010; 4: 4–12.
4. Тювина Н.А. Психические нарушения у женщин в период климактерия. М.: Крон-пресс, 1996.
5. Тювина Н.А., Смирнова В.Н. Сравнительная оценка агомелатина (Вальдоксана) при рекуррентной депрессии и биполярном аффективном расстройстве. Журн. неврол. и психиатр. им. С.С.Корсакова. 2012; 11: 53–60.
6. Aaronson S, Zuzarte E, Sklar J, Sklar M. Lamotrigine monotherapy with and without bupropion in the treatment of bipolar II depression. New Research Abstracts, Annual Meeting of the American Psychiatric Association. Washington DC. American Psychiatric Association 2008.
7. Agosti V, Stewart JW. Efficacy and safety of antidepressant monotherapy in the treatment of bipolar II depression. Int Clin Psychopharmacol 2007; 22: 309–11.
8. Akiskal HS, Pinto O. The evolving bipolar spectrum: prototypes I, II, III and IV. Psychiat Clin North Am 1999; 22: 517–34.
9. Akiskal HS. Dysthymia and cyclothymia in psychiatric practice a century after Kraepelin. J Affect Dis 2001; 62: 17–31.
10. Akiskal HS, Khani MK, Scott-Strauss A. Cyclothymic temperamental disorders. Psychiat Clin North Am 1979; 2: 527–54.
11. Alloy BL, Urošević S, Abramson LY et al. Progression along the bipolar spectrum: a longitudinal study of predictors of conversion from bipolar spectrum conditions to bipolar I and II disorders. J Abnorm Psychol 2012; 121 (1): 16–27.
12. Altshuler LL, Post RM, Leverich GS et al. Antidepressant-induced mania and cycle acceleration: a controversy revisited. Am J Psychiat 1995; 152: 1130–8.
13. American Psychiatric Association Diagnostic and Statistical Manual of Mental Disorder. 4th ed. Text revision: DSM-IV-TR. Washington DC: American Psychiatric Publishing Inc 2000.
14. Amsterdam JD, Shults J. Comparison of short-term venlafaxine vs lithium monotherapy for bipolar II major depressive episode: a randomized open-label study. J Clin Psychopharmacol 2008; 28: 171–81.
15. Arnold LM. Gender differences in bipolar disorder. Psychiat Clin N Am 2003; 26 (3): 595–620.
16. Baldessarini R, Henk H, Sklar A et al. Psychotropic medications for patients with bipolar disorder in the US: polytherapy and adherence. Psychiat Serv 2008; 59: 1175–83.
17. Calabrese JR, Guelfi JD, Perdrizet-Chevallier C. Agomelatine adjunctive therapy for acute bipolar depression: preliminary open data. Bipolar Dis 2007; 9 (6): 628–35.
18. Canadian Network for Mood and Anxiety Treatments (CANMAT) and International Society for Bipolar Disorders (ISBD) collaborative update of CANMAT guidelines for the management of patients with bipolar disorder. Bipolar Dis 2009; 11: 225–55.
19. Fountoulakis KN, Vieta E, Sanchez-Moreno J et al. Treatment guidelines for bipolar disorder: a critical review. J Affect Dis 2005; 86: 1–10.
20. Frances A, Docherty J, Kahn D. The expert consensus guideline series: treatment of bipolar disorder. J Clin Psychiat 1996; 57: 1–88.
21. Frances AJ, Kahn DA, Carpenter D et al. The expert consensus guidelines for treating depression in bipolar disorder. J Clin Psychiat 1998.
22. Goodwin GM. Evidence-based guidelines for treating bipolar disorder: recommendations from the British Association for Psychopharmacology. J Psychopharmacol 2003; 17: 149–73.
23. Grunze H. The clinical side of bipolar disorders. Pharmacopsychiat 2011; 44 (Suppl. 1): s43–8.
24. Joiner TE Jr, Steer RA, Beck AT et al. Physiological hyper arousal: construct validity of a central aspect of the tripartite model of depression and anxiety. J Abnorm Psychol 1999; 108 (2): 290–8.
25. Judd LL, Akiskal HS, Schlettler PJ et al. A prospective investigation of the natural history of the long-term weekly symptomatic status of bipolar II disorder. Arch Gen Psychiat 2003; 60: 261–9.
26. Kawa I, Carter JD, Joyce PR et al. Gender differences in bipolar disorder: age at onset, course, comorbidity, and symptom presentation. Bipolar Dis 2005; 7 (2): 119–25.
27. McClung CA. Circadian genes, rhythms and the biology of mood disorders. Pharmacol Ther 2007; 114 (2): 222–32.
28. Mendlewicz J. Disruption of the circadian timing systems. Molecular mechanisms in mood disorders. CNS Drugs 2009; 23: 15–26.
29. Miguel L, Roncero C, López-Ortiz C, Casas M. Epidemiological and diagnostic axis I gender differences in dual diagnosis patients. Adicciones 2011; 23 (2): 165–72.
30. Parker G, Tully L, Olley A, Hadzi-Pavlovic D. SSRIs as mood stabilizers for bipolar II disorder? A proof of concept study. J Affect Dis 2006; 92: 205–14.
31. Riemann D, Voderholzer U. Primary insomnia: a risk factor to develop depression? J Affect Dis 2003; 76 (1–3): 255–9.
32. Sajatovic M, Valenstein M, Blow FC et al. Treatment adherence with antipsychotic medications in bipolar disorder. Bipolar Dis 2006; 8: 232–1.
33. The ICD-10 classification of mental and behavioral disorders: clinical descriptions and diagnostic guidelines. World Health Organization. Geneva 1992.
34. Wehr TA, Sack DA, Rosenthal NE, Cowdry RW. Rapid cycling affective disorder: сontributing factors and treatment responses in 51 patients. Am J Psychiat 1988; 145: 179–84.
35. Yen CF, Cheng CP, Huang CF et al. Quality of life and its association with insight, adverse effects of medication and use of atypical antipsychotics in patients with bipolar disorder and schizophrenia in remission. Bipolar Dis 2008; 10: 617–24.

