Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03 2010
Перспективы использования мелатонинергических препаратов в терапии депрессий у пациентов с сердечно-сосудистыми заболеваниями №03 2010
Номера страниц в выпуске:17-22
Распространенность депрессивных расстройств в населении стран Европы и США достигает 5–10%. При этом данные разных авторов указывают на то, что у пациентов, наблюдающихся в учреждениях общей соматической сети, и особенно у больных сердечно-сосудистыми заболеваниями (ССЗ) депрессии выявляются в несколько раз чаще: встречаемость депрессивных состояний среди этого контингента достигает 20–45%
Распространенность депрессивных расстройств в населении стран Европы и США достигает 5–10% [28, 74]. При этом данные разных авторов указывают на то, что у пациентов, наблюдающихся в учреждениях общей соматической сети, и особенно у больных сердечно-сосудистыми заболеваниями (ССЗ) депрессии выявляются в несколько раз чаще [16, 53, 66]: встречаемость депрессивных состояний среди этого контингента достигает 20–45% [16, 55, 66]. При этом наибольший риск выявления аффективных расстройств отмечен у больных с хронической кардиологической патологией. Так, исследователи указывают на то, что частота депрессивных состояний среди госпитализированных больных с ишемической болезнью сердца (ИБС) составляет около 31% [71]. Предполагается, что этот показатель может быть и больше, с учетом еще 10–15% пациентов с субсиндромальными и маскированными формами гипотимии [66, 67].
О высокой частоте коморбидности депрессий и кардиологических заболеваний свидетельствуют и данные отечественных авторов. Согласно обобщенным результатам нескольких исследований среди больных ИБС, наблюдающихся у кардиологов, доля пациентов с расстройствами депрессивного спектра, характеризующимися 18 баллами и более по шкале CES-D, достигает 55,7%. Достаточно велика и доля пациентов с психопатологически завершенными депрессивными состояниями – 33,1% [1, 2, 14].
Результаты клинико-эпидемиологического исследования «КОМПАС» по изучению депрессий среди пациентов общей соматической сети показали, что депрессивные расстройства при ССЗ диагностируются более чем в половине наблюдений. Самый высокий показатель отмечен при хронической сердечной недостаточности (ХСН) – 61%; артериальной гипертензии (АГ) – 52%; при ИБС – 34% [6]. В диссертационной работе Т.В.Довженко (2008 г.) приводит собственные данные о наибольшей частоте и выраженности гипотимии у больных ИБС – 96% наблюдений, в то время как «тревожно-депрессивные опасения» неблагоприятного исхода болезни зарегистрированы у 98,6% пациентов с АГ и ИБС и у 89,6% с ХСН [4].
Столь различные показатели встречаемости депрессий отчасти, по-видимому, объясняются отсутствием единых подходов к диагностике. Следует отметить, что наряду с типичными проявлениями депрессивных расстройств (гипотимия, тоска, тревога и др.), диагностика которых не вызывает значительных затруднений, часть депрессий, выявляемых в кардиологии, относится к стертым, маскированным формам (ларвированные, скрытые, алекситимические депрессии, тимопатические эквиваленты).
При маскированных депрессиях [40] основные депрессивные проявления не достигают полной психопатологической завершенности (гипотимия, психомоторные расстройства, идеи виновности и т.п.), а часть из них вовсе отсутствует («субсиндромальные депрессии» [38]). В ряде случаев собственно аффективные расстройства отступают на второй план, а в клинической картине представлены в основном невротические и соматовегетативные симптомы, имитирующие или амплифицирующие симптоматику ССЗ, квалификация которых в качестве патологии аффективной сферы требует уточнения [69].
По признаку доминирующих феноменов выделяют различные варианты «масок» атипичных депрессий: в форме психопатологических (сенсопатические, тревожные, обсессивно-компульсивные, ипохондрические и др.) и патохарактерологических (импульсивность, расстройства влечений, истерические реакции и т.п.) расстройств. При этом одним, иногда единственным, из наиболее значимых дифференциальных признаков депрессии у этих пациентов является нарушение суточного (циркадианный) ритма [8, 26, 73, 75]. Ритмические изменения наблюдаются у 98% пациентов с депрессиями и проявляются не только нарушением физиологических функций (цикл сон–бодрствование), но и изменением выраженности депрессивной симптоматики в течение дня [8].
Значение депрессивных состояний, коморбидных ССЗ, определяется не только их высокой распространенностью. По данным ВОЗ, при сохранении существующих демографических тенденций к 2020 г. ССЗ и депрессии займут соответственно первое и второе место по числу лет сокращения полноценной жизни в связи с инвалидностью [3].
Кроме того, депрессия и ССЗ находятся в реципрокных соотношениях: каждое из них утяжеляет течение другого. Например, обострение ИБС или гипертонической болезни может провоцировать наступление очередной депрессивной фазы [16]. В свою очередь депрессии рассматриваются как независимый фактор риска развития, неблагоприятного течения и исхода кардиоваскулярных заболеваний, а также смертности от коронарной патологии [16, 22]. В многолетнем контролируемом исследовании J.Barefoot, M.Schroll (1996 г.) установлено, что риск заболеть ИБС у пациентов с депрессией в 2 раза превышает таковой у лиц без сопутствующей гипотимии. По данным F.Lesperance (2002 г.), 27,5% больных, перенесших инфаркт миокарда, имели по крайней мере один эпизод выраженной депрессии до его развития; 7,7% перенесли депрессивный эпизод в течение года до его возникновения; у 31,5% депрессия развилась в стационаре либо в течение года после инфаркта миокарда. Отмечено также, что затяжное течение аффективного заболевания с неполными ремиссиями даже при сравнительно неглубоком уровне психопатологических проявлений существенно повышает суицидальный риск.
Наконец, депрессия, усложняя клиническую картину ССЗ и затрудняя их диагностику, отрицательно коррелирует с показателями качества жизни, комплаентности и адаптационных возможностей пациентов, что связано с отказом следовать рекомендациям врача, усилением зависимости от табакокурения, недооценкой методов кардиореабилитации и т.п. [13, 21, 77].
Таким образом, важное клиническое, терапевтическое и прогностическое значение у больных ССЗ имеет своевременное выявление и адекватная психофармакотерапия депрессивных состояний. Приведенные данные указывают на необходимость обоснованного подбора антидепрессивной терапии, направленной на купирование и профилактику проявлений депрессии у пациентов с сердечно-сосудистой патологией.
Препаратами выбора в кардиологической клинике являются антидепрессанты последних поколений. Преимуществом появления большого количества новых тимолептиков, значительно отличающихся по своим свойствам, является возможность подбора препарата, наиболее соответствующего не только психопатологическим особенностям депрессии, но и сопутствующей кардиальной патологии и соматотропной терапии. При этом на первый план выдвигаются характеристики тимолептика, связанные с его переносимостью и безопасностью.
Согласно результатам многочисленных исследований в последние десятилетия препаратами выбора в терапии аффективных расстройств у больных кардиологического профиля являются антидепрессанты из группы селективных ингибиторов обратного захвата серотонина
(СИОЗС) и двойного действия – ингибиторы обратного захвата серотонина и норадреналина (ИОЗСН) [5, 9–11, 14–16, 18, 70]. В то же время, несмотря на сравнимую с полициклическими антидепрессантами эффективность, их использование сопряжено с широким спектром нежелательных, в том числе кардиотропных, эффектов и лекарственных взаимодействий с соматотропными препаратами.
Так, в литературе встречаются упоминания о способности различных СИОЗС приводить к развитию фибрилляции предсердий [27], удлинению интервала QT [35, 50], тромбоцитопатии и нарушению свертываемости крови [60].
Одной из проблем, возникающих при назначении некоторых антидепрессантов из группы ИОЗСН, является угнетение сосудодвигательных центров и развитие ортостатической гипотензии. Другие тимолептики этой группы вызывают вазодилатацию и снижают артериальное давление, ингибируя постсинаптические α1-адренорецепторы сосудов и обратный захват норадреналина [36, 47, 56, 61]. В других исследованиях применение ИОЗСН, напротив, ассоциируется с АГ [20, 29]. На фоне приема ИОЗСН отмечается также синусовая тахикардия [10]. При совместном назначении отдельных ИОЗСН с антикоагулянтами непрямого действия эффект последних усиливается, что приводит к удлинению протромбинового времени и повышению международного нормализованного отношения (МНО) [20].
Из других побочных эффектов современных антидепрессантов, отражающихся на комплаентности и приверженности терапии больных ССЗ, следует отметить озноб с чувством жара и повышенной потливостью, диспептические явления (сухость во рту, гастралгии, тошнота, диарея, обстипация), седацию с развитием сонливости в дневное время, увеличение аппетита и массы тела, дизурию, половые дисфункции, синдром отмены [16, 18, 45, 46, 64].
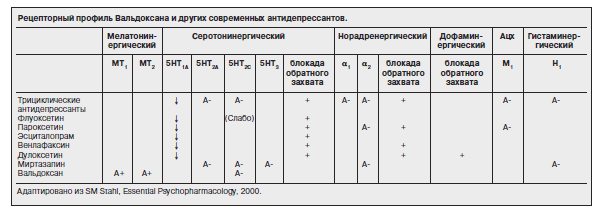
Новый антидепрессант Вальдоксан (агомелатин) является агонистом МТ1- и МТ2-мелатониновых и антагонистом 5-НТ2C-серотониновых рецепторов [23, 57]. При этом Вальдоксан не обнаруживает значимого аффинитета к другим центральным рецепторам или мембранным переносчикам моноаминов, а также не влияет на уровни серотонина [46]. Инновационный механизм действия препарата реализуется ресинхронизацией нарушенных циркадианных ритмов, что приводит к редукции депрессивной симптоматики [8, 54, 62].
Поскольку препарат не влияет на захват моноаминов и не имеет сродства к α-, β-адренорецепторам, холинорецепторам, гистаминовым, дофаминовым и бензодиазепиновым рецепторам, это объясняет отсутствие у Вальдоксана характерных для других антидепрессантов побочных эффектов со стороны сердечно-сосудистой системы, сексуальных дисфункций, чрезмерной седации, увеличения массы тела [42, 52] (см. рисунок).
Наиболее частыми нежелательными явлениями при приеме Вальдоксана являются тошнота (7,7% против 7,1% при приеме плацебо), головокружение (5,4% против 3,1%), сухость во рту (3,3% против 3%), диарея (2,9% против 2,2%), боли в эпигастрии (2,3% против 1,3%), зуд (1% против 0,5%), парестезии (0,9% против 0,1%), нечеткость зрения (0,6% против отсутствия реакции при приеме плацебо), дерматит (0,5% против 0,4%), экзема (0,2% против 0,1%), эритематозная сыпь (0,2% против отсутствия реакции) [7, 8, 31–33]. Тип и частота возникновения побочных реакций не зависят от пола и возраста больных.
Вальдоксан не вызывает привыкания, что было показано в исследовании на здоровых добровольцах с использованием визуальной аналоговой шкалы и опросника Исследовательского центра по изучению пагубных пристрастий (Addiction Research Center Inventory — ARCI 49 check-list) [30]. Синдром отмены не развивается даже при резком прекращении приема Вальдоксана [25, 30, 58, 59].
Установлен ряд лекарственных взаимодействий Вальдок-сана. Так, поскольку 90% действующего вещества препарата метаболизируется в печени при участии изоферментов CYP1А2 и 10% – при участии CYP2C9/19, то любые препараты, метаболизм которых зависит от этих изоферментов, могут повышать или уменьшать биодоступность агомелатина [42, 63]. Флувоксамин, который является сильным ингибитором CYP1A2 и 2С9, может существенно замедлять метаболизм Вальдоксана (одновременное применение не рекомендуется) [42, 63]. Эстрогены – умеренные ингибиторы CYP1A2 – усиливают действие Вальдоксана [31–33]. Между Вальдоксаном и пароксетином, лоразепамом, солями лития, флуконазолом не установлено фармакокинетического и фармакодинамического взаимодействия. У здоровых добровольцев агомелатин не изменял фармакокинетику теофиллина [31–33].
Эффективность Вальдоксана при лечении депрессивных расстройств установлена как в свободной клинической практике [17], так и в клинико-экспериментальных работах. При этом до настоящего момента не существует сформированного мнения об эффективности и безопасности применения Вальдоксана у больных ССЗ, поскольку отсутствуют целенаправленные исследования на данной категории пациентов. Однако в литературе представлены результаты исследований, выполненных на группах больных в возрасте до 65 лет, страдающих различными хроническими (вне обострения) соматическими заболеваниями, в том числе ССЗ1 [8, 34, 44, 51]. Эти исследования свидетельствуют о возможности применения Вальдоксана у больных с кардиальной патологией.
В отечественных натуралистических исследованиях получены данные о высокой эффективности Вальдоксана при терапии депрессивных расстройств средней и тяжелой степени у пациентов в возрасте до 65 лет.
Так, по результатам масштабной общероссийской многоцентровой (54 региона, 1910 врачей-психиатров и неврологов, 6276 пациентов) программы «ХРОНОС» установлено, что при приеме Вальдоксана средний суммарный балл по шкале HAMD-17 прогрессивно снижается, начиная с 1-й недели терапии на протяжении всех 8 нед лечения препаратом. Дополнительным подтверждением значительного терапевтического эффекта Вальдоксана служит высокая доля пациентов (64,12%) с «выраженным» или «сильно выраженным» улучшением по шкале CGI-I и уменьшение числа пациентов с «умеренным/тяжелым» заболеванием с 82,06 до 6,08% по завершении 8 нед терапии. По полученным данным, Вальдоксан обеспечивает становление ремиссии примерно у 1/4 пациентов (25,27%) уже через 3 нед лечения, а по завершении 8-недельного курса доля пациентов, достигших ремиссии, составляет 60% [8].
Купирующий и профилактический антидепрессивный эффекты Вальдоксана подтверждены результатами зарубежных плацебо-контролируемых исследований [43, 62]. В исследованиях H.Loo и соавт. (2002 г.), S.Kennedy, R.Emsley (2006 г.) и J.Olie, S.Kasper (2007 г.) у больных в возрасте до 65 лет зафиксировано преимущество Вальдоксана (25 мг/сут) перед плацебо с достоверно более выраженным снижением среднего суммарного балла по шкале HAM-D. Эти данные соответствовали показателям шкалы CGI-S.
В других исследованиях доказана способность Вальдоксана редуцировать симптомы «психической тревоги» и «соматической тревоги» у пациентов 18–65 лет, страдающих депрессией. В результате оценки динамики суммарных баллов шкалы тревоги Гамильтона (HAM-A) Вальдоксан (25–50 мг/сут) достоверно снижал выраженность симптома тревоги в сравнении с плацебо [41, 44, 51].
В других исследованиях продемонстрирована эквивалентность или превосходство Вальдоксана по эффективности в сравнении с антидепрессантами группы СИОЗС и ИОЗСН у пациентов разных возрастов [51, 63, 72]. В 8-недельном исследовании 711 пациентов 18–65 лет H.Loo и соавт. (2002 г.) Вальдоксан в дозе 25 мг и пароксетин оказались достоверно эффективнее, чем плацебо: среднее различие по HDRS – 2,57 для Вальдоксана против плацебо (p=0,034) и 2,25 для пароксетина против плацебо (p=0,030).
По заключению других исследователей, кратковременные 6–8-недельные испытания у пациентов в возрасте до 65 лет подтверждают сопоставимость антидепрессивного эффекта Вальдоксана (25–50 мг/сут) и венлафаксина (75–150 мг/сут) [45, 48, 63, 68] и демонстрируют статистически значимое превосходство эффективности Вальдоксана по сравнению с сертралином (50–100 мг/сут) [63] для купирования большого депрессивного эпизода и профилактики рецидивов гипотимических состояний.
Способность Вальдоксана купировать депрессивную симптоматику и предупреждать развитие рецидивов аффективных расстройств на протяжении длительного периода (от 6 мес) установлена в работах G.Goodwin и соавт. (2008 г.) и S.Kennedy и соавт. (2008 г.). В ходе исследований на выборках пациентов 18–65 лет, страдающих большим депрессивным расстройством, установлено, что частота рецидивов при терапии Вальдоксаном в течение полугода была почти в 2 раза ниже, чем у пациентов, получавших плацебо (47% против 22% и 20,6% против 41,4% соответственно). Предварительные данные свидетельствуют, что длительная (в течение 6 мес) терапия Вальдоксаном у пациентов с большим депрессивным расстройством обеспечивает более выраженное симптоматическое улучшение в сравнении с венлафаксином. По результатам анализа показателей CGI-I через полгода лечения установлено более выраженное улучшение в группе пациентов, получавших терапию Вальдоксаном [39, 41].
Необходимо подчеркнуть, что в приведенных исследованиях инновационный механизм действия Вальдоксана хорошо заметен при оценке показателей ритма сон–бодрствование. В терапевтических дозах Вальдоксан предотвращает развитие бессонницы и нарушений памяти с момента приема препарата и до утра [48]. Это подтверждается как улучшением субъективных характеристик ночного сна и дневного бодрствования, так и положительной динамикой электрофизиологических параметров сна (распределение основных фаз сна в циклах сна в течение всей ночи) [48, 65]. Полисомнографическое обследование демонстрирует, что при приеме Вальдоксана сокращается время ожидания сна и улучшается стабильность сна [76].
Наряду с демонстрацией высокой эффективности данные большинства исследований свидетельствуют о хорошей переносимости Вальдоксана. Спектр побочных эффектов Вальдоксана невелик. При проведении плацебо-контролируемых исследований на выборках соматически здоровых пациентов между Вальдоксаном и плацебо не выявлено значимых отличий по влиянию на гемодинамические показатели и параметры деятельности сердечно-сосудистой системы [30, 42, 43, 52, 62].
Зарубежные клинические испытания, в которых уделяли внимание переносимости Вальдоксана, включали более 4600 пациентов в возрасте до 65 лет [31–33]. Около 2400 больных депрессией получали препарат в дозах 25–50 мг/сут. При приеме этих доз в краткосрочных плацебо-контролируемых испытаниях число побочных эффектов не отличалось от таковых в группах, получавших плацебо. Побочные эффекты чаще всего были «незначительно» или «умеренно выражены» и наблюдались преимущественно в первые 2 нед лечения [8, 52]. Установлена сопоставимость числа пациентов со связанными с терапией нежелательными явлениями (НЯ) в группах Вальдоксана и плацебо (59,4% против 56,9%) и при более длительных исследованиях – через 10 мес терапии [34, 42].
В ходе уже упоминавшегося общероссийского натуралистического исследования «ХРОНОС» установлена очень хорошая переносимость Вальдоксана. НЯ зарегистрированы лишь у 6% больных. Только 1,72% пациентов преждевременно выбыли из исследования из-за побочных эффектов препарата. Наиболее частым НЯ была тошнота, выявленная у 4% принимавших Вальдоксан. Остальные НЯ развивались значительно реже, показатели частоты их выявления сопоставимы с высокими результатами оценки переносимости Вальдоксана в плацебо-контролируемых исследованиях [42]. Также в исследовании подчеркивается кратковременность (преимущественно в первые 2–3 нед терапии с последующей редукцией без изменения дозы) и легкая степень НЯ. Серьезные побочные эффекты фиксировали редко (0,8%), они заключались, как правило, в обострении имеющегося соматического заболевания и ни в одном случае, по оценкам врачей-исследователей, не имели причинной связи с приемом Вальдоксана [8].
В большинстве сравнительных исследований указывается на лучшую, чем у антидепрессантов других групп, переносимость Вальдоксана за счет меньшего спектра и частоты возникновения побочных эффектов [37, 39, 48]. В соответствии с результатами анализа объединенных данных по комплаентности пациентов к терапии Вальдоксаном в сравнении с пароксетином, флуоксетином и венлафаксином установлено, что НЯ при приеме агомелатина возникают достоверно реже [31, 45].
Таким образом, представленные на данный момент результаты исследований, выполненных на выборках больных психиатрического стационара или амбулатории, свидетельствуют о соответствии или преимуществах Вальдоксана (агомелатин) в сравнении с плацебо и антидепрессантами других групп. Инновационный механизм действия нового антидепрессанта Вальдоксана открывает новые возможности для терапии психических расстройств у больных общей соматической сети. Высокие показатели эффективности и профиля толерантности (в том числе со стороны сердечно-сосудистой системы) у пациентов в возрасте до 65 лет, получавших терапию Вальдоксаном в натуралистических и клинико-экспериментальных исследованиях, позволяют предположить, что Вальдоксан может стать препаратом выбора для коррекции депрессивных расстройств у больных ССЗ.
О высокой частоте коморбидности депрессий и кардиологических заболеваний свидетельствуют и данные отечественных авторов. Согласно обобщенным результатам нескольких исследований среди больных ИБС, наблюдающихся у кардиологов, доля пациентов с расстройствами депрессивного спектра, характеризующимися 18 баллами и более по шкале CES-D, достигает 55,7%. Достаточно велика и доля пациентов с психопатологически завершенными депрессивными состояниями – 33,1% [1, 2, 14].
Результаты клинико-эпидемиологического исследования «КОМПАС» по изучению депрессий среди пациентов общей соматической сети показали, что депрессивные расстройства при ССЗ диагностируются более чем в половине наблюдений. Самый высокий показатель отмечен при хронической сердечной недостаточности (ХСН) – 61%; артериальной гипертензии (АГ) – 52%; при ИБС – 34% [6]. В диссертационной работе Т.В.Довженко (2008 г.) приводит собственные данные о наибольшей частоте и выраженности гипотимии у больных ИБС – 96% наблюдений, в то время как «тревожно-депрессивные опасения» неблагоприятного исхода болезни зарегистрированы у 98,6% пациентов с АГ и ИБС и у 89,6% с ХСН [4].
Столь различные показатели встречаемости депрессий отчасти, по-видимому, объясняются отсутствием единых подходов к диагностике. Следует отметить, что наряду с типичными проявлениями депрессивных расстройств (гипотимия, тоска, тревога и др.), диагностика которых не вызывает значительных затруднений, часть депрессий, выявляемых в кардиологии, относится к стертым, маскированным формам (ларвированные, скрытые, алекситимические депрессии, тимопатические эквиваленты).
При маскированных депрессиях [40] основные депрессивные проявления не достигают полной психопатологической завершенности (гипотимия, психомоторные расстройства, идеи виновности и т.п.), а часть из них вовсе отсутствует («субсиндромальные депрессии» [38]). В ряде случаев собственно аффективные расстройства отступают на второй план, а в клинической картине представлены в основном невротические и соматовегетативные симптомы, имитирующие или амплифицирующие симптоматику ССЗ, квалификация которых в качестве патологии аффективной сферы требует уточнения [69].
По признаку доминирующих феноменов выделяют различные варианты «масок» атипичных депрессий: в форме психопатологических (сенсопатические, тревожные, обсессивно-компульсивные, ипохондрические и др.) и патохарактерологических (импульсивность, расстройства влечений, истерические реакции и т.п.) расстройств. При этом одним, иногда единственным, из наиболее значимых дифференциальных признаков депрессии у этих пациентов является нарушение суточного (циркадианный) ритма [8, 26, 73, 75]. Ритмические изменения наблюдаются у 98% пациентов с депрессиями и проявляются не только нарушением физиологических функций (цикл сон–бодрствование), но и изменением выраженности депрессивной симптоматики в течение дня [8].
Значение депрессивных состояний, коморбидных ССЗ, определяется не только их высокой распространенностью. По данным ВОЗ, при сохранении существующих демографических тенденций к 2020 г. ССЗ и депрессии займут соответственно первое и второе место по числу лет сокращения полноценной жизни в связи с инвалидностью [3].
Кроме того, депрессия и ССЗ находятся в реципрокных соотношениях: каждое из них утяжеляет течение другого. Например, обострение ИБС или гипертонической болезни может провоцировать наступление очередной депрессивной фазы [16]. В свою очередь депрессии рассматриваются как независимый фактор риска развития, неблагоприятного течения и исхода кардиоваскулярных заболеваний, а также смертности от коронарной патологии [16, 22]. В многолетнем контролируемом исследовании J.Barefoot, M.Schroll (1996 г.) установлено, что риск заболеть ИБС у пациентов с депрессией в 2 раза превышает таковой у лиц без сопутствующей гипотимии. По данным F.Lesperance (2002 г.), 27,5% больных, перенесших инфаркт миокарда, имели по крайней мере один эпизод выраженной депрессии до его развития; 7,7% перенесли депрессивный эпизод в течение года до его возникновения; у 31,5% депрессия развилась в стационаре либо в течение года после инфаркта миокарда. Отмечено также, что затяжное течение аффективного заболевания с неполными ремиссиями даже при сравнительно неглубоком уровне психопатологических проявлений существенно повышает суицидальный риск.
Наконец, депрессия, усложняя клиническую картину ССЗ и затрудняя их диагностику, отрицательно коррелирует с показателями качества жизни, комплаентности и адаптационных возможностей пациентов, что связано с отказом следовать рекомендациям врача, усилением зависимости от табакокурения, недооценкой методов кардиореабилитации и т.п. [13, 21, 77].
Таким образом, важное клиническое, терапевтическое и прогностическое значение у больных ССЗ имеет своевременное выявление и адекватная психофармакотерапия депрессивных состояний. Приведенные данные указывают на необходимость обоснованного подбора антидепрессивной терапии, направленной на купирование и профилактику проявлений депрессии у пациентов с сердечно-сосудистой патологией.
Препаратами выбора в кардиологической клинике являются антидепрессанты последних поколений. Преимуществом появления большого количества новых тимолептиков, значительно отличающихся по своим свойствам, является возможность подбора препарата, наиболее соответствующего не только психопатологическим особенностям депрессии, но и сопутствующей кардиальной патологии и соматотропной терапии. При этом на первый план выдвигаются характеристики тимолептика, связанные с его переносимостью и безопасностью.
Согласно результатам многочисленных исследований в последние десятилетия препаратами выбора в терапии аффективных расстройств у больных кардиологического профиля являются антидепрессанты из группы селективных ингибиторов обратного захвата серотонина
(СИОЗС) и двойного действия – ингибиторы обратного захвата серотонина и норадреналина (ИОЗСН) [5, 9–11, 14–16, 18, 70]. В то же время, несмотря на сравнимую с полициклическими антидепрессантами эффективность, их использование сопряжено с широким спектром нежелательных, в том числе кардиотропных, эффектов и лекарственных взаимодействий с соматотропными препаратами.
Так, в литературе встречаются упоминания о способности различных СИОЗС приводить к развитию фибрилляции предсердий [27], удлинению интервала QT [35, 50], тромбоцитопатии и нарушению свертываемости крови [60].
Одной из проблем, возникающих при назначении некоторых антидепрессантов из группы ИОЗСН, является угнетение сосудодвигательных центров и развитие ортостатической гипотензии. Другие тимолептики этой группы вызывают вазодилатацию и снижают артериальное давление, ингибируя постсинаптические α1-адренорецепторы сосудов и обратный захват норадреналина [36, 47, 56, 61]. В других исследованиях применение ИОЗСН, напротив, ассоциируется с АГ [20, 29]. На фоне приема ИОЗСН отмечается также синусовая тахикардия [10]. При совместном назначении отдельных ИОЗСН с антикоагулянтами непрямого действия эффект последних усиливается, что приводит к удлинению протромбинового времени и повышению международного нормализованного отношения (МНО) [20].
Из других побочных эффектов современных антидепрессантов, отражающихся на комплаентности и приверженности терапии больных ССЗ, следует отметить озноб с чувством жара и повышенной потливостью, диспептические явления (сухость во рту, гастралгии, тошнота, диарея, обстипация), седацию с развитием сонливости в дневное время, увеличение аппетита и массы тела, дизурию, половые дисфункции, синдром отмены [16, 18, 45, 46, 64].
Новый антидепрессант Вальдоксан (агомелатин) является агонистом МТ1- и МТ2-мелатониновых и антагонистом 5-НТ2C-серотониновых рецепторов [23, 57]. При этом Вальдоксан не обнаруживает значимого аффинитета к другим центральным рецепторам или мембранным переносчикам моноаминов, а также не влияет на уровни серотонина [46]. Инновационный механизм действия препарата реализуется ресинхронизацией нарушенных циркадианных ритмов, что приводит к редукции депрессивной симптоматики [8, 54, 62].
Поскольку препарат не влияет на захват моноаминов и не имеет сродства к α-, β-адренорецепторам, холинорецепторам, гистаминовым, дофаминовым и бензодиазепиновым рецепторам, это объясняет отсутствие у Вальдоксана характерных для других антидепрессантов побочных эффектов со стороны сердечно-сосудистой системы, сексуальных дисфункций, чрезмерной седации, увеличения массы тела [42, 52] (см. рисунок).
Наиболее частыми нежелательными явлениями при приеме Вальдоксана являются тошнота (7,7% против 7,1% при приеме плацебо), головокружение (5,4% против 3,1%), сухость во рту (3,3% против 3%), диарея (2,9% против 2,2%), боли в эпигастрии (2,3% против 1,3%), зуд (1% против 0,5%), парестезии (0,9% против 0,1%), нечеткость зрения (0,6% против отсутствия реакции при приеме плацебо), дерматит (0,5% против 0,4%), экзема (0,2% против 0,1%), эритематозная сыпь (0,2% против отсутствия реакции) [7, 8, 31–33]. Тип и частота возникновения побочных реакций не зависят от пола и возраста больных.
Вальдоксан не вызывает привыкания, что было показано в исследовании на здоровых добровольцах с использованием визуальной аналоговой шкалы и опросника Исследовательского центра по изучению пагубных пристрастий (Addiction Research Center Inventory — ARCI 49 check-list) [30]. Синдром отмены не развивается даже при резком прекращении приема Вальдоксана [25, 30, 58, 59].
Установлен ряд лекарственных взаимодействий Вальдок-сана. Так, поскольку 90% действующего вещества препарата метаболизируется в печени при участии изоферментов CYP1А2 и 10% – при участии CYP2C9/19, то любые препараты, метаболизм которых зависит от этих изоферментов, могут повышать или уменьшать биодоступность агомелатина [42, 63]. Флувоксамин, который является сильным ингибитором CYP1A2 и 2С9, может существенно замедлять метаболизм Вальдоксана (одновременное применение не рекомендуется) [42, 63]. Эстрогены – умеренные ингибиторы CYP1A2 – усиливают действие Вальдоксана [31–33]. Между Вальдоксаном и пароксетином, лоразепамом, солями лития, флуконазолом не установлено фармакокинетического и фармакодинамического взаимодействия. У здоровых добровольцев агомелатин не изменял фармакокинетику теофиллина [31–33].
Эффективность Вальдоксана при лечении депрессивных расстройств установлена как в свободной клинической практике [17], так и в клинико-экспериментальных работах. При этом до настоящего момента не существует сформированного мнения об эффективности и безопасности применения Вальдоксана у больных ССЗ, поскольку отсутствуют целенаправленные исследования на данной категории пациентов. Однако в литературе представлены результаты исследований, выполненных на группах больных в возрасте до 65 лет, страдающих различными хроническими (вне обострения) соматическими заболеваниями, в том числе ССЗ1 [8, 34, 44, 51]. Эти исследования свидетельствуют о возможности применения Вальдоксана у больных с кардиальной патологией.
В отечественных натуралистических исследованиях получены данные о высокой эффективности Вальдоксана при терапии депрессивных расстройств средней и тяжелой степени у пациентов в возрасте до 65 лет.

Так, по результатам масштабной общероссийской многоцентровой (54 региона, 1910 врачей-психиатров и неврологов, 6276 пациентов) программы «ХРОНОС» установлено, что при приеме Вальдоксана средний суммарный балл по шкале HAMD-17 прогрессивно снижается, начиная с 1-й недели терапии на протяжении всех 8 нед лечения препаратом. Дополнительным подтверждением значительного терапевтического эффекта Вальдоксана служит высокая доля пациентов (64,12%) с «выраженным» или «сильно выраженным» улучшением по шкале CGI-I и уменьшение числа пациентов с «умеренным/тяжелым» заболеванием с 82,06 до 6,08% по завершении 8 нед терапии. По полученным данным, Вальдоксан обеспечивает становление ремиссии примерно у 1/4 пациентов (25,27%) уже через 3 нед лечения, а по завершении 8-недельного курса доля пациентов, достигших ремиссии, составляет 60% [8].
Купирующий и профилактический антидепрессивный эффекты Вальдоксана подтверждены результатами зарубежных плацебо-контролируемых исследований [43, 62]. В исследованиях H.Loo и соавт. (2002 г.), S.Kennedy, R.Emsley (2006 г.) и J.Olie, S.Kasper (2007 г.) у больных в возрасте до 65 лет зафиксировано преимущество Вальдоксана (25 мг/сут) перед плацебо с достоверно более выраженным снижением среднего суммарного балла по шкале HAM-D. Эти данные соответствовали показателям шкалы CGI-S.
В других исследованиях доказана способность Вальдоксана редуцировать симптомы «психической тревоги» и «соматической тревоги» у пациентов 18–65 лет, страдающих депрессией. В результате оценки динамики суммарных баллов шкалы тревоги Гамильтона (HAM-A) Вальдоксан (25–50 мг/сут) достоверно снижал выраженность симптома тревоги в сравнении с плацебо [41, 44, 51].
В других исследованиях продемонстрирована эквивалентность или превосходство Вальдоксана по эффективности в сравнении с антидепрессантами группы СИОЗС и ИОЗСН у пациентов разных возрастов [51, 63, 72]. В 8-недельном исследовании 711 пациентов 18–65 лет H.Loo и соавт. (2002 г.) Вальдоксан в дозе 25 мг и пароксетин оказались достоверно эффективнее, чем плацебо: среднее различие по HDRS – 2,57 для Вальдоксана против плацебо (p=0,034) и 2,25 для пароксетина против плацебо (p=0,030).
По заключению других исследователей, кратковременные 6–8-недельные испытания у пациентов в возрасте до 65 лет подтверждают сопоставимость антидепрессивного эффекта Вальдоксана (25–50 мг/сут) и венлафаксина (75–150 мг/сут) [45, 48, 63, 68] и демонстрируют статистически значимое превосходство эффективности Вальдоксана по сравнению с сертралином (50–100 мг/сут) [63] для купирования большого депрессивного эпизода и профилактики рецидивов гипотимических состояний.
Способность Вальдоксана купировать депрессивную симптоматику и предупреждать развитие рецидивов аффективных расстройств на протяжении длительного периода (от 6 мес) установлена в работах G.Goodwin и соавт. (2008 г.) и S.Kennedy и соавт. (2008 г.). В ходе исследований на выборках пациентов 18–65 лет, страдающих большим депрессивным расстройством, установлено, что частота рецидивов при терапии Вальдоксаном в течение полугода была почти в 2 раза ниже, чем у пациентов, получавших плацебо (47% против 22% и 20,6% против 41,4% соответственно). Предварительные данные свидетельствуют, что длительная (в течение 6 мес) терапия Вальдоксаном у пациентов с большим депрессивным расстройством обеспечивает более выраженное симптоматическое улучшение в сравнении с венлафаксином. По результатам анализа показателей CGI-I через полгода лечения установлено более выраженное улучшение в группе пациентов, получавших терапию Вальдоксаном [39, 41].
Необходимо подчеркнуть, что в приведенных исследованиях инновационный механизм действия Вальдоксана хорошо заметен при оценке показателей ритма сон–бодрствование. В терапевтических дозах Вальдоксан предотвращает развитие бессонницы и нарушений памяти с момента приема препарата и до утра [48]. Это подтверждается как улучшением субъективных характеристик ночного сна и дневного бодрствования, так и положительной динамикой электрофизиологических параметров сна (распределение основных фаз сна в циклах сна в течение всей ночи) [48, 65]. Полисомнографическое обследование демонстрирует, что при приеме Вальдоксана сокращается время ожидания сна и улучшается стабильность сна [76].
Наряду с демонстрацией высокой эффективности данные большинства исследований свидетельствуют о хорошей переносимости Вальдоксана. Спектр побочных эффектов Вальдоксана невелик. При проведении плацебо-контролируемых исследований на выборках соматически здоровых пациентов между Вальдоксаном и плацебо не выявлено значимых отличий по влиянию на гемодинамические показатели и параметры деятельности сердечно-сосудистой системы [30, 42, 43, 52, 62].
Зарубежные клинические испытания, в которых уделяли внимание переносимости Вальдоксана, включали более 4600 пациентов в возрасте до 65 лет [31–33]. Около 2400 больных депрессией получали препарат в дозах 25–50 мг/сут. При приеме этих доз в краткосрочных плацебо-контролируемых испытаниях число побочных эффектов не отличалось от таковых в группах, получавших плацебо. Побочные эффекты чаще всего были «незначительно» или «умеренно выражены» и наблюдались преимущественно в первые 2 нед лечения [8, 52]. Установлена сопоставимость числа пациентов со связанными с терапией нежелательными явлениями (НЯ) в группах Вальдоксана и плацебо (59,4% против 56,9%) и при более длительных исследованиях – через 10 мес терапии [34, 42].
В ходе уже упоминавшегося общероссийского натуралистического исследования «ХРОНОС» установлена очень хорошая переносимость Вальдоксана. НЯ зарегистрированы лишь у 6% больных. Только 1,72% пациентов преждевременно выбыли из исследования из-за побочных эффектов препарата. Наиболее частым НЯ была тошнота, выявленная у 4% принимавших Вальдоксан. Остальные НЯ развивались значительно реже, показатели частоты их выявления сопоставимы с высокими результатами оценки переносимости Вальдоксана в плацебо-контролируемых исследованиях [42]. Также в исследовании подчеркивается кратковременность (преимущественно в первые 2–3 нед терапии с последующей редукцией без изменения дозы) и легкая степень НЯ. Серьезные побочные эффекты фиксировали редко (0,8%), они заключались, как правило, в обострении имеющегося соматического заболевания и ни в одном случае, по оценкам врачей-исследователей, не имели причинной связи с приемом Вальдоксана [8].
В большинстве сравнительных исследований указывается на лучшую, чем у антидепрессантов других групп, переносимость Вальдоксана за счет меньшего спектра и частоты возникновения побочных эффектов [37, 39, 48]. В соответствии с результатами анализа объединенных данных по комплаентности пациентов к терапии Вальдоксаном в сравнении с пароксетином, флуоксетином и венлафаксином установлено, что НЯ при приеме агомелатина возникают достоверно реже [31, 45].
Таким образом, представленные на данный момент результаты исследований, выполненных на выборках больных психиатрического стационара или амбулатории, свидетельствуют о соответствии или преимуществах Вальдоксана (агомелатин) в сравнении с плацебо и антидепрессантами других групп. Инновационный механизм действия нового антидепрессанта Вальдоксана открывает новые возможности для терапии психических расстройств у больных общей соматической сети. Высокие показатели эффективности и профиля толерантности (в том числе со стороны сердечно-сосудистой системы) у пациентов в возрасте до 65 лет, получавших терапию Вальдоксаном в натуралистических и клинико-экспериментальных исследованиях, позволяют предположить, что Вальдоксан может стать препаратом выбора для коррекции депрессивных расстройств у больных ССЗ.
Список исп. литературыСкрыть список1. Васюк Ю.А., Довженко Т.В., Школьник Е.Л., Ющук Е.В. Депрессия и хроническая сердечная недостаточность при сердечно-сосудистых заболеваниях. М., 2008.
2. Верткин А.Л., Тополянский А.В., Любшина О.В. Применение антидепрессантов в кардиологии. Лечащий врач. 2001; 7: 34–9.
3. Доклад о состоянии здравоохранения в мире. ВОЗ, 2002.
4. Довженко Т.В. Расстройства депрессивного спектра с кардиалгическим синдромом у больных сердечно-сосудистыми заболеваниями (клиника, диагностика, терапия). Дис... докт. мед. наук. М., 2008
5. Дробижев М.Ю. Психофармакотерапия в общесоматической сети (соматотропные эффекты, совместимость с соматотропными препаратами). Психиат. и психофармакотер. 2000; 2 (2): 49–52.
6. Дробижев М.Ю., Дробижева К.Ю. Клинико-экономический анализ программы КОМПАС. Обозрение психиатрии и медицинской психологии им. М.В.Бехтерева. 2006; 1(03): 12–7.
7. Злоказова М.В. Опыт применения Вальдоксана при лечении умеренных и тяжелых депрессивных расстройств непсихотического уровня у амбулаторных пациентов. Психиат. и психофармакотер. 2009; 4: 39–41.
8. Иванов С.В. Вальдоксан (агомелатин) при терапии умеренныХ и тяжелых депРессий непсихОтического уровНя в амбулатОрной и гоСпитальной практике (результаты Российского мультицентрового исследования «ХРОНОС»). Психиат. и психофармакотер 2009; 6: 14–7
9. Концевой В.А., Яковлева О.Б., Сафарова Т.П., Шешенин В.С. Использование ципрамила при лечении депрессий в старости. Психиат. и психофармакотер. 2003; 2 (5): 68–71.
10. Медведев В.Э., Добровольский А.В. Лечение депрессий у больных сердечно-сосудистыми заболеваниями. Опыт применения Велаксина. Психиат. и психофармакотер. 2007; 3: 23–7.
11. Медведев В.Э., Копылов Ф.Ю., Макух Е.А. Терапия депрессий при гипертонической болезни (на моделе препарата Плизил). Психические расстройства в общей медицине. 2008; 4: 43–8.
12. Оганов Р.Г., Масленникова Г.Я. Смертность от сердечно-сосудистых и других хронических неинфекционных заболеваний среди трудоспособного населения России. Кардиоваск. тер. и проф. 2002; 3: 4–8.
13. Погосова Г.В. Депрессия — новый фактор риска ишемической болезни сердца и предиктор коронарной смерти. Кардиология. 2002; 4: 86–91.
14. Смулевич А.Б. Депрессии при соматических и психических заболеваниях. М., 2003.
15. Смулевич А.Б. Клинико-фармакологические эффекты антидепрессантов. Психиат. и психофармакотер. 2003 (Приложение №1): 3–6.
16. Смулевич А.Б., Сыркин А.Л., Дробижев М.Ю., Иванов С.В. Психокардиология. М., 2005.
17. Счастный Е.Д., Зражевская И.А. Применение инновационного антидепрессанта Вальдоксана (агомелатин) при лечении пациента с быстроциклическим течением биполярного аффективного расстройства (клинический случай). Психиат. и психофармакотер. 2009; 5: 22–5.
18. Сыркин А.Л., Медведев В.Э., Троснова А.П., Добровольский А.В. Терапия депрессивных расстройств в кардиологической практике (опыт применения препарата Опра). Психические расстройства в общей медицине. 2006; 2: 28–31.
19. Тимофеева Т.Н., Шальнова С.А., Константинов В.В. и др. Распространенность факторов, влияющих на прогноз больных артериальной гипертонией, и оценка общего сердечно-сосудистого риска. Кардиоваск. тер. и проф. 2005; 6, Часть1: 5–9.
20. Федеральное руководство по использованию лекарственных средств. Формулярная система, 2003.
21. Ades PA, Huang D, Weaver SO. Cardiac rehabilitation participation predicts lower rehospitalization costs. Am Heart J 1992; 123 (4 Pt 1): 916–21.
22. Ariyo AA, Haan M, Tangen CM et al. Depressive symptoms and risks of coronary heart disease and mortality in elderly Americans. Cardiovascular Health Study Collaborative Research Group. Circulation 2000; 102 (15): 1773–9.
23. Audinot V, Mailliet F, Lahaye-Brasseur C et al. New selective ligands of human cloned melatonin MTI and MT2 receptors. Naunyn Schmiedebergs Arch Pharmacol 2003; 367: 553–61.
24. Barefoot JC, Schroll M. Symptoms of depression, acute myocardial infarction, and total mortality in a community sample. Circulation 1996; 93 (11): 1976–80.
25. Bánki MC. Agomelatine: the first «melatoninergic» antidepressant. Neuropsychopharmacol Hung 2006; 8 (3): 105–12.
26. Boivin DB. Influence of sleep-wake and circadian rhythm disturbances in psychiatric disorders. J Psychiatry Neurosci 2000; 25 (5): 446–58.
27. Buff DD, Brenner R, Kirtane SS, Gilboa R. Dysrhythmia associated with fluoxetine treatment in an elderly patient with cardiac disease. J Clin Psychiatry 1991; 52 (4): 174–6.
28. Cross-national comparisons of the prevalences and correlates of mental disorders. Bull WHO 2000; 4 (78): 413–26.
29. Degner D, Grohmann R, Kropp S et al. Severe adverse drug reactions of antidepressants: results of the German multicenter drug surveillance program AMSP. Pharmacopsychiatry 2004; 37 (Suppl. 1): 39–45.
30. Dubovsky SL, Warren C. Agomelatine, a melatonin agonist with antidepressant properties. Expert Opin Investig Drugs 2009; 18 (10): 1533–40.
31. European Medicines Agency. CMHP Assessment Report For Valdoxan.URL:http://www.emea.europa.eu/humandocs/PDFs/EPAR/valdoxan/H-915-en6.pdf. Accessed November 20, 2008.
32. European Medicines Agency. Committee For Medicinal Products For Human Use Summary of Positive Opinion for Valdoxan. URL: http://www.emea.europa.eu/pdfs/human/opinion/Valdoxan_57541108en.pdf. Accessed November 20, 2008.
33. European Medicines Agency. Valdoxan Product Information. Summary of Product Characteristics. URL:http://www.emea.europa.eu/ humandocs/ PDFs/EPAR/valdoxan/H-915-PI-en.pdf.
34. Goodwin GM, Rouillon F, Emsley R. Long-term treatment with agomelatine: prevention of relapse in patients with major depressive disorder over 10 months [abstract]. In: 21st European College of Neuropsychopharmacology Congress; 30 Aug – 3 Sept 2008; Bareelone. Spain. Eur Neuropsychophar-macol 2008; 18: 338–9.
35. Hartigan-Go K, Bateman DN, Nyberg G et al. Concentration-related pharmacodynamic effects of thioridazine and its metabolites in humans. Clin Pharmacol Ther 1996; 60 (5): 543–53.
36. Hugues FC, Munera Y, Le Jeunne C. Drug induced orthostatic hypotension. Rev Med Interne 1992; 13 (6): 465–70.
37. Howland RH. Critical appraisal and update on the clinical utility of agomelatine, a melatonergic agonist, for the treatment of major depressive disease in adults. Neuropsychiatric Disease and Treatment 2009; 5: 563–76.
38. Judd LL. The clinical course of unipolar major depressive disorders. Arch Gen Psychiatry 1997; 54: 989–91.
39. Kasper S, Lemoine P. Comparative efficacy of the antidepressants agomelatine, venlafaxine and sertraline [abstract]. In: 21st European College of Neuropsycho-pharmacology Congress; 30 Aug-3 Sept 2008; Bareelone, Spain. Eur Neuropsychopharmacol 2008; 18: 331–2.
40. Kielholz P. Masked depression. Bern: Hans Huber 1973.
41. Kennedy SH. Efficacy of agomelatine from treatment initiation to treatment completion [abstract]. In: 21st European College of Neuropsychopharmacology Congress; 30 Aug – 3 Sept 2008; Barcelona. Spain. Eur Neuropsychopharmacol 2008; 18 (Suppl. 4): 293.
42. Kennedy SH. Agomelatine. Efficacy at Each Phase of Antidepressant Treatment. CNS Drugs 2009; 23 (Suppl. 2): 41–7.
43. Kennedy SH, Emsley R. Placebo-controlled trial of agomelatine in the treatment of major depressive disorder. Eur Neuropsychopharmacol 2006; 16: 93–100.
44. Kennedy S, Loo H, Olie JP. The antidepressant efficacy of agomelatine is independent of gender, age, body mass index and use of concomitant anxiolytics: combined analysis of three placebo-controlled studies [abstract]. In: 26th Collegium Internationale Neuro-Psychopharmacologicum Congress; 13–17 July 2008; Munich, Germany. Int J Neuropsychopharmacol 2008; 11 (Suppl. I): 193.
45. Kennedy SH, Rizvi S, Fulton K et al. A double-blind comparison of sexual functioning, antidepressant efficacy, and tolerability between agomelatine and venlafaxine XR. J Clin Psychopharmacol 2008; 28: 329–33.
46. Lader M. Pharmacotherapy of mood disorders and treatment discontinuation. Drugs 2007; 67: 1657–63.
47. Lane RM, Sweeney M, Henry JA. Pharmacotherapy of the depressed patient with cardiovascular and/or cerebrovascular illness. Br J Clin Pract 1994; 48 (5): 256–62.
48. Lemoine P, Guilleminault C, Alvarez E. Improvement in subjective sleep in major depressive disorder with a novel antidepressant, agomelatine: randomized, double-blind comparison with venlafaxine. J Clin Psychiatry 2007; 68: 1723–32.
49. Lespérance F, Frasure-Smith N. Sertraline for treatment of depression in acute coronary syndromes. JAMA 2002; 288 (19): 2403; author reply 2403–4.
50. Lischke V, Wilke HJ, Probst S et al. Prolongation of the QT-interval during induction of anesthesia in patients with coronary artery disease. Acta Anaesthesiol Scand 1994; 38 (2): 144–8.
51. Loo H, Hale A, D\'haenen H. Determination of the dose of agomelatine, a melatoninergic agonist and selective 5-HT(2C) antagonist, in the treatment of major depressive disorder: a placebo-controlled dose range study. Int Clin Psychopharmacol 2002; 17: 239–47.
52. Lôo H, Daléry J, Macher JP, Payen A. Pilot study comparing in blind the therapeutic effect of two doses of agomelatine, melatonin- agonist and selective 5HT2c receptors antagonist, in the treatment of major depressive disorders. Encephale 2003; 29 (2): 165–71.
53. Lopez AA, Bragg J, Young E еt al. Depression as a predictor of mortality and hospitalization among hemodialysis patients in United States and Europe. Kidney Int 2002; 62 (1): 199–207.
54. McClung CA. Circadian rhythms, the mesolimbic dopaminergic circuit, and drug addiction. Scientific World Journal 2007; 7: 194–202.
55. McFarlane A, Kamath MV, Fallen EL et al. Effect of sertraline on the recovery rate of cardiac autonomic function in depressed patients after acute myocardial infarction. Am Heart J 2001; 142: 617–23.
56. Mets TF. Drug-induced orthostatic hypotension in older patients. Drugs Aging 1995; 6 (3): 219–28.
57. Millan MJ, Gobert A, Lejeune F et al. The novel melatonin agonist agomelatine (S20098) is an antagonist at 5-hydro-xytryptamine2C receptors, blockade of which enhances the activity of frontocortical dopaminergic and adrenergic pathways. J Pharmacol Exp Ther 2003; 306: 954–64.
58. Montgomery SA, Kennedy SH, Burrows GD et al. Absence of discontinuation symptoms with agomelatine and occurrence of discontinuation symptoms with paroxetine: a randomized, double-blind, placebo-controlled discontinuation study. Int Clin Psychopharmacol 2004; 19 (5): 271–80.
59. Montgomery SA, Kasper S. Severe depression and antidepressants: focus on a pooled analysis of placebo-controlled studies on agomelatine. Int Clin Psychopharmacol 2007; 22: 283–91.
60. Moses HW, Yu PN. Antiarrhythmic drugs. J Clin Pharmacol 1980; 20 (10): 598–618.
61. Nemeroff CB. Evolutionary trends in the pharmacotherapeutic management of depression. J Clin Psychiatry 1994; 55 (Suppl.): 3–15; discussion 16–7.
62. Olie JP, Kasper S. Efficacy of agomelatine, a MT1/MT2 receptor agonist with 5-HT2C antagonistic properties, in major depressive disorder. Int J Neuropsychopharmacol 2007; 10: 661–73.
63. Owen RT. Agomelatine: A novel pharmacological approach to treating depression. Drugs Today (Barc) 2009; 45 (8): 599–608.
64. Papakostas GI. Tolerability of modern antidepressants. J Clin Psychiatry 2008; 69 (Suppl. El): 8–13.
65. Quera-Salva MA, Vanier B, Chapotot F. Effect of agomelatine on the sleep EEG in patients with major depressive disorder. Eur Neuropsychopharmacol 2005; 15 (Suppl. 3): 435–6.
66. Rudisch B, Nemeroff CB. Epidemiology of comorbid coronary artery disease and depression. Biol Psychiatry 2003; 54 (3): 227–40.
67. Ruo B, Rumsfeld JS, Hlatky MA et al. Depressive symptoms and health-related quality of life: the Heart and Soul Study. JAMA 2003; 290(2) Jul 9: 215–21.
68. Rush AJ, Trivedi MH, Wisniewski SR et al. Bupropion-SR, sertraline, or venlafaxine-XR after failure of SSRIs for depression. N Engl J Med 2006; 354: 1231–42.
69. Saitz Ruiz J, Ibanez Cuadrado A. Diagnosis of depressive equivalents. Rev Clin Esp 2002; 202 (2): 88–90.
70. Schulberg HC, Block MR, Madonia MJ et al. Treating major depression in primary care practice. Eight-month clinical outcomes. Arch Gen Psychiatry 1996; 53: 913–9.
71. Strik JJ, Lousberga R, Cheriexb EC, Honiga A. One year cumulative incidence of depression following myocardial infarction and impact on cardiac outcome. J Psychosomatic Research 2004; 56: 59–66.
72. Tessmer M. Agomelatine. Med Monatsschr Pharm 2009; 32 (8): 282–8.
73. Turek FW. From circadian rhythms to clock genes in depression. Int Clin Psychopharmacol 2007; 22 (Suppl. 2): 1–8.
74. Ustin T, Sartorius N. 1995 Preventive Services Task Forse: Guide to Clinical Preventive Services. 2nd Ed. Washington, DC:U.S. Department of Health and Human Services., 1999.
75. von Zerssen D, Dirlich G, Doerr P et al. Are biological rhythms disturbed in depression? Acta Psychiatr Belg 1985; 85 (5): 624–35.
76. Zupancic M, Guilleminault C. Agomelatine: a preliminary review of a new antidepressant. CNS Drugs 2006; 20 (12): 981–92.
77. Wang PS, Patrick AR, Dormuth CR et al. The impact of cost sharing on antidepressant use among older adults in British Columbia. Psychiatr Serv 2008; 59 (4): 377–83.

