Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2004
Терапия депрессий, протекающих с соматовегетативными расстройствами: перспективы применения милнаципрана №01 2004
Введение
Актуальность разработки методов фармакотерапии депрессий, характеризующихся наличием соматовегетативных нарушений, диктуется свойственной для патоморфоза психических заболеваний в последние десятилетия тенденцией к соматизации депрессий как эндогенного, так и психогенного круга [1].
Некоторые авторы отмечают, что больные депрессиями, протекающими с соматическими проявлениями, обладают более высокой психофармакологической лабильностью и большей чувствительностью к антидепрессантам [2]. Другие исследователи, наоборот, подчеркивают их относительную толерантность к тимоаналептической терапии [3, 4] в противоположность “чистым” депрессиям. Такое противоречие, возможно, объясняется клинической неоднородностью соматовегетативных расстройств, наблюдающихся в структуре депрессии, которые сами по себе имеют различную диагностическую ценность. Наибольшей нозологической значимостью обладает соматический симптомокомплекс (нарушения сна, аппетита, либидо), являющийся облигатной составляющей депрессии и рассматривающийся как следствие нарушения генетически детерминированных биологических ритмов, метаболизма и вегетативной нервной системы, контролируемых гипоталамусом. Выраженность соматического симптомокомплекса тесно связана с тяжестью депрессивного состояния. Синдромальная значимость заложена в соматовегетативной симптоматике, являющейся “маской” лавированной депрессии. Соматические (соматоформные) расстройства, хотя и наблюдающиеся в структуре депрессии, могут иметь коморбидную значимость и, таким образом, быть лишь относительно патогенетически связанными с аффективным состоянием. Учет клинической неоднородности соматовегетативных расстройств в структуре депрессии особенно важен при выборе конкретного антидепрессанта и определении его эффективности.
Другой важной особенностью терапии указанных состояний является необходимость подбора препарата, обладающего улучшенной переносимостью, особенно касающейся побочной симптоматики, затрагивающей соматическую сферу. Поскольку применение трициклических антидепрессантов (ТЦА) сопровождается как выраженными проявлениями поведенческой токсичности, так и побочными холинолитическими и сердечно-сосудистыми побочными эффектами, ведущими к усилению соматовегетативных расстройств (тахикардия, уменьшение потоотделения, сухость во рту, тошнота, запоры, затрудненное мочеиспускание), оптимизация терапии депрессий с соматовегетативными нарушениями подразумевает преимущественное использование препаратов с иным механизмом действия [5–8].
Препараты группы селективных ингибиторов обратного захвата серотонина (СИОЗС) обладают более высокими, чем ТЦА, показателями переносимости и безопасности, что делает предпочтительным их использование у больных с соматизированными депрессиями. Однако эффективность этих препаратов, по мнению ряда исследователей, уступает ТЦА [1, 6, 9].
Поиск препаратов, обладающих эффективностью, сравнимой с ТЦА, а переносимостью – с СИОЗС, реализовался в появлении нового антидепрессанта – милнаципрана (иксел/Ixel), являющегося представителем группы ингибиторов обратного захвата серотонина и норадреналина (СИОЗСиН), производимого компанией “Pierre Fabre Medicament” (Франция). Препарат, как и ТЦА, ингибирует обратный захват норадреналина и серотонина, при этом, подобно СИОЗС, лишен холинолитического действия [6, 10] и не обладает поведенческой токсичностью [11]. Многочисленные исследования подтвердили превосходящую СИОЗС и сравнимую с ТЦА высокую эффективность милнаципрана при терапии широкого круга депрессивных расстройств [10, 12–13]. Рекомендуемая дозировка милнаципрана составляет 50–200 мг в сутки. Препарат характеризуется широтой действия, быстротой наступления терапевтического эффекта, хорошей переносимостью, возможностью использования у больных с различными соматическими нарушениями [14].
Целью настоящего многоцентрового исследования явилась оценка эффективности и переносимости милнаципрана при лечении соматизированных депрессивных расстройств.
Выборка сформирована из 80 госпитализированных и амбулаторных пациентов, проходивших лечение в 3 исследовательских центрах (табл. 1).
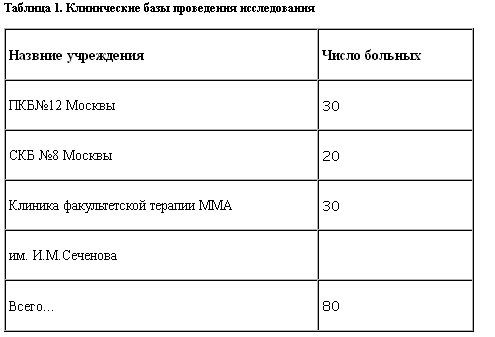
Обработка полученных данных проводилась в отделе пограничной психиатрии (руководитель – проф. Ю.А.Александровский) Государственного научного центра социальной и судебной психиатрии им. В.П.Сербского.
Материал и методы исследования
В исследование включали пациентов в возрасте от 18 до 65 лет, состояние которых соответствовало критериям МКБ-10 для депрессивного эпизода (F32), в том числе в рамках рекуррентного депрессивного расстройства (F33.01, F33.11, F33.2) или биполярного расстройства (F31.3, F31.4). Также включали больных с депрессивной фазой циклотимии (F34.0).
Исключали больных депрессиями с тенденцией к хронификации (превышающими по длительности 12 мес) или резистентные к антидепрессивной терапии (отсутствие эффекта двух адекватных курсов терапии антидепрессантов продолжительностью не менее 6 нед в период предшествующего эпизода депрессии). Также в исследование не включались пациенты с сопутствующими галлюцинаторно-бредовыми расстройствами, органическими заболеваниями ЦНС (включая эпилепсию и эписиндром), алкоголизмом или наркоманиями, любой клинически значимой соматической патологией.
В методы исследования помимо клинического входил набор шкал: шкала оценки степени депрессии Гамильтона (HDRS), шкала общего клинического впечатления CGI (учитывающая тяжесть состояния пациента [CGI-S] и динамику в результате терапии [CGI-I]), шкала Шихана для субъективной оценки динамики состояния и шкала соматических симптомов (CHESS). У 12 пациентов дополнительно проведено инструментальное обследование для определения влияния милнаципрана на психофизиологические и вегетативные показатели.
Началу активной терапии предшествовал период отмены сроком не менее 7 дней. Длительность лечения составляла 42 дня (6 нед активной терапии).
Милнаципран назначали в качестве средства монотерапии в дозировке от 50 до 200 мг в сутки в течение 6 нед. Оценку терапевтического эффекта и переносимости препарата проводили на всем протяжении лечения. Показатели оценочных шкал регистрировали в день начала лечения, на 7, 14, 28 и 42-й день терапии.
Исследование предусматривало использование режима “гибкого” дозирования милнаципрана. Начальная суточная дозировка 100 мг в сутки. На второй неделе при наличии удовлетворительного эффекта прежнюю дозу сохраняли, при недостаточности или отсутствии – увеличивали до 150–200 мг в сутки. При наличии нежелательных явлений допускалась редукция дозировки до 50 мг в сутки. В отдельных случаях с целью коррекции инсомнии допускалось разовое назначение гипнотиков в дозах, эквивалентных 10–20 мг диазепама.
Материал исследования составили пациенты в возрасте от 19 до 65 лет (средний возраст 44,5 года). Средний возраст начала заболевания составил 39,3 года, длительность текущего депрессивного эпизода варьировала от 2 нед до 8,5 мес.
Распределение больных по полу и диагностическим рубрикам МКБ-10 представлено в табл. 2.
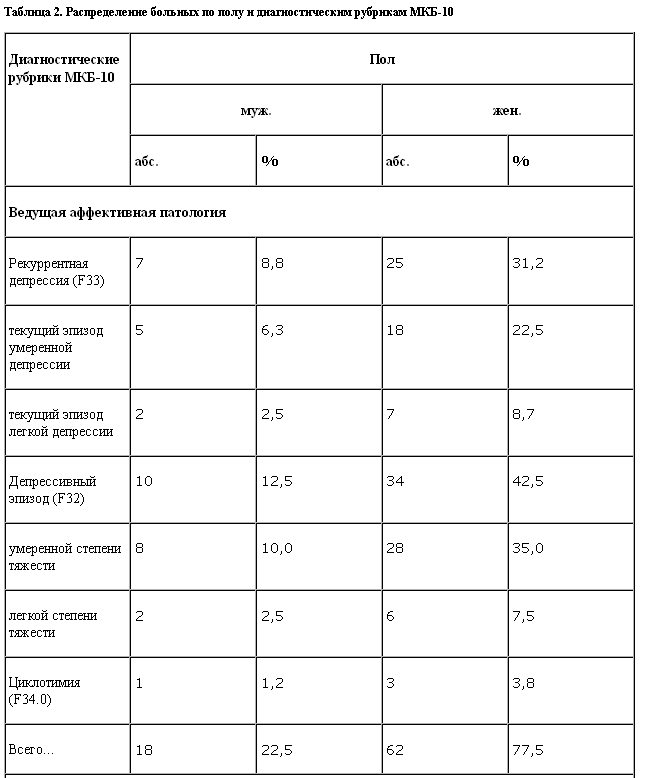
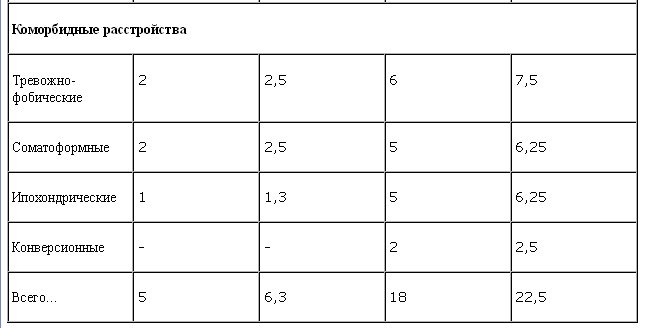
Состав представленной выборки достаточно однороден и соответствует традиционной характеристике этой группы состояний с преобладанием неглубоких аффективных нарушений без выраженной тенденции к хронификации состояния [1–3, 15, 16].
Критерием эффективности для итоговой оценки результатов лечения служили показатели “значительное улучшение” или “очень значительное улучшение” по CGI.
Полный курс терапии милнаципраном завершили 75 (93,8%) пациентов, 5 (6,2%) больных были досрочно исключены из исследования в связи с отсутствием выраженного клинического улучшения.

Значительный терапевтический эффект был достигнут у 64 (80%) больных. На момент завершения исследования у 35 (43,8%) пациентов зарегистрировано “очень значительное улучшение” (по CGI-I), у 29 (36,2%) – “значительное улучшение"; “незначительное улучшение или его отсутствие” отмечено у 11 (13,75%) больных (рис. 1). Высокий процент респондеров подтверждает данные других авторов о выраженной тимолептической активности милнаципрана [11–13].
Анализ эффективных курсов лечения показал, что терапевтический эффект достигается при назначении милнаципрана в среднем в дозе 100 мг в сутки. Необходимость повышения доз возникала в тех случаях, когда депрессивная симптоматика имела тенденцию к хронификации (депрессия длительностью более 1,5 мес), однако применение максимальной дозировки (до 150–200 мг в сутки и выше) не приводило к значимым изменениям в терапевтическом ответе. Эти данные согласуются с результатами, приведенными S.Montgomery, о том, что эффективная дозировка препарата составляет 100 мг в сутки (в 2 приема), а коррекция дозы чаще всего проводится в сторону ее снижения у людей с повышенной чувствительностью к препарату [14].
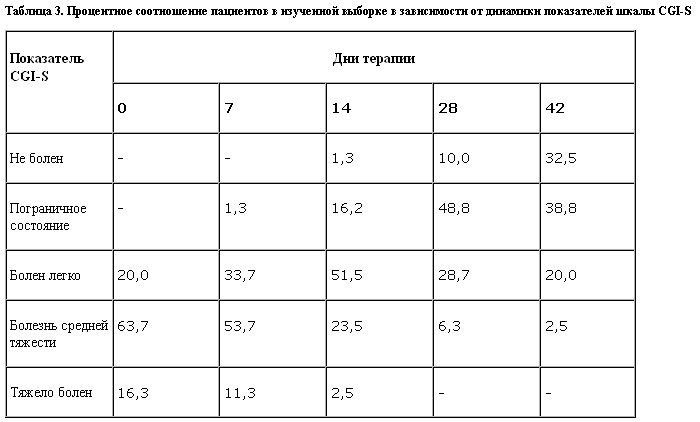
Как следует из табл. 3, до начала терапии у большинства пациентов состояние по CGI-S оценено как среднетяжелое. Отчетливая динамика состояния отмечена уже на 14-й день терапии, когда состояние большинства больных (51,5%) определено как “болен легко". Тенденция к положительной динамике сохранялась до конца терапии: на 28 и 42-й день терапии число пациентов с оценками “пограничное состояние” и “не болен” составляло 58,8 и 71,3% соответственно.
К моменту завершения лечения отмечено снижение среднего балла шкалы HDRS на 73,6% от исходного, при этом более чем 50% снижение показателей HDRS регистрировали на четвертой неделе терапии, максимальная редукция показателя происходила к окончанию исследования. Полученные результаты согласуются с данными других исследователей [11, 13], отметивших быстрое наступление терапевтического эффекта в течение первого месяца лечения милнаципраном. Сходную динамику демонстрируют показатели шкалы CHESS. В процессе терапии была достигнута в среднем 72,5% редукция показателей шкалы CHESS, причем в отличие от шкалы HDRS 50% редукция была достигнута уже к 14-му дню терапии (рис. 2).
Дифференцированный анализ динамики шкалы CHESS (рис. 3) показывает, что максимальное обратное развитие при терапии милнаципраном претерпевают показатели, регистрирующие соматовегетативные проявления, конгруэнтные аффективным нарушениям или входящие в структуру собственно депрессивного синдромокомплекса.
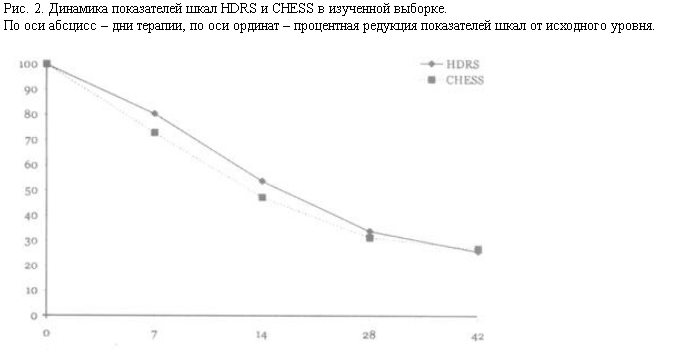
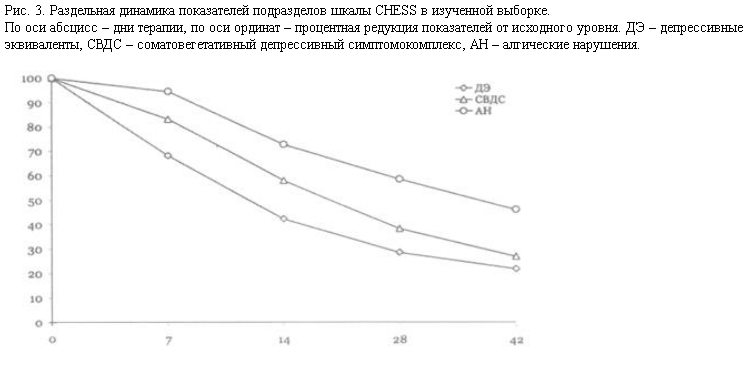
Для этой группы симптомов, к которой в первую очередь относятся проявления, непосредственно входящие в витальный кластер депрессии, – нарушения сна и аппетита [16, 18–20] – характерна максимальная корреляция динамики показателей шкал CHESS и HDRS (пп. 1–4, 22–28 шкалы CHESS; 72,7% редукция).
Наименее выраженной была динамика показателей подраздела шкалы CHESS, отражающего выраженность алгической составляющей депрессивной соматизации (пп. 7, 38–42 шкалы CHESS; 53,5% редукция). Этот факт представляется возможным объяснить в аспекте синдромальной коморбидности депрессии с соматоформными расстройствами невротического кластера [21], при которой клинические проявления последних “перекрываются” с аффективными нарушениями, нередко “маскируясь” ими; однако обнаруживают тенденцию к “отщеплению” и последующему автономному развитию в результате терапии [22].
Полученные данные свидетельствуют о выраженном вегетостабилизирующем действии милнаципрана, что подтверждается как указаниями других авторов [6, 11, 13], так и результатами изучения его психофизиологических и вегетологических эффектов, проведенного в рамках настоящего исследования. Также выявлено, что наличие алгических расстройств в структуре депрессии в значительной степени (20% отличие в динамике этого компонента от остальных показателей шкалы CHESS) определяет ретенцию соматоформной составляющей депрессии, существенно затрудняя лечение. Обнаруженной тенденции соответствует тот факт, что все 5 пациентов из настоящей выборки с соматоформными нарушениями оказались нонреспондерами, 2 из них были досрочно исключены из исследования в связи с отсутствием терапевтического эффекта. Представляется возможным предположить необходимость присоединения к терапии лекарственных препаратов других классов у пациентов с доминированием в клинической картине симптоматики этой группы.
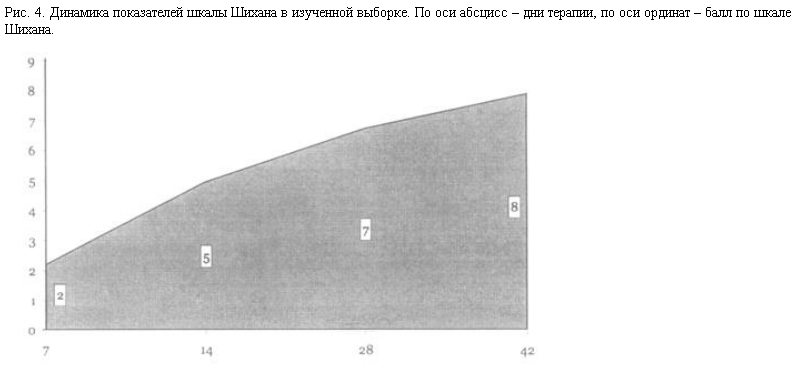
В результате терапии был достигнут 3,5-кратный рост показателей шкалы самооценки Шихана (2-кратный – уже на 14-й день), что указывает не только на выраженность действия милнаципрана, но также косвенно свидетельствует о хорошей его переносимости (рис. 4).
Нежелательные явления
В ходе исследования регистрировали нежелательные реакции, причем можно утверждать, что частота их не превышала аналогичные показатели, приводимые другими авторами [11–13], общее количество незначительно, а большинство из них (дневная сонливость в первые дни терапии, сухость во рту, тошнота, головокружение в 2 наблюдениях) не является специфическим для милнаципрана (табл. 4).
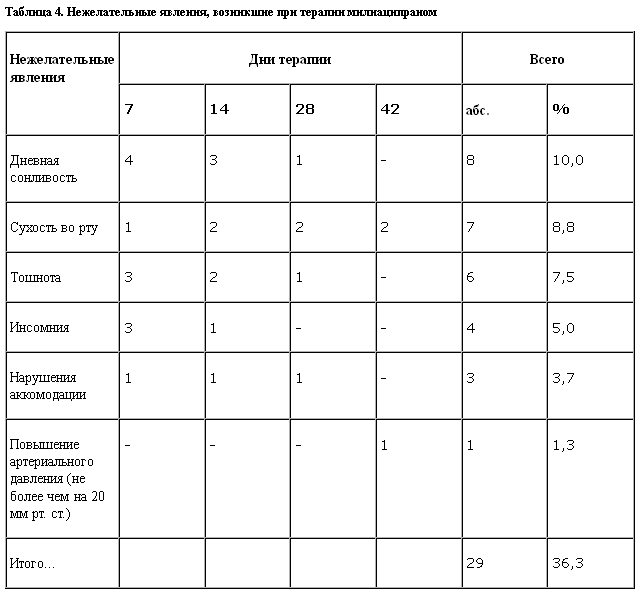
За исключением дневной сонливости в начале терапии не отмечено таких традиционных для ТЦА побочных эффектов, как ортостатическая гипотензия и прибавка массы тела. Более заметными оказались серотонинергические побочные эффекты, включая инсомнию и тошноту. Также не обнаружено значимых антихолинергических побочных эффектов (отражающих воздействие на мускариновые рецепторы), лишь в 7 наблюдениях отмечена небольшая сухость слизистых оболочек. Подавляюще большинство указанных побочных эффектов было характерно для первых 2 нед терапии и в дальнейшем редуцировалось без необходимости изменения суточной дозировки. Инсомнические расстройства, наблюдаемые в 4 случаях, вызвали необходимость дополнительного подключения короткодействующих гипнотиков, которые были отменены в течение 3–5 дней без необходимости возвращения к ним в дальнейшем.
Единичный случай незначительного подъема артериального давления не может быть определен как однозначно возникший в результате приема милнаципрана, несмотря на то что ряд исследователей приводят данные о подобных наблюдениях [14].
В рамках настоящего исследования была проведена дифференцированно-динамическая оценка влияния разовых однократных и курсовых доз милнаципрана на психофизиологические и нейровегетологические показатели у 12 пациентов. Регистрацию показателей проводили в 4 этапа (начальное обследование, исследование через 2 ч после приема разовой однократной дозы – 50 мг, на 7 и 21-й день курсовой терапии). Оценивали характеристики времени реакции, памяти и внимания, а также интегративные параметры вегетативной реактивности. Оценку проводили с применением автоматизированных систем диагностики “КПФК-99” и “ВНС-Спектр".
Результаты обследования приведены в табл. 5.
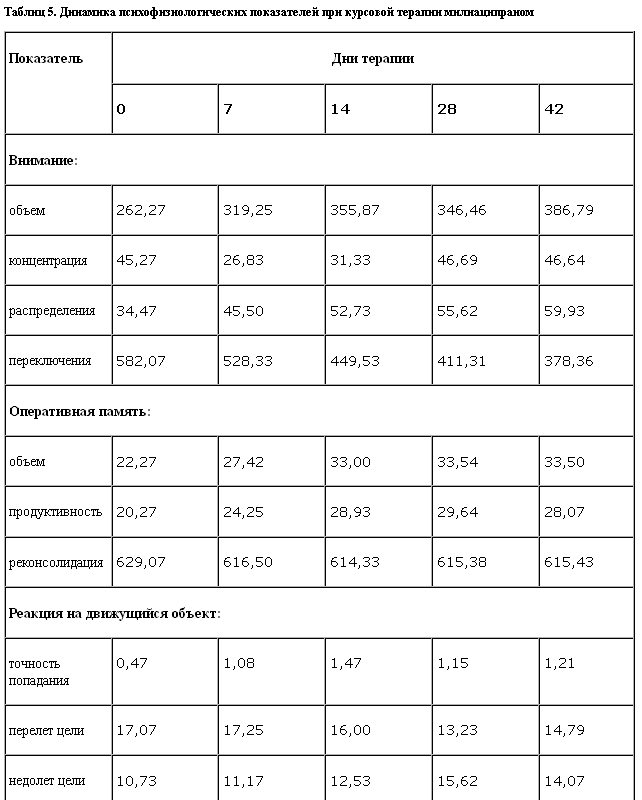

Анализ результатов фонового обследования указывает на негативную направленность динамики психофизиологических характеристик сенсомоторной активности (пролонгация латентных периодов времени реакции), продуктивности памяти (большое число ошибочных ответов при выполнении тестовых заданий, оценивающих краткосрочную и оперативную память), нарушение переключения и распределения внимания (удлинение времени одного ответа и межинтервального ответа), что соответствует данным других авторов о влиянии аффективных нарушений на психофизиологические показатели [23].
Анализ полученных результатов динамической оценки влияния курсовой монотерапии милнаципраном указывает на позитивные сдвиги параметров объема, распределения и переключения внимания, которые носят однонаправленный характер. Следует отметить, что показатели концентрации внимания имеют тенденцию к интермиттированию. На фоне курсовой монотерапии отмечено улучшение показателей оперативной памяти при незначительном ухудшении продуктивности и относительно стабильном времени реконсолидации.
При выполнении “корректурной пробы” отмечено улучшение показателей объема внимания с первой недели терапии с оптимизацией к 3–4-й неделе. Показатели концентрации внимания на фоне курсовой терапии проявляются разнонаправленными колебаниями: улучшение в течение 1, 2 и 4, 6-й недели, ухудшение – на 3–4-й неделе. Показатели распределения характеризуются позитивной динамикой с 1-й недели. Показатели переключения внимания на фоне курсовой терапии улучшаются, начиная со 2-й недели монотерапии, о чем свидетельствует снижение времени одного ответа.
Отмечается увеличение доли правильно решенных арифметических действий, свидетельствующее об улучшении объема оперативной памяти, начиная со 2-й недели, с оптимизацией к 3–4-й неделе терапии. На этом этапе исследования препарат оказывает нерезко выраженное негативное влияние на продуктивность оперативной памяти, что демонстрируется прогрессирующим увеличением количества ошибочно выполненных операций, с максимумом на 3 и 4-й неделе терапии. Однако показатель реконсолидации оперативной памяти на фоне терапии препаратом практически не изменяется.
При выполнении теста “Реакция на движущиеся объекты” на фоне курсовой монотерапии антидепрессантом установлены следующие закономерности изменений баланса и подвижности сенсомоторных процессов: препарат не оказывает позитивного влияния на токсичность выполнения теста, о чем свидетельствуют показатели точности попадания в заданные цели. При этом отмечается стимулирующее влияние препарата с ростом интенсивности возбуждения в нейронах и снижением баланса и лабильности энергетических процессов в нервных клетках, на то указывает количество “недолетов” до цели. Этот показатель достигает оптимальных значений с 3-й недели терапии.
На фоне приема разовой дозы милнаципрана выявлено существенное изменение показателей латентных периодов времени реакции в сторону их сокращения (с 0,658 до 0,553 мс) и направленности вектора активности вегетативной реактивности от ваготонии в сторону симпатической активации по сравнению с начальным уровнем. Выявленная тенденция сохранялась и при курсовой терапии милнаципраном.
Результаты проведенного обследования демонстрируют выраженное вегетоактивирующее действие милнаципрана, незначительную инициальную супрессию функций краткосрочной и оперативной памяти, нормализующуюся после 2-й недели терапии, и сохранность психофизиологических показателей функции внимания на фоне приема разовых и курсовых доз.
Определение предикторов эффективности терапии с использованием t-критерия показало, что кластер респондеров характеризовался достоверно (p<0,01) менее выраженным уровнем тяжести исходного состояния по шкале CGI и большей длительностью заболевания. При этом оценка исходных уровней показателей шкал CHESS и HDRS в группах респондеров и нонреспондеров не выявила достоверных различий между ними. Однако с учетом динамики показателя тяжести заболевания стоит предположить, что удлинение сроков лечения позволит достичь более выраженного улучшения в группе нонреспондеров, поскольку тенденция к снижению тяжести состояния сохраняется до последнего дня терапии (см. табл. 3).
С учетом профиля показателей шкалы CHESS, наиболее подверженных обратному развитию при терапии, можно заключить, что преимущественной чувствительностью к назначению милнаципрана обладают депрессии, протекающие с соматовегетативными и функциональными соматоформными нарушениями, в то время как наличие персистирующих алгических расстройств может потребовать более длительных сроков терапии или присоединения препаратов других классов.
Выводы
Результаты проведенного исследования показали, что милнаципран, назначаемый в дозировке 100 мг в сутки, обладает значительным тимолептическим действием и является эффективным средством терапии депрессий различной степени тяжести и генеза, протекающих с соматовегетативными и функциональными соматоформными нарушениями. Выявленные особенности действия препарата, включая вегетостабилизирующий эффект, объясняют его преимущественное воздействие на депрессивные нарушения, протекающие с преобладанием соматовегетативных расстройств. Необходимо отметить, что вопросы адекватной терапии состояний этой группы до настоящего времени далеки от разрешения, а ассортимент фармакотерапевтических средств, эффективно и мягко их купирующих, достаточно ограничен [1, 16].
Терапия милнаципраном позволяет достичь быстрого (в течение 14–28 дней активной терапии) обратного развития аффективных расстройств наряду с редукцией проявлений соматовегетативного симптомокомплекса. Хорошая переносимость препарата и отсутствие выраженных побочных явлений, включая проявления поведенческой токсичности, позволяют широко использовать его не только в условиях специализированного стационара, но и в амбулаторной практике (в том числе общемедицинской).


