Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№05 2004
Атипичный антипсихотик кветиапин при лечении острых психотических состояний у больных эндогенными заболеваниями: сравнительное исследование №05 2004
Появление нового поколения антипсихотических средств – так называемых атипичных антипсихотиков – значительно расширило возможности терапии эндогенных заболеваний. Атипичные антипсихотики при применении в терапевтических дозах практически не вызывают экстрапирамидных побочных эффектов [3]. Эта важнейшая особенность связана с характеристиками рецепторного связывания препаратов. Атипичные антипсихотики имеют более высокий аффинитет в отношении 5-НТ2А-рецепторов по сравнению с допаминовыми D2-рецепторами, что, по мнению большинства исследователей, и обусловливает минимальную выраженность экстрапирамидных побочных эффектов и большую эффективность в отношении негативной симптоматики [4, 5].
Атипичный антипсихотик кветиапин (сероквель) по химическому строению относится к группе дибензодиазепинов. Имеет более выраженное сродство в отношении 5-НТ2А-рецепторов по сравнению с допаминовыми D1- и D2-рецепторами, что является основным признаком “атипичности” антипсихотика. Это определяет отсутствие или слабую выраженность экстрапирамидных побочных эффектов, отсутствие гиперпролактинемии при отчетливом антипсихотическом эффекте и способности корригировать негативную симптоматику. Препарат обладает также высоким сродством к гистаминовым и a1-адренорецепторам и менее выраженным – к a2-адренорецепторам, что обеспечивает наличие неспецифического седативного эффекта кветиапина, способность вызывать гипотензию; помимо этого, сильное блокирующее воздействие на 1-й тип гистаминовых рецепторов (Н1) обусловливает возможность увеличения массы тела вследствие усиления аппетита. Не обладает сродством к м-холинорецепторам и бензодиазепиновым рецепторам [6]. При пероральном применении кветиапин хорошо всасывается, прием пищи не оказывает существенного влияния на биодоступность препарата. Максимальная концентрация в плазме крови достигается через 1–1,5 ч после приема. Фармакокинетика кветиапина носит линейный характер, не зависит от пола [7]. Связывание с белками плазмы составляет около 83%. Период полувыведения около 7 ч. Действие на серотониновые 5-НТ2- и допаминовые D2-рецепторы продолжается до 12 ч, что позволяет принимать препарат дважды в день. Кветиапин подвергается интенсивному метаболизму; ключевым ферментом является CYP3А4 цитохрома Р-450. Основные метаболиты, определяемые в плазме крови, не обладают существенной фармакологической активностью. Средний клиренс кветиапина у пожилых на 30–50% меньше, чем у пациентов в возрасте от 18 до 65 лет, что требует более осторожного повышения дозировки препарата у этой категории больных.
Результаты клинических исследований свидетельствуют об эффективности кветиапина при лечении обострений шизофрении [8–12], в том числе при наличии в клинической картине выраженной враждебности и агрессивности [13]. Препарат демонстрирует хорошие результаты у больных с недостаточной эффективностью и/или плохой переносимостью предшествующей антипсихотической терапии [14–17].
В настоящее время в инструкции по применению препарата рекомендуется постепенное наращивание суточной дозировки антипсихотика в первые 4 дня лечения (начиная с 50 мг/сут и до 300 мг/сут на 4-й день), в дальнейшем доза подбирается индивидуально и составляет от 150 до 750 мг/сут. Однако существуют указания на хорошую переносимость и эффективность как применения кветиапина в значительно более высоких дозах, так и более быстрого темпа наращивания дозировки [18–20].
Цель данного исследования состояла в изучении терапевтической эффективности и переносимости атипичного антипсихотика кветиапина при лечении острых психотических состояний у больных шизофренией и шизоаффективным психозом в сравнении с галоперидолом.
Материал и методы исследования
В открытое сравнительное рандомизированное исследование включены больные:
• мужчины и женщины;
• в возрасте от 18 до 70 лет;
• в остром психотическом состоянии (включая психомоторное, бредовое, маниакальное возбуждение) в рамках одного из перечисленных ниже диагнозов по МКБ-10:
• шизофрения параноидная (F20.0),
• шизофрения кататоническая (F20.2),
• шизофрения недифференцированная (F20.3),
• шизоаффективное расстройство, маниакальный тип (F25.0).
Из исследования исключали больных:
• с острыми соматическими заболеваниями и хроническими соматическими заболеваниями в стадии обострения;
• беременных и кормящих грудью женщин;
• с органическими заболеваниями центральной нервной системы (ЦНС);
• принимавших пролонгированные нейролептики менее чем за 3 нед до начала исследования.
Если больной получал нейролептики к началу исследования, проводили одномоментное изменение терапии – вместо ранее осуществляемого лечения назначали один из сравниваемых препаратов; в случае замены традиционного нейролептика на атипичный при необходимости прием антихолинергических препаратов продолжали.
Кветиапин назначали по следующей схеме: начальная доза составляла 100 мг/сут, в дальнейшем в зависимости от клинического состояния больного дозу подбирали индивидуально. Увеличение дозы проводили постепенно, с интервалом не менее 24 ч. При наличии выраженного возбуждения допускали форсированное наращивание дозы кветиапина – в 1-й день 300–400 мг на 2 приема, на следующий день – 400–500 мг. При возникновении экстрапирамидных побочных явлений назначался циклодол в адекватной дозе, при тревоге и нарушениях сна – феназепам в дозе до 1 мг/сут.
Галоперидол назначали в возрастающей дозе вплоть до достижения клинического эффекта, но не более 60 мг/сут; препарат вводили как перорально, так и внутримышечно, суточную дозу разделяли на три приема. При развитии экстрапирамидных побочных эффектов назначался циклодол в адекватной дозе.
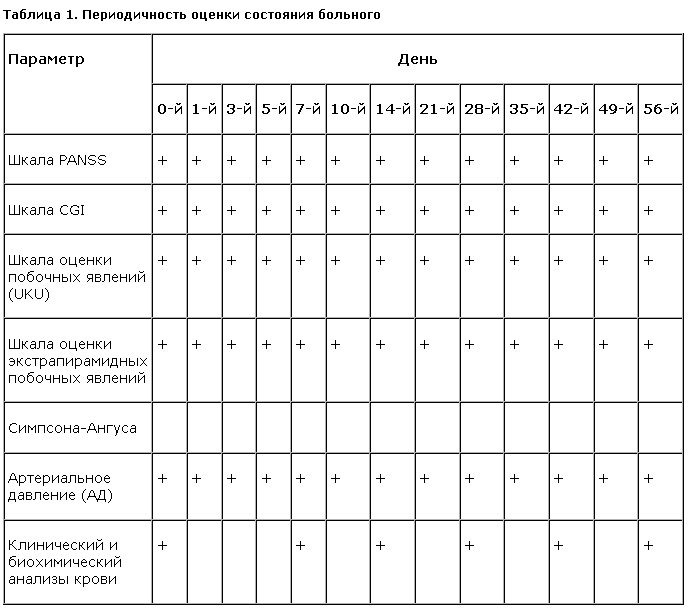
Состояние больных оценивали по шкалам PANSS, общего клинического впечатления (CGI), шкале побочных эффектов (UKU), шкале оценки экстрапирамидных побочных явлений Симпсона–Ангуса, отмечали изменение массы тела, регулярно проводили клинический и биохимический анализы крови. Периодичность проведения оценки состояния больного по различным шкалам представлена в табл. 1.
Терапию расценивали как эффективную, если общий балл по шкале PANSS снижался более чем на 20%.
Для статистического анализа результатов исследования использовали программу Microsoft Exсel и специализированные программные пакеты “Биостатистика” и Statistica 5.5. Рассчитывали относительные и средние величины (среднее ± стандартная ошибка), проводили оценку достоверности различий результатов исследования, наличия и силы корреляционной зависимости.
Результаты и обсуждение
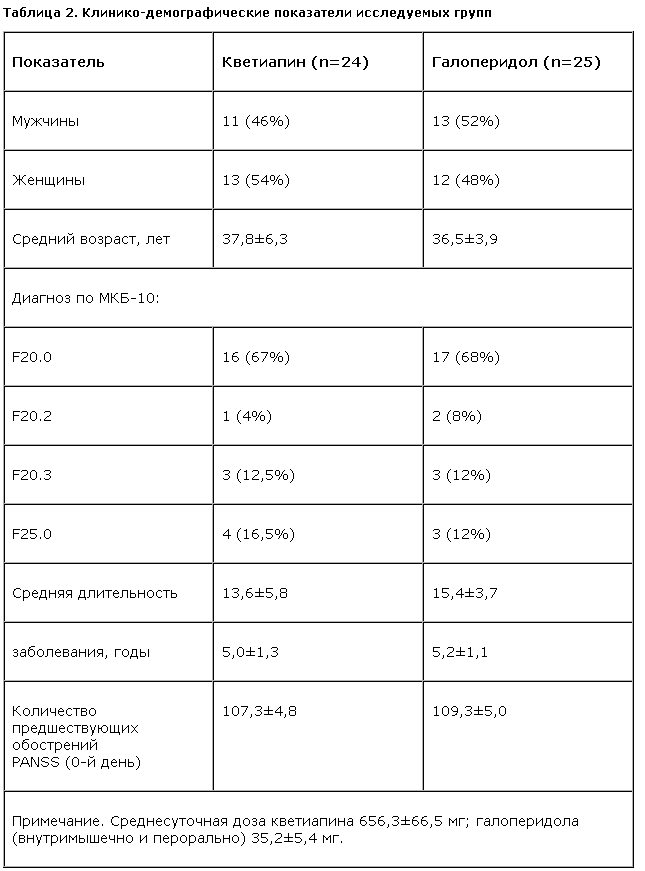
В соответствии с критериями отбора случайным образом были сформированы две группы больных (табл. 2).
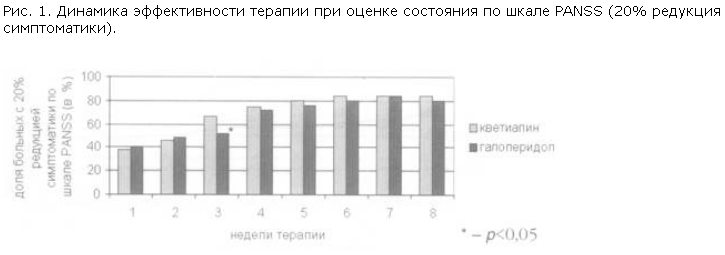
Результаты исследования показали примерно равную эффективность сравниваемых препаратов к концу 8-й недели терапии. Динамика показателя эффективности при оценке состояния по шкале PANSS показана на рис. 1, причем к концу 1 и 2-й недели терапии число респондеров (т.е. пациентов с не менее чем 20% редукцией симптоматики) статистически значимо не отличалось в первой и второй группах больных, к концу 3-й недели число респондеров при лечении кветиапином было достоверно выше, чем при лечении галоперидолом, в ходе дальнейшего наблюдения эти различия нивелировались. Таким образом, при равной эффективности кветиапин не уступает галоперидолу по скорости наступления терапевтического эффекта.
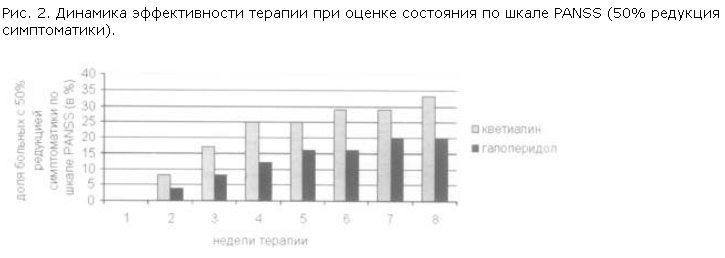
При использовании более жесткого критерия – определение доли больных с более чем 50% редукцией симптоматики по шкале PANSS, – начиная со 2-й недели терапии, кветиапин достоверно (р<0,05) превосходил галоперидол, в дальнейшем на протяжении всего периода наблюдения эти различия сохранялись. Динамика показателей 50% редукции симптоматики в двух исследуемых группах показана на рис. 2.
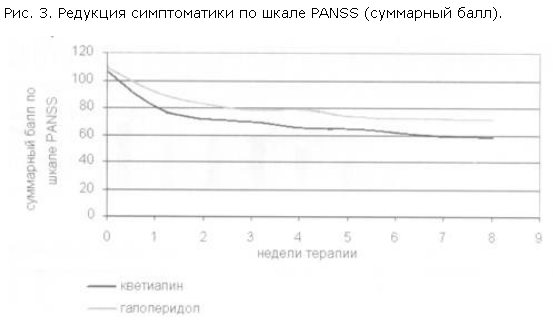
Выраженность психотической симптоматики уменьшалась в обеих исследуемых группах, но темпы редукции как суммарного балла, так и баллов по субшкалам PANSS были различными. Суммарный балл по шкале PANSS быстрее снижался в группе больных, получавших кветиапин; эти различия отмечены с 1-й недели терапии и сохранялись вплоть до завершения наблюдения (рис. 3).
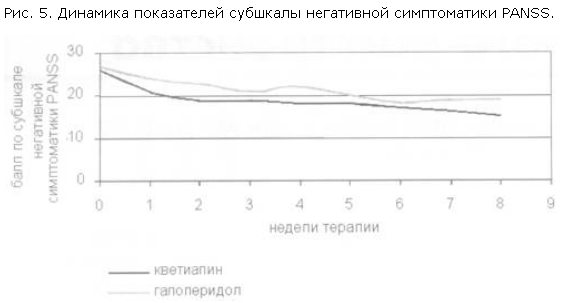
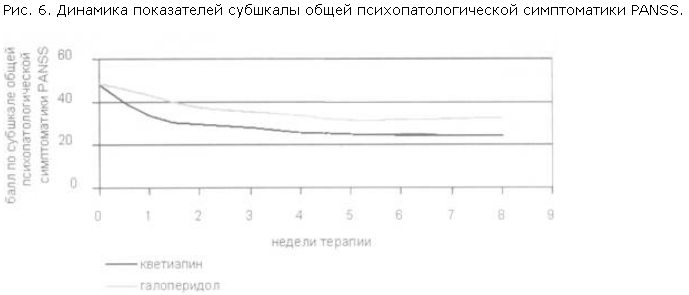
При анализе редукции баллов по отдельным субшкалам PANSS были получены следующие данные: на 1 и 2-й неделе терапии темп редукции баллов по позитивной субшкале был выше в группе галоперидола (рис. 4); в то же время кветиапин превосходил галоперидол по темпу редукции баллов по субшкале общей психопатологической симптоматики PANSS (различия достоверны) и по субшкале негативной симптоматики (рис. 5, 6).
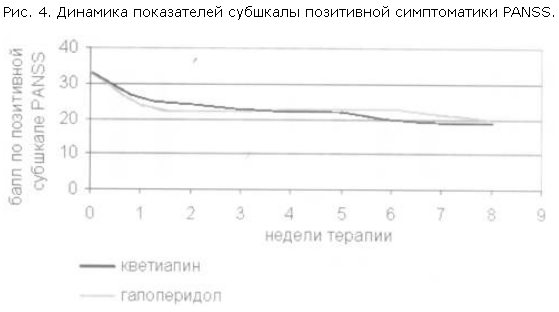
На 3–4-й неделе терапии в группе кветиапина возрастала редукция баллов по позитивной субшкале, и начиная с 5-й недели терапии этот показатель был примерно равным в обеих группах. В течение всего периода наблюдения кветиапин превосходил галоперидол по воздействию на негативную симптоматику, причем по мере продолжения терапии это различие возрастало.
При клиническом изучении особенностей психотропной активности препаратов были выявлены определенные различия. Начиная с первых дней лечения в группе кветиапина отмечено уменьшение аффективной напряженности, психомоторного возбуждения, подозрительности, страха, враждебности, больные становились более доброжелательными и доступными.
У больных с выраженной напряженностью, враждебностью, возбуждением в первые дни терапии проводили форсированное наращивание дозировок кветиапина: пациент получал сразу 200 мг препарата, при необходимости суточную дозу в первый день доводили до 400 мг. На 2-й день лечения суточная доза при необходимости составляла 400–500 мг. При этом в течение 2–4 дней отмечена отчетливая седация больных, в последующем неспецифический седативный эффект нивелировался, но пациенты оставались более доброжелательными, покладистыми, соглашались выполнять требования распорядка дня отделения, охотно принимали лекарство. В дальнейшем увеличение дозировки кветиапина проводили в соответствии с клиническими показаниями.
В группе галоперидола в первую очередь происходила блокада аффективной напряженности, возбуждения, враждебности и агрессивности; галлюцинаторно-бредовые расстройства, явления психического автоматизма редуцировались в более поздние сроки. Это приводило к дезактуализации психотических переживаний, снижению их влияния на поведение больных. В то же время зачастую в течение длительного времени отмечено угнетение двигательной активности, сонливость, снижение инициативности, безразличие к окружающему. При оценке состояния по субшкалам PANSS темпы и степень редукции негативной симптоматики значительно отставали от уменьшения позитивной и общей психопатологической симптоматики.
При оценке переносимости антипсихотической терапии было выявлено, что число больных, нуждавшихся в коррекции неврологических побочных эффектов, было достоверно выше в группе галоперидола (79% наблюдений). Доза корректора (циклодол) составляла до 16 мг/сут. В группе кветиапина появления неврологических побочных эффектов отмечено не было. У части больных к моменту включения в исследование уже присутствовали нейролептические экстрапирамидные нарушения. В этих случаях при назначении кветиапина выраженность неврологической симптоматики постепенно снижалась, причем уменьшение выраженности экстрапирамидных нарушений по сравнению с исходным уровнем становилось к 21-му дню статистически достоверным. В группе галоперидола, несмотря на использование корректоров, выраженность экстрапирамидной симптоматики увеличивалась. Из других побочных эффектов в группе кветиапина следует отметить сонливость в течение дня (29%), снижение АД (12,5%), головокружение (8%), сухость во рту (8%). Побочные эффекты наблюдались в начале терапии, на этапе повышения дозировки атипичного нейролептика, не требовали дополнительной коррекции и, как правило, самостоятельно разрешались в течение 7–10 дней. В случае сохранения сонливости хороший результат давало назначение кветиапина 3 раза в день с приемом большей части суточной дозировки в вечернее время.
При сравнительной оценке эффективности терапии по шкале CGI отмечено преимущество кветиапина по сравнению с галоперидолом начиная с 21-го дня лечения, что позволяет подтвердить хороший терапевтический эффект и переносимость препарата.
Таким образом, результаты проведенного исследования свидетельствуют о том, что кветиапин является высокоэффективным и безопасным антипсихотическим средством. Полученные данные позволяют сделать вывод о высокой терапевтической эффективности кветиапина при купировании острых состояний у больных шизофренией и шизоаффективным психозом. При равной эффективности кветиапин не уступает галоперидолу по скорости наступления терапевтического эффекта. Начиная с первых дней лечения проявляется отчетливое антипсихотическое действие препарата; кветиапин быстро купирует острую продуктивную психотическую симптоматику и превосходит галоперидол по влиянию на негативную симптоматику. При выраженном возбуждении и агрессивности показано форсированное наращивание дозировки кветиапина. Нежелательные побочные эффекты при терапии кветиапином возникали достоверно реже, чем при применении галоперидола, не требовали назначения корректоров и не препятствовали проведению нейролептической терапии. Хорошая переносимость (включая случаи с форсированным наращиванием дозировок), отсутствие длительного затормаживающего влияния на психическую и моторную активность больного являются несомненными преимуществами кветиапина, обусловливают позитивное отношение пациента к лечению, согласие на продолжение терапии после купирования острого психоза. Высокая эффективность, быстрое наступление терапевтического действия, гармоничное влияние как на позитивную, так и на негативную психопатологическую симптоматику, отсутствие экстрапирамидных побочных эффектов и безопасность применения препарата позволяют рекомендовать кветиапин в качестве действенного средства для лечения острых психотических состояний у больных шизофренией и шизоаффективным психозом.
Список исп. литературыСкрыть список1. Lieberman JA. Atypical antipsychotic drugs as a first-line treatment of schizophrenia: a rational and hypothesis. J Clin Psychiatry 1996; 57 (Suppl. 11): 68–71.
2. Fleischhacker WW. New drugs for the treatment of schizophrenic patients. Acta Psychiatr Scand 1995; 91 (Suppl. 388): 24–30.
3. Kerwin R, Taylor D. New antipsychotics: a review of their current status and clinical potential. CNS Drugs. 1996 Jul; 6: 71–82.
4. Kapur S, Remington G. Atypical antipsychotics: new directions and new challenges in the treatment of schizophrenia. Annu Rev Med 2001; 52: 503–17.
5. Meltzer HY. The mechanism of action of novel antipsychotic drugs. Schizophr Bull 1991; 17 (2): 263–87.
6. Goldstein JM. Atypical antipsychotic drugs: beyond acute psychosis, new directions. Emerging Drugs 1999; 4: 127–51.
7. Wong JYW, BJ et al. Multiple-dose pharmacokinetics of “Seroquel” (quetiapine) in schizophrenic men and women. Schizophr Res 1997; 24: 200.
8. Мосолов С.Н., Калинин В.В., Еремин А.В. Сравнительная эффективность и переносимость нового поколения антипсихотических средств при лечении обострений шизофрении (мета-анализ оригинальных исследований оланзапина, рисперидона, кветиапина, клозапина и галоперидола). В сб.: Новые достижения в терапии психических заболеваний. М., 2002; с. 82–94.
9. Смулевич А.Б. Спектр клинических эффектов кветиапина (сероквеля) в условиях крупного психиатрического стационара. Психиатрия и психофармакотер. 2003; Приложение 2: 7–8.
10. Arvanitis LA, Miller BG et al. Multiple fixed doses of “Seroquel” (quetiapine) in patients with acute exacerbation of schizophrenia: a comparison with haloperidol and placebo. Biol Psychiatry 1997; 42: 233–46.
11. Kasper S, Tauscher J, Heiden A. Quetiapine: Efficacy and tolerability in schizophrenia. Eur Neuropsychopharmacol 2001; 11 (Suppl. 4): 405–13.
12. King DJ, Link CGG, Kowalck B. A comparison of bd and td dose regimens of quetiapine (Seroquel) in the treatment of schizophrenia. Psychopharmacology 1998; 137: 139–46.
13. Hellewell J, McKellar M, Raniwalla J. “Seroquel”: efficacy in aggression, hostility and low mood of schizophrenia (abstract). Presented at the CINP Congress 1998, Glasgow, UK.
14. Bovio H, Jimenez J, Herranz S et al. Switching to quetiapine in schizophrenic patients with antipsychotic-induced extrapyramidal symptoms. Eur Neuropsychopharmacol 2002; 12 (Suppl. 3): 266.
15. Gillain B, Van Peborgh P, De Brueeker G et al. Quetiapine clinical use in real-life environment – The SECURE Study. Eur Neuropsychopharmacol 2002; 12 (Suppl. 3): 263–4.
16. Mosolov SN, Kabanov S. Treatment of resistant auditory hallucinations with quetiapine: Two case reports with cognitive assessment. Eur Neuropsychopharmacol 2003; 13 (Suppl. 4): 309.
17. Polana P, Roveyaz E, Colotto A. Risperidone and quetiapine for treatment-resistant schizophrenia. Eur Psychiatry 2002; 17 (Suppl. 1): 104.
18. Bobes J, Garcia-Portilla MP, Saiz PA et al. High degree of tolerability for monotherapy with high doses of quetiapine: a case report. J Clin Psychiatry 2002; 63: 1048–9.
19. Ganesan S, Levy M, Bilsker D. Effectiveness of quetiapine treatment of aggressive psychosis in the emergency psychiatric setting: a naturalistic pilot study. American Psychiatric Association 156th Annual Meeting, California, San Francisco, USA, 17–22 May 2003.
20. Nagy J. Effectiveness of quetiapine up to 1600 mg/day: Short-term results with 14-month follow-up. Eur Neuropsychopharmacol 2003; 13 (Suppl. 4): 340.


