Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№06 2004
Эффективность и безопасность пиразидола у детей и подростков с обсессивно- компульсивным расстройством №06 2004
Обсессивно-компульсивное расстройство (ОКР) является одним из наиболее часто встречающихся психических заболеваний. Его распространенность среди населения составляет 1,9–3,3% (E.Hollander и соавт., 2003). Около трети пациентов заболевают в возрасте 10–15 лет, что обусловливает особую актуальность исследований эффективности терапевтических воздействий в этом возрасте. У мужчин расстройство начинается раньше (6–15 лет), у женщин в более позднем возрасте (Ю.В.Попов, В.Д.Вид, 2000). Расстройство характеризуется выраженными навязчивостями и/или компульсивными действиями, приводящими к дистрессу и снижающими обычный уровень функционирования пациента. Течение ОКР, как правило, хроническое, при этом нередки случаи выраженного прогрессирования заболевания с инвалидизацией пациента. Тяжелые варианты расстройства являются одним из основных показаний для психохирургической коррекции (J.Greist, J.Jefferson, 1998), применение которой у детей и подростков строго ограничено.
Терапия ОКР представляет непростую задачу. Данная патология является наименее курабельной из всех тревожных расстройств. Ни один из существующих подходов к лечению не дает достаточно устойчивого терапевтического эффекта. Среди методов психосоциального воздействия лучшие результаты наблюдаются при когнитивной поведенческой терапии (I.Marks, 1997). Из средств фармакотерапии с определенным успехом применяются антидепрессанты. При этом, хотя препаратами выбора формально считаются трициклический антидепрессант (ТЦА) кломипрамин и селективные ингибиторы обратного захвата серотонина (СИОЗС) флувоксамин, сертралин, флюоксетин, пароксетин, циталопрам (M.Piccinelli и соавт., 1995), результаты их применения не являются в полной мере удовлетворительными, что обусловлено следующими причинами.
• Высок процент терапевтической резистентности. При этом даже при положительной реакции на лечение в большинстве случаев удается достичь лишь частичного смягчения симптомов, а не полноценной ремиссии (B.Bandelow и соавт., 2002).
• Кломипрамин, считающийся наиболее эффективным препаратом для терапии ОКР, обладает рядом серьезных побочных эффектов (в первую очередь связанных с антихолинергическим и кардиотоксическим действием). СИОЗС, не оказывая подобного действия, в последнее время выходят на первый план при терапии ОКР, однако и эти препараты имеют определенные побочные эффекты (бессонница, усиление тревоги, сексуальная дисфункция, гастроинтестинальные расстройства), что делает их непереносимыми для целого ряда пациентов (M.Stahl и соавт., 1997).
• Промежуток между началом лечения и появлением терапевтического эффекта при ОКР составляет от 4–6 до 12 нед (E.Hollander и соавт., 2003). Одним из следствий подобной задержки является существенное снижение комплаенса.
• В случае положительного эффекта поддерживающая терапия должна продолжаться как минимум 12–24 мес (B.Bandelow и соавт., 2002), а нередко и гораздо дольше. При такой продолжительности лечения (к тому же не всегда эффективного) не могут не учитываться фармакоэкономические факторы (в частности, стоимость препарата).
Кроме того, имеются данные контролируемых исследований о том, что по своей эффективности как кломипрамин, так и СИОЗС не превосходят другие антидепрессанты, в частности ингибиторы моноаминоксидазы – ИМАО (J.Vallejo и соавт., 1992). К тому же изучение эффективности большинства антидепрессантов проводили у пациентов старше 18 лет. Сказанное определяет актуальность поиска иных подходов к фармакотерапии ОКР у детей и подростков. В связи с этим представляет интерес применение оригинального отечественного антидепрессанта пиразидола, являющегося по своему механизму обратимым ингибитором моноаминоксидазы.
Пиразидол является оригинальным препаратом российского производства. Препарат обладает выраженной антидепрессивной активностью; отчетливый тимоаналептический эффект его сравним по выраженности с действием имипрамина (мелипрамин) и амитриптилина, что позволяет отнести его к “большим” антидепрессантам (Г.А.Авруцкий, А.А.Недува, 1981). Особенностью пиразидола является сочетание тимоаналептического эффекта с бимодальным действием на ЦНС (в малых дозах – активирующее, в больших – преимущественно седативное). Активирующий и седативный компоненты действия пиразидола развиваются практически параллельно и не зависят от уровня применяемых дозировок (С.Н.Мосолов, Е.Г.Костюкова. Информационное письмо, 2003). Препарат обратимо ингибирует моноаминоксидазу (особенно типа А), блокирует дезаминирование серотонина, в меньшей степени – норадреналина и незначительно – тирамина.
С современных позиций пиразидол является препаратом с уникальным механизмом действия в силу дополнительной способности блокировать обратный захват моноаминовых нейромедиаторов пресинаптическими нервными окончаниями, т.е. сочетает свойства ИМАО и ТЦА (С.Н.Мосолов, Е.Г.Костюкова. Информационное письмо, 2003).
Активирует процессы синаптической передачи в ЦНС, оказывает ноотропное действие, улучшает когнитивные функции (П.В.Морозов, 2002); в отличие от ТЦА не обладает антихолинергической активностью. Сбалансированное действие пиразидола на ЦНС позволяет с успехом применять его для терапии различных вариантов депрессивного синдрома (от анергической до ажитированной депрессии). Высокоэффективен при невротических и “маскированных” депрессиях; при атипичных депрессиях с явлениями соматизированной тревоги, тревожно-ипохондрических, вегетативных, соматизированных депрессиях, а также при гипотимических состояниях с преобладанием анксиозных и фобических расстройств. В связи с положительным влиянием на когнитивные функции используется в геронтологической практике в комплексной терапии старческих деменций, в том числе болезни Альцгеймера. Препарат не оказывает существенного влияния на артериальное давление, показатели ЭКГ, сердечный ритм, функцию желудочно-кишечного тракта, водно-электролитный баланс.
В числе несомненных достоинств пиразидола – его совместимость с многими лекарственными препаратами. Хорошая переносимость, отсутствие привыкания, выраженное вегетостабилизирующее действие позволяет применять пиразидол у детей и подростков.
Материал и методы
В исследовании, проведенном на базе Санкт-Петербургского научно-исследовательского психоневрологического института им. В.М.Бехтерева МЗ и СР РФ, изучали эффективность и безопасность применения пиразидола у детей с ОКР.
В исследование были включены дети и подростки от 10 до 15 лет с подтвержденным диагнозом ОКР, соответствующим диагностическим критериям рубрики F42 классификации МКБ-10 (ВОЗ, 1994). Тяжесть заболевания расценивали не менее 3 баллов по шкале CGI-Severity (шкала оценки тяжести клинической картины)
Критериями исключения больных из исследования являлись: установленный в соответствии с критериями МКБ-10 диагноз шизофрении, шизоаффективного расстройства или других психотических расстройств; наличие данных об алкогольной, лекарственной или иной зависимости (согласно критериям МКБ-10) в течение последних 3 мес; нарушения, относящиеся к органическим психическим расстройствам согласно МКБ-10; высокий риск суицида, тяжелые соматические заболевания, лекарственная аллергия в анамнезе, необходимость постоянного приема сопутствующей терапии.
Проведено прямое несравнительное открытое исследование. После подписания информированного согласия (у детей до 14 лет подписывали родители), сбора анамнестических данных, оценки соответствия критериям включения/исключения и забора образцов крови и мочи для клинического анализа на визите 1 начинали период “отмывки” продолжительностью 3–5 дней (для пациентов, получавших ранее терапию). После “отмывки” проводили исходный визит (визит 2 – неделя 0), после которого начинали 12-недельный период активной терапии пиразидолом. Препарат назначали в фиксированной дозе 150 мг в сутки, разделенной на 3 приема.
Для оценки эффективности терапии применяли следующие шкалы:
• CGI-Severity (шкала оценки тяжести клинической картины);
• CGI-Improvement (шкала оценки улучшения клинической картины);
• Yale-Brown Obsessive-Compulsive Scale – Y-BOCS (шкала оценки обсессивно-компульсивной симптоматики).
Для оценки переносимости препарата и его безопасности на каждом запланированном визите, начиная с визита 2, проводили регулярную регистрацию возникающих побочных эффектов. Кроме того, выполняли клинические анализы крови и мочи на завершающем визите (по сравнению с исходным).
Оценка эффективности
• Основным критерием терапевтического эффекта являлся процент пациентов, отнесенных к группе респондеров, оцениваемый в конце 12-й недели исследования. Респондеры определялись как пациенты, имеющие оценку в 1 (очень выраженное улучшение) или 2 (выраженное улучшение) балла по шкале CGI-Improvement.
• Дополнительные критерии оценки эффективности включали:
– изменение среднего исходного балла по шкале CGI-Severity, оцениваемое в конце 1, 2, 4, 6, 9 и 12-й недели терапии;
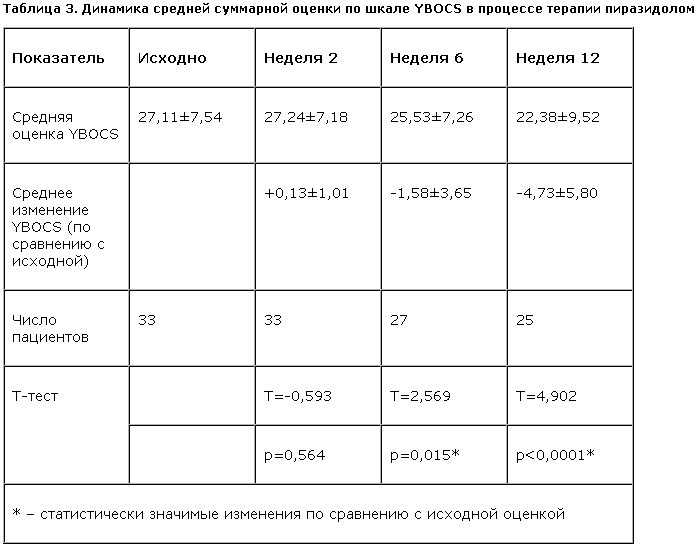
– изменение средней исходной суммы баллов по шкале YBOCS, оцениваемое в конце 2, 6 и 12-й недели терапии.
Оценка безопасности
• Регистрация возникающих побочных эффектов, т.е. всех негативных явлений, о появлении которых сообщали сами пациенты или которые отмечались исследователем, – на каждом визите.
• Результаты медицинского осмотра пациента – конец 12-й недели (по сравнению с исходным визитом).
• Результаты лабораторных исследований (патологические показатели в клиническом анализе крови или мочи) – конец 12-й недели (по сравнению с исходным визитом).
Статистический анализ
В выборку пациентов для оценки эффективности были включены больные, завершившие по крайней мере 2 нед терапии. Основным результирующим показателем эффективности терапии являлся процент респондеров, определяемых посредством шкалы CGI-Improvement. Оценку достоверности изменений рейтинга шкалы CGI-Severity и шкалы YBOCS в процессе терапии проводили при помощи Т-критерия Стьюдента. При сравнении эффективности терапии между различными подгруппами пациентов (по доле респондеров) использовали критерий c2.
Безопасность пиразидола оценивали в выборке, состоявшей из всех пациентов, принявших хотя бы одну таблетку. Для оценки безопасности регистрировали возникающие побочные эффекты, которые распределяли по трем общепринятым градациям: легкие, умеренные и тяжелые. Регистрировали процент пациентов, выбывших из исследования в связи с непереносимыми побочными эффектами. Проводили оценку изменений физикального статуса по сравнению с исходным. Фиксировали появление (либо усиление по сравнению с исходным уровнем) любых клинически значимых отклонений от нормы в анализах крови и мочи.
Характеристика пациентов
Всего в исследование включены 37 пациентов с ОКР (в соответствии с диагностическими критериями рубрики F42 МКБ-10). Поскольку 4 пациента выбыли из исследования до завершения ими 2-й недели терапии, они были исключены из выборки, в которой проводили окончательный анализ эффективности пиразидола. Причиной выбывания обоих больных был их собственный отказ от продолжения лечения, по их словам, “из-за отсутствия улучшения от этого лекарства”. Для оценки безопасности препарата использовали данные, полученные во всей выборке пациентов, лечившихся пиразидолом. Таким образом, эффективность препарата оценивали на материале 33 больных, а его безопасность – на 37. Полностью завершили предусмотренный 12-недельный курс терапии 25 пациентов (табл. 1).

Демографические и некоторые клинические характеристики пациентов приведены в табл. 2.
Подчеркнем, что в исследование были включены как первичные пациенты, никогда ранее не получавшие лекарственной терапии по поводу ОКР, так и лечившиеся ранее больные (в том числе резистентные к терапии). При этом под термином “резистентность” в соответствии с общепринятым определением понималось отсутствие эффекта от двух или более курсов терапии кломипрамином или СИОЗС в адекватных дозировках в течение не менее 12 нед (E.Hollander и соавт., 2003).
Пациенты разделены на две группы. В группу 1 вошли 17 больных (8 мужчин), у которых в клинической картине преобладали навязчивые действия (компульсии), связанные преимущественно с соблюдением чистоты и сопровождавшиеся выраженной озабоченностью возможным загрязнением. Отмечалось постоянное мытье рук, доходившее до стирания кожи. Компульсивные ритуальные действия, направленные на уменьшение тревоги и страха, могли занимать несколько часов в день. Пациенты активно избегали потенциально “опасных” ситуаций (например, соприкосновения с “загрязненными” предметами, способными привести к “заражению”). Наблюдалась избирательность в приеме пищи. От фобий данные навязчивости отличались тем, что появлялись в отсутствие фобического стимула. Группу 2 составили 20 пациентов (16 мужчин) с более полиморфной клинической картиной. У ряда больных преобладали навязчивые сомнения в правильности совершенных действий. Больные были постоянно озабочены тем, что забыли что-либо сделать или, возможно, сделали что-то не так. Подобные мысли часто сопровождались многократными проверками, к примеру, закрыта ли дверь на ключ и т.д. Наблюдались навязчивый счет, повторения, повышенная тщательность, педантичность, стремление добиться совершенства, точности, симметричности расположения предметов. Достаточно типичным для этих больных было накопление дома всяческого хлама и множества ненужных вещей, что мотивировалось тем, что они “могут когда-нибудь все же понадобиться”. Нередко наблюдалась навязчивая медлительность, служившая тяжким препятствием для любой повседневной деятельности больного. Одевание, прием пищи, мытье и другие обычные действия могли растягиваться на часы. У других пациентов этой группы навязчивые мысли и представления непроизвольно вторгались в сознание в виде живых образов. Как правило, эти представления носили субъективно крайне неприятный характер (к примеру, мысли о каких-то агрессивных действиях по отношению к близким) и тяжело переносились больными. Отдельные представления могли вызывать отвращение больного, отталкивая своей бессмысленностью. Реже отмечались просто бесполезные идеи, в том числе бесконечные рассуждения по малосущественным альтернативам.
Основываясь на МКБ-10, можно было говорить (хотя и с известной долей условности) о соответствии больных группы 1 диагностическим критериям категории F42.1: преимущественно компульсивные действия (обсессивные ритуалы), а пациентов группы 2 критериям рубрики F42.0: преимущественно навязчивые мысли или размышления (“умственная жвачка”), хотя у больных обеих групп встречались как обсессивные мысли, так и компульсивные действия.
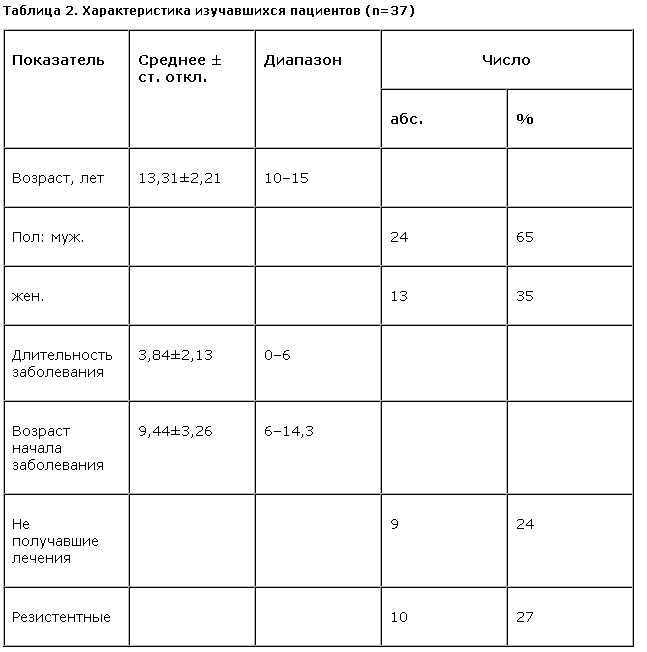
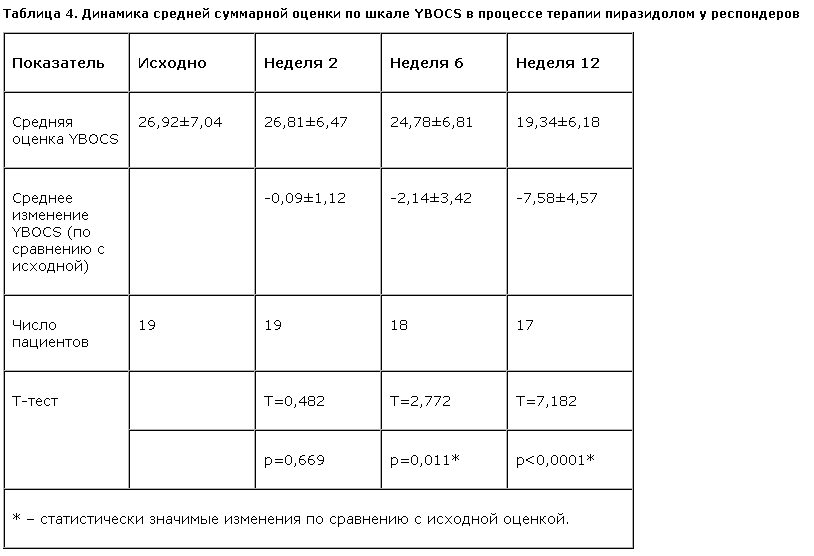
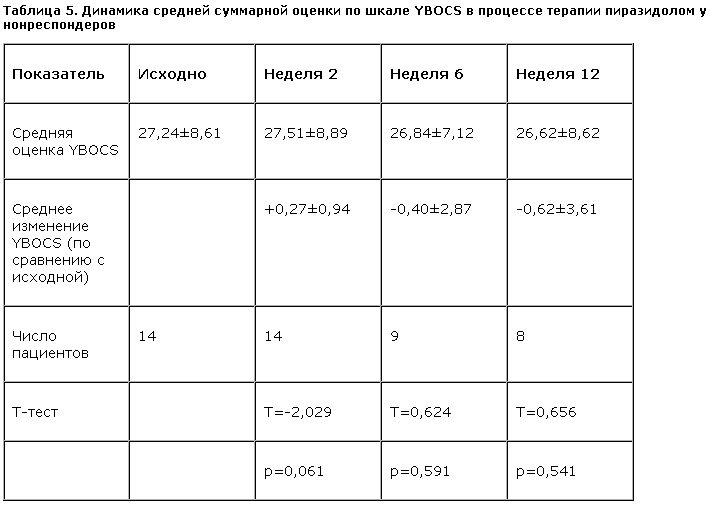
Пиразидол оказался эффективным (оценка в 1 или 2 балла по шкале CGI-Improvement) у 19 (58%) пациентов, которые соответственно были отнесены к категории респондеров. Остальные 14 (42%) пациентов составили категорию нонреспондеров (рис. 1). В группе 1 респондерами оказались 8 пациентов, а в группе 2 – 11. Различия в доле респондеров между двумя группами статистически незначимы (c2=0,247; df=1; p=0,620). Это говорит о том, что эффективность пиразидола не зависит от ведущего синдрома в клинической картине ОКР.
Также не было выявлено влияния на эффективность пиразидола при терапии ОКР таких факторов, как возраст пациента, пол, длительность заболевания к моменту начала терапии и возраста его начала. У 16 респондеров в анамнезе не было отмечено явлений резистентности к лекарственной терапии ОКР. Только 3 пациента из числа резистентных к предшествующей терапии оказались респондерами к пиразидолу (c2=7,140; df=1; p=0,0094).
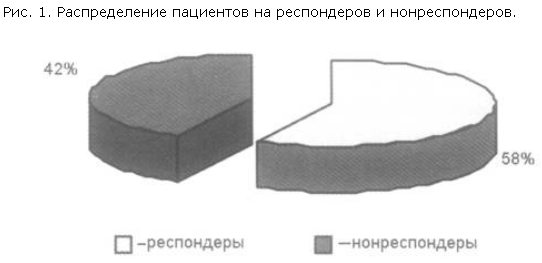
Средняя оценка по шкале CGI-Severity до начала терапии составляла 4,19±0,78 балла, а по завершении 12-й недели исследования – 3,68±0,97 балла (разница статистически значима: t=2,447; df=32; p=0,020). Динамика среднего балла по шкале CGI-Severity по визитам отражена на рис. 2.
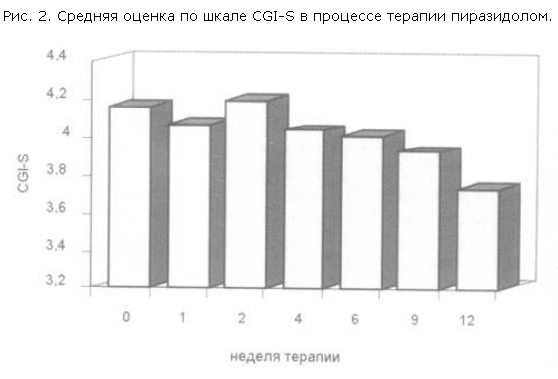
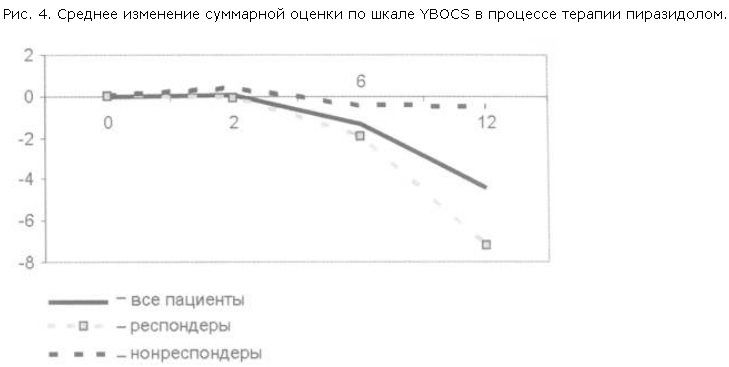
Редукция средней суммарной оценки по шкале YBOCS приведена в табл. 3 и на рис. 3. Изменение суммарной оценки YBOCS становилось статистически значимым на 6-й неделе терапии пиразидолом. Показатели динамики средней суммарной оценки по шкале YBOCS отдельно среди респондеров и нонреспондеров приведены в табл. 4, 5 и на рис. 4.
Из 37 больных, лечившихся пиразидолом, за все время исследования побочные эффекты отмечены у 17 (46%). Все зарегистрированные побочные эффекты приведены в табл. 6.
Данные по больным, выбывшим из исследования, суммированы в табл. 7.
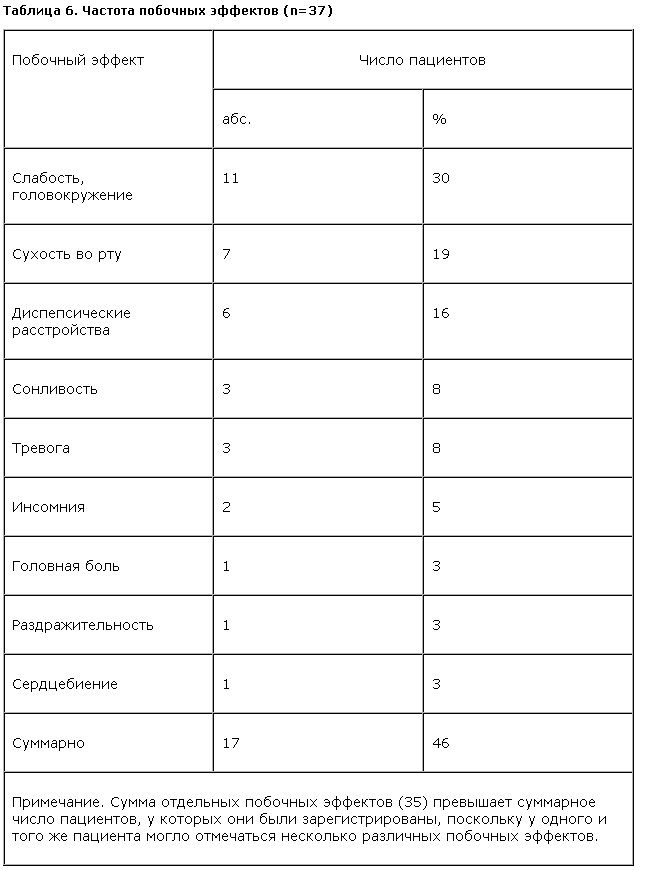
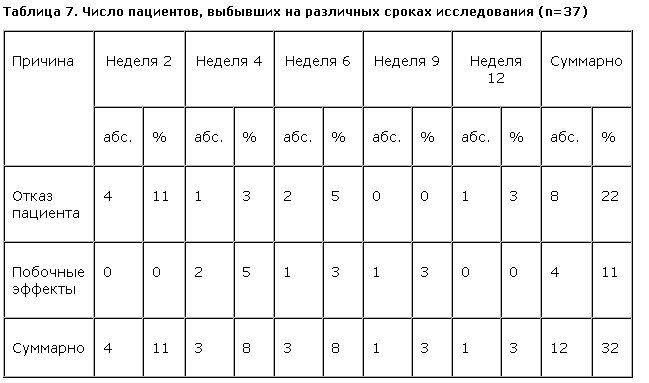
Таким образом, в связи с возникновением субъективно непереносимых побочных эффектов за все время исследования выбыли 4 (11%) пациента. Сроки и причины их выбывания, а также степень тяжести побочного эффекта следующие:
• 18-й день – раздражительность (умеренная);
• 22-й день – диспепсия (тяжелая);
• 37-й день – диспепсия (умеренная);
• 48-й день – инсомния (умеренная).

Подавляющее большинство побочных эффектов расценивалось как легкое или умеренное (рис. 5). В качестве тяжелого был расценен лишь один побочный эффект.
По данным физикального обследования больных, не было выявлено никаких клинически значимых изменений на неделе 12 по сравнению с исходным уровнем. В клинических анализах крови и мочи (на неделе 12) также не было выявлено клинически значимых сдвигов по сравнению с исходными показателями.
Заключение
Проведенное исследование является первым клиническим испытанием пиразидола у пациентов, страдающих ОКР. Полученные данные свидетельствуют о том, что пиразидол является эффективным и безопасным средством терапии у этого контингента больных.
Полученные нами результаты эффективности препарата при лечении ОКР в целом соответствуют имеющимся литературным данным, полученным при применении серотонинергических антидепрессантов. Показано, что эффективность пиразидола не зависит от ведущего синдрома, пола, возраста пациента, длительности заболевания к моменту начала терапии и возраста начала болезни.
Хотя эффективность пиразидола достоверно выше при отсутствии явлений резистентности к терапии ОКР в анамнезе, тем не менее ряд ранее резистентных пациентов оказались респондерами к пиразидолу, что позволяет говорить об отсутствии полной “перекрестной” резистентности между пиразидолом и другими антидепрессантами.
По данным настоящего исследования, пиразидол вызывает незначительное число побочных эффектов, подавляющее большинство которых – легкой степени тяжести. Высокая переносимость и безопасность пиразидола обусловливает его преимущество над антидепрессантами, традиционно использующимися при терапии ОКР (кломипрамин, СИОЗС). При этом можно полагать, что число зарегистрированных побочных эффектов, возможно, несколько завышено, учитывая особенности изучавшегося контингента больных. Количество отмечавшихся жалоб могло увеличиваться в связи с астеноипохондрической фиксацией, присущей пациентам с ОКР.
Основные ограничения исследования связаны с открытым дизайном и незначительным числом пациентов. Для уточнения полученных нами данных в дальнейшем желательно проведение двойных слепых контролируемых исследований.
Таким образом, возобновление производства отечественного препарата “Пиразидол” и появление его в аптечной сети должно приветствоваться не только теми психиатрами, которые помнят этот препарат как высокоэффективный антидепрессант, сбалансированно влияющий на ЦНС, с широким спектром действия и хорошей переносимостью, но и гораздо большим кругом специалистов, в практике которых нередко встречаются пациенты с обсессивно-компульсивным расстройством, в целом весьма резистентным к различным видам терапии. Проведенное исследование дает основание полагать, что пиразидол, обладающий помимо антидепрессивного действия, по-видимому, еще и самостоятельным антиобсессивным эффектом, расширит арсенал средств, доступных для психиатра при терапии ОКР. Если же учесть, что большинство современных антидепрессантов последнего поколения не рекомендуется применять у пациентов моложе 18 лет (в связи с отсутствием специальных исследований) и стоимость их достаточно велика, то пиразидол, на наш взгляд, вполне можно считать препаратом первого ряда при терапии ОКР у детей и подростков.
Список исп. литературыСкрыть список1. Всемирная организация здравоохранения. Международная классификация болезней (10-й пересмотр). Классификация психических и поведенческих расстройств. СПб.: Адис, 1994.
2. Морозов П.В. Пиразидол – эффективный отечественный антидепрессант. Психиатрия и психофармакотер. 2002; 4 (6): 250.
3. Попов Ю.В., Вид В.Д. Современная клиническая психиатрия. СПб.: Речь, 2000.
4. Bandelow B, Zohar J, Hollander E et al. WFSBP Task Force on Treatment Guidelines for Anxiety, Obsessive-Compulsive and Posttraumatic Stress Disorder. World Federation of Societies of Biological Psychiatry (WFSBP) guidelines for the pharmacological treatment of anxiety, obsessive-compulsive and posttraumatic stress disorder. World J Biolog Psych 2002; 3: 171–99.
5. Greist JH, Jefferson JW. Pharmacotherapy for obsessive-compulsive disorder. Brit J Psych 1998; Suppl. 35: 64–70.
6. Hollander E, Kaplan A, Stahl S. A double-blind, placebo-controlled study of clonazepam in obsessive-compulsive disorder. World J Biolog Psych 2003; 4: 30–4.
7. Marks I. Behaviour therapy for obsessive-compulsive disorder: a decade of progress. Canad J Psych 1997; 41: 1021–7.
8. Piccinelli M, Pini S, Bellantuono C, Wilkinson G. Efficacy of drug treatment in obsessive-compulsive disorder. A metaanalytic review. Brit J Psych 1995; 166: 424–43.
9. Stahl MM, Lindquist M, Pettersson M et al. Withdrawal reactions with selective serotonin re-uptake inhibitors as reported to the WHO system. Eur J Clin Pharmacol 1997; 53: 163–9.
10. Vallejo J, Olivares J, Marcos T et al. Clomipramine versus phenelzine for obsessive-compulsive disorder. A controlled clinical trial. Brit J Psych 1992; 161: 665–70.
11. Смулевич А.Б. Депрессии в общей медицине. 2001.
12. Мосолов С.Н., Костюкова Е.Г. Информационное письмо. М., 2003.


