Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№1 2004 Приложение
Ламиктал: поли- и монотерапия эпилепсии №1 2004 Приложение
Препарат “Ламиктал” назначается при лечении эпилепсии уже более десяти лет, в зарубежных клиниках проведено значительное число исследований по эффективности и переносимости ламиктала, а также накоплен важный опыт его применения. В нашей стране такой опыт ограничен, публикации единичны, а практические врачи по непонятной причине редко назначают ламиктал больным.
В настоящее время основной принцип лечения эпилепсии может быть сформулирован следующим образом: максимум терапевтической эффективности при минимуме побочных эффектов (ПЭ) [1]. Больные, страдающие эпилепсией, часто вынуждены применять антиэпилептические препараты (АЭП) в течение многих лет. Важнейшим требованием к терапии является полный контроль над приступами и высокое качество жизни пациентов. В связи с этим в настоящее время продолжается поиск новых эффективных средств, обладающих высокой антиэпилептической активностью с минимальными ПЭ.
Одним из новых АЭП, применяющихся в течение последних 10 лет, является ламотриджин (ламиктал). Противосудорожный эффект ламиктала обусловлен главным образом двумя механизмами. Как и большинство других АЭП, препарат стабилизирует пресинаптическую нейрональную мембрану, блокируя вольтаж-зависимые натриевые каналы. Кроме того, ламиктал ограничивает высвобождение возбуждающих нейромедиаторов – глутамата и аспартата [14].
Ламиктал имеет линейную фармакокинетику. Пик концентрации препарата устанавливается спустя 1–3 ч после перорального приема. Период полувыведения при монотерапии составляет 24–41 ч; связываемость с белками плазмы не высока – 55%. Препарат метаболизируется в печени, однако не стимулирует глюкуронилтрансферазную систему, поэтому при длительном приеме его концентрация в крови сохраняется на прежнем уровне. При синдроме Жильбера период полувыведения ламиктала превышает нормативные показатели на 37%. На метаболизм ламиктала значительно влияют другие АЭП. При совместном применении с АЭП, вызывающими индукцию ферментов печени (барбитураты, карбамазепин, фенитоин), метаболизм препарата ускоряется и период полувыведения может укорачиваться до 15 ч. Вальпроаты замедляют выведение препарата, и период полувыведения удлиняется до 60 ч [14, 18].
Ламиктал в лечении эпилепсии у детей и подростков
Ламиктал обладает широким спектром терапевтического действия и эффективен практически при всех видах эпилептических приступов. Однако его эффективность при различных типах приступов различна. В последние годы появилось большое количество исследований, посвященных дифференцированному применению ламиктала в педиатрической эпилептологии; сравнительному анализу его эффективности и переносимости у детей; частоте и характеру побочных эффектов. Исследование, проведенное O.Dulac (1994 г.) [14], показало, что препарат особенно эффективен при атипичных (в рамках синдрома Леннокса–Гасто) и типичных (пикнолептических) абсансах. При детской абсансной эпилепсии (ДАЭ) препарат был эффективен в купировании абсансов в 73% случаев, а генерализованных судорожных приступов (ГСП) – лишь в 30%.
F.Besag и соавт. (1997 г.) [6] констатировали высокую эффективность ламиктала у 12 пациентов при статусе абсансов (пик-волновом ступоре). Препарат оказывал выраженный клинический эффект и вызывал редукцию генерализованной пик-волновой активности на электроэнцефалограмме (ЭЭГ).
L.Frank и соавт. (1997 г.) [18] сообщили о высокой эффективности ламиктала в виде монотерапии при купировании детских и юношеских абсансов. Препарат применяли в дозе 5–15 мг/кг/сут. При применении двойного слепого метода эффективность ламиктала составила 64% (полная ремиссия), а при применении плацебо – 21% (р=0,015). Однако следует учитывать, что сравнительного исследования по эффективности и безопасности ламиктала и вальпроатов при абсансных формах эпилепсии не проводилось.
S.Wallace (1990 г.) [40] у 18 детей в возрасте 5–11 лет при назначении ламиктала отмечено значительное снижение частоты миоклонических абсансов.
A.Arzimanoglou (2002 г.) [2] рекомендует назначение ламиктала в качестве дополнительного препарата в небольших дозах в комбинации с вальпроатами для купирования типичных абсансов у пациентов, резистентных к монотерапии вальпроатами, или при непереносимости терапевтических доз вальпроатов.
Отмечена возможность применения ламиктала при юношеской миоклонической эпилепсии (ЮМЭ) для лечения резистентных к терапии абсансов, а также эффективность препарата в комбинации с вальпроатами в лечении эпилепсии с миоклонически-астатическими приступами.
A.Arzimanoglou (2002 г.) рекомендует назначение ламиктала в комбинации с вальпроатами при синдроме Леннокса–Гасто и подчеркивает, что это наиболее рациональная комбинация при данном заболевании [2].
C.Akman, G.Holmes (2003 г.) отметили при применении ламиктала у детей и подростков с различными формами эпилепсии, резистентной к антиэпилептической терапии, улучшение основной активности фонового ритма (21,9%), уменьшение выраженности интериктальной пароксизмальной активности (37,8%) и эпилептиформных изменений на ЭЭГ (41,1%) наряду с клиническим улучшением.
При миоклонических и фокальных приступах терапевтический эффект ламиктала ниже (О.Dulac, 1994) [14], однако различается по разным данным. Согласно наблюдению O.Dulac (1994 г.) [14] урежение фокальных приступов при лечении ламикталом достигалось у 29% больных, причем ремиссия наблюдалась лишь в единичных случаях.
M.Brodie и соавт. (1996 г.) провели двойное слепое исследование эффективности и переносимости ламиктала и карбамазепина при различных видах эпилептических приступов. Эффективность обоих препаратов в купировании фокальных приступов, а также первично- и вторично-генерализованных пароксизмов была абсолютно идентичной. Вместе с тем переносимость ламиктала была лучше, в частности кожная сыпь возникала достоверно чаще при применении карбамазепина. Кроме того, у некоторых больных при приеме карбамазепина наблюдались симптомы угнетения центральной нервной системы (ЦНС) (сонливость, вялость, снижение концентрации внимания), которых лишен ламиктал.
В исследовании E.Schlumberger и соавт. (1992 г.) [34] положительный эффект при применении ламиктала (редукция приступов на 50% и более) был достигнут у 1/3 больных, страдающих фокальной эпилепсией. Учащение приступов наблюдалось в 7% случаев.
O.Dulac (1994 г.) [14] сообщает о низкой эффективности ламиктала при эпилепсии с миоклоническими приступами (форма не уточнена) и указывает на возможность экзацербации миоклонических пароксизмов на фоне терапии (12,7% пациентов).
A.Arzimanoglou (2002 г.) [2] сообщает о возможности учащения миоклонических приступов вследствие назначения ламиктала при тяжелой миоклонической эпилепсии младенчества (синдром Драве), что согласуется с данными P.Genton (2000 г.). E.Ben-Menachem (2003 г.) [5] указывает на возможность учащения миоклонических приступов при ЮМЭ при назначении ламиктала (а также карбамазепина, окскарбазепина, габапентина, фенитоина, тиагабина и вигабатрина).
Имеются публикации, свидетельствующие, что у отдельных пациентов при применении ламиктала могут учащаться фокальные приступы (A.Petrukhin и соавт., 1996; E.Schlumberger и соавт., 1992) [31, 34].
Учитывая, что ламиктал применяется в эпилептологии сравнительно недавно и практически отсутствуют серьезные сравнительные исследования по эффективности действия ламиктала и других АЭП, препарат в педиатрической практике назначается главным образом как дополнительный – при недостаточной эффективности базовых АЭП.
Однако, по данным ряда исследований, ламиктал эффективен и в монотерапии у детей. E.Solowiej и соавт. (2000 г.) [35] отметили высокую эффективность монотерапии ламикталом в лечении фокальных приступов у детей: уменьшение частоты приступов на 50% и более или наступление ремиссии, а блокирование эпилептиформной активности на ЭЭГ зарегистрировано в 61% случаев (в исследовании участвовали небольшое число пациентов – 19 детей и подростков с фокальными формами эпилепсии). В исследовании T.Barron (2000 г.) [4] монотерапия ламикталом проведена 83 пациентам (43 – с фокальными, 32 – с генерализованными и 8 пациентов с неклассифицируемыми формами эпилепсии). Ремиссия была достигнута в 45% случаев (из них 44% – фокальные эпилепсии и 36% – генерализованные формы эпилепсии). В исследовании G.Coppola и соавт. (2004 г.) [10] подтверждается эффективность ламиктала в лечении абсансных форм эпилепсии в виде монотерапии. Из 20 пациентов детского возраста у 11 (55%) детей была достигнута ремиссия, у 4 (20%) – урежение приступов более чем на 75% и еще у 5 (25%) – снижение частоты приступов более чем на 50%.
При проведении антиэпилептической терапии у детей очень важно влияние АЭП на когнитивные функции, поведение и отсутствие седативного эффекта препаратов. Большинство АЭП могут оказывать неблагоприятное влияние на функцию ЦНС. Наиболее нейротоксичными препаратами считаются барбитураты, гидантоины и бензодиазепины (M.Ferrari, G.Barabas, W.Matthews, 1983; M.Harbord, 2000; M.Trimble и соавт., 1988, 1989 [37, 38]; E.Hirsch и соавт., 2003). Считается, что наибольший риск развития когнитивных нарушений и нарушения поведения имеется при приеме препаратов, усиливающих ГАМКергическое торможение.
Ламиктал не оказывает угнетающего влияния на нейрональную активность (E.Schlumberger и соавт., 1992) [34], что делает его особенно привлекательным в педиатрической эпилептологии. Более того, имеются многочисленные исследования, свидетельствующие о стимулирующем действии ламиктала на когнитивные функции. J.Gibbs и соавт. (1992 г.) [20] констатировали, что при назначении ламиктала наблюдается улучшение концентрации внимания и школьной успеваемости. Данный эффект не зависит от противоэпилептической эффективности препарата. Авторы предположили, что стимулирующий эффект ламиктала в отношении когнитивных функций может быть обусловлен снижением продолжительности постприступного периода или снижением частоты субклинических разрядов на фоне лечения. Данный эффект препарата особенно важен при лечении пациентов, страдающих криптогенной генерализованной и симптоматической фокальной эпилепсией и эпилептическими энцефалопатиями, так как расстройство когнитивных функций – почти облигатный клинический признак этих синдромов. По данным E.Hirsch и соавт. (2003 г.), даже у пациентов с резистентными формами эпилепсии при добавлении к терапии ламиктала отмечено улучшение внимания, активности, выравнивание настроения.
Положительное влияние ламиктала на когнитивные функции, аффективную сферу и поведение [2, 5, 8, 13, 20] также крайне важно в лечении пациентов подросткового возраста, у которых существует наиболее высокий риск появления поведенческих расстройств, эмоциональной лабильности, аффективных нарушений, небрежность в приеме АЭП. Последнее зачастую определяет неэффективность антиэпилептической терапии в этой возрастной группе.
Многие авторы подчеркивают хорошую переносимость ламиктала, в том числе в педиатрической практике (E.Ben-Menachem, 2003; A.Arzimanoglou, 2002) [2, 5].
При лечении эпилепсии у женщин и девочек подросткового возраста врач встречается с проблемой, не свойственной другим категориям пациентов: это проблема репродуктивного здоровья женщины и здоровья ее потомства. Влияние АЭП на гормональный обмен и обусловленные этим влиянием нейроэндокринные нарушения становятся очевидными уже в подростковом возрасте и не теряют своего значения у женщин не только зрелого, но и пожилого возраста. Таким образом, при проведении антиэпилептической терапии у женщин необходимо учитывать следующие особенности:
• возможность негативного влияния АЭП на репродуктивную функцию женщин детородного возраста, течение беременности и родов, а также здоровье потомства и лактацию;
• возможность влияния гормональных изменений во время менструального цикла, в течение беременности и в период менопаузы на концентрацию АЭП в крови, а следовательно, и на антиконвульсантную активность препаратов;
• влияние АЭП на гормональную контрацепцию;
• влияние АЭП на метаболизм костной ткани и повышение риска развития остеопороза;
• повышение частоты депрессий у женщин, страдающих эпилепсией, и возможность коррекции аффективных нарушений при помощи АЭП.
У женщин, страдающих эпилепсией, повышен риск нарушений репродуктивной функции, включая аменорею, олигоменорею, гиперандрогенизм, патологическое изменение продолжительности (удлинение, сокращение) менструального цикла, ановуляцию, поликистозные изменения в яичниках и синдром поликистозных яичников (который включает кроме изменения структуры яичников и частые ановуляторные циклы, эндокринные нарушения и ассоциирован с повышенным риском развития рака матки и молочных желез, диабета и атеросклероза); возможно изменение сексуальной функции (гипосексуальность). Это связано как с гормональными изменениями, обусловленным основным заболеванием (эпилептическими приступами), так и негативным влиянием АЭП (M.Morrell и соавт., 2002) [25]. Нейроэндокринные нарушения могут приводить к бесплодию и осложнениям течения беременности и родов.
У женщин, страдающих эпилепсией (особенно идиопатической генерализованной) и получающих вальпроаты, чаще встречается увеличение массы тела, гиперандрогения, аменорея, олигоменорея, ановуляторные циклы (до 55%) и поликистозные изменения в яичниках (до 40%), по данным M.Morell, G.Montouris, 2004 [26], что подтверждается и исследованиями других авторов (P.Genton, 2001; J.Isojarvi, J.Tapanainen, 2000) [21]. Увеличение массы тела, обусловленное влиянием вальпроатов на углеводный обмен и развитием гиперинсулинемии (M.Morell, G.Montouris, 2004) [26], наблюдается чаще у женщин и девочек с исходно повышенной массой тела (до начала терапии) и склонностью к конституциональному ожирению (наследственный метаболический синдром) и наиболее выражено в первые 6 мес терапии (G.Novak и соавт., 1999) [28]. Увеличение массы тела, чаще связанное с приемом вальпроатов и реже — карбамазепина (E.Demir и соавт., 2000) [11], а также другие косметические побочные эффекты АЭП (ассоциированные с приемом фенитоина гирсутизм, гиперплазия десен, огрубение черт лица; и алопеция – при приеме вальпроатов и карбамазепина) могут снижать комплаентность терапии и служить причиной отказа от приема препарата, особенно у девочек-подростков и молодых женщин.
Прием ламиктала сочетается со “стабильной массой тела” (O.Devinsky и соавт., 2000) [12], что, с одной стороны, повышает комплаентность терапии у подростков, с другой – позволяет избежать медикаментозных осложнений (в том числе развитие поликистозных изменений в яичниках), патогенетически связанных с избыточной массой тела.
Риск возникновения гиперандрогении, ожирения и поликистоза яичников повышается, если лечение вальпроатами начинается ранее 20-летнего возраста, особенно в пубертатном периоде (M.Morell, G.Montouris, 2004 [26]; J.Isojarvi и соавт., 2000 [21]; P.Genton, 2001 [19]; K.Mikkonen и соавт., 2004 [24]; L.Vainionpaa; J.Rattya, M.Knip и соавт., 1999 [39]). Поликистозные изменения в яичниках могут претерпевать обратное развитие после отмены вальпроатов (M.Morell, G.Montouris, 2004) [26].
Ламиктал не влияет на гормональный статус, не вызывает повышение массы тела и развитие нейроэндокринных нарушений; препарат не оказывает негативного влияния на формирование репродуктивной функции в подростковом периоде. Это является важным преимуществом ламиктала в лечении эпилепсии у женщин и девочек подросткового возраста.
АЭП, индуцирующие или ингибирующие ферменты печени, могут оказывать влияние на уровень женских и мужских половых гормонов (пролактина, эстрадиола, тестостерона, лютеинизирующего и фолликулостимулирующего гормонов). Индукторы ферментов (фенобарбитал, карбамазепин, фенитоин) усиливают метаболизм андрогенов и эстрогенов и уменьшают их концентрацию (что может способствовать развитию гипосексуальности), ингибиторы ферментов печени (вальпроаты), напротив, повышают уровень андрогена (что патогенетически связано с повышением массы тела и развитием синдрома поликистозных яичников, K.Mikkonen и соавт., 2004) [24]. Половые гормоны в свою очередь могут оказывать влияние на уровень АЭП. Этим обусловлено колебание концентрации ферментиндуцирующих АЭП во время менструального цикла; в то время как стабильная концентрация АЭП в крови способствует достижению эффективного контроля над приступами, что особенно важно при эпилепсии, обусловленной циклическими гормональными изменениями – катамениальной эпилепсии (N.Foldary-Schaefer, 2004) [17].
Ламиктал не метаболизируется с участием цитохрома P-450, следовательно, не влияет на уровень половых гормонов, что является важным преимуществом ламиктала в лечении эпилепсии у женщин.
АЭП, индуцирующие ферменты печени (фенобарбитал, примидон, фенитоин, карбамазепин, а также, по данным некоторых авторов, топирамат), уменьшают надежность гормональных контрацептивов с низким содержанием эстрогенов. В отличие от вышеперечисленных АЭП ламиктал не снижает уровня надежности гормональной контрацепции.
Известно, что антиэпилептическая терапия во время беременности повышает риск пороков развития у плода в целом в 2 раза (4–6% против 2–4% у женщин, не страдающих эпилепсией). Наибольший риск пороков развития плода существует при приеме АЭП в I триместре беременности и в некоторой степени зависит от дозы препарата (M.Yerby и соавт., 2004) [41]. Ни один из АЭП не является абсолютно безопасным при беременности, поэтому лечение проводится с учетом соотношения риска антиэпилептической терапии для плода и риска, ассоциированного с эпилептическими приступами, для плода и матери. Тем не менее риск развития мальформаций и врожденных аномалий значительно выше при политерапии, чем при монотерапии, и резко отличается при разных АЭП. Известно, что фенобарбитал, фенитоин, вальпроаты и, в меньшей степени, карбамазепин обладают более выраженным тератогенным эффектом; прием некоторых АЭП во время беременности может приводить к появлению специфических аномалий (например, пороки развития нервной трубки наиболее часто возникают при терапии вальпроатами).
По данным различных исследований, риск пороков развития при приеме ламиктала во время беременности в виде монотерапии не высок и не превышает популяционный риск (2–3%). По результатам самого крупного исследования влияния терапии ламикталом на исход беременности риск врожденных аномалий составляет 1,8% при монотерапии ламикталом (P.Tennis и соавт., 2002) [36], и не описано грубых врожденных пороков (мальформаций). Не замечена также связь приема ламиктала во время беременности с развитием каких-либо определенных аномалий. Большинство из этих редких сообщений свидетельствует о наличии рудиментарных дополнительных пальцев кистей рук (А.С.Петрухин, 2001). A.Sabers (2004 г.) [33] отмечает, что в связи с безопасностью ламиктала этот препарат применяется у беременных женщин чаще, чем другие АЭП.
На фоне антиэпилептической терапии возможно развитие остеопороза у женщин как в климактерическом периоде, так и в молодом возрасте. Индукторы ферментов печени (фенобарбитал, фенитоин, карбамазепин) и, в меньшей степени, ингибиторы ферментов (вальпроаты) могут оказывать негативное влияние на метаболизм костной ткани и повышать риск развития остеопороза и переломов костей (P.Penovich и соавт., 2004) [30].
Ламиктал не оказывает негативного влияния ни на одно из звеньев метаболизма костной ткани и не увеличивает риска развития остеопороза (A.Pack и соавт., 2004) [29].
У женщин, страдающих эпилепсией, повышен риск возникновения аффективных нарушений (депрессии), что обусловлено полом (у женщин депрессия встречается в 2 раза чаще, чем у мужчин), психосоциальными ограничениями, связанными с хроническим заболеванием, и негативным воздействием некоторых антиконвульсантов – особенно барбитуратов (G.Barabas, W.Matthews, 1988) и вигабатрина (F.Besag, 2004) [8].
Ламиктал является корректором настроения (O.Devinsky, 2002). Улучшение настроения и антидепрессивный эффект ламиктала подтверждены в многочисленных исследованиях (D.Kalogjera-Sackelldies, 2002; K.Edwards и соавт., 2001; J.Cramer и соавт., 2004) [15, 22]. В настоящее время зарегистрированы дополнительные показания назначения ламиктала при биполярных расстройствах.
Целью исследования, проведенного на кафедре неврологии педиатрического факультета Российского государственного медицинского университета, являлось изучение клинической эффективности ламиктала при дополнительной терапии в лечении отдельных форм эпилепсии у детей и подростков, а также частоты и характера ПЭ.
Мы наблюдали 72 пациента с различными формами эпилепсии в возрасте от 5 мес до 14 лет (средний возраст 7,9±1,5 года, 39 мальчиков и 33 девочки). Изучали влияние ламиктала на частоту приступов: полная ремиссия (катамнез от 1 года до 4 лет), значительное улучшение (урежение приступов на 50% и более), незначительное улучшение или отсутствие эффекта. Также проводили анализ ПЭ терапии. Препарат назначали в дополнительной терапии при недостаточной эффективности монотерапии базовыми АЭП.
Диагноз эпилепсии устанавливали в стационаре на основании клинических и электроэнцефалографических данных, видео-ЭЭГ-мониторирования и нейровизуализационных исследований (КТ, МРТ). Всем больным проводили клинический анализ крови (с определением уровня тромбоцитов) и стандартный биохимический анализ крови в динамике (с определением уровня ферментов печени). Исследовали фармакокинетику АЭП. Выбор АЭП производили в соответствии с формой эпилепсии (К.Ю.Мухин, А.С.Петрухин, 1998) согласно рекомендациям рабочей группы ILAE (Ben Menachem и соавт., 2003).
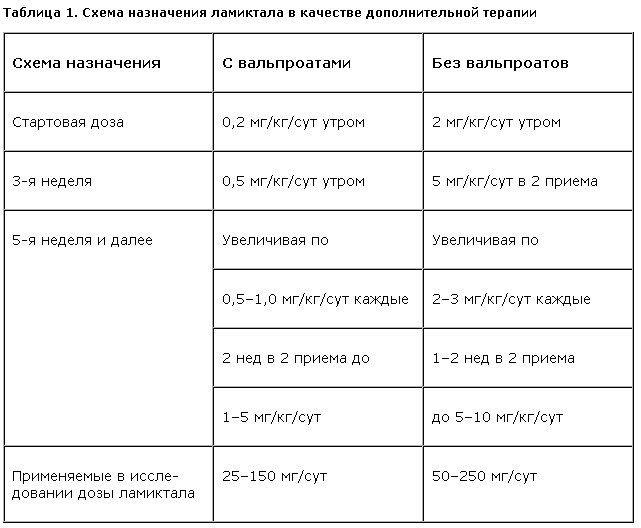
Назначение ламиктала начинали с суточной дозировки 2 мг/кг, с постепенным увеличением в течение 2–4 нед до 5 мг/кг в 2 приема. При добавлении ламиктала к препаратам вальпроевой кислоты начальную дозу уменьшали в 10 раз – до 0,2 мг/кг с постепенным увеличением до 2–3 мг/кг в 1 или 2 приема (табл. 1).
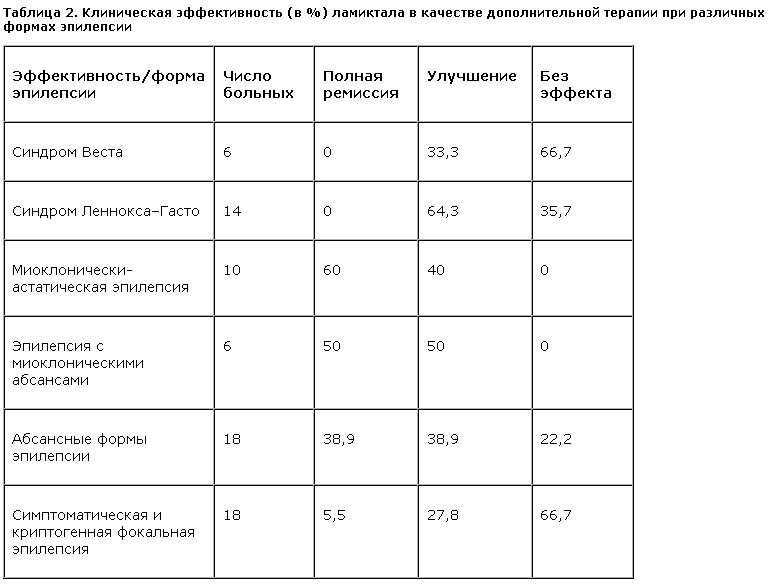
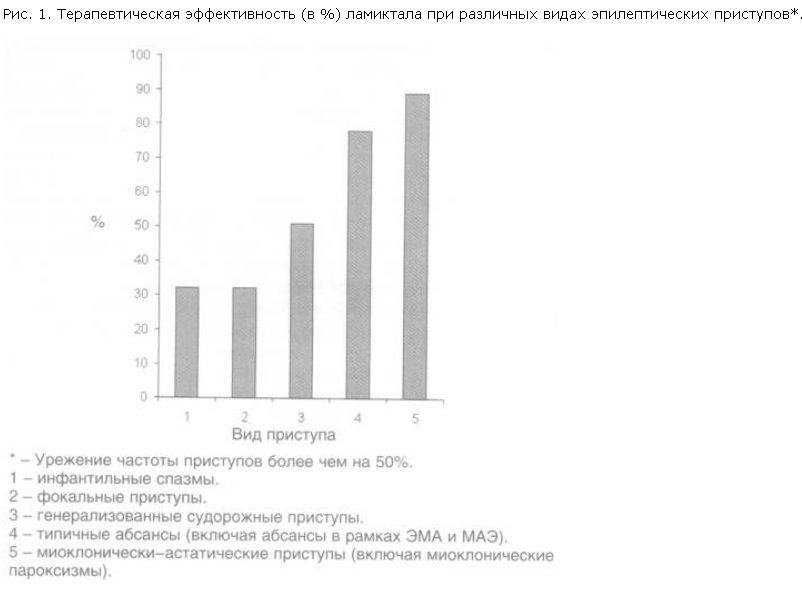
1. Полная терапевтическая ремиссия у пациентов с резистентными формами эпилепсии при добавлении ламиктала достигнута в 26,4% случаев, и значительное снижение частоты приступов наблюдали у 43,1% больных. Терапевтический эффект был минимальным или полностью отсутствовал только у 30,1% пациентов. Эффективность ламиктала существенно колебалась в зависимости от формы эпилепсии (табл. 2) и характера приступов (рис. 1).
2. Наиболее позитивный эффект при добавлении ламиктала был достигнут в лечении резистентных форм криптогенной генерализованной эпилепсии: миоклонически-астатической эпилепсии (МАЭ) и эпилепсии с миоклоническими абсансами (ЭМА). Обращало на себя внимание, что ламиктал был высокоэффективен во всех случаях криптогенной генерализованной эпилепсии с достижением полной терапевтической ремиссии в 60 и 50% случаев при МАЭ и ЭМА соответственно.
Таким образом, ламиктал вызывает аггравацию миоклоний только при злокачественных формах эпилепсии и ЮМЭ, что свидетельствует о различной патофизиологии миоклонических приступов. При лечении криптогенной генерализованной эпилепсии ламиктал применяли в комбинации с вальпроатами или вальпроатами и бензодиазепинами. Достижение стойкой ремиссии при добавлении ламиктала позволяло в дальнейшем постепенно снизить дозу или отменить бензодиазепины, что способствовало значительному улучшению когнитивных функций.
3. При абсансных формах эпилепсии (детской и юношеской абсанс-эпилепсии) ламиктал применяли в случае неэффективности монотерапии вальпроатами или непереносимости препаратов вальпроевой кислоты при монотерапии. Согласно нашим исследованиям примерно у 15% пациентов с абсансными формами эпилепсии наблюдается резистентность к производным вальпроевой кислоты или возникают реакции идиосинкразии при приеме данных препаратов (А.С.Петрухин и соавт., 1996) [1, 31, 32]. Монотерапия этосуксимидом приводит к урежению абсансов на 25% при ЮАЭ и в 11% случаев при ЮМЭ. Кроме того, назначение этосуксимида в виде монотерапии противопоказано при сочетании абсансов с ГСП.
Добавление ламиктала существенно снижало частоту абсансов у 38,9% больных и приводило к стойкому их исчезновению также в 38,9% случаев. Вместе с тем 22,2% больных по-прежнему оставались резистентными к лечению. Ламиктал также был недостаточно эффективен в купировании сопутствующих абсансам ГСП.
4. Синдромы Веста и Леннокса–Гасто были представлены главным образом резистентными к антиэпилептической терапии тяжелыми формами. Клиническое и электроэнцефалографическое улучшение при добавлении ламиктала наблюдали у 33,3% пациентов с синдромом Веста и у 64,3% пациентов с синдромом Леннокса–Гасто. Эффективность воздействия ламиктала повышается при генерализованных формах с большей зрелостью нейрональных систем.
5. Фокальная эпилепсия была представлена преимущественно симптоматическими формами, резистентными к моно- и политерапии базовыми и резервными АЭП. Клиническое улучшение было достигнуто у 1/3 общего числа больных: ремиссия – всего в 5,5% случаев и достоверно значимое урежение приступов – у 27,8% пациентов. У большинства пациентов (66,7%) терапевтический эффект отсутствовал или был незначительным. У 16,7% больных при добавлении ламиктала наблюдали учащение приступов (этот эффект был констатирован только в группе пациентов, страдающих фокальной симптоматической эпилепсией). В лечении фокальной эпилепсии ламиктал применяли в сочетании с карбамазепином и реже – с барбитуратами.
6. Положительное влияние ламиктала на поведение пациентов и когнитивные функции было отмечено в 45,8% случаев. Наблюдали улучшение самочувствия, уменьшение апатии и сонливости, выравнивание настроения. Важным достоинством ламиктала являлось значительное уменьшение выраженности, а в ряде случаев и исчезновение гиперактивности, дефицита внимания, а также улучшение школьной успеваемости.
7. Клиническая эффективность ламиктала сочеталась с позитивными изменениями ЭЭГ. Исчезновение эпилептиформной активности на ЭЭГ, особенно заметное при идиопатической и криптогенной генерализованной эпилепсии, при добавлении ламиктала зафиксировано у 58,3% больных, у которых имелись патологические изменения на ЭЭГ. В 31,3% отмечено уменьшение индекса медленных волн.
8. Побочные эффекты терапии при добавлении ламиктала наблюдали у 31,9% больных (рис. 2). Основным ПЭ являлась кожная сыпь, напоминающая таковую при краснухе.
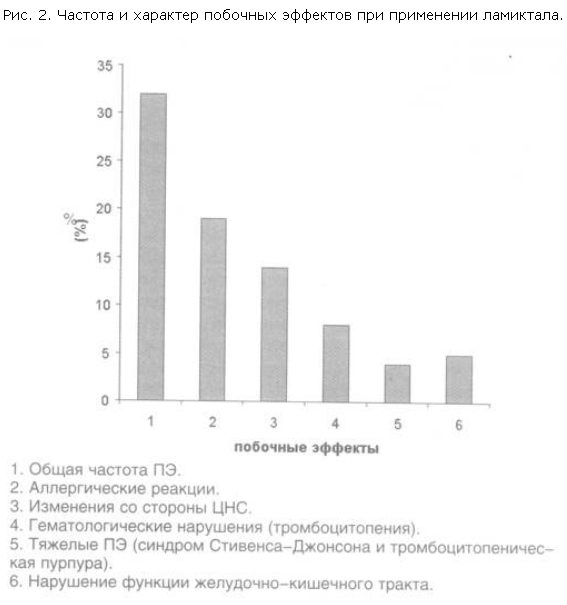
Отмечалась бледно-красная макулопапулезная сыпь, преимущественно на лице, распространяющаяся на туловище и проксимальные отделы конечностей. Данное осложнение отмечено у 18,1% пациентов и возникало обычно на 3–5-й неделе с момента назначения ламиктала, что совпадало со временем увеличения дозы препарата. В 1 (1,4%) случае кожная сыпь сочеталась с системной аллергической реакцией в виде лихорадки, лимфаденопатии, артралгии, миалгии и буллезной эритемы на слизистой оболочке полости рта; в крови отмечена эозинофилия – был диагностирован синдром Стивенса–Джонсона. У 2,8% больных имели место проявления респираторного аллергоза в виде отека и набухания слизистой оболочки носа с затруднением носового дыхания.
Нарушения со стороны центральной нервной системы (ЦНС) отмечены в 13,9% случаев и проявлялись следующими явлениями: диссомния (6,9% больных), психомоторное возбуждение (4,2%), головные боли (2,8%), вялость и сонливость (2,8%), атаксия (1,4%). У 1 пациента мы наблюдали не описанную ранее специфическую вегетативно-висцеральную реакцию на прием ламиктала: чрезмерную потливость в покое.
Симптомы со стороны желудочно-кишечного тракта при добавлении ламиктала наблюдали редко, всего в 2,8% случаев (боли в эпигастриуме, тошнота). Увеличение содержания ферментов печени по результатам биохимического анализа крови выявлено в 2,8% случаев; уровень ферментов (АЛТ, АСТ) был увеличен не более чем в 2 раза по сравнению с исходной нормой, что не сопровождалось какими-либо клиническими признаками поражения печени.
Изменения со стороны крови в виде тромбоцитопении в процессе терапии были выявлены у 8,3% больных. Тромбоцитопению диагностировали в случае прогрессирующего снижения уровня тромбоцитов ниже 180 тыс. при проведении повторных анализов крови. В 2,8% случаев тромбоцитопении сопутствовала тяжелая клиническая картина тромбоцитопенической пурпуры (массивные кожные петехии и экхимозы). Следует обратить внимание, что во всех случаях тромбоцитопения развилась у пациентов, которые принимали ламиктал в сочетании с препаратами вальпроевой кислоты.
У всех пациентов ПЭ возникали в течение 1,5 мес с момента начала лечения ламикталом. Побочные реакции со стороны ЦНС и желудочно-кишечного тракта появлялись обычно в первые дни назначения ламиктала или сразу после увеличения дозы препарата. Вместе с тем аллергические реакции и изменения в анализах крови возникали позже – спустя 3–5 нед с момента введения препарата. Необходимость отмены ламиктала при появлении ПЭ возникла у 20,8% больных, принимающих препарат, что составило 65,2% из числа пациентов, имеющих ПЭ. Абсолютными показаниями к моментальной отмене ламиктала были синдром Стивенса–Джонсона и тромбоцитопеническая пурпура; относительными показаниями к отмене – кожная сыпь и нарастающая тромбоцитопения. В остальных случаях ПЭ исчезали при снижении дозы препарата или спонтанно или были выражены минимально, без снижения качества жизни пациентов. При этом степень выраженности и характер ПЭ позволяли продолжать лечение при условии хорошего терапевтического эффекта.
Полученные в ходе исследования результаты сложно интерпретировать однозначно, ввиду того что всем пациентам ламиктал назначали дополнительно к базовым АЭП. Вместе с тем эффективность лечения оценивали до и после добавления препарата.
В исследовании отчетливо продемонстрирован различный эффект ламиктала в зависимости от формы эпилепсии. Наиболее оптимистичные результаты были получены при лечении криптогенной генерализованной эпилепсии: МАЭ, ЭМА, синдрома Леннокса–Гасто и абсансной эпилепсии. При симптоматической фокальной эпилепсии эффективность ламиктала была минимальной. В нашем исследовании ламиктал значительно снижал частоту и купировал приступы типичных абсансов при ДАЭ, но при присоединении ГСП был недостаточно эффективен, что согласуется с результатами других исследований (О.Dulac, 1994 [14]; F.Besag и соавт., 1997 [6]; L.Frank и соавт., 1997 [18]). Наши данные свидетельствуют о том, что при сочетании абсансов с ГСП ламиктал может быть недостаточно эффективен в отношении генерализованных судорожных приступов. Вместе с тем частота встречаемости ГСП при абсансных формах эпилепсии высока – от 33% при ДАЭ до 85% при ЮАЭ (А.С.Петрухин и соавт., 1996) [1]. В связи с этим применение ламиктала в монотерапии ювенильных абсансов в отношении стойкой ремиссии может быть весьма проблематичным.
Среди обследованных нами пациентов отмечена высокая эффективность препарата при МАЭ (улучшение во всех случаях), причем учащения приступов не наблюдали ни в одном случае. Ламиктал был эффективен в отношении всего полиморфизма приступов при МАЭ, снижая частоту не только типичных абсансов, но и миоклонически-астатических приступов, ГСП и фокальных пароксизмов. В нашем исследовании ламиктал был эффективен у всех пациентов, страдающих МАЭ, с достижением полной ремиссии в 50% случаев.
Симптоматическая и криптогенная фокальная эпилепсия являлась наиболее резистентной формой к терапии ламикталом. Кроме того, в единственной группе больных с фокальной эпилепсией при назначении ламиктала наблюдали эффект аггравации приступов, что согласуется с результатами исследования E.Schlumberger и соавт., 1992 [34]. Несмотря на невысокую эффективность препарата при фокальной эпилепсии, положительным моментом следует считать значительное улучшение поведения и когнитивных функций, достигнутое почти у половины общего числа пациентов на терапии. Это определяет показания для дополнительной терапии ламикталом фокальных форм эпилепсии.
Важнейшим свойством ламиктала, делающим его особенно привлекательным для педиатрической эпилептологии, является отсутствие угнетающего действия на когнитивные функции. В нашем исследовании позитивное влияние ламиктала на поведение и когнитивные функции отмечено в 45,8% случаев. Особенно следует отметить эффект препарата в редукции синдрома гиперактивности с дефицитом внимания.
Основным побочным эффектом при применении ламиктала считается кожная сыпь (Т.Betts и соавт., 1991) [9]. Частота возникновения кожной сыпи варьирует от 2,8 до 6%. Однако при сочетанном применении препарата с производными вальпроевой кислоты риск появления сыпи возрастает во много раз и может достигать 25%, по данным O.Dulac (1994 г.) [14]. Проблема заключается в том, что именно данные препараты, причем в максимально высоких дозах, эффективны при криптогенной генерализованной эпилепсии. По мнению многих исследователей, частое возникновение кожной сыпи при применении ламиктала в качестве дополнительной терапии значительно ограничивает его применение в эпилептологии. Следует учитывать и тот факт, что кожная сыпь может быть началом крайне серьезного ПЭ – синдрома Стивенса–Джонсона (1,4% в нашем исследовании). Поэтому при появлении кожной сыпи, связанной с введением ламиктала, препарат должен быть отменен. Однако, по данным некоторых исследователей, в дальнейшем можно повторить попытку введения ламиктала в схему терапии, используя режим более медленного наращивания дозы. Это допустимо только в тех случаях, если сыпь была умеренно выражена и отсутствовало поражение слизистых оболочек аллергического характера (F.Besag и соавт., 2000) [7]. После возникновения более тяжелых аллергических реакций повторный прием препарата недопустим. Уменьшить риск возникновения аллергических реакций реально при более медленном титровании дозы на начальном этапе введения препарата (в среднем в течение 6 нед).
Побочные эффекты ламиктала со стороны ЦНС относительно редки. В целом чаще отмечаются реакции раздражения (возбудимость, агрессия, бессонница), чем торможения (сонливость, вялость). Атаксия и диплопия наблюдаются лишь в 0,6–2% случаев и обычно не носят выраженный характер (Т.Betts и соавт., 1991) [9].
Особая настороженность при применении ламиктала должна соблюдаться в отношении развития тромбоцитопении. В нашем исследовании данный ПЭ был констатирован только у больных, получавших ламиктал в комбинации с вальпроатами. В 2,8% случаев тромбоцитопения сочеталась с тяжелой клинической картиной тромбоцитопенической пурпуры.
Несмотря на относительно частое появление ПЭ при терапии ламикталом в комбинации с другими АЭП, необходимость отмены препарата возникает в среднем лишь у 12% больных (Т.Betts и соавт., 1991; A.Petrukhin и соавт., 1997) [9, 32]. Однако считается, что при развитии и нарастании кожной сыпи препарат следует отменять во всех случаях (Т.Betts и соавт., 1991) [9]. Также, по нашему мнению, прогрессирующее уменьшение числа тромбоцитов, особенно в сочетании с появлением геморрагической сыпи, является абсолютным показанием к отмене ламиктала.
Таким образом, проведенное исследование показало, что ламиктал является высокоэффективным АЭП с широким спектром антиэпилептической активности. Основное показание к назначению ламиктала в виде дополнительной терапии – генерализованные формы эпилепсии, резистентные к монотерапии вальпроатами. Особенно высокая эффективность ламиктала при криптогенной генерализованной эпилепсии в сочетании со значительным улучшением когнитивных функций и поведения позволяет рекомендовать его применение в педиатрической эпилептологии. Необходимы дальнейшие исследования эффективности ламиктала в виде монотерапии при различных формах эпилепсии у детей и подростков.
Список исп. литературыСкрыть список1. Петрухин А.С., Бурд Г.С., Мухин К.Ю., Медведев М.И., Калинина Л.В.. Ламиктал в лечении эпилепсии у детей. Социальная и клиническая психиатрия. 1996; 6 (3): 121-4.
2. Arzimanoglou A. Treatment options in pediatric epilepsy syndromes. Epileptic disorders 2002; 3: 217-25.
3. Barabas G, Matthews WS. Barbiturate anticonvulsants as a cause of severe depression. Pediatrics 1988; 82: 284.
4. Barron TF, Hunt SL, Hoban TF, Price ML. Lamotrigine monotherapy in children. Pediatr Neurol 2000; 23 (2): 160-3.
5. Ben-Menachem E, Scheepers B, Stodieck S. Epilepsy: fron consesus to daily practise. Acta Neurol Scand 2003; 108 (Suppl. 180): 5-15.
6. Besag FM, Dulac O, Alving J, Mullens EL. Long-term safety and efficacy of lamotrigine (Lamictal) in paediatric patients with epilepsy. Seizure 1997; 6 (1): 51-6.
7. Besag FM et al. Successful re-introduction of lamotrigine after initial rash. Seizure 2000; 9 (4): 282-6.
8. Besag FM. Behavioural effects of the newer antiepileptic drugs: an update. Expert Opin Drug Saf 2004; 3 (1): 1-8.
9. Betts Т, Goodwin G, Withers RM, Yuen AWC. Human safety of Lamotrigine. Epilepsia 1991; 32 (Suppl. 2): 17-21.
10. Coppola G, Licciardi F, Sciscio N et al. Lamotrigine as first-line drug in childhood absence epilepsy: a clinical and neurophysiological study. Brain Dev 2004 Jan; 26 (1): 26-9.
11. Demir E, Aysun S. Weight gain associated with valproate in childhood. Pediatr Neurol 2000; 22 (5): 361-4.
12. Devinsky O, Vuong A, Hammer A, Barrett PS. Stable weight during lamotrigine therapy: a review of 32 studies. Neurology 2000; 54: 973-5.
13. Duchowny M Pellock JM, Graf WD et al. A placebo-controlled trial of lamotrigine add-on therapy for partial seizures in children. Lamictal Pediatric Partial Seizure Study Group. Neurology 1999; 53: 1724-31.
14. Dulac О. The use of Lamotrigine in children. Rev Contemp Pharmacother 1994; 5: 133-9.
15. Edwards KR, Sdckellares JC, Vuong A et al. Lamotrigine Monotherapy Improves Depressive Symptoms in Epilepsy: A Double Blind Comparison with Valproate. Epilepsy Behav 2001; 2: 28-36.
16. Ferrari M, Barabas G, Matthews WS. Psychologic and behavioral disturbance among epileptic children treated with barbiturate anticonvulsants. Am J Psych 1983; 140: 112-3.
17. Foldary-Schaefer N, Harden C, Herzog A, Falcone T. Hormones and seizures. Cleveland Clinic J Med 2004; 71 (Suppl. 2): 11-8.
18. Frank LM, Casale E, Womble G, Manasco P. Lamictal is effective for the treatment of newly - diagnosed typical absence seizures in children and adolescents. Ann of Neurol 1997; 42 (3): 489.
19. Pierre Genton, Jurgen Bauer, Susan Duncan et al. On the association Between Valproat and Polycystic Ovary Syndrome. Epilepsia 2001; 42 (3): 295-304.
20. Gibbs J, Appleton RE, Rosenbloom L, Yuen WC. Lamotrigine for intractable childhood epilepsy: a preliminary communication. Dev Med Child Neurol 1992; 34: 368-71.
21. Isojarvi JI, Tapanainen JS. Valproate, hyperandrogenism, and polycystic ovaries: a report of 3 cases. Neurol 2000; 57 (7): 1064-8.
22. Kalogjera-Sackelldies D, Sackellares JC. Improvement in depression associated with partial epilepsy in patients treated with lamotrigine. Epilepsy Behav 2002; 3: 510-6.
23. Meador KJ, Zupanc ML. Neurodevelopmental outcomes of children born to mothers with epilepsy. Cleveland Clinic J Med 2004; 71 (Suppl. 2): 38-41.
24. Mikkonen K, Vaniopaa K, Pakarinen AJ et al. Long-term reproducyive endocrine health in yong women with epilepsy during puberty. Neurology 2004; 62: 445-50.
25. Morrell MJ, Guidice L, Flynn KL et al. Predictors of ovulatiry failure in women with epilepsy. Ann Neurol 2002; 52: 704-11.
26. Morrell MJ, Montouris GD. Reproductive disturbances in patients with epilepsy. Cleveland Clinic J Med 2004; 71 (Suppl. 2): 19-24.
27. Morrow JJ, Craig JJ. Antiepileptic drugs in pregnancy: current safety and other issues. Expert Opin Pharmacother 2003; 4 (4): 445-6.
28. Novak GP, Maytal J, Alshansky A et al. Risk of excessive weight gain in epileptic children treated with valproate. J Child Neurol 1999; 14 (8): 490-5.
29. Pack AM, Gidal B, Vazquez B. Bone disease associated with antiepilaptic drugs. Cleveland Clin J Med 2004; 71 (Suppl. 2): 42-9.
30. Penovich PE, Eck KE, Economou VV. Recommendation for care of women with epilepsy. Cleveland Clin J Med 2004; 71 (Suppl. 2): 49-58.
31. Petrukhin AS, Mukhin KYu, Medvedev MI. Lamictal in the treatment of epilepsy in children. Epilepsia 1996; 37 (Suppl. 3): 14.
32. Petrukhin AS, Mukhin KYu, Medvedev MI. Lamotrigine in the treatment of cryptogenic generalized epilepsy. Epilepsia 1997; 38 (Suppl. 3.): 66.
33. Sabers A, Dam M, Rogvi A et al. Epilepsy and pregnancy: lamotrigine as main drug used. Acta Neurol Scand 2004; 109 (1): 9-13.
34. Schlumberger E, Chavez F, Dulac O, Moszkowski J. Open study with lamotrigine (LTG) in child epilepsy. Seizure 1992; 1 (Suppl. 3): 9-21.
35. Solowiej E, Sobaniec W, Kozik A, Ujma-Czapska B. The use of lamotrigine monotherapy in children with newly diagnosed partial epilepsy. Neurol Neurochir Pol 2000; 33 (Suppl. 1): 129-41.
36. Tennis P, Eldridge RR, and International Lamotrigine Pregnancy Registery Scientific Advisory Committee Preliminary results on pregnancy outcomes in women using lamotrigine. Epilepsia 2002; 10: 1161-7.
37. Trimble MR, Cull CA. Antiepileptic drugs, cognitive function, and behavior in children. Cleve Clin J Med 1989; 56 (Suppl. 1): 140-6; discussion P. 147-9.
38. Trimble MR, Cull C. Children of school age: The influence of antiepileptic drugs on behavior and intellect. Epilepsia 1988; 29 (Suppl. 1): 15-9.
39. Vainionpaa LK, Rattya J, Knip M et al. Valproate induced hyperandrogenism during pubertal maturation in girls with epilepsy. Ann Neurol 1999; 45 (4): 444-50.
40. Wallace SJ. Add-on open trial of lamotrigine in resistant childhood seizures. Brain Devel 1990; I2: 739.
41. Yerby MS, Kaplan P, Tran T. Risk and managent of pregnancy in women with epilepsy. Cleveland Clin J Med 2004; 71 (Suppl. 2): 25-37.

