Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2003
Электроэнцефалограмма предикторы эффективности холинергической и глутаматергической терапии при болезни Альцгеймера №01 2003
Значительное место в терапии болезни Альцгеймера (БА) занимает коррекция нейромедиаторных нарушений (С.И.Гаврилова, Г.А.Жариков, 2001). Холинергический дефицит является одним из центральных биохимических звеньев в патогенеза БА. У больных БА дегенерируют холинергические нейроны базального ядра Мейнерта, гиппокампа, снижается уровень холинацетилтрансферазы в коре. С холинергической недостаточностью связано развитие интеллектуально-мнестических расстройств (P.Whitehouse и соавт., 1982).
Для коррекции холинергического дефицита наиболее широко используются ингибиторы ацетилхолинэстеразы – фермента, разрушающего ацетилхолин. Препараты этой группы (амиридин, такрин, экселон, арисепт, физостигмин) улучшают когнитивные функции больных. После терапии увеличивается спектральная мощность альфа-активности электороэнцефлограммы (ЭЭГ), повышается церебральный энергетический обмен и локальный мозговой кровоток (Н.Михайлова и соавт., 1991; A.Nordberg и соавт., 1992). Однако положительный эффект от приема препаратов наблюдается лишь у 20–60% больных, причем он наступает после длительного лечения (Н.Д. Селезнева и соавт., 2001).
Другой подход к лечению БА связан с воздействием на глутаматергическую нейротрансмиссию. Глутамат является главным возбуждающим медиатором в мозге. Глутаматергические нейроны находятся в коре мозга, гиппокампе, обонятельной луковице, черной субстанции, мозжечке. При недостаточности глутамата нарушаются процессы длительной потенциации, с которыми связана консолидация следов памяти. С другой стороны, глутамат при длительном экстранейрональном повышении его концентрации оказывает нейротоксическое действие. Это наблюдается, в частности, когда из-за недостаточного энергетического обеспечения нейронов происходит их деполяризация. Избыточная активация NMDA глутаматных рецепторов приводит к массивному поступлению кальция в нейроны, включенного в ряд энзиматических реакций с участием фосфолипаз, протеаз и эндонуклеаз, расщепляющих клеточные структуры (C.Cotman, L.Iversen, 1987).
Акатинол мемантин является модулятором глутаматергической системы. При недостаточной активации глутаматергических рецепторов препарат улучшает глутаматергическую нейротрансмиссию, нормализуя процессы длительной потенциации и тем самым способствуя восстановлению процессов памяти и обучения. В случае избыточной активации глутаматных рецепторов этот препарат блокирует NMDA-рецепторы, защищая нейроны от нейротоксического действия глутамата (W. Dimpfel, 1995). Показано, что акатинол мемантин улучшает память, внимание и интеллектуальные функции при БА. Положительный эффект наблюдается у 40–50% больных БА (Н.Д.Селезнева и соавт., 2001).
Наиболее многочисленные данные накоплены к настоящему времени о предикторах терапевтического эффекта холинергической терапии, в частности такрина и амиридина. Результаты исследований, однако, не носят однозначного характера, что может быть связано с особенностями действия препаратов этой группы, а также с различиями в выборках больных, принимающих участие в испытаниях. Имеются данные, что амиридин более эффективен у больных с мягкой, чем с умеренной деменцией (Н.Д.Селезнева и соавт., 2001). Респондеры на физистигмин также имели несколько более высокие показатели по мини-тесту оценки психического состояния – MMSE (L.Thal и соавт., 1996). Однако, по данным D.Aarsland и соавт. (1995), положительный терапевтический ответ на такрин чаще обнаруживается у больных с умеренной, чем с мягкой или тяжелой деменцией.
Одним из факторов, влияющих на эффективность терапии, может быть функциональная сохранность церебральных структур, участвующих в терапевтическом ответе. Информативным методом оценки функционального состояния структур мозга при БА является ЭЭГ. У больных БА снижается основная частота ЭЭГ, редуцируется альфа- и бета-активность и увеличивается медленноволновая активность, причем снижение альфа-активности связано с холинергической недостаточностью (А.Ф.Изнак и соавт., 1999). Характеристики бета-активности зависят от сохранности моноаминергической и глутаматергической нейротрансмиссии (H.Boddeke и соавт., 1997). Имеются единичные данные об ЭЭГ-предикторах терапевтического ответа на различные препараты у больных БА, в частности показано, что отношение альфа-тета в некоторых областях у респондеров на такрин выше, чем у нереспондеров (O.Almkvist и соавт., 2001).
Целью настоящей работы являлось выявление ЭЭГ-предикторов эффективности амиридина, влияющего на холинергическую нейротрансмиссию, и акатинола мемантина – модулятора глутаматергической системы при БА.
Материал и методы исследования
Обследовано 26 больных БА в возрасте 63,7±1,2 года, которые в последующем получали лечение амиридином, а также 24 больных БА в возрасте 65,5±1,4 года, получавшие в дальнейшем акатинол мемантин. В качестве контроля использовали данные ЭЭГ 19 здоровых испытуемых того же возраста (63,6±1,7 года), которые для исключения церебральной патологии проходили неврологическое и электрофизиологическое обследование. Диагностика БА включала психиатрическое, нейропсихологическое, неврологическое, компьютерно-томографическое обследования и необходимые лабораторные тесты. Больные соответствовали критериям МКБ-10 для вероятной БА с ранним началом (до 65 лет). Все они были обследованы на этапе клинически выраженной деменции (этап 2). Амирин назначали 40 мг в день в течение 2 мес, акатинол мемантин – в дозе 10 мг в день в течение 2 мес.
Психическое состояние пациентов оценивали дважды: до начала терапии и после ее окончания – MMSE (M.Folstein и соавт., 1975). Эффективность терапии оценивали также по шкале общего клинического впечатления – Clinical Global Impression – CGI (1976). В зависимости от эффективности терапии больные были классифицированы как респондеры и нереспондеры. Респондерами считали пациентов с улучшением оценки по шкале MMSE к моменту завершения курса терапии по сравнению с оценкой до начала лечении на 3 балла и более и с оценкой эффекта терапии по шкале CGI как очень хорошего, выраженного и умеренно выраженного. Нереспондерами считали больных с изменением оценки по шкале MMSE на 2 балла и менее и с оценкой терапевтического эффекта по шкале CGI как минимальное улучшение, его отсутствие или ухудшение.
ЭЭГ регистрировали у испытуемых в состоянии спокойного бодрствования на электроэнцефалографе Nihon Kohden 4217G EEG (Япония) при постоянной времени 0,3 с и верхней частоте пропускания 30 Гц. Во время записи ЭЭГ обследуемые сидели в кресле с закрытыми глазами. Экспериментатор контролировал уровень бодрствования испытуемых, наблюдая за ними и мониторируя ЭЭГ. 16 электродов Ag/AgCl помещали в соответствии с международной схемой 10–20 в следующих областях: O2, O1, P4, P3, C4, C3, F4, F3, Fp2, Fp1, T6, T5, T4, T3, F8, F7. В качестве референтного использовали объединенный ушной электрод. Сопротивление в областях регистрации не превышало 10 кОм. Анализ ЭЭГ проводили с помощью компьютерной системы анализа и картирования ЭЭГ Brainsys 1.8 (Россия).
После окончания записи ЭЭГ просматривали и удаляли периоды артефактов. С помощью быстрого преобразования Фурье обрабатывали 60 с свободной от артефактов ЭЭГ (эпоха анализа 4 с). Находили относительную спектральную мощность (% общей спектральной мощности ЭЭГ) для дельта (1,00–3,99 Гц), тета (4,00–6,99), альфа (7,00–12,99), бета1 (13,00–19,99), бета2 (20,00–30,00) в каждом отведении. Кроме того, оценивали относительную спектральную мощность ЭЭГ в узких частотных диапазонах (по 1,5 Гц). Для того чтобы распределение параметров ЭЭГ соответствовало нормальному в соответствии с рекомендациями T.Gasser и соавт. (1982) производили преобразование относительной спектральной мощности в каждом отведении по формуле: log [x/(1–x)], где x – это непреобразованная относительная спектральная мощность ЭЭГ. После этого вычисляли среднюю относительную спектральную мощность ЭЭГ для каждого частотного диапазона. Достоверность различий параметров ЭЭГ у больных БА и здоровых, а также у респондеров и нереспондеров оценивали с помощью однофакторного дисперсионного анализа (ANOVA).
У больных БА относительная спектральная мощность медленноволновой активности дельта- и тета-диапазона повышена, а альфа- и бета-активности снижена по сравнению с нормой. Параметры ЭЭГ у больных БА, получавших акатинол мемантин и амиридин, не различались. Больные в этих группах имели также близкие показатели мнестико-интеллектуальных нарушений (MMSE 13,5±0,6 и 13,0±0,8 балла соответственно).
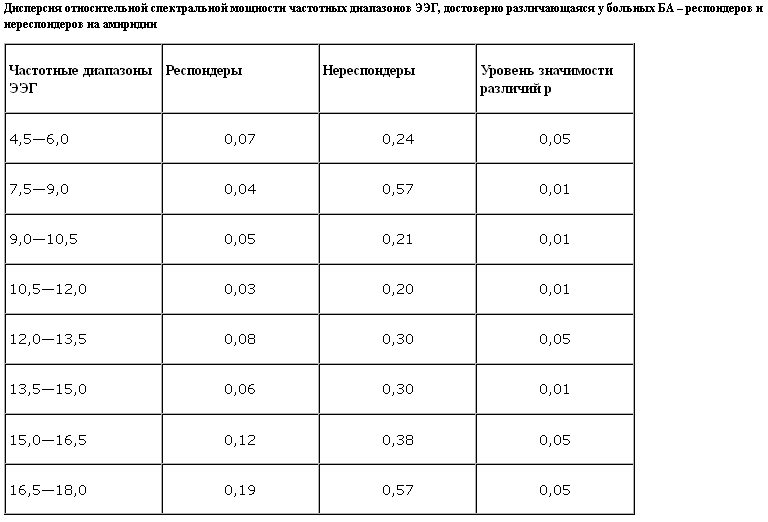
При лечении амиридином положительный терапевтический ответ был получен у 8, отрицательный – у 18 больных. Средние величины относительной спектральной мощности основных частотных диапазонов ЭЭГ (дельта-, тета-, альфа-, бета1- и бета2-) достоверно не различались у респодеров и нереспондеров на амиридин. Однако у респондеров разброс величины относительной мощности альфа-активности был значимо меньше, чем у нереспондеров (рис. 1). Дисперсия величины относительной мощности альфа-активности у респондеров составила 0,05, у нереспондеров – 0,52, различия между группами по этому показателю достоверны (F критерий 10,4, p<0,01).
Согласно этим данным респондерами на амиридин являются больные БА с достаточно узким диапазоном нарушений альфа-активности, близким к среднему значению в группе больных БА. Результаты находятся в определенном параллелизме с клиническими данными о том, что ингибиторы ацетилхолинэстеразы более эффективны у больных БА с умеренной степенью мнестико-интеллектуального снижения (MMSE 14–21), чем при более легкой или тяжелой деменции (D.Aarsland и соавт., 1995). В генерации альфа-ритма участвуют холинергические механизмы (T.Marczynski, L.Burns, 1976). Можно полагать, что при значительном поражении холинергических структур и соответственно снижении относительной мощности альфа-активности повышение уровня ацетилхолина при лечении амиридином уже не компенсирует нарушений в холинергических структурах мозга в связи с уменьшением числа холинорецепторов. Неожиданным является отсутствие терапевтического ответа у больных с относительно сохранным альфа-ритмом (более высоким, чем в среднем по группе).
Возможно, у таких больных в генезе клинических расстройств играют большую роль нехолинергические механизмы, и воздействие на холинергическую нейротрансмиссию не является достаточным для положительного терапевтического эффекта. Другое объяснение этого факта может быть связано с неоднородностью альфа-ритма, частотные составляющие которого изменяются неодинаково по мере прогрессирования БА, причем высокочастотный альфа-ритм часто замещается низкочастотной альфа-активностью.
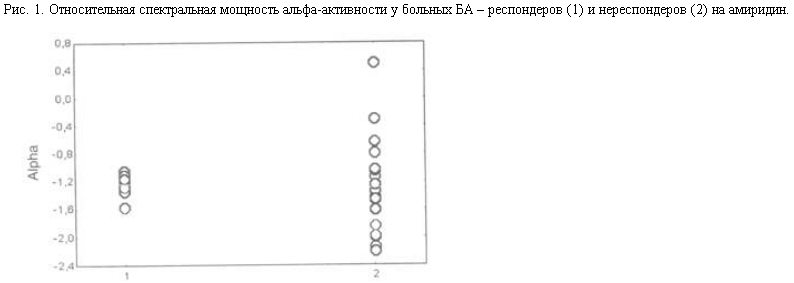
Для проверки этого предположения проводился анализ ЭЭГ в узких частотных диапазонах (по 1,5 Гц). Было найдено, что величина относительной спектральной мощности в диапазоне высокочастотного альфа-ритма (10,5–12,0 Гц) у респондеров достоверно выше, чем у нереспондеров, F критерий составил 4,37, p<0,05 (рис. 2). Напротив, относительная мощность низкочастотного альфа-ритма (7,5–9 Гц) была несколько выше у нереспондеров, чем у респондеров, хотя различия не достигали уровня значимости. Это подтверждало представление о том, что для положительного ответа на амиридин необходима относительная сохранность холинергических структур мозга.
Таким образом, положительный ответ на амиридин возможен у больных БА с умеренно выраженным снижением относительной спектральной мощности ЭЭГ в альфа- и бета-диапазонах, при относительной сохранной высокочастотной альфа-активности. Полученные результаты позволяют заключить, что положительный эффект амиридина предполагает возможность терапевтического ответа холинергических структур мозга и их взаимодействия с нехолинергическими медиаторными системами.
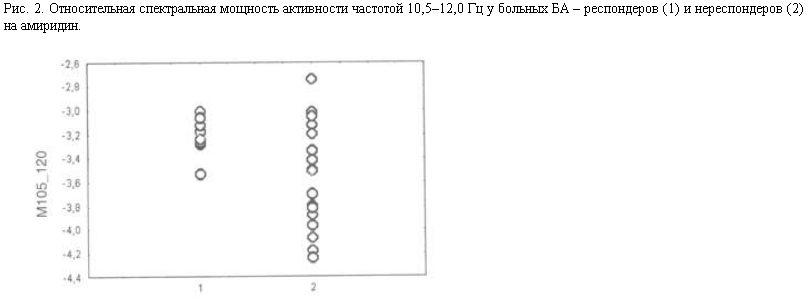
Рассмотрим результаты, полученные при исследовании ЭЭГ-предикторов клинической эффективности акатинола мемантина. На этот препарат положительный терапевтический ответ наблюдали у 13, а отрицательный – у 11 больных БА. У респондеров на акатинол по сравнению с нереспондентами была достоверно больше относительная спектральная мощность альфа- и бета1-активности и меньше относительная мощность дельта-активности (рис. 3). У респондеров относительная спектральная мощность бета1-активности не отличались от нормы, что указывает на большую сохранность у них глутаматергических и моноаминергических нейротрансмиттерных систем.
У нереспондеров показатели относительной мощности всех диапазонов ЭЭГ отличались от нормы. Более близкие к норме показатели ЭЭГ у респондеров по сравнению с нереспондерами соответствуют и клиническим данным о том, что положительный терапевтический ответ на акатинол более вероятен у больных с менее тяжелыми когнитивными нарушениями (Н.Д.Селезнева и соавт., 2001).
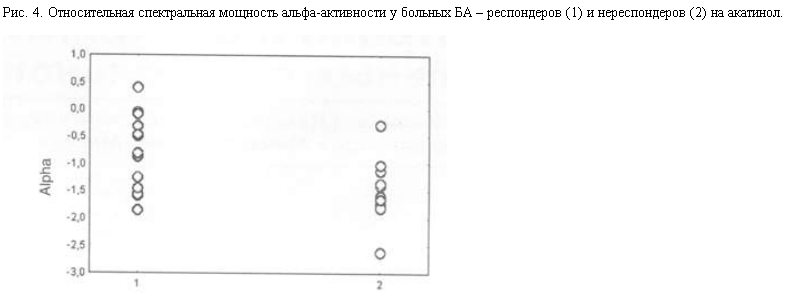
По величине дисперсии относительной спектральной мощности параметров ЭЭГ различий между респондерами и нереспондерами на акатинол мемантин не было. Из рис. 4 видно, что у респондеров на акатинол мемантин (в отличие от респондеров на амиридин) дисперсия параметров относительной мощности альфа-активности не отличалась от нереспондеров. Это свидетельствует о том, что положительный терапевтический ответ на акатинол может наблюдаться у больных БА с достаточно большими вариациями нарушений ЭЭГ.
Итак, респондеры на акатинол мемантин характеризовались в целом менее выраженными изменениями ЭЭГ, чем нереспондеры, при этом спектр изменений параметров ЭЭГ, когда возможен положительный ответ на акатинол, был достаточно широк. Последнее можно объяснить модулирующим влиянием акатинола мемантина на глутаматергическую систему, зависящим от ее состояния. Препарат не только восстанавливает глутаматергическую нейротрансмиссию в случаях ее снижения, но оказывает нейропротективный эффект, предохраняя нейроны от эксайтотоксического действия глутамата.
Заключение
Полученные в настоящем исследовании данные могут быть использованы в качестве параклинического теста для прогноза эффективности лечения больных БА. Амиридин показан пациентам с достаточно узким спектром изменений ЭЭГ, которые характеризуются умеренным снижением альфа- и бета-активности при относительно сохранной высокочастотной составляющей альфа-ритма. Акатинол мемантин эффективен у больных БА с более широким спектром нарушений ЭЭГ, чем амиридин. Положительный ответ на акатинол более вероятен у пациентов с сохранными ЭЭГ показателями: высокой относительной спектральной мощностью альфа- и бета1-активности и низкой относительной мощностью дельта-активности.


