Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03 2003
Применение ноотропов у больных резидуальной шизофренией №03 2003
Широкое внедрение нейролептической терапии значительно изменило характер работы психиатрических больниц и позволило пересмотреть существовавшие представления о фатальной неизбежности развития дефекта при шизофрении [1–6]. Высокая эффективность нейролептических препаратов при терапии шизофрении позволила расширить показания для их назначения как для купирования острых психотических состояний, так и для противорецидивной терапии [7–10]. Однако развивающиеся в процессе терапии нейролептиками побочные эффекты часто усугубляют течение свойственных самому шизофреническому процессу нарушений. При этом побочные эффекты могут неправильно интерпретироваться как постпсихотическая депрессия, негативные симптомы или даже аггравация болезни, что приводит к повышению дозы антипсихотических препаратов, дополнительному назначению других нейролептиков, антидепрессантов или анксиолитиков, каждый из которых сам по себе вызывает добавочные нежелательные явления [11, 12].
В настоящее время можно выделить несколько подходов к улучшению переносимости нейролептической терапии. Один из них – сочетание традиционных нейролептиков с антихолинергическими препаратами, которые, однако, сами по себе являются достаточно токсичными, приводят к ухудшению когнитивных функций, являются средствами злоупотребления [13]. Второй подход – перевод больных с лечения традиционными нейролептиками на применение атипичных нейролептиков [9, 14]. Третьим и наименее изученным подходом к коррекции данного вида нарушений является присоединение к лечению традиционными нейролептиками ноотропных препаратов, которые, по мнению многих авторов [11, 15], не только уменьшают нежелательные явления антипсихотической терапии, но и положительно действуют на интеллектуально-мнестические функции.
До настоящего времени динамика психопатологических расстройств в результате сочетанного применения ноотропов с традиционными нейролептиками у больных шизофренией остается малоизученной. С помощью применения специальных клинико-психопатологических и патопсихологических методов можно получить наиболее полную картину изменения интеллектуально-мнестических свойств при применении высоких доз ноотропов, что позволит в дальнейшем обосновывать их применение у больных резидуальной шизофренией.
Актуальность изложенного определила необходимость целенаправленного сравнительного исследования действия ноотропных препаратов при лечении больных резидуальной шизофренией.
Целью исследования явилась разработка показаний для применения ноотропов у больных резидуальной шизофренией на основе сравнительного анализа их эффективности/переносимости и влияния на когнитивные функции. Для исследования отбирали больных резидуальной шизофренией при условии стойкости резидуального состояния (минимум один год до настоящего обследования), непрерывно получающих терапию нейролептиками со времени установления диагноза шизофрении, а в течение последнего года – терапию малыми и неизменными дозами нейролептиков. Общее количество баллов по шкале PANSS>60 баллов. Исследуемую выборку составили 138 больных. Всех пациентов наблюдали в условиях стационара, причинами госпитализации в который являлись социальные факторы (невозможность обеспечения себя в случае проживания больного без родственников; собственное желание больного находиться под наблюдением врача в отделении, в котором он неоднократно проходил лечение; прохождение комиссии по вопросу трудоспособности в условиях стационара, а также перевод из загородных больниц). Большинство исследуемых пациентов были мужчины (64,5%), средний возраст составил 51,8±1,7 года. В основном все больные имели среднее специальное образование – 71,01% (98 человек), неоконченное высшее – 25,4% (35 человек) и только 3,6% (5 человек) – высшее образование. Большинство включенных в исследование пациентов являлись инвалидами II группы по психическому заболеванию (94,2%), у 2,1% (3 больных) было выявлено заметное снижение профессионального статуса, а 3,6% (5 человек) не работали. Преобладали одинокие больные – 85,5% (118 человек), в браке состояло только 14,5% (20 человек). Приведенная социодемографическая характеристика исследуемых пациентов представляется типичной для больных с резидуальной шизофренией и соответствует данным, приведенным в других исследованиях [16, 17].
Длительность активного этапа течения шизофрении у всех больных составляла в среднем 9,7±2,01 года. Характерной особенностью состояния всех пациентов до лечения было наличие той или иной степени выраженности побочной экстрапирамидной симптоматики.
В анамнезе клиническое состояние пациентов характеризовалось галлюцинаторно-параноидными (68,9% – 95 человек) и аффективно-бредовыми (31,1% – 43 человека) приступами. Течение заболевания (согласно МКБ-10) определялось либо как эпизодическое с нарастанием негативной симптоматики в ремиссиях – 89 (64,5%) пациентов (F 20.01), либо как обострения с сохраняющейся, но не нарастающей негативной симптоматикой в ремиссиях – 49 (35,5%) пациентов (F20.02). Средняя длительность резидуального периода составляла 15,4±1,2 мес. Большинство больных (47,1%) стационировались в психиатрические больницы от 10 до 24 раз. Структура резидуfльного состояния характеризовалась астеноадинамическим (53,6% – 74 человека) и апатоабулическим синдромами (46,4% – 64 человека). Все пациенты на протяжении периода наблюдения получали поддерживающее лечение нейролептиками в неизменных дозах (галоперидол 15 мг в сутки или трифтазин 15 мг в сутки), а также корректорами (циклодол до 6 мг в сутки).
Больные в произвольном порядке были распределены по терапевтическим группам:
1-я группа – 34 больных, получающих высокие дозы гинкго билоба (360 мг);
2-я группа – 24 больных, получающих гинкго билоба в низкой дозе (120 мг);
3-я группа – 30 больных, получающих пирацетам в высоких дозах (4,8 г);
4-я группа – 30 больных, получающих пирацетам в низкой дозе (1,2 г);
5-я группа – 20 человек – контрольная группа (больные, не получавшие ноотропов).
Длительность исследования составила 6 нед и была достаточной для выявления собственно ноотропного действия изучаемых препаратов.
В случаях появления нежелательных явлений при терапии ноотропами (диссомнические расстройства, тревога, усиление двигательной активности) допускали дополнительное назначение 10 мг реланиума внутримышечно на ночь.
Все исследуемые группы больных до начала терапии были равноценны по социодемографическим и по клиническим характеристикам. Соотношение больных с сильно выраженными расстройствами и с умеренно выраженными психическими нарушениями во всех группах было одинаково – 5: 1.
Надежность результатов настоящей работы в большей степени определяла гомогенность пяти изучаемых групп пациентов, получающих разные препараты ноотропного ряда по социодемографическим и клиническим характеристикам. Больные в выделенных группах относительно равномерно распределялись по таким значимым факторам, как пол, возраст, длительность и тяжесть состояния. С больными не проводили специальные психотерапевтические занятия, и их не выделяли в особые группы.
Методы исследования включали клинико-психопатологическое обследование, а также оценку динамики тяжести заболевания и общей эффективности терапии по шкале CGI, позитивных, негативных и общепатологических расстройств по шкале PANSS, выраженность экстрапирамидной симптоматики, тест дифференцированной самооценки состояния "Самочувствие, активность, настроение", методики исследования интеллектуально-мнестических функций.
Общую эффективность высоких и низких доз гинкго билоба и пирацетама при терапии больных резидуальной шизофренией оценивали при помощи традиционного психопатологического анализа заболевания, а также по шкале CGI. При анализе результатов лечения было выявлено, что степень выраженности заболевания (шкала CGI-S) претерпевала существенные изменения в процессе терапии ноотропами. Динамика этих изменений была неодинаковой в группах больных, принимающих разные дозы препаратов.
Наибольшие изменения в состоянии отмечены у больных, принимавших высокие дозы ноотропов. При этом следует подчеркнуть, что самыми выраженными они были при лечении пирацетамом, тогда как положительная динамика в состоянии больных, принимавших высокие дозы гинкго билоба, приводила в основном к увеличению числа больных с умеренно выраженными психическими нарушениями. В конце терапии критерию "слабо выраженных психических нарушений" соответствовало в 1,5 раза больше больных, принимавших пирацетам, чем гинкго билоба. При этом критерию "выраженных психических нарушений" соответствовали лишь 7% больных (2 человека) в 3-й группе пациентов и 10% в 1-й группе больных (см. рисунок).
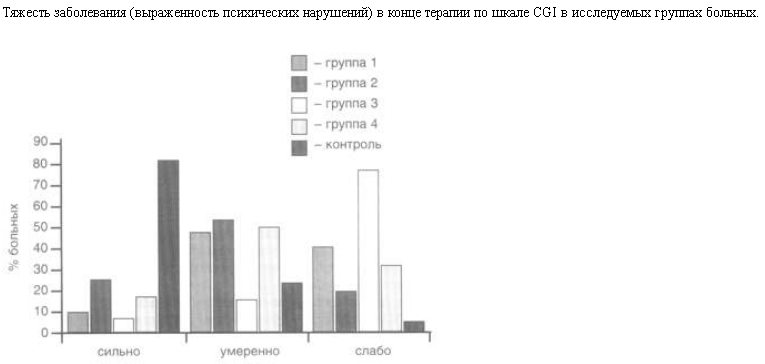
В отличие от пациентов, принимавших высокие дозы ноотропов, среди принимавших низкие дозы улучшение было менее выраженным. Однако и здесь более значимые результаты наблюдали в группе больных, принимавших пирацетам (4-я группа). При этом процент больных с "умеренно выраженными психическими нарушениями" вырос на 33%, а у принимавших гинкго билоба – на 37%. Число пациентов, у которых к концу терапии состояние соответствовало критерию "слабо выраженных психических нарушений", также было больше у принимавших пирацетам (33%), чем у леченных гинкго билоба (21%). При этом "сильно выраженные психические нарушения" наблюдали у 25% больных, использующих низкие дозы гинкго билоба, и только у 17% в группе пациентов, принимавших пирацетам в низких дозах.
В контрольной группе к концу терапии состояние только 5% больных соответствовало критерию "слабо выраженных психических нарушений"; критерию "умеренно выраженных психических нарушений" соответствовало состояние 10% больных, и осталось на таком же уровне число пациентов с "сильно выраженными психическими нарушениями" (85%).
Таким образом, в результате лечения наибольшие изменения в состоянии отмечены у больных, принимавших высокие дозы ноотропов, преимущественно пирацетама. Так, к концу терапии высокими дозами пирацетама число пациентов со "слабо выраженными психическими нарушениями" в 1,5 раза превышало таковое у больных, принимавших высокие дозы гинкго билоба, почти в 2 раза – низкие дозы пирацетама и почти в 4 раза – низкие дозы гинкго билоба. Применение ноотропов приводило к увеличению числа пациентов, состояние которых соответствовало критерию "умеренно выраженные психические нарушения". К концу лечения среди пациентов, принимавших высокие дозы препаратов, было выявлено лишь 17% случаев "выраженных психических нарушений", тогда как у пациентов, принимавших низкие дозы, эти случаи составляли 42%; их было в 2 раза меньше при использовании пирацетама, чем гинкго билоба. В контрольной группе число больных, состояние которых соответствовало "сильно выраженным психическим нарушениям", не изменилось в процессе терапии.
При оценке общей эффективности терапии (CGI-I) в изучаемых группах больных отмечено различие в степени положительной динамики, а также в скорости наступлении терапевтического эффекта. К концу терапии ее эффективность преобладала у больных, принимавших высокие дозы препаратов. В группе пациентов, принимавших высокие дозы гинкго билоба (1-я группа), выраженную эффективность терапии наблюдали у 26,4% больных, существенную – у 29,4%, незначительную – у 44% больных. У пациентов, принимавших высокие дозы пирацетама (3-я группа), изменения были более наглядными. Так, у 43,3% больных наблюдали выраженный терапевтический эффект, у 16,6% – существенный, у 40% – незначительный. В то время как в группе больных, принимавших низкие дозы гинкго билоба (2-я группа), отсутствовали больные с выраженной эффективностью терапии; существенную эффективность наблюдали у 41,6% больных, незначительную – у 41,6%, а у 16% состояние оставалось без перемен. В группе больных, принимавших низкие дозы пирацетама, только у 6,6% больных отмечена выраженная эффективность, существенная – у 40%, незначительная – у 43,3% и состояние 10% больных не изменилось. В контрольной группе у 45% больных наблюдали незначительное снижение эффективности терапии.
Об общей эффективности терапии ноотропами свидетельствует также соотношение процента респондеров и нонреспондеров (шкала CGI-I). К концу терапии самый большой процент респондеров наблюдали в группах больных, принимавших высокие дозы ноотропов, а нонреспондеров – низкие дозы ноотропов и в контрольной группе. Так, в процессе применения высоких доз пирацетама и гинкго билоба респондеры составляли 60% (18 человек) и 56% (19 человек) соответственно, тогда как в группах больных, принимавших низкие дозы пирацетама и гинкго билоба, – 47% (14 человек) и 43% (10 человек).
На протяжении терапии у всех больных наблюдали постепенное снижение среднего балла шкалы PANSS, однако степень и время его редукции были различными. Анализ полученных данных позволил заключить, что наиболее ранняя (на 7-й день терапии) и выраженная редукция среднего балла по шкале PANSS отмечена у больных, принимавших высокие дозы пирацетама и гинкго билоба (на 12,2 и 9% соответственно). Среди больных, принимавших низкие дозы препаратов, наибольшая редукция среднего балла отмечена в группе больных, получавших пирацетам (на 5,8% по сравнению с фоном), а изменение среднего балла у пациентов, леченных низкими дозами гинкго билоба, не носило статистической значимости на всем протяжении лечения.
Применение пирацетама оказывало более выраженное воздействие на редукцию негативной симптоматики: у больных уменьшались явления эмоциональной отгороженности, повышалась способность к налаживанию межперсональных контактов, а также редуцировались такие симптомы, как апатия, утрата энергии и волевых побуждений, что повышало активность и инициативность больных в повседневной деятельности. Применение гинкго билоба имело большее воздействие на редукцию общей психопатологической симптоматики (снижалась моторная заторможенность, уменьшалась малоконтактность, повышалась инициативность), что в свою очередь также повышало активность и улучшало самочувствие больных. Таким образом, во всех исследуемых группах наблюдали снижение среднего общего балла по шкале PANSS при наличии различий в скорости и степени выраженности редукции показателей субшкал в каждой группе больных.
Проведенный анализ динамики баллов самоопросника "Самочувствие, активность, настроение" (САН) в контрольной группе обнаружил отсутствие достоверных изменений в показателях субшкал самочувствия и настроения, а также ухудшение активности пациентов к концу лечения (р>0,05). Применение ноотропов в любых дозах оказывало положительное влияние на активность больных. По сравнению с контрольной группой активирующий эффект наступал раньше при применении высоких доз препаратов: причем у больных, принимавших высокие дозы гинкго билоба, к концу лечения наблюдали более выраженное увеличение показателя активности (на 7% больше, чем у больных, принимавших высокие дозы пирацетама). У больных, леченных низкими дозами ноотропов, достоверное увеличение показателя активности наступало позже – на 30-й день терапии, и было менее выраженным (при использовании гинкго билоба наблюдали более выраженное увеличение активности – на 3% больше, чем при приеме пирацетама).
Использование ноотропов приводило к редукции экстрапирамидной симптоматики у больных резидуальной шизофренией. Наиболее выраженные положительные изменения наблюдали у больных, принимавших высокие дозы пирацетама (3-я группа) – к концу терапии редукция показателя составила 34% по сравнению с фоном. Несколько меньшая редукция экстрапирамидной симптоматики отмечена у больных, леченных низкими дозами пирацетама (на 23%) и высокими дозами гинкго билоба (на 30,6%). У пациентов, принимавших низкие дозы гинкго билоба, улучшение этого показателя не было статистически значимым. В отличие от пациентов, получавших ноотропы, в контрольной группе больных отмечен рост экстрапирамидной симптоматики, которая носила статистически значимый характер уже с 14-го дня лечения.
Переносимость изучаемых ноотропов оценивали при помощи шкалы UKU, позволяющей провести анализ времени появления различных побочных расстройств (кардиоваскулярных, вегетативных, психомоторных).
Во всех группах больных наибольшее число нежелательных эффектов возникало уже в первые дни лечения, а максимальное – на 14-й день терапии. Начиная с 21-го дня терапии отмечено достоверное (р<0,005) и устойчивое снижение числа побочных эффектов. При этом побочные эффекты существенно не влияли на самочувствие больных.
При сравнении числа побочных эффектов в изучаемых группах выявлено, что наибольшее их количество было в контрольной группе больных (2,55 побочных эффекта у одного больного).
Побочные эффекты при использовании гинкго билоба и пирацетама отличались как по спектру, так и по частоте их возникновения. Применение гинкго билоба как в высоких, так и в низких дозировках в большей степени приводило к развитию нарушений вегетативных функций (расстройства со стороны желудочно-кишечного тракта, головные боли), а также к возникновению кардиоваскулярных побочных эффектов (головокружение, гипотензия, тахикардия). Число этих побочных эффектов почти в 2 раза превышало таковые у больных, использующих пирацетам. При применении пирацетама как в высоких, так и в низких дозировках преобладали психомоторные нарушения в виде усиления тревоги, беспокойства, двигательной активности и диссомнии. Число этих нарушений почти в 2 раза превышало таковые при использовании гинкго билоба. В связи с усилением двигательной активности из исследования были исключены 5 больных, принимавших высокие дозы пирацетама, и 3 больных, принимавших высокие дозы гинкго билоба. Следует особо отметить, что возникавшие в процессе лечения психомоторные побочные эффекты не вызывали экзацербации процесса, проявлялись в виде усиления беспокойства и тревоги, купировались внутримышечным назначением 10 мг реланиума и уменьшались в процессе терапии. Использование высоких доз препаратов приводило к увеличению почти в 1,5 раза частоты возникновения побочных вегетативных, психомоторных и кардиоваскулярных расстройств, однако их появление не являлось причиной отказа от лечения ноотропами.
В отличие от активирующих психомоторных эффектов в процессе терапии ноотропами у большинства больных контрольной группы наблюдали расстройства в виде повышенной слабости (80%) и уменьшения двигательной активности (60%), которые в отличие от подобных проявлений при терапии ноотропами носили стойкий характер и усиливались в процессе терапии.
Для изучения кратковременной и долговременной памяти использовали тест "10 слов для запоминания" (А.Р.Лурия, 1962). Применение ноотропов увеличивало объем кратковременной памяти. Более выраженный эффект наблюдали у больных, принимавших высокие дозы препаратов. При этом у больных, принимавших пирацетам, показатель объема кратковременной памяти на 10,5% превышал таковой у пациентов, использующих гинкго билоба. В группах больных, получавших низкие дозы препаратов, увеличение объема кратковременной памяти было также большим (на 10%) среди пациентов, принимавших пирацетам. В контрольной группе больных к концу терапии показатель кратковременной памяти снизился на 12,1% от исходного уровня.
Как показали данные, полученные в конце исследования, показатели долговременной памяти у всех больных, принимавших ноотропы (1–4 группы), улучшались в процессе лечения. Наилучшие результаты отмечены у больных, принимавших высокие дозы препаратов, по сравнению с низкими. При этом больные, получавшие высокие дозы пирацетама, воспроизводили к концу терапии на 15% слов больше, чем пациенты, принимавшие высокие дозы гинкго билоба. При терапии низкими дозами препаратов также отмечено преимущество пирацетама. В контрольной группе больных к концу терапии показатель долговременной памяти снизился на 20% от исходного уровня. Следует отметить, что улучшение кратковременной и долговременной памяти наступало на 21, 30, 44-й дни и по времени совпадало со сроком наступления "медленного" специфического компонента действия ноотропов [15].
Изучение показателей внимания у больных с резидуальной шизофренией (таблица Крепелина) показало, что улучшение показателя объема внимания наступало раньше при лечении пирацетамом, а степень его улучшения была больше в процессе терапии гингко билоба. Так, в группе больных, принимавших высокие дозы гингко билоба, к концу терапии объем внимания увеличился на 57% от исходного уровня, а при применении высоких доз пирацетама – на 34,5% по сравнению с фоном. В группе больных, принимавших низкие дозы гингко билоба (2-я группа), объем внимания к концу лечения возрос на 26,8%, а при низких дозах пирацетама – на 20,8% от исходного уровня.
Показатель качества внимания (число допущенных ошибок при выполнении теста по Крепелину) также улучшился в процессе терапии ноотропами во всех исследованных группах. Терапия высокими дозами препаратов приводила к более выраженному снижению числа ошибок (на 58% при терапии гинкго билоба и пирацетамом), чем низкими дозами (на 52% при лечении гинкго билоба, и на 39% – пирацетамом). В контрольной группе отмечено увеличение числа сделанных ошибок на 3,4% по сравнению с фоном.
В результате терапии ноотропами наблюдали достоверное улучшение скорости выполнения заданий. К концу терапии отмечалось большее увеличение этого показателя в группе больных, принимавших высокие и низкие дозы пирацетама (на 25,5 и 11,3% соответственно), чем в группах, получавших высокие и низкие дозы гинкго билоба (на 10 и 7,5% соответственно). В контрольной группе к концу лечения наблюдали ухудшение скорости выполнения задания на 25,7% по сравнению с фоном (р<0,05).
Результаты исследования коэффициента интеллекта у больных показали незначительную его положительную динамику, не достигающую статистически значимого характера (р>0,05). В контрольной группе больных наблюдали незначительное ухудшение этого показателя, статистически не имеющее достоверного значения.
Таким образом, результаты исследования выявили, что применение ноотропов у больных резидуальной шизофренией на фоне длительной терапии нейролептиками повышает эффективность лечения за счет редукции общей психопатологической симптоматики, экстрапирамидных расстройств и улучшения интеллектуально-мнестических функций. При этом было отмечено, что применение высоких доз ноотропов является более эффективным, чем применение низких доз. Отмеченная обратимость в процессе терапии ноотропами определенных негативных проявлений позволяет рассматривать их как следствие нейролептической терапии и частично относить ко вторичным негативным расстройствам, в том числе к синдрому дефицита, вызванного нейролептиком. Об этом свидетельствует и ряд других исследований. Так, в работах многих авторов [18–20] показано, что такие симптомы, как уплощение аффекта, абулия, эмоциональная отгороженность, обеднение речи, ангедония, т.е. нарушения, относимые к негативным симптомам, в ряде случаев являются обратимыми и по существу представляют собой побочные эффекты фармакотерапии. Назначение ноотропов больным резидуальной шизофренией показано при длительном (не менее 1 года) отсутствии психотической симптоматики и преобладании дефицитарных, а также экстрапирамидных расстройств. Длительность применения ноотропов должна превышать 4–6 нед, что соответствует срокам наступления “медленного” специфического компонента действия ноотропов. Пирацетам следует назначать больным шизофренией, резидуальное состояние которых определяется апатоабулическим синдромом с преобладанием экстрапирамидных и негативных расстройств, а гинкго билоба – больным шизофренией, резидуальное состояние которых определяется астеноадинамическим синдромом с преобладанием общих психопатологических нарушений.
Список исп. литературыСкрыть список1. Авруцкий Г.Я., Недува А.А., Фотьянов М.И. Основы социальной психиатрии и социально-трудовой реабилитации психически больных. М., 1981; 29–54.
2. Авруцкий Г.Я., Гурович И.Я., Громова В.В. Фармакотерапия психических заболеваний. М.: Медицина, 1974; 471 с.
3. Снежневский А.В. Руководство по психиатрии. М.: Медицина. Т. 1, 1983.
4. Тиганов А.С. Руководство по психиатрии, в 2 томах. М.: Медицина, 1999.
5. Barnas C et al. Psychopharmacology 1990; 100: 361–5.
6. Gur RE, Pearlson G. Schizophr Bull 1993; 19: 337–53.
7. Мосолов С.Н. Шкалы психометрической оценки симптоматики шизофрении и концепция позитивных и негативных расстройств. М., 2001.
8. Вовин Р.Я. Шизофренический дефект (диагностика, патогенез, лечение). СПб.: Психоневрологический институт им. В.П.Бехтерева, 1991; 171 с.
9. Калинин В.В., Рывкин П.В. Психиатр. и психофармакотер. 1999; 1.
10. Lieberman JA. Intern J Neuropsychopharmacol (Montreal) 2002.
11. Рыжаков Б.А. Обозрение психиатр. и мед. психол. им. Бехтерева. 1996; 1–2: 54–7.
12. Flaum M, Andreasen N. Comprehensive Psychiatry 1995; 36 (6): 421–7.
13. Малин Д.И., Козырев В.В., Равилов Р.С. Психиатр. и психофармакотер. 2001; 6.
14. Emsley R. Intern J Neuropsychopharmacol (Montreal) 2002.
15. Аведисова А.С. Дис... д-ра мед. наук. М., 1999; 313 с.
16. Бочаров А.В. Автореф. дис... д-ра мед. наук. 1996; 22 с.
17. Магомедова М.В. Соц. и клин. психиатр. 2000; 1: 92–8.
18. Borison RL. Acta Psychiatr Scand 1996.
19. Freidman JI. Cognition in schizophrenia. Impairments, Importance and Treatment Strategies. – Sharma T., Harvey Ph. (eds), Oxford University Press, Oxford-New-York, 2000; 303–32.
20. Gold S, Arndt S, Nopoulos P et al. Am J Psychitr 1999; 156: 1342–8.

