Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03 2003
Эффективность ремерона в комплексной терапии алкогольного абстинентного синдрома №03 2003
Патологическое влечение к алкоголю часто сопровождается снижением настроения, чувством неудовлетворенности, тревогой и раздражительностью [1, 7, 8]. В структуре алкогольного абстинентного синдрома (ААС) гипотимия и тревога наблюдаются в 95% случаев, а в период ремиссии частота депрессивных нарушений сохраняется на уровне 20–25% [1, 2, 5].
Депрессия значительно осложняет течение алкоголизма и обостряет патологическое влечение к алкоголю. С наличием депрессии связывают более частые рецидивы алкоголизма и развитие запойных состояний, увеличение количества потребляемого алкоголя, а также нарушение поведения и более частые и длительные периоды временной нетрудоспособности и госпитализации у больных с алкогольной зависимостью [1, 5, 6, 9].
Тесная взаимосвязь алкоголизма и депрессии обусловлена их общими патогенетическими звеньями. Установлено, что алкоголь при длительном употреблении приводит к подавлению моноаминергической активности и снижению активности серотонина в ЦНС [3, 10–13]. Алкоголь обладает анксиолитическим эффектом, сходным с эффектом производных бензодиазепина и при однократном приеме подавляет тревогу и панические расстройства. Отмена алкоголя у больных хроническим алкоголизмом сопровождается уменьшением тормозящей активности ГАМК-ергической системы мозга, что приводит к развитию тревожных состояний и эпилептических припадков в период алкогольной абстиненции [12].
При ААС депрессивные нарушения и другие психопатологические симптомы тесно связаны с соматовегетативными и неврологическими расстройствами и обусловлены токсическим и собственно депримирующим действием алкоголя. Адекватное лечение ААС и раннего постабстинентного периода имеет важное значение, так как во многом определяет дальнейшее течение заболевания, закладывая фундамент для становления терапевтической ремиссии. Современные способы купирования ААС предполагают использование дезинтоксикационной и общеукрепляющей терапии в комплексе с психотропными препаратами различных групп и классов – транквилизаторами, гипнотиками, нейролептиками, нормотимиками и антидепрессантами, действие которых направлено на устранение патологического влечения к алкоголю и коррекцию психопатологических нарушений [9, 14–17]. При выборе антидепрессанта традиционно предпочтение отдается препаратам седативного действия и наиболее часто амитриптилину [2, 8, 9, 16, 17], так как антидепрессанты со стимулирующими свойствами могут обострять тревогу, усиливать бессонницу и тягу к алкоголю. В то же время амитриптилин, обладая кардиотоксическими свойствами и выраженной адрено- и холинолитической активностью, может усилить ряд соматических проявлений ААС и спровоцировать развитие алкогольного делирия [18, 19].
В последние годы появилось новое поколение антидепрессантов, лишенных серьезных побочных эффектов и в первую очередь холинолитических и кардиотоксических свойств с отчетливым седативным и анксиолитическим действием. К числу таких препаратов относятся леривон (миансерин) и коаксил (тианептин), эффективность которых в комплексной терапии ААС была установлена во многих исследованиях [2, 8, 15, 17, 20, 21]. Другим новым антидепрессантом, со схожим спектром психотропной активности, является ремерон [11, 17]. И хотя эффективность ремерона у больных хроническим алкоголизмом отмечена в ряде публикаций [11, 17], специальных контролируемых исследований по оценке его применения в комплексной терапии острого периода ААС в доступной нам литературе мы не обнаружили.
Препарат "Ремерон" (миртазапин), выпускаемый фармацевтической компанией "Organon", – антидепрессант тетрациклической структуры, по химическому строению сходный с леривоном (миансерином). Он является активным центральным антагонистом пресинаптических a2-адренорецепторов, которые повышают норадренергическую нейротрансмиссию, а также избирательно стимулирует 5-НТ1-серотониновые рецепторы. Таким образом, ремерон по своим фармакодинамическим характеристикам является одновременно норадренергическим и селективным серотонинергическим антидепрессантом. Препарат обладает умеренной антигистаминной активностью, с чем отчасти связано его седативное действие и практически лишен адрено- и холинолитических побочных эффектов и кардиотоксических свойств. Ремерон быстро всасывается из желудочно-кишечного тракта, его биодоступность составляет 50%. Пик концентрации в крови достигается через 2 ч после приема таблетки внутрь. Средний период полувыведения препарата составляет примерно 20–40 ч. Этого достаточно для однократного приема препарата в течение суток без развития эффекта кумуляции.
Спектр психотропной активности ремерона определяется отчетливым тимоаналептическим действием, сочетающимся с седативным и анксиолитическим эффектом. Отмечена эффективность применения ремерона в лечении инсомнии [22, 23].
Целью данной работы явилось изучение эффективности и безопасности применения антидепрессанта ремерона (миртазапина) в комплексной терапии ААС.
Материал и методы исследования
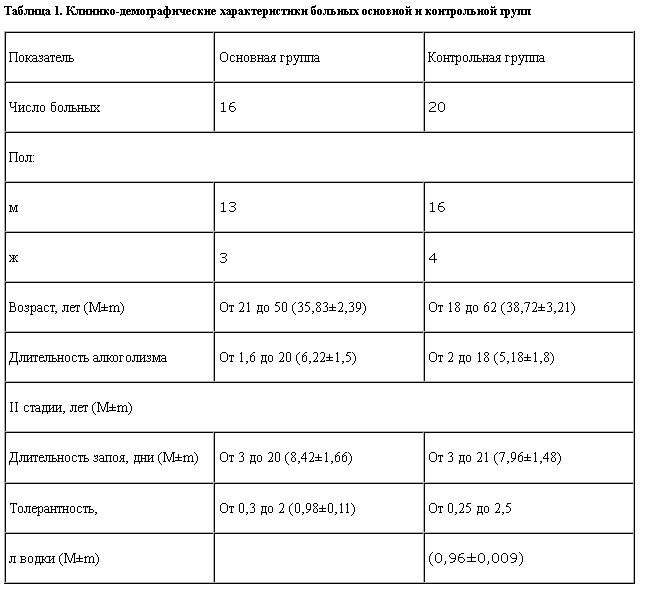
Были изучены 36 больных (29 мужчин и 7 женщин) в возрасте от 18 до 62 лет со II стадией алкоголизма и развернутым ААС. Больные поступали на лечение в клинику наркологии кафедры психотерапии и наркологии ФПК медицинских работников РУДН и отделение интенсивной терапии отдела терапии психических заболеваний Московского НИИ психиатрии Минздрава РФ после многодневного злоупотребления алкоголем. Длительность запоя составляла от 3 до 21 дня, толерантность – от 0,25 до 2,5 л водки. В исследование не включали больных с сопутствующей тяжелой соматической и неврологической патологией, а также с III стадией алкоголизма.
Вторую (основную) группу составили 16 больных, которым в комплексе с дезинтоксикационной, общеукрепляющей и перечисленной выше психофармакотерапией применяли ремерон. Препарат назначали в дозе от 30 до 60 мг в сутки в один прием, в первый день с момента поступления в стационар, а затем на ночь.
Группы больных были сопоставимы по основным клинико-демографическим показателям и исходной выраженности симптомов ААС (табл. 1).
Для стандартизации исследования была разработана индивидуальная оценочная карта, состоящая из двух частей – анамнестической и клинико-терапевтической. В клинико-терапевтической части в динамике в процессе терапии фиксировали выраженность основных психопатологических, соматовегетативных и неврологических симптомов, входящих в структуру ААС. Также оценивали частоту сердечных сокращений и артериальное давление. Степень выраженности каждого симптома оценивали по 4-балльной шкале (1 балл – симптом отсутствует, 2 балла – слабо выражен, 3 балла – умеренно выражен, 4 балла – сильно выражен). Регистрацию симптоматики осуществляли 2 раза в сутки на протяжении 5 дней с момента поступления больного в стационар.
Статистический анализ достоверности различий усредненных показателей в основной и контрольной группах проводили с помощью t-критерия Стьюдента.
Анализ динамики обратного развития психопатологических симптомов, входящих в структуру ААС (рис. 1) показал, что начиная с 3-го дня терапии у больных основной группы по сравнению с контрольной на статистически достоверном уровне (р<0,01) отмечено более быстрое снижение суммарного значения выраженности симптомов, оцениваемых по 4-балльной шкале.

Так, в группе больных, в которой назначен ремерон, начиная со 2–3-го дня лечения, отмечены достоверные различия (р<0,05 и р<0,01) в выраженности таких симптомов ААС, как влечение к алкоголю, тревога, гипотимия, беспокойство, раздражительность и нарушение сна (табл. 2).
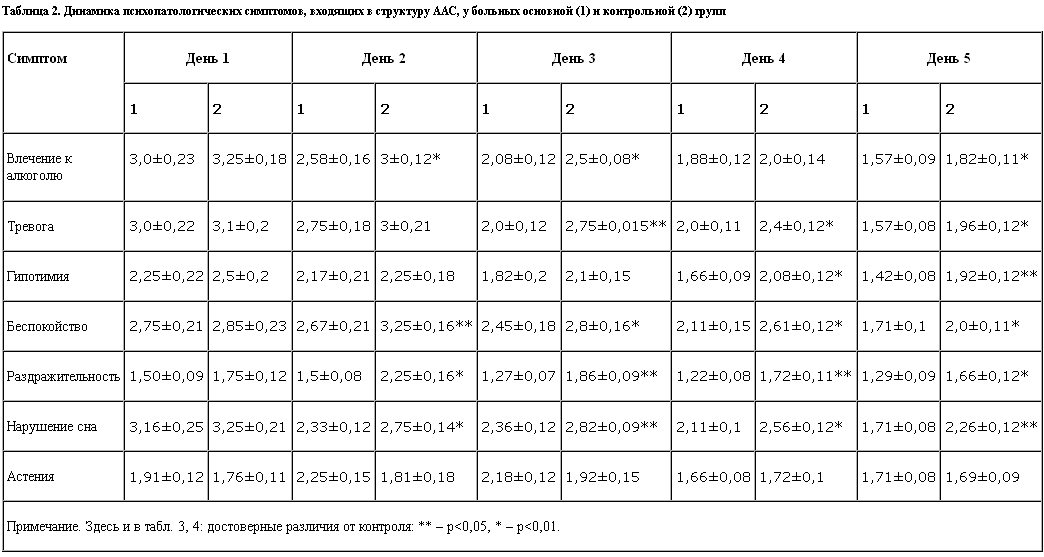
На рис. 2 представлена динамика обратного развития соматовегетативных и неврологических симптомов, входящих в структуру ААС, в процессе терапии.
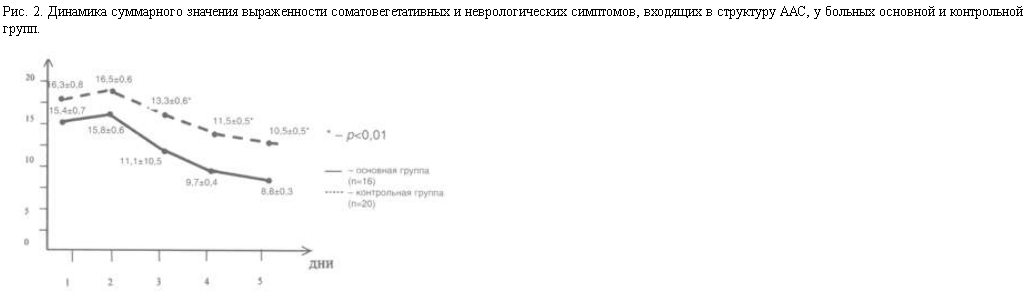
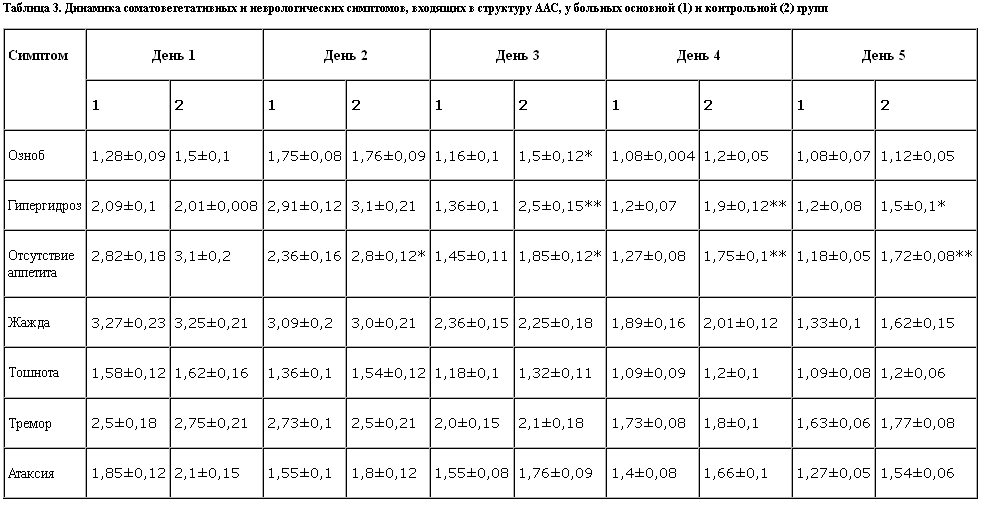
Более быстрое улучшение аппетита при назначении ремерона у больных с ААС, по всей видимости, связано с умеренной антигистаминной активностью препарата. Назначение ремерона не приводило к усилению астении и неврологических расстройств (тремора и атаксии), характерных для ААС, и не сопровождалось какими-либо побочными эффектами.
Анализ влияния ремерона на динамику основных гемодинамических показателей – частоту сердечных сокращений и артериального давления представлен в табл. 4.
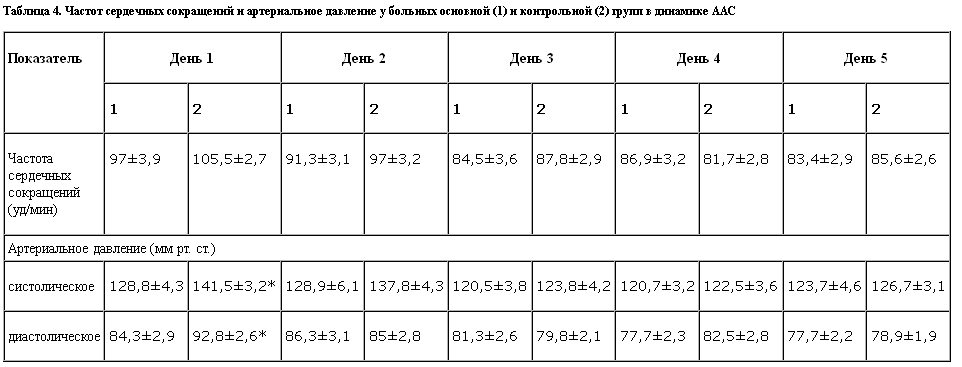
Как видно из полученных данных, в группе больных, получавших ремерон, начиная с первых дней терапии, отмечены достоверные различия (р<0,01) в выраженности систолического и диастолического артериального давления, которые в последующие дни нивелировались. Различий в частоте сердечных сокращений в динамике обратного развития ААС у больных основной и контрольной групп обнаружено не было. Нормализация артериального давления, отмеченная нами при назначении ремерона, по всей видимости, связана с его слабой адренолитической активностью. Эта сторона действия препарата является положительной для больных алкоголизмом с ААС, поскольку у них в этот период прослеживается отчетливая тенденция к повышению артериального давления.
Заключение
Таким образом, проведенное исследование показало эффективность и безопасность применения ремерона (миртазапина) в комплексной терапии ААС. Его назначение способствует более быстрой редукции таких симптомов ААС, как тревога, пониженное настроение, беспокойство, раздражительность и нарушение сна. Препарат уменьшает влечение к алкоголю, улучшает аппетит, стабилизирует артериальное давление, уменьшает озноб и потоотделение в остром периоде ААС. Быстро развивающееся седативное и анксиолитическое действие ремерона дает возможность полностью отказаться от назначения транквилизаторов и гипнотиков у больных с ААС. Все это в сочетании с хорошей переносимостью препарата позволяет рекомендовать его использование у больных с хроническим алкоголизмом с первых дней похмельного синдрома.
Список исп. литературыСкрыть список1. Гофман А.Г., Александрова Н.В., Граженский А.В. и др. Депрессивные нарушения в структуре основных синдромов алкоголизма и их купирование. Пособие для врачей. М.: 1999; 121 с.
2. Гофман А.Г., Крылов Е.Н., Граженский А.В. и др. Социальн. и клин. психиатр., 2001; II (3): 41–3.
3. Cornelins JR, Sallourn IM, Cornelius MD et al. Psychopharmacol Bull 1993; 29: 195–9.
4. Roy A, Dejong J, Lamparski D et al. Arch Gen Psychiat 1991; 48 (5): 428–36.
5. Weissman MM, Myeis JK. Amer J Psychiat 1980; 137: 372–3.
6. Roy A, Lmnoila M. Suicide Life – Threat Behav 1986; 16: 224–73.
7. Альтшулер В.Б. Патологическое влечение к алкоголю: вопросы клиники и терапии. М.: Имидж, 1994; 216 с.
8. Иванец Н.Н. Место антидепрессантов в терапии патологического влечения к алкоголю. Лекции по наркологии (под редакцией проф. Н.Н.Иванца). М.: Медпрактика, 2001; 117–26.
9. Энтин Г.М., Гофман А.Г., Музыченко А.П., Крылов Е.Н. Алкогольная и наркотическая зависимость. М.: Медпрактика, 2002; 327 с.
10. Анохина И.П. Биологические механизмы зависимости от психоактивных веществ (патогенез). Лекции по наркологии (под редакцией проф. Н.Н.Иванца). М.: Медпрактика, 2001; 223–32.
11. Иванец Н.Н., Анохина И.П., Агибалова Т.В. и др. Вопр. наркол., 2001; 1: 20–8.
12. Шабанов П.Д.Основы наркологии. СПб.: Лань, 2002; 555 с.
13. Balltnger JC, Goodwin FK, Major LF et al. Arch Gen Psychiatry 1980; 36: 226–7.
14. Гофман А.Г., Граженский А.В., Крылов Е.Н. и др. Патогенетическая терапия алкогольного абстинентного синдрома. Учебно-методическое пособие. М., 1995; 19 с.
15. Иванец Н.Н., Даренский И.Д. и др. Лечение алкоголизма, наркоманий, токсикоманий (в таблицах). М.: Анахарсис, 2000; 57 с.
16. Энтин Г.М. Лечение алкоголизма. М.: Медицина, 1990; 416 с.
17. Иванец Н.Н. Кинкулькина М.А. Психиатр. и психофармакотер., 2001; 3 (3): 1–6.
18. Малин Д.И. Побочное действие психотропных средств. М.: Вузовская книга, 2000; 207 с.
19. Стрелец Н.В. Острые психозы у больных хроническим алкоголизмом и опийной наркоманией, развивающиеся в ходе стационарного лечения. Лекции по наркологии (под редакцией проф. Н.Н.Иванца). М.: Медпрактика, 2001; 223–32.
20. Иванец Н.Н., Анохина И.П., Чирко В.В. и др. Социальн. и клин. психиатр., 1998; 8 (1): 68–73.
21. Malka P, Loo H, Ganry H et al. Br J Psychiatry 1992; 160 (suppl. 15): 66–71.
22. Мосолов С.Н. Клиническое применение современных антидепрессантов. СПб.: Мединформ. Агентство, 1995; 568 с.
23. Мосолов С.Н., Костюкова Е.Г. и др. Социальн. и клин. психиатр., 2000; 1: 55–60.


