Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№06 2003
Оланзапин в сравнении с галоперидолом при лечении острых психотических состояний у эндогенных больных №06 2003
При выборе лекарственного средства для купирования острого психотического состояния предпочтение традиционно отдавалось препаратам, оказывающим мощное антипсихотическое действие в максимально короткие сроки. Традиционные, или классические, нейролептики позволяют успешно решить задачу быстрого купирования острой психотической симптоматики у больных эндогенными заболеваниями, но частое возникновение и сильная выраженность побочных эффектов, в первую очередь неврологических, нередко приводят к отказу от продолжения терапии и как следствие к новому обострению заболевания. Попытки избежать возникновения или уменьшить интенсивность нежелательных побочных эффектов путем использования недостаточно высоких доз препарата являются одной из основных причин развития терапевтической резистентности. У части больных не удается добиться терапевтического эффекта и при назначении больших доз классических нейролептиков. Кроме того, традиционные нейролептики недостаточно эффективны в отношении дефицитарных расстройств и сами могут приводить к развитию вторичной фармакогенной негативной симптоматики, что затрудняет реабилитацию больных после купирования острого психоза.
Появление нового поколения антипсихотических препаратов – так называемых атипичных антипсихотиков – значительно расширило возможности терапии эндогенных заболеваний. Атипичные антипсихотики в силу особенностей спектра своего нейрохимического действия обладают мощным антипсихотическим эффектом, значительно реже вызывают возникновение экстрапирамидных побочных нарушений при применении в терапевтически эффективных дозах, оказывают воздействие как на позитивные, так и на негативные симптомы при хронических психозах, эффективны при резистентных к традиционным нейролептикам состояниях. Лучшая переносимость лечения приводит к тому, что большее число пациентов соблюдают режим приема препарата, в том числе при проведении длительной противорецидивной терапии, вследствие чего снижается количество рецидивов заболевания и улучшается качество жизни больных.
Атипичный антипсихотик оланзапин (зипрекса) по химическому строению относится к группе производных тиено-бензодиазепина. Обладает сродством к большинству нейрорецепторов: серотониновым 5H2А/С-, 5HT3-, 5HT6-рецепторам; допаминовым D1-, D2-, D3-, D4-, D5-рецепторам; M1–5-холинорецепторам, a1-адренорецепторам и гистаминовым H1-рецепторам. Препарат обладает более выраженным сродством в отношении 5-HT2-рецепторов по сравнению с допаминовыми D2-рецепторами, что является основным признаком “атипичности” антипсихотика. Это определяет отсутствие или слабую выраженность экстрапирамидных побочных эффектов, отсутствие гиперпролактинемии при отчетливом антипсихотическом эффекте и способности корригировать негативную симптоматику. Тропизм к a1-адренорецепторам и H1-гистаминовым рецепторам обеспечивает наличие неспецифического седативного эффекта оланзапина, способность увеличивать массу тела, вызывать гипотензию. Блокада мускариновых рецепторов определяет возможность появления холинолитических побочных явлений, таких как сухость во рту и запоры. При приеме внутрь оланзапин хорошо абсорбируется из желудочно-кишечного тракта, всасываемость препарата не зависит от приема пищи. Максимальная концентрация в плазме крови достигается через 5–8 ч после приема, причем концентрация препарата в плазме имеет линейную зависимость от дозы (в диапазоне от 1 до 20 мг). Оланзапин метаболизируется в печени путем конъюгации и окисления, основная фармакологическая активность обусловлена неизменным оланзапином. Средняя длительность периода полувыведения после перорального приема составляет 33 ч. Фармакокинетические показатели оланзапина несколько варьируют в зависимости от пола, возраст, наличия пристрастия к курению, однако степень изменения фармакокинетики под влиянием каждого из указанных факторов значительно уступает степени индивидуальных различий [1].
Результаты клинических исследований подтверждают эффективность применения оланзапина при лечении больных с острыми психотическиими состояниями [2–8], при этом лишь в некоторых публикациях указывается на необходимость быстрого наращивания дозы препарата у больных в состоянии ажитации [6]. Не существует единой точки зрения и в отношении развития побочных эффектов терапии: некоторые авторы в качестве клинически значимых рассматривают только увеличение массы тела [3, 4], в других работах отмечают, помимо этого, возможность возникновения акатизии, акинеторигидного синдром, слюнотечения, повышенной сонливости в течение дня [5].
Цель данного исследования состояла в изучении терапевтической эффективности и переносимости атипичного антипсихотика оланзапина при лечении острых психотических состояний у больных шизофренией и шизоаффективным психозом в сравнении с галоперидолом.
Материал и методы исследования
В открытое сравнительное рандомизированное исследование включали больных:
• мужчин и женщин,
• в возрасте от 18 до 70 лет,
• в остром психотическом состоянии (включая психомоторное, бредовое, маниакальное возбуждение) в рамках одного из следующих диагнозов по МКБ-10:
• шизофрения параноидная (F20.0),
• шизофрения кататоническая (F20.2),
• шизофрения недифференцированная (F20.3),
• шизоаффективное расстройство, маниакальный тип (F25.0).
Из исследования исключали больных:
• с острыми соматическими заболеваниями и хроническими соматическими заболеваниями в стадии обострения,
• беременных и кормящих грудью женщин,
• с органическими заболеваниями центральной нервной системы,
• принимавших пролонгированные нейролептики менее чем за 3 нед до начала исследования.
Если больной получал нейролептики к началу исследования, проводили одномоментное изменение терапии – вместо ранее применявшегося лечения назначали один из сравниваемых препаратов; в случае замены традиционного нейролептика на атипичный при необходимости продолжался прием антихолинергических препаратов.
Больным, включенным в исследование, случайным образом назначали монотерапию оланзапином в таблетках по 5 мг или галоперидолом. Таким образом сформированы 2 группы: 1-я группа – больные, получающие оланзапин, 2-я группа – больные, получающие галоперидол. Длительность наблюдения каждого пациента составила 8 нед.
Галоперидол назначали в возрастающей дозе вплоть до достижения клинического эффекта, но не более 60 мг/сут; препарат вводили как перорально, так и внутримышечно, суточную дозу разделяли на 3 приема. При развитии экстрапирамидных побочных эффектов назначали циклодол в адекватной дозе.
Состояние больных оценивали по шкалам PANSS, общего клинического впечатления (CGI), шкале побочных эффектов (UKU), шкале оценки экстрапирамидных побочных явлений Симпсона–Ангуса (каждый из 10 пунктов шкалы оценивали по %-балльной системе в градациях от 1 до 5), отмечали изменение массы тела, регулярно проводили клинический и биохимический анализы крови (табл. 1).
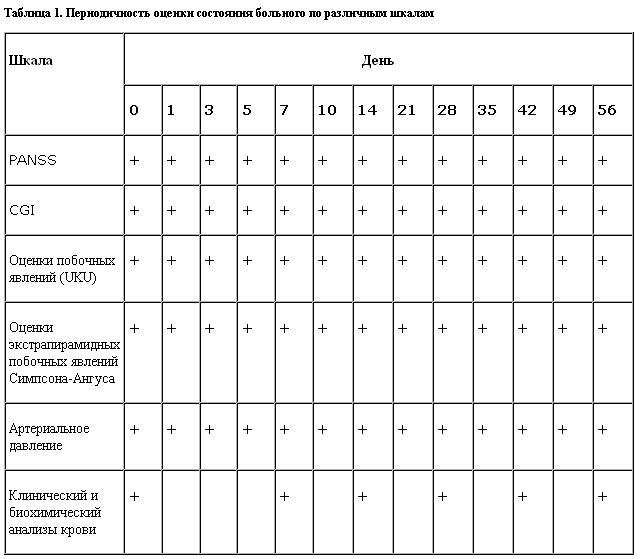
Терапию расценивали как эффективную, если общий балл по шкале PANSS снижался более чем на 20%.
Для статистического анализа результатов исследования использовали программу Microsoft Excel и специализированные программные пакеты “Биостатистика” и Statistica 5.5. Рассчитывали относительные и средние величины (среднее ± стандартная ошибка), проводили оценку достоверности различий результатов исследования, наличия и силы корреляционной зависимости.
Результаты и обсуждение
В соответствии с критериями отбора случайным образом были сформированы две группы больных. Как видно из табл. 2, группы сопоставимы по количеству наблюдений, полу, возрасту, диагнозу, длительности заболевания, количеству предшествующих обострений, степени выраженности психотической симптоматики на момент включения в исследование (имеющиеся межгрупповые различия недостоверны).
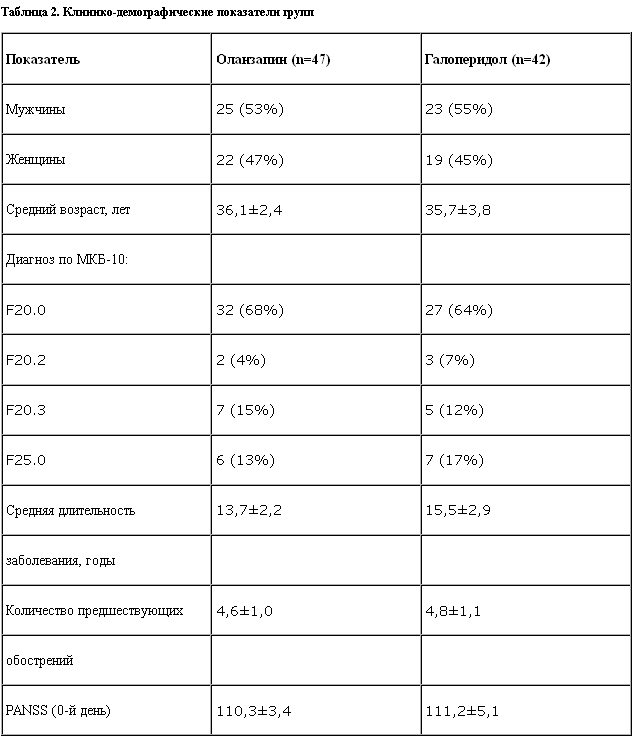
Среднесуточные дозы исследуемых препаратов были следующими: оланзапин – 19,05±0,48 мг; галоперидол (внутримышечно и перорально) – 34,31±4,26 мг.
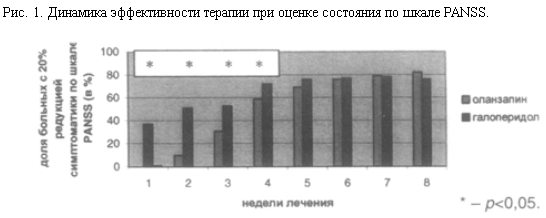
Как видно из рис. 1, к концу 1, 2, 3, 4-й недели терапии число респондеров было статистически значимо выше в группе галоперидола, в ходе дальнейшего наблюдения эти различия нивелировались, так как на 5-й неделе терапии значительно возрастало число респондеров в группе оланзапина. К концу 8-й недели лечения доля больных с более чем 20% редукцией симптоматики была выше среди пациентов, получавших оланзапин, но эти различия не достигали уровня статистически значимых. Таким образом, при равной эффективности оланзапин несколько отстает от галоперидола по скорости наступления терапевтического эффекта.
Выраженность психотической симптоматики уменьшалась в обеих исследуемых группах, темпы редукции как суммарного балла, так и баллов по субшкалам PANSS различались. На рис. 2 показано, что суммарный балл по шкале PANSS быстрее начинал снижаться в группе галоперидола, причем галоперидол достоверно превосходил по этому показателю оланзапин на 1–3-й неделе терапии, к 4–5-й неделе лечения эти различия нивелировались.
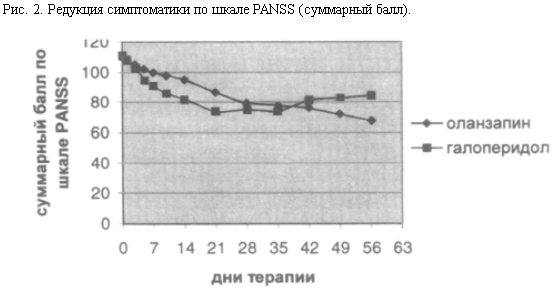
В дальнейшем, начиная с 6-й недели, динамика изменений в двух исследуемых группах приобретала противоположный характер: наблюдали некоторое возрастание суммарного балла в группе галоперидола (в основном за счет роста баллов по негативной субшкале), в то время как в группе оланзапина суммарный балл продолжал снижаться (в основном за счет продолжающейся редукции балла по негативной субшкале PANSS). К концу 8-й недели приема препаратов оланзапин достоверно превосходил галоперидол по степени редукции суммарного балла по шкале PANSS. Следует отметить, что эффект был связан с более значительным уменьшением баллов по негативной и общей психопатологической субшкалам PANSS, в то время как воздействие обоих препаратов на позитивную симптоматику было примерно равным.
Определенные различия были выявлены при клиническом изучении особенностей психотропной активности препаратов. В группе оланзапина, начиная с самых ранних этапов лечения, отмечена своеобразная диссоциация симптоматики, когда при сохранении интенсивности галлюцинаторных и бредовых переживаний наблюдали уменьшение напряжения, психотической тревоги, подозрительности и страха, больные с некоторым удивлением говорили что “все по-прежнему, а стало легче”. Следует отметить, что редукция собственно бреда и галлюцинаторных расстройств происходила в гораздо более отдаленные сроки начиная с 3–4-й недели приема антипсихотика. Указания на подобную особенность действия препарата есть в некоторых выполненных ранее исследованиях [3, 4]. У больных с выраженным возбуждением, враждебностью, подозрительностью и агрессивностью в начале терапии проводили форсированное наращивание дозы атипичного антипсихотика – до 20 мг в 1-е сутки терапии и до 30 мг на 2–3-и сутки. При этом в течение 2–4 дней наблюдали достаточно отчетливую седацию больных, в последующем неспецифический седативный эффект нивелировался, но пациенты оставались более доброжелательными, покладистыми, соглашались соблюдать распорядок дня отделения, охотно принимали лекарство. Высокие дозировки оланзапина (25–30 мг в сутки) назначали не более 7–10 дней, в дальнейшем суточную дозу антипсихотика снижали до 20 мг, отрицательной динамики состояния при этом не отмечено. Лишь в 2 наблюдениях больные выбыли из исследования в связи с упорным категорическим отказом от приема таблеток (отказ обусловлен бредовыми мотивами) и были переведены на парентеральное введение антипсихотического препарата “Клопиксол-акуфаза”.
В группе галоперидола в первую очередь происходила блокада аффективной напряженности, возбуждения, враждебности и агрессивности, в то время как галлюцинаторно-бредовые расстройства, явления психического автоматизма редуцировались также в более поздние сроки. Это приводило к определенной дезактуализации психотических переживаний, снижению их влияния на поведение больных. В то же время нередко отмечали угнетение двигательной активности, сонливость, снижение инициативности, безразличие к окружающему. При оценке состояния по шкале PANSS темпы и степень редукции негативной симптоматики значительно отставали от уменьшения позитивной и общей психопатологической симптоматики.
При оценке переносимости антипсихотической терапии было выявлено, что число больных, нуждавшихся в коррекции неврологических побочных эффектов, было достоверно выше в группе галоперидола (79% наблюдений). Доза корректора (циклодол) составляла до 16 мг/сут. В группе оланзапина единственным неврологическим побочным эффектом была акатизия, которая развилась у 9 (19%) больных, получавших терапию атипичным антипсихотиком. Акатизия появлялась к концу 1–2-й недели терапии, чаще вслед за повышением дозировки оланзапина. Ее выраженность расценивали как слабую или умеренную, ни в одном случае оценка по шкале Симпсона–Ангуса не превышала 3 баллов. Для купирования акатизии применяли циклодол в дозе до 4 мг/сут в течение 5–7 дней, в последующем у 4 больных циклодол постепенно удалось отменить без возобновления акатизии. Из других побочных эффектов следует отметить увеличение массы тела (36% больных), транзиторное незначительное повышение уровня глюкозы крови – не более 126 г/л при норме до 120 (6%), слюнотечение (2%). У части больных к моменту включения в исследование уже присутствовали нейролептические экстрапирамидные нарушения. В этих случаях при назначении оланзапина выраженность неврологической симптоматики постепенно снижалась, причем уменьшение выраженности экстрапирамидных нарушений по сравнению с исходным уровнем становилось к 21-му дню статистически достоверны. В группе галоперидола, несмотря на использование корректоров, выраженность экстрапирамидной симптоматики увеличивалась.
При сравнительной оценке эффективности терапии по шкале CGI отмечено преимущество оланзапина по сравнению с галоперидолом, начиная с 28-го дня лечения, что позволяет подтвердить хороший терапевтический эффект и переносимость препарат.
Таким образом, результаты проведенного исследования свидетельствуют о том, что оланзапин является высокоэффективным и безопасным антипсихотичским препаратом для лечения острых состояний у больных эндогенными заболеваниями. При выраженном возбуждении и агрессивности показано форсированное наращивание дозировок. При равной эффективности оланзапин превосходит галоперидол по степени редукции негативной симптоматики, что позволяет рассчитывать на становление качественной ремиссии у больных, перенесших психотическое расстройство. Высокая безопасность терапии, включая случаи с форсированным наращиванием дозировок, является важным достоинством препарата.
Список исп. литературыСкрыть список1. Справочник Видаль. Лекарственные препараты в России. 2003 г.
2. Григорьев Е.А., Рицков А.С. применение оланзапина при лечении депрессивно-бредовых расстройств. Психиатр. и психофармакотер. 2001; 3 (6): 204–7.
3. Морозова МА.. Спектр клинической активности атипичного антипсихотика оланзапина. Психиатрия и психофармакотер. 2000; 2 (5): 144–6.
4. Морозов М.А., Жаркова Н.Б., Бениашвили А.Г. Опыт применения атипичного нейролептика оланзапина в остром периоде шизофрении. Журн. неврол. и психиатр. 2000; 4: 37–43.
5. Мосолов С.Н., Калинин В.В., Еремин А.В. Сравнительная эффективность и переносимость нового поколения антипсихотических средств при лечении обострений шизофрении (метанализ оригинальных исследований оланзапина, рисперидона, кветипина, клозапина и галоперидола). В сб.: Новые достижения в терапии психических заболеваний. М., 2002; 82–94.
6. Baker R, Kinon B et al. Effectiveness of rapid initial dose escalation of oral olanzapine for acute agitation. J ECNP (Barcelona), 2002; P. 256.
7. Ciudad A, Bobes J et al. Efectiveness and safety of olanzapine versus conventional antipsychotics in the treatment of inpatients with acute schizophrenia: A multivariate analysis. Ibit. P. 303.
8. Tolleson G, Beasley C et al. Olanzapine versus haloperidol in the treatment of schizophrenia and schizoaffective and schizophreniform disorders: results of an international collaborative trial. Am J Psychiatry 1997; 154: 457–65.


