Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№06 2009
Опыт применения Коаксила (тианептин) при тревожно-депрессивных расстройствах, коморбидных с климактерическим синдромом №06 2009
Номера страниц в выпуске:40-44
Физиологическое течение менопаузы в 18–50% случаев осложняется развитием климактерического синдрома (КС). Тревожно-депрессивные состояния встречаются у 65–100% пациенток с КС. В современных исследованиях продемонстрированы мультифакториальная этиология данных состояний, взаимосвязь их возникновения и течения с дефицитом эстрогенов [4, 13, 29, 38], стрессовыми событиями и соматическим фоном . Учитывая, что в патогенез КС вовлечены как прямые психосоматические, так и обратные соматопсихические взаимосвязи [20], адекватная психофармакотерапия (ПФТ) ассоциированных с КС тревожно-депрессивных расстройств должна улучшать не только психическое, но и соматическое состояние пациенток, что подтверждается данными ряда исследователей
Актуальность проблемы
Ведущей демографической тенденцией современности является прогрессирующее постарение населения с увеличением доли женщин в старших возрастных группах [8]. ВОЗ прогнозирует, что к 2030 г. 1,2 млрд женщин в мире будут находиться в возрасте постменопаузы [23]. Поскольку среди прочих групп населения пожилые женщины являются наиболее активными потребителями ресурсов здравоохранения, повышение эффективности терапии психических и соматических расстройств, характерных для данной когорты населения, является одной из наиболее актуальных задач медицинской науки и практики. В частности, непсихотические тревожно-депрессивные расстройства встречаются у 30–70% пациентов общей медицинской практики с различной хронической соматической патологией [21, 31]. Поскольку частота депрессий у женщин превышает частоту депрессий у мужчин приблизительно в 3 раза [22], очевидно, что большую часть пациентов общей врачебной практики с расстройствами депрессивного спектра составляют женщины, а сами эти расстройства нередко ассоциированы с менопаузой.
Физиологическое течение менопаузы в 18–50% случаев [17] осложняется развитием климактерического синдрома (КС). Тревожно-депрессивные состояния встречаются у 65–100% пациенток с КС [4, 16, 24, 38, 39]. В современных исследованиях продемонстрированы мультифакториальная этиология данных состояний, взаимосвязь их возникновения и течения с дефицитом эстрогенов [4, 13, 29, 38], стрессовыми событиями [5, 28, 30, 35, 40, 41] и соматическим фоном [10, 11, 18, 27, 33, 35, 37].
Учитывая, что в патогенез КС вовлечены как прямые психосоматические, так и обратные соматопсихические взаимосвязи [20], адекватная психофармакотерапия (ПФТ) ассоциированных с КС тревожно-депрессивных расстройств должна улучшать не только психическое, но и соматическое состояние пациенток, что подтверждается данными ряда исследователей [5, 16, 18]. В то же время проведение ПФТ у таких пациенток сопряжено с рядом рисков, таких как индивидуальная непереносимость психотропных средств, включая аллергические реакции [1, 19], индукция гиперпролактинемии, утяжеляющая проявления артериальной гипертензии и постменопаузального остеопороза [6], нежелательные реакции лекарственного взаимодействия, обусловленные проведением ПФТ в условиях вынужденной полипрагмазии, а также психогенные нежелательные лекарственные реакции, обусловленные личностными особенностями пациенток и выраженной ипохондрической фиксацией [5].
В работе [25] сформулированы требования к идеальному антидепрессанту, применяемому у пациенток с КС. Это наличие вегетостабилизирующего и противотревожного эффектов, неспособность потенцировать связанные с КС сердечно-сосудистые и обменно-эндокринные расстройства, минимальный потенциал лекарственного взаимодействия, отсутствие поведенческой токсичности, удобный режим дозирования. Как по мнению данного автора, так и по нашему мнению, препарат тианептин (Коаксил) удовлетворяет всем перечисленным требованиям. Следует отметить высокую эффективность и хорошую переносимость у больных с тревожно-депрессивными состояниями различной выраженности [9, 34, 36], в том числе коморбидными с ишемической болезнью сердца [15] и неврологической патологией [12].
Применение тианептина при тревожно-депрессивных состояниях у пациенток с КС изучено в работах [13, 25], продемонстрировавших его высокую эффективность и безопасность. Однако данные исследования не затрагивали такие аспекты, как влияние на ипохондрическую, психопатоподобную и конверсионную симптоматику, показатели выраженности когнитивного дефицита, качество жизни пациенток, выраженность сердечно-сосудистой патологии и менопаузальных метаболических расстройств, спектр реакций лекарственного взаимодействия с препаратами для лечения фоновой соматической патологии.
Исходя из сказанного, целью исследования было изучение действия тианептина на основные и дополнительные симптомы тревожно-депрессивных состояний, показатели когнитивного дефицита, уровня качества жизни, выраженности сердечно-сосудистой патологии и менопаузального метаболического синдрома, а также спектра реакций лекарственного взаимодействия тианептина у пациенток с тревожно-депрессивными расстройствами, коморбидными с КС.
Материалы и методы
Исследование проведено на базе ГУЗ Воронежский областной клинический психоневрологический диспансер. В исследование были включены 20 амбулаторных пациенток в возрасте 45–60 лет.
Больных включали в исследование, исходя из наличия непсихотических тревожно-депрессивных расстройств, возникших во временной связи с появлением симптомов КС, а также характерных для КС вазовегетативных нарушений («приливы»). Исключали больных с симптомами эндогенных психических расстройств, судорожным синдромом, зависимостью от алкоголя или психоактивных веществ, выраженными когнитивными нарушениями, тяжелой декомпенсированной соматической патологией, риском суицидального или агрессивного поведения, установленной по данным анамнеза неэффективностью или непереносимостью тианептина.
Тревожно-депрессивные расстройства у участвовавших в исследовании пациенток расценивали в рамках следующих рубрик МКБ-10: смешанное тревожное и депрессивное расстройство (F41.2.) – 8 пациенток, не имевших убедительных клинических и анамнестических данных об органической стигматизации ЦНС; непсихотическое смешанное тревожное и депрессивное расстройство органической этиологии (F06.37) – 12 пациенток, имевших установленный врачом-неврологом диагноз дисциркуляторной энцефалопатии, а также обнаруживавших интеллектуально-мнестические расстройства незначительной выраженности.
Тианептин назначали в дозе 12,5 мг внутрь 3 раза в день независимо от приема пищи в течение 6 нед, на 7-й неделе терапии дозу препарата снижали до 12,5 мг 2 раза в день, а на 8-й неделе – до 12,5 мг 1 раз в день. Длительность наблюдения за больными составила 2 мес.
Исследование завершили 19 пациенток. Исключена из исследования на 15-й день 1 пациентка в связи с выявленной уже в ходе лечения зависимостью от алкоголя. Случаев досрочного прекращения исследования по инициативе пациенток не было.
Больных обследовали с использованием следующих методов:
1. Клинико-психопатологическое исследование.
2. Экспериментально-психологические методики – стандартизированные рейтинговые шкалы депрессии Гамильтона (HDRS) и тревоги Гамильтона (HARS) [32], опросник Басса–Дарки в редакции [26], Гиссенский опросник соматических жалоб в редакции [7], корректурная проба в редакции [2], тест рисования часов в редакции [3].
3. Оценка показателей качества жизни с использованием стандартизированного опросника SF-36 в русскоязычной адаптации [14].
4. Методы оценки выраженности фоновой соматической патологии – определение индекса массы тела, измерение артериального давления (АД) и частоты сердечных сокращений (ЧСС), электрокардиография (ЭКГ), определение уровней глюкозы, триглицеридов, холестерина, показателей коагулограммы – протромбина по Квику, международного нормализованного отношения (МНО), активированного частичного тромбопластинового времени (АЧТВ).
Обследование проводили до начала терапии (Д0), по завершении 1-го месяца терапии (Д30) и завершении исследования (Д60).
Статистическую обработку данных проводили с использованием пакета «Statistica 6.0 for Windows». Применяли общепринятые методы параметрической и непараметрической статистики.
При анализе качества ответов депрессивной симптоматики на терапию тианептином установлено, что состояние ремиссии симптомов депрессии (общий балл HDRS≤7) к Д60 отмечено у 20% пациенток. Состояние респонса (редукция общего балла HDRS>50% от исходного) отмечено у 35% пациенток, нонреспондерами (редукция общего балла HDRS>50% от исходного) оказались 40%. Таким образом, у 55% пациенток отмечен хороший и удовлетворительный ответ депрессивной симптоматики на терапию тианептином.
При анализе качества ответов тревожной симптоматики на терапию тианептином установлено, что состояние ремиссии симптомов тревоги (общий балл HARS≤8) к Д60 отмечено у 25% больных, состояние респонса (редукция общего балла HARS>50% от исходного) – у 40%, нонреспондерами (редукция общего балла HARS<50% от исходного) были 30%. Таким образом, у 65% пациенток наблюдали хороший и удовлетворительный ответ симптомов тревоги на терапию тианептином.
Данные о динамике дополнительных проявлений сложных по структуре тревожно-депрессивных состояний – ипохондрической фиксации (общий балл Гиссенского опросника), истероконверсионных расстройств (балл по разделу «Сердечные жалобы» Гиссенского опросника), психопатоподобных расстройств (баллы по шкалам «Вербальная агрессия» и «Обида» опросника Басса–Дарки) отражены в табл. 1.
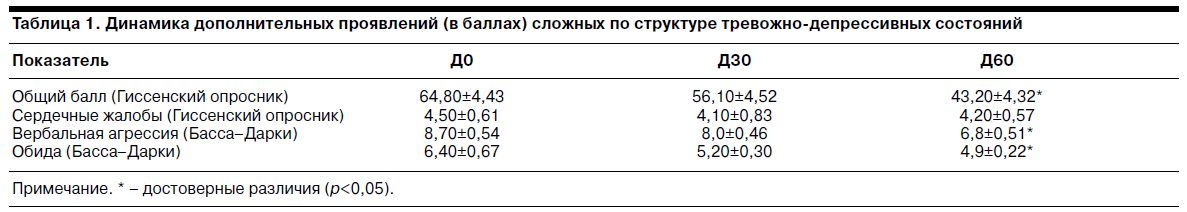
Как видно, к Д60 отмечено статистически достоверное снижение выраженности ипохондрической и психопатоподобной симптоматики. На выраженность истероконверсионных расстройств терапия тианептином не влияла.
Данные о динамике показателей выраженности когнитивного дефицита – времени выполнения корректурной пробы (КП; отражает темп интеллектуальных операций), числа ошибок в КП (отражает концентрацию произвольного внимания), балла по тесту рисования часов (отражает нарушения высших корковых функций) – представлены в табл. 2.
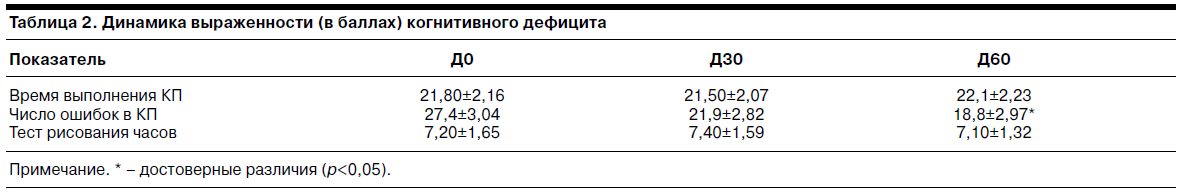
Данные демонстрируют, что на фоне терапии тианептином отсутствовало статистически достоверное снижение показателей темпа психических процессов и высших корковых функций. К Д60 отмечено статистически достоверное снижение числа ошибок в КП, что свидетельствует об улучшении функций произвольного внимания у пациенток.
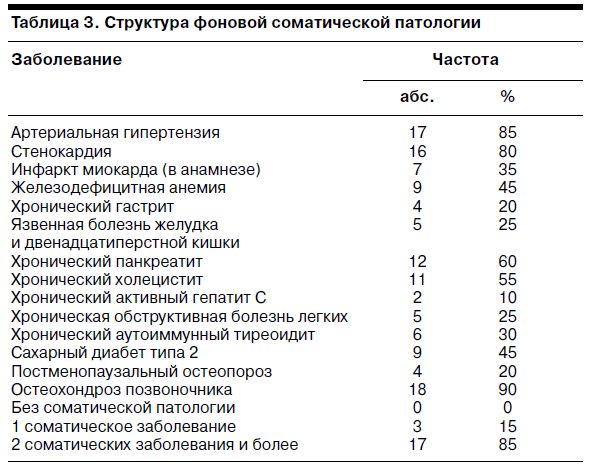
Данные о структуре фоновой соматической патологии в исследованной группе отражены в табл. 3.
Данные о динамике показателей АД и ЧСС отражены в табл. 4.

На фоне терапии тианептином к Д30 отмечено статистически достоверное снижение исходно повышенных значений систолического и диастолического АД, а также снижение ЧСС. Данные изменения сохранялись и на Д60.
Динамика длительности интервалов ЭКГ на фоне терапии тианептином отражена в табл. 5.
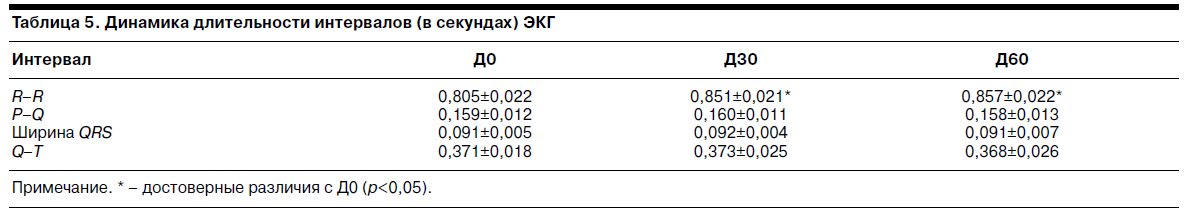
Как видно, на фоне терапии тианептином к Д30 наблюдали статистически достоверное удлинение интервала R–R, сохраняющееся на Д60, что обусловлено снижением ЧСС. Все остальные интервалы ЭКГ на фоне терапии тианептином статистически значимо не изменялись.
Динамика показателей выраженности метаболических расстройств отражена в табл. 6.
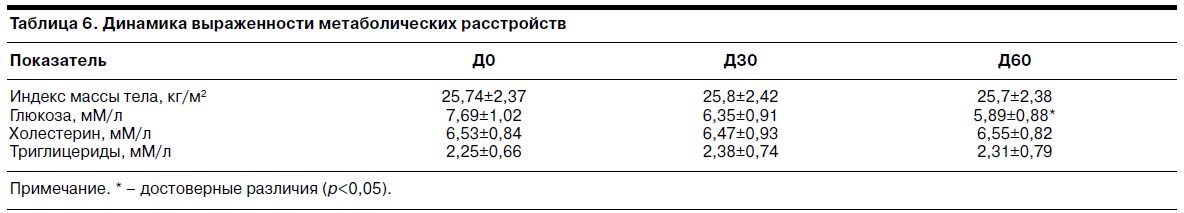
Данные показывают, что на Д0 у пациенток имелись повышенные значения индекса массы тела, уровней глюкозы в крови и холестерина, свидетельствующие о признаках менопаузального метаболического синдрома. На фоне терапии тианептином к Д60 отмечено статистически достоверное снижение уровня глюкозы в крови, другие показатели выраженности метаболических расстройств оставались без достоверной динамики.
Динамика показателей коагулограммы на фоне терапии тианептином отражена в табл. 7.
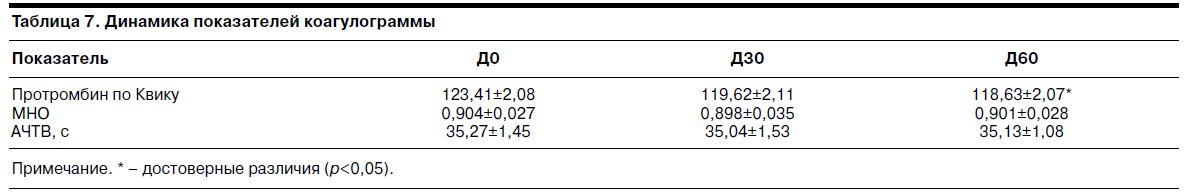
Как видно из представленных данных, на Д0 у пациенток имелись признаки гиперкоагуляции. На Д60 отмечено статистически достоверное снижение протромбина по Квику, статистически достоверные сдвиги других показателей отсутствуют.
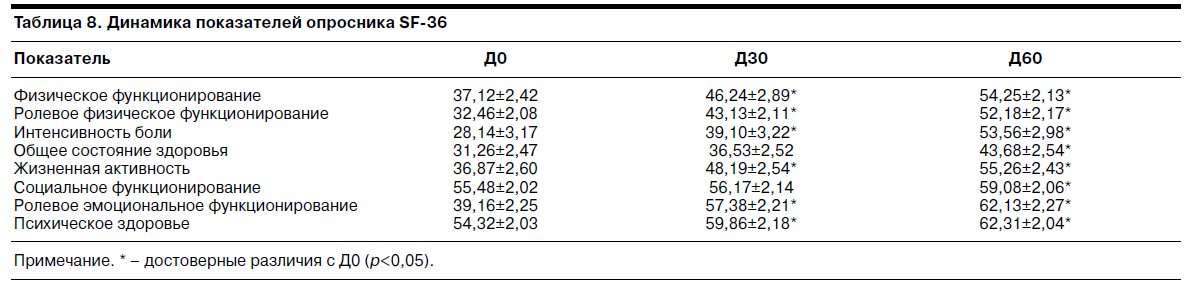
На фоне терапии тианептином к Д30 отмечен статистически достоверный рост 6 из 8 показателей уровня качества жизни, а к Д60 – статистически достоверный рост всех показателей опросника. К Д60 наиболее выраженный рост наблюдали по следующим показателям (в порядке убывания): «Интенсивность боли» – на 90,7% от исходного, «Ролевое физическое функционирование» – на 60,6% от исходного, «Ролевое эмоциональное функционирование» – на 58,4% от исходного, «Физическое функционирование» – на 46,4% от исходного.
В табл. 9 отражены данные о психотропных средствах, которые получали участвовавшие в исследовании больные, и наблюдавшихся реакциях лекарственного взаимодействия с данными средствами.
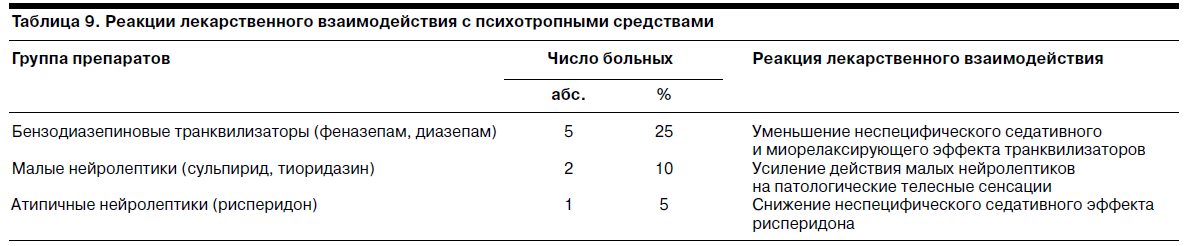
Из приведенных данных видно, что у 40% участниц исследования наблюдались реакции лекарственного взаимодействия с психотропными средствами. Все отмеченные реакции лекарственного взаимодействия имели терапевтически выгодную направленность.
В табл. 10 отражены данные о наблюдавшихся реакциях лекарственного взаимодействия с препаратами для лечения фоновой соматической патологии.
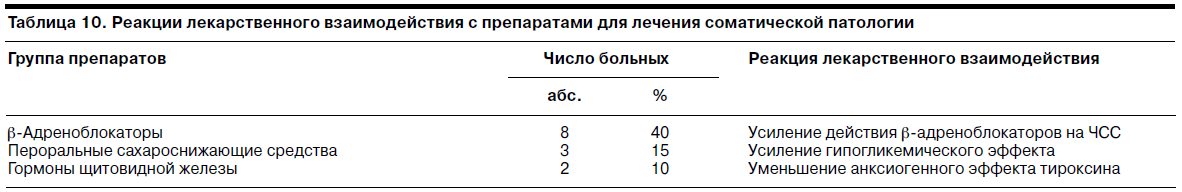
Так, у 65% участниц исследования наблюдались реакции лекарственного взаимодействия тианептина и препаратов для лечения фоновой соматической патологии. Данные реакции были терапевтически выгодными (усиление гипогликемизирующего эффекта пероральных гипогликемических средств, снижение анксиогенного эффекта тироксина) либо нейтральными (усиление действия b-адреноблокаторов на ЧСС).
Обсуждение
Полученные результаты позволяют подчеркнуть следующие особенности действия тианептина у пациенток с тревожно-депрессивными расстройствами, коморбидными с КС.
Во-первых, терапия тианептином не только снижает выраженность как основных, так и дополнительных симптомов тревожно-депрессивных расстройств (за исключением истероконверсионных симптомов, которые характеризуются относительной фармакорезистентностью), но и вызывает благоприятные сдвиги соматического состояния пациенток – снижение исходно повышенных значений АД и ЧСС, уменьшение выраженности гипергликемии и гиперкоагуляции. Гипертензия, тахикардия, гипергликемия и гиперкоагуляция являются характерными соматическими проявлениями стресс-реакции, а снижение выраженности данных сдвигов позволяет говорить о том, что тианептин у пациенток с тревожно-депрессивными расстройствами, коморбидными с КС, проявляет стресс-протективное действие.
Во-вторых, на фоне терапии тианептином не отмечено потенциально опасных сдвигов психического (рост показателей выраженности когнитивного дефицита) и соматического состояния больных (удлинение интервала Q–T, увеличение массы тела, повышение уровня холестерина и триглицеридов в крови), которые нередко наблюдаются на фоне терапии другими антидепрессантами. Отмечавшиеся реакции лекарственного взаимодействия с психотропными средствами и препаратами для лечения фоновой соматической патологии являются терапевтически выгодными или нейтральными. Данные факты позволяют говорить о высокой безопасности терапии тианептином у пациенток инволюционного возраста с мультиморбидной психической, соматической и неврологической патологией в условиях вынужденной полипрагмазии.
В-третьих, на фоне терапии тианептином отмечен статистически достоверный рост всех изучавшихся показателей уровня качества жизни. Наиболее выраженный рост наблюдали у показателей физического компонента качества жизни. По-видимому, их исходно низкие значения обусловлены не столько тяжестью фоновой соматической патологии, сколько ипохондрической фиксацией пациенток. Снижение выраженности ипохондрической симптоматики на фоне терапии тианептином приводит к росту данных показателей.
Выводы
Ведущей демографической тенденцией современности является прогрессирующее постарение населения с увеличением доли женщин в старших возрастных группах [8]. ВОЗ прогнозирует, что к 2030 г. 1,2 млрд женщин в мире будут находиться в возрасте постменопаузы [23]. Поскольку среди прочих групп населения пожилые женщины являются наиболее активными потребителями ресурсов здравоохранения, повышение эффективности терапии психических и соматических расстройств, характерных для данной когорты населения, является одной из наиболее актуальных задач медицинской науки и практики. В частности, непсихотические тревожно-депрессивные расстройства встречаются у 30–70% пациентов общей медицинской практики с различной хронической соматической патологией [21, 31]. Поскольку частота депрессий у женщин превышает частоту депрессий у мужчин приблизительно в 3 раза [22], очевидно, что большую часть пациентов общей врачебной практики с расстройствами депрессивного спектра составляют женщины, а сами эти расстройства нередко ассоциированы с менопаузой.
Физиологическое течение менопаузы в 18–50% случаев [17] осложняется развитием климактерического синдрома (КС). Тревожно-депрессивные состояния встречаются у 65–100% пациенток с КС [4, 16, 24, 38, 39]. В современных исследованиях продемонстрированы мультифакториальная этиология данных состояний, взаимосвязь их возникновения и течения с дефицитом эстрогенов [4, 13, 29, 38], стрессовыми событиями [5, 28, 30, 35, 40, 41] и соматическим фоном [10, 11, 18, 27, 33, 35, 37].
Учитывая, что в патогенез КС вовлечены как прямые психосоматические, так и обратные соматопсихические взаимосвязи [20], адекватная психофармакотерапия (ПФТ) ассоциированных с КС тревожно-депрессивных расстройств должна улучшать не только психическое, но и соматическое состояние пациенток, что подтверждается данными ряда исследователей [5, 16, 18]. В то же время проведение ПФТ у таких пациенток сопряжено с рядом рисков, таких как индивидуальная непереносимость психотропных средств, включая аллергические реакции [1, 19], индукция гиперпролактинемии, утяжеляющая проявления артериальной гипертензии и постменопаузального остеопороза [6], нежелательные реакции лекарственного взаимодействия, обусловленные проведением ПФТ в условиях вынужденной полипрагмазии, а также психогенные нежелательные лекарственные реакции, обусловленные личностными особенностями пациенток и выраженной ипохондрической фиксацией [5].
В работе [25] сформулированы требования к идеальному антидепрессанту, применяемому у пациенток с КС. Это наличие вегетостабилизирующего и противотревожного эффектов, неспособность потенцировать связанные с КС сердечно-сосудистые и обменно-эндокринные расстройства, минимальный потенциал лекарственного взаимодействия, отсутствие поведенческой токсичности, удобный режим дозирования. Как по мнению данного автора, так и по нашему мнению, препарат тианептин (Коаксил) удовлетворяет всем перечисленным требованиям. Следует отметить высокую эффективность и хорошую переносимость у больных с тревожно-депрессивными состояниями различной выраженности [9, 34, 36], в том числе коморбидными с ишемической болезнью сердца [15] и неврологической патологией [12].
Применение тианептина при тревожно-депрессивных состояниях у пациенток с КС изучено в работах [13, 25], продемонстрировавших его высокую эффективность и безопасность. Однако данные исследования не затрагивали такие аспекты, как влияние на ипохондрическую, психопатоподобную и конверсионную симптоматику, показатели выраженности когнитивного дефицита, качество жизни пациенток, выраженность сердечно-сосудистой патологии и менопаузальных метаболических расстройств, спектр реакций лекарственного взаимодействия с препаратами для лечения фоновой соматической патологии.
Исходя из сказанного, целью исследования было изучение действия тианептина на основные и дополнительные симптомы тревожно-депрессивных состояний, показатели когнитивного дефицита, уровня качества жизни, выраженности сердечно-сосудистой патологии и менопаузального метаболического синдрома, а также спектра реакций лекарственного взаимодействия тианептина у пациенток с тревожно-депрессивными расстройствами, коморбидными с КС.
Материалы и методы
Исследование проведено на базе ГУЗ Воронежский областной клинический психоневрологический диспансер. В исследование были включены 20 амбулаторных пациенток в возрасте 45–60 лет.
Больных включали в исследование, исходя из наличия непсихотических тревожно-депрессивных расстройств, возникших во временной связи с появлением симптомов КС, а также характерных для КС вазовегетативных нарушений («приливы»). Исключали больных с симптомами эндогенных психических расстройств, судорожным синдромом, зависимостью от алкоголя или психоактивных веществ, выраженными когнитивными нарушениями, тяжелой декомпенсированной соматической патологией, риском суицидального или агрессивного поведения, установленной по данным анамнеза неэффективностью или непереносимостью тианептина.
Тревожно-депрессивные расстройства у участвовавших в исследовании пациенток расценивали в рамках следующих рубрик МКБ-10: смешанное тревожное и депрессивное расстройство (F41.2.) – 8 пациенток, не имевших убедительных клинических и анамнестических данных об органической стигматизации ЦНС; непсихотическое смешанное тревожное и депрессивное расстройство органической этиологии (F06.37) – 12 пациенток, имевших установленный врачом-неврологом диагноз дисциркуляторной энцефалопатии, а также обнаруживавших интеллектуально-мнестические расстройства незначительной выраженности.
Тианептин назначали в дозе 12,5 мг внутрь 3 раза в день независимо от приема пищи в течение 6 нед, на 7-й неделе терапии дозу препарата снижали до 12,5 мг 2 раза в день, а на 8-й неделе – до 12,5 мг 1 раз в день. Длительность наблюдения за больными составила 2 мес.
Исследование завершили 19 пациенток. Исключена из исследования на 15-й день 1 пациентка в связи с выявленной уже в ходе лечения зависимостью от алкоголя. Случаев досрочного прекращения исследования по инициативе пациенток не было.
Больных обследовали с использованием следующих методов:
1. Клинико-психопатологическое исследование.
2. Экспериментально-психологические методики – стандартизированные рейтинговые шкалы депрессии Гамильтона (HDRS) и тревоги Гамильтона (HARS) [32], опросник Басса–Дарки в редакции [26], Гиссенский опросник соматических жалоб в редакции [7], корректурная проба в редакции [2], тест рисования часов в редакции [3].
3. Оценка показателей качества жизни с использованием стандартизированного опросника SF-36 в русскоязычной адаптации [14].
4. Методы оценки выраженности фоновой соматической патологии – определение индекса массы тела, измерение артериального давления (АД) и частоты сердечных сокращений (ЧСС), электрокардиография (ЭКГ), определение уровней глюкозы, триглицеридов, холестерина, показателей коагулограммы – протромбина по Квику, международного нормализованного отношения (МНО), активированного частичного тромбопластинового времени (АЧТВ).
Обследование проводили до начала терапии (Д0), по завершении 1-го месяца терапии (Д30) и завершении исследования (Д60).
Статистическую обработку данных проводили с использованием пакета «Statistica 6.0 for Windows». Применяли общепринятые методы параметрической и непараметрической статистики.
При анализе качества ответов депрессивной симптоматики на терапию тианептином установлено, что состояние ремиссии симптомов депрессии (общий балл HDRS≤7) к Д60 отмечено у 20% пациенток. Состояние респонса (редукция общего балла HDRS>50% от исходного) отмечено у 35% пациенток, нонреспондерами (редукция общего балла HDRS>50% от исходного) оказались 40%. Таким образом, у 55% пациенток отмечен хороший и удовлетворительный ответ депрессивной симптоматики на терапию тианептином.
При анализе качества ответов тревожной симптоматики на терапию тианептином установлено, что состояние ремиссии симптомов тревоги (общий балл HARS≤8) к Д60 отмечено у 25% больных, состояние респонса (редукция общего балла HARS>50% от исходного) – у 40%, нонреспондерами (редукция общего балла HARS<50% от исходного) были 30%. Таким образом, у 65% пациенток наблюдали хороший и удовлетворительный ответ симптомов тревоги на терапию тианептином.
Данные о динамике дополнительных проявлений сложных по структуре тревожно-депрессивных состояний – ипохондрической фиксации (общий балл Гиссенского опросника), истероконверсионных расстройств (балл по разделу «Сердечные жалобы» Гиссенского опросника), психопатоподобных расстройств (баллы по шкалам «Вербальная агрессия» и «Обида» опросника Басса–Дарки) отражены в табл. 1.

Как видно, к Д60 отмечено статистически достоверное снижение выраженности ипохондрической и психопатоподобной симптоматики. На выраженность истероконверсионных расстройств терапия тианептином не влияла.
Данные о динамике показателей выраженности когнитивного дефицита – времени выполнения корректурной пробы (КП; отражает темп интеллектуальных операций), числа ошибок в КП (отражает концентрацию произвольного внимания), балла по тесту рисования часов (отражает нарушения высших корковых функций) – представлены в табл. 2.

Данные демонстрируют, что на фоне терапии тианептином отсутствовало статистически достоверное снижение показателей темпа психических процессов и высших корковых функций. К Д60 отмечено статистически достоверное снижение числа ошибок в КП, что свидетельствует об улучшении функций произвольного внимания у пациенток.
Данные о структуре фоновой соматической патологии в исследованной группе отражены в табл. 3.

Данные о динамике показателей АД и ЧСС отражены в табл. 4.

На фоне терапии тианептином к Д30 отмечено статистически достоверное снижение исходно повышенных значений систолического и диастолического АД, а также снижение ЧСС. Данные изменения сохранялись и на Д60.
Динамика длительности интервалов ЭКГ на фоне терапии тианептином отражена в табл. 5.

Как видно, на фоне терапии тианептином к Д30 наблюдали статистически достоверное удлинение интервала R–R, сохраняющееся на Д60, что обусловлено снижением ЧСС. Все остальные интервалы ЭКГ на фоне терапии тианептином статистически значимо не изменялись.
Динамика показателей выраженности метаболических расстройств отражена в табл. 6.

Данные показывают, что на Д0 у пациенток имелись повышенные значения индекса массы тела, уровней глюкозы в крови и холестерина, свидетельствующие о признаках менопаузального метаболического синдрома. На фоне терапии тианептином к Д60 отмечено статистически достоверное снижение уровня глюкозы в крови, другие показатели выраженности метаболических расстройств оставались без достоверной динамики.
Динамика показателей коагулограммы на фоне терапии тианептином отражена в табл. 7.

Как видно из представленных данных, на Д0 у пациенток имелись признаки гиперкоагуляции. На Д60 отмечено статистически достоверное снижение протромбина по Квику, статистически достоверные сдвиги других показателей отсутствуют.

На фоне терапии тианептином к Д30 отмечен статистически достоверный рост 6 из 8 показателей уровня качества жизни, а к Д60 – статистически достоверный рост всех показателей опросника. К Д60 наиболее выраженный рост наблюдали по следующим показателям (в порядке убывания): «Интенсивность боли» – на 90,7% от исходного, «Ролевое физическое функционирование» – на 60,6% от исходного, «Ролевое эмоциональное функционирование» – на 58,4% от исходного, «Физическое функционирование» – на 46,4% от исходного.
В табл. 9 отражены данные о психотропных средствах, которые получали участвовавшие в исследовании больные, и наблюдавшихся реакциях лекарственного взаимодействия с данными средствами.

Из приведенных данных видно, что у 40% участниц исследования наблюдались реакции лекарственного взаимодействия с психотропными средствами. Все отмеченные реакции лекарственного взаимодействия имели терапевтически выгодную направленность.
В табл. 10 отражены данные о наблюдавшихся реакциях лекарственного взаимодействия с препаратами для лечения фоновой соматической патологии.

Так, у 65% участниц исследования наблюдались реакции лекарственного взаимодействия тианептина и препаратов для лечения фоновой соматической патологии. Данные реакции были терапевтически выгодными (усиление гипогликемизирующего эффекта пероральных гипогликемических средств, снижение анксиогенного эффекта тироксина) либо нейтральными (усиление действия b-адреноблокаторов на ЧСС).
Обсуждение
Полученные результаты позволяют подчеркнуть следующие особенности действия тианептина у пациенток с тревожно-депрессивными расстройствами, коморбидными с КС.
Во-первых, терапия тианептином не только снижает выраженность как основных, так и дополнительных симптомов тревожно-депрессивных расстройств (за исключением истероконверсионных симптомов, которые характеризуются относительной фармакорезистентностью), но и вызывает благоприятные сдвиги соматического состояния пациенток – снижение исходно повышенных значений АД и ЧСС, уменьшение выраженности гипергликемии и гиперкоагуляции. Гипертензия, тахикардия, гипергликемия и гиперкоагуляция являются характерными соматическими проявлениями стресс-реакции, а снижение выраженности данных сдвигов позволяет говорить о том, что тианептин у пациенток с тревожно-депрессивными расстройствами, коморбидными с КС, проявляет стресс-протективное действие.
Во-вторых, на фоне терапии тианептином не отмечено потенциально опасных сдвигов психического (рост показателей выраженности когнитивного дефицита) и соматического состояния больных (удлинение интервала Q–T, увеличение массы тела, повышение уровня холестерина и триглицеридов в крови), которые нередко наблюдаются на фоне терапии другими антидепрессантами. Отмечавшиеся реакции лекарственного взаимодействия с психотропными средствами и препаратами для лечения фоновой соматической патологии являются терапевтически выгодными или нейтральными. Данные факты позволяют говорить о высокой безопасности терапии тианептином у пациенток инволюционного возраста с мультиморбидной психической, соматической и неврологической патологией в условиях вынужденной полипрагмазии.
В-третьих, на фоне терапии тианептином отмечен статистически достоверный рост всех изучавшихся показателей уровня качества жизни. Наиболее выраженный рост наблюдали у показателей физического компонента качества жизни. По-видимому, их исходно низкие значения обусловлены не столько тяжестью фоновой соматической патологии, сколько ипохондрической фиксацией пациенток. Снижение выраженности ипохондрической симптоматики на фоне терапии тианептином приводит к росту данных показателей.
Выводы
1. У больных с тревожно-депрессивными расстройствами, коморбидными с КС, тианептин проявляет стресс-протективное действие, за счет чего уменьшается выраженность проявлений ассоциированной с менопаузой сердечно-сосудистой и эндокринной патологии.
2. Применение тианептина у пациенток с КС в условиях мотивированной полипрагмазии не приводит к потенциально опасным сдвигам показателей ЭКГ, массы тела, липидного спектра крови и не сопровождается терапевтически неблагоприятными реакциями лекарственного взаимодействия как с психотропными средствами, так и с препаратами для лечения фоновой соматической патологии.
3. Терапия тианептином приводит к повышению уровня качества жизни пациенток с тревожно-депрессивными расстройствами, коморбидными с КС.
Список исп. литературыСкрыть список1. Александровский Ю.А. Пограничные психические расстройства. М.: Медицина, 2000.
2. Альманах психологических тестов. М.: Практика, 1995.
3. Ананьева Н.И., Круглов Л.С., Залуцкая Н.М. и др. Комплексная диагностика сосудистых деменций. СПб.: Научно-исследовательский психоневрологический институт им. В.М.Бехтерева, 2007; с. 41.
4. Барденштейн Л.М., Торчинов А.М., Умаханова М.М. и др. Клиническая типология депрессивных расстройств у женщин в перименопаузальном периоде. Аллергол. и иммунол. 2005; 6 (2): 269.
5. Батурин К.А., Яньшина Т.П., Троснова А.П., Добровольский А.В. Соматические проявления при инволюционной истерии. Психич. расстройства в общей мед. 2006; 1 (1): 12–20.
6. Горобец Л.Н. Нейроэндокринные побочные эффекты современной антипсихотической фармакотерапии. В сб.: Современные проблемы психиатрической эндокринологии. М., 2004; с. 22–45.
7. Гиссенский личностный опросник (Использование в психодиагностике для решения дифференциально-диагностических и психотерапевтических задач). Метод. пос. СПб.: Психоневрологический институт им. В.М.Бехтерева, 1993.
8. Дмитриева Т.Б. Психическое здоровье и общество. Новые вызовы и угрозы. Материалы Всероссийской конференции «Психическое здоровье и общественная безопасность». Екатеринбург, 2008; с. 41–9.
9. Иванец Н.Н., Тювина Н.А., Балабанова В.В., Прупис О.В. Эффективность тианептина (коаксила) при депрессивных расстройствах невротического и субпсихотического уровня. Психиат. и психофармакотер. 2001; 3 (5): 166–8.
10. Калашникова М.Ф., Катхурия Ю.Б., Мельниченко Г.А. Заболевания щитовидной железы и менопауза. Климактерий. 2002; 1: 24–6.
11. Кириченко А.А., Демельханова Т.С., Рязанцев А.А., Юрченко К.В. Динамика выраженности климактерического синдрома при лечении гипертонической болезни моэксиприлом. Cons. Med. 2005; 11 (1): 23–5.
12. Левин О.С. Коаксил (тианептин) в лечении депрессии при болезни Паркинсона. Журн. неврол. и психиат. им. С.С.Корсакова. 2006; 106: 20–5.
13. Мочалова Е.М. Статистический анализ состояния и рациональная коррекция психоэмоциональных расстройств у женщин в климактерическом периоде. Дис. … канд. мед. наук. Воронеж, 2004.
14. Недошивин А.О. Исследование качества жизни и психологического статуса больных с хронической сердечной недостаточностью. Серд. недостаточность. 2000; 1 (4): 12–8.
15. Погосова Г.В., Жидко Н.И., Красницкий В.Б. и др. Клиническая эффективность тианептина у пациентов с ИБС и коморбидной депрессией. Кардиология. 2004; 44: 20–4.
16. Попов А.А., Изможерова Н.В., Андреев А.Н. и др. Депрессивные нарушения у женщин с менопаузальным синдромом. Пробл. репродукции. 2005; 1: 17–8.
17. Серов В.Н. Климактерический период: нормальное состояние или патология. Рус. мед. журн. 2002; 10 (18): 11–20.
18. Сидоренко Б.А., Угрюмова М.О. Артериальная гипертония у женщин в постменопаузе. Кардиология. 2003; 4: 8–17.
19. Сметник В.П., Кулаков В.И. Руководство по климактерию. М.: МИА, 2001.
20. Смулевич А.Б. Психосоматические расстройства (клиника, терапия, организация медицинской помощи). Психиат. и психофармакотер. 2000; 2: 36–47.
21. Смулевич А.Б. Депрессии при соматических и психических заболеваниях. М.: МИА, 2003.
22. Терапия антидепрессантами и другие методы лечения депрессивных расстройств. Доклад рабочей группы CINP на основе обзора доказательных данных. Ред. рус. пер. В.Н.Краснов. М.: РОП, 2008.
23. Тихомиров А.Л., Олейник Ч.Г. Патофизиология климактерия и новые возможности заместительной гормонотерапии у женщин в постменопаузе. Рус. мед. журн. 2003; 11 (16): 13–7.
24. Торчинов А.М., Барденштейн Л.М., Умаханова М.М. и др. Современные аспекты депрессивных расстройств у женщин в перименопаузе. Журн. Рос. общества акуш.-гин. 2006; 3: 34–8.
25. Тювина Н.А., Балабанова В.В. Место Коаксила в терапии депрессивных расстройств климактерического периода у женщин. Психиат. и психофармакотер. 2002; 4 (1): 32–8.
26. Фетискин Н.П., Козлов В.В., Мануйлов Г.М. Социально-психологическая диагностика развития личности и малых групп. М.: Изд-во Института психотерапии, 2002.
27. Чукаева И.И., Шургая М.А. Особенности терапии артериальной гипертонии у женщин в климактерическом периоде. Рус. мед. журн. 2002; 10 (18): 28–34.
28. Bernard L, Harlow BL. Factors associated with early menopause. Maturitas 2002; 42 (suppl. 1): 87–93.
29. Cohen LS, Soares CN, Vitonis AF et al. Risk for new onset of depression during the menopausal transition: the Harvard study of moods and cycles. Arch Gen Psychiat 2006; 63: 385–90.
30. De Lorenzi DR, Baracat EC, Saciloto B et al. Factors related to quality of life in post-menopause. Revista da Associa??o M?dica Brasileira 2006; 52 (5): 312–7.
31. Evans DL, Charney DS, Lewis L et al. Mood disorders in the medically ill: scientific review and recommendations. Biol Psychiat 2005; 58: 175–89.
32. Hamilton M. Developing of a rating scale for primary depressive illness. Brit J Soc Clin Psychol 1967; 278 (6): 100–8.
33. Hansen S. Mental health issues associated with cardiovascular disease in women. Psychiatr Clin N Am 2003; 266: 693–712.
34. Kasper S, Olie JP. A meta-analysis of randomized controlled trials of tianeptine versus SSRI in the short-term treatment of depression. Eur Psychiat 2002; 17 (Suppl. 3): 331–40.
35. Karacam Z, Seker SE. Factors associated with menopausal symptoms and their relationship with the quality of life among Turkish women. Maturitas 2007; 58 (1): 75–82.
36. Lepine JP, Altamura C, Ansseau M et al. Guttierez Tianeptine and paroxetine in major depressive disorder, with a special focus on the anxious component of depression: an international, 6-week double-blind study dagger. Hum Psychopharmacol 2003; 16: 219–27.
37. Nanette K, Wenger M. Women’s Health and Menopause: A Comprehensive Approach. Bethesda: NIH, 2002.
38. Richardson TA, Robinson R.D. Menopause and depression. Prim Care Update Ob Gyns 2000; 7: 215–23.
39. Schnatz PF, Banever AE, Greene JF. Menopausal symptoms in clinical population: a pilot study. Menopause 2005; 12 (5): 623–9.
40. Smoller JW, Pollack MH, Wassertheil-Smoller S. Study of panick attacks prevalence and interlinks in menopausal women. Arch Intern Med 2003; 163 (17): 2041–50.
41. Woods N, Mitchell E, Marie A. Stress, neuroendocrine profiles, and depressed mood during the transition to menopausal. Women\'s health and menopause. Washington, 2001; p. 17.

