Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2014
Активность пролинспецифических ферментов пролилэндопептидазы и дипептидилпептидазы-4 у больных с разной структурой тревожных расстройств при терапии Афобазолом №01 2014
Тревожные расстройства являются клинически гетерогенными состояниями, ассоциирующимися со сложными этиопатогенетическими механизмами. При этом одним из приоритетных направлений изучения подобных комплексных состояний является их анализ с позиций эндофенотипов, позволяющий провести оценку взаимосвязей между клинической картиной и ее биологическими коррелятами.
Резюме. Проведено изучение активности пролинспецифических пептидаз и ее изменения при терапии Афобазолом у больных с тревожными расстройствами разной структуры. В проведенном исследовании нашли подтверждение данные предшествующих работ об увеличении активности ферментов дипептидилпептидазы-4 (ДПП-4) и противоэпилептических препаратов (ПЭП) при тревожных нарушениях. Выявлена взаимосвязь между активностью ДПП-4 и выраженностью у больных с ГТР, тревожно-фобическим и тревожно-ипохондрическим расстройствами астенических проявлений. При терапии Афобазолом динамика активности ДПП-4 и ПЭП у больных с тревожными расстройствами оказалась разнонаправленной. Обнаружена взаимосвязь терапевтических изменений активности ферментов с их фоновыми показателями и динамикой психопатологических расстройств. Сформулировано положение о значимости активности изучаемых ферментов в генезе и формировании клинической картины тревожных нарушений.
Ключевые слова: клинико-биохимическое исследование, пролинспецифические ферменты, дипептидилпептидаза-4, пролилэндопептидаза, тревожные расстройства, анксиолитик, Афобазол.
Activity of prolyn-specific enzymes in patients with anxiety disorders and its changes during Afobazole treatment
G.G.Neznamov1, N.N.Zolotov1, T.S.Syunyakov1, S.A.Syunyakov1, M.V.Metlina2, G.A.Nazarova1
1FSBI Zakusov Institute of Pharmacology RAMS, Moscow
2State Budget Funded Entity of Healthcare Psychiatric Clinical Hospital №12 of Moscow Healthcare Department
Summary. This study is the first aimed on investigation of proline-specific enzyme system activity in patients with different anxiety disorders. In accordance to previous data the study revealed increased activity of dipeptidyl peptidase-4 and prolyl endopeptidase in anxiety disorders. DPP-4 activity correlated with severity of asthenia. Afobazole treatment resulted in opposite changes in activity of both DPP-4 and PEP. Therapeutic changes of both enzyme activity correlated with their background activity and with changes in severity of psychopathological symptoms during treatment. These results indicate on importance of DPP-4 and PEP activity in the anxiety disorders.
Key words: clinic-biochemistry study, proline-specific enzymes, dipeptidyl peptidase-4, prolyl endopeptidase, anxiety disorders, anxiolytic, Afobazole.
Введение
Тревожные расстройства являются клинически гетерогенными состояниями, ассоциирующимися со сложными этиопатогенетическими механизмами [1–3]. При этом одним из приоритетных направлений изучения подобных комплексных состояний является их анализ с позиций эндофенотипов, позволяющий провести оценку взаимосвязей между клинической картиной и ее биологическими коррелятами [4, 5].
Исходя из представлений о том, что пептидергические механизмы играют значимую роль в патогенезе тревоги и являются потенциальной мишенью для ее фармакологической регуляции [6–8], особое значение приобретают исследования протеолитических ферментов, участвующих в метаболизме нейропептидов [9–11]. Ранее в экспериментальных и клинических условиях были получены данные о вовлечении пролинспецифических ферментов – пролилэндопептидазы (ПЭП) и дипептидилпептидазы-4 (ДПП-4) – субстратом которых являются многие нейропептиды
[12, 13], в патогенез широкой группы тревожно-депрессивных расстройств – ТДР [14–16] и отдельных тревожных нарушений [17–22].
В ФГБУ «НИИ фармакологии им. В.В.Закусова» РАМН в течение ряда лет проводятся целенаправленные экспериментальные исследования роли пролинспецифических пептидаз в патогенезе тревожно-аффективных расстройств [23–25]. Полученные в результате проведенных работ данные стали основой для разработки экспериментальных моделей тревожно-депрессивных состояний у лабораторных животных [14]. У больных с тревожными нарушениями также получены данные о повышении активности ПЭП и ДПП-4 в плазме крови и о достоверном снижении под влиянием бензодиазепинового анксиолитика феназепама активности ДПП-4, что может указывать на вовлеченность этого фермента в реализацию терапевтического действия препарата [26].
Все эти доводы позволяют рассматривать активность данных энзиматических систем в структуре эндофенотипа расстройств тревожного спектра. Однако активность ПЭП и ДПП-4 не являлась предметом систематического изучения на всем континууме анксиозных состояний, начиная с относительно простых, определяющихся феноменом генерализованной тревоги, и заканчивая сложными синдромами, в рамках которых тревога невротического уровня сосуществует с другими невротическими проявлениями.
Все перечисленное определило цель и задачи настоящего исследования. Они ориентированы на изучение активности пролинспецифических ферментов ПЭП и ДПП-4 и особенностей ее изменения при терапии больных анксиолитиком небензодиазепиновой структуры Афобазолом в зависимости от различий в психопатологической структуре тревожных расстройств в континууме тревожных, ТДР и тревожно-ипохондрических нарушений. Важным аспектом работы стала оценка соотношений, реализующихся в клинических условиях параметров терапевтического действия Афобазола и активности ПЭП и ДПП-4 у указанных больных.
Материалы
Критерии включения: больные, соответствующие диагностическим критериям генерализованного тревожного расстройства (ГТР), код F41.1, по Международной классификации болезней 10-го пересмотра, агорафобии с паническим расстройством (ТФР), код F40.0, и ипохондрического расстройства (тревожно-ипохондрического расстройства – ТИР), код F45.2, в возрасте от 18 до 55 лет, без сопутствующей неврологической и соматической патологии (в том числе алкоголизма, лекарственной и наркотической зависимости).
Критерии исключения: женщины беременные или в период лактации, больные, принимающие препараты с психотропной активностью на протяжении менее 1 нед до включения в исследование, а также ранее в течение длительного времени принимавшие Афобазол или с индивидуальной непереносимостью препарата; больные с суммарной оценкой депрессивных расстройств по «общему депрессивному фактору» (пп. 1–3, 6–8) шкалы оценки депрессии Гамильтона более 7 баллов, с наличием значительного и стойкого улучшения состояния на фоне 7-дневного приема плацебо («очень большое» и «большое» улучшение по шкале CGI). Отобранным в исследование больным проводилась курсовая терапия Афобазолом в стандартной суточной дозе 30 мг длительностью 14 дней.
Методы исследования
Для оценки у больных выраженности психопатологических расстройств и терапевтической динамики состояния применялись шкала оценки тревоги Гамильтона (HAMA) [27] и шкала оценки выраженности симптоматики1 [29], терапевтической эффективности – шкала общего клинического впечатления (CGI) [30]. Стандартизованная оценка состояния больных проводилась до начала терапии, на 7 и 14-й дни терапии. Для оценки активности ПЭП и ДПП-4 кровь собирали из локтевой вены в пробирки BD Vacutainer с этилендиаминтетрауксусной кислотой до начала терапии (день 0), на 7 и 14-й дни терапии в утренние часы, центрифугировали и хранили полученную плазму до определения активности ферментов при температуре
-20°C не более 7 дней. Активность ПЭП и ДПП-4 определяли по гидролизу флуорогенных субстратов Z-Ala-Pro-MCA и Gly-Pro-MCA соответственно [31].
Статистическая обработка
Оценка активности ПЭП и ДПП-4 и особенностей клинического состояния, полученных путем группировки показателей шкалы оценки выраженности симптоматики, до начала лечения и в процессе терапии Афобазолом с целью их последующего сопоставления проводилась методами дескриптивной статистики. Терапевтическая динамика состояния в 3 диагностических группах анализировалась при помощи двухфакторного дисперсионного анализа (ANOVA), в который в качестве зависимых переменных были внесены выраженность тревожных расстройств, расстройств настроения, астенических, невротических и вегетативных расстройств, нарушений сна, дневной сонливости, а в качестве независимой категориальной переменной – диагноз.
Попарное сравнение выявленных достоверных различий проводилось в рамках post-hoc анализа с применением методики наименьших квадратов Фишера. Анализ изменений непрерывных показателей в сравнении с фоном внутри диагностических групп производился с использованием непараметрического теста Уилкоксона для парных измерений. Сравнение непрерывных переменных между 3 диагностическими группами производилось при помощи непараметрической методики Краскала–Уоллиса с последующим попарным сравнением выявленных межгрупповых различий по непараметрической методике Манна–Уитни. Корреляционный анализ проводился по методике Спирмена. При проведении статистических расчетов использовались уровни достоверности при р≤0,1, р≤0,05 и р≤0,01. Статистические расчеты производились при помощи программ Microsoft Excel 2007, Statsoft Statistica 8.0.
Результаты и обсуждение
Характеристика изученных больных
и терапевтическая динамика состояния
В исследование включены 30 больных (19 женщин, 11 мужчин), представляющих разные состояния в рамках спектра тревожных расстройств, включая больных с простыми по структуре тревожно-астеническими нарушениями и со сложной структурой синдрома, в рамках которого тревога сочеталась с фобическими и ипохондрическими проявлениями: по 10 пациентов в группах ГТР, ТФР, ТИР. Клинико-демографические характеристики изученных больных приведены в табл. 1. В качестве контроля использовались данные активности ПЭП и ДПП-4 у 33 здоровых добровольцев (17 мужчин, 16 женщин) в возрасте от 19 до 32 лет [26].
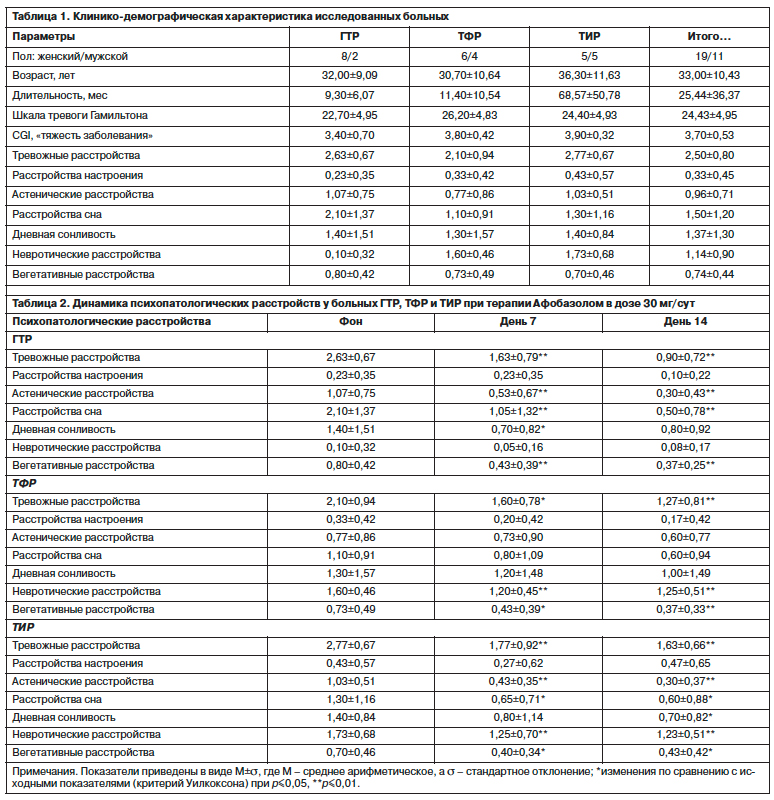
Больные ГТР, ТФР и ТИР были сопоставимы по возрасту, общей тяжести состояния (шкала CGI – «тяжесть заболевания»), выраженности тревоги, оцениваемой по шкале оценки тревоги Гамильтона и по шкале оценки выраженности симптоматики (критерий Краскала–Уоллиса; все p>0,1). Больные ТИР достоверно превосходили больных из 2 других диагностических групп по длительности заболевания (p<0,01; критерий Манна–Уитни), что, с одной стороны, отражает особенности формирования и течения ипохондрических расстройств, принадлежащих к состояниям сравнительно более глубокого психопатологического регистра.
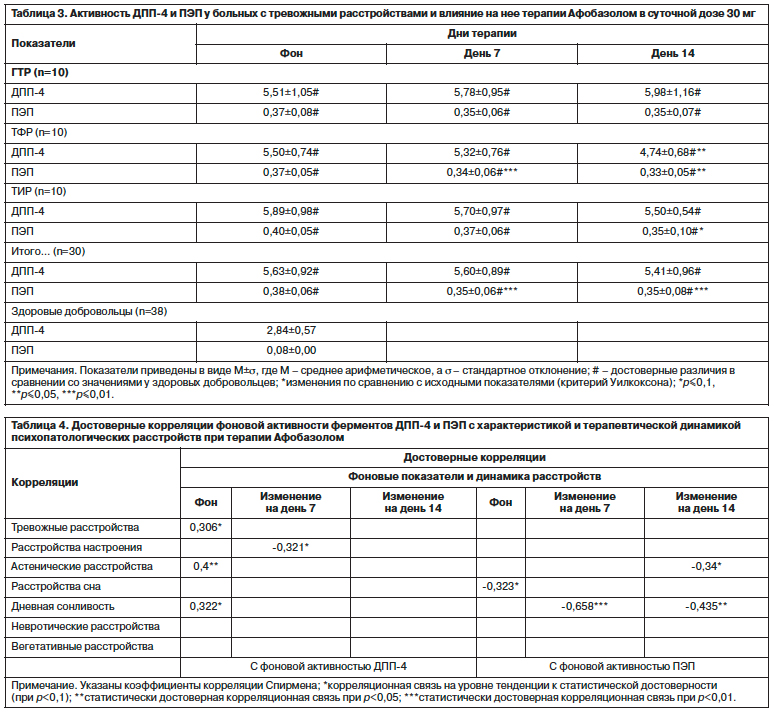
В табл. 2 приведены данные о фоновой выраженности психопатологических расстройств, рассчитанных на основании сгруппированных показателей шкалы оценки выраженности симптоматики, и их терапевтических изменений при применении Афобазола. Как следует из приведенных данных, наиболее полноценная и терапевтически значимая динамика всего комплекса патологических нарушений, определяющих состояние исследуемых больных, отмечалась под влиянием Афобазола при ГТР. У больных ТФР и ТИР отмечалось проявление анксиолитического действия препарата и его активирующего эффекта при клинически несущественной редукции невротических (обсессивно-фобических и ипохондрических) расстройств, составляющих ядро психопатологического состояния у этих больных, ограничивающейся их аффективным компонентом. Мультивариантный анализ выявил, что наибольшие различия между группами выявлялись в отношении терапевтической динамики тревожных расстройств (F=2,36, df=4, p=0,065) и невротических расстройств (F=2,79, df=4, p=0,036).
Post-hoc анализ с применением методики наименьших квадратов Фишера продемонстрировал возникновение достоверных различий по выраженности тревожных расстройств между группами ГТР и ТИР на 14-й день (p=0,041) при отсутствии исходных различий между группами (p=0,7). Кроме того, между группой ГТР и группами ТФР и ТИР в процессе терапии сохранялись достоверные различия по выраженности невротических расстройств (все p<0,001). Также выраженность тревожных расстройств, оцениваемых по шкале оценки выраженности симптоматики на 14-й день, при ТИР достоверно превосходила таковую при ГТР (p<0,05). В качестве особенностей терапевтической динамики выступают возникающие на 14-й день терапии различия между группами ГТР и ТИР по выраженности тревоги, оцениваемой по шкале тревоги Гамильтона (p<0,05; критерий Манна–Уитни), и тенденция к достоверным различиям по этому показателю на 14-й день между группами ГТР и ТФР (p<0,1; критерий Манна–Уитни). Кроме того, между группой ГТР и группами ТФР и ТИР на 14-й день терапии Афобазолом выявляются статистически достоверные различия по показателям тяжести состояния, выраженности общего улучшения и терапевтического эффекта, оцениваемых по шкале CGI (все p<0,05). Полученные данные подтверждают ранее установленные закономерности в действии Афобазола и свидетельствуют о наиболее полной реализации его терапевтических возможностей при относительно простой структуре тревожных и тревожно-астенических расстройств [32–34].
Фоновые показатели активности ферментов ДПП-4 и ПЭП у обследованных больных с тревожными расстройствам вне зависимости от диагноза достоверно превосходили данные показатели здоровых добровольцев (табл. 3). Сравнение фоновой активности ферментов у больных ГТР, ТФР и ТИР не выявило достоверных различий (H=3,78, p=0,151 и H=1,24, p=0,537 для ДПП-4 и ПЭП соответственно, методика Краскала–Уоллиса), хотя при структурно более сложных расстройствах (у больных ТИР) отмечались несколько более высокие показатели активности обоих ферментов.
Анализ изменения активности ферментов при терапии Афобазолом (см. табл. 3) установил, что по суммарным данным всей группы исследованных больных с тревожными расстройствами не отмечалось достоверной динамики ДПП-4 при регистрируемом достоверном снижении активности ПЭП. При этом в разных диагностических подгруппах наблюдался разный паттерн изменения активности ферментов как по направленности, так и по выраженности. Показатель активности ДПП-4 при ГТР незначительно увеличивался, при ТФР и ТИР отмечалось его снижение, достигающее достоверных изменений при ТФР. Активность ПЭП по показателям средних значений у всех групп больных снижалась: недостоверно при ГТР, на уровне тенденции к статистической достоверности при ТИР и достоверно при ТФР. Следует отметить, что терапия Афобазолом не приводила к снижению активности ферментов до уровня, сопоставимого с регистрируемым у здоровых добровольцев.
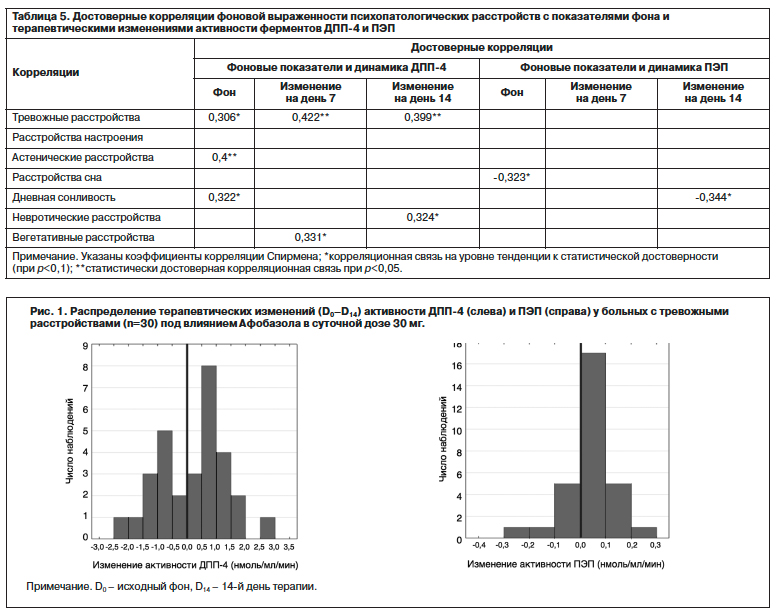
Детальный анализ изменений активности ферментов под влиянием Афобазола у всех больных тревожными расстройствами (n=30) показал, что для ДПП-4 у одних больных отмечалось повышение, а у других – снижение активности фермента. Активность ПЭП изменялась в соответствии с нормальным распределением, но также имелись больные с увеличением и снижением активности фермента в результате терапии (рис. 1).
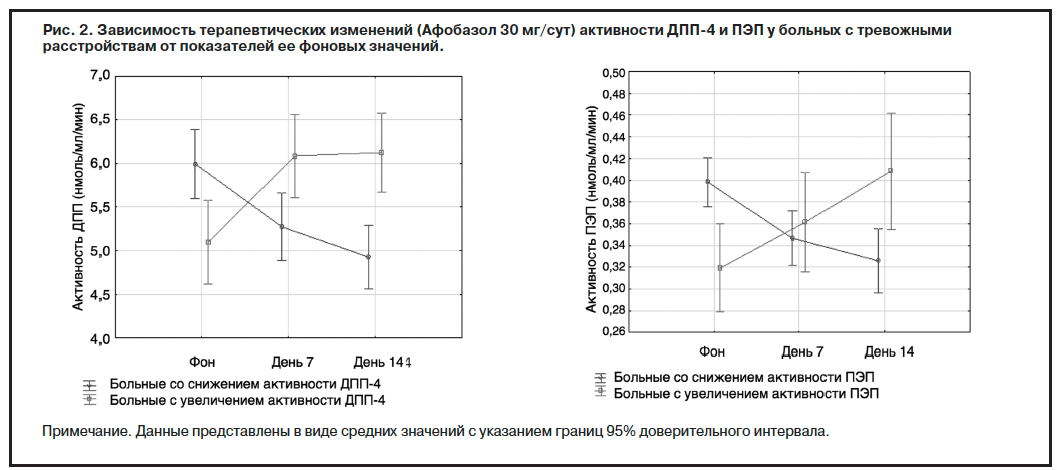
У 18 больных отмечалось снижение активности ДПП-4, у 12 – увеличение. Активность ПЭП у 23 больных снижалась и у 7 – увеличивалась. Установлена зависимость направленности терапевтических изменений активности обоих ферментов от различий фоновой активности ДПП-4 и ПЭП: фоновая активность ДПП-4 у больных с ее терапевтическим снижением и увеличением составила 5,993±0,715 и 5,095±0,951 (U=51, p=0,015), а фоновая активность ПЭП у больных с ее снижением и увеличением – 0,398±0,053 и 0,319±0,048 соответственно; U=15, p=0,001); рис. 2.
При оценке различий клинических характеристик у больных с увеличением и снижением активности ДПП-4 и ПЭП наиболее значимыми разграничительными признаками групп с разной динамикой ДПП-4 является выраженность невротических расстройств до приема препарата (1,4±0,8 балла у больных с последующим снижением активности фермента и 0,7±0,8 балла у больных с последующим повышением активности фермента; p=0,037), а в отношении ПЭП – уровень бодрости (1,1±1,2 у больных с последующим снижением активности фермента и 2,3±1,1 у больных с последующим увеличением его активности; p=0,025). Представляется важным, что группа с увеличением активности ДПП-4 на уровне тенденции отличалась более благоприятными результатами терапии, о чем свидетельствуют статистически достоверные различия по показателю общего улучшения состояния по шкале CGI (средний балл по шкале CGI «общее улучшение» на 14-й день: 2,2±0,9 и 3,0±0,8 у больных с увеличением и уменьшением активности ДПП-4 соответственно; р=0,054).
Проведен анализ соотношений активности изучаемых ферментов у обследованных пациентов до начала лечения с характеристикой и динамикой в процессе терапии психопатологических нарушений (см. табл. 4). Установлено наличие достоверных корреляций активности ДПП-4 с астеническими расстройствами и на уровне тенденции (р<0,1) с выраженностью в клинической картине психопатологического состояния больных тревожных расстройств и дневной сонливости. Также обнаружена ее корреляция с терапевтическими изменениями расстройств настроения. Фоновая активность ПЭП на уровне тенденции коррелировала с выраженностью у больных расстройств сна и статистически значимо с терапевтическими изменениями показателей уровня бодрствования.
В табл. 5 приведены данные корреляционного анализа взаимосвязей показателей психического состояния исследуемых больных с активностью ДПП-4 и ПЭП и ее терапевтическими изменениями. Не обсуждая фоновые соотношения параметров психического состояния и уровня в плазме крови ферментов, приведенные выше, необходимо отметить наличие отдельных корреляций изменения активности ДПП-4 и ПЭП с отдельными характеристиками психического состояния больных. Наиболее значимые из них для ДПП-4 – с выраженностью тревожных расстройств, а для ПЭП – с уровнем бодрствования.
Для характеристики изучаемых взаимосвязей важно отметить, что также выявлена достоверная корреляция между фоновой активностью ДПП-4 и динамикой общего балла по шкале тревоги Гамильтона (R=0,49, p=0,006 и R=0,393, p=0,032 с общим баллом по шкале тревоги Гамильтона на 7 и 14-й дни соответственно; и R=0,454, p=0,012 с изменением общего балла по шкале тревоги Гамильтона к 7-му дню).
Состояние системы ДПП-4 и ее терапевтические изменения в отличие от ПЭП обнаружили корреляционные взаимосвязи с разными показателями результативности терапии. Фоновая активность фермента на уровне тенденции была связана с улучшением состояния на 7 и 14-й дни терапии (R=0,33, p=0,075 и R=0,32, p=0,083 соответственно). Более того, выявлена достоверная взаимосвязь между изменением активности ДПП-4 к 14-му дню терапии с выраженностью общего улучшения по шкале CGI-I (R=0,36, p=0,05), на уровне тенденций такие взаимосвязи были обнаружены в отношении других показателей эффективности на 14-й день (CGI – «тяжесть заболевания и терапевтический эффект»: R=0,3, p=0,1 и R=0307, p=0,1).
Заключение
По данным экспериментальных и клинических работ, тревожно-депрессивные расстройства ассоциируются с повышением активности пролинспецифических ферментов, и такую связь внешних проявлений с биохимическими изменениями можно рассматривать в качестве отдельного эндофенотипа, требующего специального изучения в плане его значения для характеристики состояния больных тревожными расстройствами и прогноза эффективности терапии. В проведенном исследовании нашли подтверждение данные предшествующих работ: у пациентов с тревожными расстройствами, вне зависимости от сложности их структуры, отмечалось достоверное повышение активности ферментов ДПП-4 и ПЭП в сравнении с контрольной группой здоровых добровольцев [26]. Особенностью данного исследования является то, что данный эндофенотип рассматривается не в рамках конкретной узкой нозологической единицы, а впервые в контексте континуума тревожных расстройств по мере усложнения их клинической картины в ряду ГТР, ТФР, ТИР. Такое расширение изучаемых состояний позволило выявить взаимосвязь между фоновой активностью ДПП-4 и выраженностью астенических расстройств, которая утрачивалась в процессе терапии, тогда как в предшествующих исследованиях не удавалось выявить корреляций между активностью данного фермента с особенностями состояния больных [22].
Более того, терапевтическая динамика активности как ДПП-4, так и ПЭП у больных с тревожными расстройствами при терапии Афобазолом оказалась разнонаправленной: имелись больные с увеличением и снижением активности фермента в ходе терапии, хотя в отношении ДПП-4 данная закономерность проявилась более очерченно, о чем свидетельствует характер распределения изменений. При этом группы с их разнонаправленной динамикой достоверно различались по фоновой активности ДПП-4 и ПЭП. Разная направленность терапевтических изменений активности ферментов взаимосвяна с психопатологической структурой состояния пациентов: у больных с большей выраженностью невротических расстройств (т.е. при состояниях, не являющихся оптимальной терапевтической мишенью действия Афобазола) отмечалось снижение активности ДПП-4.
Таким образом, полученные данные позволяют с большой вероятностью предполагать значимость активности изучаемых ферментов в генезе и формировании клинической картины тревожных нарушений. Разнонаправленность терапевтической динамики ферментативной активности под влиянием Афобазола, а также выявленные взаимосвязи с показателями эффективности терапии предполагают теоретическую возможность прогнозировать достижение терапевтических результатов у больных с тревожными расстройствами на основании оценки активности в плазме крови больных ДПП-4 и ПЭП.
Сведения об авторах
Незнамов Григорий Георгиевич – д-р мед. наук, проф., зав. лаб. клинической психофармакологии ФГБУ НИИ фармакологии им. В.В.Закусова РАМН. E-mail: neznamovpharm@mail.ru
Золотов Николай Николаевич – гл. науч. сотр., д-р биол. наук, проф. лаб. психофармакологии ФГБУ НИИ фармакологии
им. В.В.Закусова РАМН. E-mail: zolotovnn@gmail.com
Сюняков Тимур Сергеевич – канд. мед. наук, ст. науч. сотр. лаб. фармакологической генетики ФГБУ НИИ фармакологии
им. В.В.Закусова РАМН. E-mail: sjunja@bk.ru
Сюняков Сергей Александрович – канд. мед. наук, вед. науч. сотр. лаб. клинической психофармакологии ФГБУ НИИ фармакологии им. В.В.Закусова РАМН. E-mail: Siuniakov@mail.ru
Метлина Марианна Вячеславовна – врач ГБУЗ ПКБ №12 Департамента здравоохранения г. Москвы. E-mail: mariannamet@mail.ru
Назарова Галина Александровна – науч. сотр. лаб. психофармакологии ФГБУ НИИ фармакологии им. В.В.Закусова РАМН.
E-mail: g-a-nazarova@rambler.ru
Ключевые слова: клинико-биохимическое исследование, пролинспецифические ферменты, дипептидилпептидаза-4, пролилэндопептидаза, тревожные расстройства, анксиолитик, Афобазол.
Activity of prolyn-specific enzymes in patients with anxiety disorders and its changes during Afobazole treatment
G.G.Neznamov1, N.N.Zolotov1, T.S.Syunyakov1, S.A.Syunyakov1, M.V.Metlina2, G.A.Nazarova1
1FSBI Zakusov Institute of Pharmacology RAMS, Moscow
2State Budget Funded Entity of Healthcare Psychiatric Clinical Hospital №12 of Moscow Healthcare Department
Summary. This study is the first aimed on investigation of proline-specific enzyme system activity in patients with different anxiety disorders. In accordance to previous data the study revealed increased activity of dipeptidyl peptidase-4 and prolyl endopeptidase in anxiety disorders. DPP-4 activity correlated with severity of asthenia. Afobazole treatment resulted in opposite changes in activity of both DPP-4 and PEP. Therapeutic changes of both enzyme activity correlated with their background activity and with changes in severity of psychopathological symptoms during treatment. These results indicate on importance of DPP-4 and PEP activity in the anxiety disorders.
Key words: clinic-biochemistry study, proline-specific enzymes, dipeptidyl peptidase-4, prolyl endopeptidase, anxiety disorders, anxiolytic, Afobazole.
Введение
Тревожные расстройства являются клинически гетерогенными состояниями, ассоциирующимися со сложными этиопатогенетическими механизмами [1–3]. При этом одним из приоритетных направлений изучения подобных комплексных состояний является их анализ с позиций эндофенотипов, позволяющий провести оценку взаимосвязей между клинической картиной и ее биологическими коррелятами [4, 5].
Исходя из представлений о том, что пептидергические механизмы играют значимую роль в патогенезе тревоги и являются потенциальной мишенью для ее фармакологической регуляции [6–8], особое значение приобретают исследования протеолитических ферментов, участвующих в метаболизме нейропептидов [9–11]. Ранее в экспериментальных и клинических условиях были получены данные о вовлечении пролинспецифических ферментов – пролилэндопептидазы (ПЭП) и дипептидилпептидазы-4 (ДПП-4) – субстратом которых являются многие нейропептиды
[12, 13], в патогенез широкой группы тревожно-депрессивных расстройств – ТДР [14–16] и отдельных тревожных нарушений [17–22].
В ФГБУ «НИИ фармакологии им. В.В.Закусова» РАМН в течение ряда лет проводятся целенаправленные экспериментальные исследования роли пролинспецифических пептидаз в патогенезе тревожно-аффективных расстройств [23–25]. Полученные в результате проведенных работ данные стали основой для разработки экспериментальных моделей тревожно-депрессивных состояний у лабораторных животных [14]. У больных с тревожными нарушениями также получены данные о повышении активности ПЭП и ДПП-4 в плазме крови и о достоверном снижении под влиянием бензодиазепинового анксиолитика феназепама активности ДПП-4, что может указывать на вовлеченность этого фермента в реализацию терапевтического действия препарата [26].
Все эти доводы позволяют рассматривать активность данных энзиматических систем в структуре эндофенотипа расстройств тревожного спектра. Однако активность ПЭП и ДПП-4 не являлась предметом систематического изучения на всем континууме анксиозных состояний, начиная с относительно простых, определяющихся феноменом генерализованной тревоги, и заканчивая сложными синдромами, в рамках которых тревога невротического уровня сосуществует с другими невротическими проявлениями.
Все перечисленное определило цель и задачи настоящего исследования. Они ориентированы на изучение активности пролинспецифических ферментов ПЭП и ДПП-4 и особенностей ее изменения при терапии больных анксиолитиком небензодиазепиновой структуры Афобазолом в зависимости от различий в психопатологической структуре тревожных расстройств в континууме тревожных, ТДР и тревожно-ипохондрических нарушений. Важным аспектом работы стала оценка соотношений, реализующихся в клинических условиях параметров терапевтического действия Афобазола и активности ПЭП и ДПП-4 у указанных больных.
Материалы
Критерии включения: больные, соответствующие диагностическим критериям генерализованного тревожного расстройства (ГТР), код F41.1, по Международной классификации болезней 10-го пересмотра, агорафобии с паническим расстройством (ТФР), код F40.0, и ипохондрического расстройства (тревожно-ипохондрического расстройства – ТИР), код F45.2, в возрасте от 18 до 55 лет, без сопутствующей неврологической и соматической патологии (в том числе алкоголизма, лекарственной и наркотической зависимости).
Критерии исключения: женщины беременные или в период лактации, больные, принимающие препараты с психотропной активностью на протяжении менее 1 нед до включения в исследование, а также ранее в течение длительного времени принимавшие Афобазол или с индивидуальной непереносимостью препарата; больные с суммарной оценкой депрессивных расстройств по «общему депрессивному фактору» (пп. 1–3, 6–8) шкалы оценки депрессии Гамильтона более 7 баллов, с наличием значительного и стойкого улучшения состояния на фоне 7-дневного приема плацебо («очень большое» и «большое» улучшение по шкале CGI). Отобранным в исследование больным проводилась курсовая терапия Афобазолом в стандартной суточной дозе 30 мг длительностью 14 дней.
Методы исследования
Для оценки у больных выраженности психопатологических расстройств и терапевтической динамики состояния применялись шкала оценки тревоги Гамильтона (HAMA) [27] и шкала оценки выраженности симптоматики1 [29], терапевтической эффективности – шкала общего клинического впечатления (CGI) [30]. Стандартизованная оценка состояния больных проводилась до начала терапии, на 7 и 14-й дни терапии. Для оценки активности ПЭП и ДПП-4 кровь собирали из локтевой вены в пробирки BD Vacutainer с этилендиаминтетрауксусной кислотой до начала терапии (день 0), на 7 и 14-й дни терапии в утренние часы, центрифугировали и хранили полученную плазму до определения активности ферментов при температуре
-20°C не более 7 дней. Активность ПЭП и ДПП-4 определяли по гидролизу флуорогенных субстратов Z-Ala-Pro-MCA и Gly-Pro-MCA соответственно [31].
Статистическая обработка
Оценка активности ПЭП и ДПП-4 и особенностей клинического состояния, полученных путем группировки показателей шкалы оценки выраженности симптоматики, до начала лечения и в процессе терапии Афобазолом с целью их последующего сопоставления проводилась методами дескриптивной статистики. Терапевтическая динамика состояния в 3 диагностических группах анализировалась при помощи двухфакторного дисперсионного анализа (ANOVA), в который в качестве зависимых переменных были внесены выраженность тревожных расстройств, расстройств настроения, астенических, невротических и вегетативных расстройств, нарушений сна, дневной сонливости, а в качестве независимой категориальной переменной – диагноз.
Попарное сравнение выявленных достоверных различий проводилось в рамках post-hoc анализа с применением методики наименьших квадратов Фишера. Анализ изменений непрерывных показателей в сравнении с фоном внутри диагностических групп производился с использованием непараметрического теста Уилкоксона для парных измерений. Сравнение непрерывных переменных между 3 диагностическими группами производилось при помощи непараметрической методики Краскала–Уоллиса с последующим попарным сравнением выявленных межгрупповых различий по непараметрической методике Манна–Уитни. Корреляционный анализ проводился по методике Спирмена. При проведении статистических расчетов использовались уровни достоверности при р≤0,1, р≤0,05 и р≤0,01. Статистические расчеты производились при помощи программ Microsoft Excel 2007, Statsoft Statistica 8.0.
Результаты и обсуждение
Характеристика изученных больных
и терапевтическая динамика состояния
В исследование включены 30 больных (19 женщин, 11 мужчин), представляющих разные состояния в рамках спектра тревожных расстройств, включая больных с простыми по структуре тревожно-астеническими нарушениями и со сложной структурой синдрома, в рамках которого тревога сочеталась с фобическими и ипохондрическими проявлениями: по 10 пациентов в группах ГТР, ТФР, ТИР. Клинико-демографические характеристики изученных больных приведены в табл. 1. В качестве контроля использовались данные активности ПЭП и ДПП-4 у 33 здоровых добровольцев (17 мужчин, 16 женщин) в возрасте от 19 до 32 лет [26].

Больные ГТР, ТФР и ТИР были сопоставимы по возрасту, общей тяжести состояния (шкала CGI – «тяжесть заболевания»), выраженности тревоги, оцениваемой по шкале оценки тревоги Гамильтона и по шкале оценки выраженности симптоматики (критерий Краскала–Уоллиса; все p>0,1). Больные ТИР достоверно превосходили больных из 2 других диагностических групп по длительности заболевания (p<0,01; критерий Манна–Уитни), что, с одной стороны, отражает особенности формирования и течения ипохондрических расстройств, принадлежащих к состояниям сравнительно более глубокого психопатологического регистра.

В табл. 2 приведены данные о фоновой выраженности психопатологических расстройств, рассчитанных на основании сгруппированных показателей шкалы оценки выраженности симптоматики, и их терапевтических изменений при применении Афобазола. Как следует из приведенных данных, наиболее полноценная и терапевтически значимая динамика всего комплекса патологических нарушений, определяющих состояние исследуемых больных, отмечалась под влиянием Афобазола при ГТР. У больных ТФР и ТИР отмечалось проявление анксиолитического действия препарата и его активирующего эффекта при клинически несущественной редукции невротических (обсессивно-фобических и ипохондрических) расстройств, составляющих ядро психопатологического состояния у этих больных, ограничивающейся их аффективным компонентом. Мультивариантный анализ выявил, что наибольшие различия между группами выявлялись в отношении терапевтической динамики тревожных расстройств (F=2,36, df=4, p=0,065) и невротических расстройств (F=2,79, df=4, p=0,036).
Post-hoc анализ с применением методики наименьших квадратов Фишера продемонстрировал возникновение достоверных различий по выраженности тревожных расстройств между группами ГТР и ТИР на 14-й день (p=0,041) при отсутствии исходных различий между группами (p=0,7). Кроме того, между группой ГТР и группами ТФР и ТИР в процессе терапии сохранялись достоверные различия по выраженности невротических расстройств (все p<0,001). Также выраженность тревожных расстройств, оцениваемых по шкале оценки выраженности симптоматики на 14-й день, при ТИР достоверно превосходила таковую при ГТР (p<0,05). В качестве особенностей терапевтической динамики выступают возникающие на 14-й день терапии различия между группами ГТР и ТИР по выраженности тревоги, оцениваемой по шкале тревоги Гамильтона (p<0,05; критерий Манна–Уитни), и тенденция к достоверным различиям по этому показателю на 14-й день между группами ГТР и ТФР (p<0,1; критерий Манна–Уитни). Кроме того, между группой ГТР и группами ТФР и ТИР на 14-й день терапии Афобазолом выявляются статистически достоверные различия по показателям тяжести состояния, выраженности общего улучшения и терапевтического эффекта, оцениваемых по шкале CGI (все p<0,05). Полученные данные подтверждают ранее установленные закономерности в действии Афобазола и свидетельствуют о наиболее полной реализации его терапевтических возможностей при относительно простой структуре тревожных и тревожно-астенических расстройств [32–34].
Фоновые показатели активности ферментов ДПП-4 и ПЭП у обследованных больных с тревожными расстройствам вне зависимости от диагноза достоверно превосходили данные показатели здоровых добровольцев (табл. 3). Сравнение фоновой активности ферментов у больных ГТР, ТФР и ТИР не выявило достоверных различий (H=3,78, p=0,151 и H=1,24, p=0,537 для ДПП-4 и ПЭП соответственно, методика Краскала–Уоллиса), хотя при структурно более сложных расстройствах (у больных ТИР) отмечались несколько более высокие показатели активности обоих ферментов.
Анализ изменения активности ферментов при терапии Афобазолом (см. табл. 3) установил, что по суммарным данным всей группы исследованных больных с тревожными расстройствами не отмечалось достоверной динамики ДПП-4 при регистрируемом достоверном снижении активности ПЭП. При этом в разных диагностических подгруппах наблюдался разный паттерн изменения активности ферментов как по направленности, так и по выраженности. Показатель активности ДПП-4 при ГТР незначительно увеличивался, при ТФР и ТИР отмечалось его снижение, достигающее достоверных изменений при ТФР. Активность ПЭП по показателям средних значений у всех групп больных снижалась: недостоверно при ГТР, на уровне тенденции к статистической достоверности при ТИР и достоверно при ТФР. Следует отметить, что терапия Афобазолом не приводила к снижению активности ферментов до уровня, сопоставимого с регистрируемым у здоровых добровольцев.

Детальный анализ изменений активности ферментов под влиянием Афобазола у всех больных тревожными расстройствами (n=30) показал, что для ДПП-4 у одних больных отмечалось повышение, а у других – снижение активности фермента. Активность ПЭП изменялась в соответствии с нормальным распределением, но также имелись больные с увеличением и снижением активности фермента в результате терапии (рис. 1).
У 18 больных отмечалось снижение активности ДПП-4, у 12 – увеличение. Активность ПЭП у 23 больных снижалась и у 7 – увеличивалась. Установлена зависимость направленности терапевтических изменений активности обоих ферментов от различий фоновой активности ДПП-4 и ПЭП: фоновая активность ДПП-4 у больных с ее терапевтическим снижением и увеличением составила 5,993±0,715 и 5,095±0,951 (U=51, p=0,015), а фоновая активность ПЭП у больных с ее снижением и увеличением – 0,398±0,053 и 0,319±0,048 соответственно; U=15, p=0,001); рис. 2.

При оценке различий клинических характеристик у больных с увеличением и снижением активности ДПП-4 и ПЭП наиболее значимыми разграничительными признаками групп с разной динамикой ДПП-4 является выраженность невротических расстройств до приема препарата (1,4±0,8 балла у больных с последующим снижением активности фермента и 0,7±0,8 балла у больных с последующим повышением активности фермента; p=0,037), а в отношении ПЭП – уровень бодрости (1,1±1,2 у больных с последующим снижением активности фермента и 2,3±1,1 у больных с последующим увеличением его активности; p=0,025). Представляется важным, что группа с увеличением активности ДПП-4 на уровне тенденции отличалась более благоприятными результатами терапии, о чем свидетельствуют статистически достоверные различия по показателю общего улучшения состояния по шкале CGI (средний балл по шкале CGI «общее улучшение» на 14-й день: 2,2±0,9 и 3,0±0,8 у больных с увеличением и уменьшением активности ДПП-4 соответственно; р=0,054).
Проведен анализ соотношений активности изучаемых ферментов у обследованных пациентов до начала лечения с характеристикой и динамикой в процессе терапии психопатологических нарушений (см. табл. 4). Установлено наличие достоверных корреляций активности ДПП-4 с астеническими расстройствами и на уровне тенденции (р<0,1) с выраженностью в клинической картине психопатологического состояния больных тревожных расстройств и дневной сонливости. Также обнаружена ее корреляция с терапевтическими изменениями расстройств настроения. Фоновая активность ПЭП на уровне тенденции коррелировала с выраженностью у больных расстройств сна и статистически значимо с терапевтическими изменениями показателей уровня бодрствования.
В табл. 5 приведены данные корреляционного анализа взаимосвязей показателей психического состояния исследуемых больных с активностью ДПП-4 и ПЭП и ее терапевтическими изменениями. Не обсуждая фоновые соотношения параметров психического состояния и уровня в плазме крови ферментов, приведенные выше, необходимо отметить наличие отдельных корреляций изменения активности ДПП-4 и ПЭП с отдельными характеристиками психического состояния больных. Наиболее значимые из них для ДПП-4 – с выраженностью тревожных расстройств, а для ПЭП – с уровнем бодрствования.
Для характеристики изучаемых взаимосвязей важно отметить, что также выявлена достоверная корреляция между фоновой активностью ДПП-4 и динамикой общего балла по шкале тревоги Гамильтона (R=0,49, p=0,006 и R=0,393, p=0,032 с общим баллом по шкале тревоги Гамильтона на 7 и 14-й дни соответственно; и R=0,454, p=0,012 с изменением общего балла по шкале тревоги Гамильтона к 7-му дню).
Состояние системы ДПП-4 и ее терапевтические изменения в отличие от ПЭП обнаружили корреляционные взаимосвязи с разными показателями результативности терапии. Фоновая активность фермента на уровне тенденции была связана с улучшением состояния на 7 и 14-й дни терапии (R=0,33, p=0,075 и R=0,32, p=0,083 соответственно). Более того, выявлена достоверная взаимосвязь между изменением активности ДПП-4 к 14-му дню терапии с выраженностью общего улучшения по шкале CGI-I (R=0,36, p=0,05), на уровне тенденций такие взаимосвязи были обнаружены в отношении других показателей эффективности на 14-й день (CGI – «тяжесть заболевания и терапевтический эффект»: R=0,3, p=0,1 и R=0307, p=0,1).
Заключение
По данным экспериментальных и клинических работ, тревожно-депрессивные расстройства ассоциируются с повышением активности пролинспецифических ферментов, и такую связь внешних проявлений с биохимическими изменениями можно рассматривать в качестве отдельного эндофенотипа, требующего специального изучения в плане его значения для характеристики состояния больных тревожными расстройствами и прогноза эффективности терапии. В проведенном исследовании нашли подтверждение данные предшествующих работ: у пациентов с тревожными расстройствами, вне зависимости от сложности их структуры, отмечалось достоверное повышение активности ферментов ДПП-4 и ПЭП в сравнении с контрольной группой здоровых добровольцев [26]. Особенностью данного исследования является то, что данный эндофенотип рассматривается не в рамках конкретной узкой нозологической единицы, а впервые в контексте континуума тревожных расстройств по мере усложнения их клинической картины в ряду ГТР, ТФР, ТИР. Такое расширение изучаемых состояний позволило выявить взаимосвязь между фоновой активностью ДПП-4 и выраженностью астенических расстройств, которая утрачивалась в процессе терапии, тогда как в предшествующих исследованиях не удавалось выявить корреляций между активностью данного фермента с особенностями состояния больных [22].
Более того, терапевтическая динамика активности как ДПП-4, так и ПЭП у больных с тревожными расстройствами при терапии Афобазолом оказалась разнонаправленной: имелись больные с увеличением и снижением активности фермента в ходе терапии, хотя в отношении ДПП-4 данная закономерность проявилась более очерченно, о чем свидетельствует характер распределения изменений. При этом группы с их разнонаправленной динамикой достоверно различались по фоновой активности ДПП-4 и ПЭП. Разная направленность терапевтических изменений активности ферментов взаимосвяна с психопатологической структурой состояния пациентов: у больных с большей выраженностью невротических расстройств (т.е. при состояниях, не являющихся оптимальной терапевтической мишенью действия Афобазола) отмечалось снижение активности ДПП-4.
Таким образом, полученные данные позволяют с большой вероятностью предполагать значимость активности изучаемых ферментов в генезе и формировании клинической картины тревожных нарушений. Разнонаправленность терапевтической динамики ферментативной активности под влиянием Афобазола, а также выявленные взаимосвязи с показателями эффективности терапии предполагают теоретическую возможность прогнозировать достижение терапевтических результатов у больных с тревожными расстройствами на основании оценки активности в плазме крови больных ДПП-4 и ПЭП.
Сведения об авторах
Незнамов Григорий Георгиевич – д-р мед. наук, проф., зав. лаб. клинической психофармакологии ФГБУ НИИ фармакологии им. В.В.Закусова РАМН. E-mail: neznamovpharm@mail.ru
Золотов Николай Николаевич – гл. науч. сотр., д-р биол. наук, проф. лаб. психофармакологии ФГБУ НИИ фармакологии
им. В.В.Закусова РАМН. E-mail: zolotovnn@gmail.com
Сюняков Тимур Сергеевич – канд. мед. наук, ст. науч. сотр. лаб. фармакологической генетики ФГБУ НИИ фармакологии
им. В.В.Закусова РАМН. E-mail: sjunja@bk.ru
Сюняков Сергей Александрович – канд. мед. наук, вед. науч. сотр. лаб. клинической психофармакологии ФГБУ НИИ фармакологии им. В.В.Закусова РАМН. E-mail: Siuniakov@mail.ru
Метлина Марианна Вячеславовна – врач ГБУЗ ПКБ №12 Департамента здравоохранения г. Москвы. E-mail: mariannamet@mail.ru
Назарова Галина Александровна – науч. сотр. лаб. психофармакологии ФГБУ НИИ фармакологии им. В.В.Закусова РАМН.
E-mail: g-a-nazarova@rambler.ru
Список исп. литературыСкрыть список1. Meyer-Lindenberg A, Tost H. Neural mechanisms of social risk for psychiatric disorders. Nat Neurosci 2012; 15 (5): 663–8.
2. Hofmann SG, Ellard KK, Siegle GJ. Neurobiological correlates of cognitions in fear and anxiety: a cognitive-neurobiological information-processing model. Cogn Emot 2012; 26 (2): 282–99.
3. Le-Niculescu H, Balaraman Y, Patel SD et al. Convergent functional genomics of anxiety disorders: translational identification of genes, biomarkers, pathways and mechanisms. Transl Psychiat 2011; 1: e9.
4. Gottesman II, Gould TD. The endophenotype concept in psychiatry: etymology and strategic intentions. Am J Psychiat 2003; 160 (4): 636–45.
5. Flint J, Munafo MR. The endophenotype concept in psychiatric genetics. Psychol Med 2007; 37 (2): 163–80.
6. Кост Н.В., Мешавкин В.К., Зозуля А.А. Нейропептиды в регуляции тревоги. Психиатрия. 2010; 46 (4): 64–75.
7. Madaan V, Wilson DR. Neuropeptides: relevance in treatment of depression and anxiety disorders. Drug News Perspect 2009; 22 (6): 319–24.
8. Hokfelt T, Bartfai T, Bloom F. Neuropeptides: opportunities for drug discovery. Lancet Neurol 2003; 2 (8): 463–72.
9. Fricker LD. Neuropeptide-processing enzymes: applications for drug discovery. AAPS J 2005; 7 (2): e449–55.
10. Kanai K, Feher M, Lopata A et al. Molecular modeling studies of prolyl endopeptidase inhibitors. Acta Pharm Hung 1999; 69 (5): 240–6.
11. Mentlein R. Dipeptidyl-peptidase IV (CD26) – role in the inactivation of regulatory peptides. Regul Pept 1999; 85 (1): 9–24.
12. Tarantola E, Bertone V, Milanesi G et al. Dipeptidylpeptidase-IV, a key enzyme for the degradation of incretins and neuropeptides: activity and expression in the liver of lean and obese rats. Eur J Histochem 2012; 56 (4): e41.
13. Nolte WM, Tagore DM, Lane WS et al. Peptidomics of prolyl endopeptidase in the central nervous system. Biochemistry 2009; 48 (50): 11 971–81.
14. Крупина Н.А., Кушнарева Е.Ю., Хлебникова Н.Н. и др. Экспериментальная модель тревожно-депрессивного состояния у крыс, вызванная введением ингибитора дипептидилпептидазы IV метионил-2(S)-цианопирролидина в раннем постнатальном периоде. Журн. высшей нерв. деятельности. 2009; 59 (3): 358–67.
15. Хлебникова Н.Н., Крупина Н.А., Богданова Н.Г. и др. Влияние ингибитора пролилэндопептидазы бензилоксикарбонил-метионил-2(S)-цианопирролидина на развитие экспериментального депрессивного синдрома у крыс. Бюл. эксперим. биол. и мед. 2009; 147 (1): 27–31.
16. El Yacoubi M, Vaugeois JM, Marguet D и др. Behavioral characterization of CD26 deficient mice in animal tests of anxiety and antidepressant-like activity. Behav Brain Res 2006; 171 (2): 279–85.
17. Emanuele E, Minoretti P, Martinelli V et al. Circulating levels of soluble CD26 are associated with phobic anxiety in women. Prog Neuropsychopharmacol Biol Psychiat 2006; 30 (7): 1334–6.
18. Maes M, Bonaccorso S. Lower activities of serum peptidases predict higher depressive and anxiety levels following interferon-alpha-based immunotherapy in patients with hepatitis C. Acta Psychiat Scand 2004; 109 (2): 126–31.
19. Maes M, Bonaccorso S, Marino V et al. Treatment with interferon-alpha (IFN alpha) of hepatitis C patients induces lower serum dipeptidyl peptidase IV activity, which is related to IFN alpha-induced depressive and anxiety symptoms and immune activation. Mol Psychiat 2001; 6 (4): 475–80.
20. Maes M, Goossens F, Lin A et al. Effects of psychological stress on serum prolyl endopeptidase and dipeptidyl peptidase IV activity in humans: higher serum prolyl endopeptidase activity is related to stress-induced anxiety. Psychoneuroendocrinol 1998; 23 (5): 485–95.
21. Maes M, Libbrecht I, Lin A et al. Effects of pregnancy and delivery on serum prolyl endopeptidase (PEP) activity: alterations in serum PEP are related to increased anxiety in the early puerperium and to postpartum depression. J Affect Dis 2000; 57 (1–3): 125–37.
22. Yolac Yarpuz A, Yilmaz A, Soykan A et al. Levels of adenosine deaminase and dipeptidyl peptidase IV in patients with panic disorder. Turk Psikiyatri Derg 2008; 19 (2): 149–56.
23. Krupina NA, Zolotov NN, Bogdanova NG et al. Activities of prolyl endopeptidase and dipeptidyl peptidase IV in brain structures of rats with dopamine deficiency-dependent MPTP-induced depressive syndrome. Bull Exp Biol Med 2006; 142 (5): 554–6.
24. Zozulya AA, Kost NV, Sokolov OY et al. The inhibitory effect of Selank on enkephalin-degrading enzymes as a possible mechanism of its anxiolytic activity. Bull Exp Biol Med 2001; 131 (4): 315–7.
25. Кушнарева Е.Ю., Крупина Н.А., Хлебникова Н.Н. и др. Активность пролинспецифических пептидаз в структурах мозга крыс с экспериментальным тревожно-депрессивным состоянием, вызванным введением ингибитора дипептидилпептидазы IV в раннем постнатальном периоде. Бюл. эксперим. биол. и мед. 2011; 151 (6): 619–23.
26. Золотов Н.Н., Сюняков Т.С., Дорофеева О.А. и др. Активность пролинспецифических ферментов у больных с тревожными расстройствами и ее изменения при терапии феназепамом. Психиатр. и психофармакотер. 2012; 14 (6): 4–7.
27. Hamilton M. The assessment of anxiety states by rating. Br J Med Psychol 1959; 32 (1): 50–5.
28. Незнамов Г.Г., Сюняков С.А., Бочкарев В.К. и др. Клинические данные о терапевтическом действии и эффективности феназепама. Феназепам: 25 лет в медицинской практике. М.: Наука, 2007; с. 203–77.
29. Александровский Ю.А., Руденко Г.М., Незнамов Г.Г. и др. Унифицированная система оценки клинико-фармакологического действия психотропных препаратов у больных с пограничными нервно-психическими расстройствами. Метод. рекомендации. М., 1984.
30. Guy W. National Institute of Mental Health: CGI Clinical Global Impression. ECDEU Assesment – Manual for Psychopharmacology Rev. Rockville, Maryland 1976; с. 217–22.
31. Золотов Н.Н., Наркевич В.Б., Назарова Г.А. и др. Нейролептическая каталепсия у крыс сопровождается активацией пролилэндопептидазы мозга и устраняется ингибиторами этого фермента. Доклады АН, 1994; 339: 691–3.
32. Чумаков Д.В. Клинико-фармакологическая характеристика нового анксиолитика Афобазола. Автореф. дис. ... канд. мед. наук. М., 2004.
33. Незнамов Г.Г., Сюняков С.А., Чумаков Д.В., Маметова Л.Э. Новый селективный анксиолитик Афобазол. Журн. неврол. и психиатр. им. С.С.Корсакова, 2005; 105 (4): 48–54.
34. Незнамов Г.Г., Сюняков С.А., Чумаков Д.В. и др. Результаты клинического изучения селективного анксиолитика Афобазола. Эксперим. и клин. фармакология, 2001; 64 (2): 15–9.


