Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№02 2014
Методология проведения фармакоэкономического анализа в психиатрии №02 2014
Номера страниц в выпуске:54-58
При проведении фармакоэкономического анализа исследователями могут быть использованы различные фармакоэкономические методы в зависимости от цели и задач исследования, а также доступности материала в рамках информационного поиска. В настоящей статье рассмотрены общие моменты методологии проведения фармакоэкономического анализа, а также представлены особенности данного анализа при оценке психических расстройств.
Резюме. При проведении фармакоэкономического анализа исследователями могут быть использованы различные фармакоэкономические методы в зависимости от цели и задач исследования, а также доступности материала в рамках информационного поиска. При этом существующий на сегодняшний день выбор используемых методов фармакоэкономического анализа не означает единообразный подход для оценки разных заболеваний. Специфика каждой отдельной группы болезней имеет отражение и в рамках проведения фармакоэкономической оценки. В настоящей статье рассмотрены общие моменты методологии проведения фармакоэкономического анализа, а также представлены особенности данного анализа при оценке психических расстройств.
Ключевые слова: фармакоэкономический анализ, психиатрия, методология, анализ эффективности, анализ затрат, здравоохранение.
Мethodology for pharmacoeconomic analysis in psychiatry
R.I.Yagudina, A.Yu.Kulikov, I.A.Komarov
Laboratory of pharmacoeconomic researches, I.M.Sechenov First Moscow State Medical University
Summary. During pharmacoeconomic researches there are various methods of pharmacoeconomic analysis. These ones depend on aim and purposes of research and also data availability in the process of information search. However different pharmacoeconomic approaches nowadays have its own features in terms of estimation of various disease. This article covers such key methodology issues in relation to psychiatry disorders evaluation.
Key words: pharmacoeconomic analysis, psychiatry, methodology, effectiveness analysis, cost analysis, health care.
Введение
Системы здравоохранения во всем мире, в том числе и в Российской Федерации, за последние три десятилетия претерпели значительные изменения. Научно-техническая революция, осуществленная во второй половине XX в., открыла и внедрила в практику множество новых медицинских технологий, благодаря которым стала возможна эффективная терапия заболеваний, в том числе в области психиатрии, до того момента характеризовавшихся негативным прогнозом для пациентов.
Вместе с этим внедряемые инновационные медицинские технологии (например, появление нового класса атипичных антипсихотических лекарственных средств – ЛС) существенно удорожали стоимость лечения заболеваний; тенденция к росту цен новых медицинских технологий со временем проявляется лишь ярче. Стремительное увеличение расходов систем здравоохранения стало обгонять по темпам роста возможности их бюджетов, тем самым сделав реальной угрозу дефицита средств в системах здравоохранения и отсутствия фактического доступа к новым эффективным медицинским технологиям.
С другой стороны, с позиции декларируемой политики систем здравоохранения наблюдается постоянный рост социальных ожиданий от эффективности систем здравоохранения: пациентские и врачебные сообщества требуют обеспечить реальную доступность существующих инновационных эффективных медицинских технологий.
В этой связи перед системами здравоохранения была поставлена задача обеспечить социальные ожидания населения в новых высокоэффективных и чаще всего дорогостоящих технологиях при лимитированных возможностях своих бюджетов. Решение указанной задачи ввиду ограниченности бюджетов систем здравоохранения требовало оптимизации использования доступных ресурсов и их перераспределения внутри систем здравоохранения или, другими словами, улучшения процесса управления системами здравоохранения, особенно на этапах принятия решений о внедрении различных медицинских технологий.
В свою очередь процесс совершенствования управления систем здравоохранения привел к изменению основных парадигм самого управления в области принятия решений об использовании медицинских технологий (распределения бюджета систем здравоохранения). Произошел перевод оценки стоимости лечения со стоимости самой медицинской технологии к стоимости получаемого результата, следствием чего явилась необходимость полного учета затрат при лечении или нелечении заболеваний рассматриваемыми медицинскими технологиями. Последнее потребовало точных математических расчетов и конкретных цифр, что означало переход от умозрительных заключений к точным расчетам, характеризуемым высокой степенью доказательности.
Обозначенная смена парадигмы мышления при принятии решений в системах здравоохранения потребовала разработки специальных методов анализа, которые могли бы предоставить лицам, принимающим решения, необходимую информацию о медицинских технологиях. В рамках указанного контекста возникло междисциплинарное научное направление – фармакоэкономика, которое разрабатывало и анализировало методы идентификации получения данных, необходимых лицам, принимающим решения, при рассмотрении вопросов о внедрении медицинских технологий в систему здравоохранения. В данном разделе будет приведен обзор основных понятий и методов фармакоэкономического анализа применительно к отечественной системе здравоохранения.
Фармакоэкономика – новая самостоятельная наука, которая изучает в сравнительном плане соотношение между затратами и эффективностью, безопасностью, качеством жизни при альтернативных схемах лечения (профилактики) заболевания. К настоящему времени специалисты фармакоэкономики разработали значительный пул методов фармакоэкономического анализа, наиболее широкое распространение из которых получили следующие [1]:
Выбор критериев эффективности
Выбор критериев эффективности является первым этапом проводимого фармакоэкономического исследования и ставит перед собой задачу поиска показателя эффективности, удовлетворяющего целям исследования, а также получения данных, характеризующих анализируемые технологии с позиций выбранного показателя эффективности.
В зависимости от дизайна фармакоэкономического исследования задача получения данных по эффективности изучаемых технологий здравоохранения для лечения психических заболеваний может решаться двумя методами: организацией и проведением клинических исследований анализируемой медицинской технологии или же анализом уже существующих клинических исследований. Проспективный дизайн исследования включает в себя проведение нового клинического исследования. В случае ретроспективного дизайна фармакоэкономического исследования данные о показателях эффективности анализируемых технологий получают методом информационного поиска. Информационный поиск осуществляется прежде всего в специализированных библиотеках и базах данных. Наиболее информационно обеспеченными и часто используемыми базами данных по клиническим исследованиям, в том числе анализирующих методы терапии психических заболеваний, являются зарубежные электронные базы данных – Pubmed, Medlink и Cochrane; особенно предпочтительным является их использование при проведении анализа эффективности зарубежных технологий. Отечественные информационные ресурсы по клиническим исследованиям целесообразно задействовать в том случае, когда исследуются оригинальные или воспроизведенные в РФ медицинские технологии [1, 2].
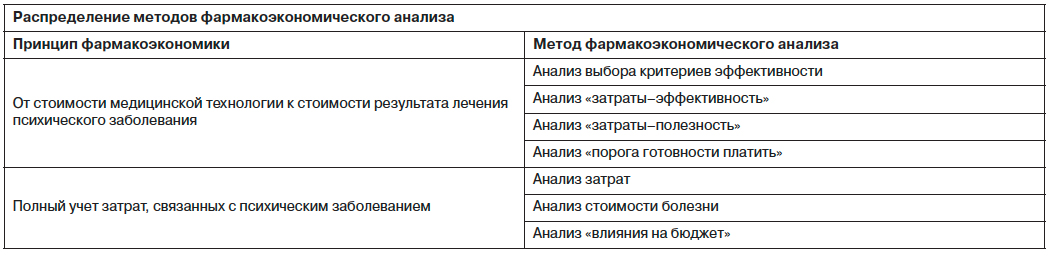
Проблема выбора критерия эффективности при проведении фармакоэкономического исследования всегда является очень трудной по той причине, что критерии эффективности, используемые и достаточные в клинической практике лечения психических заболеваний, зачастую оказываются невалидными для целей фармакоэкономического анализа. Необходимо принимать во внимание тот факт, что результаты фармакоэкономического исследования используются при решении вопроса о целесообразности внедрения медицинской технологии в систему здравоохранения, и помнить первый принцип фармакоэкономики о стоимости получаемого результата. В этом случае становится очевидным, что у лиц, принимающих решение в области здравоохранения, могут возникнуть трудности в интерпретации адекватности стоимости достижения пациентом определенных сугубо клинических параметров (рис. 1).
 В этой связи становится очевидной значимость этапа выбора специальных критериев эффективности для проведения фармакоэкономического исследования, в том числе в области психиатрии.
В этой связи становится очевидной значимость этапа выбора специальных критериев эффективности для проведения фармакоэкономического исследования, в том числе в области психиатрии.
Адекватный выбор конечных точек подразумевает получение с их помощью объективной оценки эффективности медицинского вмешательства. Так, например, отдаленные результаты могут не подтвердить заключения об эффективности лечения, сделанного на основании анализа прямых клинических эффектов исследуемого вмешательства. Таким образом, при выборе точек клинической эффективности необходимо учитывать следующие факторы: специфику медицинского вмешательства; особенности и характер течения психического заболевания и т.д. В качестве критериев эффективности медицинского вмешательства, направленного на лечение психического заболевания, при проведении комплексного клинико-экономического анализа могут использоваться:
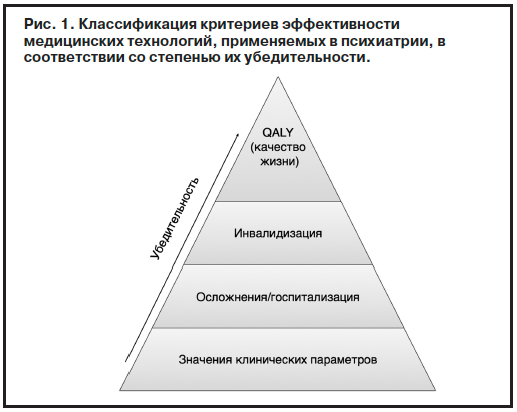
Фармакоэкономические исследования предполагают соотнесение полученного результата лечения, профилактики, диагностики с затраченными ресурсами в условиях системы здравоохранения, в которой они оцениваются. В связи с этим полнота и правильность учтенных затрат оказывают непосредственное влияние на результат фармакоэкономического исследования, иногда меняя его на противоположный. Именно поэтому анализ затрат является важнейшим моментом фармакоэкономического исследования, в том числе в области психиатрии. Существуют различные классификации «затрат» (рис. 2).
 К прямым медицинским затратам относятся: затраты на ЛС (в том числе связанные с лекарственным обеспечением в стационаре и льготным отпуском лекарств); лабораторные и диагностические исследования (например, общий анализ крови); визиты к врачу; иные лечебные процедуры и т.п.
К прямым медицинским затратам относятся: затраты на ЛС (в том числе связанные с лекарственным обеспечением в стационаре и льготным отпуском лекарств); лабораторные и диагностические исследования (например, общий анализ крови); визиты к врачу; иные лечебные процедуры и т.п.
Прямые немедицинские затраты включают в себя затраты на питание пациента, его пребывание на больничной койке (т.е. стоимость койко-дня), а также услуги социальных служб и работу немедицинского персонала. Оценка этого вида затрат часто не проводится из-за малой информативности применительно к конкретному исследованию или же вследствие отсутствия данных о частоте и длительности госпитализаций пациентов, включенных в исследование, так же как и данных о частоте развития нежелательных реакций и мерах, принимаемых для их коррекции.
При проведении анализа затрат необходимо использовать сопоставимые источники информации и параметры цен для сравнения ЛС. Так, при выполнении фармакоэкономического исследования необходимо соблюдать требование использования единого уровня цены для сравниваемых медицинских технологий: или оптового, или розничного. При этом рекомендуется брать цены из единого источника (регистр предельных отпускных цен на жизненно необходимые и важнейшие лекарственные препараты, маркетинговые ресурсы) в том случае, если это представляется возможным.
При этом для расчетов используется следующий основной формульный аппарат. Цена за мг действующего вещества ЛС определяется по следующей формуле: PriceG= Sni=1C(Q×N)/n,
где Price (G) – средняя цена мг действующего вещества ЛС, руб.; C – цена за упаковку ЛС, руб.; Q – количество действующего вещества в лекарственной форме (ЛФ) ЛС, мг;
N – количество ЛФ в упаковке ЛС, штук; n – количество форм выпуска ЛС.
Затраты на фармакотерапию при коррекции побочных эффектов ЛС:
Cost (E)=S[price(M)¥P(E)¥D(M)¥E(M)],
где Cost (E) – затраты на фармакотерапию побочных эффектов ЛС, руб.; Price (M) – стоимость единицы действующего вещества ЛС, руб.; P (E) – частота побочного эффекта; D (M) – суточная дозировка ЛС, мг/мл/Ед; E (M) – продолжительность курса приема ЛС, дней.
Затраты на медицинские процедуры определяются по формуле:
Cost (S)=SPrice(S)¥P(S)¥n(S),
где Cost (S) – затраты на медицинские процедуры, руб.; Price (M) – стоимость медицинской процедуры ЛС, руб.; P (M) – частота назначения медицинской процедуры; n (S) – количество единиц предоставляемой медицинской процедуры.
К непрямым затратам относятся расходы, связанные со снижением или утратой трудоспособности пациентом и/или лицами, осуществляющими уход за ним, потеря ВВП и пр.
В общем виде значение потери ВВП можно рассчитать с помощью формулы:
С(непр. затр. ВВП)=N(дн.)¥П(ВВП),
где С(непр. затр. ВВП) – величина непрямых затрат вследствие потери ВВП; N(дн.) – количество дней болезни; П(ВВП) – величина значения ВВП на одного человека в день.
Еще одним примером оценки непрямых затрат в фармакоэкономических исследованиях является анализ «стоимости» дня временной нетрудоспособности, которая может быть рассчитана по формуле:
С(BH)=[ЗП(БЛ+ЕСН+ПН)]/22+ВРП/350,
где С(ВН) – «стоимость» дня временной нетрудоспособности; ЗП – средняя заработная плата; БЛ – больничный лист, %; ЕСН – единый социальный налог, %; ПН – подоходный налог, %; ВРП – валовой региональный продукт на душу населения в год.
Часто анализ непрямых затрат не проводится из-за того, что протокол исследования не предполагает сбор информации о социальном статусе пациентов и не представляется возможным оценить производственные потери и т.п.
К неосязаемым (неизмеримым, нематериальным) затратам относятся субъективно оцениваемые пациентом различные стороны лечения, влияющие на его самочувствие и качество жизни. К ним относятся: боль, страдания, снижение социальной активности пациента (невозможность водить автомобиль), а также его родных и близких людей. Другими словами, здесь учитываются физические, психические, когнитивные и сексуальные способности пациента, а также эмоциональные и социальные стороны его самочувствия. Как отмечают некоторые авторы, в определенных случаях расходы на нематериальные затраты в связи с развитием дополнительных страданий, связанных с осложнениями лечения, могут достигать 30% от общей величины затрат [1, 4].
Cудя по опубликованным данным [15–26], было бы крайне целесообразно провести более углубленную фармако-экономическую оценку применения Афобазола при лечении тревожных расстройств [19–20].
Так, непрямые расходы, в том числе при лечении тревожных расстройств, включают:
При этом терапия генерализованного тревожного расстройства (ГТР) – длительная, как правило, более 1 мес [19–20]. Ранее стандартом терапии являлись бензодиазепины (БД), которые обеспечивают быстрый и выраженный терапевтический эффект. Однако Всемирная организация здравоохранения не рекомендует более длительное назначение БД (более 2–4 нед), так как оно связано с высоким риском следующих нежелательных явлений:
При этом Афобазол можно отменить сразу по завершении 3 мес, а антидепрессанты – постепенно отменять не менее 1 мес. Возможность совместного назначения Афобазола и антидепрессантов может привести к более быстрому наступлению эффекта [20–21], купированию усиливающихся в первые недели терапии симптомов тревоги, а также сократить период отмены антидепрессантов. Возможность назначения Афобазола вместе с БД (перевод с БД на Афобазол) – для более быстрого прекращения приема БД и, следовательно, снижения числа побочных эффектов и снижения риска синдрома отмены.
Дополнительное назначение Афобазола пациентам с соматической патологией позволяет не только купировать проявления тревожных расстройств, но и улучшить результаты лечения соматического заболевания и, следовательно, снизить расходы на его терапию (более быстрое достижение целевого артериального давления при гипертонической болезни, улучшение качества жизни при гипертонической болезни, снижение частоты приступов фибрилляции предсердий и их продолжительности, более быстрая динамика кожных симптомов при дерматологических заболеваниях, в том числе розацеа и вульгарном псориазе, уменьшение фасциальных тиков, выраженности неврологических симптомов у пациентов с хронической ишемией головного мозга, болевого синдрома при вертеброгенной люмбалгии и синдроме раздраженного кишечника [15–19, 23–26].
Обсуждение
Таким образом, при проведении фармакоэкономического анализа исследователями могут быть использованы различные фармакоэкономические методы в зависимости от цели и задач исследования, а также доступности материала в рамках информационного поиска. При этом существующий на сегодняшний день выбор используемых методов фармакоэкономического анализа не означает единообразный подход для оценки различных заболеваний. Специфика каждой отдельной группы болезней имеет отражение и в рамках проведения фармакоэкономической оценки. На примере настоящей статьи общие моменты методологии проведения фармакоэкономического анализа представлены наряду с особенностями данного анализа при оценке психических расстройств.
Сведения об авторах
Ягудина Роза Исмаиловна – д-р фарм. наук, проф., зав. лаб. фармакоэкономических исследований ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: yagudina@inbox.ru
Куликов Андрей Юрьевич – канд. мед. наук, вед. науч. сотр. лаб. фармакоэкономических исследований ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: 7677041@mail.ru
Комаров Илья Александрович – аспир. лаб. фармакоэкономических исследований ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: 4esko@rambler.ru
Ключевые слова: фармакоэкономический анализ, психиатрия, методология, анализ эффективности, анализ затрат, здравоохранение.
Мethodology for pharmacoeconomic analysis in psychiatry
R.I.Yagudina, A.Yu.Kulikov, I.A.Komarov
Laboratory of pharmacoeconomic researches, I.M.Sechenov First Moscow State Medical University
Summary. During pharmacoeconomic researches there are various methods of pharmacoeconomic analysis. These ones depend on aim and purposes of research and also data availability in the process of information search. However different pharmacoeconomic approaches nowadays have its own features in terms of estimation of various disease. This article covers such key methodology issues in relation to psychiatry disorders evaluation.
Key words: pharmacoeconomic analysis, psychiatry, methodology, effectiveness analysis, cost analysis, health care.
Введение
Системы здравоохранения во всем мире, в том числе и в Российской Федерации, за последние три десятилетия претерпели значительные изменения. Научно-техническая революция, осуществленная во второй половине XX в., открыла и внедрила в практику множество новых медицинских технологий, благодаря которым стала возможна эффективная терапия заболеваний, в том числе в области психиатрии, до того момента характеризовавшихся негативным прогнозом для пациентов.
Вместе с этим внедряемые инновационные медицинские технологии (например, появление нового класса атипичных антипсихотических лекарственных средств – ЛС) существенно удорожали стоимость лечения заболеваний; тенденция к росту цен новых медицинских технологий со временем проявляется лишь ярче. Стремительное увеличение расходов систем здравоохранения стало обгонять по темпам роста возможности их бюджетов, тем самым сделав реальной угрозу дефицита средств в системах здравоохранения и отсутствия фактического доступа к новым эффективным медицинским технологиям.
С другой стороны, с позиции декларируемой политики систем здравоохранения наблюдается постоянный рост социальных ожиданий от эффективности систем здравоохранения: пациентские и врачебные сообщества требуют обеспечить реальную доступность существующих инновационных эффективных медицинских технологий.
В этой связи перед системами здравоохранения была поставлена задача обеспечить социальные ожидания населения в новых высокоэффективных и чаще всего дорогостоящих технологиях при лимитированных возможностях своих бюджетов. Решение указанной задачи ввиду ограниченности бюджетов систем здравоохранения требовало оптимизации использования доступных ресурсов и их перераспределения внутри систем здравоохранения или, другими словами, улучшения процесса управления системами здравоохранения, особенно на этапах принятия решений о внедрении различных медицинских технологий.
В свою очередь процесс совершенствования управления систем здравоохранения привел к изменению основных парадигм самого управления в области принятия решений об использовании медицинских технологий (распределения бюджета систем здравоохранения). Произошел перевод оценки стоимости лечения со стоимости самой медицинской технологии к стоимости получаемого результата, следствием чего явилась необходимость полного учета затрат при лечении или нелечении заболеваний рассматриваемыми медицинскими технологиями. Последнее потребовало точных математических расчетов и конкретных цифр, что означало переход от умозрительных заключений к точным расчетам, характеризуемым высокой степенью доказательности.
Обозначенная смена парадигмы мышления при принятии решений в системах здравоохранения потребовала разработки специальных методов анализа, которые могли бы предоставить лицам, принимающим решения, необходимую информацию о медицинских технологиях. В рамках указанного контекста возникло междисциплинарное научное направление – фармакоэкономика, которое разрабатывало и анализировало методы идентификации получения данных, необходимых лицам, принимающим решения, при рассмотрении вопросов о внедрении медицинских технологий в систему здравоохранения. В данном разделе будет приведен обзор основных понятий и методов фармакоэкономического анализа применительно к отечественной системе здравоохранения.
Фармакоэкономика – новая самостоятельная наука, которая изучает в сравнительном плане соотношение между затратами и эффективностью, безопасностью, качеством жизни при альтернативных схемах лечения (профилактики) заболевания. К настоящему времени специалисты фармакоэкономики разработали значительный пул методов фармакоэкономического анализа, наиболее широкое распространение из которых получили следующие [1]:
- Анализ выбора критериев эффективности.
- Анализ затрат.
- Анализ стоимости болезни.
- Анализ «влияния на бюджет».
- Анализ «затраты–эффективность».
- Анализ «затраты–полезность».
- Анализ «порога готовности платить».
- Фармакоэкономическое моделирование.

Выбор критериев эффективности
Выбор критериев эффективности является первым этапом проводимого фармакоэкономического исследования и ставит перед собой задачу поиска показателя эффективности, удовлетворяющего целям исследования, а также получения данных, характеризующих анализируемые технологии с позиций выбранного показателя эффективности.
В зависимости от дизайна фармакоэкономического исследования задача получения данных по эффективности изучаемых технологий здравоохранения для лечения психических заболеваний может решаться двумя методами: организацией и проведением клинических исследований анализируемой медицинской технологии или же анализом уже существующих клинических исследований. Проспективный дизайн исследования включает в себя проведение нового клинического исследования. В случае ретроспективного дизайна фармакоэкономического исследования данные о показателях эффективности анализируемых технологий получают методом информационного поиска. Информационный поиск осуществляется прежде всего в специализированных библиотеках и базах данных. Наиболее информационно обеспеченными и часто используемыми базами данных по клиническим исследованиям, в том числе анализирующих методы терапии психических заболеваний, являются зарубежные электронные базы данных – Pubmed, Medlink и Cochrane; особенно предпочтительным является их использование при проведении анализа эффективности зарубежных технологий. Отечественные информационные ресурсы по клиническим исследованиям целесообразно задействовать в том случае, когда исследуются оригинальные или воспроизведенные в РФ медицинские технологии [1, 2].
Проблема выбора критерия эффективности при проведении фармакоэкономического исследования всегда является очень трудной по той причине, что критерии эффективности, используемые и достаточные в клинической практике лечения психических заболеваний, зачастую оказываются невалидными для целей фармакоэкономического анализа. Необходимо принимать во внимание тот факт, что результаты фармакоэкономического исследования используются при решении вопроса о целесообразности внедрения медицинской технологии в систему здравоохранения, и помнить первый принцип фармакоэкономики о стоимости получаемого результата. В этом случае становится очевидным, что у лиц, принимающих решение в области здравоохранения, могут возникнуть трудности в интерпретации адекватности стоимости достижения пациентом определенных сугубо клинических параметров (рис. 1).
 В этой связи становится очевидной значимость этапа выбора специальных критериев эффективности для проведения фармакоэкономического исследования, в том числе в области психиатрии.
В этой связи становится очевидной значимость этапа выбора специальных критериев эффективности для проведения фармакоэкономического исследования, в том числе в области психиатрии.
Адекватный выбор конечных точек подразумевает получение с их помощью объективной оценки эффективности медицинского вмешательства. Так, например, отдаленные результаты могут не подтвердить заключения об эффективности лечения, сделанного на основании анализа прямых клинических эффектов исследуемого вмешательства. Таким образом, при выборе точек клинической эффективности необходимо учитывать следующие факторы: специфику медицинского вмешательства; особенности и характер течения психического заболевания и т.д. В качестве критериев эффективности медицинского вмешательства, направленного на лечение психического заболевания, при проведении комплексного клинико-экономического анализа могут использоваться:
- Прямые клинические эффекты (сдвиг физиологических и биохимических параметров, на изменение которых направлено действие ЛС – измерение уровней серотонина, норадреналина и т.п.; уровень лития и пр.).
- Опосредованные клинические эффекты (снижение частоты осложнений, сокращение количества повторных госпитализаций и т.п.).
- Изменение показателей здоровья в группе, на которую направлено действие медицинского вмешательства [инвалидизация, число сохраненных лет без инвалидности (DALY – disability adjusted life years) и т.п.].
- Изменение качества жизни, обусловленного здоровьем (QALY – quality adjusted life years).
Фармакоэкономические исследования предполагают соотнесение полученного результата лечения, профилактики, диагностики с затраченными ресурсами в условиях системы здравоохранения, в которой они оцениваются. В связи с этим полнота и правильность учтенных затрат оказывают непосредственное влияние на результат фармакоэкономического исследования, иногда меняя его на противоположный. Именно поэтому анализ затрат является важнейшим моментом фармакоэкономического исследования, в том числе в области психиатрии. Существуют различные классификации «затрат» (рис. 2).
 К прямым медицинским затратам относятся: затраты на ЛС (в том числе связанные с лекарственным обеспечением в стационаре и льготным отпуском лекарств); лабораторные и диагностические исследования (например, общий анализ крови); визиты к врачу; иные лечебные процедуры и т.п.
К прямым медицинским затратам относятся: затраты на ЛС (в том числе связанные с лекарственным обеспечением в стационаре и льготным отпуском лекарств); лабораторные и диагностические исследования (например, общий анализ крови); визиты к врачу; иные лечебные процедуры и т.п.
Прямые немедицинские затраты включают в себя затраты на питание пациента, его пребывание на больничной койке (т.е. стоимость койко-дня), а также услуги социальных служб и работу немедицинского персонала. Оценка этого вида затрат часто не проводится из-за малой информативности применительно к конкретному исследованию или же вследствие отсутствия данных о частоте и длительности госпитализаций пациентов, включенных в исследование, так же как и данных о частоте развития нежелательных реакций и мерах, принимаемых для их коррекции.
При проведении анализа затрат необходимо использовать сопоставимые источники информации и параметры цен для сравнения ЛС. Так, при выполнении фармакоэкономического исследования необходимо соблюдать требование использования единого уровня цены для сравниваемых медицинских технологий: или оптового, или розничного. При этом рекомендуется брать цены из единого источника (регистр предельных отпускных цен на жизненно необходимые и важнейшие лекарственные препараты, маркетинговые ресурсы) в том случае, если это представляется возможным.
При этом для расчетов используется следующий основной формульный аппарат. Цена за мг действующего вещества ЛС определяется по следующей формуле: PriceG= Sni=1C(Q×N)/n,
где Price (G) – средняя цена мг действующего вещества ЛС, руб.; C – цена за упаковку ЛС, руб.; Q – количество действующего вещества в лекарственной форме (ЛФ) ЛС, мг;
N – количество ЛФ в упаковке ЛС, штук; n – количество форм выпуска ЛС.
Затраты на сопутствующую фармакотерапию равны сумме стоимостей курсов соответствующих ЛС: Cost (PhT)=S[price(M)¥P(M)¥D(M)¥E(M)],
где Cost (PhT) – затраты на сопутствующую фармакотерапию, руб.; Price (M) – стоимость единицы действующего вещества ЛС, руб.; P (M) – частота назначения ЛС; D (M) – суточная дозировка ЛС, мг/мл/Ед; E (M) – продолжительность курса приема ЛС, дней.
Затраты на фармакотерапию при коррекции побочных эффектов ЛС:
Cost (E)=S[price(M)¥P(E)¥D(M)¥E(M)],
где Cost (E) – затраты на фармакотерапию побочных эффектов ЛС, руб.; Price (M) – стоимость единицы действующего вещества ЛС, руб.; P (E) – частота побочного эффекта; D (M) – суточная дозировка ЛС, мг/мл/Ед; E (M) – продолжительность курса приема ЛС, дней.
Затраты на медицинские процедуры определяются по формуле:
Cost (S)=SPrice(S)¥P(S)¥n(S),
где Cost (S) – затраты на медицинские процедуры, руб.; Price (M) – стоимость медицинской процедуры ЛС, руб.; P (M) – частота назначения медицинской процедуры; n (S) – количество единиц предоставляемой медицинской процедуры.
К непрямым затратам относятся расходы, связанные со снижением или утратой трудоспособности пациентом и/или лицами, осуществляющими уход за ним, потеря ВВП и пр.
В общем виде значение потери ВВП можно рассчитать с помощью формулы:
С(непр. затр. ВВП)=N(дн.)¥П(ВВП),
где С(непр. затр. ВВП) – величина непрямых затрат вследствие потери ВВП; N(дн.) – количество дней болезни; П(ВВП) – величина значения ВВП на одного человека в день.
Еще одним примером оценки непрямых затрат в фармакоэкономических исследованиях является анализ «стоимости» дня временной нетрудоспособности, которая может быть рассчитана по формуле:
С(BH)=[ЗП(БЛ+ЕСН+ПН)]/22+ВРП/350,
где С(ВН) – «стоимость» дня временной нетрудоспособности; ЗП – средняя заработная плата; БЛ – больничный лист, %; ЕСН – единый социальный налог, %; ПН – подоходный налог, %; ВРП – валовой региональный продукт на душу населения в год.
Часто анализ непрямых затрат не проводится из-за того, что протокол исследования не предполагает сбор информации о социальном статусе пациентов и не представляется возможным оценить производственные потери и т.п.
К неосязаемым (неизмеримым, нематериальным) затратам относятся субъективно оцениваемые пациентом различные стороны лечения, влияющие на его самочувствие и качество жизни. К ним относятся: боль, страдания, снижение социальной активности пациента (невозможность водить автомобиль), а также его родных и близких людей. Другими словами, здесь учитываются физические, психические, когнитивные и сексуальные способности пациента, а также эмоциональные и социальные стороны его самочувствия. Как отмечают некоторые авторы, в определенных случаях расходы на нематериальные затраты в связи с развитием дополнительных страданий, связанных с осложнениями лечения, могут достигать 30% от общей величины затрат [1, 4].
Cудя по опубликованным данным [15–26], было бы крайне целесообразно провести более углубленную фармако-экономическую оценку применения Афобазола при лечении тревожных расстройств [19–20].
Так, непрямые расходы, в том числе при лечении тревожных расстройств, включают:
- снижение качества жизни, трудоспособности и даже иногда необходимость в госпитализации при наличии тревожных расстройств;
- побочные эффекты проводимой терапии – снижают активность, трудоспособность (до временной нетрудоспособности) и требует назначения дополнительных ЛС для коррекции состояния;
- медленное развитие терапевтического эффекта – сохранение низкой трудоспособности и активности в период развития эффекта, кроме того, возможно ухудшение общего состояния пациента в связи с отсутствием видимого эффекта;
- невозможность проведения терапии достаточной продолжительности, как следствие – неэффективность терапии;
- при наличии сопутствующей соматической патологии: ухудшение прогноза, низкая комплаентность, несоблюдение рекомендаций врача по проведению диагностических процедур и лечению. Кроме того, при взаимодействии ЛС для лечения соматических заболеваний и противотревожных ЛС возможно снижение эффективности терапии, может требоваться коррекция терапии – увеличение доз препаратов или смена препаратов, или назначение дополнительной терапии.
При этом терапия генерализованного тревожного расстройства (ГТР) – длительная, как правило, более 1 мес [19–20]. Ранее стандартом терапии являлись бензодиазепины (БД), которые обеспечивают быстрый и выраженный терапевтический эффект. Однако Всемирная организация здравоохранения не рекомендует более длительное назначение БД (более 2–4 нед), так как оно связано с высоким риском следующих нежелательных явлений:
- выраженная седация и миорелаксация (нетрудоспособность) – непрямые расходы;
- «соматические» побочные эффекты – мышечная гипотония, слабость, атаксия, головокружение, головная боль, тошнота, боли в животе, запоры, дизартрия, увеличение массы тела, кожные высыпания, недержание мочи и кала, нарушение половой функции [20–22];
- нарушение когнитивных функций: снижение трудоспособности – непрямые расходы;
- развитие привыкания: необходимость повышения дозы препарата – прямые расходы;
- необходимость постепенной отмены препарата: увеличение стоимости курса терапии;
- риск синдрома отмены и зависимости, что требует повторного назначения препарата – прямые расходы;
- широкий спектр лекарственного взаимодействия.
- Риск побочных эффектов (седация, нарушение когнитивных функций), «соматические» побочные эффекты (тошнота, диарея, головная боль, нарушения сна, нарушения сексуальной функции, ортостатическая гипотония и др.) – в меньшей степени по сравнению с БД.
- Медленное развитие эффекта (4–6 нед).
- Необходимость титрования доз в связи с риском побочных эффектов.
- Возможность усиления симптомов тревожных расстройств в первые недели – необходимость дополнительного назначения БД или седативных препаратов.
- Необходимость постепенной отмены препаратов – увеличение продолжительности приема и стоимости курса терапии.
- Широкий спектр лекарственного взаимодействия.
При этом Афобазол можно отменить сразу по завершении 3 мес, а антидепрессанты – постепенно отменять не менее 1 мес. Возможность совместного назначения Афобазола и антидепрессантов может привести к более быстрому наступлению эффекта [20–21], купированию усиливающихся в первые недели терапии симптомов тревоги, а также сократить период отмены антидепрессантов. Возможность назначения Афобазола вместе с БД (перевод с БД на Афобазол) – для более быстрого прекращения приема БД и, следовательно, снижения числа побочных эффектов и снижения риска синдрома отмены.
Дополнительное назначение Афобазола пациентам с соматической патологией позволяет не только купировать проявления тревожных расстройств, но и улучшить результаты лечения соматического заболевания и, следовательно, снизить расходы на его терапию (более быстрое достижение целевого артериального давления при гипертонической болезни, улучшение качества жизни при гипертонической болезни, снижение частоты приступов фибрилляции предсердий и их продолжительности, более быстрая динамика кожных симптомов при дерматологических заболеваниях, в том числе розацеа и вульгарном псориазе, уменьшение фасциальных тиков, выраженности неврологических симптомов у пациентов с хронической ишемией головного мозга, болевого синдрома при вертеброгенной люмбалгии и синдроме раздраженного кишечника [15–19, 23–26].
Обсуждение
Таким образом, при проведении фармакоэкономического анализа исследователями могут быть использованы различные фармакоэкономические методы в зависимости от цели и задач исследования, а также доступности материала в рамках информационного поиска. При этом существующий на сегодняшний день выбор используемых методов фармакоэкономического анализа не означает единообразный подход для оценки различных заболеваний. Специфика каждой отдельной группы болезней имеет отражение и в рамках проведения фармакоэкономической оценки. На примере настоящей статьи общие моменты методологии проведения фармакоэкономического анализа представлены наряду с особенностями данного анализа при оценке психических расстройств.
Сведения об авторах
Ягудина Роза Исмаиловна – д-р фарм. наук, проф., зав. лаб. фармакоэкономических исследований ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: yagudina@inbox.ru
Куликов Андрей Юрьевич – канд. мед. наук, вед. науч. сотр. лаб. фармакоэкономических исследований ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: 7677041@mail.ru
Комаров Илья Александрович – аспир. лаб. фармакоэкономических исследований ГБОУ ВПО Первый МГМУ им. И.М.Сеченова. E-mail: 4esko@rambler.ru
Список исп. литературыСкрыть список1. Хабриев Р.У., Куликов А.Ю., Аринина Е.Е. Методологические основы фармакоэкономического анализа. М., 2011.
2. Ягудина Р.И., Новиков И.В., Серпик В.Г. Информационный поиск при проведении фармакоэкономических исследований. Фармакоэкономика. 2012; 3: 3–7.
3. Ягудина Р.И., Чибиляев В.А. Использование конечных и суррогатных точек в фармакоэкономических исследованиях. Фармакоэкономика. 2010; 2: 12–8.
4. Ягудина Р.И., Куликов А.Ю., Комаров И.А. Методология проведения анализа «затрат» при проведении фармакоэкономических исследований. Фармакоэкономика. 2011; 3: 3–6.
5. Ягудина Р.И., Зинчук И.Ю., Литвиненко М.М. Анализ «стоимости болезни»: виды, методология, особенности проведения в Российской Федерации. Фармакоэкономика. 2012; 1: 4–9.
6. Ягудина Р.И., Литвиненко М.М., Сороковиков И.В. Регистры пациентов: структура, функции, возможности использования. Фармакоэкономика. 2011; 4: 3–7.
7. Ягудина Р.И., Куликов А.Ю. Теоретические основы фармакоэкономического метода: анализ «влияния на бюджет». Фармакоэкономика. 2011; 2: 9–12.
8. Ягудина Р.И., Куликов А.Ю., Литвиненко М.М. QALY: история, методология и будущее метода. Фармакоэкономика. 2010; 1: 7–11.
9. Ягудина Р.И., Сороковиков И.В. Методология проведения анализа «затраты–полезность» при проведении фармакоэкономических исследований. Фармакоэкономика. 2012; 2: 4–12.
10. Ягудина Р.И., Куликов А.Ю., Нгуен Т. Определение «порога готовности платить» в России, в Европейских странах и в странах СНГ. Фармакоэкономика. 2011; 1: 7–12.
11. Куликов А.Ю., Нгуен Т.Т., Тихомирова А.В. Методология моделирования в фармакоэкономике. Фармакоэкономика. 2011; 4: 8–16.
12. Ягудина Р.И., Куликов А.Ю., Серпик В.Г. Дисконтирование при проведении фармакоэкономических исследований. Фармако-экономика. 2009; 4: 10–3.
13. Аннеманс Л. Экономика здравоохранения для неэкономистов. Введение в концепции, методы и трудности экономической оценки в здравоохранении. Пер. с англ. М.: Ньюдиамед, 2010.
14. Мосолов С.Н. Клиника и терапия маниакальных и смешанных состояний. В кн.: Биполярное аффективное расстройство. М.: Медпресс-информ, 2008; с. 62–127.
15. Калинина С.Ю. Влияние анксиолитика Афобазола на эффективность лечения гипертонической болезни у пожилых женщин. Обозрение психиатрии и мед. психологии им. В.М.Бехтерева. 2009; 4: 37–42.
16. Татарский Б.А., Бисерова И.Н. Использование Афобазола при лечении пароксизмальной формы фибрилляции предсердий. РМЖ. 2007; 15 (9): 760–6.
17. Татарский Б.А., Бисерова И.Н. Лечение пароксизмальной формы фибрилляции предсердий: использование анксиолитиков. Справ. поликлин. врача. 2007; 9.
18. Жидких Б.Д., Колесникова О.Е., Барбашина Т.А. и др. Влияние Афобазола на качество жизни кардиологических больных в процессе стационарного лечения. РМЖ. 2007; 15 (16): 1241–5.
19. Шоломов И.И. и др. Эффективность афобазола при тревожных расстройствах у пациентов с хронической цереброваскулярной недостаточностью. Журн. неврол. и психиатр. им. С.С. Корсакова. 2008; 108 (6): 75–7.
20. Дороженок И.Ю., Терентьева М.А. Афобазол при терапии тревожных расстройств у больных дерматологического стационара. РМЖ. 2007; 15 (19): 1379–82.
21. Дороженок И.Ю. Клинико-терапевтические аспекты психических расстройств, коморбидных хроническим дерматозам. Доктор.Ру. 2010; 4 (55).
22. Обгольц И.А. Новые подходы к терапии розацеа. Современные проблемы дерматовенерологии, иммунологии и врачебной косметологии. 2010; 4: 11–6.
23. Кунгуров Н.В. Комплексная терапия больных вульгарным псориазом с триггерным стрессовым фактором. Психич. расстройства в общей медицине. 2010; 2.
24. Маркин С.П. Тревожные расстройства при болях в спине. Справ. поликлин. врача. 2011; 6.
25. Тетерин Д. Применение Афобазола в лечении локальных гиперкинезов. Врач. 2011; 9.
26. Полуэктова Е.А., Ивашкин В.Т. и др. Обоснование применения психотропных препаратов у больных с синдромом раздраженного кишечника. РМЖ. 2007; 9: 1.
27. Alonso J, Angermeyer MC, Bernert S et al. Sampling and methods of the European Study of the Epidemiology of Mental Disorders (ESEMeD) project. Acta Psychiatrica Scandinavica 2004; 109 (Suppl. 420): 8–20.
28. Bowden CL, Grunze H, Mullen J. A randomized, double-blind, placebo-controlled efficacy and safety study of quetiapine or lithium as monotherapy for mania in bipolar disorder. J Clin Psychiat 2005; 66: 111–21.
29. Ekman M, Lindgren P, Miltenburger C. Cost effectiveness of quetiapine in patients with acute bipolar depression and in maintenance treatment after an acute depressive episode. Pharmacoeconomics 2012; 30 (6): 513–30.
30. Kessler RC, McGonagle KA, Zhao S et al. Lifetime and 12-month prevalence of DSM-IIIR psychiatric disorders in the United States: results from the National Comorbidity Survey. Arch Gen Psychiat 2005; 518–19.
31. Nicolson S, Nemeroff C. Ziprasidone in the treatment of mania in bipolar disorder. Neuropsychiatric Dis and Treatment 2007; 3 (6): 823–34.
32. Üstün ТВ, Sartorius N. Mental illness in general health care. John Wiley & Sons, Inc. NY 1995.
33. Zarate CA Jr, Brutsche N, Ibrahim L et al. Replication of ketamine’s antidepressant efficacy in bipolar depression: a randomized controlled add-on trial. Biol Psychiat 2012.
34. http://www.who.int/mental_health/mhgap/evidence/psychosis/en

