Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03 2014
Актуальные вопросы диагностики расстройства аутистического спектра и синдрома дефицита внимания и гиперактивности (по материалам 26-го Конгресса Европейской коллегии по нейропсихофармакологии) №03 2014
Номера страниц в выпуске:41-44
Настоящая публикация представляет собой обзор материалов 26-го Европейского конгресса по нейропсихофармакологии (Барселона, 5–9 октября 2013 г.), посвященных вопросам детской и подростковой психиатрии. Приведены новые данные относительно нейробиологии расстройств аутистического спектра и синдрома дефицита внимания и гиперактивности в сравнительно-возрастном аспекте, а также терапии этих состояний.
Резюме. Настоящая публикация представляет собой обзор материалов 26-го Европейского конгресса по нейропсихофармакологии (Барселона, 5–9 октября 2013 г.), посвященных вопросам детской и подростковой психиатрии. Приведены новые данные относительно нейробиологии расстройств аутистического спектра и синдрома дефицита внимания и гиперактивности в сравнительно-возрастном аспекте, а также терапии этих состояний.
Ключевые слова: аутизм, синдром дефицита внимания и гиперактивности у детей и взрослых, Европейский конгресс по нейропсихофармакологии 2013 г.
Advances in autistic spectrum disorder and attention deficit hyperactivity disorder (according to the proceedings of the 26st European College of Neuropsychopharmacology)
N.Hajiyeva1, A.V.Pavlichenko2, K.Kabosnidze3
1Azerbaijan Medical University, Baku;
2N.I.Pirogov Russian National Research Medical University, Moscow;
3Clinical Hospital №5, Tbilisi, Georgia
Summary. This publication provides an overview of materials 26st European College of Neuropsychopharmacology in Barcelona
(October 5–9, 2013) concerning some issues of child and adolescent psychiatry. It has been presented some new findings of neurobiology of Autistic spectrum Disorder and Attention Deficit Hyperactivity Disorder in children and adults as well as new treatment strategies.
Key words: autism, Attention Deficit Hyperactivity Disorder in children and adults, European College of Neuropsychopharmacology 2013.
Доклад Christine Ecker (Великобритания) был посвящен новым нейровизуализационным подходам в диагностике РАС. Новый метод, использующий пять морфологических параметров, включая объемные и геометрические характеристики головного мозга, а также так называемые опорные векторы, позволяет построить «нейровизуализационный паттерн» лиц с РАС (чувствительность и специфичность метода составляет 90 и 80% соответственно). Несмотря на то что в пределах РАС данные параметры могут варьировать, с помощью этого метода можно дифференцировать лиц с РАС от лиц с другой психической патологией – шизофренией, синдромом дефицита внимания и гиперактивности (СДВГ). Кроме того, результаты проведенного исследования подтверждают гипотезу о том, что нейроанатомические изменения при РАС носят многомерный характер и влияют на разные корковые функции. Эти открытия, сделанные с помощью пространственных нейровизуализационных методов и последних генетических достижений, позволяют по-новому взглянуть на многофакторную этиологию заболевания.
Сообщение Jeffrey Glennon (Нидерланды) было посвящено достижениям в области поиска разных биомаркеров РАС в сравнительно-возрастном аспекте. Известно, что первые симптомы РАС появляются в возрасте до 3 лет и составляют триаду основных симптомов: социальные нарушения, коммуникационные проблемы и стереотипное поведение. Клинические признаки РАС в дальнейшем могут измениться. В частности, было показано, что по мере взросления тяжесть симптомов и поведенческие нарушения, как правило, уменьшаются, что приводит к улучшению социального функционирования лиц с РАС в подростковом и взрослом возрасте. В исследованиях десятилетней давности было показано, что уже у детей 2–4 лет можно обнаружить снижение функциональной активности (по сравнению с контрольной группой) тех областей головного мозга, которые отвечают за социальные и когнитивные навыки, а также функцию внимания. В дальнейшем изменения находят и в других областях коры головного мозга (например, областях, отвечающих за моторные функции, социальную когницию), которые, по-видимому, лежат в основе клинических и поведенческих симптомов при РАС.
До настоящего времени было выполнено лишь несколько исследований, которые пытались выделить молекулярные и генетические маркеры РАС в зависимости от возраста больных.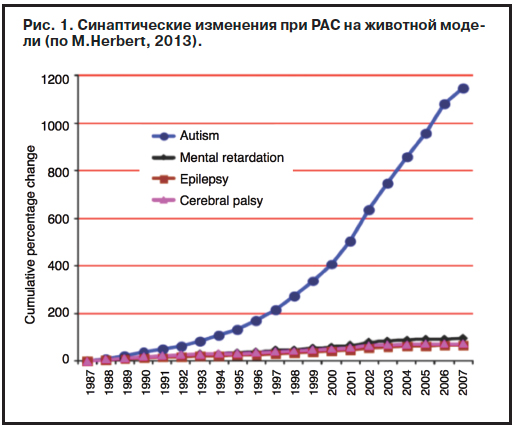 В частности, в одном исследовании изучались возрастные изменения экспрессии генов в префронтальной коре с помощью анализа уровня мРНК умерших лиц с РАС. На основе этих данных в будущем, по-видимому, можно будет идентифицировать конкретные признаки и симптомы, которые могут стать фармакологическими «мишенями» для действия лекарств. На моделях мышей с РАС были выделены некоторые синаптические изменения: уменьшение числа протеинов постсинаптических рецепторов; уменьшение постсинаптической плотности; снижение числа дендритных шипиков и разветвления дендритов; ослабление сигналов; увеличение размеров полосатого тела (рис. 1). Что же касается конкретных генов, вовлеченных в патогенез РАС, то лишь некоторые из них (Neurorexin-1, CNTNAP2, OXTR, AVPR1A) изучались в контексте связи с поведенческими, когнитивными и нейровизуализационными изменениями при РАС. Также было показано, что уровень мозгового нейротрофического фактора у детей 0–9 лет значительно ниже, чем у детей с РАС, которые были старше 10 лет, в то время как у здоровых детей возрастных различий уровня мозгового нейротрофического фактора найдено не было. В другом исследовании было обнаружено, что концентрация N-ацетиласпартата в лобной коре у детей с РАС заметно понижена, что может отражать увеличение обмена веществ в митохондриях и может быть связано со стереотипным поведением и снижением социальной активности.
В частности, в одном исследовании изучались возрастные изменения экспрессии генов в префронтальной коре с помощью анализа уровня мРНК умерших лиц с РАС. На основе этих данных в будущем, по-видимому, можно будет идентифицировать конкретные признаки и симптомы, которые могут стать фармакологическими «мишенями» для действия лекарств. На моделях мышей с РАС были выделены некоторые синаптические изменения: уменьшение числа протеинов постсинаптических рецепторов; уменьшение постсинаптической плотности; снижение числа дендритных шипиков и разветвления дендритов; ослабление сигналов; увеличение размеров полосатого тела (рис. 1). Что же касается конкретных генов, вовлеченных в патогенез РАС, то лишь некоторые из них (Neurorexin-1, CNTNAP2, OXTR, AVPR1A) изучались в контексте связи с поведенческими, когнитивными и нейровизуализационными изменениями при РАС. Также было показано, что уровень мозгового нейротрофического фактора у детей 0–9 лет значительно ниже, чем у детей с РАС, которые были старше 10 лет, в то время как у здоровых детей возрастных различий уровня мозгового нейротрофического фактора найдено не было. В другом исследовании было обнаружено, что концентрация N-ацетиласпартата в лобной коре у детей с РАС заметно понижена, что может отражать увеличение обмена веществ в митохондриях и может быть связано со стереотипным поведением и снижением социальной активности.
Главной целью исследования докладчика (J.Glennon) и соавт. из Института когнитивных наук и поведения в
г. Неймеген (Nijmegen, Нидерланды) было изучение изменения лабораторных показателей у детей с РАС разного возраста. Всего в исследование вошли 37 детей с РАС и 37 детей без РАС, сопоставимых по полу, возрасту, индексу массы тела и другим показателям и условно дифференцированных на три возрастные группы (4–9, 9–13 и 13–18 лет). С помощью разных лабораторных методик (преимущественно иммуноферментных) у детей с РАС были выявлены статистически достоверные изменения уровня девяти белков по сравнению с детьми контрольной группы: белок Тамма–Хорсфолла – мочевой гликопротеид (p=0,004), интерлейкин-3 (p=0,01), фактор Виллебранда (p=0,023), интерлейкин-12 – субъединица р40 (p=0,025), тирозинкиназа (p=0,033), фактор некроза опухоли b (p=0,034), интерлейкин-13 (p=0,038), хемотаксический для макрофагов белок (p=0,042), фактор стволовых клеток (p=0,05).
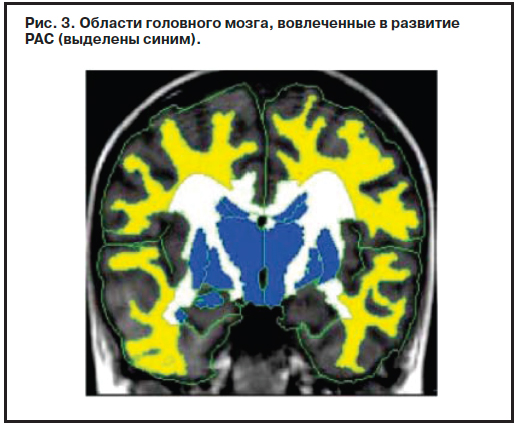
Доклад Martha Herbert (США) был посвящен ревизии концепции аутизма в последние годы («Аутизм: от статичного генетического дефекта до концепции динамического взаимодействия генов и факторов внешней среды»). В течение 10 лет (1997–2007 гг.) диагностика РАС в США увеличилась почти в 6 раз, что особенно заметно на фоне относительно стабильного числа других психических расстройств детского возраста (рис. 2).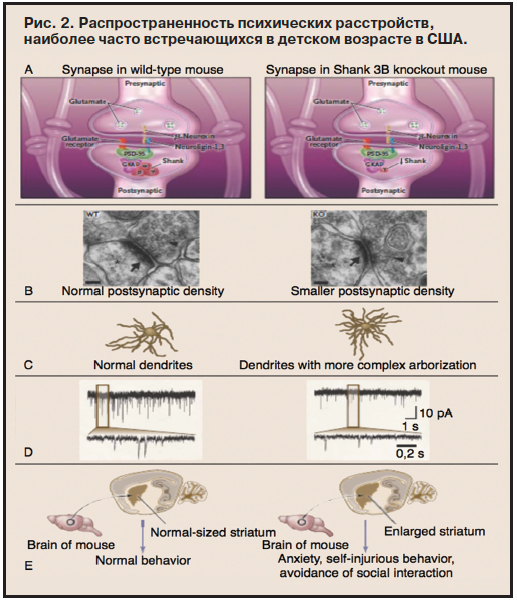 Последние достижения в области изучения РАС сильно отличаются от того, что предсказывали ученые еще 10–15 лет назад. В настоящее время исследователи начинают осознавать сложность изучаемой проблемы: в патогенез РАС вовлечено не несколько, а сотни генов, не только генетические причины, но и факторы окружающей среды, не только нейроны, но и глиальные клетки, не только патология головного мозга, но и более общие патофизиологические изменения (рис. 3). Аутизм может появиться у маленьких детей, чьи психосоциальные и сенсорные функции не обнаруживали какой-либо патологии, а многие признаки могут варьировать по тяжести как на протяжении короткого времени, так и в долговременной перспективе. Хотя ранее многие факторы рассматривались в качестве основных «причин» РАС, само понятие «причина» неоднозначно в контексте РАС и часто понимается по-разному. В качестве основного кандидата на роль «причины» поведенческого фенотипа РАС называлось нарушение электрофизиологической активности, которую в свою очередь часто связывают как с генетическими, так и физиологическими факторами. Кроме того, митохондриальная дисфункция, приводящая к изменению синаптических взаимодействий и нейрональных сетей, может быть связана с внешними и физиологическими изменениями, с одной стороны, и генетическими факторами, с другой. «Аутизм» может также возникнуть в связи с нарушениями электрофизиологической активности, связанной с метаболическими и иммунными дисфункциями и клеточной патологией.
Последние достижения в области изучения РАС сильно отличаются от того, что предсказывали ученые еще 10–15 лет назад. В настоящее время исследователи начинают осознавать сложность изучаемой проблемы: в патогенез РАС вовлечено не несколько, а сотни генов, не только генетические причины, но и факторы окружающей среды, не только нейроны, но и глиальные клетки, не только патология головного мозга, но и более общие патофизиологические изменения (рис. 3). Аутизм может появиться у маленьких детей, чьи психосоциальные и сенсорные функции не обнаруживали какой-либо патологии, а многие признаки могут варьировать по тяжести как на протяжении короткого времени, так и в долговременной перспективе. Хотя ранее многие факторы рассматривались в качестве основных «причин» РАС, само понятие «причина» неоднозначно в контексте РАС и часто понимается по-разному. В качестве основного кандидата на роль «причины» поведенческого фенотипа РАС называлось нарушение электрофизиологической активности, которую в свою очередь часто связывают как с генетическими, так и физиологическими факторами. Кроме того, митохондриальная дисфункция, приводящая к изменению синаптических взаимодействий и нейрональных сетей, может быть связана с внешними и физиологическими изменениями, с одной стороны, и генетическими факторами, с другой. «Аутизм» может также возникнуть в связи с нарушениями электрофизиологической активности, связанной с метаболическими и иммунными дисфункциями и клеточной патологией.
4) предсказать ответ на терапию; 4) определить биологически гомогенные группы больных; 5) выделить группы пациентов с высокой вероятностью возникновения тяжелых побочных реакций в ответ на прием поверхностно-активных веществ. В настоящее время такие широко известные маркеры РАС, как гиперсеротонинемия и макроцефалия, определяются лишь в 25–41 и 18% случаев. В то же время при разных состояниях в рамках РАС в настоящее время активно изучают несколько молекулярных мишеней: IGF-1 при синдроме Ретта, антагонисты mGluR5-рецепторов при синдроме ломкой X-хромосомы, ингибиторы mTOR при аутизме (D.Ehninger, 2011). Персонифицированная молекулярная терапия, без сомнения, представляет собой самую многообещающую долговременную цель генетических исследований и изучения биомаркеров при РАС.
В частности, было показано, что при СДВГ у детей в патологический процесс вовлечено несколько регионов мозга: в первую очередь подкорковые ядра и в меньшей степени префронтальная кора, височно-париетальные области и мозжечок. Метаанализ структурных изменений в мозге, полученных с помощью магнитно-резонансной томографии (МРТ), показывает, что изменения в подкорковых ядрах с возрастом нивелируются и у взрослых изменения в этой области уже не обнаруживают. В других исследованиях показано, что у взрослых с СДВГ сохраняются изменения в лобной коре. С другой стороны, функциональные МРТ-исследования говорят о том, что когнитивные проблемы, связанные с изменениями в коре, полосатом теле и мозжечке, удивительным образом схожи как у взрослых, так и у детей, а изменения корковых функций демонстрируют устойчивость во времени. Исключение, правда, составляет патология подкорковых ядер, которая отмечается в детстве и обусловливает, с одной стороны, трудности при выполнении задач на изучение функции внимания (его дефицит), а с другой стороны, свидетельствует о том, что СДВГ у взрослых представляет собой более легкую форму заболевания, по крайней мере на уровне мозговой патологии. В то же время стоит подчеркнуть, что СДВГ – это не просто изменения в какой-то конкретной области, но в первую очередь патология корково-стриато-мозжечковых сетей. В нескольких исследованиях была четко установлена патология лобной коры у взрослых с СДВГ. Последнее обстоятельство говорит о том, что изменения в нейрональных сетях на уровне подкорковых ядер, по-видимому, могут редуцироваться в случае стойких изменений в корковой области. В качестве гипотезы можно предположить, что у тех детей с СДВГ, которые в дальнейшем выздоравливают, в патологический процесс преимущественно вовлечены подкорковые ядра, в то время как при локализации патологии в области лобной коры болезнь может сохраниться. Известно, что подкорковые ядра иннервируются дофамином, уровень которого у детей с СДВГ обычно понижен, а лечение агонистами дофамина (стимуляторы) может повысить его уровень, особенно в области подкорковых ядер. Таким образом, тот факт, что стимуляторы улучшают дофаминовую проводимость в подкорковых ядрах, которые преимущественно поражены у детей с СДВГ, позволяет предположить, что данная группа препаратов более эффективна у детей, чем у взрослых с СДВГ. Кроме того, данные, полученные на основе позитронно-эмиссионной томографии, свидетельствуют о том, что головной мозг постепенно адаптируется к терапии стимуляторами и их эффективность в ходе длительного приема снижается. К сожалению, ученые еще не могут предсказать вероятность сохранения конкретных психопатологических признаков СДВГ во взрослой жизни, но дальнейшие исследования должны помочь определить эти риски. Несколько катамнестических исследований СДВГ свидетельствуют о том, что структура мозга и социальное функционирование тех лиц, которые находятся в состоянии ремиссии, больше напоминают здоровых людей, чем тех, у которых СДВГ сохраняется. Кроме того, было показано, что те пациенты, у которых длительное время персистируют определенные симптомы СДВГ (в частности, патология внимания), характеризуются большей плотностью коры. Дальнейшие проспективные катамнестические исследования СДВГ должны помочь идентифицировать те клинические признаки, которые ассоциируются с сохранением или ослаблением симптомов и когнитивным функционированием, с одной стороны, и со структурными и функциональными нарушениями при СДВГ у взрослых, с другой. Они также помогут понять роль коморбидных расстройств, в том числе злоупотребления поверхностно-активными веществами, в поддержании симптомов и глубине их проявления, а также прояснить роль лекарственных средств в отношении возможностей нормализации патологического процесса. Только тогда, когда мы сможем понять механизмы, лежащие в основе сохранения симптомов СДВГ в подростковом и зрелом возрасте, мы сможем построить лучшую стратегию лечения.
Ведущий немецкий специалист в области СДВГ Esther Sobansky (Германия) представила доклад «Новые перспективы лечения СДВГ у взрослых». Было отмечено, что, подобно другим расстройствам, длительное существование СДВГ ассоциируется с высокой вероятностью появления коморбидных заболеваний: риск возникновения любого другого психического расстройства (депрессии, тревоги, злоупотребления поверхностно-активными веществами) при СДВГ достигает 77,1%, что почти в 2 раза выше, чем в популяции в целом (40%). Кроме того, для взрослых с СДВГ характерно поведение, которое может быть потенциально опасно для жизни (быстрая езда на автомобиле, увлечение экстремальными видами спорта).
Фармакотерапия СДВГ у взрослых всеми доступными на рынке препаратами, включая стимулянты и другие лекарственные средства, оказалась эффективной (величина эффекта до 1) в отношении как основных, так и облигатных признаков расстройства, в частности эмоциональной дисрегуляции и проблем со сном. Кроме того, у тех пациентов, которые ранее получали лекарственные средства, в последующем были достаточно эффективны психотерапевтические интервенции. Также было показано, что фармакотерапия может улучшать психосоциальное функционирование лиц с СДВГ и уменьшать их склонность к риску. Однако с учетом высокой коморбидности СДВГ необходимы исследования, направленные на выработку оптимальной стратегии и оценки терапии в реальных условиях. Кроме того, в будущем необходимо включать в исследование те группы лиц с СДВГ, которые редко изучаются – в частности, пациентов, находящихся в тюрьмах, у которых распространенность СДВГ крайне высока, а лечение они, как правило, не получают.
Постерное сообщение David Coghill (Великобритания) было посвящено влиянию препарата lisdexamfetamine dimesylate (LDX) на исходы СДВГ у детей и подростков. Основной целью исследования явилась оценка влияния LDX (III фаза исследования) на качество жизни детей и взрослых с СДВГ. Исследование продолжалось
7 нед и полностью его завершили 317 пациентов с СДВГ в возрасте от 6 до 17 лет. В ходе двойного слепого плацебо-контролируемого исследования, в котором приняли участие ученые десяти европейских стран, было показано, что LDX хорошо переносится и является эффективным лекарственным средством в отношении редукции основных психопатологических симптомов расстройства. Кроме того, он улучшает ежедневное функционирование и качество жизни детей с СДВГ. Изучение нескольких опросников, в том числе заполняемых родителями пациентов, показало, что препарат оказался наиболее эффективен (статистически достоверно) в отношении следующих сфер жизни: обучение и школа; семья; общественная деятельность; склонность к риску.
DSM-5 в первую очередь коснулась сравнительно-возрастных аспектов заболеваний, что нашло отражение и в материалах конгресса. В проведенных клинических и экспериментальных исследованиях, в том числе с привлечением животных моделей, генетики и методов нейровизуализации, пытаются понять, какие признаки предрасполагают к появлению конкретных симптомов заболевания и сохранению расстройств во взрослом возрасте. Многофакторная природа РАС и СДВГ, с одной стороны, и сложность патогенетических механизмов, вовлеченных в их развитие, с другой, по-видимому, замедляют существенный прогресс в этой области и поиск новых подходов к терапии. В то же время появляется все больше и больше данных, свидетельствующих о том, что РАС и СДВГ являются не просто совокупностью определенных клинических симптомов и психологических характеристик, но представляют собой болезни в традиционном, крепелиновском смысле, имеющие определенное единство этиопатогенетических механизмов, клинических симптомов и исходов.
Сведения об авторах
Н.Р.Гаджиева – Азербайджанский медицинский университет, Баку. E-mail: nar_gad@mail.ru
А.В.Павличенко – ГБОУ ВПО РНИМУ им. Н.И.Пирогова Минздрава России. E-mail: apavlichenko76@gmail.ru
К.Е.Кабоснидзе – Клиническая больница №5, Грузия, Тбилиси. E-mail: kobakabosnidze@yahoo.com
Ключевые слова: аутизм, синдром дефицита внимания и гиперактивности у детей и взрослых, Европейский конгресс по нейропсихофармакологии 2013 г.
Advances in autistic spectrum disorder and attention deficit hyperactivity disorder (according to the proceedings of the 26st European College of Neuropsychopharmacology)
N.Hajiyeva1, A.V.Pavlichenko2, K.Kabosnidze3
1Azerbaijan Medical University, Baku;
2N.I.Pirogov Russian National Research Medical University, Moscow;
3Clinical Hospital №5, Tbilisi, Georgia
Summary. This publication provides an overview of materials 26st European College of Neuropsychopharmacology in Barcelona
(October 5–9, 2013) concerning some issues of child and adolescent psychiatry. It has been presented some new findings of neurobiology of Autistic spectrum Disorder and Attention Deficit Hyperactivity Disorder in children and adults as well as new treatment strategies.
Key words: autism, Attention Deficit Hyperactivity Disorder in children and adults, European College of Neuropsychopharmacology 2013.
Расстройства аутистического спектра у детей и подростков
Как известно, в DSM-5 (Diagnostic and Statistical Manual of Mental Disorders, fifth edition) были отменены отдельные аутистические расстройства (синдром Аспергера, синдром Ретта, детское расстройство дезинтеграции) и вместо них было выделено «расстройства аутистического спектра» (autistism spectrum disorder), которое рассматривается как группа состояний, связанных с патологией нервно-психического развития, многофакторной генетической этиологией и разными клиническими симптомами. В связи с этим задача описать общие нейрональные системы, вовлеченные в патогенез расстройств аутистического спектра (РАС), представляется чрезвычайно актуальной и сложной. Ряд доказательств, полученных в последнее время на основе изучения животных моделей и данных гистохимии, свидетельствует о том, что этиология РАС включает атипический синаптогенез и морфологические изменения в спинном мозге, дисбаланс процессов возбуждения и торможения и нарушения нейронных связей, причем как между отдельными областями головного мозга, так и мозгом в целом. В связи с этим на повестке дня стоит задача попытаться выделить специфичные нейровизуализационные маркеры болезни, которые вместе с генетическими и гистологическими признаками могут иметь определенную «трансляционную» ценность, т.е. могут помочь в диагностике этой распространенной психической патологии. Вопросам РАС на площадках ведущего психиатрического форума Европы было уделено немало места. Ниже приводятся основные положения докладов, отражающих последние достижения исследований в этой области.Доклад Christine Ecker (Великобритания) был посвящен новым нейровизуализационным подходам в диагностике РАС. Новый метод, использующий пять морфологических параметров, включая объемные и геометрические характеристики головного мозга, а также так называемые опорные векторы, позволяет построить «нейровизуализационный паттерн» лиц с РАС (чувствительность и специфичность метода составляет 90 и 80% соответственно). Несмотря на то что в пределах РАС данные параметры могут варьировать, с помощью этого метода можно дифференцировать лиц с РАС от лиц с другой психической патологией – шизофренией, синдромом дефицита внимания и гиперактивности (СДВГ). Кроме того, результаты проведенного исследования подтверждают гипотезу о том, что нейроанатомические изменения при РАС носят многомерный характер и влияют на разные корковые функции. Эти открытия, сделанные с помощью пространственных нейровизуализационных методов и последних генетических достижений, позволяют по-новому взглянуть на многофакторную этиологию заболевания.
Сообщение Jeffrey Glennon (Нидерланды) было посвящено достижениям в области поиска разных биомаркеров РАС в сравнительно-возрастном аспекте. Известно, что первые симптомы РАС появляются в возрасте до 3 лет и составляют триаду основных симптомов: социальные нарушения, коммуникационные проблемы и стереотипное поведение. Клинические признаки РАС в дальнейшем могут измениться. В частности, было показано, что по мере взросления тяжесть симптомов и поведенческие нарушения, как правило, уменьшаются, что приводит к улучшению социального функционирования лиц с РАС в подростковом и взрослом возрасте. В исследованиях десятилетней давности было показано, что уже у детей 2–4 лет можно обнаружить снижение функциональной активности (по сравнению с контрольной группой) тех областей головного мозга, которые отвечают за социальные и когнитивные навыки, а также функцию внимания. В дальнейшем изменения находят и в других областях коры головного мозга (например, областях, отвечающих за моторные функции, социальную когницию), которые, по-видимому, лежат в основе клинических и поведенческих симптомов при РАС.
До настоящего времени было выполнено лишь несколько исследований, которые пытались выделить молекулярные и генетические маркеры РАС в зависимости от возраста больных.
 В частности, в одном исследовании изучались возрастные изменения экспрессии генов в префронтальной коре с помощью анализа уровня мРНК умерших лиц с РАС. На основе этих данных в будущем, по-видимому, можно будет идентифицировать конкретные признаки и симптомы, которые могут стать фармакологическими «мишенями» для действия лекарств. На моделях мышей с РАС были выделены некоторые синаптические изменения: уменьшение числа протеинов постсинаптических рецепторов; уменьшение постсинаптической плотности; снижение числа дендритных шипиков и разветвления дендритов; ослабление сигналов; увеличение размеров полосатого тела (рис. 1). Что же касается конкретных генов, вовлеченных в патогенез РАС, то лишь некоторые из них (Neurorexin-1, CNTNAP2, OXTR, AVPR1A) изучались в контексте связи с поведенческими, когнитивными и нейровизуализационными изменениями при РАС. Также было показано, что уровень мозгового нейротрофического фактора у детей 0–9 лет значительно ниже, чем у детей с РАС, которые были старше 10 лет, в то время как у здоровых детей возрастных различий уровня мозгового нейротрофического фактора найдено не было. В другом исследовании было обнаружено, что концентрация N-ацетиласпартата в лобной коре у детей с РАС заметно понижена, что может отражать увеличение обмена веществ в митохондриях и может быть связано со стереотипным поведением и снижением социальной активности.
В частности, в одном исследовании изучались возрастные изменения экспрессии генов в префронтальной коре с помощью анализа уровня мРНК умерших лиц с РАС. На основе этих данных в будущем, по-видимому, можно будет идентифицировать конкретные признаки и симптомы, которые могут стать фармакологическими «мишенями» для действия лекарств. На моделях мышей с РАС были выделены некоторые синаптические изменения: уменьшение числа протеинов постсинаптических рецепторов; уменьшение постсинаптической плотности; снижение числа дендритных шипиков и разветвления дендритов; ослабление сигналов; увеличение размеров полосатого тела (рис. 1). Что же касается конкретных генов, вовлеченных в патогенез РАС, то лишь некоторые из них (Neurorexin-1, CNTNAP2, OXTR, AVPR1A) изучались в контексте связи с поведенческими, когнитивными и нейровизуализационными изменениями при РАС. Также было показано, что уровень мозгового нейротрофического фактора у детей 0–9 лет значительно ниже, чем у детей с РАС, которые были старше 10 лет, в то время как у здоровых детей возрастных различий уровня мозгового нейротрофического фактора найдено не было. В другом исследовании было обнаружено, что концентрация N-ацетиласпартата в лобной коре у детей с РАС заметно понижена, что может отражать увеличение обмена веществ в митохондриях и может быть связано со стереотипным поведением и снижением социальной активности.
Главной целью исследования докладчика (J.Glennon) и соавт. из Института когнитивных наук и поведения в
г. Неймеген (Nijmegen, Нидерланды) было изучение изменения лабораторных показателей у детей с РАС разного возраста. Всего в исследование вошли 37 детей с РАС и 37 детей без РАС, сопоставимых по полу, возрасту, индексу массы тела и другим показателям и условно дифференцированных на три возрастные группы (4–9, 9–13 и 13–18 лет). С помощью разных лабораторных методик (преимущественно иммуноферментных) у детей с РАС были выявлены статистически достоверные изменения уровня девяти белков по сравнению с детьми контрольной группы: белок Тамма–Хорсфолла – мочевой гликопротеид (p=0,004), интерлейкин-3 (p=0,01), фактор Виллебранда (p=0,023), интерлейкин-12 – субъединица р40 (p=0,025), тирозинкиназа (p=0,033), фактор некроза опухоли b (p=0,034), интерлейкин-13 (p=0,038), хемотаксический для макрофагов белок (p=0,042), фактор стволовых клеток (p=0,05).
Доклад Martha Herbert (США) был посвящен ревизии концепции аутизма в последние годы («Аутизм: от статичного генетического дефекта до концепции динамического взаимодействия генов и факторов внешней среды»). В течение 10 лет (1997–2007 гг.) диагностика РАС в США увеличилась почти в 6 раз, что особенно заметно на фоне относительно стабильного числа других психических расстройств детского возраста (рис. 2).
 Последние достижения в области изучения РАС сильно отличаются от того, что предсказывали ученые еще 10–15 лет назад. В настоящее время исследователи начинают осознавать сложность изучаемой проблемы: в патогенез РАС вовлечено не несколько, а сотни генов, не только генетические причины, но и факторы окружающей среды, не только нейроны, но и глиальные клетки, не только патология головного мозга, но и более общие патофизиологические изменения (рис. 3). Аутизм может появиться у маленьких детей, чьи психосоциальные и сенсорные функции не обнаруживали какой-либо патологии, а многие признаки могут варьировать по тяжести как на протяжении короткого времени, так и в долговременной перспективе. Хотя ранее многие факторы рассматривались в качестве основных «причин» РАС, само понятие «причина» неоднозначно в контексте РАС и часто понимается по-разному. В качестве основного кандидата на роль «причины» поведенческого фенотипа РАС называлось нарушение электрофизиологической активности, которую в свою очередь часто связывают как с генетическими, так и физиологическими факторами. Кроме того, митохондриальная дисфункция, приводящая к изменению синаптических взаимодействий и нейрональных сетей, может быть связана с внешними и физиологическими изменениями, с одной стороны, и генетическими факторами, с другой. «Аутизм» может также возникнуть в связи с нарушениями электрофизиологической активности, связанной с метаболическими и иммунными дисфункциями и клеточной патологией.
Последние достижения в области изучения РАС сильно отличаются от того, что предсказывали ученые еще 10–15 лет назад. В настоящее время исследователи начинают осознавать сложность изучаемой проблемы: в патогенез РАС вовлечено не несколько, а сотни генов, не только генетические причины, но и факторы окружающей среды, не только нейроны, но и глиальные клетки, не только патология головного мозга, но и более общие патофизиологические изменения (рис. 3). Аутизм может появиться у маленьких детей, чьи психосоциальные и сенсорные функции не обнаруживали какой-либо патологии, а многие признаки могут варьировать по тяжести как на протяжении короткого времени, так и в долговременной перспективе. Хотя ранее многие факторы рассматривались в качестве основных «причин» РАС, само понятие «причина» неоднозначно в контексте РАС и часто понимается по-разному. В качестве основного кандидата на роль «причины» поведенческого фенотипа РАС называлось нарушение электрофизиологической активности, которую в свою очередь часто связывают как с генетическими, так и физиологическими факторами. Кроме того, митохондриальная дисфункция, приводящая к изменению синаптических взаимодействий и нейрональных сетей, может быть связана с внешними и физиологическими изменениями, с одной стороны, и генетическими факторами, с другой. «Аутизм» может также возникнуть в связи с нарушениями электрофизиологической активности, связанной с метаболическими и иммунными дисфункциями и клеточной патологией.

4) предсказать ответ на терапию; 4) определить биологически гомогенные группы больных; 5) выделить группы пациентов с высокой вероятностью возникновения тяжелых побочных реакций в ответ на прием поверхностно-активных веществ. В настоящее время такие широко известные маркеры РАС, как гиперсеротонинемия и макроцефалия, определяются лишь в 25–41 и 18% случаев. В то же время при разных состояниях в рамках РАС в настоящее время активно изучают несколько молекулярных мишеней: IGF-1 при синдроме Ретта, антагонисты mGluR5-рецепторов при синдроме ломкой X-хромосомы, ингибиторы mTOR при аутизме (D.Ehninger, 2011). Персонифицированная молекулярная терапия, без сомнения, представляет собой самую многообещающую долговременную цель генетических исследований и изучения биомаркеров при РАС.
Проблема СДВГ в сравнительно-возрастном аспекте
Доктор Fernandes Cubillo (Великобритания) представила доклад «Стойкие мозговые нарушения при СДВГ у взрослых». Было отмечено, что хотя СДВГ традиционно рассматривается как детская патология, в настоящее время уже доказано, что во взрослом возрасте симптомы заболевания сохраняются у 65% больных, а общая распространенность достигает 3–4% общей популяции. С возрастом симптомы СДВГ меняются: в частности, уменьшается удельный вес гиперактивности, в то время как проблемы с вниманием и импульсивность остаются. В DSM-5 изменены число признаков, которое необходимо для диагностики расстройства, их описание и возраст начала. Это сделано в первую очередь для того, чтобы улучшить диагностики СДВГ у взрослых в общей практике. С помощью методов нейровизуализации удалось обнаружить некоторые морфологические различия у взрослых и детей, страдающих СДВГ, коррелирующие с клиническими симптомами.В частности, было показано, что при СДВГ у детей в патологический процесс вовлечено несколько регионов мозга: в первую очередь подкорковые ядра и в меньшей степени префронтальная кора, височно-париетальные области и мозжечок. Метаанализ структурных изменений в мозге, полученных с помощью магнитно-резонансной томографии (МРТ), показывает, что изменения в подкорковых ядрах с возрастом нивелируются и у взрослых изменения в этой области уже не обнаруживают. В других исследованиях показано, что у взрослых с СДВГ сохраняются изменения в лобной коре. С другой стороны, функциональные МРТ-исследования говорят о том, что когнитивные проблемы, связанные с изменениями в коре, полосатом теле и мозжечке, удивительным образом схожи как у взрослых, так и у детей, а изменения корковых функций демонстрируют устойчивость во времени. Исключение, правда, составляет патология подкорковых ядер, которая отмечается в детстве и обусловливает, с одной стороны, трудности при выполнении задач на изучение функции внимания (его дефицит), а с другой стороны, свидетельствует о том, что СДВГ у взрослых представляет собой более легкую форму заболевания, по крайней мере на уровне мозговой патологии. В то же время стоит подчеркнуть, что СДВГ – это не просто изменения в какой-то конкретной области, но в первую очередь патология корково-стриато-мозжечковых сетей. В нескольких исследованиях была четко установлена патология лобной коры у взрослых с СДВГ. Последнее обстоятельство говорит о том, что изменения в нейрональных сетях на уровне подкорковых ядер, по-видимому, могут редуцироваться в случае стойких изменений в корковой области. В качестве гипотезы можно предположить, что у тех детей с СДВГ, которые в дальнейшем выздоравливают, в патологический процесс преимущественно вовлечены подкорковые ядра, в то время как при локализации патологии в области лобной коры болезнь может сохраниться. Известно, что подкорковые ядра иннервируются дофамином, уровень которого у детей с СДВГ обычно понижен, а лечение агонистами дофамина (стимуляторы) может повысить его уровень, особенно в области подкорковых ядер. Таким образом, тот факт, что стимуляторы улучшают дофаминовую проводимость в подкорковых ядрах, которые преимущественно поражены у детей с СДВГ, позволяет предположить, что данная группа препаратов более эффективна у детей, чем у взрослых с СДВГ. Кроме того, данные, полученные на основе позитронно-эмиссионной томографии, свидетельствуют о том, что головной мозг постепенно адаптируется к терапии стимуляторами и их эффективность в ходе длительного приема снижается. К сожалению, ученые еще не могут предсказать вероятность сохранения конкретных психопатологических признаков СДВГ во взрослой жизни, но дальнейшие исследования должны помочь определить эти риски. Несколько катамнестических исследований СДВГ свидетельствуют о том, что структура мозга и социальное функционирование тех лиц, которые находятся в состоянии ремиссии, больше напоминают здоровых людей, чем тех, у которых СДВГ сохраняется. Кроме того, было показано, что те пациенты, у которых длительное время персистируют определенные симптомы СДВГ (в частности, патология внимания), характеризуются большей плотностью коры. Дальнейшие проспективные катамнестические исследования СДВГ должны помочь идентифицировать те клинические признаки, которые ассоциируются с сохранением или ослаблением симптомов и когнитивным функционированием, с одной стороны, и со структурными и функциональными нарушениями при СДВГ у взрослых, с другой. Они также помогут понять роль коморбидных расстройств, в том числе злоупотребления поверхностно-активными веществами, в поддержании симптомов и глубине их проявления, а также прояснить роль лекарственных средств в отношении возможностей нормализации патологического процесса. Только тогда, когда мы сможем понять механизмы, лежащие в основе сохранения симптомов СДВГ в подростковом и зрелом возрасте, мы сможем построить лучшую стратегию лечения.
Ведущий немецкий специалист в области СДВГ Esther Sobansky (Германия) представила доклад «Новые перспективы лечения СДВГ у взрослых». Было отмечено, что, подобно другим расстройствам, длительное существование СДВГ ассоциируется с высокой вероятностью появления коморбидных заболеваний: риск возникновения любого другого психического расстройства (депрессии, тревоги, злоупотребления поверхностно-активными веществами) при СДВГ достигает 77,1%, что почти в 2 раза выше, чем в популяции в целом (40%). Кроме того, для взрослых с СДВГ характерно поведение, которое может быть потенциально опасно для жизни (быстрая езда на автомобиле, увлечение экстремальными видами спорта).
Фармакотерапия СДВГ у взрослых всеми доступными на рынке препаратами, включая стимулянты и другие лекарственные средства, оказалась эффективной (величина эффекта до 1) в отношении как основных, так и облигатных признаков расстройства, в частности эмоциональной дисрегуляции и проблем со сном. Кроме того, у тех пациентов, которые ранее получали лекарственные средства, в последующем были достаточно эффективны психотерапевтические интервенции. Также было показано, что фармакотерапия может улучшать психосоциальное функционирование лиц с СДВГ и уменьшать их склонность к риску. Однако с учетом высокой коморбидности СДВГ необходимы исследования, направленные на выработку оптимальной стратегии и оценки терапии в реальных условиях. Кроме того, в будущем необходимо включать в исследование те группы лиц с СДВГ, которые редко изучаются – в частности, пациентов, находящихся в тюрьмах, у которых распространенность СДВГ крайне высока, а лечение они, как правило, не получают.
Постерное сообщение David Coghill (Великобритания) было посвящено влиянию препарата lisdexamfetamine dimesylate (LDX) на исходы СДВГ у детей и подростков. Основной целью исследования явилась оценка влияния LDX (III фаза исследования) на качество жизни детей и взрослых с СДВГ. Исследование продолжалось
7 нед и полностью его завершили 317 пациентов с СДВГ в возрасте от 6 до 17 лет. В ходе двойного слепого плацебо-контролируемого исследования, в котором приняли участие ученые десяти европейских стран, было показано, что LDX хорошо переносится и является эффективным лекарственным средством в отношении редукции основных психопатологических симптомов расстройства. Кроме того, он улучшает ежедневное функционирование и качество жизни детей с СДВГ. Изучение нескольких опросников, в том числе заполняемых родителями пациентов, показало, что препарат оказался наиболее эффективен (статистически достоверно) в отношении следующих сфер жизни: обучение и школа; семья; общественная деятельность; склонность к риску.
Заключение
Анализ основных докладов 26-го Европейского конгресса по нейропсихофармакологии в Барселоне, посвященных вопросам детской психиатрии, показывает, что фокус исследований все больше и больше сосредотачивается на изучении двух психических расстройств этого возрастного периода: РАС и СДВГ. Ревизия данных состояний вDSM-5 в первую очередь коснулась сравнительно-возрастных аспектов заболеваний, что нашло отражение и в материалах конгресса. В проведенных клинических и экспериментальных исследованиях, в том числе с привлечением животных моделей, генетики и методов нейровизуализации, пытаются понять, какие признаки предрасполагают к появлению конкретных симптомов заболевания и сохранению расстройств во взрослом возрасте. Многофакторная природа РАС и СДВГ, с одной стороны, и сложность патогенетических механизмов, вовлеченных в их развитие, с другой, по-видимому, замедляют существенный прогресс в этой области и поиск новых подходов к терапии. В то же время появляется все больше и больше данных, свидетельствующих о том, что РАС и СДВГ являются не просто совокупностью определенных клинических симптомов и психологических характеристик, но представляют собой болезни в традиционном, крепелиновском смысле, имеющие определенное единство этиопатогенетических механизмов, клинических симптомов и исходов.
Сведения об авторах
Н.Р.Гаджиева – Азербайджанский медицинский университет, Баку. E-mail: nar_gad@mail.ru
А.В.Павличенко – ГБОУ ВПО РНИМУ им. Н.И.Пирогова Минздрава России. E-mail: apavlichenko76@gmail.ru
К.Е.Кабоснидзе – Клиническая больница №5, Грузия, Тбилиси. E-mail: kobakabosnidze@yahoo.com
Список исп. литературыСкрыть список1. Carucci S. Growth on stimulant medication: effects in children with ADHD 26st European College of Neuropsychopharmacology.
2. Coghill D. Health-related quality of life outcomes in a long-term study of lisdexamfetamine dimesylate in children and adolescents with ADHD. 26st European College of Neuropsychopharmacology.
3. Cubillo F. Persistence of brain deficits in Adult ADHD. 26st European College of Neuropsychopharmacology.
4. Ecker С. New neuroimaging approaches in autism spectrum disorders. 26st European College of Neuropsychopharmacology.
5. Ehninger D. Rapamycin for treating tuberous sclerosis and autism spectrum disorders. Trends Mol Med 2011; 17: 78–87.
6. Glennon J. Matching preclinical and clinical studies: the translational challenge. 26st European College of Neuropsychopharmacology.
7. Herbert M. Autism: from static genetic brain defect to dynamic gene-environment modulated pathopsysiology. 26st European College of Neuropsychopharmacology.
8. Herbert MR. Autism: from static genetic brain defect to dynamic gene-environment modulated pathopsysiology. Chapter 10 of Genetic Explanations: Sense and Nonsense. Eds S.Krimsky, J.Gruber. Harvard University Press, 2013; p. 122–46.
9. Persico A. Biomarkers and new target drugs in autism spectrum disorders. 26st European College of Neuropsychopharmacology.
10. Sobansky E. Psychopharmacological treatments for adults with ADHD: new findings. 26st European College of Neuropsychopharmacology.

