Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№06 2014
Систематизированный обзор медикаментозного лечения детей с расстройствами аутистического спектра №06 2014
Номера страниц в выпуске:43-51
Хотя многие дети с РАС в настоящее время получают медикаментозную коррекцию, в современной литературе существует поразительно мало доказательств в отношении достоверной эффективности и безопасности большинства препаратов. Рисперидон и арипипразол показали преимущество в отношении коррекции ограниченных интересов и повторяющихся действий, но связанные с ними побочные эффекты ограничивают их использование для пациентов с серьезными нарушениями или органическим поражением головного мозга.
Резюме. По современным статистическим данным, в США 1 из 110 детей имеет диагноз расстройства аутистического спектра (РАС). Для коррекции подобных нарушений были предложены и изучены многочисленные медикаментозные и немедикаментозные схемы, однако до настоящего времени нет единого мнения относительно того, какие методы лечения являются наиболее эффективными.
Цель обзора – систематизация представленных в литературе последних лет данных клинических исследований эффективности и безопасности медикаментозного лечения детей в возрасте до 12 лет, страдающих РАС.
Методы: Проведен анализ информации баз данных с января 2000 по май 2010 г., представленных на сайтах Medline, PsycINFO и ERIC (Образовательные ресурсы информационного центра), нормативных данных для разрешенных к применению в детской практике лекарственных препаратов, а также имеющихся публикаций по данной теме. В обзоре представлены данные рандомизированных плацебо-контролируемых исследований.
Результаты: Данные подтверждают преимущество рисперидона и арипипразола для коррекции сложных и стереотипных действий у детей с РАС. Кроме того, получены также подтверждения значительного неблагоприятного воздействия этих препаратов. Однако в отношении оценки терапевтических или неблагоприятных эффектов других медикаментозных методов коррекции РАС, в частности ИОЗС и препаратов стимулирующего действия, достоверных доказательств не обнаружено.
Выводы: Хотя многие дети с РАС в настоящее время получают медикаментозную коррекцию, в современной литературе существует поразительно мало доказательств в отношении достоверной эффективности и безопасности большинства препаратов. Рисперидон и арипипразол показали преимущество в отношении коррекции ограниченных интересов и повторяющихся действий, но связанные с ними побочные эффекты ограничивают их использование для пациентов с серьезными нарушениями или органическим поражением головного мозга.
Ключевые слова: расстройства аутистического спектра, рандомизированные клинические исследования, антипсихотики, рисперидон, арипипразол, ингибиторы обратного захвата серотонина, циталопрам, флуоксетин, психостимуляторы.
A systematic review of medical treatment of children with autism spectrum disorders
N.V.Filippova, Yu.B.Barylnik
V.I.Razumovsky Saratov State Medical University, Russian Ministry of Health
Summary. According to modern statistics, in the United States 1 of 110 children has a diagnosis of autism spectrum disorders (ASD).
To correct such violations have been proposed and studied numerous medication and non-medication scheme, but to date there is no consensus as to what treatments are most effective.
The aim of this review was the systematization presented in the literature in recent years of clinical efficacy and safety studies of medical treatment of children under the age of 12 years suffering from autism spectrum disorders.
Methods: The analysis of information databases from January 2000 to May 2010, submitted on sites Medline, PsycINFO, and ERIC (Educational Resources Information Center), normative data for approved for use in pediatric practice, drugs, as well as existing publications this topic. This review summarizes the evidence from randomized placebo-controlled studies.
Results: The data confirm the advantage of risperidone and aripiprazole for the correction of complex and stereotyped actions in children with ASD. In addition, also received confirmation of significant adverse effects of these drugs. However, in the evaluation of therapeutic and adverse effects of other medical methods for correction at the PAC, particularly selective serotonin reuptake inhibitors and drugs stimulating action, credible evidence were found.
Conclusions: Although many children with ASD are currently receiving drug correction in modern literature, there are surprisingly few reliable evidence about the efficacy and safety of most drugs. Risperidone and aripiprazole showed a benefit in respect of compensation restricted interests and repetitive behaviors, but associated side effects limit their use in patients with severe impairment or organic brain damage.
Key words: autism spectrum disorders, randomized clinical trials, antipsychotics, risperidone, aripiprazole, serotonin-reuptake inhibitors, citalopram, fluoxetine, psychostimulants.
По современным статистическим данным, в США 1 из 110 детей имеет диагноз расстройства аутистического спектра (РАС) [1]. Страдающие аутистическими расстройствами дети демонстрируют симптомы, которые могут быть разделены на три основные категории: выраженный и всесторонний дефицит социального взаимодействия и общения, а также ограниченные интересы и повторяющиеся действия [2, 5].
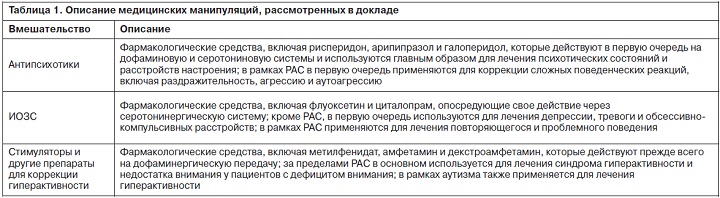
Сопутствующие заболевания и состояния, в том числе интеллектуальная недостаточность, эпилепсия, гиперактивность и тревога, являются обычным явлением при РАС [1, 2, 4, 5]. С целью коррекции РАС были предложены и изучены многие методы, в том числе поведенческие, образовательные, медикаментозные и психологические методики, однако в настоящее время нет глобального консенсуса относительно того, какие стратегии вмешательства являются наиболее эффективными [6, 7]. С учетом пожизненного диагноза аутистических расстройств большинство пациентов подвергаются многочисленным вмешательствам, направленным на коррекцию различных симптомов заболевания. Медицинские вмешательства при РАС, как правило, направлены в первую очередь на лечение сопутствующих симптомов, а не основных аутистических проявлений. В рамках данного систематизированного обзора терапии детей в возрасте до 12 лет с РАС [8] мы рассмотрели литературу по антипсихотикам, ингибиторам обратного захвата серотонина (ИОЗС) и стимулирующим препаратам (табл. 1). Все остальные методы лечения, за исключением секретина [9], не получили достаточных доказательств для оценки их возможных преимуществ у детей с РАС.
Отбор исследований. В данном обзоре проанализированы исследования, опубликованные не ранее 2000 г. и включавшие не менее 30 участников с РАС в возрасте до
13 лет. Диагноз аутистического расстройства устанавливался в соответствии с критериями DSM-IV [2] и широко используемых и являющихся «золотым стандартом» в США шкал Autism Diagnostic Observation System (ADOS) [10] и Autism Diagnostic Interview-Revised (ADI-R) [11].
Извлечение данных. Использованы стандартные формы для получения данных, касающихся дизайна исследования; описания изучаемой популяции, видов вмешательства и групп сравнения, а также базовых показателей, результатов терапии и сведений о нежелательных или побочных эффектах. Были также учтены данные о сроках проведения и методиках исследования с целью оценки качества данных. Основной интерес при проведении данного анализа представляли результаты воздействия на основные симптомы РАС или общие сопутствующие симптомы, включающие диссомнические расстройства, тревожность, гиперактивность и вызывающее поведение (например, раздражительность, ажитацию).
Оценка качества исследований. Каждое исследование, включенное в данный обзор, было оценено с помощью формы оценки качества, разработанной M.McPheeters и соавт. (2011 г.). Данная форма включала следующие критерии:

В 9 исследованиях назначались антипсихотические препараты [13–29], в 5 – изучалась эффективность и безопасность ИОЗС [30–34], и 4 исследования оценивали препараты группы стимуляторов [35–40].
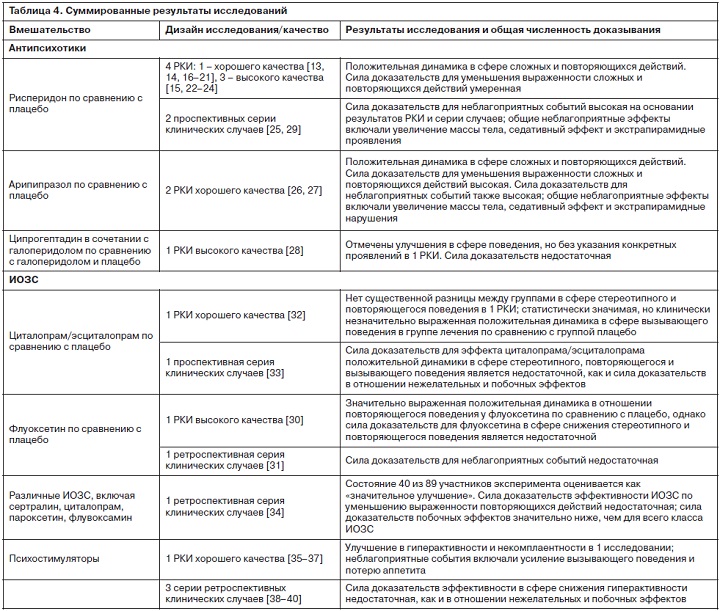
Суммированные результаты исследований представлены в табл. 4.
В двух из четырех РКИ приоритетной целью явилось изучение влияния рисперидона на целенаправленное сложное поведение [18, 23]. Первое исследование [13, 14, 16–21] было проведено под эгидой Национального института психического здоровья в рамках научно-исследовательских подразделений детской психофармакологии (RUPP) «Autism Network». Второе исследование было организовано фирмой-производителем рисперидона (Risperdal; Ortho-McNeil-Janssen Pharmaceuticals, Inc, Titusville, NJ) [22]. Рисперидон получали 89 детей с аутистическими расстройствами, 91 ребенок составил группу сравнения с плацебо.
В обоих исследованиях было применено титрование дозы исследуемого препарата в течение 8 нед. Средняя доза рисперидона варьировала от 1,5 до 1,8 мг/сут, с ежедневным однократным суточным приемом препарата в 1-м исследовании [23], и 2 раза в сутки – во 2-м протоколе [13, 14, 16–21]. В этих двух исследованиях базовые рейтинги нецеленаправленного поведения, оцененные как девиантное поведение по шкале ABC-CI в подшкалах «раздражительность», «ажитация», «плач», в основной и контрольной группах практически не различались. Данная шкала оценки отклоняющегося поведения включает баллы от 0 до 48, где самые высокие значения соответствуют максимально выраженным поведенческим нарушениям.
В обоих исследованиях уменьшение балльной оценки по шкале ABC-CI было значительно более выражено у пациентов, получавших рисперидон (среднее снижение 12,1–14,9 балла), по сравнению с плацебо (в контрольной группе среднее значение редукции поведенческих расстройств по данной шкале составило 3,6–6,5 балла). Подобное улучшение было отмечено и по субшкалам «гиперактивность», «некомплаентность» (ABC-CH) в обоих исследованиях, оценивающих такие показатели, как гиперактивность и нецеленаправленное поведение. Базовые рейтинги ABC-CH были сопоставимыми в обеих терапевтических группах; более выраженная динамика отмечена у пациентов основной группы, получавших рисперидон (средний балл редукции симптомов составил 14,8–14,9), по сравнению с пациентами, получавшими плацебо (средний балл редукции симптомов составил 4,7–7,4).
Вторичными целями обоих исследований стало изучение влияния рисперидона на выраженность повторяющегося и стереотипного поведения, в том числе стереотипии, по субшкале ABC-CS. Базовые рейтинги по ABC-CS были сопоставимы между группами, получавшими рисперидон и плацебо, и подвергались значительно более выраженной редукции в основной группе исследований по сравнению с группой плацебо-контроля в одном РКИ (среднее снижение: 4,8 балла vs 1,7 балла) [18], однако после коррекции в ходе многократного тестирования в другом РКИ столь существенной разницы выявлено не было (в среднем данный показатель уменьшался на 4,3 балла в основной группе и на 2,4 балла в группе сравнения) [23].
В одном из проанализированных в данном обзоре исследований [16, 18] также используется шкала Children’s
Yale-Brown Obsessive Compulsive Scale (CY-BOCS), модифицированная под глубокое расстройство развития для оценки повторяющегося поведения. В данном исследовании не было обнаружено базовых различий между исследуемыми группами, однако значительно большее снижение баллов было констатировано у пациентов, принимавших рисперидон, по сравнению с группой плацебо (среднее снижение: 3,9 балла vs 1,0 балла). В ходе этого исследования проводилась оценка и ряда других клинических проявлений, таких как вызывающее поведение, гиперактивность и повторяющиеся действия, однако статистически значимых различий не обнаружено.
Два дополнительных РКИ не предусматривали конкретной числовой оценки нецеленаправленного или повторяющегося поведения [15, 24]. Одно из исследований предусматривало прием рисперидона и плацебо в течение
8 нед [15] после положительного ответа на предшествующее лечение рисперидоном в течение 4 мес [18]. В этом исследовании «рецидив» заболевания индексировался с помощью сочетания измерения по шкале ABC-CI и клинической оценки состояния [15], причем констатировано значительно меньше «рецидивов» в группе пациентов, получавших рисперидон (у 2 из 16), по сравнению с группой плацебо (у 10 из 16).
Последнее из проанализированных в данном обзоре – 6-месячное исследование оценки эффективности и
безопасности рисперидона по сравнению с плацебо с использованием разных общих оценочных шкал для оценки терапевтического ответа [24]. Авторы исследования сообщают, что средние значения по шкале Childhood Autism Rating отмечались у 20% участников исследования и более выраженное улучшение наблюдалось в группе пациентов, получавших рисперидон (11,1 балла), по сравнению с группой сравнения, принимавшей плацебо (2,5 балла) [24].
Во всех проанализированных РКИ по рисперидону в сравнении с плацебо были также представлены данные о неблагоприятных явлениях или побочных эффектах. Авторы всех четырех исследований сообщили и о повышении массы тела [14, 15, 18, 22–24], более выраженном у пациентов, получавших рисперидон (в среднем увеличение массы тела составило 2,7–2,8 кг), в то время как в группе плацебо среднее значение прибавки массы тела составило 0,8–1,7 кг [14, 18, 22, 23]. Авторы трех из четырех РКИ [14, 15, 18, 22, 23] представили также данные о других неблагоприятных явлениях, зарегистрированных в ходе проведения исследований. Вялость или сонливость были самыми частыми нежелательными явлениями в двух из этих исследований и наблюдались у 53 из 89 пациентов в группе рисперидона и у 9 из 91 – в группе плацебо, однако со временем отмечалось уменьшение сонливости у большинства пациентов [14, 18, 22, 23].
В обоих исследованиях было зарегистрировано больше случаев экстрапирамидных симптомов (в том числе тремора, дискинезии и скованности) у получавших рисперидон по сравнению с плацебо, но эти события были классифицированы по-разному авторами исследований, и статистически значимых различий между терапевтическими группами не было выявлено [14, 18, 22, 23]. Авторы одного из исследований [18] также сообщили о большем повышении уровня пролактина у пациентов, получавших рисперидон (среднее увеличение – 27,7 нг/мл), по сравнению с группой плацебо (среднее увеличение – 0,8 нг/мл) [21], хотя о таких клинических проявлениях, как гинекомастия или галакторея, которые могут быть связаны с повышенным уровнем пролактина, не сообщается. Исследования RUPP специально оценивали когнитивные функции в обеих исследуемых группах и не обнаружили снижения уровня когнитивного функционирования, а, напротив, даже некоторое улучшение когнитивных показателей в группе рисперидона, однако статистическая значимость этих данных после проведения нескольких тестирований не была подтверждена [13, 18].
В данный обзор были включены также два 8-недельных РКИ арипипразола у детей с РАС [26, 27], проведенных под эгидой фирмы-производителя арипипразола (Abilify; Otsuka America Pharmaceutical, Inc., Tokyo, Japan). Приоритетной целью этих исследований было нецеленаправленное поведение, оцениваемое по шкале ABC-CI. Эти исследования включали 213 пациентов в группе арипипразола и 103 – в группе плацебо. В одном из исследований использовали фиксированные дозы препаратов: 1 группа плацебо и 3 группы арипипразола по 5, 10 и 15 мг/сут [26]; все пациенты начинали принимать арипипразол в дозе
2 мг/сут с обязательным еженедельным титрованием до достижения целевой дозы. В другом исследовании использовался график титрования доз с еженедельной прогрессией от 2 до 15 мг/сут по клиническому впечатлению [27].
В этих двух исследованиях базовые рейтинговые показатели по шкале ABC-CI были сопоставимы в группах арипипразола и плацебо, и более значимое снижение регистрировалось у пациентов, получавших арипипразол (среднее снижение 12,4–14,4 балла), по сравнению с плацебо (среднее снижение 5,0–8,4 балла). Терапевтический ответ возрастал параллельно увеличению дозы арипипразола [26]. В целом результаты исследования, в котором использовали титрование дозы препарата на основании комплексного клинического заключения, были более выраженными [27]. Сходные показатели улучшения состояния по шкале ABC-CH выявлены в обоих исследованиях. Исходные рейтинги в группах плацебо и арипипразола были сопоставимы; более значимая редукция показателей была отмечена у пациентов, получавших арипипразол (среднее снижение 12,7–16,3 балла), в отличие от группы плацебо (среднее снижение 2,8–7,7 балла).
Вторичной целью обоих исследований стала оценка влияния арипипразола на повторяющееся и стереотипное поведение [41]. Оба исследования включали подшкалу ABC-CS. Исходные рейтинги оценки стереотипного поведения были сопоставимы у пациентов, получавших арипипразол и плацебо. Более значительное уменьшение бал-льной оценки по субшкале ABC-CS было констатировано в группе арипипразола (среднее улучшение – 4,2–4,8 балла) по сравнению с группой плацебо (среднее улучшение – 1,8–2,0 балла). Также в обоих исследованиях была использована шкала CY-BOCS, модифицированная под первазивные расстройства развития [41] для оценки повторяющихся и стереотипных действий. Не было обнаружено никаких базовых различий между исследуемыми группами, однако большее снижение баллов отмечено у пациентов, получавших арипипразол, по сравнению с группой плацебо (среднее снижение: 2,4–3,8 балла vs 0,8–1,7 балла).
Субшкала ABC-C несоответствующей речевой активности, оценивающая главным образом речевые стереотипии, также продемонстрировала значительное улучшение в первом исследовании [27] и благоприятные тенденции – во втором [26].
Эти два РКИ арипипразола также представили данные о побочных эффектах, зарегистрированных в ходе проведения исследований. Авторы обоих исследований сообщили о повышении массы тела [26, 27], более выраженном в группе арипипразола (среднее увеличение массы тела составило 1,3–2,0 кг), чем в группе плацебо (0,3–0,8 кг); в обоих исследованиях разница данных показателей была статистически значимой [26, 27]. Сонливость и седация были наиболее частыми нежелательными явлениями в обоих исследованиях (у 66 из 210 пациентов в группе арипипразола и у 8 из 101 пациента в группе плацебо) [26, 27]. Авторы обоих исследований также сообщили о более выраженных экстрапирамидных симптомах, таких как тремор, дискинезия и скованность (у 44 из 210 пациентов в группе арипипразола и у 10 из 210 пациентов в группе плацебо) [26, 27].
Оба исследования показали статистически значимое снижение уровня пролактина у пациентов в группе арипипразола в отличие от группы плацебо [26, 27]. В одном
8-недельном РКИ (40 участников) проводилось сравнение терапевтического эффекта ципрогептадина по сравнению с плацебо и галоперидолом [28]. Дозы препаратов титровали от некоторой начальной точки для ципрогептадина 0,05 мг/кг в день и галоперидола 0,2 мг/кг в день, но другие подробности исследования не были представлены. Показатели по шкале ABC-C были заметно ниже, чем средние баллы ABC-C, полученные в начале других клинических исследований [18, 23, 26, 27], что позволяет предположить, что оценка по данной субшкале была, возможно, несколько предвзятой, хотя это и не зафиксировано [28]. Терапевтический ответ в группе «плацебо + галоперидол» был менее выражен [28], чем результаты, полученные в предыдущих исследованиях галоперидола [42, 43]. Улучшение по шкале ABC-C в группе «ципрогептадин + галоперидол» было более выраженным (среднее снижение 10,9 балла), чем в группе «плацебо + галоперидол» (среднее снижение
3,7 балла) [28].
Статистически значимых различий между пациентами, получавшими циталопрам (n=73) и плацебо (n=76), по шкале CY-BOCS, модифицированной под первазивные расстройства развития, в отношении стереотипного поведения на момент начала исследования не отмечено. Сопоставимыми оказались и результаты улучшения состояния в группах циталопрама и плацебо (среднее снижение: 2,0 балла vs 1,9 балла) соответственно. Измерение других проявлений, в частности повторяющегося поведения по шкале Repetitive Behavior Scale-Revised, также продемонстрировало сходные показатели как на начальном, так и на завершающем этапах терапии и не подтвердило достоверную эффективность циталопрама [32].
Однако при оценке вторичных целей исследования по шкале ABC-CI было доказано преимущество циталопрама. Исходные рейтинговые баллы в группах циталопрама и плацебо статистически не отличались, однако более выраженное улучшение было констатировано у 10 пациентов, принимавших циталопрам (среднее снижение 3,2 балла), по сравнению с плацебо (среднее снижение 0,9 балла) [32]. Неблагоприятные эффекты в данном исследовании включали заметное усиление «активационных» симптомов, в том числе увеличение энергии, расторможенность и диссомнические расстройства в группе пациентов, принимавших циталопрам, по сравнению с плацебо [32]. Диарея, сухость или зуд кожи также чаще отмечались в группе циталопрама.
Одно из проспективных исследований эсциталопрама также соответствовало критериям отбора в данный обзор [33]. Это 10-недельное исследование ставило целью определение фармакогенетических модификаторов терапевтического ответа в области сложного поведения по шкале АВС-CI. Пациентам (n=58) проводилось форсированное титрование дозы эсциталопрама от 2,5 мг/сут в течение недели до 20 мг/сут; большинство пациентов не переносили окончательную дозировку. К сожалению, по этому исследованию были представлены только цифровые данные, которые не позволяют делать какие-либо выводы. Очевидно, однако, что значения по шкале АВС-CI для всех пациентов на момент вступления в исследование были сопоставимы, улучшение составило 10 баллов для групп с генотипом 3 по сравнению с группой с генотипом 4 [33].
В перекрестное РКИ флуоксетина с двумя периодами 8-недельного лечения, разделенного на 4-недельный период вымывания [30], были рандомизированы 19 пациентов, принимавших сначала флуоксетин с последующим переходом на плацебо, и 20 пациентов, получавших сначала плацебо с дальнейшим переходом на флуоксетин. Во время каждого этапа исследования участники эксперимента начинали в 1-ю неделю принимать 2,5 мг/сут флуоксетина или плацебо, а затем по клиническим показаниям доза препаратов увеличивалась до 0,8 мг/кг в день в течение нескольких недель (с 4 до 8-й недели исследования). Пациенты в 1-й группе флуоксетина продемонстрировали улучшение на 1,2 балла по шкале CY-BOCS, а пациенты в 1-й группе плацебо показали улучшение на 0,5 балла. Эти различия не были статистически значимыми, если рассматривать их по отдельности. Пациенты во 2-й группе флуоксетина показали улучшение на 1,2 балла, а пациенты во 2-й группе плацебо, напротив, продемонстрировали ухудшение на 0,1 балла. Однако при совместном анализе первого и второго периодов лечения изменение оценки по шкале CY-BOCS для группы флуоксетина было значительно более выражено, чем для группы плацебо. Побочные эффекты не встречались достоверно чаще в группе флуоксетина, хотя большему числу пациентов, принимавших флуоксетин, приходилось снижать дозы препарата из-за ажитации [30].
Научно-исследовательское подразделение детской психофармакологии Национального института психического здоровья (RUPP) «Autism Network» провело двойное слепое перекрестное исследование [35–37] метилфенидата, в которое были включены 72 ребенка с аутистическими расстройствами, получавшие из 3 дней лечения в течение одного дня плацебо, затем в течение последующих 2 дней исследуемый препарат (метилфенидат) в низкой, средней или высокой дозах; дозы варьировали от 7,5 до 50,0 мг/сут. Пациенты, которые положительно реагировали на метилфенидат (n=66), переходили на этап 4-недельного двойного слепого исследования с перекрестными дозами препарата. Пациенты с положительным ответом на этапе двойной слепой фазы (n=34) завершали 8-недельную открытую фазу продолжения на наиболее оптимальных дозах. Первичной мишенью исследования были симптомы гиперактивности/некомплаентности, устанавливаемые по обучающей рейтинговой шкале ABC-CH. Клиницисты слепым методом также оценивали участников с помощью шкалы общего клинического впечатления в плане улучшения состояния (CGI-C); эта подшкала и шкала оценки гиперактивности ABC, по мнению родителей и педагогов, были объединены для оценки терапевтического ответа.
Во время двойной слепой фазы с перекрестным титрованием доз все группы с разными дозами метилфенидата продемонстрировали средний уровень терапевтического эффекта, который, однако, статистически превосходил плацебо, и по шкале оценки родителей наиболее оптимальный эффект был отмечен для средних терапевтических доз, а по оценкам учителей – для высоких доз препарата. Средние оценки родителей по субшкалам ABC-C для симптомов «вялость/социальная самоизоляция» значительно уменьшались на высоких дозах метилфенидата по сравнению с плацебо. Наиболее частой причиной для прекращения лечения (18% случаев) была раздражительность. Другие неблагоприятные эффекты включали изменения сна и аппетита, тревогу, депрессию, головную боль и диарею.
По каждому препарату проведено по крайней мере два РКИ, в которых выявлено улучшение в отношении нецеленаправленного поведения и гиперактивности по оценкам родителей. Хотя эти поведенческие особенности не были основной целью коррекции в этих исследованиях, в отношении повторяющегося поведения также было отмечено улучшение как при приеме рисперидона, так и арипипразола. Оценка доказательности для терапевтического эффекта в отношении сложных и повторяющихся действий оказалась умеренной для рисперидона и высокой для арипипразола, что позволяет предположить, что дальнейшие исследования не приведут к существенным изменениям оценки эффективности этих антипсихотических препаратов. Оба препарата также могут вызывать довольно серьезные неблагоприятные последствия, включая заметное увеличение массы тела, седативный эффект и риск возникновения экстрапирамидных симптомов. Степень доказательности для неблагоприятных событий высока как для рисперидона, так и для арипипразола.
Таким образом, при окончательном анализе проведенных клинических исследований рисперидон и арипипразол оказались достаточно эффективными в отношении лечения РАС, но связанными со значительными неблагоприятными последствиями, которые ограничивают их использование для пациентов с серьезными нарушениями или органическим поражением головного мозга. Флуоксетин продемонстрировал преимущество для коррекции повторяющихся и стереотипных действий в одном РКИ с перекрестным титрованием доз; хотя этот эффект был обусловлен прежде всего 2-й группой исследования [30].
РКИ по циталопраму [32] не выявило достоверного эффекта в отношении стереотипного поведения, однако способствовало улучшению в сфере нецеленаправленного поведения. Поскольку в доступной литературе присутствуют результаты только одного РКИ хорошего качества и одного РКИ удовлетворительного качества, доказательств в отношении влияния циталопрама на уменьшение выраженности стереотипных и повторяющихся действий или нецеленаправленное поведение недостаточно. Выявлены побочные эффекты при назначении препаратов группы ИОЗС (нарушение сна и увеличение энергии) с достаточной достоверностью (два РКИ, одно из которых хорошего качества), с относительной вариабельностью в измерении результатов. Достоверных доказательств в отношении влияния стимуляторов на гиперактивность и нецеленаправленное поведение также недостаточно, поскольку было проведено только одно качественное РКИ.
В доступной литературе по вопросам лечения РАС представлена крайне дозированная информация, что препятствует корректному представлению о соотношении положительных результатов лечения с потенциальным вредом. Данные об ИОЗС разрозненны и противоречивы, и существует особая необходимость рассмотреть такие модифицирующие факторы, как возраст и фармакогенетические параметры [33]. В самом крупном из опубликованных исследований циталопрама не отмечено никакого влияния на повторяющиеся или компульсивные действия, однако обнаружен возможный эффект на нецеленаправленное поведение (ABC-CI) [32]. Некоторые медицинские процедуры были оценены лишь в единичных исследованиях или на малых выборках пациентов и не соответствовали критериям данного обзора [47–51], в связи с чем необходимо проведение большего количества контролируемых исследований для оценки их потенциальной выгоды. На основе имеющихся данных новые методы лечения крайне необходимы для коррекции как основных симптомов аутистических расстройств, так и вторичных симптомов у пациентов с РАС.
Наконец, в современной литературе не хватает данных сравнения медикаментозной терапии и поведенческих методик и комбинации этих методов, несмотря на то что большинство детей в настоящее время получают одновременно несколько методов лечения. Этот подход оказался достоверно эффективным в исследованиях по обсессивно-компульсивному расстройству, депрессии и тревоге [52–54], но только два исследования с соответствующей численностью пациентов рассматривали комбинированное лечение рисперидона и поведенческой терапии, и недостатком этих исследований является отсутствие плацебо-контроля.
Сведения об авторах
Ю.Б.Барыльник – д-р мед. наук, зав. каф. психиатрии, наркологии, психотерапии и клинической психологии ГБОУ ВПО Саратовский ГМУ им. В.И.Разумовского Минздрава России
Филиппова Наталья Валерьевна – канд. мед. наук, ассист. каф. психиатрии, наркологии, психотерапии и клинической психологии ГБОУ ВПО Саратовский ГМУ им. В.И.Разумовского Минздрава России. E-mail natdoc@mail.ru
Цель обзора – систематизация представленных в литературе последних лет данных клинических исследований эффективности и безопасности медикаментозного лечения детей в возрасте до 12 лет, страдающих РАС.
Методы: Проведен анализ информации баз данных с января 2000 по май 2010 г., представленных на сайтах Medline, PsycINFO и ERIC (Образовательные ресурсы информационного центра), нормативных данных для разрешенных к применению в детской практике лекарственных препаратов, а также имеющихся публикаций по данной теме. В обзоре представлены данные рандомизированных плацебо-контролируемых исследований.
Результаты: Данные подтверждают преимущество рисперидона и арипипразола для коррекции сложных и стереотипных действий у детей с РАС. Кроме того, получены также подтверждения значительного неблагоприятного воздействия этих препаратов. Однако в отношении оценки терапевтических или неблагоприятных эффектов других медикаментозных методов коррекции РАС, в частности ИОЗС и препаратов стимулирующего действия, достоверных доказательств не обнаружено.
Выводы: Хотя многие дети с РАС в настоящее время получают медикаментозную коррекцию, в современной литературе существует поразительно мало доказательств в отношении достоверной эффективности и безопасности большинства препаратов. Рисперидон и арипипразол показали преимущество в отношении коррекции ограниченных интересов и повторяющихся действий, но связанные с ними побочные эффекты ограничивают их использование для пациентов с серьезными нарушениями или органическим поражением головного мозга.
Ключевые слова: расстройства аутистического спектра, рандомизированные клинические исследования, антипсихотики, рисперидон, арипипразол, ингибиторы обратного захвата серотонина, циталопрам, флуоксетин, психостимуляторы.
A systematic review of medical treatment of children with autism spectrum disorders
N.V.Filippova, Yu.B.Barylnik
V.I.Razumovsky Saratov State Medical University, Russian Ministry of Health
Summary. According to modern statistics, in the United States 1 of 110 children has a diagnosis of autism spectrum disorders (ASD).
To correct such violations have been proposed and studied numerous medication and non-medication scheme, but to date there is no consensus as to what treatments are most effective.
The aim of this review was the systematization presented in the literature in recent years of clinical efficacy and safety studies of medical treatment of children under the age of 12 years suffering from autism spectrum disorders.
Methods: The analysis of information databases from January 2000 to May 2010, submitted on sites Medline, PsycINFO, and ERIC (Educational Resources Information Center), normative data for approved for use in pediatric practice, drugs, as well as existing publications this topic. This review summarizes the evidence from randomized placebo-controlled studies.
Results: The data confirm the advantage of risperidone and aripiprazole for the correction of complex and stereotyped actions in children with ASD. In addition, also received confirmation of significant adverse effects of these drugs. However, in the evaluation of therapeutic and adverse effects of other medical methods for correction at the PAC, particularly selective serotonin reuptake inhibitors and drugs stimulating action, credible evidence were found.
Conclusions: Although many children with ASD are currently receiving drug correction in modern literature, there are surprisingly few reliable evidence about the efficacy and safety of most drugs. Risperidone and aripiprazole showed a benefit in respect of compensation restricted interests and repetitive behaviors, but associated side effects limit their use in patients with severe impairment or organic brain damage.
Key words: autism spectrum disorders, randomized clinical trials, antipsychotics, risperidone, aripiprazole, serotonin-reuptake inhibitors, citalopram, fluoxetine, psychostimulants.
По современным статистическим данным, в США 1 из 110 детей имеет диагноз расстройства аутистического спектра (РАС) [1]. Страдающие аутистическими расстройствами дети демонстрируют симптомы, которые могут быть разделены на три основные категории: выраженный и всесторонний дефицит социального взаимодействия и общения, а также ограниченные интересы и повторяющиеся действия [2, 5].
Сопутствующие заболевания и состояния, в том числе интеллектуальная недостаточность, эпилепсия, гиперактивность и тревога, являются обычным явлением при РАС [1, 2, 4, 5]. С целью коррекции РАС были предложены и изучены многие методы, в том числе поведенческие, образовательные, медикаментозные и психологические методики, однако в настоящее время нет глобального консенсуса относительно того, какие стратегии вмешательства являются наиболее эффективными [6, 7]. С учетом пожизненного диагноза аутистических расстройств большинство пациентов подвергаются многочисленным вмешательствам, направленным на коррекцию различных симптомов заболевания. Медицинские вмешательства при РАС, как правило, направлены в первую очередь на лечение сопутствующих симптомов, а не основных аутистических проявлений. В рамках данного систематизированного обзора терапии детей в возрасте до 12 лет с РАС [8] мы рассмотрели литературу по антипсихотикам, ингибиторам обратного захвата серотонина (ИОЗС) и стимулирующим препаратам (табл. 1). Все остальные методы лечения, за исключением секретина [9], не получили достаточных доказательств для оценки их возможных преимуществ у детей с РАС.

Методы исследования
Стратегии поиска. Проведен поиск на сайтах Medline через PubMed-интерфейс, PsycINFO (литература по психологии и психиатрии) и ERIC (Образовательные ресурсы информационного центра – учебная литература) за временной интервал с января 2000 по май 2010 г. с использованием соответствующих ключевых терминов, связанных с РАС (например, аутизм, аутистические расстройства), и терминов, относящихся к терапии (например, терапевтические аспекты). Кроме того, были проанализированы контрольные списки статей по выявлению дополнительных исследований, рассмотрены клинические исследования, связанные с терапией РАС, статьи по соответствующей тематике и нормативная информация о препаратах, одобренных для лечения раздражительности и возбудимости у пациентов с РАС (арипипразол и рисперидон).Отбор исследований. В данном обзоре проанализированы исследования, опубликованные не ранее 2000 г. и включавшие не менее 30 участников с РАС в возрасте до
13 лет. Диагноз аутистического расстройства устанавливался в соответствии с критериями DSM-IV [2] и широко используемых и являющихся «золотым стандартом» в США шкал Autism Diagnostic Observation System (ADOS) [10] и Autism Diagnostic Interview-Revised (ADI-R) [11].
Извлечение данных. Использованы стандартные формы для получения данных, касающихся дизайна исследования; описания изучаемой популяции, видов вмешательства и групп сравнения, а также базовых показателей, результатов терапии и сведений о нежелательных или побочных эффектах. Были также учтены данные о сроках проведения и методиках исследования с целью оценки качества данных. Основной интерес при проведении данного анализа представляли результаты воздействия на основные симптомы РАС или общие сопутствующие симптомы, включающие диссомнические расстройства, тревожность, гиперактивность и вызывающее поведение (например, раздражительность, ажитацию).
Оценка качества исследований. Каждое исследование, включенное в данный обзор, было оценено с помощью формы оценки качества, разработанной M.McPheeters и соавт. (2011 г.). Данная форма включала следующие критерии:
- дизайн исследования;
- диагностический подход;
- характеристика групп исследования;
- описание вмешательства;
- результаты измерений;
- статистический анализ.

Основные результаты
С учетом значительной неоднородности вмешательств и результатов, полученных в ходе проведенных исследований, которые соответствовали критериям включения в данных обзор, проведение метаанализа оказалось невозможным. В этой связи были обобщены характеристики изучаемых популяций и медицинских вмешательств и использована описательная статистика для получения результатов данного обзорного исследования.Результаты
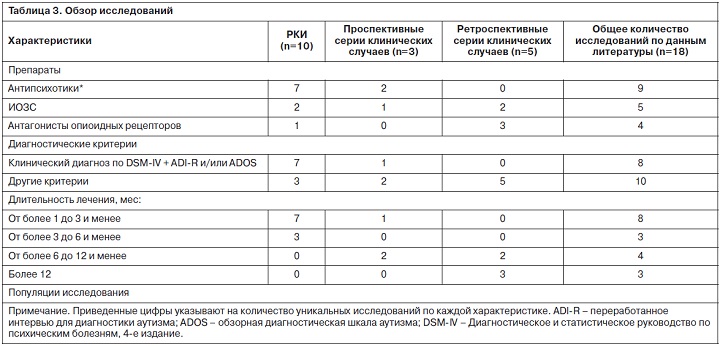
На рисунке представлены статьи, включенные в данный обзор, а в табл. 3 приведены характеристики исследований. Рассмотрено 18 уникальных исследований медицинских вмешательств у детей с РАС, 10 из которых являются рандомизированными контролируемыми (РКИ).
В 9 исследованиях назначались антипсихотические препараты [13–29], в 5 – изучалась эффективность и безопасность ИОЗС [30–34], и 4 исследования оценивали препараты группы стимуляторов [35–40].
Суммированные результаты исследований представлены в табл. 4.

В двух из четырех РКИ приоритетной целью явилось изучение влияния рисперидона на целенаправленное сложное поведение [18, 23]. Первое исследование [13, 14, 16–21] было проведено под эгидой Национального института психического здоровья в рамках научно-исследовательских подразделений детской психофармакологии (RUPP) «Autism Network». Второе исследование было организовано фирмой-производителем рисперидона (Risperdal; Ortho-McNeil-Janssen Pharmaceuticals, Inc, Titusville, NJ) [22]. Рисперидон получали 89 детей с аутистическими расстройствами, 91 ребенок составил группу сравнения с плацебо.
В обоих исследованиях было применено титрование дозы исследуемого препарата в течение 8 нед. Средняя доза рисперидона варьировала от 1,5 до 1,8 мг/сут, с ежедневным однократным суточным приемом препарата в 1-м исследовании [23], и 2 раза в сутки – во 2-м протоколе [13, 14, 16–21]. В этих двух исследованиях базовые рейтинги нецеленаправленного поведения, оцененные как девиантное поведение по шкале ABC-CI в подшкалах «раздражительность», «ажитация», «плач», в основной и контрольной группах практически не различались. Данная шкала оценки отклоняющегося поведения включает баллы от 0 до 48, где самые высокие значения соответствуют максимально выраженным поведенческим нарушениям.
В обоих исследованиях уменьшение балльной оценки по шкале ABC-CI было значительно более выражено у пациентов, получавших рисперидон (среднее снижение 12,1–14,9 балла), по сравнению с плацебо (в контрольной группе среднее значение редукции поведенческих расстройств по данной шкале составило 3,6–6,5 балла). Подобное улучшение было отмечено и по субшкалам «гиперактивность», «некомплаентность» (ABC-CH) в обоих исследованиях, оценивающих такие показатели, как гиперактивность и нецеленаправленное поведение. Базовые рейтинги ABC-CH были сопоставимыми в обеих терапевтических группах; более выраженная динамика отмечена у пациентов основной группы, получавших рисперидон (средний балл редукции симптомов составил 14,8–14,9), по сравнению с пациентами, получавшими плацебо (средний балл редукции симптомов составил 4,7–7,4).
Вторичными целями обоих исследований стало изучение влияния рисперидона на выраженность повторяющегося и стереотипного поведения, в том числе стереотипии, по субшкале ABC-CS. Базовые рейтинги по ABC-CS были сопоставимы между группами, получавшими рисперидон и плацебо, и подвергались значительно более выраженной редукции в основной группе исследований по сравнению с группой плацебо-контроля в одном РКИ (среднее снижение: 4,8 балла vs 1,7 балла) [18], однако после коррекции в ходе многократного тестирования в другом РКИ столь существенной разницы выявлено не было (в среднем данный показатель уменьшался на 4,3 балла в основной группе и на 2,4 балла в группе сравнения) [23].
В одном из проанализированных в данном обзоре исследований [16, 18] также используется шкала Children’s
Yale-Brown Obsessive Compulsive Scale (CY-BOCS), модифицированная под глубокое расстройство развития для оценки повторяющегося поведения. В данном исследовании не было обнаружено базовых различий между исследуемыми группами, однако значительно большее снижение баллов было констатировано у пациентов, принимавших рисперидон, по сравнению с группой плацебо (среднее снижение: 3,9 балла vs 1,0 балла). В ходе этого исследования проводилась оценка и ряда других клинических проявлений, таких как вызывающее поведение, гиперактивность и повторяющиеся действия, однако статистически значимых различий не обнаружено.
Два дополнительных РКИ не предусматривали конкретной числовой оценки нецеленаправленного или повторяющегося поведения [15, 24]. Одно из исследований предусматривало прием рисперидона и плацебо в течение
8 нед [15] после положительного ответа на предшествующее лечение рисперидоном в течение 4 мес [18]. В этом исследовании «рецидив» заболевания индексировался с помощью сочетания измерения по шкале ABC-CI и клинической оценки состояния [15], причем констатировано значительно меньше «рецидивов» в группе пациентов, получавших рисперидон (у 2 из 16), по сравнению с группой плацебо (у 10 из 16).
Последнее из проанализированных в данном обзоре – 6-месячное исследование оценки эффективности и
безопасности рисперидона по сравнению с плацебо с использованием разных общих оценочных шкал для оценки терапевтического ответа [24]. Авторы исследования сообщают, что средние значения по шкале Childhood Autism Rating отмечались у 20% участников исследования и более выраженное улучшение наблюдалось в группе пациентов, получавших рисперидон (11,1 балла), по сравнению с группой сравнения, принимавшей плацебо (2,5 балла) [24].
Во всех проанализированных РКИ по рисперидону в сравнении с плацебо были также представлены данные о неблагоприятных явлениях или побочных эффектах. Авторы всех четырех исследований сообщили и о повышении массы тела [14, 15, 18, 22–24], более выраженном у пациентов, получавших рисперидон (в среднем увеличение массы тела составило 2,7–2,8 кг), в то время как в группе плацебо среднее значение прибавки массы тела составило 0,8–1,7 кг [14, 18, 22, 23]. Авторы трех из четырех РКИ [14, 15, 18, 22, 23] представили также данные о других неблагоприятных явлениях, зарегистрированных в ходе проведения исследований. Вялость или сонливость были самыми частыми нежелательными явлениями в двух из этих исследований и наблюдались у 53 из 89 пациентов в группе рисперидона и у 9 из 91 – в группе плацебо, однако со временем отмечалось уменьшение сонливости у большинства пациентов [14, 18, 22, 23].
В обоих исследованиях было зарегистрировано больше случаев экстрапирамидных симптомов (в том числе тремора, дискинезии и скованности) у получавших рисперидон по сравнению с плацебо, но эти события были классифицированы по-разному авторами исследований, и статистически значимых различий между терапевтическими группами не было выявлено [14, 18, 22, 23]. Авторы одного из исследований [18] также сообщили о большем повышении уровня пролактина у пациентов, получавших рисперидон (среднее увеличение – 27,7 нг/мл), по сравнению с группой плацебо (среднее увеличение – 0,8 нг/мл) [21], хотя о таких клинических проявлениях, как гинекомастия или галакторея, которые могут быть связаны с повышенным уровнем пролактина, не сообщается. Исследования RUPP специально оценивали когнитивные функции в обеих исследуемых группах и не обнаружили снижения уровня когнитивного функционирования, а, напротив, даже некоторое улучшение когнитивных показателей в группе рисперидона, однако статистическая значимость этих данных после проведения нескольких тестирований не была подтверждена [13, 18].
В данный обзор были включены также два 8-недельных РКИ арипипразола у детей с РАС [26, 27], проведенных под эгидой фирмы-производителя арипипразола (Abilify; Otsuka America Pharmaceutical, Inc., Tokyo, Japan). Приоритетной целью этих исследований было нецеленаправленное поведение, оцениваемое по шкале ABC-CI. Эти исследования включали 213 пациентов в группе арипипразола и 103 – в группе плацебо. В одном из исследований использовали фиксированные дозы препаратов: 1 группа плацебо и 3 группы арипипразола по 5, 10 и 15 мг/сут [26]; все пациенты начинали принимать арипипразол в дозе
2 мг/сут с обязательным еженедельным титрованием до достижения целевой дозы. В другом исследовании использовался график титрования доз с еженедельной прогрессией от 2 до 15 мг/сут по клиническому впечатлению [27].
В этих двух исследованиях базовые рейтинговые показатели по шкале ABC-CI были сопоставимы в группах арипипразола и плацебо, и более значимое снижение регистрировалось у пациентов, получавших арипипразол (среднее снижение 12,4–14,4 балла), по сравнению с плацебо (среднее снижение 5,0–8,4 балла). Терапевтический ответ возрастал параллельно увеличению дозы арипипразола [26]. В целом результаты исследования, в котором использовали титрование дозы препарата на основании комплексного клинического заключения, были более выраженными [27]. Сходные показатели улучшения состояния по шкале ABC-CH выявлены в обоих исследованиях. Исходные рейтинги в группах плацебо и арипипразола были сопоставимы; более значимая редукция показателей была отмечена у пациентов, получавших арипипразол (среднее снижение 12,7–16,3 балла), в отличие от группы плацебо (среднее снижение 2,8–7,7 балла).
Вторичной целью обоих исследований стала оценка влияния арипипразола на повторяющееся и стереотипное поведение [41]. Оба исследования включали подшкалу ABC-CS. Исходные рейтинги оценки стереотипного поведения были сопоставимы у пациентов, получавших арипипразол и плацебо. Более значительное уменьшение бал-льной оценки по субшкале ABC-CS было констатировано в группе арипипразола (среднее улучшение – 4,2–4,8 балла) по сравнению с группой плацебо (среднее улучшение – 1,8–2,0 балла). Также в обоих исследованиях была использована шкала CY-BOCS, модифицированная под первазивные расстройства развития [41] для оценки повторяющихся и стереотипных действий. Не было обнаружено никаких базовых различий между исследуемыми группами, однако большее снижение баллов отмечено у пациентов, получавших арипипразол, по сравнению с группой плацебо (среднее снижение: 2,4–3,8 балла vs 0,8–1,7 балла).
Субшкала ABC-C несоответствующей речевой активности, оценивающая главным образом речевые стереотипии, также продемонстрировала значительное улучшение в первом исследовании [27] и благоприятные тенденции – во втором [26].
Эти два РКИ арипипразола также представили данные о побочных эффектах, зарегистрированных в ходе проведения исследований. Авторы обоих исследований сообщили о повышении массы тела [26, 27], более выраженном в группе арипипразола (среднее увеличение массы тела составило 1,3–2,0 кг), чем в группе плацебо (0,3–0,8 кг); в обоих исследованиях разница данных показателей была статистически значимой [26, 27]. Сонливость и седация были наиболее частыми нежелательными явлениями в обоих исследованиях (у 66 из 210 пациентов в группе арипипразола и у 8 из 101 пациента в группе плацебо) [26, 27]. Авторы обоих исследований также сообщили о более выраженных экстрапирамидных симптомах, таких как тремор, дискинезия и скованность (у 44 из 210 пациентов в группе арипипразола и у 10 из 210 пациентов в группе плацебо) [26, 27].
Оба исследования показали статистически значимое снижение уровня пролактина у пациентов в группе арипипразола в отличие от группы плацебо [26, 27]. В одном
8-недельном РКИ (40 участников) проводилось сравнение терапевтического эффекта ципрогептадина по сравнению с плацебо и галоперидолом [28]. Дозы препаратов титровали от некоторой начальной точки для ципрогептадина 0,05 мг/кг в день и галоперидола 0,2 мг/кг в день, но другие подробности исследования не были представлены. Показатели по шкале ABC-C были заметно ниже, чем средние баллы ABC-C, полученные в начале других клинических исследований [18, 23, 26, 27], что позволяет предположить, что оценка по данной субшкале была, возможно, несколько предвзятой, хотя это и не зафиксировано [28]. Терапевтический ответ в группе «плацебо + галоперидол» был менее выражен [28], чем результаты, полученные в предыдущих исследованиях галоперидола [42, 43]. Улучшение по шкале ABC-C в группе «ципрогептадин + галоперидол» было более выраженным (среднее снижение 10,9 балла), чем в группе «плацебо + галоперидол» (среднее снижение
3,7 балла) [28].
Ингибиторы обратного захвата серотонина
В данном обзоре циталопрам и эсциталопрам рассматривались вместе, поскольку эсциталопрам является активным компонентом (энантиомером) циталопрама, а результаты исследований флуоксетина анализировались отдельно. Проведено 12-недельное РКИ циталопрама [32] с целью коррекции повторяющихся и стереотипных действий. Начальная доза циталопрама составляла 2,5 мг/сут с еженедельным увеличением до максимальной дозы 20 мг/сут [32].Статистически значимых различий между пациентами, получавшими циталопрам (n=73) и плацебо (n=76), по шкале CY-BOCS, модифицированной под первазивные расстройства развития, в отношении стереотипного поведения на момент начала исследования не отмечено. Сопоставимыми оказались и результаты улучшения состояния в группах циталопрама и плацебо (среднее снижение: 2,0 балла vs 1,9 балла) соответственно. Измерение других проявлений, в частности повторяющегося поведения по шкале Repetitive Behavior Scale-Revised, также продемонстрировало сходные показатели как на начальном, так и на завершающем этапах терапии и не подтвердило достоверную эффективность циталопрама [32].
Однако при оценке вторичных целей исследования по шкале ABC-CI было доказано преимущество циталопрама. Исходные рейтинговые баллы в группах циталопрама и плацебо статистически не отличались, однако более выраженное улучшение было констатировано у 10 пациентов, принимавших циталопрам (среднее снижение 3,2 балла), по сравнению с плацебо (среднее снижение 0,9 балла) [32]. Неблагоприятные эффекты в данном исследовании включали заметное усиление «активационных» симптомов, в том числе увеличение энергии, расторможенность и диссомнические расстройства в группе пациентов, принимавших циталопрам, по сравнению с плацебо [32]. Диарея, сухость или зуд кожи также чаще отмечались в группе циталопрама.
Одно из проспективных исследований эсциталопрама также соответствовало критериям отбора в данный обзор [33]. Это 10-недельное исследование ставило целью определение фармакогенетических модификаторов терапевтического ответа в области сложного поведения по шкале АВС-CI. Пациентам (n=58) проводилось форсированное титрование дозы эсциталопрама от 2,5 мг/сут в течение недели до 20 мг/сут; большинство пациентов не переносили окончательную дозировку. К сожалению, по этому исследованию были представлены только цифровые данные, которые не позволяют делать какие-либо выводы. Очевидно, однако, что значения по шкале АВС-CI для всех пациентов на момент вступления в исследование были сопоставимы, улучшение составило 10 баллов для групп с генотипом 3 по сравнению с группой с генотипом 4 [33].
В перекрестное РКИ флуоксетина с двумя периодами 8-недельного лечения, разделенного на 4-недельный период вымывания [30], были рандомизированы 19 пациентов, принимавших сначала флуоксетин с последующим переходом на плацебо, и 20 пациентов, получавших сначала плацебо с дальнейшим переходом на флуоксетин. Во время каждого этапа исследования участники эксперимента начинали в 1-ю неделю принимать 2,5 мг/сут флуоксетина или плацебо, а затем по клиническим показаниям доза препаратов увеличивалась до 0,8 мг/кг в день в течение нескольких недель (с 4 до 8-й недели исследования). Пациенты в 1-й группе флуоксетина продемонстрировали улучшение на 1,2 балла по шкале CY-BOCS, а пациенты в 1-й группе плацебо показали улучшение на 0,5 балла. Эти различия не были статистически значимыми, если рассматривать их по отдельности. Пациенты во 2-й группе флуоксетина показали улучшение на 1,2 балла, а пациенты во 2-й группе плацебо, напротив, продемонстрировали ухудшение на 0,1 балла. Однако при совместном анализе первого и второго периодов лечения изменение оценки по шкале CY-BOCS для группы флуоксетина было значительно более выражено, чем для группы плацебо. Побочные эффекты не встречались достоверно чаще в группе флуоксетина, хотя большему числу пациентов, принимавших флуоксетин, приходилось снижать дозы препарата из-за ажитации [30].
Научно-исследовательское подразделение детской психофармакологии Национального института психического здоровья (RUPP) «Autism Network» провело двойное слепое перекрестное исследование [35–37] метилфенидата, в которое были включены 72 ребенка с аутистическими расстройствами, получавшие из 3 дней лечения в течение одного дня плацебо, затем в течение последующих 2 дней исследуемый препарат (метилфенидат) в низкой, средней или высокой дозах; дозы варьировали от 7,5 до 50,0 мг/сут. Пациенты, которые положительно реагировали на метилфенидат (n=66), переходили на этап 4-недельного двойного слепого исследования с перекрестными дозами препарата. Пациенты с положительным ответом на этапе двойной слепой фазы (n=34) завершали 8-недельную открытую фазу продолжения на наиболее оптимальных дозах. Первичной мишенью исследования были симптомы гиперактивности/некомплаентности, устанавливаемые по обучающей рейтинговой шкале ABC-CH. Клиницисты слепым методом также оценивали участников с помощью шкалы общего клинического впечатления в плане улучшения состояния (CGI-C); эта подшкала и шкала оценки гиперактивности ABC, по мнению родителей и педагогов, были объединены для оценки терапевтического ответа.
Во время двойной слепой фазы с перекрестным титрованием доз все группы с разными дозами метилфенидата продемонстрировали средний уровень терапевтического эффекта, который, однако, статистически превосходил плацебо, и по шкале оценки родителей наиболее оптимальный эффект был отмечен для средних терапевтических доз, а по оценкам учителей – для высоких доз препарата. Средние оценки родителей по субшкалам ABC-C для симптомов «вялость/социальная самоизоляция» значительно уменьшались на высоких дозах метилфенидата по сравнению с плацебо. Наиболее частой причиной для прекращения лечения (18% случаев) была раздражительность. Другие неблагоприятные эффекты включали изменения сна и аппетита, тревогу, депрессию, головную боль и диарею.
Обсуждение
Оценка литературы
Хотя многим детям с РАС в настоящее время проводятся разные медицинские вмешательства [44–46], существует поразительно мало доказательств для подтверждения очевидных преимуществ применения того или иного лекарственного средства. Тем не менее некоторые препараты продемонстрировали большую эффективность в отношении коррекции нецеленаправленного поведения, а также повторяющихся и стереотипных действий и гиперактивности. Препараты для коррекции нецеленаправленного поведения демонстрируют самые сильные доказательства в пользу их использования. Рисперидон и арипипразол являются двумя наиболее изученными препаратами для РАС, и соответствующие фармацевтические компании финансировали по меньшей мере одно РКИ для каждого из этих препаратов.По каждому препарату проведено по крайней мере два РКИ, в которых выявлено улучшение в отношении нецеленаправленного поведения и гиперактивности по оценкам родителей. Хотя эти поведенческие особенности не были основной целью коррекции в этих исследованиях, в отношении повторяющегося поведения также было отмечено улучшение как при приеме рисперидона, так и арипипразола. Оценка доказательности для терапевтического эффекта в отношении сложных и повторяющихся действий оказалась умеренной для рисперидона и высокой для арипипразола, что позволяет предположить, что дальнейшие исследования не приведут к существенным изменениям оценки эффективности этих антипсихотических препаратов. Оба препарата также могут вызывать довольно серьезные неблагоприятные последствия, включая заметное увеличение массы тела, седативный эффект и риск возникновения экстрапирамидных симптомов. Степень доказательности для неблагоприятных событий высока как для рисперидона, так и для арипипразола.
Таким образом, при окончательном анализе проведенных клинических исследований рисперидон и арипипразол оказались достаточно эффективными в отношении лечения РАС, но связанными со значительными неблагоприятными последствиями, которые ограничивают их использование для пациентов с серьезными нарушениями или органическим поражением головного мозга. Флуоксетин продемонстрировал преимущество для коррекции повторяющихся и стереотипных действий в одном РКИ с перекрестным титрованием доз; хотя этот эффект был обусловлен прежде всего 2-й группой исследования [30].
РКИ по циталопраму [32] не выявило достоверного эффекта в отношении стереотипного поведения, однако способствовало улучшению в сфере нецеленаправленного поведения. Поскольку в доступной литературе присутствуют результаты только одного РКИ хорошего качества и одного РКИ удовлетворительного качества, доказательств в отношении влияния циталопрама на уменьшение выраженности стереотипных и повторяющихся действий или нецеленаправленное поведение недостаточно. Выявлены побочные эффекты при назначении препаратов группы ИОЗС (нарушение сна и увеличение энергии) с достаточной достоверностью (два РКИ, одно из которых хорошего качества), с относительной вариабельностью в измерении результатов. Достоверных доказательств в отношении влияния стимуляторов на гиперактивность и нецеленаправленное поведение также недостаточно, поскольку было проведено только одно качественное РКИ.
Возможные направления будущих исследований
В настоящее время в литературе, касающейся лечения детей с РАС, присутствуют недостатки надлежащей организации РКИ по ряду медицинских вмешательств, недостаточно изученных на сегодняшний день. Большинство медицинских вмешательств, которые в настоящее время применяются у детей с РАС [44–46], имеют недостаточно достоверные доказательства для оценки их потенциальной эффективности или побочных эффектов. Некоторые из самых достоверных результатов исследования, свидетельствующих в пользу применения данного метода лечения, финансировались фармацевтическими компаниями или производителями медицинских устройств, получающими прибыль от лечения. Национальные институты здравоохранения профинансировали два опубликованных масштабных исследования медицинских вмешательств, но наиболее оправданным является государственное финансирование исследований лекарственных препаратов для коррекции РАС. Важно отметить, что достоверное улучшение в сфере сложного поведения, отмеченное для рисперидона и арипипразола, является основанием для дальнейшего изучения других антипсихотических препаратов, которые не вызывают столь значимого увеличения массы тела или других нарушений обмена веществ. Кроме того, препараты для коррекции гиперактивности и недостатка внимания также заслуживают дальнейшего изучения у детей с РАС.В доступной литературе по вопросам лечения РАС представлена крайне дозированная информация, что препятствует корректному представлению о соотношении положительных результатов лечения с потенциальным вредом. Данные об ИОЗС разрозненны и противоречивы, и существует особая необходимость рассмотреть такие модифицирующие факторы, как возраст и фармакогенетические параметры [33]. В самом крупном из опубликованных исследований циталопрама не отмечено никакого влияния на повторяющиеся или компульсивные действия, однако обнаружен возможный эффект на нецеленаправленное поведение (ABC-CI) [32]. Некоторые медицинские процедуры были оценены лишь в единичных исследованиях или на малых выборках пациентов и не соответствовали критериям данного обзора [47–51], в связи с чем необходимо проведение большего количества контролируемых исследований для оценки их потенциальной выгоды. На основе имеющихся данных новые методы лечения крайне необходимы для коррекции как основных симптомов аутистических расстройств, так и вторичных симптомов у пациентов с РАС.
Наконец, в современной литературе не хватает данных сравнения медикаментозной терапии и поведенческих методик и комбинации этих методов, несмотря на то что большинство детей в настоящее время получают одновременно несколько методов лечения. Этот подход оказался достоверно эффективным в исследованиях по обсессивно-компульсивному расстройству, депрессии и тревоге [52–54], но только два исследования с соответствующей численностью пациентов рассматривали комбинированное лечение рисперидона и поведенческой терапии, и недостатком этих исследований является отсутствие плацебо-контроля.
Выводы
Несколько препаратов показали преимущество в отношении коррекции сложных или повторяющихся действий, и наиболее эффективными из них являются рисперидон и арипипразол. Однако у этих препаратов выявлены значительные профили нежелательных эффектов, и, хотя эти препараты достаточно эффективны, в отношении их применения оправдана определенная осторожность у больных с органическим поражением головного мозга. Недостаточно доступных доказательств для суждения о потенциальных выгодах или негативных последствиях всех других медицинских вмешательств, используемых в настоящее время для лечения аутизма.Сведения об авторах
Ю.Б.Барыльник – д-р мед. наук, зав. каф. психиатрии, наркологии, психотерапии и клинической психологии ГБОУ ВПО Саратовский ГМУ им. В.И.Разумовского Минздрава России
Филиппова Наталья Валерьевна – канд. мед. наук, ассист. каф. психиатрии, наркологии, психотерапии и клинической психологии ГБОУ ВПО Саратовский ГМУ им. В.И.Разумовского Минздрава России. E-mail natdoc@mail.ru
Список исп. литературыСкрыть список1. Autism and Developmental Disabilities Monitoring Network. Prevalence of the Autism Spectrum Disorders (ASDs) in Multiple Areas of the United States, 2004 and 2006. Atlanta, GA. Centers for Disease Control and Prevention 2009; http://www.cdc.gov/ncbddd/ autism/states/ADDMCommunityReport2009
2. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. 4th ed. Washington, DC. American Psychiatric Association 2000.
3. Zwaigenbaum L, Bryson S, Lord C et al. Clinical assessment and management of toddlers with suspected autism spectrum disorder: insights from studies of high-risk infants. Pediatrics 2009; 123 (5): 1383–91.
4. Myers SM, Johnson CP. American Academy of Pediatrics, Council on Children With Disabilities. Management of children with autism spectrum disorders. Pediatrics 2007; 120 (5): 1162–82.
5. Myers SM. Management of autism spectrum disorders in primary care. Pediatr Ann 2009; 38 (1): 42–9.
6. National Autism Center. National Standards Report. Randolph, MA. National Autism Center 2009; http://www.nationalautismcenter
7. National Research Council, Committee on Educational Interventions for Children With Autism. Educating Children With Autism. Washington, DC. National Academies Press 2001; http://books.nap.edu/ catalog.php?record_id_10017
8. Warren Z, Veenstra-Vander Weele J, Stone W et al. Therapies for Children With Autism Spectrum Disorders. Comparative Effectiveness Review 26. (Prepared by the Vanderbilt Evidence-based Practice Center under Contract 290-02-HHSA-290-2007-10065-I.) AHRQ Publication 11-EHC035-EF. Rockville, MD. Agency for Healthcare Research and Quality 2007; www.http://effectivehealthcare.ahrq.gov/reports/final.cfm
9. Krishnaswami S, McPheeters ML, Veenstra-Vander Weele J. A systematic review of secretin for children with autism spectrum disorders. Pediatrics 2011; 127 (5); http://www.pediatrics.org/cgi/content/ full/127/5/eXXX
10. Lord C, Risi S, Lambrecht L et al. The Autism Diagnostic Observation Schedule-Generic: a standard measure of social and communication deficits associated with the spectrum of autism. J Autism Dev Dis 2000; 30 (3): 205–23.
11. Lord C, Rutter M, Le Couteur A. Autism Diagnostic Interview-Revised: a revised version of a diagnostic interview for caregivers of individuals with possible pervasive developmental disorders. J Autism Dev Dis 1994; 24 (5): 659–85.
12. Owens DK, Lohr KN, Atkins D et al. AHRQ series paper 5: grading the strength of a body of evidence when comparing medical interventions. Agency for Healthcare Research and Quality and the effective healthcare program. J Clin Epid 2010; 63 (5): 513–23.
13. Aman MG, Hollway JA, McDougle CJ et al. Cognitive effects of risperidone in children with autism and irritable behavior. J Child Adolesc Psychopharmacol 2008; 18 (3): 227–36.
14. Aman MG, Arnold LE, McDougle CJ et al. Acute and long-term safety and tolerability of risperidone in children with autism. J Child Adol Psychopharmacol 2005; 15 (6): 869–84.
15. Research Units on Pediatric Psychopharmacology Autism Network. Risperidone treatment of autistic disorder: longer-term benefits and blinded discontinuation after 6 months. Am J Psychiat 2005; 162 (7): 1361–9.
16. McDougle CJ, Scahill L, Aman MG et al. Risperidone for the core symptom domains of autism: results from the study by the autism network of the research units on pediatric psychopharmacology. Am J Psychiat 2005; 162 (6): 1142–8.
17. Martin A, Scahill L, Anderson GM et al. Weight and leptin changes among risperidone-treated youths with autism: 6-month prospective data. Am J Psychiat 2004; 161 (6): 1125–7.
18. McCracken JT, McGough J, Shah B et al. Risperidone in children with autism and serious behavioral problems. N Engl J Med 2002; 347 (5): 314–21.
19. Arnold LE, Vitiello B, McDougle C et al. Parent-defined target
symptoms respond to risperidone in RUPP autism study: customer approach to clinical trials. J Am Acad Child Adol Psychiat 2003; 42 (12): 1443–50.
20. Williams SK, Scahill L, Vitiello B et al. Risperidone and adaptive behavior in children with autism. J Am Acad Child Adol Psychiat 2006; 45 (4): 431–9.
21. Anderson GM, Scahill L, McCracken JT et al. Effects of short- and long-term risperidone treatment on prolactin levels in children with autism. Biol Psychiat 2007; 61 (4): 545–50.
22. Pandina GJ, Bossie CA, Youssef E et al. Risperidone improves behavioral symptoms in children with autism in a randomized, double-blind, placebo-controlled trial. J Autism Dev Dis 2007; 37 (2): 367–73.
23. Shea S, Turgay A, Carroll A et al. Risperidone in the treatment of disruptive behavioral symptoms in children with autistic and other pervasive developmental disorders. Pediatrics 2004; 114 (5); http://www.pediatrics.org/cgi/content/full/114/5/e634
24. Nagaraj R, Singhi P, Malhi P. Risperidone in children with autism: randomized, placebo-controlled, double-blind study. J Child Neurol 2006; 21 (6): 450–5.
25. Masi G, Cosenza A, Mucci M, Brovedani P. A 3-year naturalistic study of 53 preschool children with pervasive developmental disorders treated with risperidone. J Clin Psychiat 2003; 64 (9): 1039–47.
26. Marcus RN, Owen R, Kamen L et al. A placebo-controlled, fixed-dose study of aripiprazole in children and adolescents with irritability associated with autistic disorder. J Am Acad Child Adol Psychiat 2009; 48 (11): 1110–9.
27. Owen R, Sikich L, Marcus RN et al. Aripiprazole in the treatment of irritability in children and adolescents with autistic disorder. Pediatrics 2009; 124 (6): 1533–40.
28. Akhondzadeh S, Erfani S, Mohammadi MR et al. Cyproheptadine in the treatment of autistic disorder: a double-blind placebo-controlled trial. J Clin Pharm Ther 2004; 29 (2): 145–50.
29. Correia CT, Almeida JP, Santos PE et al. Pharmacogenetics of risperidone therapy in autism: association analysis of eight candidate genes with drug efficacy and adverse drug reactions. Pharmacogenom J 2010; 10 (5): 418–30.
30. Hollander E, Phillips A, Chaplin W et al. A placebo-controlled crossover trial of liquid fluoxetine on repetitive behaviors in childhood and adolescent autism. Neuropsychopharmacol 2005; 30 (3): 582–9.
31. DeLong GR, Ritch CR, Burch S. Fluoxetine response in children with autistic spectrum disorders: correlation with familial major affective disorder and intellectual achievement. Dev Med Child Neurol 2002; 44 (10): 652–9.
32. King BH, Hollander E, Sikich L et al. Lack of efficacy of citalopram in children with autism spectrum disorders and high levels of repetitive behavior: citalopram ineffective in children with autism. Arch Gen Psychiat 2009; 66 (6): 583–90.
33. Owley T, Brune CW, Salt J et al. A pharmacogenetic study of escitalopram in autism spectrum disorders. Autism Res 2010; 3 (1): 1–7.
34. Henry CA, Steingard R, Venter J et al. Treatment outcome and outcome associations in children with pervasive developmental disorders treated with selective serotonin reuptake inhibitors: a chart review. J Child Adolesc Psychopharmacol 2006; 16 (1–2): 187–95.
35. Research Units on Pediatric Psychopharmacology Autism Network. Randomized, controlled, crossover trial of methylphenidate in pervasive developmental disorders with hyperactivity. Arch Gen Psychiat 2005; 62 (11): 1266–74.
36. Posey DJ, Aman MG, McCracken JT et al. Positive effects of methylphenidate on inattention and hyperactivity in pervasive developmental disorders: an analysis of secondary measures. Biol Psychiat 2007; 61 (4): 538–44.
37. Jahromi LB, Kasari CL, McCracken JT et al. Positive effects of methylphenidate on social communication and self-regulation in children with pervasive developmental disorders and hyperactivity. J Autism Dev Dis 2009; 39 (3): 395–404.
38. Nickels K, Katusic SK, Colligan RC et al. Stimulant medication treatment of target behaviors in children with autism: a population based study. J Dev Behav Pediatr 2008; 29 (2): 75–81.
39. Posey DJ, Puntney JI, Sasher TM et al. Guanfacine treatment of hyperactivity and inattention in pervasive developmental disorders: a retrospective analysis of 80 cases. J Child Adol Psychopharmacol 2004; 14 (2): 233–41.
40. Stigler KA, Desmond LA, Posey DJ et al. A naturalistic retrospective analysis of psychostimulants in pervasive developmental disorders.
J Child Adol Psychopharmacol 2004; 14 (1): 49–56.
41. Scahill L, McDougle CJ, Williams SK et al. Children’s Yale-Brown Obsessive Compulsive Scale modified for pervasive developmental disorders. J Am Acad Child Adol Psychiat 2006; 45 (9): 1114–23.
42. Anderson LT, Campbell M, Adams P et al. The effects of haloperidol on discrimination learning and behavioral symptoms in autistic children. J Autism Dev Dis 1989; 19 (2): 227–39.
43. Anderson LT, Campbell M, Grega DM et al. Haloperidol in the treatment of infantile autism: effects on learning and behavioral symptoms. Am J Psychiat 1984; 141 (10): 1195–202.
44. Aman MG, Lam KS, Van Bourgondien ME. Medication patterns in patients with autism: temporal, regional, and demographic influences. J Child Adol Psychopharmacol 2005; 15 (1): 116–26.
45. Aman MG, Lam KS, Collier-Crespin A. Prevalence and patterns of use of psychoactive medicines among individuals with autism in the Autism Society of Ohio. J Autism Dev Dis 2003; 33 (5): 527–34.
46. Esbensen AJ, Greenberg JS, Seltzer MM, Aman MG. A longitudinal investigation of psychotropic and non-psychotropic medication use among adolescents and adults with autism spectrum disorders. J Autism Dev Dis 2009; 39 (9): 1339–49.
47. Amminger GP, Berger GE, Schafer MR et al. Omega-3 fatty acids supplementation in children with autism: a double-blind randomized, placebo-controlled pilot study. Biol Psychiat 2007; 61 (4): 551–3.
48. Arnold LE, Aman MG, Cook AM et al. Atomoxetine for hyperactivity in autism spectrum disorders: placebo-controlled crossover pilot trial. J Am Acad Child Adol Psychiat 2006; 45 (10): 1196–205.
49. Rossignol DA, Rossignol LW, Smith S et al. Hyperbaric treatment for children with autism: a multicenter, randomized, doubleblind, controlled trial. BMC Pediatr 2009; 9: 21.
50. Guastella AJ, Einfeld SL, Gray KM et al. Intranasal oxytocin improves emotion recognition for youth with autism spectrum disorders. Biol Psychiat 2010; 67 (7): 692–4.
51. Erickson CA, Posey DJ, Stigler KA et al. A retrospective study of memantine in children and adolescents with pervasive developmental disorders. Psychopharmacol (Berl) 2007; 191 (1): 141–7.
52. Walkup JT, Albano AM, Piacentini J et al. Cognitive behavioral therapy, sertraline, or a combination in childhood anxiety. N Engl J Med 2008; 359 (26): 2753–66.
53. Pediatric OCD Treatment Study (POTS) Team. Cognitive-behavior therapy, sertraline, and their combination for children and adolescents with obsessive-compulsive disorder: the Pediatric OCD Treatment Study (POTS) randomized controlled trial. JAMA 2004; 292 (16): 1969–76.
54. March J, Silva S, Petrycki S et al. Fluoxetine, cognitive-behavioral therapy, and their combination for adolescents with depression: Treatment for Adolescents With Depression Study (TADS) randomized controlled trial. JAMA 2004; 292 (7): 807–20.

