Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2015
Влияние депрессии при шизофрении на уровень BDNF №01 2015
Номера страниц в выпуске:12-16
C целью оценки влияния депрессии на уровень мозгового нейротрофического фактора (BDNF) у пациентов с шизофренией были обследованы 25 стационарных пациентов, которые соответствовали диагностическим критериям Международной классификации болезней 10-го пересмотра для шизофрении (F20). Обследование проводилось клинико-психопатологическим, лабораторным и психометрическим методами. Пациенты обследованы дважды: при поступлении в стационар и через 6 нед терапии. Было отмечено, что уровень BDNF у пациентов с шизофренией с депрессивной симптоматикой значимо ниже, чем у пациентов без депрессии, при этом уровень кортизола у пациентов с депрессией значимо выше.
C целью оценки влияния депрессии на уровень мозгового нейротрофического фактора (BDNF) у пациентов с шизофренией были обследованы 25 стационарных пациентов, которые соответствовали диагностическим критериям Международной классификации болезней 10-го пересмотра для шизофрении (F20). Обследование проводилось клинико-психопатологическим, лабораторным и психометрическим методами. Пациенты обследованы дважды: при поступлении в стационар и через 6 нед терапии. Было отмечено, что уровень BDNF у пациентов с шизофренией с депрессивной симптоматикой значимо ниже, чем у пациентов без депрессии, при этом уровень кортизола у пациентов с депрессией значимо выше.
Ключевые слова: шизофрения, депрессия, мозговой нейротрофический фактор.
Galina-mazo@yandex.ru
Для цитирования: Мазо Г.Э., Никифорова Ю.С., Щедрина Л.В. Влияние депрессии при шизофрении на уровень BDNF. Психиатрия и психофармакотерапия. 2015; 1: 12–16.
The influence of depression in schizophrenia at the level of BDNF
G.E.Mazo, Yu.S.Nikiforova, L.V.Schedrina
FGBU Bekhterev Research Institute. 192019, Russian Federation, Saint Petersburg, ul. Bekhtereva, d. 3;
Saint Petersburg State University. 199034, Russian Federation, Saint Petersburg, Universitetskaia nab., d. 7–9
To evaluate the effect of depression on the level of BDNF in patients with schizophrenia 25 inpatients, who met the diagnostic criteria for
ICD-10 schizophrenia (F20), were examined. The examination included clinical, psychopathological, laboratory and psychometric methods. Patients were examined twice: at admission and after 6 weeks of treatment. It was found that the level of BDNF in schizophrenic patients with depressive symptoms was significantly lower than that of non-depressed patients, and the level of cortisol in patients with depression was significantly higher.
Key words: schizophrenia, depression, BDNF.
Galina-mazo@yandex.ru
For citation: Mazo G.E., Nikiforova Yu.S., Schedrina L.V. The influence of depression in schizophrenia at the level of BDNF. Psychiatry and psichopharmacotherapy. 2015; 1: 12–16.
С современных позиций депрессию рассматривают как неблагоприятный фактор течения шизофрении. В большей степени это определяется увеличением риска суицида и ухудшением терапевтической чувствительности [19]. Интерес к этому вопросу определяется и недостаточным количеством данных о вероятностном влиянии депрессии на прогредиентность шизофренического процесса. При рассмотрении этой проблемы интерес представляет современный подход, предполагающий рассмотрение шизофрении и аффективного расстройства с позиции нейродегенерации. Следовательно, понятен интерес к анализу уровня BDNF, который может выступать в качестве маркера этого процесса. Хорошо известно, что такие нейротрофические факторы, как фактор роста нервов (NGF), нейротрофический фактор мозга (BDNF), нейротрофин-3 (NT-3) и нейротрофин 4/5 (NT-4/5), способствуют росту, дифференцировке и выживанию нервных клеток при развитии, а также участвуют в сохранении и пластичности взрослых нейронов [17, 28, 29].
Таким образом, первичные изменения в деятельности этих молекул могут привести к нежелательным изменениям в корковой схеме и синаптической передаче в мозге, которые затем могли бы привести к нейронной дисфункции, лежащей в основе психических расстройств [8]. В современной научной литературе основной акцент при оценке роли нейротрофических факторов при психических расстройствах сделан на изучении нейротрофического фактора мозга. BDNF синтезируется в эндоплазматическом ретикулуме как белковый предшественник с молекулярной массой 32 кДа и аминокислотной последовательностью в 249 аминокислотных остатков. Эффекты нейротрофинов осуществляются при их взаимодействии с тирозинкиназными рецепторами – Trk-A, Trk-B, Trk-C. В то же время все названные выше нейротрофины взаимодействуют с «универсальным» p75NTR. BDNF предпочтительно взаимодействует с Trk-B. BDNF, способный связываться с Trk-B или p75NTR, запускает внутриклеточный сигнал, ведущий к выживанию или, напротив, гибели клетки [1]. BDNF способствует росту и развитию незрелых нейронов, улучшает выживаемость и функции взрослого нейрона и помогает поддерживать синаптические соединения. Поскольку BDNF имеет важное значение для выживания нейронов, снижение его уровня может способствовать клеточной атрофии, а в некоторых случаях может привести к гибели клеток [26]. Интерес к изучению роли BDNF при психических расстройствах определяется следующими обстоятельствами: 1. В экспериментальных исследованиях показана связь BDNF с основными нейротрансмиттерами, задействованными в развитии психической патологии. Дофамин значительно вовлечен в патофизиологию и лечение шизофрении, и существует несколько известных взаимодействий между BDNF и системой дофамина. BDNF снижает потери тирозингидроксилазы, маркера дофаминергических нейронов, в культурах клеток эмбриональных крыс и вентральной части среднего мозга человека, а также защищает дофаминергические нейроны от нейротоксических агентов, таких как 6-гидроксидофамин (6-OHDA) и 1-метил-4-фенилперидин (MPPb) [43, 44]. BDNF также улучшает выживаемость нейронов дофамина в культуре [16, 36] и регулирует высвобождение мРНК рецепторов D1- и белка [24] и экспрессию D5-рецептора в развивающихся стриарных астроцитах [4]. Сообщается также о генетической связи между индуцированной антипсихотиками поздней дискинезией и взаимодействием между видами генов BDNF и D3-рецепторов [47]. 2. BDNF свободно проникает через гематоэнцефалический барьер [33]. В соответствии с этим наблюдением было показано, что уровни BDNF в сыворотке сильно коррелируют с концентрацией в центральной нервной системе [21]. В настоящее время опубликованы исследования, анализирующие уровень BDNF у пациентов с психическими расстройствами. Наиболее широко эта проблема анализируется у пациентов с депрессией в рамках аффективного расстройства. В прошлом исследования в этом направлении в значительной степени были сконцентрированы на регуляции серотонина и норадреналина, ферментах, транспортерах и рецепторах, которые модулируют эти моноаминовые системы. Недавние исследования выявили изменения внутриклеточных путей передачи сигнала и генов-мишеней, которые способствуют возможной причине депрессии. Исследования нейротрофических факторов, в частности BDNF, имели особый интерес и привели к формированию нейротрофической гипотезы депрессии [6]. Несколько сообщений показывают, что уровень в сыворотке BDNF значительно уменьшается у пациентов с депрессией [23, 41]. Это снижение отрицательно коррелирует с результатами шкалы депрессии Монтгомери–Асберга, т.е. зависит от тяжести симптомов депрессии [23]. Кроме того, имеются сообщения, демонстрирующие, что лечение антидепрессантами может обратить этот эффект [3, 11, 12]. Исследования показали, что у пациентов с депрессией сокращается объем гиппокампа и префронтальной коры [6, 39]. Снижение объема лимбических областей мозга, участвующих в аффективных расстройствах, в частности депрессии, может быть вызвано снижением трофической поддержки. Посмертный анализ гиппокампа показывает, что экспрессия BDNF уменьшается у пациентов с депрессией, совершивших самоубийство, и увеличивается у пациентов, получавших антидепрессанты на момент смерти [7, 22]. Таким образом, депрессия может быть связана с процессом нейродегенерации, что проявляется снижением уровня BDNF и уменьшением объема гиппокампа. В отношении связи уровня BDNF и шизофрении в настоящее время значительно меньше исследований и их результаты более противоречивы. Большая часть из них ориентирована на изучение связи BDNF с проводимой терапией. В обзоре G.Favalli и соавт. (2012 г.) [8] сообщается, что большинство исследований показали значительное снижение в сыворотке крови уровня BDNF у хронических и получающих лечение пациентов с шизофренией по сравнению со здоровыми добровольцами. Аналогично заметное снижение сывороточного уровня BDNF было также найдено у не получавших лечение пациентов с первым эпизодом шизофрении по сравнению со здоровыми субъектами. M.Green и соавт. (2011 г.) [13] в своем метаанализе обнаружили снижение уровня сывороточного BDNF и у пациентов, получавших и не получавших медикаментозное лечение. Но существуют исследования, которые показывают, напротив, повышение уровня BDNF у пациентов, страдающих шизофрений [10, 34], или отсутствие различий по уровню BDNF со здоровым контролем [18, 40]. Нельзя исключить, что выявленные противоречия объясняются специфичностью влияния отдельных антипсихотиков на уровень BDNF. Кроме того, можно предположить, что выраженность клинических проявлений, их разнообразие могут определять полученные результаты. В частности, есть основания предполагать влияние депрессии в структуре шизофрении на уровень BDNF. Депрессия – расстройство, в формировании которого центральная роль принадлежит гипоталамо-гипофизарно-надпочечниковой системе. Гиперкортизолемия влечет снижение уровня BDNF, что показано в экспериментальных исследованиях [20]. Цель исследования – оценить влияние депрессии на уровень BDNF у пациентов с шизофренией.
Результаты исследования
В табл. 1 приведены основные характеристики изучаемых пациентов. В процессе терапии в изучаемой выборке не произошло существенного изменения уровня BDNF. До проведения терапии этот показатель составил 21,3±7,9 нг/мл, через 6 нед терапии – 23,2±8,8 нг/мл. Уровни кортизола сыворотки также значимо не различались (до лечения 406,54±113,58 нмоль/л, через 6 нед терапии – 411,4±118,26 нмоль/л). Проведен анализ влияния длительности заболевания и количества перенесенных приступов на уровень изучаемых показателей. Данные корреляционного анализа демонстрируют наличие положительной корреляции между уровнем BDNF до лечения и длительностью заболевания и отрицательной корреляции между уровнем кортизола и длительностью заболевания (табл. 2). Проведенный анализ уровней изучаемых показателей в зависимости от пола (табл. 3) показал тенденцию к более высокому уровню BDNF до лечения у женщин. Возможно, это определяется тем, что в изучаемой выборке у пациентов мужчин определялся более высокий уровень кортизола. В процессе терапии у мужчин отмечено повышение уровня BDNF при незначительном снижении кортизола в сыворотке крови. У женщин отмечается незначительное снижение уровня BDNF при минимальном повышении кортизола. На основании шкалы CDSS были сделаны две выборки: 15 пациентов на момент первого обследования имели депрессивную симптоматику в структуре шизофренического приступа и 10 пациентов – без признаков депрессии. Группы были сопоставимы по возрасту (24,87±8,87 и 20,5±3,66 года; р=0,16). Значимые различия выявлены при сравнении группы пациентов с наличием депрессивной симптоматики в клинической картине и с ее отсутствием при первом обследовании (табл. 4). Уровень BDNF у пациентов с депрессивной симптоматикой значимо ниже, чем у пациентов без депрессии (p=0,031118). В свою очередь уровень кортизола у пациентов с депрессией значимо выше (p=0,002301). Проведен анализ половых различий в уровне BDNF в зависимости от присутствия депрессии в структуре шизофренического приступа. Полученные данные (табл. 5) свидетельствуют о статистически значимых различиях уровня BDNF у женщин. При регистрации депрессии в структуре приступа уровень BDNF был меньше при повышении уровня кортизола. У мужчин этой тенденции выявлено не было. Однако, учитывая малые выборки, включенные в анализ, полученные результаты требуют дополнительного уточнения.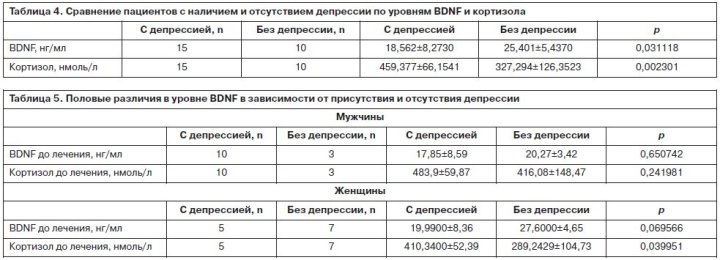
Сведения об авторах
Мазо Галина Элевна – д-р мед. наук, рук. группы эндокринологической психиатрии ФГБУ СПб НИПНИ им. В.М.Бехтерева, проф. каф. психиатрии СПбГУ. E-mail: Galina-mazo@yandex.ru
Никифорова Юлия Сергеевна – мл. науч. сотр. группы эндокринологической психиатрии ФГБУ СПб НИПНИ им. В.М.Бехтерева. E-mail: nikiforova_yulia@list.ru
Щедрина Людмила Викторовна – канд. биол. наук, зав. клинико-диагностической лабораторией, науч. сотр. ФГБУ СПб НИПНИ им. В.М.Бехтерева
Ключевые слова: шизофрения, депрессия, мозговой нейротрофический фактор.
Galina-mazo@yandex.ru
Для цитирования: Мазо Г.Э., Никифорова Ю.С., Щедрина Л.В. Влияние депрессии при шизофрении на уровень BDNF. Психиатрия и психофармакотерапия. 2015; 1: 12–16.
The influence of depression in schizophrenia at the level of BDNF
G.E.Mazo, Yu.S.Nikiforova, L.V.Schedrina
FGBU Bekhterev Research Institute. 192019, Russian Federation, Saint Petersburg, ul. Bekhtereva, d. 3;
Saint Petersburg State University. 199034, Russian Federation, Saint Petersburg, Universitetskaia nab., d. 7–9
To evaluate the effect of depression on the level of BDNF in patients with schizophrenia 25 inpatients, who met the diagnostic criteria for
ICD-10 schizophrenia (F20), were examined. The examination included clinical, psychopathological, laboratory and psychometric methods. Patients were examined twice: at admission and after 6 weeks of treatment. It was found that the level of BDNF in schizophrenic patients with depressive symptoms was significantly lower than that of non-depressed patients, and the level of cortisol in patients with depression was significantly higher.
Key words: schizophrenia, depression, BDNF.
Galina-mazo@yandex.ru
For citation: Mazo G.E., Nikiforova Yu.S., Schedrina L.V. The influence of depression in schizophrenia at the level of BDNF. Psychiatry and psichopharmacotherapy. 2015; 1: 12–16.
С современных позиций депрессию рассматривают как неблагоприятный фактор течения шизофрении. В большей степени это определяется увеличением риска суицида и ухудшением терапевтической чувствительности [19]. Интерес к этому вопросу определяется и недостаточным количеством данных о вероятностном влиянии депрессии на прогредиентность шизофренического процесса. При рассмотрении этой проблемы интерес представляет современный подход, предполагающий рассмотрение шизофрении и аффективного расстройства с позиции нейродегенерации. Следовательно, понятен интерес к анализу уровня BDNF, который может выступать в качестве маркера этого процесса. Хорошо известно, что такие нейротрофические факторы, как фактор роста нервов (NGF), нейротрофический фактор мозга (BDNF), нейротрофин-3 (NT-3) и нейротрофин 4/5 (NT-4/5), способствуют росту, дифференцировке и выживанию нервных клеток при развитии, а также участвуют в сохранении и пластичности взрослых нейронов [17, 28, 29].
Таким образом, первичные изменения в деятельности этих молекул могут привести к нежелательным изменениям в корковой схеме и синаптической передаче в мозге, которые затем могли бы привести к нейронной дисфункции, лежащей в основе психических расстройств [8]. В современной научной литературе основной акцент при оценке роли нейротрофических факторов при психических расстройствах сделан на изучении нейротрофического фактора мозга. BDNF синтезируется в эндоплазматическом ретикулуме как белковый предшественник с молекулярной массой 32 кДа и аминокислотной последовательностью в 249 аминокислотных остатков. Эффекты нейротрофинов осуществляются при их взаимодействии с тирозинкиназными рецепторами – Trk-A, Trk-B, Trk-C. В то же время все названные выше нейротрофины взаимодействуют с «универсальным» p75NTR. BDNF предпочтительно взаимодействует с Trk-B. BDNF, способный связываться с Trk-B или p75NTR, запускает внутриклеточный сигнал, ведущий к выживанию или, напротив, гибели клетки [1]. BDNF способствует росту и развитию незрелых нейронов, улучшает выживаемость и функции взрослого нейрона и помогает поддерживать синаптические соединения. Поскольку BDNF имеет важное значение для выживания нейронов, снижение его уровня может способствовать клеточной атрофии, а в некоторых случаях может привести к гибели клеток [26]. Интерес к изучению роли BDNF при психических расстройствах определяется следующими обстоятельствами: 1. В экспериментальных исследованиях показана связь BDNF с основными нейротрансмиттерами, задействованными в развитии психической патологии. Дофамин значительно вовлечен в патофизиологию и лечение шизофрении, и существует несколько известных взаимодействий между BDNF и системой дофамина. BDNF снижает потери тирозингидроксилазы, маркера дофаминергических нейронов, в культурах клеток эмбриональных крыс и вентральной части среднего мозга человека, а также защищает дофаминергические нейроны от нейротоксических агентов, таких как 6-гидроксидофамин (6-OHDA) и 1-метил-4-фенилперидин (MPPb) [43, 44]. BDNF также улучшает выживаемость нейронов дофамина в культуре [16, 36] и регулирует высвобождение мРНК рецепторов D1- и белка [24] и экспрессию D5-рецептора в развивающихся стриарных астроцитах [4]. Сообщается также о генетической связи между индуцированной антипсихотиками поздней дискинезией и взаимодействием между видами генов BDNF и D3-рецепторов [47]. 2. BDNF свободно проникает через гематоэнцефалический барьер [33]. В соответствии с этим наблюдением было показано, что уровни BDNF в сыворотке сильно коррелируют с концентрацией в центральной нервной системе [21]. В настоящее время опубликованы исследования, анализирующие уровень BDNF у пациентов с психическими расстройствами. Наиболее широко эта проблема анализируется у пациентов с депрессией в рамках аффективного расстройства. В прошлом исследования в этом направлении в значительной степени были сконцентрированы на регуляции серотонина и норадреналина, ферментах, транспортерах и рецепторах, которые модулируют эти моноаминовые системы. Недавние исследования выявили изменения внутриклеточных путей передачи сигнала и генов-мишеней, которые способствуют возможной причине депрессии. Исследования нейротрофических факторов, в частности BDNF, имели особый интерес и привели к формированию нейротрофической гипотезы депрессии [6]. Несколько сообщений показывают, что уровень в сыворотке BDNF значительно уменьшается у пациентов с депрессией [23, 41]. Это снижение отрицательно коррелирует с результатами шкалы депрессии Монтгомери–Асберга, т.е. зависит от тяжести симптомов депрессии [23]. Кроме того, имеются сообщения, демонстрирующие, что лечение антидепрессантами может обратить этот эффект [3, 11, 12]. Исследования показали, что у пациентов с депрессией сокращается объем гиппокампа и префронтальной коры [6, 39]. Снижение объема лимбических областей мозга, участвующих в аффективных расстройствах, в частности депрессии, может быть вызвано снижением трофической поддержки. Посмертный анализ гиппокампа показывает, что экспрессия BDNF уменьшается у пациентов с депрессией, совершивших самоубийство, и увеличивается у пациентов, получавших антидепрессанты на момент смерти [7, 22]. Таким образом, депрессия может быть связана с процессом нейродегенерации, что проявляется снижением уровня BDNF и уменьшением объема гиппокампа. В отношении связи уровня BDNF и шизофрении в настоящее время значительно меньше исследований и их результаты более противоречивы. Большая часть из них ориентирована на изучение связи BDNF с проводимой терапией. В обзоре G.Favalli и соавт. (2012 г.) [8] сообщается, что большинство исследований показали значительное снижение в сыворотке крови уровня BDNF у хронических и получающих лечение пациентов с шизофренией по сравнению со здоровыми добровольцами. Аналогично заметное снижение сывороточного уровня BDNF было также найдено у не получавших лечение пациентов с первым эпизодом шизофрении по сравнению со здоровыми субъектами. M.Green и соавт. (2011 г.) [13] в своем метаанализе обнаружили снижение уровня сывороточного BDNF и у пациентов, получавших и не получавших медикаментозное лечение. Но существуют исследования, которые показывают, напротив, повышение уровня BDNF у пациентов, страдающих шизофрений [10, 34], или отсутствие различий по уровню BDNF со здоровым контролем [18, 40]. Нельзя исключить, что выявленные противоречия объясняются специфичностью влияния отдельных антипсихотиков на уровень BDNF. Кроме того, можно предположить, что выраженность клинических проявлений, их разнообразие могут определять полученные результаты. В частности, есть основания предполагать влияние депрессии в структуре шизофрении на уровень BDNF. Депрессия – расстройство, в формировании которого центральная роль принадлежит гипоталамо-гипофизарно-надпочечниковой системе. Гиперкортизолемия влечет снижение уровня BDNF, что показано в экспериментальных исследованиях [20]. Цель исследования – оценить влияние депрессии на уровень BDNF у пациентов с шизофренией.
Материалы и методы
В исследование включены 25 стационарных пациентов (мужчин – 13, женщин – 12). Все пациенты соответствовали диагностическим критериям Международной классификации болезней 10-го пересмотра (МКБ-10) для шизофрении (F20). Все пациенты были госпитализированы по поводу обострения психического состояния. В исследование не включали больных, страдающих органическим заболеванием головного мозга (тяжелые травмы, острые нарушения мозгового кровообращения в анамнезе и т.д.), а также с тяжелой соматической патологией в стадии обострения. Пациенты обследовались дважды, при поступлении и через 6 нед терапии. Все получали терапию в соответствии с диагнозом и тяжестью психического состояния. Обследование носило комплексный характер и включало клинико- психопатологический, лабораторный и психометрический методы. У пациентов с шизофренией для оценки депрессивной симптоматики использовали шкалу депрессии Калгари (CDSS) [2], согласно которой депрессия определялась при сумме баллов от 5 и выше [30]. Уровень BDNF измерялся с помощью тест-системы Rand D systems ELISAs (R&D Systems, США), основанной на методе твердофазного иммуноферментного анализа (ИФА). Данная тест-система содержит рекомбинантный человеческий BDNF, вырабатываемый клетками Sf21, и антитела к рекомбинантному фактору. В основе тест-системы лежит метод количественного ИФА типа «сэндвич». На I этапе стандарты и образцы последовательно вносятся в лунки планшета и присутствующий в них BDNF связывается с антителами. На следующем этапе в лунки планшета последовательно вносятся вторые антитела к BDNF, меченные ферментом. Для оценки связавшихся комплексов «антиген–антитело» используется ферментный субстрат. Интенсивность окраски полученного раствора в лунках пропорциональна количеству BDNF, связавшегося на I этапе анализа. Полученная цветная реакция останавливается с помощью стоп-реагента, и далее оптическая плотность окончательного раствора оценивается с помощью микропланшетного фотометра. Образцы венозной крови забирали по стандартной методике и доставляли в лабораторию в течение 30 мин. Сыворотку отделяли центрифугированием при 3000 оборотов в минуту в течение 15 мин, а затем аликвотировали в пластиковые пробирки однократного применения и хранили при температуре -80°С до момента исследования. Исследуемые образцы сыворотки крови не подвергали вторичному замораживанию и использовали однократно. При постановке анализа размороженные образцы разводили в 20 раз специальным разбавителем калибратора, предлагаемым производителем тест-системы (RD6P). Для стабилизации реагентов перед началом постановки их оставляли при комнатной температуре на 30 мин. Проведение исследования с пробами пациентов предусматривало построение калибровочной кривой, для чего лиофилизированный стандарт разводили по предлагаемой схеме, где исходное значение BDNF соответствовало 4000 пг/мл, самое низкое – 62,5 пг/мл BDNF. Все образцы и стандарт анализировали в дублях. Этапы инкубации стрипов проводили при комнатной температуре (25°С) на рабочем столе, промывку лунок – с помощью автоматического промывающего устройства ELх50 (фирма «Biotek»), оценку оптической плотности лунок вели при 450 нм с помощью микропланшетного фотометра XLх800 с длиной измерения 450 нм и фильтром сравнения 570 нм. При обсчете полученных результатов рассчитывали среднее значение оптической плотности дублей. Строили калибровочную кривую, откладывая по оси Y – среднее значение оптической плотности стандартов, а по оси X – их концентрацию. Построение калибровочной кривой осуществляли с помощью программы Labtronix со специальным программным обеспечением при рекомендации использовать 4-параметрическую калибровочную кривую. При оценке концентрации BDNF учитывали фактор разведения, в связи с чем концентрацию, полученную по калибровочной кривой, умножали на фактор разведения образца. Забор крови для определения уровня кортизола проводился строго в утренние часы. Количественное определение концентрации кортизола в сыворотке пациентов проводили на автоматическом иммунохимическом анализаторе Access-2 (производитель «Beckman Coulter», США) с помощью хемилюминисцентного иммунного анализа с использованием парамагнитных частиц. В основе данного метода лежит реакция взаимодействия «антиген–антитело» с образованием комплекса, который, находясь в магнитном поле после добавления хемилюминисцентного субстрата, генерирует свечение, интенсивность которого обратно пропорциональна концентрации кортизола в пробе. Количество анализируемого вещества в пробе определяется по многоточечной калибровочной кривой. Статистические методы включали описательную статистику: среднее арифметическое, стандартное отклонение. Проведен параметрический корреляционный анализ по Пирсону и сравнительный анализ по t-критерию Стьюдента.Результаты исследования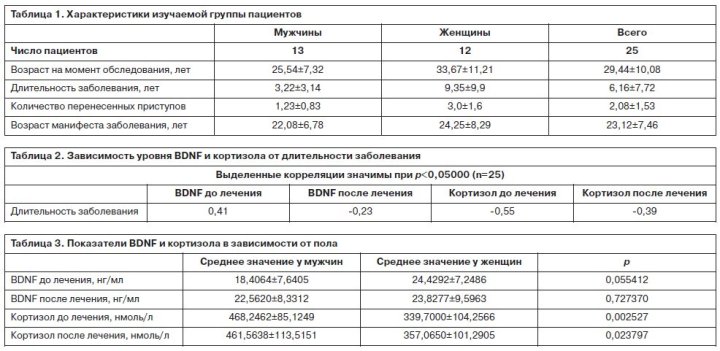
В табл. 1 приведены основные характеристики изучаемых пациентов. В процессе терапии в изучаемой выборке не произошло существенного изменения уровня BDNF. До проведения терапии этот показатель составил 21,3±7,9 нг/мл, через 6 нед терапии – 23,2±8,8 нг/мл. Уровни кортизола сыворотки также значимо не различались (до лечения 406,54±113,58 нмоль/л, через 6 нед терапии – 411,4±118,26 нмоль/л). Проведен анализ влияния длительности заболевания и количества перенесенных приступов на уровень изучаемых показателей. Данные корреляционного анализа демонстрируют наличие положительной корреляции между уровнем BDNF до лечения и длительностью заболевания и отрицательной корреляции между уровнем кортизола и длительностью заболевания (табл. 2). Проведенный анализ уровней изучаемых показателей в зависимости от пола (табл. 3) показал тенденцию к более высокому уровню BDNF до лечения у женщин. Возможно, это определяется тем, что в изучаемой выборке у пациентов мужчин определялся более высокий уровень кортизола. В процессе терапии у мужчин отмечено повышение уровня BDNF при незначительном снижении кортизола в сыворотке крови. У женщин отмечается незначительное снижение уровня BDNF при минимальном повышении кортизола. На основании шкалы CDSS были сделаны две выборки: 15 пациентов на момент первого обследования имели депрессивную симптоматику в структуре шизофренического приступа и 10 пациентов – без признаков депрессии. Группы были сопоставимы по возрасту (24,87±8,87 и 20,5±3,66 года; р=0,16). Значимые различия выявлены при сравнении группы пациентов с наличием депрессивной симптоматики в клинической картине и с ее отсутствием при первом обследовании (табл. 4). Уровень BDNF у пациентов с депрессивной симптоматикой значимо ниже, чем у пациентов без депрессии (p=0,031118). В свою очередь уровень кортизола у пациентов с депрессией значимо выше (p=0,002301). Проведен анализ половых различий в уровне BDNF в зависимости от присутствия депрессии в структуре шизофренического приступа. Полученные данные (табл. 5) свидетельствуют о статистически значимых различиях уровня BDNF у женщин. При регистрации депрессии в структуре приступа уровень BDNF был меньше при повышении уровня кортизола. У мужчин этой тенденции выявлено не было. Однако, учитывая малые выборки, включенные в анализ, полученные результаты требуют дополнительного уточнения.
Обсуждение и выводы
Нами было получено, что уровень BDNF у пациентов с шизофренией с депрессивной симптоматикой значимо ниже, чем у пациентов без депрессии, при этом уровень кортизола у пациентов с депрессией значимо выше. Эти результаты укладываются в общепринятую точку зрения о связи депрессии с гиперкортизолемией и ее влиянии на нейропластичность [31]. BDNF играет очень важную роль как в развитии, так и в пластичности взрослого мозга. Было показано, что воздействие стресса и глюкокортикоидов уменьшает экспрессию BDNF в нескольких областях мозга, включая префронтальную кору у крыс [9, 42, 45]. Также исследования указывают на повышение уровня кортикотропин-рилизинг-фактора – CRF (и уровня кортизола) у пациентов с депрессией [15]. Таким образом, наличие депрессии при шизофрении способствует большей нейродегенерации, что может быть связано с нейротоксическим действием кортизола, который значимо выше у пациентов с депрессией в структуре шизофрении. Данные о значимом снижении уровня BDNF в сыворотке при присутствии депрессии у больных шизофренией свидетельствует о выраженности нейродегенеративных процессов у данной категории пациентов. Но полученные в нашем исследовании результаты противоречат данным о повышении уровня BDNF при регистрации депрессивной симптоматики у больных шизофренией [32], в котором при обследовании 39 пациентов авторы выявили положительную корреляцию уровня BDNF и тяжести депрессивной симптоматики, оцениваемой по шкале CDSS. Противоречивость результатов может определяться различиями в этапах обследования пациентов. В нашем исследовании обследование пациентов проводилось в период обострения шизофрении, в то время как в исследовании C.Noto и соавт. включались амбулаторные пациенты после купирования острой симптоматики. Эти данные еще раз подтверждают положение о клинических и, возможно, патофизиологических различиях при депрессии в структуре приступа шизофрении и депрессии, развивающейся в период стабилизации процесса. Интерес представляют полученные данные о половых различиях в уровне BDNF. В обзоре Y.Wuet (2013 г.) [46] отмечается недостаточное количество данных о половых различиях в уровне BDNF у больных шизофренией. Основные предположения получены в эксперименте на моделях шизофрении. Вместе с тем имеется большой пласт литературы, свидетельствующей о существовании половых различий в течении шизофрении. Эпидемиологические исследования показали, что заболевание манифестирует у мужчин в более раннем возрасте (15–24 года), чем у женщин (20–29 лет) [5, 14]. При этом у женщин зарегистрирован второй пик манифеста шизофрении (45 лет), который совпадает с периодом менопаузального перехода [35]. Выявлены половые различия в течении шизофренического процесса. Так, у женщин заболевание протекает более мягко, и отмечается лучшая чувствительность к антипсихотической терапии [38]. Но это не относится к женщинам старшего возраста. После 45 лет отмечается ухудшение в течении болезненного процесса [25]. Эти данные дают возможность предположить протективное влияние эстрогена у молодых женщин, страдающих шизофренией [27, 37, 46]. Возможно, уровень BDNF у женщин, зарегистрированный в нашем исследовании, связан с тем, что в исследовании преобладали пациенты молодого возраста, т.е. определяется влиянием половых стероидов (эстрогена) на нейродегенеративные процессы. С другой стороны, присутствие депрессии в большей степени влияло на снижение уровня BDNF именно у женщин. Возможно, это связано с задействованностью гипоталамо-гипофизарно-половой оси в формировании депрессивной симптоматики. Вместе с тем этот вопрос требует дополнительного изучения, так как изменение уровня BDNF может определяться и особенностями проводимой терапии.Сведения об авторах
Мазо Галина Элевна – д-р мед. наук, рук. группы эндокринологической психиатрии ФГБУ СПб НИПНИ им. В.М.Бехтерева, проф. каф. психиатрии СПбГУ. E-mail: Galina-mazo@yandex.ru
Никифорова Юлия Сергеевна – мл. науч. сотр. группы эндокринологической психиатрии ФГБУ СПб НИПНИ им. В.М.Бехтерева. E-mail: nikiforova_yulia@list.ru
Щедрина Людмила Викторовна – канд. биол. наук, зав. клинико-диагностической лабораторией, науч. сотр. ФГБУ СПб НИПНИ им. В.М.Бехтерева
Список исп. литературыСкрыть список1. Гомазков О.А. Старение мозга и нейротрофическая терапия. М.: ИКАР, 2011. / Gomazkov O.A. Starenie mozga i neirotroficheskaia terapiia. M.: IKAR, 2011. [in Russian]
2. Addington D, Addington J, Schissel BA. Calgary depression scale for schizophrenia. Schizophr Res 1990; 3: 247–51.
3. Aydemir O, Deveci A, Taneli F. The effect of chronic antidepressant treatment on serum brain-derived neurotrophic factor levels in depressed patients: a preliminary study. Prog Neuropsychopharmacol Biol Psychiat 2005; 29: 261−5.
4. Brito V, Beyer C, Kuppers E. BDNF-dependent stimulation of dopamine D5-receptor expression in developing striatal astrocytes involves PI3-kinase signaling. Glia 2004; 46 (3): 284–95.
5. Castle D, Sham P, Murray R. Differences in distribution of ages of onset in males and females with schizophrenia. Schizophr Res 1998; 33: 179–83.
6. Duman RS. Role of neurotrophic factors in the etiology and treatment of mood disorders. Neuromolecular Med 2004; 5: 11−25.
7. Dwivedi Y, Rizavi HS, Conley RR et al. Altered gene expression of brain-derived neurotrophic factor and receptor tyrosine kinase B in postmortem brain of suicide subjects. Arch Gen Psychiat 2003; 60: 804−15.
8. Favalli G, Li J, Belmonte de Abreu P et al. The role of BDNF in the pathophysiology and treatment of schizophrenia. J Psychiat Research 2012; 46: 1–11.
9. Fumagalli F, Bedogni F, Perez J et al. Corticostriatal brainderived neurotrophic factor dysregulation in adult rats following prenatal stress. Eur J Neuro Sci 2004; 20: 348–54.
10. Gama CS, Andreazza AC, Kunz M. Serum levels of brain-derived neurotrophic factor in patients with schizophrenia and bipolar disorder. Neuroscience Letters 2007; 420 (1): 45–8.
11. Gervasoni N, Aubry JM, Bondolfi G et al. Partial normalization of serum brain-derived neurotrophic factor in remitted patients after a major depressive episode, Neuropsychobiol 2005; 51 (4): 234–8.
12. Gonul AS, Akdeniz F, Taneli F et al. Effect of treatment on serum brain-derived neurotrophic factor levels in depressed patients. Eur Arch Psychiat Clin Neurosci 2005; 255: 381−6.
13. Green MJ, Matheson SL, Shepherd A et al. Brain-derived neurotrophic factor levels in schizophrenia: a systematic review with meta-analysis. Molecular Psychiat 2011; 16 (9): 960–72.
14. Hambrecht M, Maurer K. Gender differences in schizophrenia in three cultures. Results of the WHO collaborative study on psychiatric disability. Soc Psychiat Epid 1992; 27: 117–21.
15. Hauger RL, Risbrough V, Oakley RH et al. Role of CRF receptor signaling in stress vulnerability, anxiety, and depression. Ann NY Acad Sci 2009; 1179: 120–43.
16. Höglinger GU, Sautter J, Meyer M et al. Rat fetal ventral mesencephalon grown as solid tissue cultures: influence of culture time and BDNF treatment on dopamine neuron survival and function. Brain Research 1998; 813 (2): 313–22.
17. Huang EJ, Reichardt LF. Neurotrophins: roles in neuronal development and function. Ann Rev Neuroscience 2001; 24: 677–736.
18. Huang TL, Lee CT. Associations between serum brain-derived neurotrophic factor levels and clinical phenotypes in schizophrenia patients. J Psychiat Research 2006; 40 (7): 664–8.
19. Hunt IM, Kapur N, Robinson J et al. National confidential inquiry into suicide and homicide by people with mental illness. J Psychiat Pract 2006; 12 (3): 139–47.
20. Issa G et al. An inverse relationship between cortisol and BDNF levels in schizophrenia: Data from human postmortem and animal studies. Neurobiol Disease 2010; 39: 327–33.
21. Karege F, Schwald M, Cisse M. Postnatal developmental profile of brain-derived neurotrophic factor in rat brain and platelets. Neuroscience Letters 2002; 328 (3): 261–4.
22. Karege F, Bondolfi G, Gervasoni N et al. Low brain-derived neurotrophic factor (BDNF) levels in serum of depressed patients probably results from lowered platelet BDNF release unrelated to platelet reactivity. Biol Psychiat 2005; 57: 1068−72.
23. Karege F, Perret G, Bondolfi G et al. Decreased serum brain-derived neurotrophic factor levels in major depressed patients. Psychiat Res 2002; 109: 143−8.
24. Kerr B, Kuzhikandathil EV. Brain-derived neurotrophic factor regulates the expression of D1-dopamine receptors. J Neurochemist 2007; 100 (2): 416–28.
25. Koster A, Lajer M, Lindhardt A, Rosenbaum B. Gender differences in first episode psychosis. Soc Psychiat Epid 2008; 43: 940–6.
26. Kozisek ME, Middlemas D, Bylund DB. Brain-derived neurotrophic factor and its receptor tropomyosin-related kinase B in the mechanism of action of antidepressant therapies. Pharmacol Therapeutics 2008; 117: 30–51.
27. Kulkarni J, Castella de A, Fitzgerald PB et al. Estrogen in severe mental illness: a potential new treatment approach. Arch Gen Psychiat 2008; 65: 955–60.
28. Lewin GR, Barde YA. Physiology of the neurotrophins. Ann Rev Neuroscience 1996; 19: 289–317.
29. Maisonpierre PC, Belluscio L, Friedman B et al. NT-3, BDNF, and NGF in the developing rat nervous system: parallel as well as reciprocal patterns of expression. Neuron 1990; 5 (4): 501–9.
30. Matthias J Müller. The Calgary Depression Rating Scale for schizophrenia in a healthy control group: Psychometric properties and reference values. J Affect Dis 2005; 88: 69–74.
31. McEwen BS. Central effects of stress hormones in health and disease: understanding the protective and damaging effects of stress and stress mediators. Eur J Pharmacol 2008; 583: 174–85.
32. Noto CS et al. Association of biomarkers and depressive symptoms in schizophrenia. Neuroscience Letters 2011; 505: 282–5.
33. Pan W, Banks WA, Fasold MB et al. Transport of brain-derived neurotrophic factor across the blood-brain barrier. Neuropharmacol 1998; 37 (12): 1553–61.
34. Reis HJ, Nicolato R, Barbosa IG et al. Increased serum levels of brain-derived neurotrophic factor in chronic institutionalized patients with schizophrenia. Neuroscience Letters 2008; 439 (2): 157–9.
35. Riecher-Rossler A, Loffler W, Munk-Jorgensen P. What do we really know about late-onset schizophrenia? Eur Arch Psychiat Clin Neurosci 1997; 247: 195–208.
36. Sauer H, Fischer W, Nikkhah G et al. Brain-derived neurotrophic factor enhances function rather than survival of intrastriatal dopamine cell-rich grafts. Brain Research 1993; 626 (1–2): 37–44.
37. Seeman MV. Interaction of sex, age, and neuroleptic dose. Compr Psychiat 1983; 24: 125–8.
38. Seeman MV, Lang M. The role of estrogens in schizophrenia gender differences. Schizophr Bull 1990; 16: 185–94.
39. Sheline YI, Gado MH, Kraemer HC. Untreated depression and hippocampal volume loss. Am J Psychiat 2003; 160: 1516−8.
40. Shimizu E, Hashimoto K, Watanabe H et al. Serum brain-derived neurotrophic factor (BDNF) levels in schizophrenia are indistinguishable from controls. Neuroscience Letters 2003; 351 (2): 111–4.
41. Shimizu E, Hashimoto K, Okamura N et al. Alterations of serum levels of brain-derived neurotrophic factor (BDNF) in depressed patients with or without antidepressants. Biol Psychiat 2003; 54: 70−5.
42. Smith MA, Makino S, Kvetnanský R, Post RM. Effects of stress on neurotrophic factor expression in the rat brain. Ann NY Acad Sci 1995; 771: 234–9.
43. Spenger C, Hyman C, Studer L et al. Effects of BDNF on dopaminergic, serotonergic, and GABAergic neurons in cultures of human fetal ventral mesencephalon. Experim Neurol 1995; 133 (1): 50–63.
44. Spina MB, Squinto SP, Miller J et al. Brain-derived neurotrophic factor protects dopamine neurons against 6-hydroxydopamine and N-methyl-4-phenylpyridinium ion toxicity: involvement of the glutathione system. J Neurochemistry 1992; 59 (1): 99–106.
45. Ueyama T, Kawai Y, Nemoto K et al. Immobilization stress reduced the expression of neurotrophins and their receptors in the rat brain. Neurosci Res 1997; 28: 103–10.
46. Wuet YC et al. Sex differences and the role of estrogen in animal models of schizophrenia: interaction with BDNF. Neuroscience 2013; 239: 67–83.
47. Zai CC, Tiwari AK, Luca de V et al. Genetic study of BDNF, DRD3, and their interaction in tardive dyskinesia. Europ Neuropsychopharmacol 2009; 19 (5): 317–28.

