Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№02 2016
Влияние препарата Стрезам® на психические, соматические и когнитивные аспекты тревожных расстройств у пациентов с хронической ишемией головного мозга №02 2016
Номера страниц в выпуске:41-47
Распространенность тревожных расстройств (ТР) при хронической ишемии мозга (ХИМ) достигает 70%. Тесная патогенетическая взаимосвязь тревоги и ХИМ способствует затяжному течению ТР, что значительно ухудшает качество жизни и реабилитационный потенциал этой категории больных. В качестве анксиолитической терапии широко используются препараты бензодиазепинового ряда. Актуальной задачей является поиск лекарственных средств, не отличающихся по эффективности от бензодиазепиновых анксиолитиков, но при этом лишенных их недостатков.
Цель исследования: уточнение эффективности этифоксина (Стрезам®) в отношении выраженности психологических, соматоформных и когнитивных нарушений, ассоциированных с ТР при ХИМ.
Проведено проспективное наблюдательное исследование у 30 пациентов, страдающих дисциркуляторной энцефалопатией I и II стадии. Результаты исследования показывают, что анксиолитик этифоксин (Стрезам®) эффективен у больных с ХИМ в отношении как психических, так и соматоформных и когнитивных нарушений, ассоциированных с тревогой. Этифоксин не оказывает отрицательного влияния на психомоторные и когнитивные функции, мышечный тонус, к нему не формируются зависимость, толерантность, не возникает синдрома отмены, что обосновывает его применение в качестве корректора тревожных нарушений при ХИМ.
Ключевые слова: дисциркуляторная энцефалопатия, тревожные расстройства, хроническая ишемия мозга, этифоксин, Стрезам.
Распространенность тревожных расстройств (ТР) при хронической ишемии мозга (ХИМ) достигает 70%. Тесная патогенетическая взаимосвязь тревоги и ХИМ способствует затяжному течению ТР, что значительно ухудшает качество жизни и реабилитационный потенциал этой категории больных. В качестве анксиолитической терапии широко используются препараты бензодиазепинового ряда. Актуальной задачей является поиск лекарственных средств, не отличающихся по эффективности от бензодиазепиновых анксиолитиков, но при этом лишенных их недостатков.
Цель исследования: уточнение эффективности этифоксина (Стрезам®) в отношении выраженности психологических, соматоформных и когнитивных нарушений, ассоциированных с ТР при ХИМ.
Проведено проспективное наблюдательное исследование у 30 пациентов, страдающих дисциркуляторной энцефалопатией I и II стадии. Результаты исследования показывают, что анксиолитик этифоксин (Стрезам®) эффективен у больных с ХИМ в отношении как психических, так и соматоформных и когнитивных нарушений, ассоциированных с тревогой. Этифоксин не оказывает отрицательного влияния на психомоторные и когнитивные функции, мышечный тонус, к нему не формируются зависимость, толерантность, не возникает синдрома отмены, что обосновывает его применение в качестве корректора тревожных нарушений при ХИМ.
Ключевые слова: дисциркуляторная энцефалопатия, тревожные расстройства, хроническая ишемия мозга, этифоксин, Стрезам.
official@semashko.nnov.ru
Для цитирования: Густов А.В., Антипенко Е.А., Александрова Е.А. и др. Влияние препарата Стрезам® на психические, соматические и когнитивные аспекты тревожных расстройств у пациентов с хронической ишемией головного мозга. Психиатрия и психофармакотерапия. 2016; 18 (2): 41–47.
The effect of the drug Stresam® for anxiety disorders in patients with chronic cerebral ischemia
A.V.Gustov1, E.A.Antipenko1, E.A.Aleksandrova1, E.V.Parshina2, I.V.Borodachyova2, K.M.Belyakov2
1 Nizhny Novgorod State Medical Academy of the Ministry of Health of the Russian Federation. 603005, Russian Federation, Nizhny Novgorod, pl. Minina i Pozharskogo, d. 10/1;
2 N.A.Semashko Nizhniy Novgorod Regional Clinical Hospital. 603126, Russian Federation, Nizhny Novgorod, ul. Rodionova, d. 190
The prevalence of anxiety disorders in patients with chronic brain ischemia (CBI) reaches 70%. A close pathogenetic relationship of anxiety and CBI contributes to protracted duration of anxiety disorders (AD). This greatly worsen the quality of life and rehabilitation potential of this category of patients. As anxiolytic therapy is widely used drugs benzodiazepine. The actual problem is to find the drugs, which do not differ on the effectiveness of benzodiazepine anxiolytics, but without their drawbacks. Objective: to clarify the effectiveness etifoxine (Strezam®) in respect of the severity of the psychological, cognitive and somatoform disorders associated with AD in CBI. There was a prospective observational study of 30 patients with CBI I and II stages. There was a prospective observational study of 30 patients with discirculatory encephalopathy I and II stages.
The study results show that the anxiolytic drug etifoxine (Strezam®) is effective in patients with CBI with respect to mental health, somatoform and cognitive disorders associated with anxiety. Etifoxine has no adverse effects on psychomotor and cognitive function, muscle tone, it has not formed dependence, tolerance, withdrawal syndrome does not occur, which justifies its use as a corrector of AD in patients with CBI.
Key words: dyscirculatory encephalopathy, anxiety disorders, chronic brain ischemia, etifoxine, Strezam.
official@semashko.nnov.ru
For citation: Gustov A.V., Antipenko E.A., Aleksandrova E.A. et al. The effect of the drug Stresam® for anxiety disorders in patients with chronic cerebral ischemia. Psychiatry and Psichopharmacotherapy. 2016; 18 (2): 41–47.
Введение
Тревожные расстройства (ТР) являются одним из наиболее частых коморбидных расстройств в неврологической практике. Так, было показано, что частота раннего генерализованного ТР (ГТР) у больных, перенесших острое нарушение мозгового кровообращения, достигает 27%; позднего ГТР (после 3 мес) – 23% [24, 38].
У пациентов, страдающих неврологическими заболеваниями, может иметь место ситуационная тревога, представляющая собой реакцию на стресс (в том числе заболевание) или расстройство адаптации, коморбидные болезни. С другой стороны, при неврологической патологии может проявляться первичная, личностная тревога как имевшаяся ранее преморбидная особенность личности. Распространенность ТР при хронической ишемии мозга (ХИМ) достигает 70%. Нами ранее было показано, что уровень тревоги у этих больных коррелирует со степенью выраженности клинических проявлений хронической ишемии головного мозга (ГМ) [2].
Патогенез тревоги при ХИМ носит сложный характер и связан с целым комплексом причин: нарушением кровоснабжения эмоциогенных зон ГМ, функциональным дефицитом серотонинергической системы, сложной дизрегуляцией норадренергической системы, ассоциированной с повышением уровня кортизола. Считается, что повреждающее действие кортизола на гиппокамп способствует развитию когнитивных нарушений (КН) [17, 18, 21–23]. При хронической ишемии ГМ развивается снижение чувствительности рецепторного комплекса бензодиазепинового рецептора к g-аминомасляной кислоте (ГАМК), приводящее к недостаточности связывания ГАМК. При этом не происходит ГАМК-опосредованной гиперполяризации нейронов за счет открытия хлорных каналов и не возникает торможения избыточной нейрональной активности, развиваются гипервозбудимость нейронов, психическая и вегетативная активация, приводящие не только к психическим, но и соматическим проявлениям тревоги [3, 9, 22, 28, 36].
Изменение нейропластичности в условиях ХИМ приводит к нарушению взаимодействия в системе вентрального аффективного круга, включающего в себя билатеральные медиальные вентральные структуры – миндалина, вентральный стриатум, орбитофронтальная кора, пре- и субколенная поясная извилина, также нарушение взаимодействия вентрального аффективного круга с дорсальными структурами – дорсальной поясной извилиной и дорсолатеральной префрональной корой – способствует формированию ТР у пациентов с цереброваскулярной недостаточностью [25].
Тесная патогенетическая взаимосвязь тревоги и ХИМ способствует затяжному течению ТР, что значительно ухудшает качество жизни (КЖ) и реабилитационный потенциал этой категории больных [27, 29, 39, 41, 43, 47, 48].
Между тем имеется тенденция к гиподиагностике ТР в рутинной неврологической практике. Этому способствует более пристальное внимание пациентов и врачей к вегетативным проявлениям тревоги, которые зачастую расцениваются как проявления органической патологии, вследствие чего больные не получают адекватной анксиолитической терапии. В соответствии с диагностическими критериями ГТР (Международная классификация болезней 10-го пересмотра) облигатными симптомами тревоги являются соматические (вегетативные) проявления, представленные целым спектром жизненно важных для пациента расстройств: сердечно-сосудистых, дыхательных, неврологических, желудочно-кишечных, мочеполовых, терморегуляторных, двигательных [17, 18, 34].
Использование шкал и опросников позволяет выявить ТР даже у тех больных, которые не предъявляют самостоятельных жалоб на психический дискомфорт. В диагностике ТР у пациентов с ХИМ хорошо зарекомендовала себя шкала Гамильтона, которая позволяет обнаружить не только собственно аффективные, но и психосоматические нарушения, сопутствующие эмоционально-волевым и когнитивным расстройствам у пациентов с дисциркуляторной энцефалопатией (ДЭ) [15, 23, 30].
В качестве анксиолитической терапии широко используются препараты бензодиазепинового ряда (феназепам, алпразолам, лоразепам и др.). Это обусловлено способностью бензодиазепиновых анксиолитиков потенцировать действие ГАМК благодаря аллостерическому модулированию ГАМК-ионофорного комплекса. Препараты бензодиазепинового ряда обладают широким спектром действия, включая анксиолитический, седативный, противосудорожный, миорелаксирующий, вегетостабилизирующий и мягкий анальгетический эффект [20, 26]. В то же время для транквилизаторов бензодиазепинового ряда характерны такие побочные эффекты, как чрезмерная седация, нарушение координации, внимания, мышечная слабость, поведенческое дезингибирование, нарушения когнитивных функций (КФ), привыкание и синдром отмены при длительном приеме. Актуальной задачей является поиск лекарственных средств, не отличающихся по эффективности от бензодиазепиновых анксиолитиков, но при этом лишенных их недостатков [8, 26]. К таким препаратам относится этифоксин, производимый фармацевтической компанией «Биокодекс» (Франция). Впервые данные об этифоксине как о потенциально психотропном соединении появились в 1970-е годы [10]. За период с 1995 по 2007 г. этифоксин был использован для лечения более 11,3 млн пациентов. Препарат был зарегистрирован более чем в 40 странах мира. В Российской Федерации он зарегистрирован в 2008 г. под торговым названием Стрезам®. Механизм лечебного эффекта этифоксина заключается в том, что он взаимодействует с b-субъединицей ГАМКА-рецептора, что даже в отсутствие ГАМК приводит к активации рецептора, а в присутствии же ГАМК – потенцирует ее эффекты [32, 45]. Особенностью фармакодинамики этифоксина является аллостерическая модификация конформации ГАМКА-рецепторного комплекса, вследствие которой увеличивается число сайтов связывания с эндо- и экзогенными лигандами, не влияя на аффинитет связывания с ними [44, 46]. Этифоксин воздействует на митохондриальные рецепторы, контролирующие биосинтез нейростероидов в глиальных клетках, которые, в свою очередь, являются модуляторами ГАМКергической нейротрансмиссии [46]. В экспериментах на животных было показано, что одним из нейростероидов, опосредующих анксиолитическое действие этифоксина, является аллопрегнанолон. Доказательством существования этого механизма является то, что препараты, блокирующие синтез центральных стероидов, – индометацин и финастерид – значительно ослабляют анксиолитическую активность этифоксина, в то время как прогестерон, повышающий продукцию нейростероидов в центральной нервной системе, потенцирует анксиолизис [42]. Два обозначенных механизма усиления ГАМКергической нейротрансмиссии в центральной нервной системе (нейростероидный и аллостерический) являются взаимодополняющими.
Благодаря принципиально иному механизму действия этифоксин лишен негативных побочных эффектов, свойственных бензодиазепиновым транквилизаторам, – влияния на психомоторные функции и КФ, у него отсутствуют седация и миорелаксация [35]. Наличие благоприятного профиля переносимости этифоксина позволяет назначать его как пожилым, так и активно работающим людям. Продолжительность среднего курса терапии обычно составляет от 2 нед до 3 мес, эффект появляется уже на 1-й неделе лечения [14, 44]. Этифоксин не вызывает развития зависимости, толерантности и синдрома отмены. Противопоказаниями являются индивидуальная гиперчувствительность, шоковое состояние, миастении, печеночная и почечная недостаточность. Препарат назначают в суточной дозе 150–200 мг. Дозировка и продолжительность курса терапии определяются течением заболевания и динамикой клинического ответа.
Было доказано, что этифоксин достоверно уменьшает выраженность ТР, частоту панических пароксизмов и проявления кардиоваскулярной и респираторной дизрегуляции [1, 4, 5].
При изучении эффективности этифоксина у больных с соматоформными и психосоматическими расстройствами было установлено, что помимо выраженного уменьшения ситуативной и личностной тревоги препарат достоверно улучшал настроение у пациентов с депрессивными проявлениями легкой степени тяжести [12, 16].
Цель настоящего исследования: оценить влияние этифоксина (Стрезам®) на психические, соматические и когнитивные аспекты тревоги при хронической ишемии ГМ.
Материалы и методы
Под наблюдением находились 30 пациентов с ДЭ I стадии (14 человек) и II стадии (16 человек) в возрасте от 45 до 65 лет (средний возраст 58,8±7,4 года). Исследование носило характер открытого проспективного наблюдательного. В исследование включались мужчины и женщины в возрасте от 40 до 65 лет с клинически и инструментально подтвержденным диагнозом ДЭ I и II стадии, сопровождавшейся ТР, с уровнем тревоги не менее 17 баллов по шкале Гамильтона. Все больные подписали информированное согласие на участие в исследовании.
Во время наблюдения и за 3 мес до включения в исследования пациенты не получали вегетотропные и психотропные препараты. Этифоксин (Стрезам®) назначался в суточной дозе 150 мг, разделенной на 3 приема, в течение 6 нед. Уровень тревоги оценивался по шкале Гамильтона, степень выраженности нейродинамических нарушений исследовалась в пробе Шульте; уровень КН оценивался по Краткой шкале оценки психического статуса (КШОПС). Уровень дневной сонливости оценивался по Шкале сонливости (Epworth).
Критериями исключения были: декомпенсированная соматическая патология, онкологические заболевания, уровень КН по данным КШОПС менее 22 баллов.
Шкала тревоги Гамильтона (HAM-A – Hamilton Anxiety Scale) – это клиническая рейтинговая шкала, предназначенная для измерения тяжести ТР пациента, состоящая из 14 показателей, каждый из которых определяется рядом симптомов – тревожное настроение, напряжение, страхи, инсомния, интеллектуальные нарушения, депрессивное настроение, соматические мышечные симптомы, соматические сенсорные симптомы, сердечно-сосудистые симптомы, респираторные симптомы, гастроинтестинальные симптомы, мочеполовые симптомы, вегетативные симптомы, поведение при осмотре.
Каждый показатель оценивался по 5-балльной шкале от 0 (отсутствует) до 4 (тяжелый). Заполнение HAM-A происходило в процессе полуструктурированного интервью, во время которого шел сбор анамнестических сведений и проводилось наблюдение за поведением и другими невербальными проявлениями исследуемых психопатологических феноменов. Самим пациентам шкала не предъявлялась, прямые вопросы не задавались. Для получения общего балла, отражающего уровень тяжести ТР, проводилось сложение баллов по всем пунктам. Кроме того, отдельно оценивались первые 6 пунктов шкалы – как проявления тревоги в психической сфере, а остальные 8 – как проявления тревоги в соматической сфере. Критерием эффективности терапии является более чем 50% снижение суммарного балла по сравнению с начальным [1].
КШОПС предназначалась для оценки степени нарушений КФ обследуемого. КШОПС оценивает такие КФ пациента, как: ориентацию в месте и времени, кратковременную память, устный счет, внимание, речь, восприятие, узнавание, способность к письму, чтению, рисованию, восприятию логических конструкций, выполнению последовательных действий. Тест включает в себя 9 частей, каждая из которых разбита на более мелкие пункты (всего 30 пунктов). За правильное выполнение каждого пункта начисляется 1 балл (максимум 30 баллов). При оценке результатов 28–30 баллов определяется как норма; 24–27 баллов – умеренные КН; 20–23 балла – деменция легкой степени; 11–19 баллов – деменция средней степени; 0–10 баллов – деменция тяжелой степени. Изучение КШОПС предназначено для оценки в качестве скрининга, а также для изучения динамики состояния (прогрессирование, улучшение или стабилизация состояния на фоне лечения) [6, 7].
Проба Шульте проводилась с помощью 5 специальных таблиц, в которых числа от 1 до 25 расположены в случайном порядке. Пациент должен указать все числа по порядку. Врач отмечает время, потраченное на каждую таблицу, и количество ошибок. В норме на 1 таблицу затрачивается не более 45 с [6].
Шкала сонливости (Epworth) позволяла уточнить особенности дневной сонливости больного в разных жизненных ситуациях – при чтении; просмотре телевизионных программ; в условиях, не требующих активности; при нахождении в транспорте в качестве пассажира при езде менее 1 ч; во второй половине дня во время отдыха (при наличии такой возможности); в транспорте при разговоре с кем-нибудь; после приема пищи (без алкоголя); в условиях автомобильной пробки. В случаях если исследуемый не оказывался в описанных ниже условиях, то необходимо было дать предположительный ответ. Каждому вопросу нужно дать ответ, оценив сонливость по следующей системе: 0 баллов – нет сонливости, 1 балл – слабая сонливость, 2 балла – средняя сонливость, 3 балла – сильная сонливость. Результаты оценивались следующим образом: более 5 баллов – выраженная дневная сонливость, при которой следует обратить внимание на качество или продолжительность сна. Если число баллов более 10, то, возможно, у пациента имелась повышенная потребность во сне [7].
Обследование пациентов проводилось до начала лечения, спустя 2, 4 и 6 нед терапии.
На протяжении всего курса терапии больные получали привычные дозы гипотензивных, гиполипидемических, антиагрегантных препаратов; дозы не менялись на фоне терапии этифоксином.
Статистическая обработка материала выполнена с помощью пакета прикладных программ Statistica 6.0. Для характеристики полученных данных использовались критерии описательной статистики: среднее арифметическое, среднеквадратичное отклонение. Проводилась оценка различия средних для двух групп с применением критерия Вилкоксона. Различие считалось статистически достоверным при р<0,05 [19].
Результаты и обсуждение

Оценка влияния этифоксина (Стрезам®) на психические и соматические проявления тревоги в процессе терапии у больных с ХИМ проводилась с помощью HAM-A. Действие этифоксина на КФ оценивалось путем анализа динамики пробы Шульте и данных КШОПС.
До начала терапии этифоксином у всех больных отмечался общий высокий уровень ТР: средний балл по HAM-A составил 31,2±4,02 балла. К концу 6-й недели терапии у 29 пациентов из 30 отмечалась нормализация уровня тревоги: средний балл – 12,86±2,17 (р=0,0001).
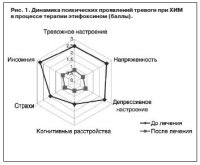
Ярко выраженный положительный эффект терапии этифоксином (Стрезам®) был получен в отношении психических проявлений тревоги по пунктам 1–6 HAM-A (рис. 1).
До начала терапии больные предъявляли жалобы на излишнюю озабоченность и связанные с этим нарушение трудоспособности и возможности ведения домашнего хозяйства, сами пациенты и их родственники жаловались на то, что из-за «плохих предчувствий» и опасений за жизнь и здоровье близких они проявляют излишнюю тревожность при задержке близких на работе или в магазине, многократно звонят на мобильный телефон родным, чтобы убедиться, что у них все в порядке; это значительно влияло на КЖ не только больного, но и его семьи.
Типичны были высокая раздражительность пациентов, тревожность и беспокойство при общении с врачом.
В ходе терапии у большинства больных значительно уменьшились тревожность и озабоченность, перестали беспокоить «плохие предчувствия». Значительная положительная динамика отмечалась уже к концу 2-й недели от начала терапии Стрезамом. К концу 6-й недели «тревожное настроение» значительно редуцировалось – с 2,53±0,11 до 0,83±0,1 балла (p=0,0001).
Показатель «внутренняя напряженность» снизился в 3,5 раза – с 2,6±0,09 до 0,7±0,08 балла (p=0,0001); практически исчезли немотивированные страхи (с 1,93±0,14 до 0,77±0,07 балла; p=0,0001).
Депрессивное настроение при начальном визите характеризовалось снижением настроения, ангедонией, потерей интереса к жизни, ранними пробуждениями, подавленностью. Были характерны суточные колебания состояния с угнетенным состоянием в вечерние часы, что является типичным для депрессивных расстройств. Спустя 6 нед от начала терапии степень выраженности показателя «депрессивные нарушения» уменьшилась с 2,43±0,09 до 0,9±0,05 балла (p=0,0001). Отмечались улучшение настроения, исчезновение подавленности, восстановился утренний сон, исчезли суточные колебания настроения. Степень выраженности инсомнии уменьшилась с 2,77±0,08 до 0,93±0,07 балла (p=0,0001). Нормализацию структуры и качества сна к концу 4-й недели от начала лечения отмечали 60% больных (18 человек), у пациентов появились чувство удовлетворенности сном.
Положительный эффект этифоксина проявился также в уменьшении выраженности КН, ассоциированных с тревогой по подпункту КН. После окончания курса терапии пациенты отмечали повышение умственной работоспособности, улучшение памяти и внимания – средний балл повысился с 1,53±0,15 до 0,93±0,1 (p=0,0001).

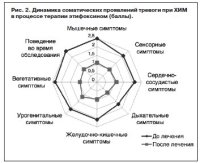
Положительный эффект этифоксина (Стрезам®) был также выявлен в отношении разных соматических проявлений тревоги при оценке динамики данных по подпунктам 7–14 по HAM-A (рис. 2).
До начала терапии мышечные симптомы были представлены неопределенными болевыми ощущениями, сопровождающимися мышечными подергиваниями, мышечно-тоническими проявлениями, повышенной мышечной напряженностью. Среди сенсорных симптомов преобладали затуманенность зрения и шум в ушах, ощущение зуда в теле, «приливы».
К концу 2-й недели выраженность соматических мышечных нарушений уменьшилась на 30% с 2,47±0,09 до 1,73±0,09, а к концу 6-й недели терапии мышечные симптомы снизились в 2,5 раза – с 2,47±0,09 до 1,1±0,05 балла (p=0,0001).
Динамика изменений сенсорных нарушений была сходна с динамикой мышечных соматических расстройств. Так, к концу 2-й недели лечения их проявления уменьшились на 30% – с 2,1±0,1 до 1,7±0,11 балла, а к концу 6-й недели их интенсивность снизилась в 2 раза – с 2,1±0,1 до 1,0±0,1 балла (p=0,0001).
Положительный эффект в отношении болевых синдромов ранее уже был обнаружен у этифоксина при лечении хронической боли [11].
Сердечно-сосудистые расстройства до начала терапии были представлены тахикардией, сердцебиениями, ощущением перебоев в работе сердца, чувством пульсации сосудов. По окончании терапии сердечно-сосудистые расстройства снизились почти в 2 раза – с 2,13±0,11 до 1,1±0,09 балла (р=0,0001). Уменьшилась частота сердцебиений, неприятных ощущений в грудной клетке, приступов одышки и «нехватки воздуха», реже отмечалась лабильность пульса и артериального давления.
Также пациенты отмечали снижение зависимости от окружающих, исчезновение страха перед возможным развитием приступов сердцебиения, что свидетельствовало о существенном повышении КЖ у этой категории больных.
В числе дыхательных расстройств до начала терапии пациенты предъявляли жалобы на сдавление или сжатие в груди, ощущение удушья, одышку, затрудненный вдох. Выраженность дыхательных симптомов к концу курса терапии этифоксином уменьшилась в 2 раза с 1,7±0,11 до 0,83±0,09 балла (р=0,0001). Наиболее важным для пациентов было исчезновение чувства неудовлетворенности вдохом и чувства нехватки воздуха.
Полученные результаты согласуются с предшествующими наблюдениями в кардиологической практике, когда было выявлено уменьшение частоты сердечных сокращений и уровня артериального давления, а также приступов одышки и «нехватки воздуха» у лиц, принимавших этифоксин [1, 4, 5, 13].
Полученные положительные результаты терапии этифоксином сердечно-сосудистых и дыхательных расстройств, ассоциированных с тревогой при ХИМ, могут быть связаны с положительным вегетотропным эффектом препарата, обусловленным уникальным механизмом лечебного эффекта этифоксина – возможности активации ГАМКА-рецептора даже в отсутствие ГАМК и потенцирования эффекта ГАМК в ее присутствии [32].
Соматоформные расстройства, ассоциированные с желудочно-кишечными нарушениями у больных с ХИМ, были представлены трудностями при глотании, метеоризмом, болями в животе, жжением, дискомфортом в животе, тошнотой и рвотой при психоэмоциональном напряжении и стрессе, слабым стулом или, напротив, запорами, потерей массы тела вне причин соматического характера.
Желудочно-кишечные расстройства редуцировались к окончанию 6-й недели терапии этифоксином (Стрезам®) более чем в 2 раза – с 2,07±0,09 до 0,96±0,05 балла (р=0,0001). Повысился аппетит, нормализовался стул. У пациентов отмечались снижение дискомфорта при глотании и прохождении пищевого комка по пищеводу, уменьшение количества эпизодов вздутия живота, исчезли тошнота и рвота при психоэмоциональном напряжении.
В проведенных ранее исследованиях эффективности этифоксина в комплексной терапии заболеваний желудочно-кишечного тракта (ЖКТ) было достоверно установлено, что он ослабляет усиленную моторику ЖКТ и ощущение дискомфорта в животе, это связано с его положительным влиянием на ГАМКергические структуры и нормализацией нарушенной парасимпатической иннервации ЖКТ [8, 14, 16].
Урогенитальные расстройства, ассоциированные с тревогой у больных с ХИМ, были представлены разными симптомами, не связанными с воспалительными заболеваниями мочевого пузыря, почек и половых органов (учащенное мочеиспускание, частые позывы, снижение полового влечения, нарушение эректильной функции, альгодисменорея, предменструальный синдром). К концу курса терапии у пациентов отмечались нормализация функции мочеиспускания, уменьшение выраженности предменструального синдрома, уменьшение альгоменореи. Выраженность урогенитальной симптоматики достоверно уменьшилась к концу курса терапии; так, показатель «урогенитальные расстройства» снизился почти в 2 раза – с 2,1±0,12 до 1,17±0,11 балла (р=0,0001). Эффективность в отношении урогенитальных нарушений при ТР по сравнению с другими классами транквилизаторов является уникальной особенностью этифоксина (Стрезам®) [1].
В числе вегетативных нарушений у пациентов с ДЭ при первичном осмотре выявлялись сухость во рту, покраснение или побледнение кожных покровов, чувство ознобления, «гусиная кожа», повышенная потливость или излишняя сухость кожных покровов, вегетативные пароксизмы в виде «приливов», липотимические состояния, метеозависимость. После курса лечения этифоксином исчезло чувство «ознобления», значительно уменьшились частота и тяжесть вегетативных пароксизмов, в частности «приливов». Наблюдавшаяся у 3 больных наклонность к липотимическим состояниям исчезла к окончанию курса терапии. Выраженность вегетативных расстройств к концу 6-й недели уменьшилась более чем в 2 раза – с 2,36±0,12 до 0,96±0,06 балла (р=0,0001).
Положительное влияние этифоксина на проявления вегетативной дисфункции в терапевтической практике ранее было продемонстрировано исследованиями О.Г.Морозовой и И.В.Киреева (2007 г.), Н.А.Маруты, Е.Е.Семикиной (2008 г.). Выяснилось, что вегетостабилизирующий эффект препарата связан со снижением избыточной активации симпатической части вегетативной нервной системы и патогенетически связанной с ней повышенной тревожности. Эти данные подтверждались результатами электроэнцефалографического исследования в виде нормализации деятельности неспецифических систем ГМ [12, 13].
После курса терапии этифоксином нормализовалось поведение пациента во время обследования – исчезли беспокойство, суетливость, раздражительность – средний балл по подпункту «поведение во время обследования» уменьшился с 2,47±0,09 до 1,03±0,09 балла (p=0,0001).
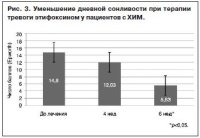
Дневная сонливость оценивалась до начала лечения, спустя 4 и 6 нед после приема этифоксина. До начала терапии пациенты предъявляли жалобы на сонливость после приема пищи, при просмотре телепрограмм. Работающие больные жаловались на избыточную сонливость при поездках в транспорте и во время совещаний. Хотя пациенты и обращали внимание на затруднение засыпания, частые или ранние пробуждения, неудовлетворенность качеством сна, существенной проблемой для трудоспособности и социальной активности они считали именно повышенную дневную сонливость. В течение 1-й недели терапии у 6 больных отмечалась наклонность к повышению дневной сонливости, однако к концу 4-й недели дневная сонливость в исследуемой группе пациентов снизилась, а к окончанию курса терапии этифоксином достоверно уменьшилась – с 14,83±0,47 до 5,53±0,24 балла. У 8 человек дневная сонливость практически исчезла (рис. 3).

Наиболее частыми расстройствами сна, ассоциирующимися с тревогой, являются нарушение засыпания и частые пробуждения. Дневная сонливость также характерна для тревожно-депрессивных расстройств и оказывает существенное влияние на КЖ. Повышенная дневная сонливость негативно влияет на КФ, служит фактором, повышающим риск развития депрессии, влияет на КЖ, здоровье и безопасность. Дневная сонливость встречается в популяции у 20% взрослых [33, 37, 49]. Положительное влияние этифоксина на дневную сонливость может быть объяснено положительным вегетотропным эффектом препарата.
В результате проведенного исследования было выявлено положительное влияние этифоксина (Стрезам®) на КФ. Средний балл, по данным КШОПС, до начала лечения составлял 25,06±1,5. К моменту окончания курса терапии этифоксином средний балл КШОПС повысился до 29,1±0,76 (р=0,0001).
После курса терапии этифоксином отмечалось уменьшение нейродинамических расстройств по результатам выполнения пробы Шульте. Скорость выполнения пробы Шульте снизилась с 51,3±4,1 до 40,12±4,1 с (р=0,0001), что свидетельствует о положительном влиянии препарата на нейродинамическую составляющую КФ.
Полученные результаты могут быть связаны с нейропротективным эффектом Стрезама, ранее показанным в эксперименте. Так, было доказано, что этифоксин способствует ускорению регенерации аксонов ниже участка поражения, стимулирует нейрональный рост, а также приводит к заметному снижению числа макрофагов в пораженных нервных окончаниях. Этифоксин способствует ускорению регенерации нервных волокон, восстанавливает их функционирование, улучшает моторную координацию и сенсорные функции [31].
Экспериментальные данные свидетельствуют о возможном нейропротективном эффекте этифоксина в отношении центрального миелина в связи с его положительным влиянием на митохондриальный транслокационный протеин TPSO [46].
Высокая эффективность этифоксина (Стрезам®) в отношении тревоги может быть связана с доказанным в экспериментальных и клинических исследованиях уникальным механизмом действия препарата – аллостерическим модифицированием конформации ГАМКА-рецепторного комплекса и воздействием на митохондриальные рецепторы, контролирующие биосинтез нейростероидов в глиальных клетках, которые, в свою очередь, являются модуляторами ГАМКергической нейротрансмиссии [40, 42, 44, 46].
Нейропротективный эффект этифоксина предположительно объясняется его нейростероидным механизмом действия. В ходе проведенного нами исследования выявлена хорошая переносимость Стрезама c отсутствием проявлений поведенческой токсичности, седативного, миорелаксирующего эффектов. Все пациенты завершили исследование.
Заключение
Результаты исследования показывают, что анксиолитик этифоксин (Стрезам®) эффективен в отношении психических, соматических нарушений и КН, ассоциированных с ТР у больных с хронической ишемией ГМ. При этом препарат не оказывает отрицательного влияния на психомоторные функции и КФ, мышечный тонус; к нему не формируются зависимость, толерантность и также не возникает синдрома отмены, что обосновывает его использование в качестве корректора тревожных нарушений при ХИМ.
Сведения об авторах
Густов Александр Васильевич – проф., зав. каф. неврологии, психиатрии и наркологии ФПКВ ГБОУ ВПО НижГМА
Антипенко Елена Альбертовна – д-р мед. наук, доц. каф. неврологии, психиатрии и наркологии ФПКВ ГБОУ ВПО НижГМА
Александрова Екатерина Александровна – канд. мед. наук, ассистент каф. неврологии, психиатрии и наркологии ФПКВ ГБОУ ВПО НижГМА
Паршина Е.В. – канд. мед. наук, врач высшей категории, зав. 2-м неврологическим отд-нием ГБУЗ НО НОКБ им. Н.А.Семашко. E-mail: official@semashko.nnov.ru
Бородачева И.В. – врач ГБУЗ НО НОКБ им. Н.А.Семашко. E-mail: official@semashko.nnov.ru
Беляков К.М. – врач ГБУЗ НО НОКБ им. Н.А.Семашко. E-mail: official@semashko.nnov.ru
Список исп. литературыСкрыть список1. Андрющенко А.В., Бескова Д.А., Романов Д.В. Психофармакотерапия генерализованной тревоги (опыт применения Стрезама и Атаракса). Психические расстройства в общей медицине. 2010; 1: 33–6. / Andryushenko A.V., Beskova D.A., Romanov D.V. Psychopharmacotherapy of anxiety disorders with Stresam and Atarax. Mental Disorders in General Medicine. 2010; 1: 33 –6. [in Russian]
2. Антипенко Е.А., Трошин В.В., Дерюгина А.В., Густов А.В. Неспецифическая резистентность организма при хронической ишемии головного мозга. Мед. альманах. 2011; 1 (14): 60–2. / Antipenko E.A., Troshin V.V., Deriugina A.V., Gustov A.V. Nespetsificheskaia rezistentnost' organizma pri khronicheskoi ishemii golovnogo mozga. Med. al'manakh. 2011; 1 (14): 60–2. [in Russian]
3. Болдырев А.А. Окислительный стресс и мозг. Соросовский образоват. журн. 2001; 7: 21–7. / Boldyrev A.A. Okislitel'nyi stress i mozg. Sorosovskii obrazovat. zhurn. 2001; 7: 21–7. [in Russian]
4. Бурчинский С.Г. Анксиолитики в кардиологической практике. Здоровая Украина. 2008; 1: 30–1. / Burchinskii S.G. Anksiolitiki v kardiologicheskoi praktike. Zdorovaia Ukraina. 2008; 1: 30–1. [in Russian]
5. Виничук С.М., Крылова В.Ю., Рогоза С.В. Тревожные расстройства с нарушением адаптации и методы их терапии. Междунар. неврол. журн. 2008; 2: 9–15. / Vinichuk S.M., Krylova V.Iu., Rogoza S.V. Trevozhnye rasstroistva s narusheniem adaptatsii i metody ikh terapii. Mezhdunar. nevrol. zhurn. 2008; 2: 9–15. [in Russian]
6. Густов А.В., Антипенко Е.А. Когнитивные расстройства в неврологии. Методы диагностики, пути коррекции. Нижний Новгород: Изд-во Нижегородской государственной медицинской академии, 2013. / Gustov A.V., Antipenko E.A. Kognitivnye rasstroistva v nevrologii. Metody diagnostiki, puti korrektsii. Nizhnii Novgorod: Izd-vo Nizhegorodskoi gosudarstvennoi meditsinskoi akademii, 2013. [in Russian]
7. Захаров В.В., Вознесенская Т.Г. Нервно-психические нарушения. Диагностические тесты. М.: МЕДпресс-информ, 2014. / Zakharov V.V., Voznesenskaia T.G. Nervno-psikhicheskie narusheniia. Diagnosticheskie testy. M.: MEDpress-inform, 2014. [in Russian]
8. Иванец Н.И., Кинкулькина М.А., Авдеева Т.И., Сысоева В.П. Психофармакотерапия тревожных расстройств у лиц пожилого возраста: эффективность, переносимость и современная роль лечения анксиолитиками. Соц. и клин. психиатрия. 2014; 2 (24): 32–44. / Ivanets N.I., Kinkul'kina M.A., Avdeeva T.I., Sysoeva V.P. Psikhofarmakoterapiia trevozhnykh rasstroistv u lits pozhilogo vozrasta: effektivnost', perenosimost' i sovremennaia rol' lecheniia anksiolitikami. Sots. i klin. psikhiatriia. 2014; 2 (24): 32–44. [in Russian]
9. Лапин И.П. Нейрохимическая мозаика тревоги и индивидуализация психофармакологии. Тревога и обсессии. М.: Изд-во РАМН, 1998; с. 12–20. / Lapin I.P. Neirokhimicheskaia mozaika trevogi i individualizatsiia psikhofarmakologii. Trevoga i obsessii. M.: Izd-vo RAMN, 1998; s. 12–20. [in Russian]
10. Линский И.В., Минко А.И., Самойлова Е.С., Минко А.А. Опыт применения этифоксина у больных с алкогольной зависимостью. Здоровая Украина. 2008; 10: 74–5. / Linskii I.V., Minko A.I., Samoilova E.S., Minko A.A. Opyt primeneniia etifoksina u bol'nykh s alkogol'noi zavisimost'iu. Zdorovaia Ukraina. 2008; 10: 74–5. [in Russian]
11. Лисенко Г.И., Ткаченко В.И. Психоэмоциональные аспекты хронической боли у больных ревматоидным артритом. Здоровая Украина. 2008; 10: 66–7. / Lisenko G.I., Tkachenko V.I. Psikhoemotsional'nye aspekty khronicheskoi boli u bol'nykh revmatoidnym artritom. Zdorovaia Ukraina. 2008; 10: 66–7. [in Russian]
12. Марута Н.А., Семикина Е.Е. Применение анксиолитической терапии в лечении соматоформной вегетативной дисфункции. Новости медицины и фармации. 2008; 5: 14–5. / Maruta N.A., Semikina E.E. Primenenie anksioliticheskoi terapii v lechenii somatoformnoi vegetativnoi disfunktsii. Novosti meditsiny i farmatsii. 2008; 5: 14–5. [in Russian]
13. Морозова О.Г., Киреев И.В. Коррекция вегетативных и тревожных нарушений в практике врача-интерниста. Психиатрия и неврология. 2007; 215. / Новости медицины и фармации. 2007; 7: 6–7. / Morozova O.G., Kireev I.V. Korrektsiia vegetativnykh i trevozhnykh narushenii v praktike vracha-internista. Psikhiatriia i nevrologiia. 2007; 215. / Novosti meditsiny i farmatsii. 2007; 7: 6–7. [in Russian]
14. Палий И.Г., Резниченко И.Г., Севак Н.М. Психосоматические расстройства в гастроэнтерологической практике: особенности клинического течения и медикаментозной терапии. Новости медицины и фармации. 2007; 6. / Palii I.G., Reznichenko I.G., Sevak N.M. Psikhosomaticheskie rasstroistva v gastroenterologicheskoi praktike: osobennosti klinicheskogo techeniia i medikamentoznoi terapii. Novosti meditsiny i farmatsii. 2007; 6. [in Russian]
15. Парфенов В.А. Дисциркуляторная энцефалопатия: дифференциальный диагноз и лечение. Клиницист. 2008; 1 (1): 38–44. / Parfenov V.A. Distsirkuliatornaia entsefalopatiia: differentsial'nyi diagnoz i lechenie. Klinitsist. 2008; 1 (1): 38–44. [in Russian]
16. Приходько В.Ю., Масленникова Н.А., Редько Л.А. Коррекция психосоматических расстройств в практике терапевта. Новости медицины и фармации. 2008; 4. / Prikhod'ko V.Iu., Maslennikova N.A., Red'ko L.A. Korrektsiia psikhosomaticheskikh rasstroistv v praktike terapevta. Novosti meditsiny i farmatsii. 2008; 4. [in Russian]
17. Путилина М.В. Нейропротекторная терапия хронической ишемии мозга. Врач. 2008; 9: 34–8. / Putilina M.V. Neiroprotektornaia terapiia khronicheskoi ishemii mozga. Vrach. 2008; 9: 34–8. [in Russian]
18. Путилина М.В. Возможности ранней медикаментозной коррекции психических и вегетативных нарушений при гипертонической энцефалопатии. Врач. 2009; 9: 38–42. / Putilina M.V. Vozmozhnosti rannei medikamentoznoi korrektsii psikhicheskikh i vegetativnykh narushenii pri gipertonicheskoi entsefalopatii. Vrach. 2009; 9: 38–42. [in Russian]
19. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. М.: МедиаСфера, 2002. / Rebrova O.Iu. Statisticheskii analiz meditsinskikh dannykh. Primenenie paketa prikladnykh programm STATISTICA. M.: MediaSfera, 2002. [in Russian]
20. Смулевич А.Б., Дробижев М.Ю., Иванов С.В. Клинические эффекты бензодиазепиновых транквилизаторов в психиатрии и общей медицине. М.: МедиаСфера, 2005; с. 88. / Smulevich A.B., Drobizhev M.Iu., Ivanov S.V. Klinicheskie effekty benzodiazepinovykh trankvilizatorov v psikhiatrii i obshchei meditsine. M.: MediaSfera, 2005; s. 88. [in Russian]
21. Суслина З.А., Федорова Т.Н., Максимова М.Ю. и др. Антиоксидантная терапия при ишемическом инсульте. Журн. неврологии и психиатрии им. С.С.Корсакова. 2000; 10: 34–8. / Suslina Z.A., Fedorova T.N., Maksimova M.Iu. i dr. Antioksidantnaia terapiia pri ishemicheskom insul'te. Zhurn. nevrologii i psikhiatrii im. S.S.Korsakova. 2000; 10: 34–8. [in Russian]
22. Федорова Т.Н. Окислительный стресс и защита головного мозга от ишемических повреждений. Дис. … д-ра биол. наук. М., 2004; с. 298. / Fedorova T.N. Okislitel'nyi stress i zashchita golovnogo mozga ot ishemicheskikh povrezhdenii. Dis. … d-ra biol. nauk. M., 2004; s. 298. [in Russian]
23. Яхно Н.Н., Захаров В.В. Когнитивные и эмоционально-аффективные нарушения при дисциркуляторной энцефалопатии. Рус. мед. журн. 2002; 10 (12–13): 532–42. / Iakhno N.N., Zakharov V.V. Kognitivnye i emotsional'no-affektivnye narusheniia pri distsirkuliatornoi entsefalopatii. Rus. med. zhurn. 2002; 10 (12–13): 532–42. [in Russian]
24. Astrom M. Generalized anxiety disorder in stroke patients. A 3-year longitudinal study. Stroke 1996; 27 (2): 270–5.
25. Andreescu C, Aizenstein H. MRI Studies in Late-Life Mood Disorders. Curr Top Behav Eurosci 2012; 11: 268–87.
26. Bandelow B, Sher L, Bunevicius R et al. Guidelines for the pharmacological treatment of anxiety disorders, obsessive-compulsive disorder and posttraumatic stress disorder in primary care. Int J Psychiatry Clin Pract 2012; 16 (2): 77–84.
27. Blay SL, Marinho V. Anxiety disorders in old age. Curr Opin Psychiatry 2012; 25 (6): 462–7.
28. Beluche I, Carrière I, Ritchie K, Ancelin ML. A prospective study of diurnal cortisol and cognitive function in community-dwelling elderly people. Psychol Med 2010; 40 (6): 1039–49.
29. De Beurs E, Beekman AT, Van Balkom AJ et al. Consequences of anxiety in older persons: its effect on disability, well-being and use of health services. Psychol Med 1999; 29 (3): 583–93.
30. O'Brien J, Ames D, Gustafson L et al. editors. Cerebrovascular disease, cognitive impairment and dementia. 2nd ed. Cerebrovascular disease and dementia London: Martin-Dunitz, 2004; p. 260–2.
31. Girard C, Liu S, Cadepond F et al. Etifoxine improves peripheral nerve regeneration and functional recovery. Proc Natl Acad Sci USA 2008; 105 (51).
32. Hamon A, Morel A, Hue B et al. The modulatory effects of the anxiolytic etifoxine on GABA(A) receptors are mediated by the beta subunit. Neuropharmacology 2003; 45 (3): 293–303.
33. Hayley AC, Williams LJ, Berk M et al. The relationship between excessive daytime sleepiness and depressive and anxiety disorders in women. Aust NZ J Psychiatry 2013; 47 (8): 772–8.
34. Kroenke K, Spitzer RL, Williams JB et al. Anxiety disorders in primary care: prevalence, impairment, comorbidity, and detection. Ann Intern Med 2007; 146 (5): 317–25.
35. Kruse HJ, Kuch H. Potentiation of clobazam’s anticonvulsant activity by etifoxine, a non-benzodiazepine tranquilizer, in mice. Comparison studies with sodium valproate. Arzneimittelforschung 1986; 36(9): 1320–2.
36. Lenze EJ, Dixon D, Mantella RC et al. Newcomer JW, Butters MA. Treatment-related alteration of cortisol predicts change in neuropsychological function during acute treatment of late-life anxiety disorder. Int J Geriatr Psychiatry 2012; 27 (5): 454–62.
37. Leblanc M-F, Desjardins S, Desgagné A. Sleep problems in anxious and depressive older adults. Psychol Res Behav Manag 2015; 8: 161–9.
38. Leppavuori A, Pohjasvaara T, Vataja R et al. Generalized anxiety disorders three to four months after ischemic stroke. Cerebrovasc Dis 2003; 16 (3): 257–64.
39. Marks IE. Cure and care of neurosis. NY: J.V.Scott Med Found, 2001.
40. DoRego JL, Vaudry D, Vaudry H. The non-benzodiazepine anxiolytic drug etifoxine causes a rapid, receptor-independent stimulation of neurosteroid biosynthesis. PLoS One 2015; 10 (3): e0120473.
41. Semaan W, Hergueta T, Bloch J et al. Cross-sectional study of the prevakence of adjustment disorder with anxiety in general practice. Encephale 2001; 27(3): 238–44, S.L.
42. Servant D, Graziani PL, Moyse D et al. Treatment of adjustment disorder with anxiety: efficacy and tolerance of etifoxine in a double-blind controlled study. Encephale 1998; 24: 569–74.
43. Strine TW, Chapman DP, Kobau R et al. Associations of self-reported anxiety symptoms with healh-related quality of life and health behaviors. Soc Psychyatry Psychiatr Epidemol 2005; 40 (6): 432–8.
44. Taylor JM, Allen AM, Graham A. Targeting mitochondrial 18 kDa translocator protein (TSPO) regulates macrophage cholesterol efflux and lipid phenotype. Clin Sci (Lond) 2014; 127 (10): 603–13.
45. Verleye M, Pansari Y, Gillardin J. Effects of etifoxine on ligand binding to GABA(A) receptors in rodents. Neurosci Res 2002; 44: 167–72.
46. Ugale RR, Sharma AN, Kokare DM et al. Neurosteroidal lopregnanolone mediates anxiolytic effect of etifoxine in rats. Brain Res 2007; 1184: 193–201.
47. Wetherell JL, Gatz M, Pedersen NL. A longitudinal analysis of anxiety and depressive symptoms. Psychol Aging 2001; 16 (2): 187–95.
48. Wittchen HU, Hoyer J, Beesdo K, Krause P. Problems and deficiencies in family physician's management of generalized anxiety disorders. Results of the GAD-P study and priorities for an improved care. [Article in German]. Fortschr Med Orig 2001; 119 (Suppl. 1): 42–9.
49. Young TB. Epidemiology of daytime sleepiness: definitions, symptomatology, and prevalence. J Clin Psychiatry 2004; 65 (Suppl. 16): 12–6.
10 мая 2016
Количество просмотров: 6435


