Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина



Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03 2016
Уроки прошлого и взгляд в будущее: современные концепции улучшения терапии психических заболеваний. Часть 1 (расширенный реферат, подготовленный А.В.Павличенко) №03 2016
Номера страниц в выпуске:10-18
Эра современной нейропсихофармакологии началась в 1950-е годы со случайного открытия антипсихотиков I поколения и антидепрессантов, которые доказали свою терапевтическую эффективность, хотя и обладали выраженными побочными эффектами. В настоящее время мы обладаем широким арсеналом более безопасных препаратов с лучшей переносимостью, которые помогают больным шизофренией, депрессией и другими психическими болезнями. Кроме того, стратегии (например, психотерапия) также играют важную роль в лечении как сами по себе, так и при совместном использовании с лекарственными средствами. Несмотря на значимые достижения, существующие на сегодняшний день модели оказания помощи являются лишь частично эффективными, а распространенные психические заболевания все еще остаются для общества огромным социально-экономическим бременем. Отсутствие достижений в области обнаружения более эффективных лекарственных средств вместе со многими другими факторами привело к некоторому разочарованию фарминдустрии в нейропсихиатрии. Тем не менее интерес все еще остается высоким, и в настоящее время мы являемся свидетелями все большей интеграции процесса открытия новых лекарственных средств и исследований в области трансляционной медицины. Таким образом, сейчас наступил благоприятный момент для того, чтобы провести ревизию наших знаний в этой области. В данной статье мы, во-первых, попытаемся вспомнить историю открытия и дальнейшей разработки психотропных средств, акцентируя внимание, в частности, на механизмах действия и терапевтической пользе и на том, как нам удалось преодолеть возникающие проблемы. Во-вторых, мы проанализируем накопленный опыт, особенно наши достижения и неудачи, для того чтобы сделать прогноз на будущее. В-третьих, мы проведем анализ новых стратегий, которые: а) улучшают наше понимание классификации психических расстройств; б) углубляют знания, лежащие в основе факторов риска и патофизиологии болезней; в) способствуют усовершенствованию клеточных и животных моделей для открытия новых терапевтических веществ; г) улучшают дизайн и исходы клинических исследований; д) направляются в сторону поиска надежных биомаркеров конкретных групп пациентов и эффективности лекарств; е) стимулируют совместные подходы, объединяющие фарминдустрию, академические центры и пациентов. Несмотря на множество трудностей в будущем, многие рекомендации, прозвучавшие в данной статье, могут улучшить профилактику и лечение психических расстройств, что является крайне актуальной задачей нашего времени.
Ключевые слова: геномика, генетика, эпигенетика, профилактика, DSM, трансляционный, биомаркеры, клинические исследования,
шизофрения, депрессия.
Эра современной нейропсихофармакологии началась в 1950-е годы со случайного открытия антипсихотиков I поколения и антидепрессантов, которые доказали свою терапевтическую эффективность, хотя и обладали выраженными побочными эффектами. В настоящее время мы обладаем широким арсеналом более безопасных препаратов с лучшей переносимостью, которые помогают больным шизофренией, депрессией и другими психическими болезнями. Кроме того, стратегии (например, психотерапия) также играют важную роль в лечении как сами по себе, так и при совместном использовании с лекарственными средствами. Несмотря на значимые достижения, существующие на сегодняшний день модели оказания помощи являются лишь частично эффективными, а распространенные психические заболевания все еще остаются для общества огромным социально-экономическим бременем. Отсутствие достижений в области обнаружения более эффективных лекарственных средств вместе со многими другими факторами привело к некоторому разочарованию фарминдустрии в нейропсихиатрии. Тем не менее интерес все еще остается высоким, и в настоящее время мы являемся свидетелями все большей интеграции процесса открытия новых лекарственных средств и исследований в области трансляционной медицины. Таким образом, сейчас наступил благоприятный момент для того, чтобы провести ревизию наших знаний в этой области. В данной статье мы, во-первых, попытаемся вспомнить историю открытия и дальнейшей разработки психотропных средств, акцентируя внимание, в частности, на механизмах действия и терапевтической пользе и на том, как нам удалось преодолеть возникающие проблемы. Во-вторых, мы проанализируем накопленный опыт, особенно наши достижения и неудачи, для того чтобы сделать прогноз на будущее. В-третьих, мы проведем анализ новых стратегий, которые: а) улучшают наше понимание классификации психических расстройств; б) углубляют знания, лежащие в основе факторов риска и патофизиологии болезней; в) способствуют усовершенствованию клеточных и животных моделей для открытия новых терапевтических веществ; г) улучшают дизайн и исходы клинических исследований; д) направляются в сторону поиска надежных биомаркеров конкретных групп пациентов и эффективности лекарств; е) стимулируют совместные подходы, объединяющие фарминдустрию, академические центры и пациентов. Несмотря на множество трудностей в будущем, многие рекомендации, прозвучавшие в данной статье, могут улучшить профилактику и лечение психических расстройств, что является крайне актуальной задачей нашего времени.
Ключевые слова: геномика, генетика, эпигенетика, профилактика, DSM, трансляционный, биомаркеры, клинические исследования,
шизофрения, депрессия.
apavlichenko76@gmail.com
Для цитирования: M.J.Millan, G.M.Goodwin, Andreas Meyer-Lindenberg, Sven Ove Örgen. Уроки прошлого и взгляд в будущее: современные концепции улучшения терапии психических заболеваний. Часть 1 (расширенный реферат, подготовленный А.В.Павличенко). Психиатрия
и психофармакотерапия. 2016; 18 (3): 10–18.
Learning from the past and looking to the future: Emerging perpectives for improving the treatment of psychiatric disorders Part 1 (extended abstract, prepared by A.V.Pavlichenko)
M.J.Millan, G.M.Goodwin, Andreas Meyer-Lindenberg, Sven Ove Örgen
Modern neuropsychopharmacology commenced in the 1950s with the serendipitous discovery of first generation antipsychotics and antidepressants which were therapeutically effective yet had marked adverse effects. Today, a broader palette of safer and better-tolerated agents is available for helping people that suffer from schizophrenia, depression and other psychiatric disorders, while complementary approaches like psychotherapy also have important roles to play in their treatment, both alone and in association with medication. Nonetheless, despite considerable efforts, current management is still only partially effective, and highly-prevalent psychiatric disorders of the brain continue to represent a huge personal and socio-economic burden. The lack of success in discovering more effective pharmacotherapy has contributed, together with many other factors, to a relative disengagement by pharmaceutical firms from neuroscience. Nonetheless, interest remains high, and partnerships are proliferating with academic centers which are increasingly integrating drug discovery and translational research into their traditional activities. This is, then, a time of transition and an opportune moment to thoroughly survey the field. Accordingly, the present paper chronicles the discovery and development of modern psychotropic agents, focusing in particular on their mechanisms of action and therapeutic utility, and how problems faced were eventually overcome.
Key words: genomics, genetics, epigenetics, prevention, DSM, translational, biomarker, discovery, clinical trial, schizophrenia, depression, OCD,
anxiety, ADHD, bipolar.
apavlichenko76@gmail.com
For citation: M.J.Millan, G.M.Goodwin, Andreas Meyer-Lindenberg, Sven Ove Örgen. Learning from the past and looking to the future: Emerging perpectives for improving the treatment of psychiatric disorders. Part 1 (extended abstract, prepared by A.V.Pavlichenko). Psychiatry and Psychopharmacotherapy. 2016; 18 (3): 10–18.
Введение: проблемы улучшения лечения болезней мозга
Два самых важных факта о психических заболеваниях – их высокая распространенность и значительное социально-экономическое бремя для общества, с одной стороны, и недостаточные на сегодняшний день стратегии лечения – с другой. Выполненные в последние годы исследования показали, что значительная экономическая стоимость этих заболеваний связана, в первую очередь, с непрямыми расходами (безработица, необходимость социальной поддержки), а не с затратами, обусловленными госпитализацией и ценой на лекарственные средства (ЛС). Новые терапевтические стратегии вместе с улучшением функционирования лиц с психическими заболеваниями, вне всякого сомнения, снизят общую стоимость психических заболеваний, а попытки лучше понять их патофизиологические причины улучшат профилактику и лечение.
На протяжении последних 30 лет огромное число ресурсов, как государственных, так и частных, было выделено на научные исследования области психических заболеваний, психического здоровья и болезней мозга в целом. В настоящее время наблюдается заметное отставание (до 20–25 лет) фундаментальных открытий (таких как молекулярные субстраты болезней и потенциальные мишени действий лекарств) от внедрения соответствующего ЛС в практику. Тем не менее, если не принимать во внимание улучшение переносимости и безопасности, со времени введения в практику психотропных средств (ПС) I поколения было очень мало сделано в плане усиления эффективности ЛС. Отсутствие очевидного прогресса вместе с недостаточным пониманием природы психических заболеваний привело к определенным разочарованиям. Некоторая потеря интереса фармацевтических компаний к нейронаукам была обусловлена несколькими факторами: сложной экономической ситуацией; ограничениями в области регуляторной и ценовой политики; длительным и дорогостоящим процессом клинических исследований; запросами других медицинских дисциплин, такими как онкология, диабетология, инфекционные болезни; ограниченным использованием в психиатрии технологий стволовых клеток и антител; осознанием того факта, что расшифровка генома не приведет к быстрым результатам в области психиатрии.
Тем не менее не все так безнадежно. Нейронаука является динамичной и быстро развивающейся областью, и в последние годы появилось несколько интересных проектов, которые могут улучшить наши возможности контролировать симптомы болезней центральной нервной системы (ЦНС). Более того, как недавно было показано, ПС не уступают по эффективности другим классам ЛС или другим лечебным стратегиям, в то время как проблемы, с которыми сталкиваются исследователи в своей работе, являются общими при исследовании различных классов препаратов.
Также не следует преуменьшать прогресс в понимании природы психических заболеваний, достигнутый с 1950-х годов, когда были открыты первые ПС. Хотя для пациентов эти достижения могут быть не столь очевидны, фармакологические и другие стратегии лечения, такие, например, как психосоциально-когнитивно-поведенческая терапия, техники стимуляции, программы профилактики, лежат в основе многих будущих достижений в этой области.
По-видимому, сейчас наступил подходящий момент для того, чтобы проанализировать прошлое и посмотреть в будущее, больше делая акцент на позитивных, чем на негативных аспектах исследований в области психиатрии.
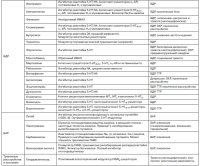
В табл. 1 представлены основные ПС и показания к их применению.
История и эволюция фармакотерапии психических заболеваний
Открытия, сделанные в начале 1950-х годов, ознаменовали начало «современной» эры нейропсихофармакологии с введением в практику лекарств для лечения многих психических заболеваний. Эти открытия, в первую очередь, были сделаны с помощью внимательного наблюдения конкретных психиатров за эффектом воздействия препаратов на разных пациентов. Затем последовал этап более систематического и более прицельного изучения действия препаратов, включая плацебо-контролируемые исследования лекарств, для того чтобы найти корреляции между приемом препаратов и клиническим исходом. Кроме того, пониманию механизмов действия ПС способствовал прогресс в области химической нейроанатомии, в частности, развитие методов измерения концентрации моноаминов в мозге. Чтобы лучше понять текущее положение дел в области нейропсихофармакологии и будущий прогресс, полезно оглянуться назад на 60-летнюю историю открытия ЛС для лечения психических заболеваний.
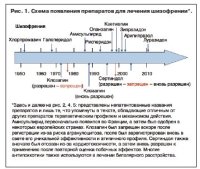
Антипсихотики в лечении шизофрении (рис. 1, см. табл. 1)

Выявление антипсихотических свойств RP4560 (хлорпромазин) в 1952 г. представляет собой важную веху в психиатрии. RP4560, аналог фенотиазина, синтезированный Charpentier во французской компании Rhone-Poulenc в 1950 г., вначале изучали из-за его антигистаминных свойств. Французский хирург Laborit был первым исследователем, который осознал возможную пользу препарата для психиатрии. В своей работе он использовал «литический коктейль» антигистаминных препаратов, содержащих в том числе RP4560, с целью снижения посттравматического шока. Позже Delay и Deniker описали важнейшие свойства хлорпромазина: смягчение галлюцинаций и уменьшение внутренних «голосов» у возбужденных и агрессивных психотических пациентов. Они же ввели термин «нейролептик» для обозначения всего класса ЛС. Данное открытие нашло подтверждение и в других работах, которые легли в основу фармакотерапии шизофрении и являются актуальными вплоть до сегодняшнего времени.
В результате нескольких исследований было высказано предположение, что механизм действия нейролептиков связан со снижением дофаминергической передачи. Было показано, что нейролептики уменьшают двигательную активность и вызывают паркинсоноподобный синдром, а дофамин (DA) играет важную роль в контроле за экстрапирамидными функциями, которые связаны со способностью его предшественника L-dopa уменьшать паркинсоноподобную брадикинезию. Кроме того, изучение влияния хлорпромазина и галоперидола на поведение крыс привело к мысли о том, что нейролептики блокируют «моноаминергические рецепторы» и/или влияют на высвобождение моноаминов. На основе этих данных van Rossum в 1966 г. выдвинул так называемую дофаминергическую гипотезу шизофрении, согласно которой нейролептики блокируют дофаминовые рецепторы. Доказательство этой гипотезы получили 10 лет спустя, когда было показано, что наномолярная концентрация нейролептиков стереоселективно ингибирует связывание галоперидола с D2-рецепторами в мозговой ткани. Кроме того, была найдена корреляция между клинически эффективной дозой нейролептиков и их сродством к D2-рецепторам. Отсутствие очевидной связи у нейролептиков с D1-рецепторами усилило убеждение, что D2-рецепторы являются основной мишенью для фармакотерапии психозов.
Хлорпромазин явился родоначальником различных ЛС для лечения шизофрении и других психотических состояний, клинические свойства которых стали обозначаться общим термином «антипсихотик». Важный этап в этой области – синтезирование производного бутирофена – галоперидола (Janssen), одобренного Управлением по контролю пищевых продуктов и лекарств в США (Food and Drug Administration – FDA) для лечения шизофрении в 1967 г. Галоперидол стал прототипом препаратов, обнаруживающих высокое сродство к D2-рецепторам и выраженные антипсихотические свойства, причем как у животных, так и у людей. Тем не менее галоперидол обладал и выраженными побочными эффектами: экстрапирамидные явления и брадикинезия из-за блокады D2-рецепторов полосатого тела; гиперпролактинемия вследствие антагонизма между гипофизарными D2-участками и высвобождением пролактина; поздняя дискинезия, вероятно, связанная с затруднениями глутаматергической передачи в базальных ганглиях.

Важным событием в разработке подходов к лечению шизофрении стало синтезирование «атипичного» препарата клозапина в 1967 г. (Hunziker и соавт., 1967). В Европе он был запущен в производство в 1971 г., но в 1975 г. его лицензия была отозвана из-за того, что препарат повышал риск агранулоцитоза. Повторно он был введен в практику лишь в 1989 г. Его главное отличие от галоперидола состояло в том, что в антипсихотических дозах клозапин не вызывал моторных и эндокринных побочных эффектов. Другая важная его особенность проявлялась в том, что он улучшал психическое состояние тех больных, которые были резистентны к терапии галоперидолом и другими «типичными» препаратами (от 1/3 до 1/2 больных). В дальнейшем было обнаружено, что при длительном приеме он обладает выраженной антисуицидальной активностью. К достоинствам клозапина можно отнести менее выраженную степень блокады D2-рецепторов по сравнению с воздействием на другие мишени, в частности антагонизм в отношении D4-рецепторов, частичный агонизм в отношении 5-HT1A-рецепторов, блокаду 5-HT2A-рецепторов и антагонизм 5-HT1A-рецепторов. Было также показано, что клозапин обладает достаточно высоким аффинитетом по отношению к 5-HT6-рецепторам, блокирование которых ассоциируется с улучшением когнитивной функции, и к
5-HT7-рецепторам, блокада которых может улучшать настроение и вторичные негативные симптомы. В то же время высокий

аффинитет клозапина к a1-AR-адренергическим рецепторам обладает как положительным (влияние на позитивные симптомы путем активации мезолимбических дофаминовых путей), так отрицательным (ортостатическая гипотензия) эффектами.
Попытки воспроизвести клинический профиль клозапина путем воздействия на индивидуальные компоненты фармакологического действия, например на селективную блокаду D4-рецепторов, в течение многих лет были очень популярными, хотя в основном оказались безуспешными. Другой стратегией стала разработка антипсихотиков II поколения, одобренных и вводимых в клиническую практику с середины 1990-х годов, которые частично повторяют рецепторный профиль клозапина. В частности, все антипсихотики II поколения обнаруживают относительный высокий аффинитет к 5-HT2A-, 5-HT2C-, 5-HT1A-, 5-HT6- и/или 5-HT7- и D2-рецепторам. Первым препаратом из группы антипсихотиков II поколения, одобренным FDA в 1994 г. для лечения шизофрении, стал рисперидон. Он стал прототипическим 5-HT2A>D2-антипсихотиком с «атипичным» профилем в виде уменьшения экстрапирамидных побочных эффектов в антипсихотических дозах. Вскоре после рисперидона в клиническую практику были введены оланзапин (1996 г.) и кветиапин (1997 г.), причем оба препарата сохранили схожий с рисперидоном профиль (5-HT2A>D2). Оланзапин, однако, обладает значительно более сильным аффинитетом к D2-рецепторам, чем кветиапин, но последний имеет большее сродство к a1-AR и гистаминовым H1-рецепторам. Зипразидон появился позже, он также обладал 5-HT2A>D2-профилем активности, хотя в отличие от предшественников имел более значимые свойства агониста 5-HT1A-рецепторов.
В то же время ни один из антипсихотиков II поколения полностью не воспроизводит рецепторный профиль клозапина, чей точный мультимодальный профиль активности так до конца и не расшифрован. Соответственно, антипсихотики II поколения не воспроизводят клинический профиль клозапина, который остается «золотым стандартом» в плане эффективности. Кроме того, потенциальные антагонистические свойства антипсихотиков II поколения в отношении мускариновых, гистаминовых и a1-AR-адренорецепторов связаны с такими побочными эффектами, как седация, повышение массы тела, метаболические расстройства и даже диабет. Поэтому, несмотря на их бесспорную клиническую пользу, истинное превосходство антипсихотиков II поколения над препаратами I поколения в лечении шизофрении остается предметом дискуссий. Антипсихотики II поколения также широко используются в лечении биполярных аффективных расстройств (БАР).
Сертиндол, антагонист дофаминовых рецепторов, обладает низким сродством к мускариновым и гистаминовым рецепторам, был одобрен в Европе в 1996 г. Однако из-за присущего ему высокого риска удлинения интервала QT и кардиотоксичности был отозван с рынка в 1998 г. Данный эффект, как считают, был связан с его высоким аффинитетом к так называемым hERG-калиевым каналам в сердце. Судьба сертиндола отразилась и на разработке многих средств для лечения шизофрении и других психических расстройств в то время. С другой стороны, это привело к тому, что новые лиганды проходили тщательный скрининг для того, чтобы уменьшить кардиологические побочные эффекты. Повторная всесторонняя оценка безопасности сертиндола привела к его перерегистрации в Европе как средства для лечения шизофрении в 2002 г., хотя и под тщательным мониторингом ЭКГ, в первую очередь у пациентов, резистентных к другим антипсихотикам.
Последний по времени появления антипсихотик II поколения, лурасидон, был одобрен FDA в 2013 г. как для лечения шизофрении, так и биполярного расстройства. Показаны антагонистические свойства лурасидона в отношении a2-AR-, 5-HT2A- и 5-HT7-рецепторов и его частичный агонизм в отношении 5-HT1A-рецепторов, а также его слабое влияние на мускариновые и гистаминовые рецепторы. Данный профиль предполагает низкий риск экстрапирамидных побочных эффектов и улучшение когнитивных функций. Кроме того, лурасидон демонстрирует благоприятный метаболический профиль, но его изучение в практике только началось, и необходимы дополнительные сведения.
Антипсихотик арипипразол является частичным антагонистом 5-HT2A-рецепторов, а также частичным агонистом 5-HT1A-рецепторов и в отличие от других антипсихотиков II поколения препарат ведет себя как частичный агонист D2- и D3-рецепторов. Такой профиль действует на дофамин-ергическую трансмиссию более сбалансированно, чем жесткий антагонизм в отношении D2-рецепторов. Чтобы избежать нежелательной активации D2-рецепторов, нужно использовать медленную титрацию дозы препарата, однако в плане клинической эффективности он не может соперничать с клозапином. Тем не менее лечение арипипразолом ассоциируется с низким риском возникновения моторных побочных эффектов и по сравнению с другими антипсихотиками II поколения он обладает достаточно невысокой способностью повышать массу тела, что делает его перспективным средством в лечении шизофрении.
Следует подчеркнуть, что ни антипсихотики I поколения, ни антипсихотики II поколения или арипипразол, ни даже клозапин не обладают достаточной эффективностью в отношении контроля над когнитивными, первичными негативными симптомами или социальной когниции, которые в настоящее время ассоциируются со снижением функционирования и трудностями социально-трудовой адаптации. Поэтому улучшение остается основной проблемой. Кроме того, антагонизм в отношении D2-, гистаминовых H1- и мускариновых рецепторов ослабляет когнитивные функции, что было доказано в результате клинических исследований последнего десятилетия.
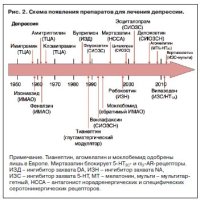
Антидепрессанты в лечении депрессивных расстройств (рис. 2, см. табл. 1)

В 1957 г. швейцарский психиатр R.Kuhn впервые продемонстрировал антидепрессивные свойства иминодибензила, G22355, который был синтезирован в 1954 г. и первоначально рассматривался как антипсихотик. G22355 был позже назван имипрамином и стал первым трициклическим антидепрессантом (ТЦА), одобренным FDA для лечения депрессий. Вскоре после имипрамина был открыт другой аналог иминодибензила – амитриптилин, который также продемонстрировал свойства антидепрессанта и был одобрен FDA в 1961 г.
Находки Kuhn вскоре нашли подтверждение в работах других исследователей, а показания к назначению антидепрессантов стали также включать тревожные состояния. Эти исследования стимулировали интерес к возможным механизмам действия ТЦА, которые не могли тогда понять. В 1961 г. американский биохимик J.Axelrod c помощью радиоизотопной техники показал, что свободный норадреналин (NA) перемещается в пресинаптические нейроны с помощью специфического и чувствительного к действию ТЦА механизма. Это привело к гипотезе, согласно которой вещества, повышающие уровень мозгового NA, обладают антидепрессивными свойствами, а депрессия, в свою очередь, может сопровождаться относительным снижением активности церебральных адренергических нейронов. Данная «катехоламиновая гипотеза аффективных расстройств» имела важнейшее значение для фарминдустрии в течение многих лет, но парадоксальным является тот факт, что препараты, нацеленные на захват NA, появились намного позже, чем их серотонинергические аналоги.
В конце 1960-х годов появилась «серотониновая гипотеза депрессии», согласно которой депрессия связана с низким уровнем серотонина (5-HT) в мозге. Это предположение основывалось на биохимическом исследовании ткани депрессивных пациентов и открытии специфического механизма захвата 5-HT в головном мозге. Решающим фактором для дальнейшего развития фармакологии антидепрессантов стало обнаружение у ТЦА способности блокировать 5-HT. К таким препаратам, в частности, относится имипрамин, в то время как его диметилированный метаболит дезипрамин преимущественно влияет на захват NA. Это открытие привело к предположению, что ТЦА улучшают настроение, а их метаболиты усиливают влечения («Блокада обратного захвата 5-HT связана с влиянием ТЦА на улучшение настроения, а блокада захвата NA усиливает влечения у депрессивных пациентов», Carlsson, 1969).
Кломипрамин, одобренный FDA в 1964 г., оказался более селективным в отношении блокады обратного захвата 5-HT, чем более ранние ТЦА. Кроме того, кломипрамин также эффективен в отношении панического и обсессивно-компульсивного расстройства (ОКР), хотя этот механизм не до конца понятен и в настоящее время.
Предположение о том, что увеличение уровня 5-HT улучшает настроение, привело к активному поиску селективных ингибиторов реаптейка серотонина (селективных ингибиторов обратного захвата серотонина – СИОЗС) в 1970 и 1980-х годах многими крупными фармацевтическими компаниями. Zimelidin, синтезированный в 1971 г. шведской компанией Astra Pharmaceutical и введенный в практику в 1982 г., был первым препаратом этой группы, однако уже год спустя его лицензия была отозвана из-за неврологических побочных эффектов. Флуоксетин разработан Eli Lilly и одобрен FDA для лечения депрессии в 1987 г. Этот препарат открыл эру СИОЗС, которые преобладают в лечении депрессии вплоть до настоящего времени. Позднее СИОЗС стали также широко использоваться в лечении разных классов тревожных расстройств.
Важным преимуществом СИОЗС по сравнению с ТЦА стал их лучший профиль переносимости и безопасности, в частности, отсутствие у них влияния на кардиальные ионные каналы, гистаминовые и мускариновые рецепторы. Однако СИОЗС обладают собственным профилем побочных эффектов, связанных с повышенной серонинергической трансмиссией и включающих сексуальную дисфункцию, тошноту, нервозность и тревожность. Клинические данные об использовании СИОЗС подтверждают важность захвата 5-HT для развития антидепрессивного эффекта, хотя многие типы серотониновых рецепторов не имеют значения, а теория развития депрессии, связанная с дефицитом 5-HT, является предметом дискуссии до настоящего времени. Кроме того, с того момента, как было доказано, что дезипрамин и ребоксетин, влияющие преимущественно на блокаду захвата NA, также эффективны в лечении депрессии, стало понятно, что и 5-HT, и NA, по-видимому, важны. Комбинированные антидепрессанты двойного действия, блокирующие захват 5-HT и NA одновременно, получили название «селективные ингибиторы обратного захвата серотонина и норадреналина» (СИОЗСН). Первый препарат этой группы венлафаксин был одобрен в 1997 г., второй (дулоксетин) – в 2004 г. В целом антидепрессивная активность СИОЗСН несколько выше, чем у СИОЗС, и они могут быть эффективные у тех пациентов, которые плохо ответили на терапию СИОЗС. Однако не все эксперты соглашаются с данным утверждением, и общая эффективность СИОЗСН может нивелироваться их кардиологическими побочными эффектами, связанными с периферическим NA, что ограничивает использование максимальных доз препарата. Также следует заметить, что использование дулоксетина в лечении нейропатической боли больше связано с ингибированием NA, чем захватом 5-HT, что напоминает ами-триптилин, хотя механизм действия последнего связан с влиянием на натриевые и кальциевые ионные каналы.
Бупропион, зарегистрированный в 1985 г., блокирует транспортеры DA и обладает невысоким клиническим потенциалом действия. Кроме влияния на обмен DA, он также действует на никотиновые рецепторы, что может влиять на его позитивный эффект при лечении депрессии и курения. К сожалению, недавние попытки создать препарат тройного действия, блокирующий захват DA, 5-HT и NA, не увенчались успехом, поэтому возможное благоприятное влияние обратного захвата DA на депрессивную симптоматику не является доказанным фактом.
Отсутствие усиления клинической эффективности СИОЗС по отношению с ТЦА привело к интенсификации попыток создать ингибитор захвата 5-HT с дополнительными свойствами. Одна группа исследователей сосредоточила свои усилия на поиске блокаторов 5-HT1A и 5-HT1B-ауторецепторов для того, чтобы предотвратить обратный захват 5-HT: считалось, что это может повысить клиническую эффективность препаратов, которые замедляют реаптейк 5-HT. Хотя такой механизм действия не был реализован на практике, препарат вилазидон, зарегистрированный в США в 2011 г., является 5-HT1A-частичным агонистом/ингибитором захвата 5-HT, который более сильно повышает экстрацеллюлярный уровень 5-HT, чем чистые СИОЗС. Недавно введенный в клиническую практику вортиоксетин, обладающий способностью ингибировать захват 5-HT, является мультитаргетированным препаратом, воздействующим на 5-HT1A-, 5-HT1B-, 5-HT3- и 5-HT7-рецепторы. Правда, остается не до конца ясным, насколько влияние на эти дополнительные мишени окажется клинически эффективным у пациентов, хотя их терапевтический профиль (включая предполагаемые прокогнитивные свойства) требует дальнейшего уточнения.

Помимо блокирования захвата моноаминов ТЦА также являются антагонистами 5-HT2С-рецепторов, которые, в свою очередь, усиливают трансмиссию DA и NA и ассоциируются с их противотревожными свойствами. Рецепторы a2-AR являются ингибиторами высвобождения DA и NA во фронтальной коре, и их блокада способна улучшить настроение. Важно отметить, что «атипичный» антидепрессант миртазапин (одобренный FDA в 1996 г.) не взаимодействует с моноаминами, но блокирует как 5-HT2С-, так и a2-AR-рецепторы, способствуя высвобождению кортикального Na и DA, и обладает также противотревожными свойствами. К сожалению, антагонизм в отношении гистаминовых рецепторов ассоциируется с повышением массы тела и сомнолентностью, что ограничивает его использование.
Влияние на 5-HT2С-антагонизм совместно с мелатонин-ергическим агонизмом привело к созданию первого немоноаминергического антидепрессанта агомелатина, зарегистрированного в Европе в 2009 г., также обнаруживающего анксиолитические свойства. Агомелатин является отличным примером гибкого подхода в фармацевтической индустрии. Его антагонистические свойства в отношении 5-HT2С-рецепторов первоначально не принимались во внимание, и лишь в процессе изучения препарата они стали рассматриваться с точки зрения потенциальной клинической пользы. В настоящее время изучаются следующие благоприятные свойства блокады 5-HT2С: усиление антидепрессивных свойств, дополнительных к синхронизации ритмов, а также возможный дополнительный анксиолитический эффект, которые в сумме приводят к уникальному фармакологическому и терапевтическому механизму действия.
Общим для всех антидепрессантов, включая агомелатин и миртазапин, является их влияние на мозговой нейротрофический фактор (brain-derived neurotrophic factor – BDNF) и нейрогенез. В то же время изменение их значений при депрессии остается не до конца понятным, и пока еще не появился клинически одобренный антидепрессант, специфично влияющий на BDNF или нейрогенез. Несмотря на перспективные исследования, направленные на изучение антагонизма нейрокинина-1 и кортикотропин-рилизинг-фактора, ни один из этих механизмов не привел к появлению препаратов для лечения депрессии. Это лишь подтверждает тот факт, что «новые» мишени, на которые воздействуют высокоселективные препараты, оказались недостаточно надежными в клинической практике.
Важно отметить, что тианептин, одобренный в 1988 г. в Европе, первоначально рассматривался как препарат, влияющий на повышение захвата 5-HT, но в работах последних лет было показано, что он усиливает синаптическую пластичность путем модулирования глутаматергической передачи. В настоящее время наблюдается оживление интереса к роли глутамата в лечении депрессии, в частности блокирование метаботропных глутаматергических рецепторов 2-го типа, восстановление глутаматергических рецепторов 7-го типа, блокада NDMA-рецепторов, преимущественно их NR2B-субъединицы. Быстрый (в течение часов) антидепрессивный эффект приема единственной дозы неконкурентного антагониста NDMA-рецепторов кетамина, вероятно, связан с его специфическим клеточным механизмом действия, хотя это пока не нашло подтверждения. Является ли антагонизм в отношении NDMA/NR2B-рецепторов надежным, устойчивым и безопасным для применения в практике явлением без риска когнитивного снижения, в настоящее время активно изучается.
Помимо блокирования захвата препарата другим механизмом, повышающим уровень моноаминов, было влияние на их катаболизм. Изониазид, прототип лекарств, названных ингибиторами моноаминоксидазы (ИМАО), был синтезирован фирмой Hoffman-La Roche в 1951 г. в качестве средства для лечения туберкулеза. Изониазид был клинически эффективным антибиотиком и, как было замечено, вызывал у пациентов признаки стимулирования ЦНС. Похожее производное гидразина, ипрониазид, обнаруживал антидепрессивные свойства у нескольких групп пациентов, а его клиническая эффективность была связана с ингибированием МАО. Несмотря на антидепрессивные свойства, ипрониазид обладал высокой печеночной токсичностью, и поэтому в начале 1960-х годов на его основе были синтезированы другие гидразины, такие как фенипразин, необратимый ИМАО. Однако и этот препарат пришлось вскоре отозвать из-за его взаимодействия с продуктами, содержащими тирамин (известный «сырный эффект»), которые усиливают его гипертензивное действие. Транилципромин, зарегистрированный в 1961 г., также сейчас редко используется по этой же причине. Практически все необратимые ИМАО характеризуются кардиоваскулярными побочными эффектами, хотя фенелзин (зарегистрирован в 1961 г.) все еще используется для лечения пациентов с тревожными и атипичными чертами. Дальнейшие исследования протекали в двух направлениях: поиск более безопасных, обратимых ИМАО и дифференцирование МАО типа А, который преимущественно метаболизирует 5-HT, NA и DA и МАО типа В, в основном метаболизирующий DA и фенетиламины, такие как тирамин. Эти исследования привели к появлению обратимого и хорошо переносимого ИМАО-А моклобемида, зарегистрированного в Европе для лечения депрессии и социальной тревоги. В отличие от этого, препараты, нацеленные на МАО типа В, такие как селегилин и разагилин, стали использоваться при симптоматическом лечении болезни Паркинсона.
ЛС для лечения БАР (рис. 3, см. табл. 1)

Антиманиакальные свойства лития были впервые описаны австралийским психиатром Cade в 1949 г. Он обнаружил, что использование лития в виде растворителя для мочевой кислоты при отсутствии обладания токсическими эффектами вызывает у гвинейских свиней заторможенность и успокоение. В то же время исследователи не сразу осознали, что успокоительный эффект связан именно с литием, а не с мочевой кислотой. Позже профессор Cade стал использовать литий для лечения своих психиатрических пациентов, и его способность контролировать маниакальные эпизоды стала очевидной. В начале 1950-х годов были установлены оптимальные терапевтические концентрации препарата и дозы, которые приводят к токсическим побочным эффектам. Однако принятие солей лития психиатрией шло достаточно медленно, и FDA лишь в 1970 г. одобрило его в качестве препарата для лечения маниакально-депрессивного психоза. Одной из причин могло стать отсутствие понимания молекулярных механизмов действия нормотимических свойств лития, хотя эта загадка еще не разгадана до сих пор. Одна из возможных гипотез говорит о том, что литий ингибирует фермент инозитолмонофосфатазу, изменение метаболизма которой влияет на чувствительность разных рецепторов и ионных каналов, устремляющихся ко вторичным мессенджерам, таким как кальций и циклическое GMP. Более поздние исследования показали, что холецистокинин и ингибирование гликоген синтазы киназы-3b могут оказать влияние на дофаминергические, глутаматергические и серотонинергические пути.
Нормотимическое действие конвульсантов ламотриджина (одобрен FDA в 2003 г.) и карбамазепина (одобрен в 2005 г.), по-видимому, тоже достаточно сложное. Ламо-триджин действует на натрийзависимые каналы, снижающие глутаматергическую передачу, а также обладающие нейропротективными свойствами. Карбамазепин оказывает стабилизирующее действие на интактивированные натрийзависимые каналы и, как полагают, усиливает трансмиссию g-аминомасляной кислоты (ГАМК) посредством воздействия на различные субъединицы ГАМКА-рецепторов. Также считается, что они уменьшают гиперактивацию арахидоновой кислоты, индуцирующую, в свою очередь, NDMA, D2 и другие классы рецепторов.
Не совсем понятен и нормотимический эффект вальпроатов. По-видимому, он связан с блокадой натриевых каналов и повышением церебрального уровня ГАМК вследствие замедления распада ГАМК-трансаминазы и подавления обратного захвата ГАМК. Другие возможные механизмы действия вальпроатов включают модулирование глутаматергической передачи, ингибирование арахидоновой кислоты, индукцию BDNF и супрессию децитилирования гистона.
Кроме того, в последнее десятилетие мы стали свидетелями включения в показания к использованию при БАР антипсихотиков, таких как кветиапин. Тем не менее блокада D2/5-HT2A-рецепторов связана, по всей видимости, с влиянием на психотические симптомы, в то время как механизмы, лежащие в основе их антиманиакального действия, все еще остаются неясными. Несмотря на отдельные сообщения о возможности кветиапина улучшать депрессивное состояние у биполярных пациентов путем блокады захвата NA, применение антипсихотиков II поколения при лечении хронической депрессии остается неразумным выбором, по крайней мере исходя из профиля их метаболических и других побочных эффектов.
Можно предположить, что существует лишь несколько способов достижения нормотимического эффекта при БАР, и, несмотря на другие интересные исследования, такие, например, как влияние на сон и циркадные ритмы, основные механизмы, лежащие в основе лабильности аффекта, остаются не до конца понятными, что замедляет прогресс в данной области. Кроме того, хроническая депрессия при БАР с фармакологической и клинической точки зрения отличается от униполярной депрессии в том смысле, что данные пациенты плохо поддаются лечению традиционными антидепрессантами. Можно сказать, что БАР на протяжении многих лет рассматривалось как «бедная родственница» рекуррентной депрессии, и в настоящее время со стороны лиц, страдающих этим расстройством, и их родных существует огромный запрос к фарм-индустрии интенсифицировать исследования по поиску более эффективных методов лечения.
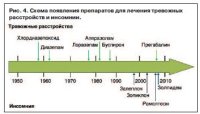
Анксиолитические препараты для лечения тревожных расстройств и инсомнии (рис. 4, см. табл. 1)

Хлордиазепоксид, который стал первым бензодиазепином в клинической практике, был зарегистрирован в 1960 г. Было показано, что данный препарат не воздействует на психотическое поведение, но при этом является эффективным средством для смягчения тревожных состояний. Вскоре на рынке появился другой аналог бензодиазепина, диазепам, и спустя короткое время оба препарата быстро стали очень популярными. К сожалению, несмотря на их высокую безопасность и эффективность в рамках купирующей терапии различных тревожных расстройств, припадков и синдрома отмены алкоголя, позже стало понятно, что их длительное использование приводит к риску увеличения дозы препарата, физической/психологической зависимости и синдрому отмены при прекращении приема. Также стали очевидны и другие нежелательные явления, такие как седация и снижение когнитивного функционирования. Появившаяся в 1970 и 1980-х годах II генерация бензодиазепинов (например, лоразепам и алпразолам), обладающих несколько отличными от классических препаратов фармакологическими и терапевтическими свойствами, к сожалению, также не была лишена таких нежелательных свойств, как толерантность и зависимость.
Анксиолитический механизм действия всех бензодиазепинов связан с усилением ГАМКергической передачи путем связывания с аллостерическим участком ГАМКА-рецепторов. Усилия фарминдустрии были сосредоточены на поиске новых агентов по двум направлениям. Во-первых, поиск препаратов, обладающих другой химической структурой и действующих на специфические аллостерические мишени, локализованные в ГАМК-рецепторах. Во-вторых, поиск веществ, действующих на специфические подтипы ГАМКА-рецепторов, часто обладающих противоположными свойствами и по-разному представленными в головном мозге. Например, вещества, которые действуют как позитивные аллостерические модуляторы a2/3-подтипов рецепторов, проявляют анксиолитические и антиконвульсивные свойства, в то время как инактивация a1-подтипа вызывает седацию, а a5-подтип снижает когнитивные свойства. К сожалению, значительные усилия фарминдустрии зарегистрировать препараты, влияющие на различные подтипы ГАМК-рецепторов, не увенчались успехом, хотя есть данные о том, что преимущественное влияние на a2-подтип ГАМКА-рецепторов может улучшить когнитивную функцию при шизофрении.
Ряд небензодиазепиновых препаратов, зарегистрированных для лечения инсомнии, таких как залеплон, зопиклон и золпидем, действуют на ГАМКА-рецепторы по-иному, нежели классические бензодиазепины, хотя также не лишены побочных эффектов и их не рекомендуют использовать длительное время из-за риска возникновения у некоторых людей зависимости.
Хотя бензодиазепины, влияющие на ГАМКА-рецепторы, все еще достаточно широко используются для краткосрочной терапии тревожных состояний и инсомнии, длительное лечение обычно осуществляется СИОЗС. Это можно объяснить тем, что их первоначальное анксиогенное действие посредством влияния на 5-HT2C-рецепторы постепенно трансформируется (отражая снижение регуляции 5-HT2C-рецепторов) в клинически важное анксиолитическое действие.
Несмотря на то что прегабалин является структурным аналогом ГАМК, механизм его анксиолитического действия (одобрен в Европе в 2007 г.) отличается от бензодиазепинов и СИОЗС и обусловлен захватом синаптических a2d-субъединиц потенциалзависимых кальциевых каналов, что приводит к уменьшения чрезмерного высвобождения возбуждающих нейротрансмиттеров, таких как глутамат и субстанция Р. По сравнению с бензодиазепинами прегабалин обладает меньшей способностью вызывать зависимость и синдром отмены, по крайней мере после краткосрочного курса лечения.
В отличие от прегабалина азаспирон буспирон (зарегистрирован для лечения генерализованных тревожных расстройств – ГТР в США) не взаимодействует с ГАМК-рецепторами. Скорее всего, его частичный агонизм в отношении 5-HT1A-рецепторов способствует высвобождению 5-HT в гиппокампе и амигдале, что приводит к снижению гиперактивации постсинаптических 5-HT2C-рецепторов.
К сожалению, нейропептидные агенты, взаимодействующие с нейрокинином-1, кортикотропин-рилизинг-фактором и рецепторами холецистокинина B, несмотря на благоприятные преклинические испытания, не привели к появлению новых анксиолитиков. Также следует упомянуть о возможности пропранолола контролировать тревожные симптомы. Различные виды психотерапии, как в виде монотерапии, так и вместе с фармакотерапией, являются важными стратегиями лечения тревожных расстройств в общей популяции.
Кроме того, в последние годы исследователи сосредоточили усилия на изучении небензодиазепиновых мелатонинергических механизмах бессонницы, влияющих на регуляцию цикла «сон–бодрствование». Препарат рамелтеон, одобренный FDA в 2005 г. для длительной терапии бессонницы, обладает высоким сродством к M1- и M2-рецепторам в супрахиазматическом ядре, которое, как полагают, и обусловливает его снотворное действие.
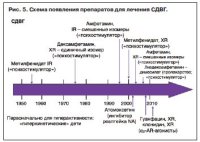
Препараты для лечения синдрома дефицита внимания и гиперактивности (рис. 5, см. табл. 1)

Первая попытка фармакологического лечения синдрома дефицита внимания и гиперактивности (СДВГ) была предпринята американским врачом Bradely, который в 1930-х годах обнаружил, что у детей с неврологическими болезнями использование бензедрина (рацемической смеси амфетамина) приводит к улучшению поведения, школьной успеваемости и снижению гиперактивности. Кроме того, он описал группу детей с чертами, напоминающими СДВГ, которые хорошо реагируют на бензедрин. Однако эти исследования оказались незамеченными на протяжении почти 25 лет, что отчасти связано с доминированием психоаналитических концепций вплоть до 1960-х годов.
FDA лишь в 1955 г. одобрило первый препарат для лечения «гиперактивности» – метилфенидат. Он является замещенным фенилтиламином, который вместе с другими стимуляторами ЦНС первоначально носил название «риталин». Хотя в 1960-х годах он активно назначался гиперактивным детям, его широкое использование при СДВГ у детей произошло только в 1990-е годы, когда сам диагноз СДВГ стал общепринятым. Таким образом, начиная с 1970-х годов, когда он использовался при гиперактивности («гиперкинетическая реакция детства»), акцент его применения постепенно сместился на лечение поддержки устойчивого внимания и гиперактивности как ключевых симптомов СДВГ, что, в свою очередь, привело к пересмотру концепции СДВГ в DSM-IV (Diagnostic and Statistical Manual of mental disorders – Руководство по диагностике и статистике психических расстройств).
Из-за высокой частоты центральных и периферических побочных эффектов бензедрин так и не был одобрен для лечения СДВГ, а метилфенидат стал препаратом 1-й линии для лечения этого расстройства. Кроме того, показания к его назначению сейчас расширены до применения у подростков и взрослых с СДВГ. Однако и другие препараты, обладающие «стимулирующими» свойствами, были одобрены для лечения детей и взрослых с такими симптомами СДВГ, как гиперактивность, снижение внимания и импульсивное поведение, причем последние два симптома лучше всего поддаются терапии. К основным психостимулирующим средствам, используемым сегодня для лечения СДВГ, относятся: комплекс (в основном декстро-) стереоизомеров/солей амфетамина; декстроизомер амфетамина; пролекарство декстроамфетамин с меньшей склонностью к формированию зависимости, лиздексамфетамин димесилат.
Механизмы действия метилфенидата и психостимуляторов разнообразны. В основном они включают пресинаптическое действие на транспортеры, механизмы высвобождения и пути ассоциированных с аминами рецепторов. Все это приводит к повышению синаптического уровня DA и NA, что, в свою очередь, должно восстановить гипотетический дефицит передачи катехоламинов в передней коре. Этот процесс представляется крайне важным, так как повышение трансмиссии улучшает исполнительную функцию, сфокусированное внимание и уменьшает импульсивность. В 2002 г. FDA одобрило для лечения СДВГ селективный ингибитор реаптейка NA атомоксетин, который оказывает более специфическое воздействие на переднюю кору, не вмешиваясь в синаптический механизм высвобождения NA. В отличие от других центральных стимуляторов он обладает меньшим риском вызвать зависимость, однако начинает действовать только через 2–4 нед терапии, и его клиническая эффективность, по-видимому, ниже, чем у аналогов.
Вышесказанное согласуется с тем фактом, что активация постсинаптических a2A-AR-рецепторов их агонистами клонидином и гуанфацином также является эффективной стратегией лечения СДВГ. Оба препарата одобрены FDA в 2010 г. как для монотерапии, так и в сочетании со стимуляторами, по сравнению с которыми они менее эффективны, в большей степени из-за того, что не влияют на D1-рецепторы.
В заключение следует упомянуть важность поведенческой терапии, так как исторически сложившиеся термины «стимуляторы» и «психостимуляторы» не являются слишком удачными для описания фармакотерапии СДВГ у детей и взрослых и не соотносятся с их основными терапевтическими преимуществами. Кроме того, продолжается дискуссия по поводу того, отмечается или нет в настоящее время гипердиагностика и лечение СДВГ.
(Продожение в следующем номере.)
Сведения о референте
Павличенко Алексей Викторович – канд. мед. наук, доц. каф. психиатрии, психотерапии и наркологии ГБОУ ВПО МГМСУ им. А.И.Евдокимова. E-mail: apavlichenko76@gmail.com

