Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2017
Прогнозирование терапевтического ответа на применение анксиолитика Афобазола при тревожных расстройствах: результаты сравнительного с Феназепамом клинико-биохимического исследования активности дипептидилпептидазы-4 №01 2017
Номера страниц в выпуске:8-16
Изучены содержание малонового диальдегида (МДА) и активность дипептидилпептидазы-4 (ДПП-4) у 92 больных с разными тревожными расстройствами и их изменения в процессе терапии анксиолитиками Афобазолом и Феназепамом, реализующими свое анксиолитическое действие через разные механизмы. Бензодиазепиновый анксиолитик Феназепам вызывает снижение концентрации МДА и активности ДПП-4. Терапия мембранным модулятором Афобазолом приводила к снижению уровней МДА и разнонаправленным изменениям активности ДПП-4: ее увеличению у лиц с относительно более низкими фоновыми показателями и снижению – у лиц с более высокими. Различия влияния двух анксиолитиков с разными механизмами действия на МДА и ДПП-4 позволили сформулировать рабочую гипотезу, объясняющую полученные данные с позиций взаимосвязи обоих показателей с повреждением мембран нервных клеток в результате перекисного окисления липидов. Показатель активности ДПП-4 до начала терапии ниже 4,75 нмоль/мл/мин является предиктором высоких терапевтических результатов двухнедельного применения Афобазола у пациентов с тревожными расстройствами.
Ключевые слова: Афобазол (фабомотизол), Феназепам, перекисное окисление липидов, малоновый диальдегид, дипептидилпептидаза-4, тревожные расстройства, эффективность.
sjunja@bk.ru
Ключевые слова: Афобазол (фабомотизол), Феназепам, перекисное окисление липидов, малоновый диальдегид, дипептидилпептидаза-4, тревожные расстройства, эффективность.
sjunja@bk.ru
Изучены содержание малонового диальдегида (МДА) и активность дипептидилпептидазы-4 (ДПП-4) у 92 больных с разными тревожными расстройствами и их изменения в процессе терапии анксиолитиками Афобазолом и Феназепамом, реализующими свое анксиолитическое действие через разные механизмы. Бензодиазепиновый анксиолитик Феназепам вызывает снижение концентрации МДА и активности ДПП-4. Терапия мембранным модулятором Афобазолом приводила к снижению уровней МДА и разнонаправленным изменениям активности ДПП-4: ее увеличению у лиц с относительно более низкими фоновыми показателями и снижению – у лиц с более высокими. Различия влияния двух анксиолитиков с разными механизмами действия на МДА и ДПП-4 позволили сформулировать рабочую гипотезу, объясняющую полученные данные с позиций взаимосвязи обоих показателей с повреждением мембран нервных клеток в результате перекисного окисления липидов. Показатель активности ДПП-4 до начала терапии ниже 4,75 нмоль/мл/мин является предиктором высоких терапевтических результатов двухнедельного применения Афобазола у пациентов с тревожными расстройствами.
Ключевые слова: Афобазол (фабомотизол), Феназепам, перекисное окисление липидов, малоновый диальдегид, дипептидилпептидаза-4, тревожные расстройства, эффективность.
sjunja@bk.ru
Для цитирования: Сюняков Т.С., Незнамов Г.Г., Золотов Н.Н. Прогнозирование терапевтического ответа на применение анксиолитика Афобазола при тревожных расстройствах: результаты сравнительного с Феназепамом клинико-биохимического исследования активности дипептидилпептидазы-4. Психиатрия и психофармакотерапия. 2017; 19 (1): 8–16.
Malondialdehyde (MDA) levels and dipeptidyl peptidase-4 (DPP-4) activity in plasma in 92 patients with different anxiety disorders and their changes during treatment with Phenazepam and Afobazol characterized by distinct mechanisms in anxiolytic action were examined. Benzodiazepine drug Phenazepam decreased both MDA levels and DPP-4 activity while treatment with membrane modulator Afobazol decreased DPP-4 activity in patients with its relatively high background levels and increased it patients with relatively low background levels. Distinct profiles of changes of both biochemical parameters during treatment with different anxiolytics allowed to make an operational hypothesize that links the findings with neuronal membranes damage due to lipid peroxidation processes. DPP-4 activity levels below 4.75 nmol/ml/min predicts favorable outcome of 2-weeks Afobazol treatment in patients with anxiety disorders.
Key words: Afobazol (fabomotizole), Phenazepam, lipid peroxidation, malondialdehyde, dipeptidyl peptidase-4, anxiety disorders, efficacy.
sjunja@bk.ru
For citation: Syunyakov T.S., Neznamov G.G., Zolotov N.N. Predicting treatment response on the use of anxiolytic Afobazol in anxiety disorders: results of a comparative clinical and biochemical study of activity of dipeptidyl peptidase-4 with Phenazepam. Psychiatry and Psychopharmacotherapy. 2017; 19 (1): 8–16.
К мембранно-зависимым нарушениям можно отнести также и наблюдаемое при ТР увеличение активности и концентрации в плазме крови дипептидилпептидазы-4 (ДПП-4). На это указывают следующие факты:
1) существуют две фракции ДПП-4, одна из которых закреплена на поверхности клеточных мембран и имеет трансмембранный и внешний домены, а другая находится в системной циркуляции;
2) циркулирующая (растворимая) фракция представляет собой усеченный вариант большего варианта белка и по первичной структуре, и по молекулярной массе соответствует наружному фрагменту [11];
3) имеются сведения о том, что при некоторых заболеваниях печени повреждение гепатоцитов ассоциируется с нарушением якорения (фиксации) наружного фрагмента к мембране, его отщеплением и усиленным поступлением в системный кровоток [12–14].
Учитывая, что повреждение клеточной мембраны в результате активации ПОЛ может облегчить отсоединение поверхностного фрагмента ДПП-4 от мест его фиксации и способствовать повышению концентрации и активности растворимой фракции фермента, представляется важным рассмотреть с этих позиций значение выявленного ранее при ТР увеличения как активности [15, 16], так и концентрации ДПП-4 [17], хотя не исключено, что в патогенезе ТР играет роль и энзиматическая активность фермента, расщепляющего многие нейропептиды, в том числе нейропептид Y, участвующий в регуляции тревоги [18].
Афобазол (фабомотизол) – это анксиолитический препарат, одними из механизмов действия которого являются препятствие стресс-индуцированному падению связывающей способности бензодиазепинового рецептора [5, 19] и опосредованная активацией s1-рецепторов миграция липидных микродоменов от эндоплазматического ретикулума к мембране клетки [20]. Ранее были опубликованы данные об устойчивом снижении при терапии Афобазолом повышенного у пациентов с ТР содержания малонового диальдегида (МДА) в плазме крови, что потенциально свидетельствует о благоприятном действии препарата на активность процессов ПОЛ [21]. Также выявлена взаимосвязь между активностью ДПП-4 и эффективностью терапии Афобазолом [15].
Целью данной работы является изучение изменения активности ДПП-4 и процессов ПОЛ под действием Афобазола по сравнению с классическим бензодиазепиновым анксиолитиком Феназепамом для уточнения роли ДПП-4 в патогенезе ТР и возможности прогноза эффективности фармакотерапии ТР этими препаратами.
Полные данные о фрагменте исследования, касающемся влияния Феназепама на активность ДПП-4, а также содержания основного конечного продукта ПОЛ МДА, были опубликованы ранее [16, 21].
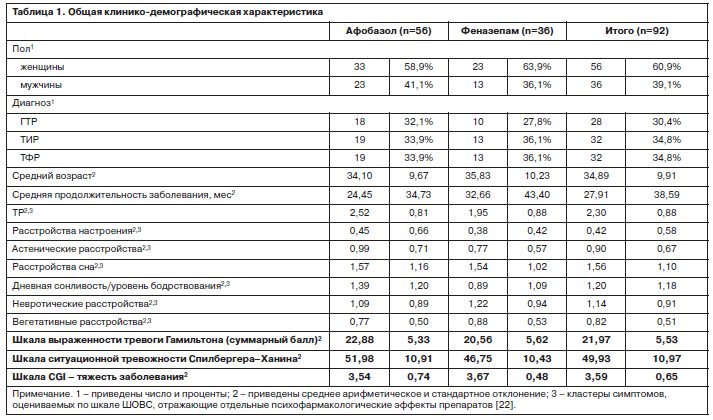 В исследование включены 92 пациента в возрасте от 20 до 57 лет с разными по структуре ТР: генерализованным ТР (ГТР, код по Международной классификации болезней 10-го пересмотра – F41.1), агорафобией [тревожно-фобическое расстройство – ТФР (F40.0)] и ипохондрическим расстройством [тревожно-ипохондрическое расстройство – ТИР (F45.2)] без сопутствующей психиатрической и соматоневрологической патологии, не принимавшие по меньшей мере в течение 1 нед до включения в исследование бензодиазепинов и Афобазола и в течение 2 нед – любых других психотропных препаратов. Из них 56 пациентов получали терапию Афобазолом (30 мг/сут), а 36 – Феназепамом (2 мг/сут)2. Длительность терапии составила 14 дней. Общая клинико-демографическая характеристика изученных больных приведена в табл. 1.
В исследование включены 92 пациента в возрасте от 20 до 57 лет с разными по структуре ТР: генерализованным ТР (ГТР, код по Международной классификации болезней 10-го пересмотра – F41.1), агорафобией [тревожно-фобическое расстройство – ТФР (F40.0)] и ипохондрическим расстройством [тревожно-ипохондрическое расстройство – ТИР (F45.2)] без сопутствующей психиатрической и соматоневрологической патологии, не принимавшие по меньшей мере в течение 1 нед до включения в исследование бензодиазепинов и Афобазола и в течение 2 нед – любых других психотропных препаратов. Из них 56 пациентов получали терапию Афобазолом (30 мг/сут), а 36 – Феназепамом (2 мг/сут)2. Длительность терапии составила 14 дней. Общая клинико-демографическая характеристика изученных больных приведена в табл. 1.
Группу контроля составили 33 здоровых добровольца (17 мужчин и 16 женщин) без соматической и неврологической патологии в возрасте от 19 до 32 лет.
A = [(E - C)/(S - B)]×t-1×v-1,
где E – флуоресценция пробы (380/460 нм); C – флуоресценция смеси, содержащей по 0,02 мл субстрата и плазмы крови, 0,76 мл трис-HCl (приготовленного из трис-основания, «Serva», Германия) буфера (pH 8,0), содержащего по 1мМ ЭДТА-Na2 («Reanal», Венгрия), дитиотреитола («Serva», Германия) и 0,2 мл 20% уксусной кислоты; B – флуоресценция смеси, содержащей 0,02 мл субстрата, 0,78 мл трис-HCl буфера (pH 8,0), содержащего по 1 мМ ЭДТА-Na2, дитиотреитола и 0,2 мл уксусной кислоты; S – флуоресценция смеси, содержащей 0,02 мл субстрата, 0,78 мл трис-HCl буфера (рН 8,0), содержащего по 1 мМ ЭДТА-Na2, дитиотреитола и 0,2 мл 20% уксусной кислоты и 0,02 мл раствора 7-амино-4-метилкумарина («Serva», Германия; 2 нмоль), t – время инкубации в минутах, v – объем ферментного препарата в миллилитрах.
Инкубационная смесь состояла из 0,02 мл плазмы крови в 0,02 М трис-HCl буфере (pH 7,5), содержащем по 1 мМ ЭДТА-Na2 и дитиотреитола; 0,02 мл раствора Z-Gly-Pro-МСА (синтезирован в ФГБНУ «НИИ биомедицинской химии им. В.Н.Ореховича» доктором химических наук В.Ф.Поздневым) в DMSO («Реахим», Россия) с концентрацией субстрата 1 мг/мл и 0,76 мл 0,02 М трис-HCl буфера (pH 8,0), содержащего по 1мМ ЭДТА-Na2, дитиотреитола. Остановка реакции производилась добавлением в инкубационную смесь 0,2 мл 20% уксусной кислоты.
Все измерения проводили в трех параллелях.
Все измерения проводили в трех параллелях.
Статистические расчеты производились при помощи статистического пакета SPSS 22.
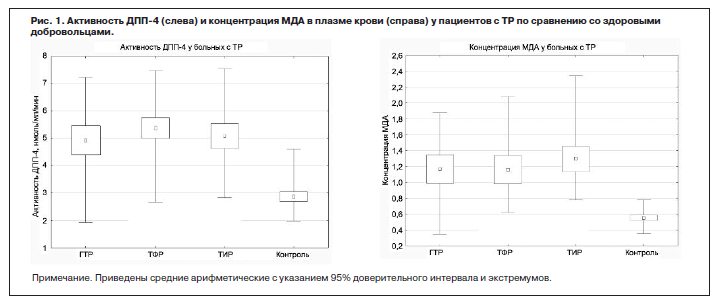
 На рис. 1 приведены суммарные данные об активности ДПП-4 и содержании в плазме крови МДА у исследованных больных по сравнению со здоровыми добровольцами.
На рис. 1 приведены суммарные данные об активности ДПП-4 и содержании в плазме крови МДА у исследованных больных по сравнению со здоровыми добровольцами.
Оба биохимических показателя у пациентов с ТР исследованной структуры достоверно (при p<0,01) превышали их значения у здоровых добровольцев. Средние значения активности ДПП-4 у 92 больных составили 5,13±1,21 нмоль/мл/мин по сравнению с 2,84±0,57 нмоль/мл/мин в группе контроля, а концентрация МДА у пациентов составила 1,21±0,39 (n=68) по сравнению с 0,55±0,1 в группе контроля.
При этом при анализе взаимосвязи активности ДПП-4 и концентрации МДА у изученной популяции пациентов и контрольной группы, как это видно на диаграмме рассеивания (рис. 2), выявляется достоверная корреляционная зависимость между обоими параметрами (r=0,545; p<0,001; n=68).
Важно отметить, что по результатам двухнедельного применения анксиолитиков Афобазола в дозе 30 мг и Феназепама в дозе 2 мг оба биохимических показателя сохранили достоверные различия от их значений у здоровых добровольцев.
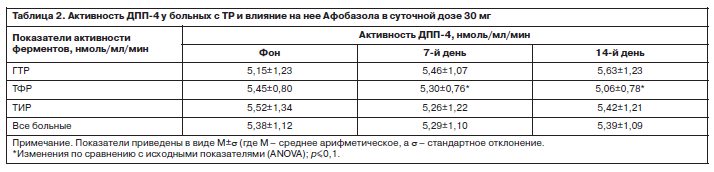
 Данные о терапевтических изменениях активности ДПП-4 у больных с ТР при применении Афобазола в суточной дозе 30 мг приведены в табл. 2.
Данные о терапевтических изменениях активности ДПП-4 у больных с ТР при применении Афобазола в суточной дозе 30 мг приведены в табл. 2.
Анализ динамики активности ДПП-4 при ее суммарной оценке у всей популяции больных показал практическое отсутствие изменений за 14 дней терапии препаратом. Вместе с тем терапевтические изменения энзиматической активности различались у пациентов разных диагностических подгрупп. У больных с ГТР отмечался недостоверный рост активности фермента на 7 и 14-й день исследования, у пациентов с ТФР – статистически значимое снижение, а у больных с ТИР – уровни оставались практически стабильными на 7 и 14-й день. При этом изменения активности ДПП-4 к 14-му дню у пациентов с ГТР и ТФР различались на уровне тенденции к статистической достоверности (p=0,09).
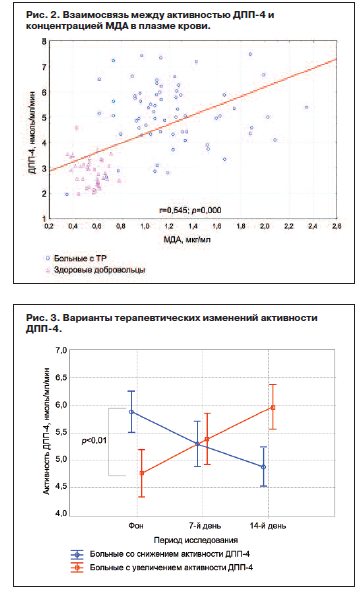
Однако при детальном анализе выявилась принципиально важная индивидуальная вариабельность изменения активности ДПП-4 под влиянием Афобазола у исследованных больных, при этом отмечались как увеличение (n=22), так и ее снижение (n=28). Установлено, что повышение активности ДПП-4 под влиянием Афобазола происходило у больных с низкими ее фоновыми значениями, а снижение – с исходно высокими (рис. 3; различия фоновых значений статистически достоверны); p<0,01.
Подтверждением данной закономерности является достоверная корреляция между исходной активностью ДПП-4 у пациентов с ТР и ее изменением через 14 дней терапии.
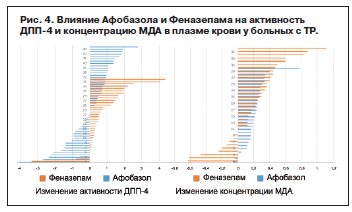
 Более однозначное влияние Афобазол оказывал на содержание МДА в плазме крови больных, снижая данный показатель по результатам двухнедельной терапии у 29 из 32 пациентов (рис. 4) [21].
Более однозначное влияние Афобазол оказывал на содержание МДА в плазме крови больных, снижая данный показатель по результатам двухнедельной терапии у 29 из 32 пациентов (рис. 4) [21].
Иная картина наблюдалась при применении Феназепама. Его использование ассоциировалось со стабильным снижением активности ДПП-4 (у 33 из 36 пациентов), при более значительной индивидуальной вариабельности изменений содержания МДА по сравнению с Афобазолом (увеличение содержания – у 9 больных, снижение – у 27); см. рис. 4 [15, 21].
Таким образом, Афобазол приводил к стабильному уменьшению содержания МДА, что соотносится с представлениями о его механизмах действия, тогда как активность ДПП-4 менялась разнонаправленно и зависела от фонового ее уровня. Феназепам приводил к уменьшению обоих биохимических показателей, более стабильному в отношении ДПП-4 и менее стабильному – в отношении МДА. Факт разного влияния эффективных в отношении ТР препаратов с различными механизмами действия на активность ДПП-4 с высокой степенью вероятности указывает на то, что сам по себе данный показатель не является эпифеноменом тревоги.
С учетом выявленной при применении Афобазола вариабельности динамики ферментативной активности в зависимости от ее фоновых уровней представляют интерес клинические различия у пациентов с разными вариантами динамики активности ДПП-4.
Установлено, что больные с исходно более низкими показателями активности ДПП-4 с ее последующим увеличением характеризовались меньшей выраженностью психопатологической симптоматики по сравнению с пациентами, имевшими высокие фоновые показатели активности с ее последующим снижением (средний балл по кластеру тревожных симптомов по шкале ШОВС: 2,23 и 2,81, соответственно, р=0,009, n=51; средний балл по кластеру невротических симптомов: 0,84 и 1,33, соответственно, р=0,065, n=51). На уровне отдельных симптомов достоверные различия отмечались в отношении повышенной раздражительности, аффективной лабильности, расстройств пробуждения, идеаторных навязчивостей, фобий и психовегетативных симптомов (артериальная гипертензия и пароксизмальные вегетативные расстройства).
 При изучении взаимосвязи между фоновой активностью ДПП-4 были обнаружены достоверные корреляции с изменением показателя дневной сонливости на 7 и 14-й день (D0 - Dn, где D0 – фоновые значения, а Dn – значения на 7 или 14-й день; R=0,39, p=0,003 и R=0,28, p=0,039, соответственно, n=51). Особенно отчетливо данная взаимосвязь прослеживается среди пациентов с ТИР (R=0,82, p<0,001 и R=0,53, p=0,02, на 7 и 14-й день, соответственно, n=17). Кроме того, у больных с ТФР (n=18) выявлена достоверная корреляция фоновой активности ДПП-4 и динамики астенических расстройств на 7-й день терапии (R=-0,48, p=0,041), а на уровне тенденции – с терапевтическими изменениями к 7 и 14-му дню выраженности гипотимии и сопряженных с ней симптомов (R=-0,41, p=0,088 и R=-0,46, p=0,054, соответственно, на 7 и 14-й день). У пациентов с ГТР (n=16) на уровне тенденции к статистической достоверности выявлена взаимосвязь активности ДПП-4 до начала терапии и динамикой нарушений сна на 14-й день (R=0,46, p=0,064).
При изучении взаимосвязи между фоновой активностью ДПП-4 были обнаружены достоверные корреляции с изменением показателя дневной сонливости на 7 и 14-й день (D0 - Dn, где D0 – фоновые значения, а Dn – значения на 7 или 14-й день; R=0,39, p=0,003 и R=0,28, p=0,039, соответственно, n=51). Особенно отчетливо данная взаимосвязь прослеживается среди пациентов с ТИР (R=0,82, p<0,001 и R=0,53, p=0,02, на 7 и 14-й день, соответственно, n=17). Кроме того, у больных с ТФР (n=18) выявлена достоверная корреляция фоновой активности ДПП-4 и динамики астенических расстройств на 7-й день терапии (R=-0,48, p=0,041), а на уровне тенденции – с терапевтическими изменениями к 7 и 14-му дню выраженности гипотимии и сопряженных с ней симптомов (R=-0,41, p=0,088 и R=-0,46, p=0,054, соответственно, на 7 и 14-й день). У пациентов с ГТР (n=16) на уровне тенденции к статистической достоверности выявлена взаимосвязь активности ДПП-4 до начала терапии и динамикой нарушений сна на 14-й день (R=0,46, p=0,064).
При оценке взаимосвязей между содержанием МДА до начала лечения и изменением показателей психического состояния при применении Афобазола у всех больных вне зависимости от диагноза были выявлены взаимосвязи с выраженностью изменения кластера ТР (r=0,368, p=0,045), астенических расстройств (r=0,45, p=0,013) и суммарного балла тревоги по шкале HAMA (r=0,419, p=0,021).
В терапевтической группе Феназепама вне зависимости от диагноза начальные уровни активности ДПП-4 не обнаружили корреляции с изменениями показателей состояния, а содержание МДА коррелировало только с изменением выраженности дневной сонливости (r=-0,433, p=0,008).
 Выявлена слабая корреляция между фоновой активностью ДПП-4 и эффективностью терапии по шкале CGI «Терапевтический эффект» у всех изученных пациентов с ТР (R=0,28, p=0,046, n=51). Кроме того, на уровне тенденции к статистической достоверности устанавливались связи с показателями других подшкал шкалы CGI на 14-й день (с тяжестью заболевания: R=0,27, p=0,053; с общим улучшением: R=0,25, p=0,071). Аналогичная корреляция была выявлена для субъективного параметра эффективности (R=-0,29, p=0,036). При этом у больных с ГТР, у которых Афобазол наиболее эффективен, коэффициент корреляции с показателями CGI «Терапевтический эффект» возрастал до 0,47 (p=0,053), а с субъективно оцениваемой пациентами эффективностью курсовой терапии – до -0,56 (р=0,02). При этом в группах больных с ТФР и ТИР достоверных корреляций с показателями шкалы CGI и субъективной оценкой эффективности не выявлялось. Положительный характер корреляций с показателями шкалы CGI и отрицательный с показателями субъективной оценки свидетельствует о том, что, чем ниже начальный уровень активности ДПП-4, тем выше эффективность терапии и легче тяжесть состояния на 14-й день лечения.
Выявлена слабая корреляция между фоновой активностью ДПП-4 и эффективностью терапии по шкале CGI «Терапевтический эффект» у всех изученных пациентов с ТР (R=0,28, p=0,046, n=51). Кроме того, на уровне тенденции к статистической достоверности устанавливались связи с показателями других подшкал шкалы CGI на 14-й день (с тяжестью заболевания: R=0,27, p=0,053; с общим улучшением: R=0,25, p=0,071). Аналогичная корреляция была выявлена для субъективного параметра эффективности (R=-0,29, p=0,036). При этом у больных с ГТР, у которых Афобазол наиболее эффективен, коэффициент корреляции с показателями CGI «Терапевтический эффект» возрастал до 0,47 (p=0,053), а с субъективно оцениваемой пациентами эффективностью курсовой терапии – до -0,56 (р=0,02). При этом в группах больных с ТФР и ТИР достоверных корреляций с показателями шкалы CGI и субъективной оценкой эффективности не выявлялось. Положительный характер корреляций с показателями шкалы CGI и отрицательный с показателями субъективной оценки свидетельствует о том, что, чем ниже начальный уровень активности ДПП-4, тем выше эффективность терапии и легче тяжесть состояния на 14-й день лечения.
С целью проверки выявленных корреляционных связей между фоновой активностью ДПП-4 и эффективностью терапии выборка изученных пациентов была классифицирована в соответствии с результативностью терапии по шкале CGI «Терапевтический эффект» на больных с высокой эффективностью (1 и 2 балла по шкале) и низкой эффективностью (3 и 4 балла по шкале). При сравнении этих двух групп пациентов были выявлены статистически достоверные различия активности ДПП-4 до начала лечения (4,94 и 5,64 нмоль/мл/мин у пациентов с высоким и низким терапевтическим эффектом); p=0,015. Аналогичные статистически достоверные различия выявлялись и при оценке больных с ГТР (4,62 и 6,10 нмоль/мл/мин у пациентов с высоким и низким терапевтическим эффектом); p=0,015.
Фоновая активность МДА не коррелировала ни с одним из показателей результативности терапии при применении Афобазола. Кроме того, фоновые значения активности ДПП-4 или содержания МДА не обнаруживали взаимосвязи с результатами терапии Феназепамом ни у всех пролеченных больных, ни в диагностических группах.
 Учитывая полученные данные о взаимосвязи исходной активности ДПП-4 с эффективностью терапии Афобазолом, был проведен регрессионный анализ методом бинарной логистической регрессии с целью оценки вклада данного показателя в эффективность. На I этапе с помощью процедуры «Автоматизированное линейное моделирование» (прямой пошаговый метод), в которую в качестве зависимой переменной были внесены показатели высокого (1 и 2 балла) или низкого (3 и 4 балла) терапевтического эффекта по шкале CGI «Терапевтический эффект» для создания стандартной модели были определены наиболее значимые независимые переменные фонового состояния пациентов среди следующих: активность ДПП-4, содержание МДА в плазме крови, суммарный балл по шкале HAMA, балл по шкале CGI «Тяжесть заболевания», средние показатели по кластерам симптомов, отражающих фармакологические эффекты препаратов по шкале ШОВС (ТР, депрессивные расстройства, астенические расстройства, нарушения сна, уровень бодрости, невротические расстройства, вегетативные расстройства). По результатам данного анализа статистически достоверную значимость имели лишь два показателя – активность ДПП-4 и суммарный балл по шкале HAMA.
Учитывая полученные данные о взаимосвязи исходной активности ДПП-4 с эффективностью терапии Афобазолом, был проведен регрессионный анализ методом бинарной логистической регрессии с целью оценки вклада данного показателя в эффективность. На I этапе с помощью процедуры «Автоматизированное линейное моделирование» (прямой пошаговый метод), в которую в качестве зависимой переменной были внесены показатели высокого (1 и 2 балла) или низкого (3 и 4 балла) терапевтического эффекта по шкале CGI «Терапевтический эффект» для создания стандартной модели были определены наиболее значимые независимые переменные фонового состояния пациентов среди следующих: активность ДПП-4, содержание МДА в плазме крови, суммарный балл по шкале HAMA, балл по шкале CGI «Тяжесть заболевания», средние показатели по кластерам симптомов, отражающих фармакологические эффекты препаратов по шкале ШОВС (ТР, депрессивные расстройства, астенические расстройства, нарушения сна, уровень бодрости, невротические расстройства, вегетативные расстройства). По результатам данного анализа статистически достоверную значимость имели лишь два показателя – активность ДПП-4 и суммарный балл по шкале HAMA.
По результатам внесения этих переменных в регрессионную модель методом бинарной логистической регрессии была получена достоверная модель (c2=15,37, df=2, p=0,0005). Регрессионное уравнение имеет следующий вид: p=1/1 + e8.77 - (0,916×ДПП-4) - (0,171×HAMA), где p – высокая или низкая эффективность терапии.
Ошибка предсказания с использованием данного уравнения регрессии составила 28,3%.
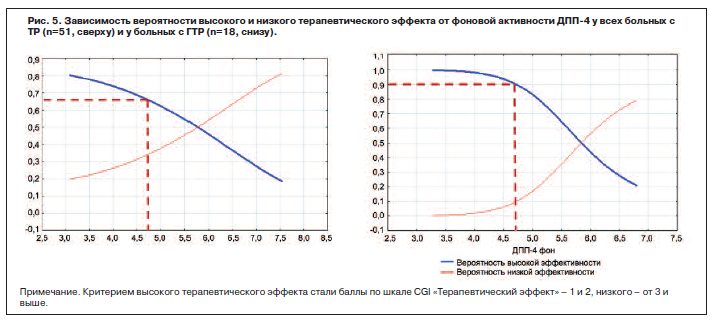
На рис. 5 представлены графики зависимости вероятности высокого или низкого терапевтического эффекта Афобазола в зависимости от исходной активности ДПП-4 у всех больных и больных с ГТР (метод Naive Bayes Classifiers).
Если при анализе всех пациентов (n=51) вероятность высокого терапевтического эффекта составила 45,0%, то у больных с фоновой активностью ДПП-4<4,75 нмоль/ мл/мин (n=17 из 51) вероятность благоприятных исходов терапии превышала 65%. В группе ГТР данное пограничное значение фоновой активности ДПП-4 позволяет выделить подгруппу пациентов (n=7 из 18), у которых высокий терапевтический эффект достигается с более чем 90% вероятностью по сравнению с 62,5% у всех больных с ГТР (n=18).
В результате исследования подтверждены данные о повышении активности ДПП-4 и содержания МДА в плазме крови у больных с разными ТР по сравнению со здоровыми добровольцами. Обнаружены корреляции обоих биохимических параметров с некоторыми клиническими характеристиками состояния. Однако если соотношения между содержанием в плазме крови МДА, отражающим активность процессов ПОЛ, и длительностью заболевания/выраженностью астенических расстройств представляются закономерными [9], то взаимосвязи между активностью ДПП-4 и выраженностью ТФР требуют отдельного анализа.
Такой анализ был проведен путем изучения и сопоставления динамики обоих показателей под влиянием двух эффективных при терапии ТР препаратов, обладающих принципиально отличающимися основными механизмами реализации своего терапевтического действия.
Классический бензодиазепиновый анксиолитик Феназепам в большинстве случаев приводит к снижению содержания МДА и активности ДПП-4. Снижение содержания МДА при терапии бензодиазепинами ранее было описано в литературе [10]. Афобазол, относящийся к классу мембранных модуляторов, при снижении содержания МДА вызывает как увеличение, так и уменьшение активности ДПП-4. При этом выявлена закономерность, что повышение активности фермента наблюдается в группе пациентов c ТР с относительно более низкими начальными уровнями активности ДПП-4 в плазме крови, а снижение, наоборот, в группе с относительно более высокими фоновыми значениями. Следует отметить, что показатели активности фермента до начала терапии в этих группах статистически достоверно различались.
Факт разного влияния на активность ДПП-4 эффективных в отношении ТР препаратов, обладающих различными механизмами действия, указывает на то, что с высокой степенью вероятности сам по себе данный показатель не является эпифеноменом тревоги. Таким образом, выявленные особенности активности ДПП-4 у больных с ТР и влияние на нее эффективного в клинических условиях анксиолитика Афобазола в виде модулирующего действия со снижением относительно высоких и увеличением относительно низких значений активности фермента свидетельствует о том, что, вероятно, регуляция состояния системы эндопептидаз, а может быть и более общих патологических изменений осуществляется у этих пациентов на отличном от здоровых лиц уровне, являющемся следствием патологической адаптации (аллостаза).
Одной из возможных трактовок наблюдаемых изменений может являться то, что повышенные уровни МДА в плазме крови, по всей видимости, в большей степени характеризуют общепатологические изменения у больных с ТР (достижение аллостаза, сам факт вовлеченности ПОЛ в патогенез), ассоциирующиеся с прогрессированием болезненного процесса (это, в частности, объясняет обнаруженные связи с общей продолжительностью заболевания и снижением уровня бодрости [21] и соотносится с литературными данными о роли процессов ПОЛ в патогенезе ТР [9]). Вместе с тем активность ДПП-4 ввиду ее гетерогенности, ассоциирующейся с выраженностью тревоги и невротических расстройств в большей степени, по-видимому, связана с некоторыми аспектами общей тяжести состояния в рамках достигнутого аллостатического равновесия.
Кроме того, получены данные о том, что при применении Афобазола, но не Феназепама, выявляется взаимосвязь между фоновой активностью ДПП-4 и сразу несколькими параметрами, отражающими эффективность терапии. При этом данная взаимосвязь усиливается у пациентов с ГТР, у которых Афобазол наиболее эффективен. Наряду с этим получены данные о том, что показатели активности ДПП-4 и суммарного балла по шкале HAMA до начала терапии являются предикторами результатов двухнедельного применения Афобазола у больных с разными ТР, и особенно в более узкой группе пациентов с относительно простой структурой синдрома в рамках ГТР, а учет исходной активности фермента с пограничным значением в 4,75 нмоль/мл/мин позволяет улучшить ожидаемый прогноз терапии на 20–30%. Однако эти данные нуждаются в репликации.
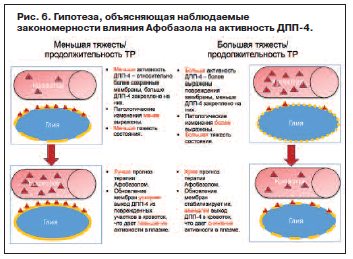
Отдельного обсуждения требуют данные об ассоциации высокой эффективности Афобазола с увеличением, а не снижением активности ДПП-4, хотя у пациентов с ТР она и без того статистически достоверно выше, чем у здоровых добровольцев. Для объяснения кажущихся противоречий мы сформулировали упрощенную механистическую гипотезу (рис. 6), исходя из современного понимания патогенетического значения процессов ПОЛ в генезе ТР и известных механизмов реализации анксиолитического действия Афобазола:
1. Процессы ПОЛ вовлечены в патогенез ТР [26, 27] и реализуются в клеточных мембранах по механизмам цепной реакции, вызывая их непрерывно расширяющееся повреждение [28].
2. ДПП-4 является трансмембранным белком, и повреждение мембраны клетки может приводить к нарушению якорения его наружного фрагмента, сохраняющего энзиматическую активность, что может приводить к выходу дополнительной фракции фермента в свободную циркуляцию и повышению его активности в плазме.
3. Выявленные взаимосвязи между активностью ДПП-4 и выраженностью тревоги, а также между содержанием МДА и продолжительностью заболевания могут свидетельствовать о том, что различной по глубине поражения патологии соответствует разная степень повреждения клеточных мембран.
4. Как следствие представляется закономерным то, что, чем менее выражено и менее продолжительно патологическое состояние, тем более сохранны мембраны, и тем менее нарушено якорение наружного фрагмента ДПП-4 и, следовательно, тем меньше его избыточных количеств поступает в свободную циркуляцию. И, наоборот, более тяжелое и затяжное патологическое состояние сопровождается более выраженными мембранными изменениями, нарушением якорения ДПП-4 и его облегченным выходом в плазму крови.
5. Одним из наиболее значимых механизмов действия Афобазола является активация s1-рецепторов [20], вызывающая миграцию липидных микродоменов от шероховатого эндоплазматического ретикулума к клеточной мембране с последующим слиянием с ней, заменяя собой участки плазмолеммы, что в свою очередь может приводить к сокращению площади вызванных ПОЛ повреждений мембран.
6. Это в итоге может приводить к снижению содержания продуктов ПОЛ в плазме крови, что соответствует как полученным в исследовании данным о снижении при терапии Афобазолом содержания МДА, так и результатам экспериментальных исследований [29].
7. В случае более выраженных нарушений структуры мембраны (теоретически ассоциированных с более тяжелым состоянием) якорение ДПП-4 нарушено в большей степени, следовательно, на мембране закреплено меньшее количество ДПП-4 и относительно большее количество находится в системной циркуляции. Встраивание под действием Афобазола липидных микродоменов в поврежденную мембрану может приводить к ее «стабилизации» и постепенному снижению облегченного поступления ДПП-4 в плазму крови, а следовательно, уменьшению активности фермента в плазме.
8. В ситуации менее выраженного повреждения плазмолеммы (т.е. теоретически, при меньшей тяжести состояния), когда относительно большое количество ДПП-4 остается закрепленным на клеточной мембране, а в циркуляции находятся относительно более низкие концентрации, слияние новых липидных микродоменов с клеточной мембраной при терапии Афобазолом потенциально может приводить к усилению выхода ДПП-4.
Тем не менее данная гипотеза нуждается в подтверждении. В пользу ее правомерности могли бы выступать данные о более однозначном снижении активности ДПП-4 при увеличении дозы Афобазола и/или продолжительности его применения. Кроме того, улучшению понимания наблюдаемых изменений могло бы способствовать изучение динамики активности ДПП-4 при назначении других мембранных модуляторов, антиоксидантов и противовоспалительных препаратов.
2. Обладающие разными механизмами реализации анксиолитического действия препараты Афобазол и Феназепам вызывают снижение содержания МДА в плазме крови.
3. Афобазол и Феназепам обладают различным влиянием на активность ДПП-4: классический бензодиазепиновый анксиолитик Феназепам в большинстве случаев приводит к снижению активности ДПП-4. Афобазол, относящийся к классу мембранных модуляторов, вызывает повышение активности фермента у пациентов с ТР с относительно более низкими фоновыми уровнями активности ДПП-4 в плазме крови, и снижение – с относительно более высокими.
4. Показатель активности ДПП-4 до начала терапии ниже 4,75 нмоль/мл/мин является предиктором высоких терапевтических результатов двухнедельного применения Афобазола у пациентов с ТР.
Cведения об авторах
Сюняков Тимур Сергеевич – канд. мед. наук, ст. науч. сотр. лаб. клин. психофармакологии ФГБНУ «НИИ фармакологии им. В.В.Закусова». E-mail: sjunja@bk.ru
Незнамов Григорий Георгиевич – д-р мед. наук, проф., зам. дир. по науч. работе, зав. лаб. клин. психофармакологии ФГБНУ «НИИ фармакологии им. В.В.Закусова». E-mail: neznamovpharm@mail.ru
Золотов Николай Николаевич – гл. науч. сотр., д-р биол. наук, проф. лаб. психофармакологии ФГБНУ «НИИ фармакологии им. В.В.Закусова». E-mail: zolotovnn@gmail.com
Ключевые слова: Афобазол (фабомотизол), Феназепам, перекисное окисление липидов, малоновый диальдегид, дипептидилпептидаза-4, тревожные расстройства, эффективность.
sjunja@bk.ru
Для цитирования: Сюняков Т.С., Незнамов Г.Г., Золотов Н.Н. Прогнозирование терапевтического ответа на применение анксиолитика Афобазола при тревожных расстройствах: результаты сравнительного с Феназепамом клинико-биохимического исследования активности дипептидилпептидазы-4. Психиатрия и психофармакотерапия. 2017; 19 (1): 8–16.
Predicting treatment response on the use of anxiolytic Afobazol in anxiety disorders: results of a comparative clinical and biochemical study of activity of dipeptidylpeptidase-4 with Phenazepam
T.S.Syunyakov, G.G.Neznamov, N.N.Zolotov
V.V.Zakusov Institute of Pharmacology. 125315, Russian Federation, Moscow, ul. Baltiiskaia, d. 8
Malondialdehyde (MDA) levels and dipeptidyl peptidase-4 (DPP-4) activity in plasma in 92 patients with different anxiety disorders and their changes during treatment with Phenazepam and Afobazol characterized by distinct mechanisms in anxiolytic action were examined. Benzodiazepine drug Phenazepam decreased both MDA levels and DPP-4 activity while treatment with membrane modulator Afobazol decreased DPP-4 activity in patients with its relatively high background levels and increased it patients with relatively low background levels. Distinct profiles of changes of both biochemical parameters during treatment with different anxiolytics allowed to make an operational hypothesize that links the findings with neuronal membranes damage due to lipid peroxidation processes. DPP-4 activity levels below 4.75 nmol/ml/min predicts favorable outcome of 2-weeks Afobazol treatment in patients with anxiety disorders.
Key words: Afobazol (fabomotizole), Phenazepam, lipid peroxidation, malondialdehyde, dipeptidyl peptidase-4, anxiety disorders, efficacy.
sjunja@bk.ru
For citation: Syunyakov T.S., Neznamov G.G., Zolotov N.N. Predicting treatment response on the use of anxiolytic Afobazol in anxiety disorders: results of a comparative clinical and biochemical study of activity of dipeptidyl peptidase-4 with Phenazepam. Psychiatry and Psychopharmacotherapy. 2017; 19 (1): 8–16.
Введение
Среди многочисленных механизмов формирования, прогрессирования и хронификации тревожных расстройств (ТР) важное место занимают патологические процессы, протекающие в мембранах нервных клеток. К их числу относятся стрессиндуцированное падение связывающей способности бензодиазепинового участка ГАМК1 А-рецептора [1–5], а также повреждения вследствие активации процессов перекисного окисления липидов (ПОЛ) [6–10].К мембранно-зависимым нарушениям можно отнести также и наблюдаемое при ТР увеличение активности и концентрации в плазме крови дипептидилпептидазы-4 (ДПП-4). На это указывают следующие факты:
1) существуют две фракции ДПП-4, одна из которых закреплена на поверхности клеточных мембран и имеет трансмембранный и внешний домены, а другая находится в системной циркуляции;
2) циркулирующая (растворимая) фракция представляет собой усеченный вариант большего варианта белка и по первичной структуре, и по молекулярной массе соответствует наружному фрагменту [11];
3) имеются сведения о том, что при некоторых заболеваниях печени повреждение гепатоцитов ассоциируется с нарушением якорения (фиксации) наружного фрагмента к мембране, его отщеплением и усиленным поступлением в системный кровоток [12–14].
Учитывая, что повреждение клеточной мембраны в результате активации ПОЛ может облегчить отсоединение поверхностного фрагмента ДПП-4 от мест его фиксации и способствовать повышению концентрации и активности растворимой фракции фермента, представляется важным рассмотреть с этих позиций значение выявленного ранее при ТР увеличения как активности [15, 16], так и концентрации ДПП-4 [17], хотя не исключено, что в патогенезе ТР играет роль и энзиматическая активность фермента, расщепляющего многие нейропептиды, в том числе нейропептид Y, участвующий в регуляции тревоги [18].
Афобазол (фабомотизол) – это анксиолитический препарат, одними из механизмов действия которого являются препятствие стресс-индуцированному падению связывающей способности бензодиазепинового рецептора [5, 19] и опосредованная активацией s1-рецепторов миграция липидных микродоменов от эндоплазматического ретикулума к мембране клетки [20]. Ранее были опубликованы данные об устойчивом снижении при терапии Афобазолом повышенного у пациентов с ТР содержания малонового диальдегида (МДА) в плазме крови, что потенциально свидетельствует о благоприятном действии препарата на активность процессов ПОЛ [21]. Также выявлена взаимосвязь между активностью ДПП-4 и эффективностью терапии Афобазолом [15].
Целью данной работы является изучение изменения активности ДПП-4 и процессов ПОЛ под действием Афобазола по сравнению с классическим бензодиазепиновым анксиолитиком Феназепамом для уточнения роли ДПП-4 в патогенезе ТР и возможности прогноза эффективности фармакотерапии ТР этими препаратами.
Полные данные о фрагменте исследования, касающемся влияния Феназепама на активность ДПП-4, а также содержания основного конечного продукта ПОЛ МДА, были опубликованы ранее [16, 21].
Материалы и методы
Данное исследование проведено в соответствии с рекомендациями Research Domain Criteria (RDoC). В нем на широкой нозологически гетерогенной популяции больных с разной структурой психопатологического состояния, но объединенных доминирующим в состоянии феноменом тревоги (домен негативной валентности, конструкт «тревога», единицы анализа: «поведение» и «молекулы» в матрице исследований), с привлечением данных здоровых добровольцев изучена взаимосвязь особенностей клинического состояния с имеющими потенциальное патогенетическое значение биохимическими показателями – содержанием МДА, отражающим активность ПОЛ клеточных мембран и активность ДПП-4, мембрансвязанного фермента.Пациенты
 В исследование включены 92 пациента в возрасте от 20 до 57 лет с разными по структуре ТР: генерализованным ТР (ГТР, код по Международной классификации болезней 10-го пересмотра – F41.1), агорафобией [тревожно-фобическое расстройство – ТФР (F40.0)] и ипохондрическим расстройством [тревожно-ипохондрическое расстройство – ТИР (F45.2)] без сопутствующей психиатрической и соматоневрологической патологии, не принимавшие по меньшей мере в течение 1 нед до включения в исследование бензодиазепинов и Афобазола и в течение 2 нед – любых других психотропных препаратов. Из них 56 пациентов получали терапию Афобазолом (30 мг/сут), а 36 – Феназепамом (2 мг/сут)2. Длительность терапии составила 14 дней. Общая клинико-демографическая характеристика изученных больных приведена в табл. 1.
В исследование включены 92 пациента в возрасте от 20 до 57 лет с разными по структуре ТР: генерализованным ТР (ГТР, код по Международной классификации болезней 10-го пересмотра – F41.1), агорафобией [тревожно-фобическое расстройство – ТФР (F40.0)] и ипохондрическим расстройством [тревожно-ипохондрическое расстройство – ТИР (F45.2)] без сопутствующей психиатрической и соматоневрологической патологии, не принимавшие по меньшей мере в течение 1 нед до включения в исследование бензодиазепинов и Афобазола и в течение 2 нед – любых других психотропных препаратов. Из них 56 пациентов получали терапию Афобазолом (30 мг/сут), а 36 – Феназепамом (2 мг/сут)2. Длительность терапии составила 14 дней. Общая клинико-демографическая характеристика изученных больных приведена в табл. 1.Группу контроля составили 33 здоровых добровольца (17 мужчин и 16 женщин) без соматической и неврологической патологии в возрасте от 19 до 32 лет.
Клинические методы
Для оценки выраженности у больных психопатологических расстройств и терапевтической динамики состояния применялись шкала оценки тревоги Гамильтона (Hamilton Anxiety Rating Scale – HAMA) [23] и шкала оценки выраженности симптоматики (ШОВС) [24], терапевтической эффективности – шкала общего клинического впечатления (Clinical Global Impression Scale – CGI) [25]. Кроме того, в рамках исследования (только при изучении Афобазола) использовалась субъективная шкала оценки эффективности терапии с диапазоном значений от 0 (отсутствие эффективности) до 10 (максимальная эффективность).Биохимические методы
Кровь собирали из локтевой вены в пробирки BD Vacutainerс ЭДТА3, центрифугировали и хранили полученную плазму до определения активности ферментов при температуре -20°C не более 7 дней.Флуорометрический метод определения активности ДПП-4
Метод основан на флуорометрическом определении освобождающегося в процессе ферментативной реакции 7-амино-4-метилкумарина с пептидом Gly-Pro-MCA, имеющего отличный от пептидов спектр флуоресценции. Гидролиз субстрата регистрировался после 30 мин инкубации при 37°C на спектрофлуорометре LS-5B («Perkin-Elmer», США). Количество освободившегося из субстрата 7-амино-4-метилкумарина определяли из величины флуоресценции. Удельную активность ферментов определяли по формуле:A = [(E - C)/(S - B)]×t-1×v-1,
где E – флуоресценция пробы (380/460 нм); C – флуоресценция смеси, содержащей по 0,02 мл субстрата и плазмы крови, 0,76 мл трис-HCl (приготовленного из трис-основания, «Serva», Германия) буфера (pH 8,0), содержащего по 1мМ ЭДТА-Na2 («Reanal», Венгрия), дитиотреитола («Serva», Германия) и 0,2 мл 20% уксусной кислоты; B – флуоресценция смеси, содержащей 0,02 мл субстрата, 0,78 мл трис-HCl буфера (pH 8,0), содержащего по 1 мМ ЭДТА-Na2, дитиотреитола и 0,2 мл уксусной кислоты; S – флуоресценция смеси, содержащей 0,02 мл субстрата, 0,78 мл трис-HCl буфера (рН 8,0), содержащего по 1 мМ ЭДТА-Na2, дитиотреитола и 0,2 мл 20% уксусной кислоты и 0,02 мл раствора 7-амино-4-метилкумарина («Serva», Германия; 2 нмоль), t – время инкубации в минутах, v – объем ферментного препарата в миллилитрах.
Инкубационная смесь состояла из 0,02 мл плазмы крови в 0,02 М трис-HCl буфере (pH 7,5), содержащем по 1 мМ ЭДТА-Na2 и дитиотреитола; 0,02 мл раствора Z-Gly-Pro-МСА (синтезирован в ФГБНУ «НИИ биомедицинской химии им. В.Н.Ореховича» доктором химических наук В.Ф.Поздневым) в DMSO («Реахим», Россия) с концентрацией субстрата 1 мг/мл и 0,76 мл 0,02 М трис-HCl буфера (pH 8,0), содержащего по 1мМ ЭДТА-Na2, дитиотреитола. Остановка реакции производилась добавлением в инкубационную смесь 0,2 мл 20% уксусной кислоты.
Все измерения проводили в трех параллелях.
Определение МДА
К 50 мкл плазмы крови добавляли 20 мкл 0,495 М раствора соли Мора и инкубировали при 37°С в течение 30 мин. Затем к образцам добавляли 1030 мкл 0,9% раствора 2-тиобарбитуровой кислоты в 50% уксусной кислоте, интенсивно встряхивали и инкубировали при 80°С в течение 60 мин. После охлаждения измеряли оптическую плотность образцов на спектрофотометре Beckman DU-50 B при 532 нм. Расчет количества МДА проводили на основании коэффициента молярной экстинкции 1,56×105 М-1см-1.Все измерения проводили в трех параллелях.
Статистические методы
Статистический анализ проводился с помощью мультивариантного дисперсионного анализа ANOVA для парных выборок с анализом внутри- и межгрупповых эффектов с попарным удалением пропущенных значений с последующим представлением данных в виде таблиц и графиков. Корреляционный анализ проводился методом Пирсона. При проведении статистических расчетов использовались уровни достоверности при двухстороннем значении р≤0,1, р≤0,05 и р≤0,01. Для анализа прогностической значимости клинико-биохимических показателей в отношении эффективности терапии отбор перемененных производился с помощью процедуры «автоматизированное линейное моделирование» (прямой пошаговый метод) с последующим внесением значимых переменных в регрессионную модель с использованием метода бинарной логистической регрессии. Анализ пограничных значений активности ДПП-4, имеющих значение для прогноза эффективности терапии, проводился при помощи графического анализа кривых, полученных путем классификации показателей активности ДПП-4 в плазме крови по бинарной переменной «наличие/отсутствие терапевтического ответа» с помощью байесовского метода классификации Naive Bayes Classifiers.Статистические расчеты производились при помощи статистического пакета SPSS 22.
Результаты
Активность ДПП-4 и содержание МДА у пациентов с ТР и влияние на них Афобазола и Феназепама
 На рис. 1 приведены суммарные данные об активности ДПП-4 и содержании в плазме крови МДА у исследованных больных по сравнению со здоровыми добровольцами.
На рис. 1 приведены суммарные данные об активности ДПП-4 и содержании в плазме крови МДА у исследованных больных по сравнению со здоровыми добровольцами.Оба биохимических показателя у пациентов с ТР исследованной структуры достоверно (при p<0,01) превышали их значения у здоровых добровольцев. Средние значения активности ДПП-4 у 92 больных составили 5,13±1,21 нмоль/мл/мин по сравнению с 2,84±0,57 нмоль/мл/мин в группе контроля, а концентрация МДА у пациентов составила 1,21±0,39 (n=68) по сравнению с 0,55±0,1 в группе контроля.
При этом при анализе взаимосвязи активности ДПП-4 и концентрации МДА у изученной популяции пациентов и контрольной группы, как это видно на диаграмме рассеивания (рис. 2), выявляется достоверная корреляционная зависимость между обоими параметрами (r=0,545; p<0,001; n=68).
Важно отметить, что по результатам двухнедельного применения анксиолитиков Афобазола в дозе 30 мг и Феназепама в дозе 2 мг оба биохимических показателя сохранили достоверные различия от их значений у здоровых добровольцев.
 Данные о терапевтических изменениях активности ДПП-4 у больных с ТР при применении Афобазола в суточной дозе 30 мг приведены в табл. 2.
Данные о терапевтических изменениях активности ДПП-4 у больных с ТР при применении Афобазола в суточной дозе 30 мг приведены в табл. 2.Анализ динамики активности ДПП-4 при ее суммарной оценке у всей популяции больных показал практическое отсутствие изменений за 14 дней терапии препаратом. Вместе с тем терапевтические изменения энзиматической активности различались у пациентов разных диагностических подгрупп. У больных с ГТР отмечался недостоверный рост активности фермента на 7 и 14-й день исследования, у пациентов с ТФР – статистически значимое снижение, а у больных с ТИР – уровни оставались практически стабильными на 7 и 14-й день. При этом изменения активности ДПП-4 к 14-му дню у пациентов с ГТР и ТФР различались на уровне тенденции к статистической достоверности (p=0,09).
Однако при детальном анализе выявилась принципиально важная индивидуальная вариабельность изменения активности ДПП-4 под влиянием Афобазола у исследованных больных, при этом отмечались как увеличение (n=22), так и ее снижение (n=28). Установлено, что повышение активности ДПП-4 под влиянием Афобазола происходило у больных с низкими ее фоновыми значениями, а снижение – с исходно высокими (рис. 3; различия фоновых значений статистически достоверны); p<0,01.
Подтверждением данной закономерности является достоверная корреляция между исходной активностью ДПП-4 у пациентов с ТР и ее изменением через 14 дней терапии.
 Более однозначное влияние Афобазол оказывал на содержание МДА в плазме крови больных, снижая данный показатель по результатам двухнедельной терапии у 29 из 32 пациентов (рис. 4) [21].
Более однозначное влияние Афобазол оказывал на содержание МДА в плазме крови больных, снижая данный показатель по результатам двухнедельной терапии у 29 из 32 пациентов (рис. 4) [21].Иная картина наблюдалась при применении Феназепама. Его использование ассоциировалось со стабильным снижением активности ДПП-4 (у 33 из 36 пациентов), при более значительной индивидуальной вариабельности изменений содержания МДА по сравнению с Афобазолом (увеличение содержания – у 9 больных, снижение – у 27); см. рис. 4 [15, 21].
Таким образом, Афобазол приводил к стабильному уменьшению содержания МДА, что соотносится с представлениями о его механизмах действия, тогда как активность ДПП-4 менялась разнонаправленно и зависела от фонового ее уровня. Феназепам приводил к уменьшению обоих биохимических показателей, более стабильному в отношении ДПП-4 и менее стабильному – в отношении МДА. Факт разного влияния эффективных в отношении ТР препаратов с различными механизмами действия на активность ДПП-4 с высокой степенью вероятности указывает на то, что сам по себе данный показатель не является эпифеноменом тревоги.
Анализ клинико-биохимических соотношений между показателями активности ДПП-4 и содержания МДА с параметрами состояния исследованных больных
При проведении корреляционного анализа биохимических показателей с параметрами состояния больных до начала терапии, оцениваемыми при помощи разных методик, был выявлен ряд достоверных слабых взаимосвязей. Содержание МДА в плазме крови достоверно коррелировало с продолжительностью заболевания (r=0,33; p=0,009; n=92) с повышенной истощаемостью по шкале ШОВС (r=0,41; p=0,025; n=92). Активность ДПП-4 в плазме крови значимо ассоциировалась с выраженностью ФР (r=0,27; p=0,048; n=92), дневной сонливости (r=0,28; p=0,044; n=92), средним баллом кластера тревожных нарушений по шкале ШОВС (r=0,24; p=0,025; n=92) и суммарным баллом по шкале HAMA (r=0,24; p=0,026; n=92).С учетом выявленной при применении Афобазола вариабельности динамики ферментативной активности в зависимости от ее фоновых уровней представляют интерес клинические различия у пациентов с разными вариантами динамики активности ДПП-4.
Установлено, что больные с исходно более низкими показателями активности ДПП-4 с ее последующим увеличением характеризовались меньшей выраженностью психопатологической симптоматики по сравнению с пациентами, имевшими высокие фоновые показатели активности с ее последующим снижением (средний балл по кластеру тревожных симптомов по шкале ШОВС: 2,23 и 2,81, соответственно, р=0,009, n=51; средний балл по кластеру невротических симптомов: 0,84 и 1,33, соответственно, р=0,065, n=51). На уровне отдельных симптомов достоверные различия отмечались в отношении повышенной раздражительности, аффективной лабильности, расстройств пробуждения, идеаторных навязчивостей, фобий и психовегетативных симптомов (артериальная гипертензия и пароксизмальные вегетативные расстройства).
Взаимосвязь между фоновыми показателями активности ДПП-4 и содержания МДА с динамикой клинических параметров при применении Афобазола и Феназепама
 При изучении взаимосвязи между фоновой активностью ДПП-4 были обнаружены достоверные корреляции с изменением показателя дневной сонливости на 7 и 14-й день (D0 - Dn, где D0 – фоновые значения, а Dn – значения на 7 или 14-й день; R=0,39, p=0,003 и R=0,28, p=0,039, соответственно, n=51). Особенно отчетливо данная взаимосвязь прослеживается среди пациентов с ТИР (R=0,82, p<0,001 и R=0,53, p=0,02, на 7 и 14-й день, соответственно, n=17). Кроме того, у больных с ТФР (n=18) выявлена достоверная корреляция фоновой активности ДПП-4 и динамики астенических расстройств на 7-й день терапии (R=-0,48, p=0,041), а на уровне тенденции – с терапевтическими изменениями к 7 и 14-му дню выраженности гипотимии и сопряженных с ней симптомов (R=-0,41, p=0,088 и R=-0,46, p=0,054, соответственно, на 7 и 14-й день). У пациентов с ГТР (n=16) на уровне тенденции к статистической достоверности выявлена взаимосвязь активности ДПП-4 до начала терапии и динамикой нарушений сна на 14-й день (R=0,46, p=0,064).
При изучении взаимосвязи между фоновой активностью ДПП-4 были обнаружены достоверные корреляции с изменением показателя дневной сонливости на 7 и 14-й день (D0 - Dn, где D0 – фоновые значения, а Dn – значения на 7 или 14-й день; R=0,39, p=0,003 и R=0,28, p=0,039, соответственно, n=51). Особенно отчетливо данная взаимосвязь прослеживается среди пациентов с ТИР (R=0,82, p<0,001 и R=0,53, p=0,02, на 7 и 14-й день, соответственно, n=17). Кроме того, у больных с ТФР (n=18) выявлена достоверная корреляция фоновой активности ДПП-4 и динамики астенических расстройств на 7-й день терапии (R=-0,48, p=0,041), а на уровне тенденции – с терапевтическими изменениями к 7 и 14-му дню выраженности гипотимии и сопряженных с ней симптомов (R=-0,41, p=0,088 и R=-0,46, p=0,054, соответственно, на 7 и 14-й день). У пациентов с ГТР (n=16) на уровне тенденции к статистической достоверности выявлена взаимосвязь активности ДПП-4 до начала терапии и динамикой нарушений сна на 14-й день (R=0,46, p=0,064).При оценке взаимосвязей между содержанием МДА до начала лечения и изменением показателей психического состояния при применении Афобазола у всех больных вне зависимости от диагноза были выявлены взаимосвязи с выраженностью изменения кластера ТР (r=0,368, p=0,045), астенических расстройств (r=0,45, p=0,013) и суммарного балла тревоги по шкале HAMA (r=0,419, p=0,021).
В терапевтической группе Феназепама вне зависимости от диагноза начальные уровни активности ДПП-4 не обнаружили корреляции с изменениями показателей состояния, а содержание МДА коррелировало только с изменением выраженности дневной сонливости (r=-0,433, p=0,008).
Взаимосвязь фоновой активности ДПП-4 и содержания МДА с результативностью терапии ТР Афобазолом и Феназепамом
 Выявлена слабая корреляция между фоновой активностью ДПП-4 и эффективностью терапии по шкале CGI «Терапевтический эффект» у всех изученных пациентов с ТР (R=0,28, p=0,046, n=51). Кроме того, на уровне тенденции к статистической достоверности устанавливались связи с показателями других подшкал шкалы CGI на 14-й день (с тяжестью заболевания: R=0,27, p=0,053; с общим улучшением: R=0,25, p=0,071). Аналогичная корреляция была выявлена для субъективного параметра эффективности (R=-0,29, p=0,036). При этом у больных с ГТР, у которых Афобазол наиболее эффективен, коэффициент корреляции с показателями CGI «Терапевтический эффект» возрастал до 0,47 (p=0,053), а с субъективно оцениваемой пациентами эффективностью курсовой терапии – до -0,56 (р=0,02). При этом в группах больных с ТФР и ТИР достоверных корреляций с показателями шкалы CGI и субъективной оценкой эффективности не выявлялось. Положительный характер корреляций с показателями шкалы CGI и отрицательный с показателями субъективной оценки свидетельствует о том, что, чем ниже начальный уровень активности ДПП-4, тем выше эффективность терапии и легче тяжесть состояния на 14-й день лечения.
Выявлена слабая корреляция между фоновой активностью ДПП-4 и эффективностью терапии по шкале CGI «Терапевтический эффект» у всех изученных пациентов с ТР (R=0,28, p=0,046, n=51). Кроме того, на уровне тенденции к статистической достоверности устанавливались связи с показателями других подшкал шкалы CGI на 14-й день (с тяжестью заболевания: R=0,27, p=0,053; с общим улучшением: R=0,25, p=0,071). Аналогичная корреляция была выявлена для субъективного параметра эффективности (R=-0,29, p=0,036). При этом у больных с ГТР, у которых Афобазол наиболее эффективен, коэффициент корреляции с показателями CGI «Терапевтический эффект» возрастал до 0,47 (p=0,053), а с субъективно оцениваемой пациентами эффективностью курсовой терапии – до -0,56 (р=0,02). При этом в группах больных с ТФР и ТИР достоверных корреляций с показателями шкалы CGI и субъективной оценкой эффективности не выявлялось. Положительный характер корреляций с показателями шкалы CGI и отрицательный с показателями субъективной оценки свидетельствует о том, что, чем ниже начальный уровень активности ДПП-4, тем выше эффективность терапии и легче тяжесть состояния на 14-й день лечения.С целью проверки выявленных корреляционных связей между фоновой активностью ДПП-4 и эффективностью терапии выборка изученных пациентов была классифицирована в соответствии с результативностью терапии по шкале CGI «Терапевтический эффект» на больных с высокой эффективностью (1 и 2 балла по шкале) и низкой эффективностью (3 и 4 балла по шкале). При сравнении этих двух групп пациентов были выявлены статистически достоверные различия активности ДПП-4 до начала лечения (4,94 и 5,64 нмоль/мл/мин у пациентов с высоким и низким терапевтическим эффектом); p=0,015. Аналогичные статистически достоверные различия выявлялись и при оценке больных с ГТР (4,62 и 6,10 нмоль/мл/мин у пациентов с высоким и низким терапевтическим эффектом); p=0,015.
Фоновая активность МДА не коррелировала ни с одним из показателей результативности терапии при применении Афобазола. Кроме того, фоновые значения активности ДПП-4 или содержания МДА не обнаруживали взаимосвязи с результатами терапии Феназепамом ни у всех пролеченных больных, ни в диагностических группах.
 Учитывая полученные данные о взаимосвязи исходной активности ДПП-4 с эффективностью терапии Афобазолом, был проведен регрессионный анализ методом бинарной логистической регрессии с целью оценки вклада данного показателя в эффективность. На I этапе с помощью процедуры «Автоматизированное линейное моделирование» (прямой пошаговый метод), в которую в качестве зависимой переменной были внесены показатели высокого (1 и 2 балла) или низкого (3 и 4 балла) терапевтического эффекта по шкале CGI «Терапевтический эффект» для создания стандартной модели были определены наиболее значимые независимые переменные фонового состояния пациентов среди следующих: активность ДПП-4, содержание МДА в плазме крови, суммарный балл по шкале HAMA, балл по шкале CGI «Тяжесть заболевания», средние показатели по кластерам симптомов, отражающих фармакологические эффекты препаратов по шкале ШОВС (ТР, депрессивные расстройства, астенические расстройства, нарушения сна, уровень бодрости, невротические расстройства, вегетативные расстройства). По результатам данного анализа статистически достоверную значимость имели лишь два показателя – активность ДПП-4 и суммарный балл по шкале HAMA.
Учитывая полученные данные о взаимосвязи исходной активности ДПП-4 с эффективностью терапии Афобазолом, был проведен регрессионный анализ методом бинарной логистической регрессии с целью оценки вклада данного показателя в эффективность. На I этапе с помощью процедуры «Автоматизированное линейное моделирование» (прямой пошаговый метод), в которую в качестве зависимой переменной были внесены показатели высокого (1 и 2 балла) или низкого (3 и 4 балла) терапевтического эффекта по шкале CGI «Терапевтический эффект» для создания стандартной модели были определены наиболее значимые независимые переменные фонового состояния пациентов среди следующих: активность ДПП-4, содержание МДА в плазме крови, суммарный балл по шкале HAMA, балл по шкале CGI «Тяжесть заболевания», средние показатели по кластерам симптомов, отражающих фармакологические эффекты препаратов по шкале ШОВС (ТР, депрессивные расстройства, астенические расстройства, нарушения сна, уровень бодрости, невротические расстройства, вегетативные расстройства). По результатам данного анализа статистически достоверную значимость имели лишь два показателя – активность ДПП-4 и суммарный балл по шкале HAMA.По результатам внесения этих переменных в регрессионную модель методом бинарной логистической регрессии была получена достоверная модель (c2=15,37, df=2, p=0,0005). Регрессионное уравнение имеет следующий вид: p=1/1 + e8.77 - (0,916×ДПП-4) - (0,171×HAMA), где p – высокая или низкая эффективность терапии.
Ошибка предсказания с использованием данного уравнения регрессии составила 28,3%.
На рис. 5 представлены графики зависимости вероятности высокого или низкого терапевтического эффекта Афобазола в зависимости от исходной активности ДПП-4 у всех больных и больных с ГТР (метод Naive Bayes Classifiers).
Если при анализе всех пациентов (n=51) вероятность высокого терапевтического эффекта составила 45,0%, то у больных с фоновой активностью ДПП-4<4,75 нмоль/ мл/мин (n=17 из 51) вероятность благоприятных исходов терапии превышала 65%. В группе ГТР данное пограничное значение фоновой активности ДПП-4 позволяет выделить подгруппу пациентов (n=7 из 18), у которых высокий терапевтический эффект достигается с более чем 90% вероятностью по сравнению с 62,5% у всех больных с ГТР (n=18).
Обсуждение и заключение
Положения проекта новой биологически обоснованной классификации психических расстройств (RDoC) ставят под сомнение валидность доминирующих в клинической практике нозологических систем, основанных на синдромологических характеристиках. Вместо изучения четко соответствующих нозологическим дефинициям того или иного расстройства случаев они предлагают изучать биологически детерминированный феномен per se во взаимосвязи с показателями из смежных областей. Данное исследование проведено в соответствии с указанными рекомендациями RDoC.В результате исследования подтверждены данные о повышении активности ДПП-4 и содержания МДА в плазме крови у больных с разными ТР по сравнению со здоровыми добровольцами. Обнаружены корреляции обоих биохимических параметров с некоторыми клиническими характеристиками состояния. Однако если соотношения между содержанием в плазме крови МДА, отражающим активность процессов ПОЛ, и длительностью заболевания/выраженностью астенических расстройств представляются закономерными [9], то взаимосвязи между активностью ДПП-4 и выраженностью ТФР требуют отдельного анализа.
Такой анализ был проведен путем изучения и сопоставления динамики обоих показателей под влиянием двух эффективных при терапии ТР препаратов, обладающих принципиально отличающимися основными механизмами реализации своего терапевтического действия.
Классический бензодиазепиновый анксиолитик Феназепам в большинстве случаев приводит к снижению содержания МДА и активности ДПП-4. Снижение содержания МДА при терапии бензодиазепинами ранее было описано в литературе [10]. Афобазол, относящийся к классу мембранных модуляторов, при снижении содержания МДА вызывает как увеличение, так и уменьшение активности ДПП-4. При этом выявлена закономерность, что повышение активности фермента наблюдается в группе пациентов c ТР с относительно более низкими начальными уровнями активности ДПП-4 в плазме крови, а снижение, наоборот, в группе с относительно более высокими фоновыми значениями. Следует отметить, что показатели активности фермента до начала терапии в этих группах статистически достоверно различались.
Факт разного влияния на активность ДПП-4 эффективных в отношении ТР препаратов, обладающих различными механизмами действия, указывает на то, что с высокой степенью вероятности сам по себе данный показатель не является эпифеноменом тревоги. Таким образом, выявленные особенности активности ДПП-4 у больных с ТР и влияние на нее эффективного в клинических условиях анксиолитика Афобазола в виде модулирующего действия со снижением относительно высоких и увеличением относительно низких значений активности фермента свидетельствует о том, что, вероятно, регуляция состояния системы эндопептидаз, а может быть и более общих патологических изменений осуществляется у этих пациентов на отличном от здоровых лиц уровне, являющемся следствием патологической адаптации (аллостаза).
Одной из возможных трактовок наблюдаемых изменений может являться то, что повышенные уровни МДА в плазме крови, по всей видимости, в большей степени характеризуют общепатологические изменения у больных с ТР (достижение аллостаза, сам факт вовлеченности ПОЛ в патогенез), ассоциирующиеся с прогрессированием болезненного процесса (это, в частности, объясняет обнаруженные связи с общей продолжительностью заболевания и снижением уровня бодрости [21] и соотносится с литературными данными о роли процессов ПОЛ в патогенезе ТР [9]). Вместе с тем активность ДПП-4 ввиду ее гетерогенности, ассоциирующейся с выраженностью тревоги и невротических расстройств в большей степени, по-видимому, связана с некоторыми аспектами общей тяжести состояния в рамках достигнутого аллостатического равновесия.
Кроме того, получены данные о том, что при применении Афобазола, но не Феназепама, выявляется взаимосвязь между фоновой активностью ДПП-4 и сразу несколькими параметрами, отражающими эффективность терапии. При этом данная взаимосвязь усиливается у пациентов с ГТР, у которых Афобазол наиболее эффективен. Наряду с этим получены данные о том, что показатели активности ДПП-4 и суммарного балла по шкале HAMA до начала терапии являются предикторами результатов двухнедельного применения Афобазола у больных с разными ТР, и особенно в более узкой группе пациентов с относительно простой структурой синдрома в рамках ГТР, а учет исходной активности фермента с пограничным значением в 4,75 нмоль/мл/мин позволяет улучшить ожидаемый прогноз терапии на 20–30%. Однако эти данные нуждаются в репликации.
Отдельного обсуждения требуют данные об ассоциации высокой эффективности Афобазола с увеличением, а не снижением активности ДПП-4, хотя у пациентов с ТР она и без того статистически достоверно выше, чем у здоровых добровольцев. Для объяснения кажущихся противоречий мы сформулировали упрощенную механистическую гипотезу (рис. 6), исходя из современного понимания патогенетического значения процессов ПОЛ в генезе ТР и известных механизмов реализации анксиолитического действия Афобазола:
1. Процессы ПОЛ вовлечены в патогенез ТР [26, 27] и реализуются в клеточных мембранах по механизмам цепной реакции, вызывая их непрерывно расширяющееся повреждение [28].
2. ДПП-4 является трансмембранным белком, и повреждение мембраны клетки может приводить к нарушению якорения его наружного фрагмента, сохраняющего энзиматическую активность, что может приводить к выходу дополнительной фракции фермента в свободную циркуляцию и повышению его активности в плазме.
3. Выявленные взаимосвязи между активностью ДПП-4 и выраженностью тревоги, а также между содержанием МДА и продолжительностью заболевания могут свидетельствовать о том, что различной по глубине поражения патологии соответствует разная степень повреждения клеточных мембран.
4. Как следствие представляется закономерным то, что, чем менее выражено и менее продолжительно патологическое состояние, тем более сохранны мембраны, и тем менее нарушено якорение наружного фрагмента ДПП-4 и, следовательно, тем меньше его избыточных количеств поступает в свободную циркуляцию. И, наоборот, более тяжелое и затяжное патологическое состояние сопровождается более выраженными мембранными изменениями, нарушением якорения ДПП-4 и его облегченным выходом в плазму крови.
5. Одним из наиболее значимых механизмов действия Афобазола является активация s1-рецепторов [20], вызывающая миграцию липидных микродоменов от шероховатого эндоплазматического ретикулума к клеточной мембране с последующим слиянием с ней, заменяя собой участки плазмолеммы, что в свою очередь может приводить к сокращению площади вызванных ПОЛ повреждений мембран.
6. Это в итоге может приводить к снижению содержания продуктов ПОЛ в плазме крови, что соответствует как полученным в исследовании данным о снижении при терапии Афобазолом содержания МДА, так и результатам экспериментальных исследований [29].
7. В случае более выраженных нарушений структуры мембраны (теоретически ассоциированных с более тяжелым состоянием) якорение ДПП-4 нарушено в большей степени, следовательно, на мембране закреплено меньшее количество ДПП-4 и относительно большее количество находится в системной циркуляции. Встраивание под действием Афобазола липидных микродоменов в поврежденную мембрану может приводить к ее «стабилизации» и постепенному снижению облегченного поступления ДПП-4 в плазму крови, а следовательно, уменьшению активности фермента в плазме.
8. В ситуации менее выраженного повреждения плазмолеммы (т.е. теоретически, при меньшей тяжести состояния), когда относительно большое количество ДПП-4 остается закрепленным на клеточной мембране, а в циркуляции находятся относительно более низкие концентрации, слияние новых липидных микродоменов с клеточной мембраной при терапии Афобазолом потенциально может приводить к усилению выхода ДПП-4.
Тем не менее данная гипотеза нуждается в подтверждении. В пользу ее правомерности могли бы выступать данные о более однозначном снижении активности ДПП-4 при увеличении дозы Афобазола и/или продолжительности его применения. Кроме того, улучшению понимания наблюдаемых изменений могло бы способствовать изучение динамики активности ДПП-4 при назначении других мембранных модуляторов, антиоксидантов и противовоспалительных препаратов.
Выводы
1. У больных с ТР повышены содержание МДА и активность ДПП-4 в плазме крови.2. Обладающие разными механизмами реализации анксиолитического действия препараты Афобазол и Феназепам вызывают снижение содержания МДА в плазме крови.
3. Афобазол и Феназепам обладают различным влиянием на активность ДПП-4: классический бензодиазепиновый анксиолитик Феназепам в большинстве случаев приводит к снижению активности ДПП-4. Афобазол, относящийся к классу мембранных модуляторов, вызывает повышение активности фермента у пациентов с ТР с относительно более низкими фоновыми уровнями активности ДПП-4 в плазме крови, и снижение – с относительно более высокими.
4. Показатель активности ДПП-4 до начала терапии ниже 4,75 нмоль/мл/мин является предиктором высоких терапевтических результатов двухнедельного применения Афобазола у пациентов с ТР.
Cведения об авторах
Сюняков Тимур Сергеевич – канд. мед. наук, ст. науч. сотр. лаб. клин. психофармакологии ФГБНУ «НИИ фармакологии им. В.В.Закусова». E-mail: sjunja@bk.ru
Незнамов Григорий Георгиевич – д-р мед. наук, проф., зам. дир. по науч. работе, зав. лаб. клин. психофармакологии ФГБНУ «НИИ фармакологии им. В.В.Закусова». E-mail: neznamovpharm@mail.ru
Золотов Николай Николаевич – гл. науч. сотр., д-р биол. наук, проф. лаб. психофармакологии ФГБНУ «НИИ фармакологии им. В.В.Закусова». E-mail: zolotovnn@gmail.com
Список исп. литературыСкрыть список1. Deutsch SI, Rosse RB, Mastropaolo J. Environmental stress-induced functional modification of the central benzodiazepine binding site. Clin Neuropharmacol 1994; 17 (3): 205–28.
2. Bremner JD, Innis RB, Southwick SM et al. Decreased benzodiazepine receptor binding in prefrontal cortex in combat-related posttraumatic stress disorder. Am J Psychiatry 2000; 157 (7): 1120–6.
3. Geuze E, van Berckel BNM, Lammertsma AA et al. Reduced GABAA benzodiazepine receptor binding in veterans with post-traumatic stress disorder. Mol Psychiatry 2008; 13 (1): 74–83, 3.
4. Havoundjian H, Paul SM, Skolnick P. Rapid, stress-induced modification of the benzodiazepine receptor-coupled chloride ionophore. Brain Res 1986; 375 (2): 401–6.
5. Середенин С.Б. Лекции по фармакогенетике. М.: Медицинское информационное агентство, 2004. / Seredenin S.B. Lektsii po farmakogenetike. M.: Meditsinskoe informatsionnoe agentstvo, 2004. [in Russian]
6. Hovatta I, Juhila J, Donner J. Oxidative stress in anxiety and comorbid disorders. Neurosci Res 2010; 68 (4): 261–75.
7. Bouayed J, Rammal H, Soulimani R. Oxidative stress and anxiety: relationship and cellular pathways. Oxid Med Cell Longev 2009; 2 (2): 63–7.
8. Ceylan MF, Guney E, Alisik M et al. Lipid peroxidation markers in children with anxiety disorders and their diagnostic implications. Redox Rep 2014; 19 (2): 92–6.
9. Александровский Ю.А., Поюровский М.В., Незнамов Г.Г. Неврозы и перекисное окисление липидов. М.: Наука, 1991. / Aleksandrovskiy Yu.A., Poyurovskiy M.V., Neznamov G.G. Nevrozy i perekisnoe okislenie lipidov. M.: Nauka, 1991. [in Russian]
10. Александровский Ю.А., Поюровский М.В., Незнамов Г.Г. и др. Перекисное окисление липидов при эмоциональном напряжении и невротических расстройствах. Журн. неврол. и психиатр. им. С.С.Корсакова. 1988; 88 (11): 95–101. / Aleksandrovskiy Yu.A., Poyurovskiy M.V., Neznamov G.G. et al. Perekisnoe okislenie lipidov pri emotsional'nom napriazhenii i nevroticheskikh rasstroistvakh. Zhurn. nevrol. i psikhiatr. im. S.S.Korsakova. 1988; 88 (11): 95–101. [in Russian]
11. Iwaki-Egawa S, Watanabe Y, Kikuya Y, Fujimoto Y. Dipeptidyl peptidase IV from human serum: purification, characterization, and N-terminal amino acid sequence. J Biochem 1998; 124 (2): 428–33.
12. Lakatos PL, Firneisz G, Borcsiczky D et al. Elevated serum dipeptidyl peptidase IV (CD26, EC 3.4.14.5) activity in experimental liver cirrhosis. Eur J Clin Invest 2000; 30 (9): 793–7.
13. Lakatos PL, Firneisz G, Borcsiczky D et al. Elevated serum dipeptidyl peptidase IV (CD26, EC 3.4.14.5) activity in experimental liver cirrhosis. Eur J Clin Invest 2000; 30 (9): 793–7.
14. Andrieu T, Thibault V, Malet I et al. Similar increased serum dipeptidyl peptidase IV activity in chronic hepatitis C and other viral infections. J Clin Virol 2003; 27 (1): 59–68.
15. Незнамов Г.Г., Золотов Н.Н., Сюняков Т.С. и др. Активность пролинспецифических ферментов пролилэндопептидазы и дипептидилпептидазы-4 у больных с разной структурой тревожных расстройств при терапии Афобазолом. Психиатрия и психофармакотерапия. 2014; 16 (1): 21–7. / Neznamov G.G., Zolotov N.N., Syunyakov T.S.et al. Activity of prolyn-specific enzymes in patients with anxiety disorders and its changes during Afobazole treatment. Psychiatry and Psychopharmacotherapy. 2014; 16 (1): 21–7. [in Russian]
16. Золотов Н.Н., Сюняков Т.С., Дорофеева О.А. и др. Активность пролинспецифических ферментов у больных с тревожными расстройствами и ее изменения при терапии феназепамом. Психиатрия и психофармакотерапия. 2012; 14 (6): 4–7. / Zolotov N.N., Syunyakov T.S., Dorofeeva O.A. et al. Activity of prolyn-specific enzymes in patients with anxiety disorders and its changes during phenazepam’ treatment. Psychiatry and Psychopharmacotherapy.. 2012; 14 (6): 4–7. [in Russian]
17. Emanuele E, Minoretti P, Martinelli V et al. Circulating levels of soluble CD26 are associated with phobic anxiety in women. Prog Neuropsychopharmacol Biol Psychiatry 2006; 30 (7): 1334–6.
18. Mentlein R, Dahms P, Grandt D, Krüger R. Proteolytic processing of neuropeptide Y and peptide YY by dipeptidyl peptidase IV. Regul Pept 1993; 49 (2): 133–44.
19. Середенин С.Б., Воронина Т.А., Незнамов Г.Г. и др. Фармакогенетическая концепция анксиоселективного эффекта. Вестн. РАМН. 1998; 11: 3–9. / Seredenin S.B., Voronina T.A., Neznamov G.G. et al. Farmakogeneticheskaia kontseptsiia anksioselektivnogo effekta. Vestn. RAMN. 1998; 11: 3–9. [in Russian]
20. Середенин С.Б., Воронин М.В. Нейрорецепторные механизмы действия Афобазола. Эксперим. и клин. фармакология. 2009; 72 (1): 3–11. / Seredenin S.B., Voronin M.V. Neiroretseptornye mekhanizmy deistviia Afobazola. Eksperim. i klin. farmakologiia. 2009; 72 (1): 3–11. [in Russian]
21. Незнамов Г.Г., Сюняков Т.С., Золотов Н.Н. и др. Терапевтическое влияние анксиолитиков Феназепама и Афобазола на содержание малонового диальдегида в плазме крови и психическое состояние больных с тревожными расстройствами. Психические расстройства в общей медицине. 2014; 2: 40–7. / Neznamov G.G., Syunyakov T.S., Zolotov N.N. et al. Effects of anxiolytics Phenazepam and Afobazole on malondialdehyde plasma levels and clinical state in patients with anxiety disorders. Mental Disorders in General Medicine. 2014; 2: 40–7. [in Russian]
22. Середенин С.Б., Воронина Т.А., Незнамов Г.Г., Жердев В.П. Феназепам. 25 лет в медицинской практике. М.: Наука, 2007. / Seredenin S.B., Voronina T.A., Neznamov G.G., Zherdev V.P. Fenazepam. 25 let v meditsinskoi praktike. M.: Nauka, 2007. [in Russian]
23. Hamilton M. Hamilton Anxiety Rating Scale (HAM-A). J Med (Cincinnati) 1959; 61: 81–2.
24. Александровский Ю.А., Руденко Г.М., Незнамов Г.Г. и др. РГМ. Унифицированная система оценки клинико-фармакологического действия психотропных препаратов у больных с пограничными нервно-психическими расстройствами: метод. рекомендации. М., 1984. / Aleksandrovskiy Yu.A., Rudenko G.M., Neznamov G.G. et al. RGM. Unifitsirovannaia sistema otsenki kliniko-farmakologicheskogo deistviia psikhotropnykh preparatov u bol'nykh s pogranichnymi nervno-psikhicheskimi rasstroistvami: metod. rekomendatsii. M., 1984. [in Russian]
25. Guy W. ECDEU Assessment Manual for Psychopharmacology, revised. In: Library. Psychopharmacol Res Branch 1976.
26. Herken H, Akyol O, Yilmaz HR et al. Nitric oxide, adenosine deaminase, xanthine oxidase and superoxide dismutase in patients with panic disorder: Alterations by antidepressant treatment. Hum Psychopharmacol 2006; 21 (1): 53–9.
27. Bulut M, Selek S, Bez Y et al. Reduced PON1 enzymatic activity and increased lipid hydroperoxide levels that point out oxidative stress in generalized anxiety disorder. J Affect Disord 2013; 150 (3): 829–33.
28. Mylonas C, Kouretas D. Lipid peroxidation and tissue damage. In Vivo 1999; 13 (3): 295–309.
29. Силкина И.В., Зенина Т.А., Середенин С.Б., Мирзоян Р.С. Влияние афобазола на содержание продуктов свободнорадикального окисления и активность каталазы в условиях ишемии головного мозга. Эксперим. и клин. фармакология. 2006; 69: 47–50. / Silkina I.V., Zenina T.A., Seredenin S.B., Mirzoyan R.S. Vliianie afobazola na soderzhanie produktov svobodnoradikal'nogo okisleniia i aktivnost' katalazy v usloviiakh ishemii golovnogo mozga. Eksperim. i klin. farmakologiia. 2006; 69: 47–50. [in Russian]


