Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№02 2017
Особенности течения параноидной шизофрении и лабораторные маркеры крови №02 2017
Номера страниц в выпуске:19-23
Цель – поиск взаимосвязей между клинико-патогенетическими характеристиками параноидной шизофрении и биохимическими показателями крови для уточнения прогноза заболевания.
Материал и методы. В исследование был включен 91 больной параноидной шизофренией (56,0% мужчин, средний возраст 34,6±9,9 года). Для обследования пациентов использовались методики PANSS, MADRS. В крови определялись уровни нейрон-специфичной енолазы (neuron-specific enolase – NSE), протеина S100B, C-реактивного белка (СРБ), нейротрофического фактора головного мозга.
Результаты. Более высокие уровни NSE и S100B характерны для пациентов с более тяжелым течением заболевания, перенесших большее количество обострений, но не с большей длительностью заболевания. Больший вклад наследственности наблюдается у больных с высоким содержанием протеина S100B, в то время как СРБ оказался выше у лиц с более поздно манифестировавшим заболеванием, что может свидетельствовать о большем вкладе фактора воспаления в развитие шизофрении у данной группы больных. У пациентов с более высокими уровнями NSE и СРБ были в большей степени выражены нарушения мышления.
Заключение. Уровни NSE, S100B, СРБ отражают особенности течения шизофрении и терапевтического ответа. У больных параноидной шизофренией с терапевтической резистентностью патофизиология процесса характеризуется наличием повышенной проницаемости мембран нейронов, о чем свидетельствует более высокая концентрация NSE в сыворотке крови. Уровни S100B и СРБ отражают особенности возможных путей развития шизофрении.
Ключевые слова: шизофрения, прогноз, биомаркеры, NSE, S100B, C-реактивный белок, BDNF.
Для цитирования: Незнанов Н.Г., Дорофейкова М.В., Петрова Н.Н. Особенности течения параноидной шизофрении и лабораторные маркеры крови. Психиатрия и психофармакотерапия. 2017; 19 (2): 19–23.
Материал и методы. В исследование был включен 91 больной параноидной шизофренией (56,0% мужчин, средний возраст 34,6±9,9 года). Для обследования пациентов использовались методики PANSS, MADRS. В крови определялись уровни нейрон-специфичной енолазы (neuron-specific enolase – NSE), протеина S100B, C-реактивного белка (СРБ), нейротрофического фактора головного мозга.
Результаты. Более высокие уровни NSE и S100B характерны для пациентов с более тяжелым течением заболевания, перенесших большее количество обострений, но не с большей длительностью заболевания. Больший вклад наследственности наблюдается у больных с высоким содержанием протеина S100B, в то время как СРБ оказался выше у лиц с более поздно манифестировавшим заболеванием, что может свидетельствовать о большем вкладе фактора воспаления в развитие шизофрении у данной группы больных. У пациентов с более высокими уровнями NSE и СРБ были в большей степени выражены нарушения мышления.
Заключение. Уровни NSE, S100B, СРБ отражают особенности течения шизофрении и терапевтического ответа. У больных параноидной шизофренией с терапевтической резистентностью патофизиология процесса характеризуется наличием повышенной проницаемости мембран нейронов, о чем свидетельствует более высокая концентрация NSE в сыворотке крови. Уровни S100B и СРБ отражают особенности возможных путей развития шизофрении.
Ключевые слова: шизофрения, прогноз, биомаркеры, NSE, S100B, C-реактивный белок, BDNF.
Для цитирования: Незнанов Н.Г., Дорофейкова М.В., Петрова Н.Н. Особенности течения параноидной шизофрении и лабораторные маркеры крови. Психиатрия и психофармакотерапия. 2017; 19 (2): 19–23.
Цель – поиск взаимосвязей между клинико-патогенетическими характеристиками параноидной шизофрении и биохимическими показателями крови для уточнения прогноза заболевания.
Материал и методы. В исследование был включен 91 больной параноидной шизофренией (56,0% мужчин, средний возраст 34,6±9,9 года). Для обследования пациентов использовались методики PANSS, MADRS. В крови определялись уровни нейрон-специфичной енолазы (neuron-specific enolase – NSE), протеина S100B, C-реактивного белка (СРБ), нейротрофического фактора головного мозга.
Результаты. Более высокие уровни NSE и S100B характерны для пациентов с более тяжелым течением заболевания, перенесших большее количество обострений, но не с большей длительностью заболевания. Больший вклад наследственности наблюдается у больных с высоким содержанием протеина S100B, в то время как СРБ оказался выше у лиц с более поздно манифестировавшим заболеванием, что может свидетельствовать о большем вкладе фактора воспаления в развитие шизофрении у данной группы больных. У пациентов с более высокими уровнями NSE и СРБ были в большей степени выражены нарушения мышления.
Заключение. Уровни NSE, S100B, СРБ отражают особенности течения шизофрении и терапевтического ответа. У больных параноидной шизофренией с терапевтической резистентностью патофизиология процесса характеризуется наличием повышенной проницаемости мембран нейронов, о чем свидетельствует более высокая концентрация NSE в сыворотке крови. Уровни S100B и СРБ отражают особенности возможных путей развития шизофрении.
Ключевые слова: шизофрения, прогноз, биомаркеры, NSE, S100B, C-реактивный белок, BDNF.
Для цитирования: Незнанов Н.Г., Дорофейкова М.В., Петрова Н.Н. Особенности течения параноидной шизофрении и лабораторные маркеры крови. Психиатрия и психофармакотерапия. 2017; 19 (2): 19–23.
N.G.Neznanov1, M.V.Dorofeikova1, N.N. Petrova2
1V.M.Bekhterev Saint Petersburg Research Institute. 192019, Russian Federation, Saint Petersburg, ul. Bekhtereva, d. 3;
2Saint Petersburg State University. 199034, Russian Federation, Saint Petersburg, Universitetskaia nab., d. 7/9
spbinstb@bekhterev.ru
Aim – to find relationships between the clinical and pathogenetic characteristics of paranoid schizophrenia and blood-based biomarkers to refine the prognosis of the disease.
Material and methods. 91 patients with paranoid schizophrenia (56,0% men, mean age 34.6±9.9 years) were assessed using PANSS and MADRS. Blood levels of neuron-specific enolase (NSE), protein S100B, C-reactive protein (CRP), brain-derived neurotrophic factor were determined.
Results. Higher levels of NSE and S100B were found in patients with more severe course of disease who have had greater number of exacerbations, but not with greater disease duration. A greater contribution of heredity was observed in patients with high levels of protein S100B, while CRP was higher in individuals with later manifestation of schizophrenia, which may indicate a greater role of inflammation in the development of schizophrenia in this group of patients. Patients with higher levels of NSE and CRP had more pronounced thought disorders.
Conclusion. Levels of NSE, S100B, CRP reflect the characteristics of schizophrenia course and therapeutic response. In patients with paranoid schizophrenia with therapeutic resistance pathophysiology of the process is characterized by increased permeability of neuronal membranes, as evidenced by the higher concentration of NSE in serum. Levels of S100B and CRP reflect the characteristics of the possible ways of development of schizophrenia.
Key words: schizophrenia, prognosis, biomarkers, NSE, S100B, C-reactive protein, BDNF.
For citation: Neznanov N.G., Dorofeikova M.V., Petrova N.N. Course of paranoid schizophrenia and blood-based biomarkers. Psychiatry and Psychopharmacotherapy. 2017; 19 (2): 19–23.
Под биомаркерами понимают биохимические, физиологические или анатомические особенности, специфичные для того или иного состояния или заболевания. Они должны иметь предсказательную силу, быть доступными в каждодневной практике, позволять выявлять лиц из группы риска, мониторировать прогрессирование болезни и эффективность лечения. В настоящее время изучение шизофрении не привело к выявлению ни одного биомаркера, который бы соответствовал перечисленным критериям [1]. В обзоре C.Weickert и соавт. (2013 г.) постулируется, что на данный момент не существует ни одного применяемого в реальности значимого биомаркера, специфичного для шизофрении [2]. Лабораторная диагностика и методы генетического скрининга шизофрении остаются ненадежными [3].
Клинически значимые биомаркеры у больных шизофренией могли бы улучшить диагностику, выбор терапии и прогнозирование течения заболевания. Биомаркеры могут стать индикатором наличия патофизиологического процесса до начала и на ранних стадиях развития заболевания, что позволит начинать терапию заблаговременно. Идентификация биомаркеров может играть важную роль для индивидуализации лечения, разработки наиболее эффективной терапии [1].
Необходимо проводить поиск прогностических маркеров для определения исходов шизофрении, что обеспечит обоснованное распределение ресурсов здравоохранения и выбор лечебно-реабилитационных мероприятий. В конечном итоге это может способствовать улучшению долгосрочного симптоматического и функционального исхода при психозах [4].
Для прогнозирования течения заболевания в настоящее время предлагают некоторые генетические маркеры (например, полиморфизм Val66Met гена BDNF) [5, 6] и разные биохимические показатели. В то время как ликвор имеет менее сложный состав, концентрации протеинов в нем ниже по сравнению с плазмой крови, а его объем ограничен, что создает технические сложности [7]. Основные преимущества маркеров, находящихся в крови, – легкая доступность материала в достаточном объеме и с необходимой частотой.
В числе биохимических показателей, определяемых в ликворе с целью диагностики шизофрении и изучения эффективности лекарственных препаратов, – метаболиты моноаминов, разные нейропептиды и протеин S100B, который участвует в пролиферации, дифференцировке клеток и обмене кальция и является биомаркером повышения активности астроцитов.
Показано, что для больных шизофренией характерно повышение уровня протеина S100B, особенно при обострениях у пациентов с резидуальными или преимущественно негативными симптомами. У пациентов на стадии хронической шизофрении повышенное содержание протеина S100B связано с когнитивными нарушениями. Нормализация концентрации маркера в плазме крови сопряжена с сокращением сроков лечения, что было достигнуто при блокировании рецептора конечных продуктов ускоренного гликозилирования [8].
Цитокины участвуют во взаимодействии между иммунной и центральной нервной системами, модулируют активность, дифференцировку и выживание нейронов на этапе развития мозга. Их избыточная экспрессия является важным фактором нейротоксичности и нейродегенерации. C.Noto и соавт. (2013 г.) высказали в своей статье предположение, что иммунная система может иметь более выраженные нарушения у подгрупп больных с тяжело протекающей шизофренией. Они впервые продемонстрировали связь между депрессией при шизофрении и конкретными нарушениями системы воспаления [9, 10].
Более прогредиентное течение шизофрении с ранним началом и выраженными негативными симптомами может быть ассоциировано с более низкой аутоиммунной реактивностью, характерной для лиц мужского пола [1].
Существует много свидетельств связи между терапевтической резистентностью и воспалением [11, 12]. Нарушения в системе воспаления ассоциированы как с патофизиологическими путями терапевтической резистентности, так и с механизмом действия клозапина [13]. Например, с ответом на терапию клозапином у больных шизофренией связан полиморфизм гена такого провоспалительного цитокина, как фактор некроза опухоли a [14].
Было проведено три исследования, в которых была показана прямая взаимосвязь между воспалением и неблагоприятным клиническим исходом у пациентов с хронической шизофренией в виде менее значительного уменьшения симптоматики или более раннего рецидива [15–17].
Проводятся исследования комбинированной антипсихотической и противовоспалительной или противодиабетической терапии [18]. Отмечено, что такие препараты, как галоперидол и клозапин, оказывают иммунносупрессивное действие, с которым связывают их антипсихотический эффект. Эти препараты, как и рисперидон, дифференцированно влияют на выработку цитокинов у пациентов [19].
В большинстве исследований концентрации маркеров воспаления у больных шизофренией оказываются повышенными по сравнению с таковыми у здоровых лиц [19]. Среди потенциальных биомаркеров терапевтического ответа – не только С-реактивный белок (СРБ) и ряд интерлейкинов, но и нейротрофический фактор головного мозга (brain-derived neurotrophic factor – BDNF). Значительное снижение уровня BDNF в сыворотке крови обнаруживается уже у пациентов с первым эпизодом шизофрении [20]. Данные о том, существует ли связь между его концентрацией и выраженностью какого-либо из доменов симптоматики по PANSS (Positive and Negative Syndrome Scale), разнятся [20, 21]. Показано, что терапия оланзапином или рисперидоном не оказывает влияния на уровень BDNF [22]. В сравнительно недавнем исследовании обнаружено, что клинически стабильные пациенты с шизофренией имеют повышенный уровень сывороточного BDNF после когнитивного тренинга, направленного на улучшение нейропластичности [23].
В исследовании C.Noto и соавт. (2011 г.) установлено, что уровни BDNF выше у больных шизофренией с более выраженными депрессивными симптомами (по шкале депрессии Калгари), а концентрация интерлейкина-1b прямо связана с выраженностью симптоматики по PANSS. Уровни BDNF не коррелировали ни с одним из показателей PANSS и концентрациями цитокинов [10].
Известно, что содержание BDNF восстанавливается при эффективном лечении депрессивных эпизодов антидепрессантами, нормотимиками и электросудорожной терапией. Повышенные уровни BDNF в сыворотке крови наблюдаются у больных шизофренией с большей длительностью заболевания и высокими дозировками лекарств [24, 25].
Как было показано S.Wan и соавт. (2006 г.), у пациентов, отвечающих на антипсихотическую терапию, наблюдается значимое повышение уровня транстиретина в ликворе. Роль данного белка и связь его с терапевтическим ответом у больных шизофренией остается недостаточно изученной, хотя аналогичные данные были получены на животных (повышение уровня транстиретина в ответ на длительную терапию клозапином) [26].
Цель исследования – поиск взаимосвязей между клинико-патогенетическими характеристиками параноидной шизофрении и биохимическими показателями крови для уточнения прогноза заболевания.
Средняя продолжительность болезни составила 11,3±8,8 года, возраст начала заболевания – 25,9±7,7 года. Число госпитализаций варьировало от 0 до 22 и в среднем составило 5,2±4,8. 44,4% пациентов имели отягощенный психическими расстройствами анамнез. 46,5% больных имели высшее образование, 40,8% – среднее специальное и 12,7% – среднее. Терапию, включавшую в себя один антипсихотик, получали 48,9% больных, два – 42,2%, три антипсихотика – 8,9%. 20 (22,0%) пациентов получали в качестве антипсихотической терапии исключительно антипсихотики II поколения.
Клинико-шкальная оценка психического состояния пациентов производилась с помощью PANSS, которая предполагает оценку 33 признаков (симптомов), оцениваемых по 7-балльной системе [27], а также шкалы оценки депрессии Монтгомери–Асберг (MADRS).
Для тестирования использовали образцы сыворотки крови пациентов, которые хранили при температуре -70°С не более 6 мес. Определение нейрон-специфичной енолазы (neuron-specific enolase – NSE), протеина S100B и СРБ в сыворотке крови пациентов проводили с использованием автоматических иммунохимических анализаторов фирм «Roche» (Швейцария) и «Abbott» (США). BDNF определяли с помощью количественного иммуноферментного анализа типа «сэндвич» (иммуноферментный набор «R&D systems», США).
Важной особенностью нашего исследования было использование стандартизованных, автоматизированных методов лабораторного анализа, разрешенных Минздравом России для диагностических целей, которые позволяют уверенно, надежно получать результаты и сравнивать их с данными других лабораторий во всем мире, а также у пациентов в динамике с разницей во времени, составляющей месяцы и годы наблюдения.
Данные были обработаны с применением программы Microsoft Office Excel 2007, пакета статистических программ SPSS Statistics 17.0 («Statistical Package for the Social Sciences», версия 17.0). Применялись дескриптивные статистики, для сравнения между разными группами в зависимости от наличия нормального распределения – T-критерий для независимых выборок либо критерий Манна–Уитни, дисперсионный анализ. Корреляционный анализ с помощью коэффициента Пирсона был проведен для поиска взаимосвязей между показателями. Значимыми считали статистические различия при р≤0,05.
У женщин уровень протеина S100B был ожидаемо более высоким по сравнению с лицами мужского пола (0,053±0,021 против 0,037±0,019 мкг/л, p<0,001). От возраста пациентов уровень нейромаркеров не зависел.
Корреляционный анализ показал, что более высокие уровни NSE и S100B характерны для пациентов с более тяжелым течением заболевания, перенесших большее количество обострений (r=0,281, p=0,012 и r=0,289; p=0,010 соответственно), но не с большей длительностью заболевания (r=-0,090, p=0,428 и r=0,190; p=0,094).
У пациентов с отягощенной психическими расстройствами наследственностью концентрации протеина S100B были статистически значимо выше (0,046±0,026 против 0,038±0,015 мкг/л; p=0,026). Не выявлено значимых различий между концентрацией протеина S100B у пациентов, соответствовавших критериям первого эпизода (39±18 нг/л), и у больных на этапе хронической шизофрении (44±21 нг/л).
Лишь у 2 пациентов были выявлены показатели высокочувствительного СРБ выше 10 мг/л, отражающие активную воспалительную реакцию, в то время как у части больных (21,4%) уровень СРБ указывал на наличие системного сосудистого воспаления (от 3 до 10 мг/л). Полученные данные свидетельствуют о возможной роли активации воспалительного ответа в развитии шизофрении у части пациентов. Следует отметить, что повышенные уровни высокочувствительного СРБ были выявлены при однократном обследовании пациентов, а поскольку этот показатель очень лабильный (за 24 ч может возрастать в десятки раз и затем в течение нескольких дней нормализоваться), можно предположить, что и у остальных пациентов он повышался в определенные периоды заболевания. Данные исследования свидетельствуют о возможной роли активации воспалительного ответа в развитии шизофрении у части пациентов.
СРБ оказался выше у лиц с более поздно манифестировавшим заболеванием (r=0,325, p=0,019), что может свидетельствовать о большем вкладе фактора воспаления как проявления средового влияния в развитие шизофрении у данной группы больных.
Уровень СРБ чаще был высоким у больных, которым назначались антидепрессанты (8,6±9,7 мг/л vs 1,7±1,6 мг/л; р=0,092), что может косвенно свидетельствовать о существенном удельном весе депрессивных расстройств в структуре шизофрении в этих случаях. Ранее было показано, что существует связь между депрессией при шизофрении и нарушениями системы воспаления (C.Noto и соавт., 2013), а также что уровень растворимых рецепторов фактора некроза опухоли 1-го типа повышен у терапевтически резистентных пациентов, больных шизофренией с депрессией, что рассматривалось и как возможное последствие далеко зашедшей, поздней стадии болезни, сопровождающейся коморбидными заболеваниями, и как свидетельство ускорения прогрессирования изменений в головном мозге (их роль в прогрессировании шизофрении пока не изучена) [10].
Повышение уровня СРБ у больных шизофренией было продемонстрировано в метаанализе B.Miller и соавт. [28]. Существует точка зрения, что усилению иммунного ответа способствуют факторы окружающей среды, связанные с госпитализациями, лечением и др. Пока что до конца не ясно, является ли воспаление частью патогенетического пути (перинатальные иммунные воздействия и инфекции играют роль в развитии шизофрении в дальнейшем).
В эпидемиологических исследованиях показано, что будущие пациенты чаще страдают аутоиммунными заболеваниями [29].
В нашем исследовании больные были разделены на 2 группы: основную (n=57), в которую вошли пациенты на этапе стабилизации ремиссии или устойчивой ремиссии, и группу терапевтически резистентных больных (n=34).
У последних отсутствовала динамика выраженности психопатологической симптоматики и/или иных ключевых симптомов на фоне терапии двумя антипсихотиками разных химических классов (как минимум одного атипичного) в рекомендуемых дозировках на протяжении 6–8 нед каждым из них.
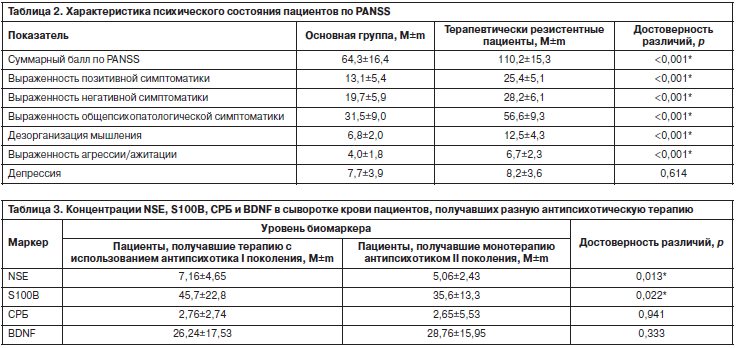
Клиническая характеристика пациентов по PANSS приведена в табл. 2. Следует отметить, что терапевтически резистентные пациенты значимо отличались по суммарным показателям всех подшкал в худшую сторону.
Больные, соответствовавшие критериям терапевтической резистентности, имели более высокие концентрации NSE (9,64±4,40 vs 5,08±3,04 нг/мл; р<0,001) и S100B (49,6±22,5 vs 40,3±20,1 нг/л; р=0,051). Уровни NSE коррелировали со всеми показателями подшкал PANSS и ее суммарным баллом (r=0,530, р<0,001). Концентрация S100B была выше у больных с более выраженной позитивной и общепсихопатологической симптоматикой. Ранее уже были получены данные, свидетельствующие о том, что уровни S100B могут быть связаны с психическим состоянием: они выше при обострениях и ниже у хронизированных пациентов. У пожилых больных шизофренией более высокие уровни данного протеина обнаруживаются у пациентов с менее выраженными негативными симптомами. Вероятно, секреция S100B у них приводила к нейропротекторному эффекту [7].
Наши данные не подтвердили наличие взаимосвязи между терапевтической резистентностью и воспалением (СРБ), указание на которую встречается в литературе [11]. У пациентов с более высокими уровнями NSE и СРБ были в большей степени выражены нарушения мышления (r=0,347, p=0,026; r=0,433; p=0,017). Уровень последнего был также выше у более агрессивных, ажитированных пациентов (r=0,394, r=0,031), что отражает менее выраженный ответ на терапию у этих больных.
Пациенты, получавшие монотерапию антипсихотиком II поколения, имели более низкий уровень NSE и S100B (табл. 3), что может говорить о меньшей проницаемости мембран нейронов. Уровни NSE значимо различались в группах больных, принимавших разную терапию, причем наиболее значимо – между группой монотерапии атипичным антипсихотиком и группой, получавшей сочетанную терапию антипсихотиками разных поколений (р=0,036). Значимых различий в уровне NSE между группами монотерапии антипсихотиком I и II поколений не было (р=0,514). Корреляционный анализ показал, что зависимости концентрации NSE от количества антипсихотиков также не было (r=0,170, p=0,263).
Уровень BDNF в сыворотке крови пациентов составил 26,96±16,19 нг/мл. Взаимосвязей концентрации указанного маркера с клиническими показателями и особенностями течения заболевания выявлено не было, хотя в литературе есть указания на наличие связей между содержанием BDNF и клинической картиной, когнитивными нарушениями при шизофрении, возрастом начала данного заболевания [30].
2. У больных параноидной шизофренией с терапевтической резистентностью патофизиология процесса характеризуется наличием повышенной проницаемости мембран нейронов, о чем свидетельствует более высокая концентрация NSE в сыворотке крови.
3. Уровни S100B и СРБ отражают особенности возможных путей развития шизофрении: больший вклад наследственности наблюдается у больных с высоким содержанием протеина S100B, в то время как СРБ оказался выше у лиц с более поздно манифестировавшим заболеванием, что может свидетельствовать о большем вкладе фактора воспаления в развитие шизофрении у данной группы больных.
Дорофейкова Мария Владимировна – мл. науч. сотр. дир. ФГБУ «СПб НИПНИ им. В.М.Бехтерева». E-mail: mvdorofeykova@mail.ru
Петрова Наталия Николаевна – д-р мед. наук, проф., зав. каф. психиатрии и наркологии медицинского фак. ФГБОУ ВО СПбГУ.
E-mail: petrova_nn@mail.ru
Материал и методы. В исследование был включен 91 больной параноидной шизофренией (56,0% мужчин, средний возраст 34,6±9,9 года). Для обследования пациентов использовались методики PANSS, MADRS. В крови определялись уровни нейрон-специфичной енолазы (neuron-specific enolase – NSE), протеина S100B, C-реактивного белка (СРБ), нейротрофического фактора головного мозга.
Результаты. Более высокие уровни NSE и S100B характерны для пациентов с более тяжелым течением заболевания, перенесших большее количество обострений, но не с большей длительностью заболевания. Больший вклад наследственности наблюдается у больных с высоким содержанием протеина S100B, в то время как СРБ оказался выше у лиц с более поздно манифестировавшим заболеванием, что может свидетельствовать о большем вкладе фактора воспаления в развитие шизофрении у данной группы больных. У пациентов с более высокими уровнями NSE и СРБ были в большей степени выражены нарушения мышления.
Заключение. Уровни NSE, S100B, СРБ отражают особенности течения шизофрении и терапевтического ответа. У больных параноидной шизофренией с терапевтической резистентностью патофизиология процесса характеризуется наличием повышенной проницаемости мембран нейронов, о чем свидетельствует более высокая концентрация NSE в сыворотке крови. Уровни S100B и СРБ отражают особенности возможных путей развития шизофрении.
Ключевые слова: шизофрения, прогноз, биомаркеры, NSE, S100B, C-реактивный белок, BDNF.
Для цитирования: Незнанов Н.Г., Дорофейкова М.В., Петрова Н.Н. Особенности течения параноидной шизофрении и лабораторные маркеры крови. Психиатрия и психофармакотерапия. 2017; 19 (2): 19–23.
Course of paranoid schizophrenia and blood-based biomarkers
N.G.Neznanov1, M.V.Dorofeikova1, N.N. Petrova2
1V.M.Bekhterev Saint Petersburg Research Institute. 192019, Russian Federation, Saint Petersburg, ul. Bekhtereva, d. 3;
2Saint Petersburg State University. 199034, Russian Federation, Saint Petersburg, Universitetskaia nab., d. 7/9
spbinstb@bekhterev.ru
Aim – to find relationships between the clinical and pathogenetic characteristics of paranoid schizophrenia and blood-based biomarkers to refine the prognosis of the disease.
Material and methods. 91 patients with paranoid schizophrenia (56,0% men, mean age 34.6±9.9 years) were assessed using PANSS and MADRS. Blood levels of neuron-specific enolase (NSE), protein S100B, C-reactive protein (CRP), brain-derived neurotrophic factor were determined.
Results. Higher levels of NSE and S100B were found in patients with more severe course of disease who have had greater number of exacerbations, but not with greater disease duration. A greater contribution of heredity was observed in patients with high levels of protein S100B, while CRP was higher in individuals with later manifestation of schizophrenia, which may indicate a greater role of inflammation in the development of schizophrenia in this group of patients. Patients with higher levels of NSE and CRP had more pronounced thought disorders.
Conclusion. Levels of NSE, S100B, CRP reflect the characteristics of schizophrenia course and therapeutic response. In patients with paranoid schizophrenia with therapeutic resistance pathophysiology of the process is characterized by increased permeability of neuronal membranes, as evidenced by the higher concentration of NSE in serum. Levels of S100B and CRP reflect the characteristics of the possible ways of development of schizophrenia.
Key words: schizophrenia, prognosis, biomarkers, NSE, S100B, C-reactive protein, BDNF.
For citation: Neznanov N.G., Dorofeikova M.V., Petrova N.N. Course of paranoid schizophrenia and blood-based biomarkers. Psychiatry and Psychopharmacotherapy. 2017; 19 (2): 19–23.
Под биомаркерами понимают биохимические, физиологические или анатомические особенности, специфичные для того или иного состояния или заболевания. Они должны иметь предсказательную силу, быть доступными в каждодневной практике, позволять выявлять лиц из группы риска, мониторировать прогрессирование болезни и эффективность лечения. В настоящее время изучение шизофрении не привело к выявлению ни одного биомаркера, который бы соответствовал перечисленным критериям [1]. В обзоре C.Weickert и соавт. (2013 г.) постулируется, что на данный момент не существует ни одного применяемого в реальности значимого биомаркера, специфичного для шизофрении [2]. Лабораторная диагностика и методы генетического скрининга шизофрении остаются ненадежными [3].
Клинически значимые биомаркеры у больных шизофренией могли бы улучшить диагностику, выбор терапии и прогнозирование течения заболевания. Биомаркеры могут стать индикатором наличия патофизиологического процесса до начала и на ранних стадиях развития заболевания, что позволит начинать терапию заблаговременно. Идентификация биомаркеров может играть важную роль для индивидуализации лечения, разработки наиболее эффективной терапии [1].
Необходимо проводить поиск прогностических маркеров для определения исходов шизофрении, что обеспечит обоснованное распределение ресурсов здравоохранения и выбор лечебно-реабилитационных мероприятий. В конечном итоге это может способствовать улучшению долгосрочного симптоматического и функционального исхода при психозах [4].
Для прогнозирования течения заболевания в настоящее время предлагают некоторые генетические маркеры (например, полиморфизм Val66Met гена BDNF) [5, 6] и разные биохимические показатели. В то время как ликвор имеет менее сложный состав, концентрации протеинов в нем ниже по сравнению с плазмой крови, а его объем ограничен, что создает технические сложности [7]. Основные преимущества маркеров, находящихся в крови, – легкая доступность материала в достаточном объеме и с необходимой частотой.
В числе биохимических показателей, определяемых в ликворе с целью диагностики шизофрении и изучения эффективности лекарственных препаратов, – метаболиты моноаминов, разные нейропептиды и протеин S100B, который участвует в пролиферации, дифференцировке клеток и обмене кальция и является биомаркером повышения активности астроцитов.
Показано, что для больных шизофренией характерно повышение уровня протеина S100B, особенно при обострениях у пациентов с резидуальными или преимущественно негативными симптомами. У пациентов на стадии хронической шизофрении повышенное содержание протеина S100B связано с когнитивными нарушениями. Нормализация концентрации маркера в плазме крови сопряжена с сокращением сроков лечения, что было достигнуто при блокировании рецептора конечных продуктов ускоренного гликозилирования [8].
Цитокины участвуют во взаимодействии между иммунной и центральной нервной системами, модулируют активность, дифференцировку и выживание нейронов на этапе развития мозга. Их избыточная экспрессия является важным фактором нейротоксичности и нейродегенерации. C.Noto и соавт. (2013 г.) высказали в своей статье предположение, что иммунная система может иметь более выраженные нарушения у подгрупп больных с тяжело протекающей шизофренией. Они впервые продемонстрировали связь между депрессией при шизофрении и конкретными нарушениями системы воспаления [9, 10].
Более прогредиентное течение шизофрении с ранним началом и выраженными негативными симптомами может быть ассоциировано с более низкой аутоиммунной реактивностью, характерной для лиц мужского пола [1].
Существует много свидетельств связи между терапевтической резистентностью и воспалением [11, 12]. Нарушения в системе воспаления ассоциированы как с патофизиологическими путями терапевтической резистентности, так и с механизмом действия клозапина [13]. Например, с ответом на терапию клозапином у больных шизофренией связан полиморфизм гена такого провоспалительного цитокина, как фактор некроза опухоли a [14].
Было проведено три исследования, в которых была показана прямая взаимосвязь между воспалением и неблагоприятным клиническим исходом у пациентов с хронической шизофренией в виде менее значительного уменьшения симптоматики или более раннего рецидива [15–17].
Проводятся исследования комбинированной антипсихотической и противовоспалительной или противодиабетической терапии [18]. Отмечено, что такие препараты, как галоперидол и клозапин, оказывают иммунносупрессивное действие, с которым связывают их антипсихотический эффект. Эти препараты, как и рисперидон, дифференцированно влияют на выработку цитокинов у пациентов [19].
В большинстве исследований концентрации маркеров воспаления у больных шизофренией оказываются повышенными по сравнению с таковыми у здоровых лиц [19]. Среди потенциальных биомаркеров терапевтического ответа – не только С-реактивный белок (СРБ) и ряд интерлейкинов, но и нейротрофический фактор головного мозга (brain-derived neurotrophic factor – BDNF). Значительное снижение уровня BDNF в сыворотке крови обнаруживается уже у пациентов с первым эпизодом шизофрении [20]. Данные о том, существует ли связь между его концентрацией и выраженностью какого-либо из доменов симптоматики по PANSS (Positive and Negative Syndrome Scale), разнятся [20, 21]. Показано, что терапия оланзапином или рисперидоном не оказывает влияния на уровень BDNF [22]. В сравнительно недавнем исследовании обнаружено, что клинически стабильные пациенты с шизофренией имеют повышенный уровень сывороточного BDNF после когнитивного тренинга, направленного на улучшение нейропластичности [23].
В исследовании C.Noto и соавт. (2011 г.) установлено, что уровни BDNF выше у больных шизофренией с более выраженными депрессивными симптомами (по шкале депрессии Калгари), а концентрация интерлейкина-1b прямо связана с выраженностью симптоматики по PANSS. Уровни BDNF не коррелировали ни с одним из показателей PANSS и концентрациями цитокинов [10].
Известно, что содержание BDNF восстанавливается при эффективном лечении депрессивных эпизодов антидепрессантами, нормотимиками и электросудорожной терапией. Повышенные уровни BDNF в сыворотке крови наблюдаются у больных шизофренией с большей длительностью заболевания и высокими дозировками лекарств [24, 25].
Как было показано S.Wan и соавт. (2006 г.), у пациентов, отвечающих на антипсихотическую терапию, наблюдается значимое повышение уровня транстиретина в ликворе. Роль данного белка и связь его с терапевтическим ответом у больных шизофренией остается недостаточно изученной, хотя аналогичные данные были получены на животных (повышение уровня транстиретина в ответ на длительную терапию клозапином) [26].
Цель исследования – поиск взаимосвязей между клинико-патогенетическими характеристиками параноидной шизофрении и биохимическими показателями крови для уточнения прогноза заболевания.
Материалы и методы
В исследование был включен 91 больной параноидной шизофренией, в том числе 51 пациент мужского пола и 40 женщин, средний возраст составил 34,6±9,9 года. Критериями включения стали возраст от 18 до 55 лет, отсутствие острых или обострений хронических соматических заболеваний, черепно-мозговых травм в анамнезе.Средняя продолжительность болезни составила 11,3±8,8 года, возраст начала заболевания – 25,9±7,7 года. Число госпитализаций варьировало от 0 до 22 и в среднем составило 5,2±4,8. 44,4% пациентов имели отягощенный психическими расстройствами анамнез. 46,5% больных имели высшее образование, 40,8% – среднее специальное и 12,7% – среднее. Терапию, включавшую в себя один антипсихотик, получали 48,9% больных, два – 42,2%, три антипсихотика – 8,9%. 20 (22,0%) пациентов получали в качестве антипсихотической терапии исключительно антипсихотики II поколения.
Клинико-шкальная оценка психического состояния пациентов производилась с помощью PANSS, которая предполагает оценку 33 признаков (симптомов), оцениваемых по 7-балльной системе [27], а также шкалы оценки депрессии Монтгомери–Асберг (MADRS).
Для тестирования использовали образцы сыворотки крови пациентов, которые хранили при температуре -70°С не более 6 мес. Определение нейрон-специфичной енолазы (neuron-specific enolase – NSE), протеина S100B и СРБ в сыворотке крови пациентов проводили с использованием автоматических иммунохимических анализаторов фирм «Roche» (Швейцария) и «Abbott» (США). BDNF определяли с помощью количественного иммуноферментного анализа типа «сэндвич» (иммуноферментный набор «R&D systems», США).
Важной особенностью нашего исследования было использование стандартизованных, автоматизированных методов лабораторного анализа, разрешенных Минздравом России для диагностических целей, которые позволяют уверенно, надежно получать результаты и сравнивать их с данными других лабораторий во всем мире, а также у пациентов в динамике с разницей во времени, составляющей месяцы и годы наблюдения.
Данные были обработаны с применением программы Microsoft Office Excel 2007, пакета статистических программ SPSS Statistics 17.0 («Statistical Package for the Social Sciences», версия 17.0). Применялись дескриптивные статистики, для сравнения между разными группами в зависимости от наличия нормального распределения – T-критерий для независимых выборок либо критерий Манна–Уитни, дисперсионный анализ. Корреляционный анализ с помощью коэффициента Пирсона был проведен для поиска взаимосвязей между показателями. Значимыми считали статистические различия при р≤0,05.
Результаты и обсуждение
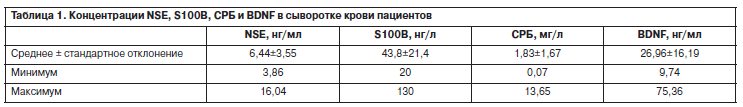
Исследование уровней нейромаркеров в крови у больных параноидной шизофренией позволило установить, что средний уровень NSE составил 6,44±3,55 нг/мл, а протеина S100B – 43,8±21,4 нг/л, не превысив границ нормы ни у одного пациента, что свидетельствует об отсутствии значимого повреждения нервных клеток (табл. 1).
У женщин уровень протеина S100B был ожидаемо более высоким по сравнению с лицами мужского пола (0,053±0,021 против 0,037±0,019 мкг/л, p<0,001). От возраста пациентов уровень нейромаркеров не зависел.
Корреляционный анализ показал, что более высокие уровни NSE и S100B характерны для пациентов с более тяжелым течением заболевания, перенесших большее количество обострений (r=0,281, p=0,012 и r=0,289; p=0,010 соответственно), но не с большей длительностью заболевания (r=-0,090, p=0,428 и r=0,190; p=0,094).
У пациентов с отягощенной психическими расстройствами наследственностью концентрации протеина S100B были статистически значимо выше (0,046±0,026 против 0,038±0,015 мкг/л; p=0,026). Не выявлено значимых различий между концентрацией протеина S100B у пациентов, соответствовавших критериям первого эпизода (39±18 нг/л), и у больных на этапе хронической шизофрении (44±21 нг/л).
Лишь у 2 пациентов были выявлены показатели высокочувствительного СРБ выше 10 мг/л, отражающие активную воспалительную реакцию, в то время как у части больных (21,4%) уровень СРБ указывал на наличие системного сосудистого воспаления (от 3 до 10 мг/л). Полученные данные свидетельствуют о возможной роли активации воспалительного ответа в развитии шизофрении у части пациентов. Следует отметить, что повышенные уровни высокочувствительного СРБ были выявлены при однократном обследовании пациентов, а поскольку этот показатель очень лабильный (за 24 ч может возрастать в десятки раз и затем в течение нескольких дней нормализоваться), можно предположить, что и у остальных пациентов он повышался в определенные периоды заболевания. Данные исследования свидетельствуют о возможной роли активации воспалительного ответа в развитии шизофрении у части пациентов.
СРБ оказался выше у лиц с более поздно манифестировавшим заболеванием (r=0,325, p=0,019), что может свидетельствовать о большем вкладе фактора воспаления как проявления средового влияния в развитие шизофрении у данной группы больных.
Уровень СРБ чаще был высоким у больных, которым назначались антидепрессанты (8,6±9,7 мг/л vs 1,7±1,6 мг/л; р=0,092), что может косвенно свидетельствовать о существенном удельном весе депрессивных расстройств в структуре шизофрении в этих случаях. Ранее было показано, что существует связь между депрессией при шизофрении и нарушениями системы воспаления (C.Noto и соавт., 2013), а также что уровень растворимых рецепторов фактора некроза опухоли 1-го типа повышен у терапевтически резистентных пациентов, больных шизофренией с депрессией, что рассматривалось и как возможное последствие далеко зашедшей, поздней стадии болезни, сопровождающейся коморбидными заболеваниями, и как свидетельство ускорения прогрессирования изменений в головном мозге (их роль в прогрессировании шизофрении пока не изучена) [10].
Повышение уровня СРБ у больных шизофренией было продемонстрировано в метаанализе B.Miller и соавт. [28]. Существует точка зрения, что усилению иммунного ответа способствуют факторы окружающей среды, связанные с госпитализациями, лечением и др. Пока что до конца не ясно, является ли воспаление частью патогенетического пути (перинатальные иммунные воздействия и инфекции играют роль в развитии шизофрении в дальнейшем).
В эпидемиологических исследованиях показано, что будущие пациенты чаще страдают аутоиммунными заболеваниями [29].
В нашем исследовании больные были разделены на 2 группы: основную (n=57), в которую вошли пациенты на этапе стабилизации ремиссии или устойчивой ремиссии, и группу терапевтически резистентных больных (n=34).
У последних отсутствовала динамика выраженности психопатологической симптоматики и/или иных ключевых симптомов на фоне терапии двумя антипсихотиками разных химических классов (как минимум одного атипичного) в рекомендуемых дозировках на протяжении 6–8 нед каждым из них.
Клиническая характеристика пациентов по PANSS приведена в табл. 2. Следует отметить, что терапевтически резистентные пациенты значимо отличались по суммарным показателям всех подшкал в худшую сторону.

Больные, соответствовавшие критериям терапевтической резистентности, имели более высокие концентрации NSE (9,64±4,40 vs 5,08±3,04 нг/мл; р<0,001) и S100B (49,6±22,5 vs 40,3±20,1 нг/л; р=0,051). Уровни NSE коррелировали со всеми показателями подшкал PANSS и ее суммарным баллом (r=0,530, р<0,001). Концентрация S100B была выше у больных с более выраженной позитивной и общепсихопатологической симптоматикой. Ранее уже были получены данные, свидетельствующие о том, что уровни S100B могут быть связаны с психическим состоянием: они выше при обострениях и ниже у хронизированных пациентов. У пожилых больных шизофренией более высокие уровни данного протеина обнаруживаются у пациентов с менее выраженными негативными симптомами. Вероятно, секреция S100B у них приводила к нейропротекторному эффекту [7].
Наши данные не подтвердили наличие взаимосвязи между терапевтической резистентностью и воспалением (СРБ), указание на которую встречается в литературе [11]. У пациентов с более высокими уровнями NSE и СРБ были в большей степени выражены нарушения мышления (r=0,347, p=0,026; r=0,433; p=0,017). Уровень последнего был также выше у более агрессивных, ажитированных пациентов (r=0,394, r=0,031), что отражает менее выраженный ответ на терапию у этих больных.
Пациенты, получавшие монотерапию антипсихотиком II поколения, имели более низкий уровень NSE и S100B (табл. 3), что может говорить о меньшей проницаемости мембран нейронов. Уровни NSE значимо различались в группах больных, принимавших разную терапию, причем наиболее значимо – между группой монотерапии атипичным антипсихотиком и группой, получавшей сочетанную терапию антипсихотиками разных поколений (р=0,036). Значимых различий в уровне NSE между группами монотерапии антипсихотиком I и II поколений не было (р=0,514). Корреляционный анализ показал, что зависимости концентрации NSE от количества антипсихотиков также не было (r=0,170, p=0,263).
Уровень BDNF в сыворотке крови пациентов составил 26,96±16,19 нг/мл. Взаимосвязей концентрации указанного маркера с клиническими показателями и особенностями течения заболевания выявлено не было, хотя в литературе есть указания на наличие связей между содержанием BDNF и клинической картиной, когнитивными нарушениями при шизофрении, возрастом начала данного заболевания [30].
Выводы
1. Уровни NSE, S100B, СРБ отражают особенности течения шизофрении и терапевтического ответа (число госпитализаций, наличие терапевтической резистентности, выраженность психопатологической симптоматики).2. У больных параноидной шизофренией с терапевтической резистентностью патофизиология процесса характеризуется наличием повышенной проницаемости мембран нейронов, о чем свидетельствует более высокая концентрация NSE в сыворотке крови.
3. Уровни S100B и СРБ отражают особенности возможных путей развития шизофрении: больший вклад наследственности наблюдается у больных с высоким содержанием протеина S100B, в то время как СРБ оказался выше у лиц с более поздно манифестировавшим заболеванием, что может свидетельствовать о большем вкладе фактора воспаления в развитие шизофрении у данной группы больных.
Работа поддержана грантом РНФ 14-50-00069.
Сведения об авторах
Незнанов Николай Григорьевич – д-р мед. наук, проф., дир. ФГБУ «СПб НИПНИ им. В.М.Бехтерева». E-mail: spbinstb@bekhterev.ruДорофейкова Мария Владимировна – мл. науч. сотр. дир. ФГБУ «СПб НИПНИ им. В.М.Бехтерева». E-mail: mvdorofeykova@mail.ru
Петрова Наталия Николаевна – д-р мед. наук, проф., зав. каф. психиатрии и наркологии медицинского фак. ФГБОУ ВО СПбГУ.
E-mail: petrova_nn@mail.ru
Список исп. литературыСкрыть список1. Stober G, Ben-Shachar D, Cardon M et al. Schizophrenia: From the brain to peripheral markers – A consensus paper of the WFSBP Task Force on biological markers. World J Biol Psychiatry 2009; 10 (2): 127–55.
2. Weickert CS, Weickert TW, Pillai A, Buckley PF. Biomarkers in schizophrenia: a brief conceptual consideration. Dis Mark 2013; 35: 3–9.
3. Lakhan SE, Kramer A. Schizophrenia genomics and proteomics: are we any closer to biomarker discovery? Behav Brain Funct 2009; 5: 2.
4. Emsley R, Rabinowitz J, Medori R. Remission in early psychosis: rates, predictors, and clinical and functional outcome correlates. Schizophr Res 2007; 89: 129–39.
5. Notaras M, Hill R, van den Buuse M. A role for the BDNF gene Val66Met polymorphism in schizophrenia? A comprehensive review. Neurosci Biobehav Rev 2015; 51: 15–30.
6. Mehta UM, Keshavan MS. Can we predict outcome in schizophrenia? The need for prognostic biomarkers. Asian J Psychiatr 2015; 14: 1–2.
7. Schwarz E, Bahn S. Cerebrospinal fluid identification of diagnostic markers for schizophrenia. Expert Rev Mol Diagn 2008; 8 (2): 209–16.
8. English BA, Thomas K, Johnstone J et al. Use of translational pharmacodynamic biomarkers in early-phase clinical studies for schizophrenia. Biomark Med 2014; 8 (1): 29–9.
9. Бубнова Ю.С., Дорофейков В.В., Мазо Г.Э., Петрова Н.Н. К вопросу о механизмах развития депрессии при шизофрении. Психиатрия и психофармакотерапия. 2012; 14 (4): 21–6. / Bubnova Yu.S., Dorofeikov V.V., Mazo G.E., Petrova N.N. K voprosu o mekhanizmakh razvitiia depressii pri shizofrenii. Psychiatry and Psychopharmacotherapy. 2012; 14 (4): 21–6. [in Russian]
10. Noto CS, Gadelha A, Belangero SI et al. Association of biomarkers and depressive symptoms in schizophrenia. Neurosci Lett 2011; 505 (3): 282–85.
11. Maes M, Bocchio Chiavetto L, Bignotti Sn et al. Increased serum interleukin-8 and interleukin-10 in schizophrenic patients resistant to treatment with neuroleptics and the stimulatory effects of clozapine on serum leukemia inhibitory factor receptor. Schizophr Res 2002; 54 (3): 281–91.
12. Sugino H, Futamura T, Mitsumoto Y et al. Atypical antipsychotics suppress production of proinflammatory cytokines and up-regulate interleukin-10 in lipopolysaccharide-treated mice. Prog Neuropsychopharmacol Biol Psychiatry 2009; 33 (2): 303–7.
13. Altamura AC, Boin F, Maes M. HPA axis and cytokines dysregulation in schizophrenia: potential implications for the antipsychotic treatment. Eur Neuropsychopharmacol 1999; 10 (1): 1–4.
14. Zai G, Muller DJ, Volavka J et al. Family and case-control association study of the tumor necrosis factor-alpha (TNF-alpha) gene with schizophrenia and response to antipsychotic medication. Psychopharmacology (Berl) 2006; 188 (2): 171–82.
15. Zhang XY, Zhou DF, Cao LY et al. Cortisol and cytokines in chronic and treatment-resistant patients with schizophrenia: association with
psychopathology and response to antipsychotics. Neuropsychopharmacology 2005; 30: 1532–8.
16. McAllister CG, van Kammen DP, Rehn TJ et al. Increases in CSF levels of interleukin-2 in schizophrenia: effects of recurrence of psychosis and medication status. Am J Psychiatry. 1995; 152: 1291–7.
17. Lin A, Kenis G, Bignotti S et al. The inflammatory response system in treatment-resistant schizophrenia: increased serum interleukin-6. Schizophr Res 1998; 32: 9–15.
18. Tomasik J, Schwarz E, Guest PC, Bahn S. Blood test for schizophrenia. Eur Arch Psychiatry Clin Neurosci 2012; 262 (Suppl. 2): 79–83.
19. Chan MK, Guest PC, Levin Y et al. Converging evidence of blood-based biomarkers for schizophrenia: an update. Int Rev Neurobiol 2011; 101: 95–144.
20. Thompson Ray M, Weickert CS, Wyatt E et al. Decreased BDNF, trkB-TK1 and GAD67 mRNA expression in the hippocampus of individuals with schizophrenia and mood disorders. J Psychiatry Neurosci 2011; 36 (3): 195–203.
21. Jindal RD, Pillai AK, Mahadik SP et al. Decreased BDNF in patients with antipsychotic naı¨ve first episode schizophrenia. Schizophr Res 2010; 119 (1–3): 47–51.
22. Pillai A, Buckley PF. Reliable biomarkers and predictors of schizophrenia and its treatment. Psychiatr Clin North Am 2012; 35: 645–59.
23. Vinogradov S, Fisher M, Holland C et al. Is Serum Brain-Derived Neurotrophic Factor a Biomarker for Cognitive Enhancement in Schizophrenia? Biol Psychiatry 2009; 66 (6): 549-53.
24. Gama CS, Andreazza AC, Kunz M et al. Serum levels of brain-derived neurotrophic factor in patients with schizophrenia and bipolar disorder. Neurosci Lett 2007; 420: 45–8.
25. Pedrini M, Chendo I, Grande I, Lobato MI et al. Serum brain-derived neurotrophic factor and clozapine daily dose in patients with schizophrenia: a positive correlation. Neurosci Lett 2011; 491: 207–10.
26. Wan S, Yang Y, Li H et al. Dysregulation of retinoid transporters expression in body fluids of schizophrenia patients. J Proteome Res 2006; 5 (11): 3213–6.
27. Kay SR, Fiszbein A, Opler LA. The positive and negative syndrome scale (PANSS) for schizophrenia. Schizophr Bull 1987; 13 (2): 261–76.
28. Miller BJ, Culpepper N, Rapaport MH. C-reactive protein levels in schizophrenia: a review and meta-analysis. Clin Schizophr Relat Psychoses 2014; 7: 223–30.
29. Dickerson F, Stallings C, Origoni A et al. Inflammatory Markers in Recent Onset Psychosis and Chronic Schizophrenia. Schizophr Bull 2016; 42 (1): 134–41.
30. Chao HM, Kao H-T, Porton B. BDNF Val66Met variant and age of onset in schizophrenia. American journal of medical genetics Part B, Neuropsychiatric genetics: the official publication of the International Society of Psychiatric Genetics. 2008; 147B (4): 505–6.
27 июня 2017
Количество просмотров: 2061


