Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№02 2018
Депрессивные расстройства как следствие аллостатической нагрузки №02 2018
Номера страниц в выпуске:55-58
Данный обзор подготовлен по материалам 25-го Конгресса Европейской психиатрической ассоциации (апрель 2017 г., Флоренция) участниками проекта «Восточноевропейская академия Всемирной психиатрической ассоциации и компании "Сервье"» специально для психиатрических журналов Зоны 10 ВПА (East European Educational WPA – Servier Academy – «EEE WPA-Servier Academy»).
В статье изложены материалы, посвященные рассмотрению иммунометаболических коррелятов депрессивных расстройств, в частности инсулинорезистентности, с позиции аллостаза, которые были представлены на 25-м Европейском Конгрессе психиатров в г. Флоренция (Италия), 1–4 апреля 2017 г.
Ключевые слова: депрессия, аллостаз, инсулинорезистентность.
Для цитирования: Федченко В.Ю. Депрессивные расстройства как следствие аллостатической нагрузки. Психиатрия и психофармакотерапия. 2018; 20 (1): 55–58.
В статье изложены материалы, посвященные рассмотрению иммунометаболических коррелятов депрессивных расстройств, в частности инсулинорезистентности, с позиции аллостаза, которые были представлены на 25-м Европейском Конгрессе психиатров в г. Флоренция (Италия), 1–4 апреля 2017 г.
Ключевые слова: депрессия, аллостаз, инсулинорезистентность.
Для цитирования: Федченко В.Ю. Депрессивные расстройства как следствие аллостатической нагрузки. Психиатрия и психофармакотерапия. 2018; 20 (1): 55–58.
Данный обзор подготовлен по материалам 25-го Конгресса Европейской психиатрической ассоциации (апрель 2017 г., Флоренция) участниками проекта «Восточноевропейская академия Всемирной психиатрической ассоциации и компании "Сервье"» специально для психиатрических журналов Зоны 10 ВПА (East European Educational WPA – Servier Academy – «EEE WPA-Servier Academy»).
В статье изложены материалы, посвященные рассмотрению иммунометаболических коррелятов депрессивных расстройств, в частности инсулинорезистентности, с позиции аллостаза, которые были представлены на 25-м Европейском Конгрессе психиатров в г. Флоренция (Италия), 1–4 апреля 2017 г.
Ключевые слова: депрессия, аллостаз, инсулинорезистентность.
Для цитирования: Федченко В.Ю. Депрессивные расстройства как следствие аллостатической нагрузки. Психиатрия и психофармакотерапия. 2018; 20 (1): 55–58.
Institute of Neurology, Psychiatry and Narcology of National Academy of Medical Science of Ukraine. 61068, Ukraine, Kharkov, ul. Akademika Pavlova, d. 46 vfedchenko83@ukr.net
The article contains materials devoted to the consideration of immunometabolic correlates of depressive disorders, in particular insulin resistance, from the position of allostasis, which were presented at the 25th European Congress of Psychiatrists in Florence (Italy), 1–4 April 2017.
Key words: depression, allostasis, insulin resistance.
For citation: Fedchenko V.Yu. Depressive disorders as a consequence of the allostatic load. Psychiatry and Psychopharmacotherapy. 2018; 20 (1): 55–58.
В статье изложены материалы, посвященные рассмотрению иммунометаболических коррелятов депрессивных расстройств, в частности инсулинорезистентности (ИР), с позиции аллостаза, которые были представлены на 25-м Европейском конгрессе психиатров во Флоренции (Италия) 1–4 апреля 2017 г.
Депрессия является самым распространенным психическим расстройством во всем мире. Бремя депрессивных расстройств выходит за рамки функционирования и качества жизни и распространяется на соматическое здоровье. В своем докладе «Депрессия и ее последствия: аллостатическая нагрузка в качестве связующего звена» в рамках семинара «Аллостаз: инсулин и головной мозг. Последствия для моделирования болезни и терапии в психиатрии» B.Penninx (Нидерланды) было показано, что депрессия впоследствии повышает риск развития, например, сердечно-сосудистых заболеваний, инсульта, сахарного диабета (СД) и ожирения. Эти соматические последствия могут быть частично вызваны метаболическими, иммуновоспалительными, вегетативными нарушениями и дисрегуляцией гипоталамо-гипофизарно-надпочечниковой системы (ГГНС), которые, как полагают, чаще встречаются у пациентов с депрессией. Доказательства, связывающие депрессию с метаболическим синдромом, указывают на то, что депрессивные расстройства чаще коррелируют с такими его компонентами, как абдоминальное ожирение и дислипидемия [1].
B.Penninx привела доказательства связи между депрессией и началом многих неблагоприятных соматических последствий для организма. В дополнение к снижению качества жизни различные физиологические процессы, связанные со стрессом, вероятно, вносят вклад в неблагоприятные соматические последствия психических расстройств, в частности депрессивных. При этом маловероятно, чтобы инициирующие этот процесс биологические системы были крайне специфическими. На самом деле в патологический процесс вовлекаются множественные дисрегуляции стресс-систем, включая иммунную, ГГНС и вегетативную нервную систему, а также различные общие протеомные или метаболические пути. Концепция аллостатической нагрузки подчеркивает наличие мультисистемной физиологической дисрегуляции.
Гетерогенность депрессии в современной классификации остается предметом обсуждения, несмотря на предыдущие попытки эмпирически разделить депрессивные расстройства. B.Penninx представила результаты исследования депрессии и тревоги в Нидерландах (NESDA), направленного на выявление подтипов депрессии внутри большой когорты пациентов с депрессивными расстройствами [2].
В ходе обследования 818 лиц с диагнозом текущего депрессивного расстройства по DSM-IV (с учетом клинико-психопатологических, демографических и психосоциальных характеристик) были выявлены три подтипа депрессии: тяжелый меланхолический (распространенность – 46,3%), тяжелый атипичный (распространенность – 24,6%) и подтип средней степени тяжести (распространенность – 29,1%). Оба тяжелых подтипа характеризовались более выраженными невротизмом (меланхолический – отношение шансов – ОШ 1,05; 95% доверительный интервал – ДИ 1,01–1,10, атипичный ОШ 1,07; 95% ДИ 1,03–1,12), нетрудоспособностью (меланхолический ОШ 1,07; 95% ДИ 1,04–1,09, атипичный ОШ 1,06; 95% ДИ 1,04–1,07) и меньшей экстраверсией (меланхолический ОШ 0,95; 95% ДИ 0,92–0,99, атипичный ОШ 0,95, 95% ДИ 0,92–0,99), чем подтип средней степени тяжести. Сравнение меланхолического подтипа с атипичным показало, что среди респондентов меланхолического подтипа зарегистрировано больше курящих лиц (атипичный ОШ 0,57; 95% ДИ 0,39–0,84) и большее количество детских травм (атипичный ОШ 0,86; 95% ДИ 0,74–1,00), а среди респондентов атипичного типа преобладали женщины (атипичный ОШ 1,52; 95% ДИ 0,99–2,32), более высокий индекс массы тела (атипичный ОШ 1,13; 95% ДИ 1,09–1,17) и чаще наблюдался метаболический синдром (атипичный ОШ 2,17; 95% ДИ 1,38–3,42).
Таким образом, важными отличительными признаками между подтипами оказались как тяжесть депрессивной симптоматики, так и ее характер (меланхолический или атипичный). Наличие более выраженных соматических симптомов и метаболического синдрома при атипичном подтипе предполагает участие в его патогенезе метаболического компонента (см. таблицу).
Следовательно, логичным будет предположение о различии подходов к терапии «типичной» (стандартные антидепрессанты или когнитивная терапия) и «атипичной» (добавление противовоспалительных средств и коррекции образа жизни) депрессии. Таким образом, иммунометаболические нарушения при депрессивных расстройствах требуют специального лечения. Среди доступных методов предложены следующие:
• (дополнительные) противовоспалительные препараты;
• альтернативные вмешательства, например, терапия бегом [по результатам 16-недельного лечения (терапия бегом против антидепрессантов) для изучения изменения настроения, физических и биологических показателей у 200 лиц с депрессией];
• пищевая коррекция [по результатам двух стратегий питания (изменение поведения в зависимости от пищи и добавления пищевых добавок) для улучшения настроения у 1 тыс. граждан Европейского союза с избыточной массой тела].
Примерно полтора десятилетия назад научный сотрудник Стэнфордского университета, доктор медицины N.Rasgon выдвинула смелую для того времени гипотезу: резистентность к инсулину, по ее мнению, является недостающим звеном между расстройствами настроения и деменцией. В последние годы эта гипотеза была подтверждена результатами многочисленных экспериментальных исследований, которые связывают не только СД типа 2, но и депрессию и болезнь Альцгеймера с ИР [3].
N.Sartorius (Швейцария) в рамках доклада «Коморбидность депрессии и диабета» представил результаты многоцентрового международного совместного исследования (International Prevalence and treatment of diabetes and depression study – INTERPRET-DD), в котором изучалась частота депрессивных расстройств у лиц, страдающих СД типа 2. Исследование проводилось в 14 странах – 5 в Азии (Бангладеш, Китай, Индия, Пакистан и Таиланд), 2 в Африке (Кения и Уганда), 2 в Латинской Америке (Аргентина и Мексика) и 5 в Европе (Германия, Польша, Россия, Сербия и Украина). Исследование показало, что депрессивные расстройства и подпороговая депрессия часто наблюдаются у лиц с СД: у 1/10 из почти 3 тыс. обследованных пациентов зарегистрирована большая депрессия и еще у 15% – подпороговые депрессивные расстройства. Депрессия редко распознавалась врачами, специализирующимися на СД, и даже в немногих случаях правильного диагностирования пациенты не получали адекватной терапии депрессивных расстройств [4].
В своем докладе «3D дилемма 21-го столетия» N.Rasgon (США) представила последствия ИР для центральной нервной системы (ЦНС) и развития депрессивной симптоматики, среди которых можно выделить:
• сокращение транспорта инсулина в головной мозг;
• депривация глюкозы в ЦНС приводит к нарушению функции мозга (депрессии, снижению познавательной способности, негативному влиянию на поведение, что отображается на качестве гликемического контроля);
• высокая распространенность депрессии у пациентов с первичной ИР (общие патофизиологические характеристики, двунаправленные связи между ЦНС и эндокринным гомеостазом);
• недиабетические пациенты с большой депрессией часто имеют ИР даже после ремиссии депрессивной симптоматики (биомаркеры, указывающие на ИР);
• ИР обычно нарастает с возрастом (нормальное и патологическое старение мозга со временем уменьшает способность распознавать специфическое негативное влияние ИР на когнитивные функции) [5–7].
Выводы из имеющихся исследований свидетельствуют о положительных корреляциях между ИР и депрессивной симптоматикой. При этом резистентность к инсулину повышается по мере возрастания тяжести депрессии. Более углубленное понимание этиологии ИР при депрессивных расстройствах могло бы стать новым вектором в их терапии. Учитывая связь ИР с рядом стрессовых факторов, была рассмотрена концепция аллостаза [8–15].
В свое время Г.Селье признал парадокс, что физиологические системы, активируемые стрессом, могут не только защищать и восстанавливать, но и наносить вред организму. Что связывает эти, казалось бы, противоречивые роли? Как стресс влияет на патогенез заболевания, и чем объяснить различия в уязвимости к стрессовым расстройствам у людей с похожим жизненным опытом? Эти и многие другие вопросы по-прежнему бросают вызов исследователям.
Стрессовый опыт включает в себя значимые жизненные события, травмы и злоупотребления, иногда связан с семейной обстановкой, профессиональной средой или окружением. Острый стресс (в понимании «борьба или бегство» или значимые жизненные события) и хронический стресс (совокупная нагрузка от незначительных повседневных стрессов) могут иметь долгосрочные последствия. Последствия хронического стресса могут усугубляться высококалорийной диетой, а также употреблением табака и алкоголя и снижаться при умеренных физических нагрузках.
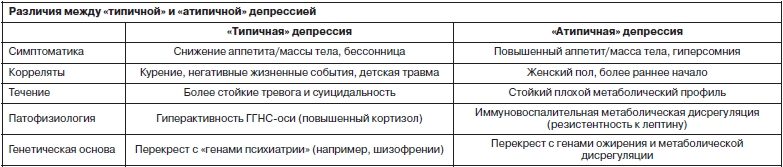
 Под аллостатической нагрузкой B.McEwen (США) подразумевает долгосрочный эффект физиологического ответа на стресс. Аллостаз – способность достичь стабильности через изменение – имеет решающее значение для выживания. Путем аллостаза вегетативная нервная, ГГНС, сердечно-сосудистая, метаболическая и иммунная система защищают организм, реагируя на внутренние и внешние стрессы. Аллостатическая нагрузка при этом приводит к преждевременному изнашиванию организма, обусловленному хронической гиперактивностью или недостаточной активностью аллостатических систем.
Под аллостатической нагрузкой B.McEwen (США) подразумевает долгосрочный эффект физиологического ответа на стресс. Аллостаз – способность достичь стабильности через изменение – имеет решающее значение для выживания. Путем аллостаза вегетативная нервная, ГГНС, сердечно-сосудистая, метаболическая и иммунная система защищают организм, реагируя на внутренние и внешние стрессы. Аллостатическая нагрузка при этом приводит к преждевременному изнашиванию организма, обусловленному хронической гиперактивностью или недостаточной активностью аллостатических систем.
Восприятие стресса зависит от личностного опыта, генетических факторов и моделей поведения. Когда мозг реагирует на стресс, инициируются физиологические и поведенческие реакции, приводящие к аллостазу и адаптации. Со временем аллостатическая нагрузка может накапливаться, а чрезмерное воздействие медиаторов нервной, эндокринной и иммунной стресс-систем может оказывать неблагоприятное воздействие на различные системы органов, приводя к развитию патологических изменений: зависимого (аддиктивного) поведения, тревожных, депрессивных расстройств, а также болезней сердечно-сосудистой, нервной, пищеварительной, эндокринной, иммунной системы (рис. 1).
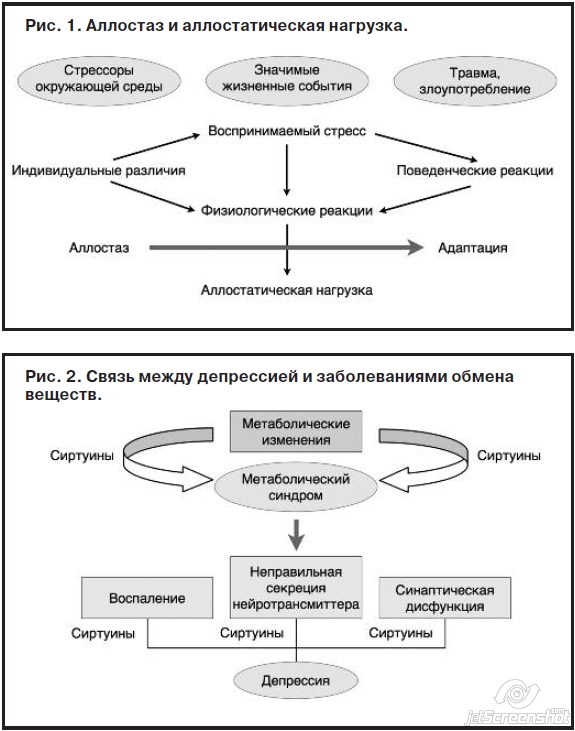
R.McIntyre (Канада) в своем докладе «Метаболические мишени и нарушения головного мозга: концептуальная основа и новые терапевтические цели» продемонстрировал связь между депрессивными расстройствами и заболеваниями обмена веществ путем суммирования недавних открытий относительно потенциальной зависимости между сиртуинами (SIRTs) и депрессией, вызванной метаболическими нарушениями [16, 17]. Как известно, депрессия связана с различными процессами в головном мозге, такими как нейровоспаление, синаптическая дисфункция и когнитивный дефицит. Недавние исследования показали, что депрессия формируется при различных метаболических изменениях, приводящих к метаболическому синдрому. Сиртуины представляют собой NAD+ (никотинамидадениндинуклеотид)-зависимые гистондезацетилазы класса III, которые регулируют различные биологические механизмы, такие как долголетие, геномная стабильность и воспаление. Модуляция активности сиртуинов была подчеркнута как перспективный подход к регрессу нейродегенеративных процессов.
В последнее время повышенный уровень метаболических факторов, включая кровяное давление, холестерин, С-реактивный белок, приводящий к СД типа 2 или ожирению, рассматривается в качестве высокого риска развития депрессивных симптомов. Повышенный уровень глюкозы и резистентность к инсулину при СД типа 2 усугубляют прогрессирующую дисфункциональность головного мозга. Гипергликемия вызывает нарушение регуляции ГГНС и моноаминергической системы. При этом отмечено, что коморбидность ожирения и депрессии – достаточно частое явление в общей популяции. Согласно ранее опубликованным доказательствам сиртуин-1 (SIRT-1) тесно связан с нейропатогенезом, вызванным СД типа 2 и ожирением. Сообщается, что сиртуин-1 играет главную роль в метаболизме глюкозы и активации клеточной сигнализации инсулина. Было продемонстрировано, что регуляция метаболизма глюкозы подавляет развитие возрастных заболеваний, таких как СД типа 2 и сердечно-сосудистые заболевания, и особенно связана с активностью AMPK (5'аденозин-монофосфат-активируемой протеинкиназы) и ассоциированным с биосинтетической активностью NAD+ сиртуином-1, а также сиртуином-6 (SIRT-6), связанным с регуляцией опосредованной инсулином клеточной сигнализации. В то же время сиртуины улучшают секрецию инсулина и гомеостаз глюкозы посредством увеличения уровней NAD+. Кроме того, в нейронах сигнализация сиртуина-1 модулирует активность активируемого пролифераторами пероксисом рецептора g коактиватора-1 (PGC-1a) и последующую митохондриальную дисфункцию. Отмечено также, что сиртуин-2 (SIRT-2) является мишенью для диабета. В целом сиртуины связаны с метаболическими заболеваниями, включая СД типа 2 и ожирение, и влияют на нейропатогенез, вызванный этими расстройствами. В совокупности сиртуины участвуют в развитии депрессивных симптомов, вызванных метаболическими заболеваниями (рис. 2). Учитывая нейропротективные эффекты, включая противовоспалительный эффект, регуляцию продукции нейротрансмиттеров и снижение синаптической дисфункции, сиртуины могут стать решающей мишенью для облегчения депрессивной симптоматики путем метаболических изменений.
Таким образом, приведенный обзор позволяет заключить, что депрессивные расстройства сопровождаются множеством дисрегуляций в биологических стресс-системах, метаболическими дисрегуляциями и клеточным старением, что указывает на повышенную аллостатическую нагрузку. В свою очередь, повышенная аллостатическая нагрузка соотносится с процессами в головном мозге, а также со множеством соматических состояний. При этом специфические процессы аллостатической нагрузки могут предоставить возможности для персонифицированных стратегий терапии депрессивных расстройств.
Сведения об авторе
Федченко Виктория Юрьевна – ст. науч. сотр. ГУ ИНПН НАМН Украины. E-mail: vfedchenko83@ukr.net
В статье изложены материалы, посвященные рассмотрению иммунометаболических коррелятов депрессивных расстройств, в частности инсулинорезистентности, с позиции аллостаза, которые были представлены на 25-м Европейском Конгрессе психиатров в г. Флоренция (Италия), 1–4 апреля 2017 г.
Ключевые слова: депрессия, аллостаз, инсулинорезистентность.
Для цитирования: Федченко В.Ю. Депрессивные расстройства как следствие аллостатической нагрузки. Психиатрия и психофармакотерапия. 2018; 20 (1): 55–58.
Depressive disorders as a consequence of the allostatic load
V.Yu.FedchenkoInstitute of Neurology, Psychiatry and Narcology of National Academy of Medical Science of Ukraine. 61068, Ukraine, Kharkov, ul. Akademika Pavlova, d. 46 vfedchenko83@ukr.net
The article contains materials devoted to the consideration of immunometabolic correlates of depressive disorders, in particular insulin resistance, from the position of allostasis, which were presented at the 25th European Congress of Psychiatrists in Florence (Italy), 1–4 April 2017.
Key words: depression, allostasis, insulin resistance.
For citation: Fedchenko V.Yu. Depressive disorders as a consequence of the allostatic load. Psychiatry and Psychopharmacotherapy. 2018; 20 (1): 55–58.
В статье изложены материалы, посвященные рассмотрению иммунометаболических коррелятов депрессивных расстройств, в частности инсулинорезистентности (ИР), с позиции аллостаза, которые были представлены на 25-м Европейском конгрессе психиатров во Флоренции (Италия) 1–4 апреля 2017 г.
Депрессия является самым распространенным психическим расстройством во всем мире. Бремя депрессивных расстройств выходит за рамки функционирования и качества жизни и распространяется на соматическое здоровье. В своем докладе «Депрессия и ее последствия: аллостатическая нагрузка в качестве связующего звена» в рамках семинара «Аллостаз: инсулин и головной мозг. Последствия для моделирования болезни и терапии в психиатрии» B.Penninx (Нидерланды) было показано, что депрессия впоследствии повышает риск развития, например, сердечно-сосудистых заболеваний, инсульта, сахарного диабета (СД) и ожирения. Эти соматические последствия могут быть частично вызваны метаболическими, иммуновоспалительными, вегетативными нарушениями и дисрегуляцией гипоталамо-гипофизарно-надпочечниковой системы (ГГНС), которые, как полагают, чаще встречаются у пациентов с депрессией. Доказательства, связывающие депрессию с метаболическим синдромом, указывают на то, что депрессивные расстройства чаще коррелируют с такими его компонентами, как абдоминальное ожирение и дислипидемия [1].
B.Penninx привела доказательства связи между депрессией и началом многих неблагоприятных соматических последствий для организма. В дополнение к снижению качества жизни различные физиологические процессы, связанные со стрессом, вероятно, вносят вклад в неблагоприятные соматические последствия психических расстройств, в частности депрессивных. При этом маловероятно, чтобы инициирующие этот процесс биологические системы были крайне специфическими. На самом деле в патологический процесс вовлекаются множественные дисрегуляции стресс-систем, включая иммунную, ГГНС и вегетативную нервную систему, а также различные общие протеомные или метаболические пути. Концепция аллостатической нагрузки подчеркивает наличие мультисистемной физиологической дисрегуляции.

Гетерогенность депрессии в современной классификации остается предметом обсуждения, несмотря на предыдущие попытки эмпирически разделить депрессивные расстройства. B.Penninx представила результаты исследования депрессии и тревоги в Нидерландах (NESDA), направленного на выявление подтипов депрессии внутри большой когорты пациентов с депрессивными расстройствами [2].
В ходе обследования 818 лиц с диагнозом текущего депрессивного расстройства по DSM-IV (с учетом клинико-психопатологических, демографических и психосоциальных характеристик) были выявлены три подтипа депрессии: тяжелый меланхолический (распространенность – 46,3%), тяжелый атипичный (распространенность – 24,6%) и подтип средней степени тяжести (распространенность – 29,1%). Оба тяжелых подтипа характеризовались более выраженными невротизмом (меланхолический – отношение шансов – ОШ 1,05; 95% доверительный интервал – ДИ 1,01–1,10, атипичный ОШ 1,07; 95% ДИ 1,03–1,12), нетрудоспособностью (меланхолический ОШ 1,07; 95% ДИ 1,04–1,09, атипичный ОШ 1,06; 95% ДИ 1,04–1,07) и меньшей экстраверсией (меланхолический ОШ 0,95; 95% ДИ 0,92–0,99, атипичный ОШ 0,95, 95% ДИ 0,92–0,99), чем подтип средней степени тяжести. Сравнение меланхолического подтипа с атипичным показало, что среди респондентов меланхолического подтипа зарегистрировано больше курящих лиц (атипичный ОШ 0,57; 95% ДИ 0,39–0,84) и большее количество детских травм (атипичный ОШ 0,86; 95% ДИ 0,74–1,00), а среди респондентов атипичного типа преобладали женщины (атипичный ОШ 1,52; 95% ДИ 0,99–2,32), более высокий индекс массы тела (атипичный ОШ 1,13; 95% ДИ 1,09–1,17) и чаще наблюдался метаболический синдром (атипичный ОШ 2,17; 95% ДИ 1,38–3,42).
Таким образом, важными отличительными признаками между подтипами оказались как тяжесть депрессивной симптоматики, так и ее характер (меланхолический или атипичный). Наличие более выраженных соматических симптомов и метаболического синдрома при атипичном подтипе предполагает участие в его патогенезе метаболического компонента (см. таблицу).
Следовательно, логичным будет предположение о различии подходов к терапии «типичной» (стандартные антидепрессанты или когнитивная терапия) и «атипичной» (добавление противовоспалительных средств и коррекции образа жизни) депрессии. Таким образом, иммунометаболические нарушения при депрессивных расстройствах требуют специального лечения. Среди доступных методов предложены следующие:
• (дополнительные) противовоспалительные препараты;
• альтернативные вмешательства, например, терапия бегом [по результатам 16-недельного лечения (терапия бегом против антидепрессантов) для изучения изменения настроения, физических и биологических показателей у 200 лиц с депрессией];
• пищевая коррекция [по результатам двух стратегий питания (изменение поведения в зависимости от пищи и добавления пищевых добавок) для улучшения настроения у 1 тыс. граждан Европейского союза с избыточной массой тела].
Примерно полтора десятилетия назад научный сотрудник Стэнфордского университета, доктор медицины N.Rasgon выдвинула смелую для того времени гипотезу: резистентность к инсулину, по ее мнению, является недостающим звеном между расстройствами настроения и деменцией. В последние годы эта гипотеза была подтверждена результатами многочисленных экспериментальных исследований, которые связывают не только СД типа 2, но и депрессию и болезнь Альцгеймера с ИР [3].
N.Sartorius (Швейцария) в рамках доклада «Коморбидность депрессии и диабета» представил результаты многоцентрового международного совместного исследования (International Prevalence and treatment of diabetes and depression study – INTERPRET-DD), в котором изучалась частота депрессивных расстройств у лиц, страдающих СД типа 2. Исследование проводилось в 14 странах – 5 в Азии (Бангладеш, Китай, Индия, Пакистан и Таиланд), 2 в Африке (Кения и Уганда), 2 в Латинской Америке (Аргентина и Мексика) и 5 в Европе (Германия, Польша, Россия, Сербия и Украина). Исследование показало, что депрессивные расстройства и подпороговая депрессия часто наблюдаются у лиц с СД: у 1/10 из почти 3 тыс. обследованных пациентов зарегистрирована большая депрессия и еще у 15% – подпороговые депрессивные расстройства. Депрессия редко распознавалась врачами, специализирующимися на СД, и даже в немногих случаях правильного диагностирования пациенты не получали адекватной терапии депрессивных расстройств [4].
В своем докладе «3D дилемма 21-го столетия» N.Rasgon (США) представила последствия ИР для центральной нервной системы (ЦНС) и развития депрессивной симптоматики, среди которых можно выделить:
• сокращение транспорта инсулина в головной мозг;
• депривация глюкозы в ЦНС приводит к нарушению функции мозга (депрессии, снижению познавательной способности, негативному влиянию на поведение, что отображается на качестве гликемического контроля);
• высокая распространенность депрессии у пациентов с первичной ИР (общие патофизиологические характеристики, двунаправленные связи между ЦНС и эндокринным гомеостазом);
• недиабетические пациенты с большой депрессией часто имеют ИР даже после ремиссии депрессивной симптоматики (биомаркеры, указывающие на ИР);
• ИР обычно нарастает с возрастом (нормальное и патологическое старение мозга со временем уменьшает способность распознавать специфическое негативное влияние ИР на когнитивные функции) [5–7].
Выводы из имеющихся исследований свидетельствуют о положительных корреляциях между ИР и депрессивной симптоматикой. При этом резистентность к инсулину повышается по мере возрастания тяжести депрессии. Более углубленное понимание этиологии ИР при депрессивных расстройствах могло бы стать новым вектором в их терапии. Учитывая связь ИР с рядом стрессовых факторов, была рассмотрена концепция аллостаза [8–15].
В свое время Г.Селье признал парадокс, что физиологические системы, активируемые стрессом, могут не только защищать и восстанавливать, но и наносить вред организму. Что связывает эти, казалось бы, противоречивые роли? Как стресс влияет на патогенез заболевания, и чем объяснить различия в уязвимости к стрессовым расстройствам у людей с похожим жизненным опытом? Эти и многие другие вопросы по-прежнему бросают вызов исследователям.
Стрессовый опыт включает в себя значимые жизненные события, травмы и злоупотребления, иногда связан с семейной обстановкой, профессиональной средой или окружением. Острый стресс (в понимании «борьба или бегство» или значимые жизненные события) и хронический стресс (совокупная нагрузка от незначительных повседневных стрессов) могут иметь долгосрочные последствия. Последствия хронического стресса могут усугубляться высококалорийной диетой, а также употреблением табака и алкоголя и снижаться при умеренных физических нагрузках.
 Под аллостатической нагрузкой B.McEwen (США) подразумевает долгосрочный эффект физиологического ответа на стресс. Аллостаз – способность достичь стабильности через изменение – имеет решающее значение для выживания. Путем аллостаза вегетативная нервная, ГГНС, сердечно-сосудистая, метаболическая и иммунная система защищают организм, реагируя на внутренние и внешние стрессы. Аллостатическая нагрузка при этом приводит к преждевременному изнашиванию организма, обусловленному хронической гиперактивностью или недостаточной активностью аллостатических систем.
Под аллостатической нагрузкой B.McEwen (США) подразумевает долгосрочный эффект физиологического ответа на стресс. Аллостаз – способность достичь стабильности через изменение – имеет решающее значение для выживания. Путем аллостаза вегетативная нервная, ГГНС, сердечно-сосудистая, метаболическая и иммунная система защищают организм, реагируя на внутренние и внешние стрессы. Аллостатическая нагрузка при этом приводит к преждевременному изнашиванию организма, обусловленному хронической гиперактивностью или недостаточной активностью аллостатических систем.Восприятие стресса зависит от личностного опыта, генетических факторов и моделей поведения. Когда мозг реагирует на стресс, инициируются физиологические и поведенческие реакции, приводящие к аллостазу и адаптации. Со временем аллостатическая нагрузка может накапливаться, а чрезмерное воздействие медиаторов нервной, эндокринной и иммунной стресс-систем может оказывать неблагоприятное воздействие на различные системы органов, приводя к развитию патологических изменений: зависимого (аддиктивного) поведения, тревожных, депрессивных расстройств, а также болезней сердечно-сосудистой, нервной, пищеварительной, эндокринной, иммунной системы (рис. 1).
R.McIntyre (Канада) в своем докладе «Метаболические мишени и нарушения головного мозга: концептуальная основа и новые терапевтические цели» продемонстрировал связь между депрессивными расстройствами и заболеваниями обмена веществ путем суммирования недавних открытий относительно потенциальной зависимости между сиртуинами (SIRTs) и депрессией, вызванной метаболическими нарушениями [16, 17]. Как известно, депрессия связана с различными процессами в головном мозге, такими как нейровоспаление, синаптическая дисфункция и когнитивный дефицит. Недавние исследования показали, что депрессия формируется при различных метаболических изменениях, приводящих к метаболическому синдрому. Сиртуины представляют собой NAD+ (никотинамидадениндинуклеотид)-зависимые гистондезацетилазы класса III, которые регулируют различные биологические механизмы, такие как долголетие, геномная стабильность и воспаление. Модуляция активности сиртуинов была подчеркнута как перспективный подход к регрессу нейродегенеративных процессов.
В последнее время повышенный уровень метаболических факторов, включая кровяное давление, холестерин, С-реактивный белок, приводящий к СД типа 2 или ожирению, рассматривается в качестве высокого риска развития депрессивных симптомов. Повышенный уровень глюкозы и резистентность к инсулину при СД типа 2 усугубляют прогрессирующую дисфункциональность головного мозга. Гипергликемия вызывает нарушение регуляции ГГНС и моноаминергической системы. При этом отмечено, что коморбидность ожирения и депрессии – достаточно частое явление в общей популяции. Согласно ранее опубликованным доказательствам сиртуин-1 (SIRT-1) тесно связан с нейропатогенезом, вызванным СД типа 2 и ожирением. Сообщается, что сиртуин-1 играет главную роль в метаболизме глюкозы и активации клеточной сигнализации инсулина. Было продемонстрировано, что регуляция метаболизма глюкозы подавляет развитие возрастных заболеваний, таких как СД типа 2 и сердечно-сосудистые заболевания, и особенно связана с активностью AMPK (5'аденозин-монофосфат-активируемой протеинкиназы) и ассоциированным с биосинтетической активностью NAD+ сиртуином-1, а также сиртуином-6 (SIRT-6), связанным с регуляцией опосредованной инсулином клеточной сигнализации. В то же время сиртуины улучшают секрецию инсулина и гомеостаз глюкозы посредством увеличения уровней NAD+. Кроме того, в нейронах сигнализация сиртуина-1 модулирует активность активируемого пролифераторами пероксисом рецептора g коактиватора-1 (PGC-1a) и последующую митохондриальную дисфункцию. Отмечено также, что сиртуин-2 (SIRT-2) является мишенью для диабета. В целом сиртуины связаны с метаболическими заболеваниями, включая СД типа 2 и ожирение, и влияют на нейропатогенез, вызванный этими расстройствами. В совокупности сиртуины участвуют в развитии депрессивных симптомов, вызванных метаболическими заболеваниями (рис. 2). Учитывая нейропротективные эффекты, включая противовоспалительный эффект, регуляцию продукции нейротрансмиттеров и снижение синаптической дисфункции, сиртуины могут стать решающей мишенью для облегчения депрессивной симптоматики путем метаболических изменений.
Таким образом, приведенный обзор позволяет заключить, что депрессивные расстройства сопровождаются множеством дисрегуляций в биологических стресс-системах, метаболическими дисрегуляциями и клеточным старением, что указывает на повышенную аллостатическую нагрузку. В свою очередь, повышенная аллостатическая нагрузка соотносится с процессами в головном мозге, а также со множеством соматических состояний. При этом специфические процессы аллостатической нагрузки могут предоставить возможности для персонифицированных стратегий терапии депрессивных расстройств.
Сведения об авторе
Федченко Виктория Юрьевна – ст. науч. сотр. ГУ ИНПН НАМН Украины. E-mail: vfedchenko83@ukr.net
Список исп. литературыСкрыть список1. https://bmcmedicine.biomedcentral.com/articles/10.1186/1741-7015-11-129/
2. Femke L et al. Identifying Depressive Subtypes in a Large Cohort Study: Results From the Netherlands Study of Depression and Anxiety (NESDA). J Clin Psychiatry 2010; 71 (12): 1582–9.
3. http://scopeblog.stanford.edu/2016/10/04/insulin-resistance-is-key-step-toward-the-3ds-diabetes-depr...
4. Lloyd CE, Sartorius N, Cimino LC et al. The INTERPRET-DD study of diabetes and depression: a protocol. Diabetic Med 2015; 32: 925–34.
5. Rasgon NL, Kenna HA. Insulin resistance in depressive disorders and Alzheimer’s disease: revisiting the missing link hypothesis. Neurobiol Aging 2005; 1: 103–7.
6. Rasgon NL, Kenna HA, Williams KE et al. Rosiglitazone add-on in treatment of depressed patients with insulin resistance: a pilot study. Scientific World J 2010; 10: 321–8.
7. Rasgon N, Jarvik GP, Jarvik L. Affective disorders and Alzheimer disease: a missing-link hypothesis. Am J Geriatr Psychiatry 2001; 9: 444–5.
8. McEwen BS. Protective and damaging effects of stress mediators. New Engl J Med 1998; 338 (3): 171–9.
9. McEwen BS. Protective and damaging effects of stress mediators: central role of the brain. Dial. Clin Neurosci: Stress 2006; 8: 367–81.
10. McEwen BS, Gianaros PJ. Central role of the brain in stress and adaptation: Links to socioeconomic status, health, and disease. Ann NY Acad Sci 2010; 1186: 190–222.
11. McEwen BS. Stress, sex, and neural adaptation to a changing environment: mechanisms of neuronal remodeling. Ann NY Acad Sci 2010; 1204: E38–59.
12. McEwen BS, Gianaros PJ. Stress- and Allostasis-Induced Brain Plasticity. Annu Rev Med 2011; 62: 431–45.
13. McEwen BS, Eiland L, Hunter RG, Miller MM. Stress and anxiety: Structural plasticity and epigenetic regulation as a consequence of stress. Neuropharmacology 2012; 62 (1): 3–12.
14. McEwen BS, Morrison JH. The Brain on Stress: Vulnerability and Plasticity of the Prefrontal Cortex Over the Life Course. Neuron 2013; 79 (1): 16–29.
15. McEwen BS, Gray JD, Nasca C. Recognizing resilience: Learning from the effects of stress on the brain. Neurobiol Stress 2015; 1: 1–11.
16. McIntyre RS, Soczynska JK, Konarski JZ et al. Should depressive syndromes be reclassified as “metabolic syndrome type II”? Ann Clin Psychiatry 2007; 19: 257–64.
17. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4814520/
10 апреля 2018
Количество просмотров: 3819

