Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
1 National Medical Research Center for High Medical Technologies – Central Military Clinical Hospital named after A.A. Vishnevsky of the Ministry of Defense of the Russian Federation, Russian Federation, Moscow Region, Krasnogorsk, 143420, City District, Novy, 1;
2 FGBUN The Institute of State and Law of The Russian Academy of Sciences, 119019, Moscow, ul.Znamenka, 10;
3 N.I. Pirogov Russian National Research Medical University of the Ministry of Health of the Russian Federation, Russian Federation, Moscow, 117513, Ostrovityanova str., 1
Abstract
The aim of the study was to predictively evaluate the effectiveness of transcranial magnetic stimulation (TMS) in combination with virtual reality therapy (VR therapy) against the background of standard psychopharmacotherapy (PFT) in patients with adynamic depression, depending on the predominance of apathetic–adynamic, melancholy-adynamic or anxious-adynamic components of the syndrome.
Materials and methods. The comparative study involved 85 patients with adynamic depression who were randomized into four groups according to the prevailing syndrome: group 1 (n-28), group 2 (n-19), group 3 (n-14), control (n-24). The duration of therapy was 20 days, and the procedures were performed daily, with a weekend break, followed by an assessment of undesirable effects and monitoring of the patient's drinking regime.
Results. After 4 weeks. A prognostic assessment of the effectiveness of the therapy was performed. In the treatment of apathodynamic syndrome, combination therapy with TMS+BP+PFT/TMS+PFT resulted in a significantly more pronounced reduction in symptoms compared with the results obtained with the use of psychotropic drugs or BP alone (t = 3.365396, t = 3.188411). BP+PFT therapy was the most effective in the treatment of melancholic-adynamic syndrome (t = 2.739537713). In the treatment of anxiety-adynamic syndrome, the use of TMS+BP+PFT leads to a significantly more pronounced reduction in symptoms (t = 4.467914967).
Conclusion. The results of the study make it possible to predict the effectiveness of TMS therapy in combination with VR therapy/TMS in patients with depression with a predominance of different symptom complexes. The identification of endophenotypes of depression responding to TMS therapy in combination with VR therapy/TMS can become a scientific justification for a differentiated approach to comprehensive psychiatric care for patients with depression.
Keywords: VR therapy of depression, transcranial magnetic stimulation, virtual reality technologies, adynamic depression, prognosis of the effectiveness of depression therapy.
For citation: E.S. Nelyubova, A.A. Shmilovich, A.V. Kolsanov, L.A. Burygina. Clinical markers of therapeutic efficacy of transcranial magnetic stimulation and virtual reality technology in patients with adynamic depression. Psychiatry and psychopharmacotherapy. 2025; 3: 32–38. DOI: 10.62202/2075-1761-2025-27-3-32-38
Депрессия является одним из наиболее распространенных психических расстройств и второй по значимости причиной инвалидности в мире [19, 23]. В настоящее время разработке методов диагностики и лечения депрессивного расстройства сильно препятствует их этиологическая и фенотипическая гетерогенность [15, 16]. Традиционные подходы были сосредоточены на изучении подтипов, основанных на синдромах, которые группировали пациентов на основе сочетаний основных и дополнительных симптомов [2, 6, 10] и искали лежащие в их основе нейробиологические субстраты в качестве биомаркеров [4, 7, 9, 22, 13, 24]. Существующий алгоритмический подход к выбору психофармакотерапии не учитывает дисфункцию множественных и перекрывающихся нейробиологических процессов, каждый из которых, вероятно, требует различного лечения. Известно, что более трети пациентов с депрессивными и тревожными расстройствами не отвечают на терапию первой линии [14, 31].
В настоящее время наибольшее значение приобретают методы функциональной нейровизуализации структурно-функциональных особенностей головного мозга, позволяющих объективизировать и количественно оценить целый ряд параметров прижизненной структуры, локального кровотока и метаболизма мозга человека в норме и патологии. Позитронно-эмиссионная томография (ПЭТ) и функциональная магнитно-резонансная томография (фМРТ) в различных режимах, позволяют оценивать специфические нейробиологические основы депрессии с точки зрения функциональной интеграции [8, 33]. Подчеркивается, в частности, что применение высокоинформативных методов прижизненного изучения структуры и метаболизма мозга способствует переходу от феноменологического описания клинических проявлений депрессивных расстройств к поиску закономерностей их развития и трансформации [12, 28], а также позволяет более объективно оценивать динамику психического состояния больных в процессе лечения [26, 29].
Характеристики интегративности мозга включают структурную связь, функциональную связь и эффективную связь. По большей части анализ структурной связности основывается на таких методах, как диффузионная магнитно-резонансная томография (дМРТ) и трактография, которые сообщают о целостности путей волокон белого вещества. Функциональная связь, визуализируемая функциональной магнитно-резонансной томографией (фМРТ), относится к ненаправленной нейрональной активности двух областей мозга, в то время как эффективная относится к направленным и, в норме, взаимным причинным влияниям между областями мозга, образующими нейрональную сеть [27]. Эффективная связь определяется как влияние, которое одна нейронная система оказывает на другую.
Нейрональные сети можно охарактеризовать как набор мозговых регионов (узлов) и связей (контуров), возникающие в момент выполнения определенных задач и образующие так называемые функциональные модули [26]. Нейрональные сети обладают такими свойствами, как сила функциональной связности или коннективность (гипер- или гипосвязанность) (FC) и активности контуров (гипер- или гипоактивность) [25].
Впервые в 1973 году в монографии «Основы нейропсихологии» отечественный нейрофизиолог А.Р. Лурия [3] изложил концепцию о структурно-функциональных блоках мозга (ФБМ) как нейродинамических параметрах психической активности, модальности форм психического отражения действительности («модус операнди») и их произвольной регуляции. Нейрофункциональные нарушения при депрессии могут быть связаны с нарушением функции энергетического блока, блока приема, переработки и хранения информации головного мозга и/или блока программирования, регуляции и контроля за протеканием деятельности головного мозга, соотношение которых при различных формах эмоциональных расстройств различается.
T. Paus и соавторы в своем исследовании говорят о модуляции кортико-кортикальной связи в определенных нейронных цепях или сетях, которая может лежать в основе некоторых поведенческих эффектов, наблюдаемых после повторяющейся транскраниальной магнитной стимуляции (rTMS) лобной коры головного мозга человека [30].
Современные зарубежные исследователи при депрессиях наблюдают нарушение функциональной связности между различными регионами головного мозга, говоря о функциональной нарушенной коннективности «functional disconnectivity» [11, 18].
Расстройства аффективного спектра, такие как депрессия, адинамия, ангедония и тревога, ассоциированы со специфическими и крупномасштабными аномалиями функциональной связности (FC) в сетях мозга [32]. В число основных регионов, входящих в состав нейрональных сетей, изменение активности которых ассоциировано с развитием депрессии, входят аффективная сеть (AN), сеть вознаграждения (RN), сеть по умолчанию (DMN), центральная исполнительная сеть (CEN).
Отечественные авторы объединяют аффективную сеть и сеть вознаграждения под общим названием сеть салиентности (SN), говоря о тройной сетевой модели [1].
Известно, что нейрофизиологическими коррелятами депрессий являются гипофункциональность сети по умолчанию DMN и гиперфункциональность или гиперактивность сети салиентности SN. Специфическим нейрофизиологическим маркером при депрессивных расстройствах является снижение сегрегации регуляторных функций сети по умолчанию и исполнительной сети (фронтопариетальной и салиенс) [27]. Ряд авторов определяют это как конвергентный дефицит в топологической организации мозга в целом и сети по умолчанию, лимбической сети при униполярных и биполярных депрессиях 2 типа [17].
Впервые Drysdale et al. (2016) выявили корреляции между клиническими симптомами и изменениями функциональной коннективности в покое [17]. Пациенты с депрессией могут быть разделены на 4 нейрофизиологических биотипа в зависимости от преобладающего паттерна дисфункциональной связности. Эти биотипы не могут быть соотнесены с известными клиническими синдромами, но имеют соотношение с различными клинико-симптоматическими профилями. Выделено общее нейроанатомическое ядро патологии, лежащее в основе всех четырех биотипов и охватывающее области островка, орбитофронтальной коры, вентромедиальной префронтальной коры и множественные подкорковые области, что коррелирует с такими клиническими симптомами, как гипотимия («чувство печали, безнадежности, беспомощности», 97,1%), ангедония (96,7%) и анергия или адинамия (93,9%). То есть можно предположить существование трансдиагностического фенотипа, лежащего в основе каждого депрессивного синдрома с преобладанием апато-адинамических признаков.
У разных пациентов, независимо от биотипа, аномальная связь в этом общем нейроанатомическом ядре коррелирует с тяжестью этих трех симптомов. Наложенные на это общее патологическое ядро различные паттерны аномальной функциональной связности дифференцировали четыре биотипа и были связаны со специфическими профилями клинических симптомов. Сниженная связность в сетях лобно-миндалевидного тела, которые регулируют поведение, связанное со страхом, и переоценку негативных эмоциональных реакций, была наиболее выраженной в биотипах 1 и 4, которые характеризовались повышенной тревожностью. Напротив, гиперсвязанность в таламических и фронтостриатальных сетях, которые поддерживают систему вознаграждения, адаптивный моторный контроль и инициацию действий, была особенно выражена в биотипах 3 и 4 и была связана с повышенной ангедонией и идеомоторным торможением. Снижение связности в передней поясной и орбитофронтальной областях, поддерживающих мотивацию и оценку значимости стимула, было наиболее серьезным в биотипах 1 и 2, которые характеризовались повышенной анергией, адинамией.
Два из указанных биотипов являются прогностическим биомаркером эффективности ТМС на дорсомедиальную префронтальную кору (область активности сети по умолчанию DMN). Терапевтический ответ на ТМС у пациентов, имеющих первый и третий биотипы, составил 82,5% и 61% соответственно, в то время как у лиц со вторым и четвертым биотипами – 25% и 29,6%. Нейровизуализационные исследования выявляют базовую связь дорсолатеральной префронтальной коры (DLPFC) с субгенуальной передней поясной корой (sgACC) в механизмах клинического действия ТМС [20]. Антидепрессивный эффект ТМС обусловлен подавлением гиперактивности sgACC через стимуляцию DLPFC, что может играть значимую роль в прогнозировании ответа на терапию и определении биомаркеров депрессии [21, 35].
В эмпирическом исследовании Tozzi et al. (2024) проводилась оценка данных нейровизуализации не только в состоянии покоя, но и при выполнении когнитивных тестов и предъявлении эмоциональных стимулов [34]. Это позволило выделить шесть биотипов депрессии и тревоги, каждый из которых характеризовался специфической дисфункцией нескольких нейронных сетей, характерным профилем симптомов, поведенческими реакциями и клиническим ответом на различную психофармакотерапию и поведенческую психотерапию. Что, с одной стороны, дает возможность говорить о гетерогенности аффективных расстройств, а с другой – об уникальном трансдиагностическом клиническом фенотипе. Биотип DC+SC+AC+, характеризующийся гиперсвязностью сети по умолчанию (DMN) и сети салиентности SN, наименьшим количеством ошибок при выполнении когнитивных задач, лучшим ответом на поведенческую психотерапию. С другой стороны, биотип АС-, характеризующийся гипоконнективностью сети внимания, имел худшую реакцию на поведенческие интервенции. Наконец, биотип CA+, характеризующийся гиперактивностью цепи когнитивного управления (DMN) и гипоактивностью исполнительной цепи (CEN), коррелировал с выраженной ангедонией в сочетании с тревогой и имел лучший ответ на венлафаксин.
Несмотря на внедрение инновационных методов исследования, сохраняется дефицит в определении биомаркеров депрессии и тревоги клинического, нейрофизиологического, нейробиологического уровня, которые позволили бы обеспечить возможность персонализированного подхода к терапии.
Целью настоящего исследования является прогностическая оценка эффективности ТМС в сочетании с ВР-терапией у пациентов с депрессией с разными симптомокомплексами.
Критерии включения пациентов в исследование – возраст от 18 до 65 лет; наличие депрессивного состояния с преобладанием адинамического компонента, формирующегося в клиническом пространстве расстройств, удовлетворяющих диагностическим критериям следующих рубрик МКБ-10 – рекуррентное депрессивное расстройство (F33), депрессивный эпизод (F32), биполярное аффективное расстройство (F31); умеренная или тяжелая степень глубины депрессии (от 14 до 36 баллов по шкале Гамильтона), обуславливающая необходимость госпитализации.
Критерии исключения – возраст до 18 и старше 65 лет, психотические расстройства галлюцинаторно-бредового или кататонического регистров на момент исследования; расстройства шизофренического спектра; иные эндогенные депрессии (тревожные, бредовые, ипохондрические, ажитированные и другие); суицидальные тенденции; ситуационно-средовое (психогенное) происхождение аффективных расстройств; депрессии при расстройствах личности; депрессии органического происхождения; а также адинамические расстройства, не обнаружившие клинической связи с депрессивным состоянием.
Исследование соответствовало всем параметрам Хельсинской декларации по этике и было одобрено локальным Этическим комитетом.
В соответствии с задачами исследования выборка была разделена на сопоставимые по демографическим и клиническим параметрам группы. Группу 1 (37 пациентов) составили пациенты с апато-адинамическим синдромом, разделенные случайным методом на 3 подгруппы: 1) получавшие стандартную медикаментозную терапию и лечение ТМС (iTBS+ПФТ); 2) получавшие стандартную медикаментозную терапию и лечение с использованием технологии виртуальной реальности (ВР+ПФТ); 3) получавшие сочетанную терапию с использованием технологий виртуальной реальности, ТМС и психофармакотерапию (iTBS+ВР+ПФТ). Группу 2 (26 пациентов) составили пациенты с тоскливо-адинамическим синдромом, разделенные на те же три терапевтические подгруппы. Группу 3 (22 пациента) составили пациенты с тревожно-адинамическим синдромом, также случайным образом разделенные на те же три терапевтические подгруппы. Контрольная группа (24 пациента) была представлена пациентами с различными клиническими вариантами адинамических депрессий, получавшими только медикаментозную терапию психотропными средствами в соответствии со стандартами оказания медицинской помощи (ПФТ).
На этапе включения в исследование с 1-го по 3-й день госпитализации (визит 1) проводились клиническая и психометрическая оценка психического состояния и сбор анамнеза.
На 4-5-й день госпитализации (визит 2) проводилось распределение пациентов в группы сравнения по синдромальному принципу с последующей рандомизацией в терапевтические подгруппы. Все пациенты получали психофармакотерпию в соответствии со стандартами оказания медицинской помощи. С данного визита в течение 28 дней пациентам трем клинических групп сравнения дополнительно проводилось лечение с использованием технологий ВР и/или лечение с использованием iTBS.
Лечение с использованием технологий ВР и/или с применением iTBS проводилось непосредственно лечащим врачом-психиатром. Процедуры проводили с информированного добровольного согласия пациентов и после оценки противопоказаний с помощью Скринингового опросника. Все процедуры проводились в кабинете реабилитации, оборудованном средствами оказания первой медицинской помощи. Процедура iTBS проводилась магнитным стимулятором MagPro R30. Параметры стимуляции определялись протоколом Theta Burst стимуляции, в котором 1 стимул состоит из 3 импульсов, интервал между которыми 20 мс (т.е. частота 50 Гц), пачка из 10 таких стимулов с частотой 10 Гц повторялась 20 раз с интервалом 8 с. Общее количество тета-стимулов 200. Длительность терапии составляла 20 дней, процедуры проводились ежедневно, с перерывом на выходные дни, с продолжительностью каждого сеанса 4 мин, с последующей оценкой нежелательных эффектов и контролем над соблюдением питьевого режима пациентом.
Воздействие с использованием технологий ВР осуществлялось на мультисенсорном нейротренажере пассивной реабилитации. Длительность терапии составляла 20 дней, сессии проводились ежедневно, с перерывом на выходные дни, с продолжительностью каждого сеанса в 15 мин, с последующей оценкой нежелательных эффектов.
В период с 30-го по 35-й день от момента поступления в стационар (визит 3) проводилась оценка эффективности лечения по клиническим показателям и психометрическим шкалам.
Для катамнестической оценки психического состояния пациентов применялись психометрические методы с использованием шкалы Гамильтона для оценки депрессии (Hamilton psychiatric rating scale for depression, HDRS), шкалы оценки ангедонии Снайта-Гамильтона (Snaith-Hamilton Pleasure Scale, SHAPS), шкалы депрессии Бека (Beck Depression Inventory, BDI), шкалы поведенческой активации при депрессии (Behavioral Activation for Depression Scale (BADS), шкалы общего клинического впечатления (Clinical global impression scale, CGI: динамики заболевания CGI-I и его тяжести CGI-S).
Статистическую обработку клинического материала проводили с использованием программного пакета Microsoft Excel 2013, статистических программ IBM SPSS Statistics версии 23.0. В качестве статистических параметров использовались средняя арифметическая и стандартная ошибка средней (M±m); статистическая вероятность события – частота события в процентах (P(А) = n(A) / n х 100%, где n(A) – число наблюдений с отличительным признаком А, n – общее число наблюдений. Достоверность различий оценивали по коэффициенту достоверности значений (t-критерию) по формуле Стьюдента. При достаточном числе наблюдений, значение t = 2 и более свидетельствовало о достоверности различий двух величин с вероятностью 95% и выше (уровень достоверности p<0,05), а при t-Стьюдента менее 2 – различия считали случайными, недоказанными.
Оценка степени тяжести депрессии по критериями МКБ-10 показала следующее распределение – 64 пациента (75%) страдали депрессией средней степени тяжести, у 21 (25%) пациента диагностировали тяжелую депрессию.
После рандомизации пациентов в терапевтические подгруппы оказалось, что соотношение долей представленности депрессий с различным длинником заболевания и тяжести текущей депрессии было сопоставимым.
Распределение больных по диагностическим рубрикам представлено следующим образом: 30 больных (35,3%) – биполярное аффективное расстройство (БАР) (F31.3-4); 12 больных (14,1%) – депрессивный эпизод (ДЭ) (F32.1-2); 43 пациента (50,6%) – рекуррентное депрессивное расстройство (РДР) (F33.1-2).
Клиническая структура депрессий (табл. 1) характеризовалась апато-адинамической симптоматикой – 37 пациентов (43,5%), тоскливо-адинамической – 26 пациентов (30,6%), тревожно-адинамической – 22 пациента (25,9%). Причем апато-адинамические нарушения преобладали в структуре БАР, а тоскливо-адинамические – в рамках РДР.
На этапе включения в исследование пациенты всех групп находились в депрессивном состоянии умеренной или тяжелой степени тяжести. Различия между группами сравнения по степени тяжести депрессии статистически не были достоверны (p>0,05) как по шкале HDRS, так и по другим психометрическим шкалам.
Результаты лечения в группе сравнения 1 – депрессии с преобладанием апато-адинамического синдрома.
Сопоставление результатов лечения больных апато-адинамическими депрессиями в основной и контрольной группах по шкале CGI-S (табл. 2) показало большую эффективность комбинированной терапии iTBS+ВР+ПФТ и iTBS+ПФТ с высокой статистической достоверностью (t = 3,674387, t = 4,824182 соответственно) и отсутствие различий в эффективности между группами ВР+ПФТ и контроля (ПФТ) (t = 0,235519).
Сопоставление результатов лечения группы iTBS+ВР+ПФТ и ВР+ПФТ по шкале CGI-S и CGI-I (табл. 2) показало большую эффективность комбинированной терапии iTBS+ВР+ПФТ с высокой статистической достоверностью (t = 3,365396, t = 3,188411 соответственно).
Сопоставление результатов лечения группы iTBS+ПФТ и ВР+ПФТ по шкале CGI-S и CGI-I (табл. 2) показало большую эффективность терапии iTBS+ПФТ с высокой статистической достоверностью (t = 4,374788, t = 2,557261 соответственно).
При практически равной интенсивности активной симптоматики у пациентов с апато-адинамическими депрессиями на 1 визите, на последующих визитах было отчетливо видно, что комбинированная терапия iTBS+ВР+ПФТ позволяла добиться большего клинического эффекта по всему профилю симптомов: степень выраженности редукции патологических симптомов у пациентов данной группы в 2 и более раз превышала таковую у пациентов группы ВР+ПФТ по шкале CGI-I; в 1,8 раза – по шкале CGI-S; сочетанная терапия iTBS+ПФТ позволила добиться большего клинического эффекта: степень выраженности редукции патологических симптомов у пациентов данной группы в 1,7 раза превышала таковую у пациентов группы ВР+ПФТ по шкале CGI-I; в 1,9 раза – по шкале CGI-S.
Результаты лечения в группе сравнения 2 – депрессии с преобладанием тоскливо-адинамического синдрома.
Сопоставление результатов лечения больных тоскливо-адинамическими депрессиями в основной и контрольной группах по шкале CGI-S (табл. 3) показало большую эффективность комбинированной терапии iTBS+ВР+ПФТ, iTBS+ПФТ и ВР+ПФТ с высокой статистической достоверностью (t = 2,648103, t = 2,321219, t = 3,133398 соответственно) и по шкале CGI-I (t = 3,880335, t = 2,462051, t = 3,535534 соответственно), чем в контрольной группе (ПФТ).
Сопоставление результатов лечения группы iTBS+ПФТ и ВР+ПФТ по шкале BDI (табл. 3) показало большую эффективность терапии ВР+ПФТ с высокой статистической достоверностью (t = 2,739537713).
При практически равной интенсивности активной симптоматики у пациентов с преобладанием тоскливо-адинамического синдрома на 1 визите, в дальнейшем группа сочетанной терапии ВР+ПФТ позволила добиться большего клинического эффекта: степень выраженности редукции патологических симптомов у пациентов данной группы в 2 раза превышала таковую у пациентов группы iTBS +ПФТ по шкале BDI.
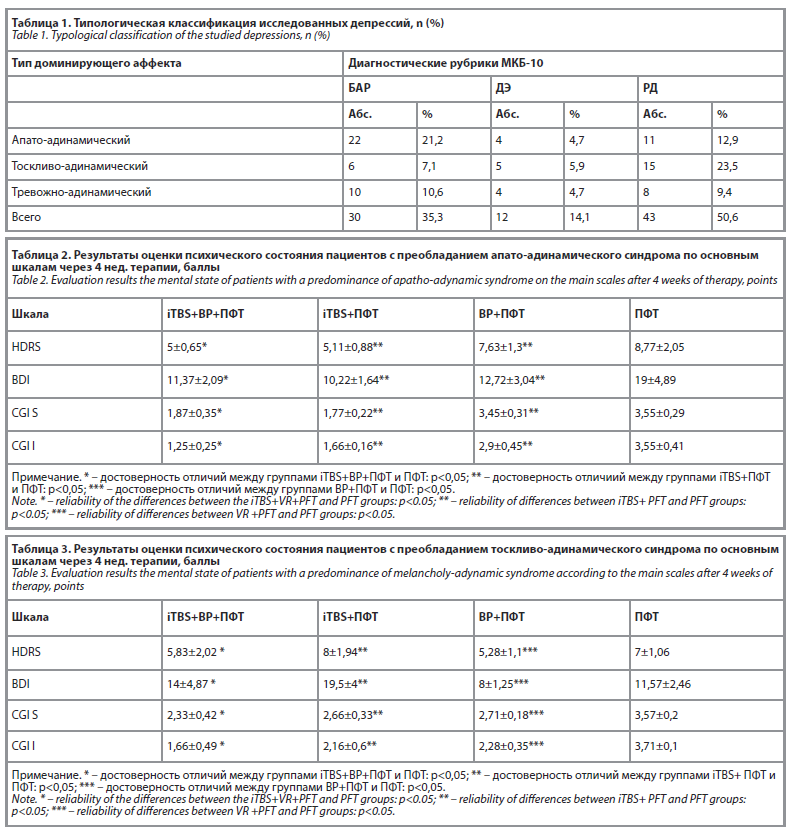
Результаты лечения в группе сравнения 3 – депрессии с преобладанием тревожно-адинамического синдрома.
Сопоставление результатов лечения больных тревожно-адинамическими депрессиями в основной и контрольной группах по шкале CGI-S (табл. 4) показало большую эффективность комбинированной терапии iTBS+ВР+ПФТ, iTBS+ПФТ и ВР+ПФТ с высокой статистической достоверностью (t = 3,972602, t = 4,936952, t = 5,351296 соответственно), и по шкале CGI-I (t = 5,908062, t = 8,774964, t = 5,405248 соответственно), чем в контрольной группе (ПФТ).
Сопоставление результатов лечения группы iTBS+ВР+ПФТ и ВР+ПФТ по шкале HDRS (табл. 4) показало большую эффективность комбинированной терапии iTBS+ВР+ПФТ с высокой статистической достоверностью (t = 4,467914967).
Сопоставление результатов лечения группы iTBS+ПФТ и ВР+ПФТ по шкале CGI-I (табл. 4) показало большую эффективность терапии iTBS+ПФТ с высокой статистической достоверностью (t = 2,44949).
При практически равной интенсивности активной симптоматики у пациентов с преобладанием тревожно-адинамического синдрома на 1 визите, в дальнейшем комбинированная терапия iTBS+ВР+ПФТ и iTBS+ПФТ позволила добиться большего клинического эффекта: степень выраженности редукции патологических симптомов у пациентов данных групп в 2,5 раза превышала таковую у пациентов группы ВР+ПФТ по шкале HDRS, а по шкале CGI-I – в 1,6 раза.

Комплексное лечение тоскливо-адинамического синдрома в структуре РДР, ДЭ и БАР с применением ПФТ и ВР приводит к достоверно более выраженной редукции симптоматики по сравнению с результатами, полученными при использовании только ПФТ, в том числе в комбинации с ТМС.
Комплексное лечение тревожно-адинамического синдрома в структуре РДР, ДЭ и БАР с сочетанным использованием ПФТ, ТМС и ВР приводит к достоверно наиболее выраженной редукции симптоматики по сравнению с результатами, полученными при использовании только ПФТ, в том числе в комбинации с ВР, что соотносится с результатами зарубежных исследователей.
Выявленные корреляции между специфическими депрессивно-адинамическими симптомокомплексами или эндофенотипами и их ответами на нейромодулирующую терапию могут являться прогностическими критериями эффективности.
Результаты исследования позволяют прогнозировать высокую эффективность терапии ТМС в сочетании с ВР-терапией у пациентов с апато-адинамическими и тревожно-адинамическими депрессиями, тогда как при тоскливо-адинамическом эндофенотипе депрессии, вопреки ожиданиям, терапевтический прогноз лучше при ВР-нейромодуляции, чем при использовании ТМС.
Выявленные в настоящем исследовании эндофенотипы депрессий, реагирующие не одинаково на различные комбинации ПФТ, ТМС и ВР, можно использовать в качестве клинического маркера терапевтического ответа на разные методы нейромодуляции.
Информация об авторах:
Нелюбова Е.С. – https://orcid.org/0009-0001-0907-0318
Шмилович А.А. – https://orcid.org/0000-0002-1060-5076
Колсанов А.В. – https://orcid.org/0000-0002-4144-7090
Бурыгина Л.А. – https://orcid.org/0000-0002-7183-1536
Автор, ответственный за переписку: Нелюбова Е.С. e-mail: e.s.nelyubova@mail.ru
Nelyubova E.S. – https://orcid.org/0009-0001-0907-0318
A.A. Shmilovich – https://orcid.org/0000-0002-1060-5076
Kolsanov A.V. – https://orcid.org/0000-0002-4144-7090
Burygina L.A. – https://orcid.org/0000-0002-7183-1536
The author responsible for the correspondence: Nelyubova E.S. e-mail: e.s.nelyubova@mail.ru
Дата поступления: 05.05.2025
Received: 05.05.2025
Принята к печати: 02.06.2025
Accepted: 02.06.2025
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03 2025
Клинические маркеры терапевтической эффективности транскраниальной магнитной стимуляции и технологии виртуальной реальности у пациентов с адинамической депрессией №03 2025
Номера страниц в выпуске:32-38
Резюме
Цель исследования – прогностическая оценка эффективности транскраниальной магнитной стимуляции (ТМС) в сочетании с терапией виртуальной реальностью (ВР-терапией) на фоне стандартной психофармакотерапии (ПФТ) у пациентов с адинамической депрессией в зависимости от преобладания апато-адинамического, тоскливо-адинамического или тревожно-адинамического компонентов синдрома.
Материал и методы. В сравнительном исследовании приняли участие 85 пациентов с адинамическими депрессиями, которые были рандомизированы в четыре группы в соответствии с преобладающим синдромом: группа 1 (n-28), группа 2 (n-19), группа 3 (n-14), контрольная (n-24). Длительность терапии составляла 20 дней, процедуры проводились ежедневно, с перерывом на выходные дни с последующей оценкой нежелательных эффектов и контролем над соблюдением питьевого режима пациентом.
Результаты. Через 4 нед. терапии была выполнена прогностическая оценка показателей эффективности. При лечении апато-адинамического синдрома комбинированная терапия ТМС+ВР+ПФТ/ТМС+ПФТ приводила к достоверно более выраженной редукции симптоматики по сравнению с результатами, полученными при использовании только психотропных лекарственных средств или ВР (t = 3,365396, t = 3,188411). В лечении тоскливо-адинамического синдрома наиболее эффективной была терапия ВР+ПФТ (t = 2,739537713). При лечении тревожно-адинамического синдрома применение ТМС+ВР+ПФТ приводит к достоверно наиболее выраженной редукции симптоматики (t = 4,467914967).
Заключение. Полученные результаты исследования позволяют прогнозировать эффективность терапии ТМС в сочетании с ВР-терапией/ТМС у пациентов с депрессией с преобладанием разных симптомокомплексов. Выявление эндофенотипов депрессий, реагирующих на терапию ТМС в сочетании с ВР-терапией/ТМС, может стать научным обоснованием к дифференцированному подходу к комплексной психиатрической помощи больным с депрессиями.
Ключевые слова: ВР-терапия депрессии, транскраниальная магнитная стимуляция, технологии виртуальной реальности, адинамическая депрессия, прогноз эффективности терапии депрессий.
Для цитирования: Е.С. Нелюбова, А.А. Шмилович, А.В. Колсанов, Л.А. Бурыгина. Клинические маркеры терапевтической эффективности транскраниальной магнитной стимуляции и технологии виртуальной реальности у пациентов с адинамической депрессией. Психиатрия и психофармакотерапия. 2025; 3: 32–38. DOI: 10.62202/2075-1761-2025-27-3-32-38
Цель исследования – прогностическая оценка эффективности транскраниальной магнитной стимуляции (ТМС) в сочетании с терапией виртуальной реальностью (ВР-терапией) на фоне стандартной психофармакотерапии (ПФТ) у пациентов с адинамической депрессией в зависимости от преобладания апато-адинамического, тоскливо-адинамического или тревожно-адинамического компонентов синдрома.
Материал и методы. В сравнительном исследовании приняли участие 85 пациентов с адинамическими депрессиями, которые были рандомизированы в четыре группы в соответствии с преобладающим синдромом: группа 1 (n-28), группа 2 (n-19), группа 3 (n-14), контрольная (n-24). Длительность терапии составляла 20 дней, процедуры проводились ежедневно, с перерывом на выходные дни с последующей оценкой нежелательных эффектов и контролем над соблюдением питьевого режима пациентом.
Результаты. Через 4 нед. терапии была выполнена прогностическая оценка показателей эффективности. При лечении апато-адинамического синдрома комбинированная терапия ТМС+ВР+ПФТ/ТМС+ПФТ приводила к достоверно более выраженной редукции симптоматики по сравнению с результатами, полученными при использовании только психотропных лекарственных средств или ВР (t = 3,365396, t = 3,188411). В лечении тоскливо-адинамического синдрома наиболее эффективной была терапия ВР+ПФТ (t = 2,739537713). При лечении тревожно-адинамического синдрома применение ТМС+ВР+ПФТ приводит к достоверно наиболее выраженной редукции симптоматики (t = 4,467914967).
Заключение. Полученные результаты исследования позволяют прогнозировать эффективность терапии ТМС в сочетании с ВР-терапией/ТМС у пациентов с депрессией с преобладанием разных симптомокомплексов. Выявление эндофенотипов депрессий, реагирующих на терапию ТМС в сочетании с ВР-терапией/ТМС, может стать научным обоснованием к дифференцированному подходу к комплексной психиатрической помощи больным с депрессиями.
Ключевые слова: ВР-терапия депрессии, транскраниальная магнитная стимуляция, технологии виртуальной реальности, адинамическая депрессия, прогноз эффективности терапии депрессий.
Для цитирования: Е.С. Нелюбова, А.А. Шмилович, А.В. Колсанов, Л.А. Бурыгина. Клинические маркеры терапевтической эффективности транскраниальной магнитной стимуляции и технологии виртуальной реальности у пациентов с адинамической депрессией. Психиатрия и психофармакотерапия. 2025; 3: 32–38. DOI: 10.62202/2075-1761-2025-27-3-32-38
Clinical markers of therapeutic efficacy of transcranial magnetic stimulation and virtual reality technology in patients with adynamic depression
E.S. Nelyubova1,2, A.A. Shmilovich1, A.V. Kolsanov3, L.A. Burygina21 National Medical Research Center for High Medical Technologies – Central Military Clinical Hospital named after A.A. Vishnevsky of the Ministry of Defense of the Russian Federation, Russian Federation, Moscow Region, Krasnogorsk, 143420, City District, Novy, 1;
2 FGBUN The Institute of State and Law of The Russian Academy of Sciences, 119019, Moscow, ul.Znamenka, 10;
3 N.I. Pirogov Russian National Research Medical University of the Ministry of Health of the Russian Federation, Russian Federation, Moscow, 117513, Ostrovityanova str., 1
Abstract
The aim of the study was to predictively evaluate the effectiveness of transcranial magnetic stimulation (TMS) in combination with virtual reality therapy (VR therapy) against the background of standard psychopharmacotherapy (PFT) in patients with adynamic depression, depending on the predominance of apathetic–adynamic, melancholy-adynamic or anxious-adynamic components of the syndrome.
Materials and methods. The comparative study involved 85 patients with adynamic depression who were randomized into four groups according to the prevailing syndrome: group 1 (n-28), group 2 (n-19), group 3 (n-14), control (n-24). The duration of therapy was 20 days, and the procedures were performed daily, with a weekend break, followed by an assessment of undesirable effects and monitoring of the patient's drinking regime.
Results. After 4 weeks. A prognostic assessment of the effectiveness of the therapy was performed. In the treatment of apathodynamic syndrome, combination therapy with TMS+BP+PFT/TMS+PFT resulted in a significantly more pronounced reduction in symptoms compared with the results obtained with the use of psychotropic drugs or BP alone (t = 3.365396, t = 3.188411). BP+PFT therapy was the most effective in the treatment of melancholic-adynamic syndrome (t = 2.739537713). In the treatment of anxiety-adynamic syndrome, the use of TMS+BP+PFT leads to a significantly more pronounced reduction in symptoms (t = 4.467914967).
Conclusion. The results of the study make it possible to predict the effectiveness of TMS therapy in combination with VR therapy/TMS in patients with depression with a predominance of different symptom complexes. The identification of endophenotypes of depression responding to TMS therapy in combination with VR therapy/TMS can become a scientific justification for a differentiated approach to comprehensive psychiatric care for patients with depression.
Keywords: VR therapy of depression, transcranial magnetic stimulation, virtual reality technologies, adynamic depression, prognosis of the effectiveness of depression therapy.
For citation: E.S. Nelyubova, A.A. Shmilovich, A.V. Kolsanov, L.A. Burygina. Clinical markers of therapeutic efficacy of transcranial magnetic stimulation and virtual reality technology in patients with adynamic depression. Psychiatry and psychopharmacotherapy. 2025; 3: 32–38. DOI: 10.62202/2075-1761-2025-27-3-32-38
Депрессия является одним из наиболее распространенных психических расстройств и второй по значимости причиной инвалидности в мире [19, 23]. В настоящее время разработке методов диагностики и лечения депрессивного расстройства сильно препятствует их этиологическая и фенотипическая гетерогенность [15, 16]. Традиционные подходы были сосредоточены на изучении подтипов, основанных на синдромах, которые группировали пациентов на основе сочетаний основных и дополнительных симптомов [2, 6, 10] и искали лежащие в их основе нейробиологические субстраты в качестве биомаркеров [4, 7, 9, 22, 13, 24]. Существующий алгоритмический подход к выбору психофармакотерапии не учитывает дисфункцию множественных и перекрывающихся нейробиологических процессов, каждый из которых, вероятно, требует различного лечения. Известно, что более трети пациентов с депрессивными и тревожными расстройствами не отвечают на терапию первой линии [14, 31].
В настоящее время наибольшее значение приобретают методы функциональной нейровизуализации структурно-функциональных особенностей головного мозга, позволяющих объективизировать и количественно оценить целый ряд параметров прижизненной структуры, локального кровотока и метаболизма мозга человека в норме и патологии. Позитронно-эмиссионная томография (ПЭТ) и функциональная магнитно-резонансная томография (фМРТ) в различных режимах, позволяют оценивать специфические нейробиологические основы депрессии с точки зрения функциональной интеграции [8, 33]. Подчеркивается, в частности, что применение высокоинформативных методов прижизненного изучения структуры и метаболизма мозга способствует переходу от феноменологического описания клинических проявлений депрессивных расстройств к поиску закономерностей их развития и трансформации [12, 28], а также позволяет более объективно оценивать динамику психического состояния больных в процессе лечения [26, 29].
Характеристики интегративности мозга включают структурную связь, функциональную связь и эффективную связь. По большей части анализ структурной связности основывается на таких методах, как диффузионная магнитно-резонансная томография (дМРТ) и трактография, которые сообщают о целостности путей волокон белого вещества. Функциональная связь, визуализируемая функциональной магнитно-резонансной томографией (фМРТ), относится к ненаправленной нейрональной активности двух областей мозга, в то время как эффективная относится к направленным и, в норме, взаимным причинным влияниям между областями мозга, образующими нейрональную сеть [27]. Эффективная связь определяется как влияние, которое одна нейронная система оказывает на другую.
Нейрональные сети можно охарактеризовать как набор мозговых регионов (узлов) и связей (контуров), возникающие в момент выполнения определенных задач и образующие так называемые функциональные модули [26]. Нейрональные сети обладают такими свойствами, как сила функциональной связности или коннективность (гипер- или гипосвязанность) (FC) и активности контуров (гипер- или гипоактивность) [25].
Впервые в 1973 году в монографии «Основы нейропсихологии» отечественный нейрофизиолог А.Р. Лурия [3] изложил концепцию о структурно-функциональных блоках мозга (ФБМ) как нейродинамических параметрах психической активности, модальности форм психического отражения действительности («модус операнди») и их произвольной регуляции. Нейрофункциональные нарушения при депрессии могут быть связаны с нарушением функции энергетического блока, блока приема, переработки и хранения информации головного мозга и/или блока программирования, регуляции и контроля за протеканием деятельности головного мозга, соотношение которых при различных формах эмоциональных расстройств различается.
T. Paus и соавторы в своем исследовании говорят о модуляции кортико-кортикальной связи в определенных нейронных цепях или сетях, которая может лежать в основе некоторых поведенческих эффектов, наблюдаемых после повторяющейся транскраниальной магнитной стимуляции (rTMS) лобной коры головного мозга человека [30].
Современные зарубежные исследователи при депрессиях наблюдают нарушение функциональной связности между различными регионами головного мозга, говоря о функциональной нарушенной коннективности «functional disconnectivity» [11, 18].
Расстройства аффективного спектра, такие как депрессия, адинамия, ангедония и тревога, ассоциированы со специфическими и крупномасштабными аномалиями функциональной связности (FC) в сетях мозга [32]. В число основных регионов, входящих в состав нейрональных сетей, изменение активности которых ассоциировано с развитием депрессии, входят аффективная сеть (AN), сеть вознаграждения (RN), сеть по умолчанию (DMN), центральная исполнительная сеть (CEN).
Отечественные авторы объединяют аффективную сеть и сеть вознаграждения под общим названием сеть салиентности (SN), говоря о тройной сетевой модели [1].
Известно, что нейрофизиологическими коррелятами депрессий являются гипофункциональность сети по умолчанию DMN и гиперфункциональность или гиперактивность сети салиентности SN. Специфическим нейрофизиологическим маркером при депрессивных расстройствах является снижение сегрегации регуляторных функций сети по умолчанию и исполнительной сети (фронтопариетальной и салиенс) [27]. Ряд авторов определяют это как конвергентный дефицит в топологической организации мозга в целом и сети по умолчанию, лимбической сети при униполярных и биполярных депрессиях 2 типа [17].
Впервые Drysdale et al. (2016) выявили корреляции между клиническими симптомами и изменениями функциональной коннективности в покое [17]. Пациенты с депрессией могут быть разделены на 4 нейрофизиологических биотипа в зависимости от преобладающего паттерна дисфункциональной связности. Эти биотипы не могут быть соотнесены с известными клиническими синдромами, но имеют соотношение с различными клинико-симптоматическими профилями. Выделено общее нейроанатомическое ядро патологии, лежащее в основе всех четырех биотипов и охватывающее области островка, орбитофронтальной коры, вентромедиальной префронтальной коры и множественные подкорковые области, что коррелирует с такими клиническими симптомами, как гипотимия («чувство печали, безнадежности, беспомощности», 97,1%), ангедония (96,7%) и анергия или адинамия (93,9%). То есть можно предположить существование трансдиагностического фенотипа, лежащего в основе каждого депрессивного синдрома с преобладанием апато-адинамических признаков.
У разных пациентов, независимо от биотипа, аномальная связь в этом общем нейроанатомическом ядре коррелирует с тяжестью этих трех симптомов. Наложенные на это общее патологическое ядро различные паттерны аномальной функциональной связности дифференцировали четыре биотипа и были связаны со специфическими профилями клинических симптомов. Сниженная связность в сетях лобно-миндалевидного тела, которые регулируют поведение, связанное со страхом, и переоценку негативных эмоциональных реакций, была наиболее выраженной в биотипах 1 и 4, которые характеризовались повышенной тревожностью. Напротив, гиперсвязанность в таламических и фронтостриатальных сетях, которые поддерживают систему вознаграждения, адаптивный моторный контроль и инициацию действий, была особенно выражена в биотипах 3 и 4 и была связана с повышенной ангедонией и идеомоторным торможением. Снижение связности в передней поясной и орбитофронтальной областях, поддерживающих мотивацию и оценку значимости стимула, было наиболее серьезным в биотипах 1 и 2, которые характеризовались повышенной анергией, адинамией.
Два из указанных биотипов являются прогностическим биомаркером эффективности ТМС на дорсомедиальную префронтальную кору (область активности сети по умолчанию DMN). Терапевтический ответ на ТМС у пациентов, имеющих первый и третий биотипы, составил 82,5% и 61% соответственно, в то время как у лиц со вторым и четвертым биотипами – 25% и 29,6%. Нейровизуализационные исследования выявляют базовую связь дорсолатеральной префронтальной коры (DLPFC) с субгенуальной передней поясной корой (sgACC) в механизмах клинического действия ТМС [20]. Антидепрессивный эффект ТМС обусловлен подавлением гиперактивности sgACC через стимуляцию DLPFC, что может играть значимую роль в прогнозировании ответа на терапию и определении биомаркеров депрессии [21, 35].
В эмпирическом исследовании Tozzi et al. (2024) проводилась оценка данных нейровизуализации не только в состоянии покоя, но и при выполнении когнитивных тестов и предъявлении эмоциональных стимулов [34]. Это позволило выделить шесть биотипов депрессии и тревоги, каждый из которых характеризовался специфической дисфункцией нескольких нейронных сетей, характерным профилем симптомов, поведенческими реакциями и клиническим ответом на различную психофармакотерапию и поведенческую психотерапию. Что, с одной стороны, дает возможность говорить о гетерогенности аффективных расстройств, а с другой – об уникальном трансдиагностическом клиническом фенотипе. Биотип DC+SC+AC+, характеризующийся гиперсвязностью сети по умолчанию (DMN) и сети салиентности SN, наименьшим количеством ошибок при выполнении когнитивных задач, лучшим ответом на поведенческую психотерапию. С другой стороны, биотип АС-, характеризующийся гипоконнективностью сети внимания, имел худшую реакцию на поведенческие интервенции. Наконец, биотип CA+, характеризующийся гиперактивностью цепи когнитивного управления (DMN) и гипоактивностью исполнительной цепи (CEN), коррелировал с выраженной ангедонией в сочетании с тревогой и имел лучший ответ на венлафаксин.
Несмотря на внедрение инновационных методов исследования, сохраняется дефицит в определении биомаркеров депрессии и тревоги клинического, нейрофизиологического, нейробиологического уровня, которые позволили бы обеспечить возможность персонализированного подхода к терапии.
Целью настоящего исследования является прогностическая оценка эффективности ТМС в сочетании с ВР-терапией у пациентов с депрессией с разными симптомокомплексами.
Материалы и методы
Клиническую выборку составили 109 больных, находившихся на стационарном лечении в клинике аффективных и суицидальных расстройств ГБУЗ «ПКБ №4 ДЗМ» в период с сентября 2020 по сентябрь 2023 г.Критерии включения пациентов в исследование – возраст от 18 до 65 лет; наличие депрессивного состояния с преобладанием адинамического компонента, формирующегося в клиническом пространстве расстройств, удовлетворяющих диагностическим критериям следующих рубрик МКБ-10 – рекуррентное депрессивное расстройство (F33), депрессивный эпизод (F32), биполярное аффективное расстройство (F31); умеренная или тяжелая степень глубины депрессии (от 14 до 36 баллов по шкале Гамильтона), обуславливающая необходимость госпитализации.
Критерии исключения – возраст до 18 и старше 65 лет, психотические расстройства галлюцинаторно-бредового или кататонического регистров на момент исследования; расстройства шизофренического спектра; иные эндогенные депрессии (тревожные, бредовые, ипохондрические, ажитированные и другие); суицидальные тенденции; ситуационно-средовое (психогенное) происхождение аффективных расстройств; депрессии при расстройствах личности; депрессии органического происхождения; а также адинамические расстройства, не обнаружившие клинической связи с депрессивным состоянием.
Исследование соответствовало всем параметрам Хельсинской декларации по этике и было одобрено локальным Этическим комитетом.
В соответствии с задачами исследования выборка была разделена на сопоставимые по демографическим и клиническим параметрам группы. Группу 1 (37 пациентов) составили пациенты с апато-адинамическим синдромом, разделенные случайным методом на 3 подгруппы: 1) получавшие стандартную медикаментозную терапию и лечение ТМС (iTBS+ПФТ); 2) получавшие стандартную медикаментозную терапию и лечение с использованием технологии виртуальной реальности (ВР+ПФТ); 3) получавшие сочетанную терапию с использованием технологий виртуальной реальности, ТМС и психофармакотерапию (iTBS+ВР+ПФТ). Группу 2 (26 пациентов) составили пациенты с тоскливо-адинамическим синдромом, разделенные на те же три терапевтические подгруппы. Группу 3 (22 пациента) составили пациенты с тревожно-адинамическим синдромом, также случайным образом разделенные на те же три терапевтические подгруппы. Контрольная группа (24 пациента) была представлена пациентами с различными клиническими вариантами адинамических депрессий, получавшими только медикаментозную терапию психотропными средствами в соответствии со стандартами оказания медицинской помощи (ПФТ).
На этапе включения в исследование с 1-го по 3-й день госпитализации (визит 1) проводились клиническая и психометрическая оценка психического состояния и сбор анамнеза.
На 4-5-й день госпитализации (визит 2) проводилось распределение пациентов в группы сравнения по синдромальному принципу с последующей рандомизацией в терапевтические подгруппы. Все пациенты получали психофармакотерпию в соответствии со стандартами оказания медицинской помощи. С данного визита в течение 28 дней пациентам трем клинических групп сравнения дополнительно проводилось лечение с использованием технологий ВР и/или лечение с использованием iTBS.
Лечение с использованием технологий ВР и/или с применением iTBS проводилось непосредственно лечащим врачом-психиатром. Процедуры проводили с информированного добровольного согласия пациентов и после оценки противопоказаний с помощью Скринингового опросника. Все процедуры проводились в кабинете реабилитации, оборудованном средствами оказания первой медицинской помощи. Процедура iTBS проводилась магнитным стимулятором MagPro R30. Параметры стимуляции определялись протоколом Theta Burst стимуляции, в котором 1 стимул состоит из 3 импульсов, интервал между которыми 20 мс (т.е. частота 50 Гц), пачка из 10 таких стимулов с частотой 10 Гц повторялась 20 раз с интервалом 8 с. Общее количество тета-стимулов 200. Длительность терапии составляла 20 дней, процедуры проводились ежедневно, с перерывом на выходные дни, с продолжительностью каждого сеанса 4 мин, с последующей оценкой нежелательных эффектов и контролем над соблюдением питьевого режима пациентом.
Воздействие с использованием технологий ВР осуществлялось на мультисенсорном нейротренажере пассивной реабилитации. Длительность терапии составляла 20 дней, сессии проводились ежедневно, с перерывом на выходные дни, с продолжительностью каждого сеанса в 15 мин, с последующей оценкой нежелательных эффектов.
В период с 30-го по 35-й день от момента поступления в стационар (визит 3) проводилась оценка эффективности лечения по клиническим показателям и психометрическим шкалам.
Для катамнестической оценки психического состояния пациентов применялись психометрические методы с использованием шкалы Гамильтона для оценки депрессии (Hamilton psychiatric rating scale for depression, HDRS), шкалы оценки ангедонии Снайта-Гамильтона (Snaith-Hamilton Pleasure Scale, SHAPS), шкалы депрессии Бека (Beck Depression Inventory, BDI), шкалы поведенческой активации при депрессии (Behavioral Activation for Depression Scale (BADS), шкалы общего клинического впечатления (Clinical global impression scale, CGI: динамики заболевания CGI-I и его тяжести CGI-S).
Статистическую обработку клинического материала проводили с использованием программного пакета Microsoft Excel 2013, статистических программ IBM SPSS Statistics версии 23.0. В качестве статистических параметров использовались средняя арифметическая и стандартная ошибка средней (M±m); статистическая вероятность события – частота события в процентах (P(А) = n(A) / n х 100%, где n(A) – число наблюдений с отличительным признаком А, n – общее число наблюдений. Достоверность различий оценивали по коэффициенту достоверности значений (t-критерию) по формуле Стьюдента. При достаточном числе наблюдений, значение t = 2 и более свидетельствовало о достоверности различий двух величин с вероятностью 95% и выше (уровень достоверности p<0,05), а при t-Стьюдента менее 2 – различия считали случайными, недоказанными.
Результаты исследования
Выборку групп сравнения составили 85 больных, среди которых было 15 пациентов мужского пола (17,6%) и 70 женского пола (82,4%). Возраст пациентов на момент начала исследования от 18 до 65 лет (средний возраст 38,6±1,8 года). Длительность заболевания от момента первого задокументированного обращения к психиатру от 1 до 30 лет (средняя длительность – 8,15±7,8 года).Оценка степени тяжести депрессии по критериями МКБ-10 показала следующее распределение – 64 пациента (75%) страдали депрессией средней степени тяжести, у 21 (25%) пациента диагностировали тяжелую депрессию.
После рандомизации пациентов в терапевтические подгруппы оказалось, что соотношение долей представленности депрессий с различным длинником заболевания и тяжести текущей депрессии было сопоставимым.
Распределение больных по диагностическим рубрикам представлено следующим образом: 30 больных (35,3%) – биполярное аффективное расстройство (БАР) (F31.3-4); 12 больных (14,1%) – депрессивный эпизод (ДЭ) (F32.1-2); 43 пациента (50,6%) – рекуррентное депрессивное расстройство (РДР) (F33.1-2).
Клиническая структура депрессий (табл. 1) характеризовалась апато-адинамической симптоматикой – 37 пациентов (43,5%), тоскливо-адинамической – 26 пациентов (30,6%), тревожно-адинамической – 22 пациента (25,9%). Причем апато-адинамические нарушения преобладали в структуре БАР, а тоскливо-адинамические – в рамках РДР.
На этапе включения в исследование пациенты всех групп находились в депрессивном состоянии умеренной или тяжелой степени тяжести. Различия между группами сравнения по степени тяжести депрессии статистически не были достоверны (p>0,05) как по шкале HDRS, так и по другим психометрическим шкалам.
Результаты лечения в группе сравнения 1 – депрессии с преобладанием апато-адинамического синдрома.
Сопоставление результатов лечения больных апато-адинамическими депрессиями в основной и контрольной группах по шкале CGI-S (табл. 2) показало большую эффективность комбинированной терапии iTBS+ВР+ПФТ и iTBS+ПФТ с высокой статистической достоверностью (t = 3,674387, t = 4,824182 соответственно) и отсутствие различий в эффективности между группами ВР+ПФТ и контроля (ПФТ) (t = 0,235519).
Сопоставление результатов лечения группы iTBS+ВР+ПФТ и ВР+ПФТ по шкале CGI-S и CGI-I (табл. 2) показало большую эффективность комбинированной терапии iTBS+ВР+ПФТ с высокой статистической достоверностью (t = 3,365396, t = 3,188411 соответственно).
Сопоставление результатов лечения группы iTBS+ПФТ и ВР+ПФТ по шкале CGI-S и CGI-I (табл. 2) показало большую эффективность терапии iTBS+ПФТ с высокой статистической достоверностью (t = 4,374788, t = 2,557261 соответственно).
При практически равной интенсивности активной симптоматики у пациентов с апато-адинамическими депрессиями на 1 визите, на последующих визитах было отчетливо видно, что комбинированная терапия iTBS+ВР+ПФТ позволяла добиться большего клинического эффекта по всему профилю симптомов: степень выраженности редукции патологических симптомов у пациентов данной группы в 2 и более раз превышала таковую у пациентов группы ВР+ПФТ по шкале CGI-I; в 1,8 раза – по шкале CGI-S; сочетанная терапия iTBS+ПФТ позволила добиться большего клинического эффекта: степень выраженности редукции патологических симптомов у пациентов данной группы в 1,7 раза превышала таковую у пациентов группы ВР+ПФТ по шкале CGI-I; в 1,9 раза – по шкале CGI-S.
Результаты лечения в группе сравнения 2 – депрессии с преобладанием тоскливо-адинамического синдрома.
Сопоставление результатов лечения больных тоскливо-адинамическими депрессиями в основной и контрольной группах по шкале CGI-S (табл. 3) показало большую эффективность комбинированной терапии iTBS+ВР+ПФТ, iTBS+ПФТ и ВР+ПФТ с высокой статистической достоверностью (t = 2,648103, t = 2,321219, t = 3,133398 соответственно) и по шкале CGI-I (t = 3,880335, t = 2,462051, t = 3,535534 соответственно), чем в контрольной группе (ПФТ).
Сопоставление результатов лечения группы iTBS+ПФТ и ВР+ПФТ по шкале BDI (табл. 3) показало большую эффективность терапии ВР+ПФТ с высокой статистической достоверностью (t = 2,739537713).
При практически равной интенсивности активной симптоматики у пациентов с преобладанием тоскливо-адинамического синдрома на 1 визите, в дальнейшем группа сочетанной терапии ВР+ПФТ позволила добиться большего клинического эффекта: степень выраженности редукции патологических симптомов у пациентов данной группы в 2 раза превышала таковую у пациентов группы iTBS +ПФТ по шкале BDI.

Результаты лечения в группе сравнения 3 – депрессии с преобладанием тревожно-адинамического синдрома.
Сопоставление результатов лечения больных тревожно-адинамическими депрессиями в основной и контрольной группах по шкале CGI-S (табл. 4) показало большую эффективность комбинированной терапии iTBS+ВР+ПФТ, iTBS+ПФТ и ВР+ПФТ с высокой статистической достоверностью (t = 3,972602, t = 4,936952, t = 5,351296 соответственно), и по шкале CGI-I (t = 5,908062, t = 8,774964, t = 5,405248 соответственно), чем в контрольной группе (ПФТ).
Сопоставление результатов лечения группы iTBS+ВР+ПФТ и ВР+ПФТ по шкале HDRS (табл. 4) показало большую эффективность комбинированной терапии iTBS+ВР+ПФТ с высокой статистической достоверностью (t = 4,467914967).
Сопоставление результатов лечения группы iTBS+ПФТ и ВР+ПФТ по шкале CGI-I (табл. 4) показало большую эффективность терапии iTBS+ПФТ с высокой статистической достоверностью (t = 2,44949).
При практически равной интенсивности активной симптоматики у пациентов с преобладанием тревожно-адинамического синдрома на 1 визите, в дальнейшем комбинированная терапия iTBS+ВР+ПФТ и iTBS+ПФТ позволила добиться большего клинического эффекта: степень выраженности редукции патологических симптомов у пациентов данных групп в 2,5 раза превышала таковую у пациентов группы ВР+ПФТ по шкале HDRS, а по шкале CGI-I – в 1,6 раза.

Обсуждение
Комплексное лечение апато-адинамического синдрома в структуре РДР, ДЭ и БАР с сочетанным использованием ПФТ, ТМС и ВР приводит к достоверно более выраженной редукции симптоматики по сравнению с результатами, полученными при использовании стандартной ПФТ, в том числе в комбинации с ВР.Комплексное лечение тоскливо-адинамического синдрома в структуре РДР, ДЭ и БАР с применением ПФТ и ВР приводит к достоверно более выраженной редукции симптоматики по сравнению с результатами, полученными при использовании только ПФТ, в том числе в комбинации с ТМС.
Комплексное лечение тревожно-адинамического синдрома в структуре РДР, ДЭ и БАР с сочетанным использованием ПФТ, ТМС и ВР приводит к достоверно наиболее выраженной редукции симптоматики по сравнению с результатами, полученными при использовании только ПФТ, в том числе в комбинации с ВР, что соотносится с результатами зарубежных исследователей.
Выявленные корреляции между специфическими депрессивно-адинамическими симптомокомплексами или эндофенотипами и их ответами на нейромодулирующую терапию могут являться прогностическими критериями эффективности.
Выводы
Оба метода нейромодуляции (ТМС и ВР) в разной степени повышают эффективность психофармакотерапии адинамических депрессий.Результаты исследования позволяют прогнозировать высокую эффективность терапии ТМС в сочетании с ВР-терапией у пациентов с апато-адинамическими и тревожно-адинамическими депрессиями, тогда как при тоскливо-адинамическом эндофенотипе депрессии, вопреки ожиданиям, терапевтический прогноз лучше при ВР-нейромодуляции, чем при использовании ТМС.
Выявленные в настоящем исследовании эндофенотипы депрессий, реагирующие не одинаково на различные комбинации ПФТ, ТМС и ВР, можно использовать в качестве клинического маркера терапевтического ответа на разные методы нейромодуляции.
Информация об авторах:
Нелюбова Е.С. – https://orcid.org/0009-0001-0907-0318
Шмилович А.А. – https://orcid.org/0000-0002-1060-5076
Колсанов А.В. – https://orcid.org/0000-0002-4144-7090
Бурыгина Л.А. – https://orcid.org/0000-0002-7183-1536
Автор, ответственный за переписку: Нелюбова Е.С. e-mail: e.s.nelyubova@mail.ru
Nelyubova E.S. – https://orcid.org/0009-0001-0907-0318
A.A. Shmilovich – https://orcid.org/0000-0002-1060-5076
Kolsanov A.V. – https://orcid.org/0000-0002-4144-7090
Burygina L.A. – https://orcid.org/0000-0002-7183-1536
The author responsible for the correspondence: Nelyubova E.S. e-mail: e.s.nelyubova@mail.ru
Дата поступления: 05.05.2025
Received: 05.05.2025
Принята к печати: 02.06.2025
Accepted: 02.06.2025
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Список исп. литературыСкрыть список1. Антонович Б.A., Майорова Л.A., Цукарзи Э.Э., Мосолов С.Н. (2019). Нейронные сети состояния покоя при депрессиях и перспективы применения персонифицированной магнитной стимуляции / Современная терапия психических расстройств, 2019, №3, с. 2–11 / https://doi.org/10.21265/PSYPH.2019.49.35967
2. Вертоградова О.П., Степанов И.Л., Максимова Н.М., Ваксман А.В., Диков С.Ю., Кошкин К.А., Моисейчева О.В., Целищев О.В. Клинико-патогенетические аспекты типологии депрессий / Социальная и клиническая психиатрия, 2012, т. 22, №3, с. 5-10 / https://cyberleninka.ru/article/n/kliniko-patogeneticheskie-aspekty-tipologii-depressiy
3. Лурия А.Р. Основы нейропсихологии: учеб. пособие для студ. учреждений высш. проф. образования, 8-е изд. / М.: Издательский центр «Академия», 2013, 384 с.
4. Максимова Н.М., Булгакова Т.С., Узбеков М.Г. Роль цитокинов в патогенезе и терапии психических расстройств / Социальная и клиническая психиатрия, 2019, №29 (3), с. 71-77
5. Мосолов С.Н. Современные биологические гипотезы рекуррентной депрессии (обзор) / Журнал неврологии и психиатрии имени С.С. Корсакова, 2012, т. 112, №11, с. 29–40
6. Нуллер Ю.Л., Михаленко И.Н. Аффективные психозы / Л.: Медицина, 1988, 264 с.
7. Петрова Н.Н., Майорова М.А. Роль кинуренинового пути в развитии и терапии депрессии / Современная терапия психических расстройств, 2018, №4, с. 2-7
8. Станжевский А.А., Тютин Л.А. Роль перфузионных технологий в оценке гемодинамики опухолей головного мозга / Трансляционная медицина, 2015, №4, с. 41-47 / https://doi.org/10.18705/2311-4495-2015-0-4-41-47
9. Узбеков М.Г., Максимова Н.М. Некоторые нейробиологические аспекты патогенеза тревожной депрессии и антиглюкокортикоидная фармакотерапия / Российский психиатрический журнал, 2018, №2, с. 31-39
10. Чиж В.Ф. Учебникъ психiатрiи / Типография К. Матиссена, 1911, 345 с.
11. Akil H., Gordon J., Hen R. et al. Treatment resistant depression: a multi-scale, systems biology approach / Neurosci. biobehav. rev., 2018, vol. 84, p. 272–288
12. Amat J., Baratta M.V., Paul E., Bland S.T., Watkins L.R., Maier S.F. Medial prefrontal cortex determines how stressor controllability affects behavior and dorsal raphe nucleus / Nat. neurosci., 2005, №8(3), p. 365-371
13. Amidfar M., Woelfer M., Reus G.Z., Quevedo J., Walter M., Kim Y.K. The role of NMDA receptor in neurobiology and treatment of major depressive disorder: Evidence from translational research / Prog. Neuropsychopharmacol. Biol. Psychiatry, 2019, vol. 94, p. 109
14. Ansara E.D. Management of treatment-resistant generalized anxiety disorder / Ment. health clin, 2020, №10, p. 326–334
15. Buch A.M., Liston C. Dissecting diagnostic heterogeneity in depression by integrating neuroimaging and genetics / Neuropsychopharmacology, 2021, № 46, p. 156–175 / https://doi.org/10.1038/s41386-020-00789-3
16. Cai N., Choi K.W., Fried E.I. Reviewing the genetics of heterogeneity in depression: operationalizations, manifestations and etiologies / Hum. Mol. Genet, 2020, № 29, p. 10-18 / https://doi.org/10.1093/hmg/ddaa115
17. Drysdale A.T., Grosenick L., Downar J., Dunlop K., Mansouri F., Meng Y., Fetcho R.N., Zebley B., Oathes D.J., Etkin A., Schatzberg A.F., Sudheimer K., Keller J., Mayberg H.S., Gunning F.M., Alexopoulos G.S., Fox M.D., Pascual-Leone A., Voss H.U., Casey B.J., Dubin M.J., Liston C. Resting-state connectivity biomarkers define neurophysiological subtypes of depression / Nat. med., 2017, №23(1), p. 28-38
18. Dubin M.J., Liston C., Avissar M.A. et al. Network-Guided transcranial magnetic stimulation for depression / Current behavioral neuroscience reports, 2017, vol. 4, №1, p. 70–77
19. Ferrari A.J., Charlson F.J., Norman R.E., Patten S.B., Freedman G., Murray C.J.L., Vos T., Whiteford H.A. Burden of depressive disorders by country, sex, age, and year: findings from the global burden of disease study 2010 / PLOS medicine, 2013 / https://doi.org/10.1371/journal.pmed.1001547
20. Fox M.D., Buckner R.L., White M.P., Greicius M.D., Pascual-Leone A. Efficacy of transcranial magnetic stimulation targets for depression is related to intrinsic functional connectivity with the subgenual cingulate / Biol. psychiatry, 2012, №72(7), p. 595–603
21. Fox M.D., Liu H., Pascual-Leone A. Identification of reproducible individualized targets for treatment of depression with TMS based on intrinsic connectivity / Neuroimage., 2013, №66, p. 151–160
22. Guillemin G.J. Quinolinic acid, the inescapable neurotoxin / FEBS J., 2012, vol. 279(8), p. 1356-1365
23. Gutierrez-Rojas L., Porras-Segovia A., Dunne H., Andrade-Gonzalez N., Cervilla J.A. Prevalence and correlates of major depressive disorder: a systematic review / Braz. J. Psychiatry, 2020, № 42, p. 657–672 / https://doi.org/10.1590/1516-4446-2020-0650
24. Harald B., Gordon P. Meta-review of depressive subtyping models / J. affect. disord., 2012, №139, p. 126–140 / https://doi.org/10.1016/j.jad.2011.07.015
25. Irena P. Ilieva, George S. Alexopoulos, Marc J. Dubin, S. Shizuko Morimoto, Lindsay W. Victoria, Faith M. Gunning. Age-Related Repetitive Transcranial Magnetic Stimulation Effects on Executive Function in Depression: A Systematic Review / The American journal of geriatric psychiatry, 2018, Vol. 26, №3, p. 334-346
26. Koenigs M., Tranel D. Irrational economic decision-making after ventromedial prefrontal damage: evidence from the Ultimatum Game / J. Neurosci., 2007, №27(4), p. 951-956
27. Li B.J., Friston K., Mody M., Wang H.N., Lu H.B., Hu D.W. A brain network model for depression: From symptom understanding to disease intervention / CNS Neurosci. Ther., 2018, №24(11), p. 1004-1019
28. Maier S.F., Amat J., Baratta M.V., Paul E., Watkins L.R. Behavioral control, the medial prefrontal cortex and resilience / Dialogues clin. neurosci., 2006, №8(4), p. 397-406
29. Mayberg H.S., Lozano A.M., Voon V., McNeely H.E., Seminowicz D., Hamani C., Schwalb J.M., Kennedy S.H. Deep brain stimulation for treatment-resistant depression / Neuron., 2005, №45(5), p. 651-660
30. Paus T., Collins D.L., Evans A.C., Leonard G., Pike B., Zijdenbos A. Maturation of white matter in the human brain: a review of magnetic resonance studies / Brain res. bull., 2001, №54(3), p. 255-266
31. Ruberto V.L., Jha M.K., Murrough J.W. Pharmacological treatments for patients with treatment-resistant depression / Pharmaceuticals, 2020, №13, p. 116
32. Sheline Y.I., Barch D.M., Price J.L., Rundle M.M., Vaishnavi S.N., Snyder A.Z., Mintun M.A., Wang S., Coalson R.S., Raichle M.E. The default mode network and self-referential processes in depression / Proc. natl. acad. sci USA, 2009, №106(6), p. 1942-1947
33. Taber K.H., Hurley R.A. 2008). Functional neuroanatomy of sleep and sleep deprivation / Windows to the brain: Insights from neuroimaging, American psychiatric publishing, 2008, p. 153–158
34. Tozzi L., Zhang X., Pines A. et al. Personalized brain circuit scores identify clinically distinct biotypes in depression and anxiety / Nat. med., 2024, №30, p. 2076–2087 / https://doi.org/10.1038/s41591-024-03057-9
35. Weigand A., Horn A., Caballero R., Cooke D., Stern A.P., Taylor S.F., et al. Prospective validation that Subgenual connectivity predicts antidepressant efficacy of Transcranial magnetic stimulation sites / Biol. psychiatry, 2018, №84(1), p. 28–37
22 августа 2025
Количество просмотров: 278

