Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
1 N.Pirogov Russian National Medical Research University, Moscow, Russia;
2 V.Serbsky National Research Center of Psychiatry and Narcology, Moscow, Russia
Abstract
Objectives. To systematize the available data in the literature showing the relationship between asthma, anxiety disorders and depression.
Material and methods. Search and content analysis of articles in PubMed, Elibrary, Cochrane Library, and Google Scholar scientific databases using the queries “(asthma) AND (depression)”, “(asthma) AND (anxiety disorders)”, “asthma and depression”, “asthma and anxiety disorders”.
Results. The сlinical and pathophysiological relationship has been identified between depression, anxiety disorders, and asthma, and the influence of these disorders on the course of bronchial asthma has been described. Additionally, it has been established that affective disorders become more complicated and severe within the progressive course of bronchial asthma. The choice of therapy for bronchial asthma is a complex issue, taking into consideration the toxic effects of steroid remedies.
Conclusion. The presented data confirm the existence of a relationship between asthma, depression, and anxiety disorders.
Keywords: asthma, depression, anxiety disorders, asthma control, quality of life.
For citation: M.V. Ivanyuta, V.N. Krasnov. Depression and Anxiety Disorders in Patients with Asthma. Psychiatry and psychopharmacotherapy. 2025; 3: 39–45. DOI: 10.62202/2075-1761-2025-27-3-39-45
В ходе исследования полногеномных ассоциаций (GWAS) были выявлены общие патогенетические связи между бронхиальной астмой и тревожными расстройствами, а также депрессией. Перекрестный метаанализ обнаружил один локус, который совместно ассоциирован с астмой и тревожными расстройствами, а также десять локусов, общих для астмы и депрессии. Найденные варианты отвечают за регуляцию экспрессии генов в тканях, относящихся к экзокринной, эндокринной, пищеварительной, дыхательной, кроветворной и иммунной системам [6].
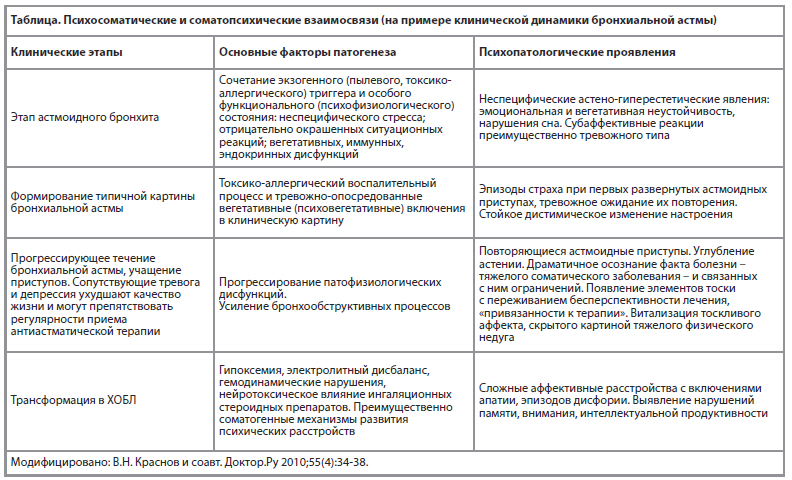
Согласно эпидемиологическим исследованиям, распространенность депрессии и тревожных расстройств среди людей с астмой значительно выше, чем в общей популяции [2]. В метаанализах, проведенных M. Jiang [7] и соавт., а также Ye. Gang и соавт. [5], было установлено, что риск развития депрессии у пациентов с астмой в 1,5 раза выше, а тревожных расстройств – в 2 раза по сравнению со здоровыми людьми. Кроме того, наличие депрессии и тревожных расстройств тесно связано с низкими показателями контроля астмы и ухудшением качества жизни [2]. Бронхиальная астма может служить примером неоднозначного соотношения соматопсихического и психосоматического контекста заболевания с трудностями выделения первичной патогенной сущности заболевания. С определенной долей условности соматогенные механизмы можно признать первичными, учитывая, в частности, аллергическую готовность (прослеживается с раннего возраста реакции на пыль, пыльцу растений, некоторые пищевые продукты и т.п., перенесенные в детско-подростковом возрасте бронхиты, пневмонии). Присоединение тревожного реагирования, сопровождающего нарушения дыхания, можно считать коморбидным явлением. Дальнейшее течение заболевания соответствует закономерностям психосоматической патологии. Основные этапы структурно-динамических соотношений соматического и психопатологического, в первую очередь аффективных звеньев заболевания, отражены в Таблице [8]. Ниже представлены данные ряда современных исследований, в той или иной мере соотносимых с изложенной концепцией.
У больных, перенесших ряд особенно тяжелых приступов астмы, иногда даже легкие ощущения одышки – через процесс классического обусловливания – могут служить триггерами гипервентиляции, панических приступов и других тревожно-вегетативных нарушений, которые, в свою очередь, усугубляют течение астмы [15]. Приступы астмы могут провоцироваться воздействием на дыхательные пути холодного, сухого воздуха [16] или ваготонически опосредованной бронхоконстрикцией [17]. Важно проводить дифференциальную диагностику между паническим приступом и приступом бронхиальной астмы. Важным признаком приступа при истинной астме является преимущественное затруднение выдоха; в отличие от этого, при функциональных тревожно-вегетативных приступах, как правило, наблюдается затруднение вдоха [8].
Симптомы астмы, особенно ощущение одышки, воспринимаются интенсивнее у больных астмой с сопутствующей тревогой, причем эта связь возникает независимо от тяжести астмы [18]. Таким образом, потенциальное влияние тревоги на восприятие симптомов астмы должно учитываться врачами при оценке самоотчетов пациентов о своих симптомах. Так, в одном из исследований было показано, что на решения врачей об увеличении дозировки лекарств, в частности стероидных препаратов, значительно влиял уровень тревоги у пациента с астмой [9].
В исследовании Bosley и соавт. у пациентов с астмой, которые были классифицированы как не соблюдающие режим лечения (принимали менее 70% предписанных доз ингаляционных препаратов), показатели по шкале Гамильтона для оценки депрессии были значительно выше, чем у тех, кто соблюдал режим лечения [21]. К возможным путям влияния депрессии на самоконтроль астмы и связанное с ним соблюдение режима лечения относят следующие: 1) чувство безнадежности может привести пациента к мысли о бесполезности приема лекарств; 2) депрессии часто сопутствует изоляция от семьи и друзей, которые могли бы оказать поддержку в соблюдении режима лечения; 3) депрессия часто связана со снижением когнитивных функций (решение проблем, выполнение сложных задач, концентрация, устойчивость внимания и память), которые необходимы для соблюдения рекомендаций по лечению [21].
Качество жизни, связанное со здоровьем (HRQoL), у пациентов с астмой страдает во многих аспектах. Исследования демонстрируют значительное снижение физической, психологической и социальной сфер HRQoL [22, 23]. К причинам снижения качества жизни относят плохой контроль заболевания, наличие тяжелых симптомов, а также сопутствующую депрессию. Исследование Medical Outcomes Study показало, что сопутствующая астме депрессия оказывает негативное влияние на HRQoL [23]. Кроме того, у пациентов с астмой и депрессией снижается умственная и физическая работоспособность по сравнению с пациентами, страдающими только астмой [24]. Что касается плохого контроля заболевания и низкого качества жизни, B. Gonzalez-Freire и соавт. в своем исследовании подтвердили, что плохой контроль астмы связан с ухудшением общего самочувствия [25].
Выявлено, что повторяющийся опыт гипоксии и гиперкапнии вследствие астмы может сенсибилизировать нейронные цепи, контролирующие реакцию страха, такие как нейроны в миндалине и locus ceruleus, что приводит к чрезмерной реакции либо на последующие эпизоды гипоксии и гиперкапнии из-за астмы, либо связано со страхом перед условными стимулами, такими как ощущение одышки [33]. Данные о повышенной вероятности развития тревожных расстройств у пациентов с тяжелой астмой по сравнению с нетяжелой астмой подтверждают эту теорию [34].
Согласно некоторым исследованиям, при паническом расстройстве имеются отклонения в функционировании респираторной системы, что объединяет его с бронхиальной астмой. Предполагалось, что пациенты с паническим расстройством обладают повышенной чувствительностью к воздействию углекислого газа на медуллярную хеморецепторную систему или сверхчувствительной центральной системой «сигнализации удушья», обнаруживающей патофизиологические механизмы приближающегося удушья, такие как повышенное парциальное давление углекислого газа или уровень лактата в мозге [35, 36]. Возникающая в ответ на повышение СО2 гипервентиляция является результатом адаптивных попыток организма снизить содержание углекислого газа, вызывающего симптомы паники. Согласно другой теории, гипнокапнический алкалоз вследствие острой гипервентиляции вызывает сосудистые, неврологические и метаболические изменения, которые приводят к симптомам, напоминающим панические приступы [37]. Однако позже в лабораторных исследованиях было показано, что после вдыхания СО2 у пациентов с паническим расстройством и без него наблюдалось одинаковое обязательное увеличение частоты дыхания и минутного объема вентиляции (гипервентиляция). Кроме того, данные физиологические изменения в респираторной системе хорошо переносились контрольной группой, даже пациентами с депрессией, однако у пациентов с паническим расстройством возникали панические приступы, причиной которых была катастрофическая интерпретация связанного с гипервентиляцией соматического дискомфорта. Следовательно, полученные результаты свидетельствовали о том, что у пациентов с паническим расстройством не было обнаружено нарушений в легочных, периферических (дуга аорты) или медуллярных хеморецепторах, что отрицает предыдущую гипотезу о наличии сверхчувствительной к воздействию углекислого газа хеморецепторной системы у пациентов с паническим расстройством [38].
IL-4 участвует в переходе от врожденного к приобретенному иммунитету и в поляризации иммунных реакций от Th1 к Th2, что может привести к развитию аллергических реакций и даже астмы. Известно, что примерно 50% астмы легкой и средней степени тяжести, а также значительная часть астмы тяжелого течения вызваны Th2-зависимым воспалением [40]. IL-6 и TNF-α после преодоления гематоэнцефалического барьера способны связываться со специфическими рецепторами на клетках-предшественниках нейронов и уменьшать объем серого вещества гиппокампа, что всегда наблюдается при т.н. большой депрессии [7]. В механизмах развития не-Т2-эндотипа БА, характеризующегося нейтрофильным воспалением и трудно поддающегося лечению, участвуют, в частности, цитокины IL-6 и TNF-α [41, 42].
«Пересечение» цитокиновой и ГГН-систем имеет существенное значение для развития как астмы, так и депрессии. Провоспалительные цитокины ингибируют экспрессию или функцию рецепторов глюкокортикостероидов (ГК), что по механизму обратной связи способствует высвобождению адренокортикотропного гормона (АКТГ) и, следовательно, приводит к гиперактивации ГГН-системы [40]. Некоторые антидепрессанты оказывают прямое воздействие на ГР, приводя к усилению функции ГР и повышению экспрессии ГР [43]. Наличие резистентности к экзогенным ГК, наблюдаемой при трудноконтролируемой астме, также может быть связано с дисфункцией рецепторов ГК [44]. Цитокины IL-1 и IL-6 способны напрямую связываться со специфическими рецепторами на гипоталамусе и регулировать настроение путем чрезмерной активации ГГН-системы [7].
IL-1 индуцирует фермент индоламин-2,3-диоксигеназу, расщепляющий триптофан до нейротоксичных метаболитов – хинолиновой кислоты и 3-гидроксикиуренина, таким образом, влияя на моноаминовую нейротрансмиссию в мозге [7]. В одной из работ было показано, что IL-1β может изменить реактивность гладкой мускулатуры дыхательных путей при астме [45].
Повышенный уровень цитокинов активирует транскрипционный фактор NF-κB, который повышает экспрессию гена 5-HT1A, что, в свою очередь, приводит к снижению активности серотонина и нейротрансмиссии в нервных клетках и потенциально способствует развитию симптомов депрессии [46]. NF-κB также участвует в воспалении и при астме. В одном из исследований впервые был выявлен активный NF-κB в дыхательных путях и воспалительных клетках пациентов с астмой. Повышенная экспрессия NF-κB наблюдалась в клетках, полученных из мокроты и биопсий бронхов пациентов с легкой формой астмы, что было подтверждено с помощью анализа связывания ДНК и иммуногистохимического окрашивания [47]. Это свидетельствует о значительной активации NF-κB в дыхательных путях астматиков, особенно в эпителиальных и подслизистых клетках, с возможным участием макрофагов.
Окислительный стресс имеет отношение к патогенезу как астмы, так и депрессии. При астме маркеры окислительного стресса повышены не только локально в дыхательных путях, но и системно, и коррелируют с тяжестью заболевания [48]. Депрессия способна подавлять антиоксидантную систему и ассоциируется с повышенным уровнем реактивных видов кислорода [49]. Окислительный стресс также связан с переходом иммунного ответа на Th2-фенотип [48].
Таким образом, существуют убедительные доказательства, что астма и депрессия имеют общую дизрегуляцию некоторых ключевых цитокинов. Отражает ли это совпадение специфическую патогенетическую взаимосвязь или есть просто общее состояние воспалительных процессов, еще предстоит выяснить.
Кокрановский обзор 2016 года проанализировал данные о влиянии когнитивно-поведенческой терапии (КПТ) по сравнению с обычным лечением (без КПТ) на ряд показателей здоровья людей с астмой, включая качество жизни, приверженность медикаментозному лечению, уровень тревоги и депрессии. Выяснилось, что у участников, которые проходили тренинг КПТ, улучшились показатели по опроснику качества жизни при астме и показатели контроля астмы, а также снизился уровень тревоги по сравнению с участниками, которые не проходили тренинг КПТ. Однако не было обнаружено явного улучшения показателей по шкале депрессии или приверженности медикаментозному лечению [51].
В последнее время появляется все больше данных, подтверждающих связь между изменением образа жизни и улучшением результатов лечения астмы. Систематический обзор эффективности физических упражнений при астме, проведенный в 2021 году, продемонстрировал общий положительный эффект в виде улучшения качества жизни при астме и увеличения количества дней без симптомов астмы [52]. В дальнейшем требуется проведение рандомизированных клинических исследований с целью оценки результатов изменений образа жизни у больных астмой с депрессией и тревогой.
Таким образом, данные об оптимальных подходах к терапевтической коррекции сопутствующих тревожных расстройств и/или депрессии у пациентов с астмой ограничены. Когнитивно-поведенческая терапия и изменение образа жизни являются многообещающими и улучшают показатели как астмы, так и психического здоровья. Для лучшего понимания роли депрессии и тревожных расстройств у пациентов с астмой необходимы хорошо спланированные рандомизированные контролируемые исследования с большим объемом выборки, стандартизированными результатами и более длительными сроками наблюдения.
Еще в 80-х годах прошлого века было опубликовано два клинических случая неожиданного развития тяжелой депрессии при применении бронхолитического препарата теофиллина. У первой пациентки, 19-летней девушки, страдающей астмой, в течение месяца после начала приема теофиллина развились депрессия и раздражительность. После отмены теофиллина депрессивные симптомы исчезли, но появились вновь после его повторного назначения. У второй пациентки, 11-летней девочки с астмой, после лечения теофиллином развились острая депрессия, с частыми приступами плача, и даже мыслями о самоповреждающем поведении. Данные симптомы также прошли после прекращения приема теофиллина [56].
Побочные эффекты, часто наблюдаемые при использовании бронходилататоров из группы бета2-агонистов, таких как сальбутамол, могут включать тревогу, беспокойство и нервозность. Эти симптомы обычно исчезают через некоторое время после начала лечения [57].
Таким образом, если у пациента с астмой возникают тревожные или депрессивные расстройства, важно тщательно собирать анамнез, чтобы определить, связаны ли они с приемом препаратов или имеют самостоятельный характер.
Статья выполнена в рамках Госзадания на 2024-2026 гг. «Разработка клинических инструментов и алгоритмов для поддержки принятия решений при диагностике, терапии и реабилитации пациентов с непсихотическими депрессивными расстройствами». 124020800064-9
Сведения об авторах
Иванюта Мария Валерьевна – ординатор 2-го года кафедры психиатрии ФДПО РНИМУ им. Н.И. Пирогова Минздрава России
E-mail: omari99769@gmail.com
https://orcid.org/0000-0001-5014-1950
Краснов Валерий Николаевич – руководитель отдела клинико-патогенетических исследований в психиатрии Московского НИИ психиатрии – филиала ФГБУ «НМИЦ ПН им. В.П. Сербского» Минздрава России; зав. кафедрой психиатрии ФДПО РНИМУ им. Н.И. Пирогова» Минздрава России, д.м.н., профессор
E-mail:valery-krasnov@mail.ru
https://orcid.org/0000-0002-5249-3316
Дата поступления: 24.03.2025
Received: 24.03.2025
Принята к печати: 02.06.2025
Accepted: 02.06.2025
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03 2025
Депрессия и тревожные расстройства у больных бронхиальной астмой №03 2025
Номера страниц в выпуске:39-45
Резюме
Цель. Систематизировать имеющиеся в литературе данные, отражающие взаимосвязи между астмой, тревожными расстройствами и депрессией.
Материалы и методы. Поиск и анализ содержания статей в наукометрических базах PubMed, Elibrary, Cochrane Library, Google Scholar по запросам «(asthma) AND (depression)», «(asthma) AND (anxiety disorders)», «астма и депрессия», «астма и тревожные расстройства».
Результаты. Подтверждена клиническая и патофизиологическая взаимосвязь между депрессией, тревожными расстройствами и астмой, описано влияние данных расстройств на течение бронхиальной астмы, наряду с этим установлено усложнение и утяжеление аффективных расстройств при прогредиентном течении бронхиальной астмы. Сложной проблемой является выбор терапии бронхиальной астмы, учитывая нейротоксические эффекты стероидных бронхолитиков.
Выводы. Представленные данные подтверждают наличие взаимосвязи между астмой, депрессией и тревожными расстройствами.
Ключевые слова: астма, депрессия, тревожные расстройства, контроль астмы, качество жизни.
Для цитирования: М.В. Иванюта, В.Н. Краснов. Депрессия и тревожные расстройства у больных бронхиальной астмой. Психиатрия и психофармакотерапия. 2025; 3: 39–45. DOI: 10.62202/2075-1761-2025-27-3-39-45
Цель. Систематизировать имеющиеся в литературе данные, отражающие взаимосвязи между астмой, тревожными расстройствами и депрессией.
Материалы и методы. Поиск и анализ содержания статей в наукометрических базах PubMed, Elibrary, Cochrane Library, Google Scholar по запросам «(asthma) AND (depression)», «(asthma) AND (anxiety disorders)», «астма и депрессия», «астма и тревожные расстройства».
Результаты. Подтверждена клиническая и патофизиологическая взаимосвязь между депрессией, тревожными расстройствами и астмой, описано влияние данных расстройств на течение бронхиальной астмы, наряду с этим установлено усложнение и утяжеление аффективных расстройств при прогредиентном течении бронхиальной астмы. Сложной проблемой является выбор терапии бронхиальной астмы, учитывая нейротоксические эффекты стероидных бронхолитиков.
Выводы. Представленные данные подтверждают наличие взаимосвязи между астмой, депрессией и тревожными расстройствами.
Ключевые слова: астма, депрессия, тревожные расстройства, контроль астмы, качество жизни.
Для цитирования: М.В. Иванюта, В.Н. Краснов. Депрессия и тревожные расстройства у больных бронхиальной астмой. Психиатрия и психофармакотерапия. 2025; 3: 39–45. DOI: 10.62202/2075-1761-2025-27-3-39-45
Depression and Anxiety Disorders in Patients with Asthma
M.V. Ivanyuta1, V.N. Krasnov1,21 N.Pirogov Russian National Medical Research University, Moscow, Russia;
2 V.Serbsky National Research Center of Psychiatry and Narcology, Moscow, Russia
Abstract
Objectives. To systematize the available data in the literature showing the relationship between asthma, anxiety disorders and depression.
Material and methods. Search and content analysis of articles in PubMed, Elibrary, Cochrane Library, and Google Scholar scientific databases using the queries “(asthma) AND (depression)”, “(asthma) AND (anxiety disorders)”, “asthma and depression”, “asthma and anxiety disorders”.
Results. The сlinical and pathophysiological relationship has been identified between depression, anxiety disorders, and asthma, and the influence of these disorders on the course of bronchial asthma has been described. Additionally, it has been established that affective disorders become more complicated and severe within the progressive course of bronchial asthma. The choice of therapy for bronchial asthma is a complex issue, taking into consideration the toxic effects of steroid remedies.
Conclusion. The presented data confirm the existence of a relationship between asthma, depression, and anxiety disorders.
Keywords: asthma, depression, anxiety disorders, asthma control, quality of life.
For citation: M.V. Ivanyuta, V.N. Krasnov. Depression and Anxiety Disorders in Patients with Asthma. Psychiatry and psychopharmacotherapy. 2025; 3: 39–45. DOI: 10.62202/2075-1761-2025-27-3-39-45
Введение
Во всем мире бронхиальной астмой страдают по крайней мере 348 млн человек [1]. Бремя болезни ассоциируется со снижением качества жизни, негативным влиянием на социальную активность, ограничением профессиональных возможностей [2]. Бронхиальная астма традиционно считается классическим психосоматическим заболеванием [3, 4], хотя в отличие от других заболеваний данной категории менее всего может быть связана с «первичными психологическими» патогенными факторами. Аллергическая готовность (прослеживающиеся с раннего возраста реакции на пыльцу, пыль, некоторые пищевые продукты) как предпосылка развития бронхиальной астмы не имеет доказуемой психогенной природы, чаще связана с перинатальными вредностями, органическими экзогенными факторами, бронхолегочными заболеваниями в раннем детском возрасте. Взаимосвязь бронхиальной астмы и расстройств аффективного (тревожно-депрессивного) спектра является очевидным клиническим фактом, при этом побуждает клиницистов-практиков и исследователей в очередной раз попытаться решить проблему коморбидности, соответственно – выявить наиболее доступное терапевтической коррекции звено в этой цепи. По своим патогенетическим механизмам бронхиальная астма в современной литературе рассматривается как многофакторное заболевание, включающее сложное взаимодействие респираторной, нервной, эндокринной и иммунной систем; в той или иной форме уже первые астмоидные приступы сопровождаются тревожными реакциями [5].В ходе исследования полногеномных ассоциаций (GWAS) были выявлены общие патогенетические связи между бронхиальной астмой и тревожными расстройствами, а также депрессией. Перекрестный метаанализ обнаружил один локус, который совместно ассоциирован с астмой и тревожными расстройствами, а также десять локусов, общих для астмы и депрессии. Найденные варианты отвечают за регуляцию экспрессии генов в тканях, относящихся к экзокринной, эндокринной, пищеварительной, дыхательной, кроветворной и иммунной системам [6].
Согласно эпидемиологическим исследованиям, распространенность депрессии и тревожных расстройств среди людей с астмой значительно выше, чем в общей популяции [2]. В метаанализах, проведенных M. Jiang [7] и соавт., а также Ye. Gang и соавт. [5], было установлено, что риск развития депрессии у пациентов с астмой в 1,5 раза выше, а тревожных расстройств – в 2 раза по сравнению со здоровыми людьми. Кроме того, наличие депрессии и тревожных расстройств тесно связано с низкими показателями контроля астмы и ухудшением качества жизни [2]. Бронхиальная астма может служить примером неоднозначного соотношения соматопсихического и психосоматического контекста заболевания с трудностями выделения первичной патогенной сущности заболевания. С определенной долей условности соматогенные механизмы можно признать первичными, учитывая, в частности, аллергическую готовность (прослеживается с раннего возраста реакции на пыль, пыльцу растений, некоторые пищевые продукты и т.п., перенесенные в детско-подростковом возрасте бронхиты, пневмонии). Присоединение тревожного реагирования, сопровождающего нарушения дыхания, можно считать коморбидным явлением. Дальнейшее течение заболевания соответствует закономерностям психосоматической патологии. Основные этапы структурно-динамических соотношений соматического и психопатологического, в первую очередь аффективных звеньев заболевания, отражены в Таблице [8]. Ниже представлены данные ряда современных исследований, в той или иной мере соотносимых с изложенной концепцией.

Влияние тревожных расстройств на течение астмы
Имеются предположения, что умеренная тревога может играть адаптивную роль во время эпизодов бронхоконстрикции, способствуя более эффективному применению бронхолитиков [9, 10]. В то же время выраженная тревожность может усугублять течение астмы и привести к значительному ухудшению качества жизни. Так, среди больных астмой высокий уровень тревоги и «панического страха» ассоциировался с применением более агрессивных стероидных схем, чрезмерным использованием бронходилататоров, а также с более частыми и длительными госпитализациями, не зависящими от объективной функции легких [9, 11, 12]. Из-за «страха перед одышкой» пациенты с астмой и тревожными расстройствами могут чрезмерно ограничивать физическую активность, избегать эмоционально напряженных ситуаций и ограничивать межличностные отношения, пытаясь свести к минимуму любые нагрузки, которые потенциально могут привести к одышке [9]. Пациенты с астмой, страдающие одновременно генерализованным тревожным расстройством, нередко испытывают трудности в принятии адекватных решений по самоконтролю, что, в свою очередь, может негативно сказаться на контроле астмы и качестве жизни по сравнению с пациентами, не имеющими данного расстройства [13, 14].У больных, перенесших ряд особенно тяжелых приступов астмы, иногда даже легкие ощущения одышки – через процесс классического обусловливания – могут служить триггерами гипервентиляции, панических приступов и других тревожно-вегетативных нарушений, которые, в свою очередь, усугубляют течение астмы [15]. Приступы астмы могут провоцироваться воздействием на дыхательные пути холодного, сухого воздуха [16] или ваготонически опосредованной бронхоконстрикцией [17]. Важно проводить дифференциальную диагностику между паническим приступом и приступом бронхиальной астмы. Важным признаком приступа при истинной астме является преимущественное затруднение выдоха; в отличие от этого, при функциональных тревожно-вегетативных приступах, как правило, наблюдается затруднение вдоха [8].
Симптомы астмы, особенно ощущение одышки, воспринимаются интенсивнее у больных астмой с сопутствующей тревогой, причем эта связь возникает независимо от тяжести астмы [18]. Таким образом, потенциальное влияние тревоги на восприятие симптомов астмы должно учитываться врачами при оценке самоотчетов пациентов о своих симптомах. Так, в одном из исследований было показано, что на решения врачей об увеличении дозировки лекарств, в частности стероидных препаратов, значительно влиял уровень тревоги у пациента с астмой [9].
Влияние депрессии на течение астмы
Депрессия является одним из важных факторов, который потенциально снижает эффективность самоконтроля астмы и влияет на соблюдение режима лечения. Исследование DiMatteo и соавт. показало, что у пациентов с хроническим заболеванием и депрессией риск несоблюдения режима лечения в три раза выше по сравнению с пациентами без депрессии [19]. Согласно гипотезе DiMatteo и соавт., за снижение эффективности самоконтроля астмы отвечает петля обратной связи с депрессией. Депрессия приводит к несоблюдению режима лечения, что еще больше усугубляет астму. Кроме того, депрессию часто сопровождает бессонница, которая самостоятельно ассоциирована с негативным влиянием на показатели контроля астмы [20].В исследовании Bosley и соавт. у пациентов с астмой, которые были классифицированы как не соблюдающие режим лечения (принимали менее 70% предписанных доз ингаляционных препаратов), показатели по шкале Гамильтона для оценки депрессии были значительно выше, чем у тех, кто соблюдал режим лечения [21]. К возможным путям влияния депрессии на самоконтроль астмы и связанное с ним соблюдение режима лечения относят следующие: 1) чувство безнадежности может привести пациента к мысли о бесполезности приема лекарств; 2) депрессии часто сопутствует изоляция от семьи и друзей, которые могли бы оказать поддержку в соблюдении режима лечения; 3) депрессия часто связана со снижением когнитивных функций (решение проблем, выполнение сложных задач, концентрация, устойчивость внимания и память), которые необходимы для соблюдения рекомендаций по лечению [21].
Качество жизни, связанное со здоровьем (HRQoL), у пациентов с астмой страдает во многих аспектах. Исследования демонстрируют значительное снижение физической, психологической и социальной сфер HRQoL [22, 23]. К причинам снижения качества жизни относят плохой контроль заболевания, наличие тяжелых симптомов, а также сопутствующую депрессию. Исследование Medical Outcomes Study показало, что сопутствующая астме депрессия оказывает негативное влияние на HRQoL [23]. Кроме того, у пациентов с астмой и депрессией снижается умственная и физическая работоспособность по сравнению с пациентами, страдающими только астмой [24]. Что касается плохого контроля заболевания и низкого качества жизни, B. Gonzalez-Freire и соавт. в своем исследовании подтвердили, что плохой контроль астмы связан с ухудшением общего самочувствия [25].
Патофизиологическая взаимосвязь астмы и тревожных расстройств
Вызываемая тревогой физиологическая дизрегуляция вегетативной нервной системы и гипоталамо-гипофизарно-надпочечниковой оси оказывает влияние на контроль астмы через повышение парасимпатической активности и увеличение секреции провоспалительных цитокинов, являющихся важными медиаторами обострений астмы [26, 27]. Кроме того, данные сложные психо-нейро-иммунологические взаимодействия приводят к дисбалансу в сторону Th2 Т-клеточного ответа, наблюдаемому как при астме, так и при тревожных расстройствах [28, 29]. В исследованиях было продемонстрировано, что при тревожных расстройствах повышается уровень провоспалительных цитокинов, таких как интерлейкин (IL)-6, фактор некроза опухоли-альфа, IL-10 и моноцитарный хемоаттрактантный протеин-1/CCL2 [30], которые также играют важную роль в патогенезе бронхиальной астмы. Предполагается, что эпителиальные цитокины связаны с аллергическим воспалением, в том числе имеющим отношение к развитию астмы [31]. Другое относительно недавнее исследование показало, что провоспалительные цитокины, кортизол слюны и альфа-амилаза потенциально связаны с развитием генерализованного тревожного расстройства у пациентов с астмой [32].Выявлено, что повторяющийся опыт гипоксии и гиперкапнии вследствие астмы может сенсибилизировать нейронные цепи, контролирующие реакцию страха, такие как нейроны в миндалине и locus ceruleus, что приводит к чрезмерной реакции либо на последующие эпизоды гипоксии и гиперкапнии из-за астмы, либо связано со страхом перед условными стимулами, такими как ощущение одышки [33]. Данные о повышенной вероятности развития тревожных расстройств у пациентов с тяжелой астмой по сравнению с нетяжелой астмой подтверждают эту теорию [34].
Согласно некоторым исследованиям, при паническом расстройстве имеются отклонения в функционировании респираторной системы, что объединяет его с бронхиальной астмой. Предполагалось, что пациенты с паническим расстройством обладают повышенной чувствительностью к воздействию углекислого газа на медуллярную хеморецепторную систему или сверхчувствительной центральной системой «сигнализации удушья», обнаруживающей патофизиологические механизмы приближающегося удушья, такие как повышенное парциальное давление углекислого газа или уровень лактата в мозге [35, 36]. Возникающая в ответ на повышение СО2 гипервентиляция является результатом адаптивных попыток организма снизить содержание углекислого газа, вызывающего симптомы паники. Согласно другой теории, гипнокапнический алкалоз вследствие острой гипервентиляции вызывает сосудистые, неврологические и метаболические изменения, которые приводят к симптомам, напоминающим панические приступы [37]. Однако позже в лабораторных исследованиях было показано, что после вдыхания СО2 у пациентов с паническим расстройством и без него наблюдалось одинаковое обязательное увеличение частоты дыхания и минутного объема вентиляции (гипервентиляция). Кроме того, данные физиологические изменения в респираторной системе хорошо переносились контрольной группой, даже пациентами с депрессией, однако у пациентов с паническим расстройством возникали панические приступы, причиной которых была катастрофическая интерпретация связанного с гипервентиляцией соматического дискомфорта. Следовательно, полученные результаты свидетельствовали о том, что у пациентов с паническим расстройством не было обнаружено нарушений в легочных, периферических (дуга аорты) или медуллярных хеморецепторах, что отрицает предыдущую гипотезу о наличии сверхчувствительной к воздействию углекислого газа хеморецепторной системы у пациентов с паническим расстройством [38].
Патофизиологическая взаимосвязь астмы и депрессии
Последние данные свидетельствуют о том, что в патогенезе депрессии большую роль играет воспаление, что подтверждается повышенной выработкой провоспалительных цитокинов, таких как интерлейкин (IL)-1β, IL-4, IL-6 и фактор некроза опухоли-альфа (TNF-α) [39].IL-4 участвует в переходе от врожденного к приобретенному иммунитету и в поляризации иммунных реакций от Th1 к Th2, что может привести к развитию аллергических реакций и даже астмы. Известно, что примерно 50% астмы легкой и средней степени тяжести, а также значительная часть астмы тяжелого течения вызваны Th2-зависимым воспалением [40]. IL-6 и TNF-α после преодоления гематоэнцефалического барьера способны связываться со специфическими рецепторами на клетках-предшественниках нейронов и уменьшать объем серого вещества гиппокампа, что всегда наблюдается при т.н. большой депрессии [7]. В механизмах развития не-Т2-эндотипа БА, характеризующегося нейтрофильным воспалением и трудно поддающегося лечению, участвуют, в частности, цитокины IL-6 и TNF-α [41, 42].
«Пересечение» цитокиновой и ГГН-систем имеет существенное значение для развития как астмы, так и депрессии. Провоспалительные цитокины ингибируют экспрессию или функцию рецепторов глюкокортикостероидов (ГК), что по механизму обратной связи способствует высвобождению адренокортикотропного гормона (АКТГ) и, следовательно, приводит к гиперактивации ГГН-системы [40]. Некоторые антидепрессанты оказывают прямое воздействие на ГР, приводя к усилению функции ГР и повышению экспрессии ГР [43]. Наличие резистентности к экзогенным ГК, наблюдаемой при трудноконтролируемой астме, также может быть связано с дисфункцией рецепторов ГК [44]. Цитокины IL-1 и IL-6 способны напрямую связываться со специфическими рецепторами на гипоталамусе и регулировать настроение путем чрезмерной активации ГГН-системы [7].
IL-1 индуцирует фермент индоламин-2,3-диоксигеназу, расщепляющий триптофан до нейротоксичных метаболитов – хинолиновой кислоты и 3-гидроксикиуренина, таким образом, влияя на моноаминовую нейротрансмиссию в мозге [7]. В одной из работ было показано, что IL-1β может изменить реактивность гладкой мускулатуры дыхательных путей при астме [45].
Повышенный уровень цитокинов активирует транскрипционный фактор NF-κB, который повышает экспрессию гена 5-HT1A, что, в свою очередь, приводит к снижению активности серотонина и нейротрансмиссии в нервных клетках и потенциально способствует развитию симптомов депрессии [46]. NF-κB также участвует в воспалении и при астме. В одном из исследований впервые был выявлен активный NF-κB в дыхательных путях и воспалительных клетках пациентов с астмой. Повышенная экспрессия NF-κB наблюдалась в клетках, полученных из мокроты и биопсий бронхов пациентов с легкой формой астмы, что было подтверждено с помощью анализа связывания ДНК и иммуногистохимического окрашивания [47]. Это свидетельствует о значительной активации NF-κB в дыхательных путях астматиков, особенно в эпителиальных и подслизистых клетках, с возможным участием макрофагов.
Окислительный стресс имеет отношение к патогенезу как астмы, так и депрессии. При астме маркеры окислительного стресса повышены не только локально в дыхательных путях, но и системно, и коррелируют с тяжестью заболевания [48]. Депрессия способна подавлять антиоксидантную систему и ассоциируется с повышенным уровнем реактивных видов кислорода [49]. Окислительный стресс также связан с переходом иммунного ответа на Th2-фенотип [48].
Таким образом, существуют убедительные доказательства, что астма и депрессия имеют общую дизрегуляцию некоторых ключевых цитокинов. Отражает ли это совпадение специфическую патогенетическую взаимосвязь или есть просто общее состояние воспалительных процессов, еще предстоит выяснить.
Обзор методов лечения
При растущем понимании связи депрессии и тревоги с астмой крайне мало исследований, посвященных лечению данных состояний у пациентов с астмой. В недавно проведенном метаанализе было выявлено шесть рандомизированных контролируемых исследований, изучавших эффективность и безопасность фармакологических вмешательств при первичном большом депрессивном расстройстве у лиц с астмой. Метаанализ объединенных данных четырех исследований селективных ингибиторов обратного захвата серотонина (эсциталопрама или циталопрама) не показал значительного влияния на симптомы депрессии по сравнению с контролем [50]. Короткая продолжительность этих исследований, возможно, ограничила полный эффект от лечения СИОЗС, так как СИОЗС может потребоваться не менее 6 недель для проявления эффекта и даже больше для достижения максимального эффекта. Для лучшего понимания роли фармакологической терапии в лечении депрессии при астме важны дальнейшие исследования с большим объемом выборки и более длительными периодами применения антидепрессантов. Примечательно, что в ходе нашего поиска мы не нашли ни одного исследования, в котором бы оценивалась фармакологическая терапия тревожных расстройств при астме.Кокрановский обзор 2016 года проанализировал данные о влиянии когнитивно-поведенческой терапии (КПТ) по сравнению с обычным лечением (без КПТ) на ряд показателей здоровья людей с астмой, включая качество жизни, приверженность медикаментозному лечению, уровень тревоги и депрессии. Выяснилось, что у участников, которые проходили тренинг КПТ, улучшились показатели по опроснику качества жизни при астме и показатели контроля астмы, а также снизился уровень тревоги по сравнению с участниками, которые не проходили тренинг КПТ. Однако не было обнаружено явного улучшения показателей по шкале депрессии или приверженности медикаментозному лечению [51].
В последнее время появляется все больше данных, подтверждающих связь между изменением образа жизни и улучшением результатов лечения астмы. Систематический обзор эффективности физических упражнений при астме, проведенный в 2021 году, продемонстрировал общий положительный эффект в виде улучшения качества жизни при астме и увеличения количества дней без симптомов астмы [52]. В дальнейшем требуется проведение рандомизированных клинических исследований с целью оценки результатов изменений образа жизни у больных астмой с депрессией и тревогой.
Таким образом, данные об оптимальных подходах к терапевтической коррекции сопутствующих тревожных расстройств и/или депрессии у пациентов с астмой ограничены. Когнитивно-поведенческая терапия и изменение образа жизни являются многообещающими и улучшают показатели как астмы, так и психического здоровья. Для лучшего понимания роли депрессии и тревожных расстройств у пациентов с астмой необходимы хорошо спланированные рандомизированные контролируемые исследования с большим объемом выборки, стандартизированными результатами и более длительными сроками наблюдения.
Влияние препаратов для лечения астмы на развитие депрессии и тревожных расстройств
Кортикостероиды и теофиллин обладают побочными действиями на ЦНС, которые способны привести к развитию депрессии у пациентов, страдающих астмой. Кросс-секционное исследование, проведенное S.B. Patten, показало, что среди пациентов, которые в период исследования принимали кортикостероиды или использовали их в течение последнего месяца, распространенность депрессии была значительно выше по сравнению с теми, кто не принимал кортикостероиды [53]. Это говорит о возможной связи между применением кортикостероидов и повышением риска развития депрессии. В амбулаторном исследовании S.B. Bonala и соавт. попытались количественно оценить распространенность психиатрической заболеваемости среди пациентов с астмой в зависимости от тяжести астмы, качества жизни и принимаемой дозы ингаляционных кортикостероидов (ИКС) [54]. В результате было выяснено, что хотя использование высоких доз ИКС улучшает легочную функцию и качество жизни больных астмой, оно может оказывать негативное влияние на психическое благополучие пациента в виде развития тревоги и/или депрессии. M. Amelink и соавт. сообщали, что пациенты, страдающие тяжелой не преднизолонозависимой или легкой умеренной астмой, были менее подвержены психологическому дистрессу по сравнению с людьми, страдающими тяжелой, преднизолонозависимой астмой [55].Еще в 80-х годах прошлого века было опубликовано два клинических случая неожиданного развития тяжелой депрессии при применении бронхолитического препарата теофиллина. У первой пациентки, 19-летней девушки, страдающей астмой, в течение месяца после начала приема теофиллина развились депрессия и раздражительность. После отмены теофиллина депрессивные симптомы исчезли, но появились вновь после его повторного назначения. У второй пациентки, 11-летней девочки с астмой, после лечения теофиллином развились острая депрессия, с частыми приступами плача, и даже мыслями о самоповреждающем поведении. Данные симптомы также прошли после прекращения приема теофиллина [56].
Побочные эффекты, часто наблюдаемые при использовании бронходилататоров из группы бета2-агонистов, таких как сальбутамол, могут включать тревогу, беспокойство и нервозность. Эти симптомы обычно исчезают через некоторое время после начала лечения [57].
Таким образом, если у пациента с астмой возникают тревожные или депрессивные расстройства, важно тщательно собирать анамнез, чтобы определить, связаны ли они с приемом препаратов или имеют самостоятельный характер.
Заключение
Обзор литературных данных последних десятилетий, касающихся взаимосвязи бронхиальной астмы и расстройств тревожно-депрессивного спектра, подтверждает клиническую значимость коморбидности этих форм патологии. Попытки решения проблемы первичности/вторичности того или иного компонента из этого сложного взаимосвязанного единства будут иметь скорее схоластический характер. Начальный этап развития преимущественно субклинических и эпизодических тревожно-депрессивных проявлений, равно как усложнение аффективных расстройств по мере нарастания бронхообструктивных нарушений и, соответственно, гипоксии и гипоксемии, – правомерно рассматривать с позиций соматогении. Вместе с тем усложняющаяся депрессивная симптоматика привносит дополнительный неблагоприятный вклад в самочувствие больного, отягощая его качество жизни. Приведены убедительные данные о том, что депрессия и тревожные расстройства оказывают негативное влияние на показатели контроля симптомов астмы. Представляют интерес биологические механизмы патогенеза, которые устанавливают взаимосвязь между указанными расстройствами. Представленные практические рекомендации, включающие обзор методов терапии астмы, по-видимому, требуют уточнения и специальных дополнительных исследований. Внимание к психиатрической симптоматике должно быть важнейшим компонентом диагностики и лечения астмы, поскольку и депрессия, и тревожные расстройства широко распространены среди лиц с астмой и тесно с ней связаны. Бронхиальную астму следует рассматривать как единое патологическое состояние, требующее участия пульмонологов и психиатров, разумеется, в рамках первичной компетенции пульмонологов. Дальнейшие исследовательские стратегии должны быть направлены на поиск эффективных мер терапии и вторичной профилактики у данной группы пациентов.Статья выполнена в рамках Госзадания на 2024-2026 гг. «Разработка клинических инструментов и алгоритмов для поддержки принятия решений при диагностике, терапии и реабилитации пациентов с непсихотическими депрессивными расстройствами». 124020800064-9
Сведения об авторах
Иванюта Мария Валерьевна – ординатор 2-го года кафедры психиатрии ФДПО РНИМУ им. Н.И. Пирогова Минздрава России
E-mail: omari99769@gmail.com
https://orcid.org/0000-0001-5014-1950
Краснов Валерий Николаевич – руководитель отдела клинико-патогенетических исследований в психиатрии Московского НИИ психиатрии – филиала ФГБУ «НМИЦ ПН им. В.П. Сербского» Минздрава России; зав. кафедрой психиатрии ФДПО РНИМУ им. Н.И. Пирогова» Минздрава России, д.м.н., профессор
E-mail:valery-krasnov@mail.ru
https://orcid.org/0000-0002-5249-3316
Дата поступления: 24.03.2025
Received: 24.03.2025
Принята к печати: 02.06.2025
Accepted: 02.06.2025
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Список исп. литературыСкрыть список1. Chuchalin A.G., Avdeev S.N., Aisanov Z.R. et al. Bronchial asthma: Federal clinical recommendations for diagnostics and treatment. Pul’monologia. 2022; 32 (3): 393-447. doi: 10.18093/0869-0189-2022-32-3-393-447. (In Russ.).
2. Stanescu S., Kirby S.E., Tomas M. et al. A systematic review of psychological, physical health factors, and quality of life in adult asthma. NPJ Prim Care Respir Med. 2019; 29 (1): 37. doi: 10.1038/s41533-019-0149-3.
3. Herzog W., Kruze J., Woller W. Psychosomatik. Stuttgart, New York: Georg Thieme Verlag. 2017. doi: 10.1055/b-004-135633. (In German).
4. Semenova N.D. Development of the concept of psychosomatic disorders. In: Mental and psychosomatic disorders in general medical practice (Ed. L.V.Romasenko). M.: GEOTARmedia. 2023, pp 9-56. doi: 10.33029/9704-76-29-1-PSY-2023-1-320. (In Russ.).
5. Ye G., Baldwin D.S., Hou R. Anxiety in asthma: a systematic review and meta-analysis. Psychol Med. 2021; 51(1):11-20. doi: 10.1017/S0033291720005097
6. Zhu Z., Zhu X., Liu C.L., et al. Shared genetics of asthma and mental health disorders: a large-scale genome-wide cross-trait analysis. Eur Respir J. 2019; 54(6):1901507. doi: 10.1183/13993003.01507-2019.
7. Jiang M., Qin P., Yang X. Comorbidity between depression and asthma via immune-inflammatory pathways: a meta-analysis. J Affect Disord. 2014;166:22-9. doi: 10.1016/j.jad.2014.04.027
8. Krasnov V.N., Paleev N.R., Martynova N.V. et al. Affektiv spektrum disorders in bronchial asthma and its therapeutic correction. Doktor.Ru. 2010; 55(4):34-38. (in Russ.).
9. Carr RE. Panic disorder and asthma. J Asthma. 1999;36(2):143-52. doi: 10.3109/02770909909056310
10. Spinhoven P., van Peski-Oosterbaan A.S., Van der Does A.J., et al. Association of anxiety with perception of histamine induced bronchoconstriction in patients with asthma. Thorax. 1997;52(2):149-52. doi: 10.1136/thx.52. 2.149
11. Smoller J.W., Otto M.W. Panic, dyspnea, and asthma. Curr Opin Pulm Med. 1998;4(1):40-5. doi: 10.1097/00063198-199801000-00008
12. Mawhinney H., Spector S.L., Heitjan D., et al. As-needed medication use in asthma usage patterns and patient characteristics. J Asthma. 1993; 30 (1):61-71. doi: 10.3109/02770909309066381
13. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition, Text Revision (DSM-5-TR). Washington, DC: American Psychiatric Publishing. 2022.
14. Lavoie K.L., Boudreau M., Plourde A., et al. Association between generalized anxiety disorder and asthma morbidity. Psychosom Med. 2011;73(6):504-13. doi: 10.1097/PSY.0b013e318222e9fc
15. Lehrer P.M., Isenberg S., Hochron S.M. Asthma and emotion: a review. J
Asthma/ 1993;30(1):5-21. doi: 10.3109/02770909309066375
16. Hibbert G., Pilsbury D. Demonstration and treatment of hyperventilation causing asthma. Br J Psychiatry. 1988;153:687-9. doi: 10.1192/bjp.153.5.687
17. Isenberg S.A., Lehrer P.M., Hochron S. The effects of suggestion and emotional arousal on pulmonary function in asthma: a review and a hypothesis regarding vagal mediation. Psychosom Med. 1992;54(2):192-216. doi: 10.1097/00006842-199203000-00006
18. Moore M.C., Zebb B.J. The catastrophic misinterpretation of physiological distress. Behaviour research and therapy. 1999;37(11):1105–1118. doi: 10.1016/S0005-7967(98)00197-1
19. DiMatteo M.R., Lepper H.S., Croghan T.W. Depression is a risk factor for noncompliance with medical treatment: meta-analysis of the effects of anxiety and depression on patient adherence. Arch Intern Med. 2000;160(14):2101-7. doi: 10.1001/archinte.160.14.2101
20. Rhoads S.L., Edinger J., Khatiwada A., et al. The impact of insomnia and depression on asthma control. J Asthma. 2024;61(10):1248-1251. doi: 10.1080/02770903.2024.2335367
21. Bosley C.M., Fosbury J.A., Cochrane G.M. The psychological factors associated with poor compliance with treatment in asthma. Eur Respir J. 1995;8(6):899-904
22. Pate C.A., Zahran H.S., Bailey C.M. Impaired health-related quality of life and related risk factors among US adults with asthma. J Asthma. 2019;56(4):431-439. doi: 10.1080/02770903.2018.1466314
23. Kharaba Z., Feghali E., El Husseini F., et al. An Assessment of Quality of Life in Patients With Asthma Through Physical, Emotional, Social, and Occupational Aspects. A Cross-Sectional Study. Front Public Health. 2022;10:883784. doi: 10.3389/fpubh.2022.883784
24. Feldman J.M., Zeigler A.E., Nelson K., et al. Depression symptoms and quality of life among individuals with aspirin-exacerbated respiratory disease. J Asthma. 2019;56(7):731-738. doi: 10.1080/02770903.2018.1490754
25. González-Freire B., Vázquez I., Pértega-Díaz S. The Relationship of Psychological Factors and Asthma Control to Health-Related Quality of Life. J Allergy Clin Immunol Pract. 2020;8(1):197-207. doi: 10.1016/j.jaip.2019. 07.009
26. Wright R.J., Cohen R.T., Cohen S. The impact of stress on the development and expression of atopy. Curr Opin Allergy Clin Immunol. 2005;5(1):23-9. doi: 10.1097/00130832-200502000-00006
27. Wright R.J., Rodriguez M., Cohen S. Review of psychosocial stress and asthma: an integrated biopsychosocial approach. Thorax. 1998;53(12):1066-74. doi: 10.1136/thx.53.12.1066
28. Del Giacco S.R., Cappai A., Gambula L., et al. The asthma-anxiety connection. Respir Med. 2016;120:44-53. doi: 10.1016/j.rmed.2016.09.014
29. Tamayo J.M., Osman H.C., Schwartzer J.J., et al. The influence of asthma on neuroinflammation and neurodevelopment: From epidemiology to basic models. Brain Behav Immun. 2024;116:218-228. doi: 10.1016/j.bbi. 2023.12.003
30. Köhler C.A., Freitas T.H., Stubbs B., et al. Peripheral Alterations in Cytokine and Chemokine Levels After Antidepressant Drug Treatment for Major Depressive Disorder: Systematic Review and Meta-Analysis. Mol Neurobiol. 2018;55(5):4195-4206. doi: 10.1007/s12035-017-0632-1
31. Castillo E.F., Zheng H., Yang X.O. Orchestration of epithelial-derived cytokines and innate immune cells in allergic airway inflammation. Cytokine Growth Factor Rev. 2018;39:19-25. doi: 10.1016/j.cytogfr.2017.11.004
32. Yang C.J., Liu D., Xu Z.S., et al. The pro-inflammatory cytokines, salivary cortisol and alpha-amylase are associated with generalized anxiety disorder (GAD) in patients with asthma. Neurosci Lett. 2017;656:15-21. doi: 10.1016/j.neulet.2017.07.021
33. Katon W.J., Richardson L., Lozano P., et al. The relationship of asthma and anxiety disorders. Psychosom Med. 2004;66(3):349-55. doi: 10.1097/01.psy.0000126202.89941.ea
34. Goodwin R.D., Jacobi F., Thefeld W. Mental disorders and asthma in the community. Arch Gen Psychiatry. 2003;60(11):1125-30. doi: 10.1001/archpsyc.60.11.1125
35. Klein D.F. False suffocation alarms, spontaneous panics, and related conditions. An integrative hypothesis. Arch Gen Psychiatry. 1993;50(4):306-17. doi: 10.1001/archpsyc.1993.01820160076009
36. Klein D.F. Testing the suffocation false alarm theory of panic disorder. Anxiety. 1994;1(1):1-7. doi: 10.1002/anxi.3070010103
37. Ley R. Panic disorder and agoraphobia: fear of fear or fear of the symptoms produced by hyperventilation? J Behav Ther Exp Psychiatry. 1987;18(4):305-16. doi: 10.1016/0005-7916(87)90044-9
38. Gorman J.M., Kent J., Martinez J., et al. Physiological changes during carbon dioxide inhalation in patients with panic disorder, major depression, and premenstrual dysphoric disorder: evidence for a central fear mechanism. Arch Gen Psychiatry. 2001;58(2):125-31. doi: 10.1001/archpsyc.58.2.125
39. Harsanyi S., Kupcova I., Danisovic L., et al. Selected Biomarkers of Depression: What Are the Effects of Cytokines and Inflammation? Int J Mol Sci. 2022;24(1):578. doi: 10.3390/ijms24010578
40. Habib N., Pasha M.A., Tang D.D. Current Understanding of Asthma Pathogenesis and Biomarkers. Cells. 2022;11(17):2764. doi: 10.3390/cells11172764
41. Hudey S.N., Ledford D.K., Cardet J.C. Mechanisms of non-type 2 asthma. Curr Opin Immunol. 2020;66:123-128. doi: 10.1016/j.coi.2020.10.002
42. Raison C.L., Miller A.H. Depression in cancer: new developments regarding diagnosis and treatment. Biol Psychiatry. 2003;54(3):283-94. doi: 10.1016/s0006-3223(03)00413-x
43. Pariante C.M., Miller A.H. Glucocorticoid receptors in major depression: relevance to pathophysiology and treatment. Biol Psychiatry. 2001;49(5):391-404. doi: 10.1016/s0006-3223(00)01088-x
44. Nabe T. Steroid-Resistant Asthma and Neutrophils. Biol Pharm Bull. 2020;43(1):31-35. doi: 10.1248/bpb.b19-00095
45. Whelan R., Kim C., Chen M., et al. Role and regulation of interleukin-1 molecules in pro-asthmatic sensitised airway smooth muscle. Eur Respir J. 2004;24(4):559-67. doi: 10.1183/09031936.04.00133803
46. Bethea C.L., Reddy A.P., Smith L.J. Nuclear factor kappa B in the dorsal raphe of macaques: an anatomical link for steroids, cytokines and serotonin. J Psychiatry Neurosci. 2006;31(2):105-14. doi: 10.1016/j.yfrne.2006.03.262
47. Barnes P.J., Adcock I.M. Transcription factors and asthma. Eur Respir J. 1998;12(1):221-34. doi: 10.1183/09031936.98.12010221
48. Kleniewska P., Pawliczak R. The participation of oxidative stress in the pathogenesis of bronchial asthma. Biomed Pharmacother. 2017;94:100-108. doi: 10.1016/j.biopha.2017.07.066
49. Ji N., Lei M., Chen Y., et al. How Oxidative Stress Induces Depression? ASN Neuro. 2023;15:17590914231181037. doi: 10.1177/17590914231181037
50. Tran L., Sharrad K., Kopsaftis Z., et al. Pharmacological interventions for the treatment of psychological distress in patients with asthma: a systematic review and meta-analysis. J Asthma. 2021;58(6):759-769. doi: 10.1080/02770903.2020.1731826
51. Kew K.M., Nashed M., Dulay V., et al. Cognitive behavioural therapy (CBT) for adults and adolescents with asthma. Cochrane Database Syst Rev. 2016;9(9):CD011818. doi: 10.1002/14651858.CD011818.pub2
52. Kuder M.M., Clark M., Cooley C., et al. A Systematic Review of the Effect of Physical Activity on Asthma Outcomes. J Allergy Clin Immunol Pract. 2021;9(9):3407-3421.e8. doi: 10.1016/j.jaip.2021.04.048
53. Patten S.B. Exogenous corticosteroids and major depression in the general population. J Psychosom Res. 2000;49(6):447-9. doi: 10.1016/s0022-3999(00)00187-2
54. Bonala S.B., Pina D., Silverman B.A., et al. Asthma severity, psychiatric morbidity, and quality of life: correlation with inhaled corticosteroid dose. J Asthma. 2003;40(6):691-9. doi: 10.1081/jas-120023491
55. Amelink M., Hashimoto S., Spinhoven P., et al. Anxiety, depression and personality traits in severe, prednisone-dependent asthma. Respir Med. 2014;108(3):438-44. doi: 10.1016/j.rmed.2013.12.012.
56. Murphy M.B., Dillon A., Fitzgerald M.X. Theophylline and depression. Br Med J. 1980;281(6251):1322. doi: 10.1136/bmj.281.6251.1322
57. Ma L.H., Jia L., Bai L. Safety outcomes of salbutamol: A systematic review and meta-analysis. Clin Respir J. 2023;17(12):1254-1264. doi: 10.1111/crj.13711


