Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Federal State Budgetary Institution "V.A. Almazov National Medical Research Center" of the Ministry of Health of the Russian Federation, Saint Petersburg, Russia
Department of Psychiatry and Psychotherapy with the Clinic of the Faculty of Medicine
Abstract
This article examines the genetic interrelationship between schizophrenia, bipolar affective disorder, schizoaffective disorder, and schizotypal disorder using network analysis. The study analyzed 155 alleles associated with schizophrenia, 29 with bipolar disorder, 28 with schizoaffective disorder, and 11 with schizotypal disorder. The results revealed significant genetic overlaps among the disorders, including 28 shared alleles. These findings suggest a potential genetic connection between psychotic disorders. Despite the identified associations, many genetic variants remain underexplored, hindering a comprehensive understanding of the genetic architecture of these disorders. In conclusion, the article emphasizes the need for further research to deepen our understanding of the genetic foundations of endogenous mental disorders and their interrelationships.
Keywords: network analysis, genetics, schizophrenia, bipolar affective disorder, schizoaffective disorder, schizotypal disorder.
For citation: V.V. Pospelova, E.Yu. Abritalin, A.A. Krasnov. Network analysis of genetic relationships in endogenous mental disorders. Psychiatry and psychopharmacotherapy. 2025; 5: 4–9. DOI: 10.62202/2075-1761-2025-27-5-4-9
Полифакторность психических расстройств не вызывает сомнений. В рамках такой поликазуальности выделяют генетические факторы (точечные полиморфизмы генов, вариации числа копий, эпистаз – влияние генов друг на друга). Несмотря на то, что только лишь генетические варианты и взаимосвязи вряд ли объяснят патогенез клинических вариантов психических расстройств, данный подход поможет уточнить патогенетические взаимосвязи эндогенных психических расстройств и оценить мишени для терапии и дальнейших исследований. Кроме того, обнаружение генетических ассоциаций может стать естественной основой для спектрального подхода, способствующего развитию дименсиональной оценки в диагностике эндогенных психических расстройств, и, возможно, определить мишени для терапии.
В современных системах классификации МКБ и DSM диагностический подход основан на критериях того или иного расстройства, которые включают в себя набор симптомов, течение и длительность заболевания, что приводит к значительной гетерогенности форм одного и того же расстройства настолько, что два разных пациента с одним диагнозом клинически могут не иметь ничего общего.
Одна из проблем психиатрии заключается в преобладании описательных диагностических критериев диагностики, основанных на клинико-психопатологическом подходе, результаты которого сильно зависят от личности врача, взглядов и представлений различных научных школ, что не способствует объективизации диагностического процесса. Критерии включения в системах классификации также не всегда специфичны для отдельных расстройств, что приводит к необходимости существования и критериев исключения [32].
В настоящее время принято выделять две основные диагностические категории психических расстройств, традиционно относимых к эндогенным: шизофрению и биполярное аффективное расстройство (БАР) [8].
Вопрос о континууме шизофрении и БАР остается предметом дискуссии довольно долгое время. Пересечение аффективного и шизоидного спектров отмечалось в различных публикациях [17, 22, 48]. Однако недостаточность знаний об этиопатогенезе психических заболеваний до сих пор не позволяет приблизиться к пониманию разнообразия феноменологических проявлений как внутри выделяемых спектров, так и в особенностях их взаимного перекреста, хотя именно такое спектральное пересечение клинико-психопатологической структуры заболеваний наиболее часто приводит к субъективной интерпретации диагноза [9]. Вместе с тем следует признать тот факт, что если эти диагностические категории представляют собой настоящие заболевания, то это должно подразумевать естественную границу или разрыв между расстройствами, и должна быть возможность идентифицировать этот разрыв или «точку редкости» [47].
Примерно у 50% пациентов с БАР наблюдаются галлюцинации, бред или расстройства мышления, в том числе и в период ремиссии, а у 33% пациентов с диагнозом «шизофрения» имеется аффективная симптоматика [7, 25]. Кроме того, есть сложности с установлением специфичности исхода данных расстройств: описываются как стойкие клинические ремиссии при исходе шизофрении, так и исходы БАР с хроническим прогрессирующим течением и неблагоприятным прогнозом. По современным представлениям, некоторые аффективные эпизоды также приводят к формированию когнитивного дефекта и ухудшению функционирования, предположительно за счет нейротоксичности, оксидативного стресса и воспаления [3]. Сходство между шизофренией и психотическим биполярным расстройством также существует в отношении биологических параметров, включая количество рецепторов дофамина D2, измеренное с помощью ПЭТ-КТ [31]. Нейроанатомические сходства определены по данным МРТ: при обоих заболеваниях структурные изменения серого и белого вещества преобладают в лобной, височной областях и лимбической системе, в зонах, отвечающих за интеграцию исполнительных, когнитивных и аффективных функций [12].
Таким образом, появляется все больше клинических, биохимических и морфологических данных, позволяющих представить эндогенные психические расстройства как широкий спектр: от легкой шизотипии до тяжелой шизофрении по оси выраженности шизофренической симптоматики и от шизофрении до БАР (с шизоаффективным расстройством в промежуточной позиции) по аффективной оси.
Подтверждение естественности спектрального подхода было получено в исследовании Keshavan M.S. с соавт. (2011): 762 пробанда с диагнозами «шизофрения», БАР и шизоаффективным расстройством (ШАР) были оценены по шизо-биполярной шкале, которая основывается на сумме трех показателей: относительная доля неаффективного психоза, степень маниакального синдрома и преобладающая полярность аффекта. Низкие баллы соответствовали симптомам и течению, наиболее напоминающим БАР, а высокие баллы – шизофрении. В получившемся распределении, 45% выборки находились в среднем диапазоне несмотря на то, что многие случаи были распределены по верхним и нижним границам. Т.е. было получено мультимодальное распределение со значительным перекрытием между шизофренией и БАР [21].
Генетическая связь шизофрении и БАР рассматривается как один из важных аспектов связи этих заболеваний. Так, вопрос о дискретности или непрерывности психоза может решиться нахождением биологической основы, генетических ассоциаций, учитывая, что оба расстройства имеют оценочную наследуемость 0,7-0,8 и рассматриваются как сложные расстройства с полигенной архитектурой. Феноменологический «перекрест» наблюдается и в наследственности: ряд семейных исследований показал, что среди членов семьи больного шизофренией выше вероятность обнаружения БАР, и наоборот, существуют примеры близнецовых исследований, в которых описываются однояйцевые близнецы, где у одного диагностирована шизофрения, а у второго БАР [30, 26]. Полногеномные ассоциативные исследования (GWAS) показали наличие общих полиморфизмов одного нуклеотида в ДНК, оказывающих влияние на вероятность возникновения как шизофрении, так и БАР [29].
Исследования генетического сцепления выявили области хромосом, где пересекаются гены, связанные с шизофренией и БАР, такие как 13q, 22q, 6q и 18. Однако сложности возникают из-за неоднозначности результатов и трудностей в оценке статистической значимости. Гипотеза о наличии локусов, влияющих на восприимчивость к обоим расстройствам, получает поддержку от сканирования генома с использованием семей, где преобладает ШАР биполярного типа. Наблюдения показывают общегеномную ассоциацию в 1q42 и предположительное сцепление в 22q11 как у семей с шизофренией, так и у семей с БАР [2]. Вариации одних и тех же генов также были найдены у пациентов с шизофренией и БАР, например: NRG1, ген белка дисбиндина (DTNBP1), DAOA, DISC1, COMT, BDNF [34, 38, 19, 43]. Таким образом, семейные, близнецовые исследования и найденные генетические ассоциации говорят о некоторой связи между заболеваниями.
Цель исследования: провести анализ генетической взаимосвязи шизофрении, биполярного аффективного расстройства, шизоаффективного и шизотипического расстройств с помощью методики сетевого анализа.
Задачи исследования:
1. Провести обзор существующих данных о генах, связанных с шизофренией, биполярным аффективным расстройством (БАР), шизоаффективным расстройством (ШАР) и шизотипическим расстройством (ШТР) для создания базы данных для дальнейшего анализа.
2. Применить методику сетевого анализа для визуализации взаимосвязей между идентифицированными генами и их локусами, связанными с психическими расстройствами.
3. Выявить и классифицировать локусы, связанные с шизофренией, БАР, ШАР и ШТР с целью определения их значимости и степени взаимосвязи между расстройствами.
4. Исследовать пересечения аллелей между различными расстройствами для выявления общих генетических факторов, способствующих развитию этих заболеваний.
5. Оценить степень генетической близости между шизофренией, БАР, ШАР и ШТР на основе полученных данных о локусах и аллелях.
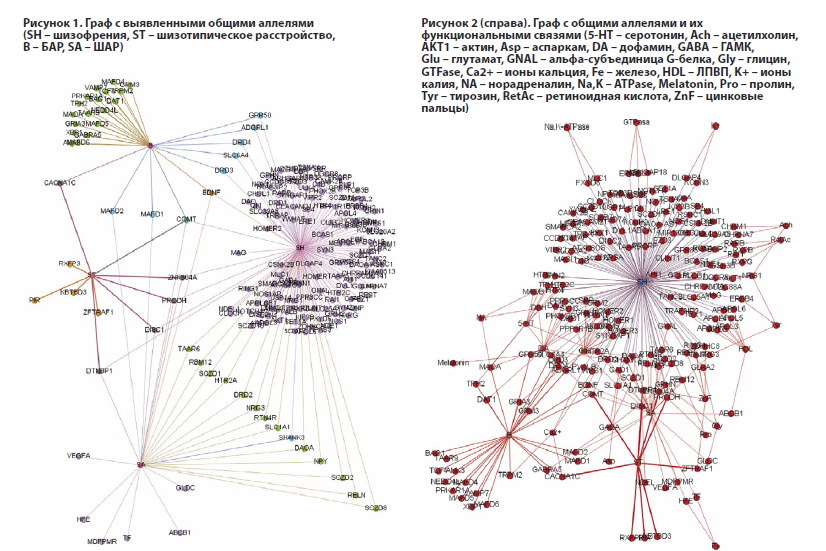
COMT – единственный аллель, найденный у всех четырех расстройств, находится на 22q11.21, кодирует катехол-О-метилтрансфераза, которая катализирует перенос метильной группы от S-аденозилметионина к катехоламинам, включая нейромедиаторы дофамин, адреналин и норадреналин. О-метилирование приводит к одному из основных путей деградации катехоламинов. Низкая активность фермента, вызванная мутацией, вероятно, связана с развитием психотических расстройств вследствие нарушения деградации дофамина [6].
BDNF с локусом 11p14.1 – общий аллель для шизофрении, БАР и ШАР, является фактором выживания, индуцируемым кортикальными нейронами и необходимым для выживания нейронов полосатого тела в головном мозге [4].
К общим найденным аллелям БАР и шизофрении относятся: GPR50, DRD3, DRD4, ADGRL1, SLC6A4.
GPR50 находится на Xq28, кодирует рецептор 50, связанный с G-белком, ингибирует функцию рецептора мелатонина 1А посредством гетеродимеризации, играет роль во многих процессах, включая регуляцию метаболизма, рост нейронов или миграцию клеток, дифференцировке нейрональных клеток-предшественников посредством активации сигнальных путей NOTCH и WNT/бета-катенин [18].
DRD3 находится на 3q13.31. Этот ген кодирует подтип D3 из пяти (D1-D5) дофаминовых рецепторов. Этот рецептор локализован в лимбических областях мозга, которые связаны с передачей дофамина [14].
DRD4 находится на 11p15.5, кодирует рецептор дофамина 4 типа [15].
ADGRL1 (рецептор L1, связанный с белком адгезии G) с локусом 19p13.12, кодирует члена семейства адгезивных трансмембранных рецепторов, связанных с G-белком [1].
SLC6A4 (член 4 семейства растворенных носителей 6) с локусом 17q11.2. Этот ген кодирует интегральный мембранный белок, который транспортирует серотонин из синаптических пространств в пресинаптические нейроны [45].
Общие аллели для шизофрении и ШАР: TAAR6, RBM12, SCZD1, HTR2A, DRD2, NRG3, RTN4R, SLC1A1, SHANK3, DAOA, NPY, SCZD2, SCZD8, RELN.
TAAR6 с локусом 6q23.2. Этот ген кодирует семитрансмембранный рецептор, связанный с G-белком, который, вероятно, функционирует как рецептор для эндогенных следовых аминов [46].
RBM12 с локусом 20q11.22. Этот ген кодирует белок, который содержит несколько РНК-связывающих мотивов, потенциальные трансмембранные домены и богатые пролином области. Связан с шизофренией 19 (SCZD19) [35].
SCZD1 с локусом 5q23-q35. Функция неизвестна [39].
HTR2A с локусом 13q14.2. Кодирует один из рецепторов серотонина [20].
DRD2 с локусом 11q23.2. Этот ген кодирует подтип D2 рецептора дофамина [13].
NRG3 с локусом 10q23.1. Этот ген кодирует нейрегулин 3 (NRG3) [28].
RTN4R с локусом 22q11.21. Этот ген кодирует рецептор ретикулона 4, олигодендроцитарного миелинового гликопротеина и миелин-ассоциированного гликопротеина. Этот рецептор опосредует ингибирование роста аксонов и может играть роль в регуляции регенерации и пластичности аксонов в центральной нервной системе взрослого человека [37].
SLC1A1 с локусом 9p24.2. Этот ген кодирует часть высокоаффинных переносчиков глутамата, которые играют важную роль в транспортировке глутамата через плазматические мембраны. В мозге эти транспортеры играют решающую роль в прекращении постсинаптического действия нейромедиатора глутамата и в поддержании его внеклеточных концентраций ниже нейротоксических уровней. Этот транспортер также транспортирует аспартат, и считается, что мутации в этом гене вызывают дикарбоксиликаминоацидурию, также известную как дефект транспорта глутамат-аспартат. Связан с шизофренией 18 (SCZD18) [44].
SHANK3 с локусом 22q13.33. Белки Shank представляют собой многодоменные каркасные белки постсинаптической мембраны, которые соединяют рецепторы нейромедиаторов, ионные каналы и другие мембранные белки с актиновым цитоскелетом и сигнальными путями, связанными с G-белком. Белки Shank также играют роль в формировании синапсов и созревании дендритных отростков. Мутации в этом гене являются причиной расстройства аутистического спектра (РАС), также вызывают шизофрению 15 (SCZD15) [42].
DAOA с локусом 13q22-q34. Этот ген кодирует белок, который может функционировать как активатор оксидазы D-аминокислот, которая разрушает глиотрансмиттер D-серин, мощный активатор глутаматных рецепторов N-метил-D-аспартатного (NMDA) типа. Исследования также показывают, что одна кодируемая изоформа может играть роль в функции митохондрий и ветвления дендритов [10].
NPY с локусом 7p15.3. Кодирует нейропептид Y [27].
SCZD2 с локусом 11q14-q21. Функция неизвестна. Связан с шизофренией 2 (SCZD2) [40].
SCZD8 с локусом 18p. Функция неизвестна. Связан с шизофренией 8 (SCZD8) [41].
RELN с локусом 7q22.1 Ген RELN кодирует рилин, большой секретируемый гликопротеин, который продуцируется определенными типами клеток развивающегося мозга и активирует сигнальный путь в постмитотически мигрирующих нейронах, необходимый для правильного позиционирования нейронов в слоистой паренхиме нервной системы [36].
Общие аллели для БАР и ШАР: MAFD1, MAFD2.
MAFD1 с локусом 18p. Функция неизвестна [23].
MAFD2 с локусом Xq28. Функция неизвестна [24].
К общим найденным аллелям ШТР, ШАР и шизофрении относятся: DISC1, ZNF804A, PRODH, DTNBP1.
DISC1 («Нарушенный при шизофрении-1») с локусом 1q42.2. Кодирует одноименный белок, который участвует в росте нейронов и развитии коры головного мозга посредством взаимодействия с другими белками, напрямую регулирует внутриклеточные сигнальные пути, синаптическую передачу, экспрессируется на мембранах митохондрий, участвует в регуляции транскрипции, внутриклеточного транспорта [11].
ZNF804A (белок цинковых пальцев 804A) с локусом 2q32.1. Белок, кодируемый этим геном, представляет собой белок, связывающий цинковые пальцы [49].
PRODH (пролиндегидрогеназа 1) с локусом 22q11.21. Этот ген кодирует митохондриальный белок, пролиноксидазу, который катализирует первый этап деградации пролина [33].
DTNBP1 (дистробревин-связывающий белок 1) с локусом 6p22.3. Кодирует дисбиндин, ключевой компонент биогенеза комплекса органелл-1, связанного с лизосомами (BLOC-1), который регулирует транспорт белков по лизосомальному пути [16].
К общим найденным аллелям ШТР и БАР относится: CACNA1C (субъединица кальциевого потенциалзависимого канала альфа1 C) с локусом 12p13.3. Опосредует приток ионов кальция в цитоплазму и тем самым запускает высвобождение кальция из саркоплазмы [5].
Полученные данные представляют собой теоретическую отправную точку для последующих исследований влияния генетических факторов на этиологию данных заболеваний и для возможности применения нового формата оценки архитектуры генома.
Дата поступления:26.03.2025
Received: 26.03.2025
Принята к печати: 01.09.2025
Accepted: 01.09.2025
Автор заявляет об отсутствии конфликта интересов.
Author declares no conflicts of interest.
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№05 2025
Сетевой анализ генетических соотношений эндогенных психических расстройств №05 2025
Номера страниц в выпуске:4-9
Резюме
В статье рассматривается генетическая взаимосвязь между шизофренией, биполярным аффективным расстройством, шизоаффективным и шизотипическим расстройством с использованием сетевого анализа. В ходе исследования были рассмотрены 155 аллелей для шизофрении, 29 для БАР, 28 для шизоаффективного расстройства и 11 для шизотипического расстройства. Результаты показали наличие значительных генетических совпадений между расстройствами, включая 28 общих аллелей. Эти данные указывают на возможную генетическую связь между психотическими расстройствами. Несмотря на выявленные связи, многие генетические варианты остаются недостаточно исследованными, что затрудняет полное понимание генетической структуры этих расстройств. В заключение, статья подчеркивает необходимость дальнейших исследований для более глубокого понимания генетических основ эндогенных психических расстройств и их взаимосвязей.
Ключевые слова: сетевой анализ, генетика, шизофрения, биполярное аффективное расстройство, шизоаффективное расстройство, шизотипическое расстройство.
Для цитирования: В.В. Поспелова, Е.Ю. Абриталин, А.А. Краснов. Сетевой анализ генетических соотношений эндогенных психических расстройств. Психиатрия и психофармакотерапия. 2025; 5: 4–9. DOI: 10.62202/2075-1761-2025-27-5-4-9
В статье рассматривается генетическая взаимосвязь между шизофренией, биполярным аффективным расстройством, шизоаффективным и шизотипическим расстройством с использованием сетевого анализа. В ходе исследования были рассмотрены 155 аллелей для шизофрении, 29 для БАР, 28 для шизоаффективного расстройства и 11 для шизотипического расстройства. Результаты показали наличие значительных генетических совпадений между расстройствами, включая 28 общих аллелей. Эти данные указывают на возможную генетическую связь между психотическими расстройствами. Несмотря на выявленные связи, многие генетические варианты остаются недостаточно исследованными, что затрудняет полное понимание генетической структуры этих расстройств. В заключение, статья подчеркивает необходимость дальнейших исследований для более глубокого понимания генетических основ эндогенных психических расстройств и их взаимосвязей.
Ключевые слова: сетевой анализ, генетика, шизофрения, биполярное аффективное расстройство, шизоаффективное расстройство, шизотипическое расстройство.
Для цитирования: В.В. Поспелова, Е.Ю. Абриталин, А.А. Краснов. Сетевой анализ генетических соотношений эндогенных психических расстройств. Психиатрия и психофармакотерапия. 2025; 5: 4–9. DOI: 10.62202/2075-1761-2025-27-5-4-9
Network analysis of genetic relationships in endogenous mental disorders
V.V. Pospelova, E.Yu. Abritalin, A.A. KrasnovFederal State Budgetary Institution "V.A. Almazov National Medical Research Center" of the Ministry of Health of the Russian Federation, Saint Petersburg, Russia
Department of Psychiatry and Psychotherapy with the Clinic of the Faculty of Medicine
Abstract
This article examines the genetic interrelationship between schizophrenia, bipolar affective disorder, schizoaffective disorder, and schizotypal disorder using network analysis. The study analyzed 155 alleles associated with schizophrenia, 29 with bipolar disorder, 28 with schizoaffective disorder, and 11 with schizotypal disorder. The results revealed significant genetic overlaps among the disorders, including 28 shared alleles. These findings suggest a potential genetic connection between psychotic disorders. Despite the identified associations, many genetic variants remain underexplored, hindering a comprehensive understanding of the genetic architecture of these disorders. In conclusion, the article emphasizes the need for further research to deepen our understanding of the genetic foundations of endogenous mental disorders and their interrelationships.
Keywords: network analysis, genetics, schizophrenia, bipolar affective disorder, schizoaffective disorder, schizotypal disorder.
For citation: V.V. Pospelova, E.Yu. Abritalin, A.A. Krasnov. Network analysis of genetic relationships in endogenous mental disorders. Psychiatry and psychopharmacotherapy. 2025; 5: 4–9. DOI: 10.62202/2075-1761-2025-27-5-4-9
Введение
Основная проблема нозологического подхода в психиатрии заключается в том, что часто невозможно определить и классифицировать заболевания, этиология и патогенез которых неизвестны, то есть нет естественной основы для классификации, из-за чего таксоны плохо определяются и на клиническом уровне патокинетически переходят друг в друга. Проблему этого градиента может решить анализ психических расстройств как кластеров психопатологических состояний, имеющих в ряде случаев общность генетического спектра, а не дискретных патологических филогенетических категорий.Полифакторность психических расстройств не вызывает сомнений. В рамках такой поликазуальности выделяют генетические факторы (точечные полиморфизмы генов, вариации числа копий, эпистаз – влияние генов друг на друга). Несмотря на то, что только лишь генетические варианты и взаимосвязи вряд ли объяснят патогенез клинических вариантов психических расстройств, данный подход поможет уточнить патогенетические взаимосвязи эндогенных психических расстройств и оценить мишени для терапии и дальнейших исследований. Кроме того, обнаружение генетических ассоциаций может стать естественной основой для спектрального подхода, способствующего развитию дименсиональной оценки в диагностике эндогенных психических расстройств, и, возможно, определить мишени для терапии.
В современных системах классификации МКБ и DSM диагностический подход основан на критериях того или иного расстройства, которые включают в себя набор симптомов, течение и длительность заболевания, что приводит к значительной гетерогенности форм одного и того же расстройства настолько, что два разных пациента с одним диагнозом клинически могут не иметь ничего общего.
Одна из проблем психиатрии заключается в преобладании описательных диагностических критериев диагностики, основанных на клинико-психопатологическом подходе, результаты которого сильно зависят от личности врача, взглядов и представлений различных научных школ, что не способствует объективизации диагностического процесса. Критерии включения в системах классификации также не всегда специфичны для отдельных расстройств, что приводит к необходимости существования и критериев исключения [32].
В настоящее время принято выделять две основные диагностические категории психических расстройств, традиционно относимых к эндогенным: шизофрению и биполярное аффективное расстройство (БАР) [8].
Вопрос о континууме шизофрении и БАР остается предметом дискуссии довольно долгое время. Пересечение аффективного и шизоидного спектров отмечалось в различных публикациях [17, 22, 48]. Однако недостаточность знаний об этиопатогенезе психических заболеваний до сих пор не позволяет приблизиться к пониманию разнообразия феноменологических проявлений как внутри выделяемых спектров, так и в особенностях их взаимного перекреста, хотя именно такое спектральное пересечение клинико-психопатологической структуры заболеваний наиболее часто приводит к субъективной интерпретации диагноза [9]. Вместе с тем следует признать тот факт, что если эти диагностические категории представляют собой настоящие заболевания, то это должно подразумевать естественную границу или разрыв между расстройствами, и должна быть возможность идентифицировать этот разрыв или «точку редкости» [47].
Примерно у 50% пациентов с БАР наблюдаются галлюцинации, бред или расстройства мышления, в том числе и в период ремиссии, а у 33% пациентов с диагнозом «шизофрения» имеется аффективная симптоматика [7, 25]. Кроме того, есть сложности с установлением специфичности исхода данных расстройств: описываются как стойкие клинические ремиссии при исходе шизофрении, так и исходы БАР с хроническим прогрессирующим течением и неблагоприятным прогнозом. По современным представлениям, некоторые аффективные эпизоды также приводят к формированию когнитивного дефекта и ухудшению функционирования, предположительно за счет нейротоксичности, оксидативного стресса и воспаления [3]. Сходство между шизофренией и психотическим биполярным расстройством также существует в отношении биологических параметров, включая количество рецепторов дофамина D2, измеренное с помощью ПЭТ-КТ [31]. Нейроанатомические сходства определены по данным МРТ: при обоих заболеваниях структурные изменения серого и белого вещества преобладают в лобной, височной областях и лимбической системе, в зонах, отвечающих за интеграцию исполнительных, когнитивных и аффективных функций [12].
Таким образом, появляется все больше клинических, биохимических и морфологических данных, позволяющих представить эндогенные психические расстройства как широкий спектр: от легкой шизотипии до тяжелой шизофрении по оси выраженности шизофренической симптоматики и от шизофрении до БАР (с шизоаффективным расстройством в промежуточной позиции) по аффективной оси.
Подтверждение естественности спектрального подхода было получено в исследовании Keshavan M.S. с соавт. (2011): 762 пробанда с диагнозами «шизофрения», БАР и шизоаффективным расстройством (ШАР) были оценены по шизо-биполярной шкале, которая основывается на сумме трех показателей: относительная доля неаффективного психоза, степень маниакального синдрома и преобладающая полярность аффекта. Низкие баллы соответствовали симптомам и течению, наиболее напоминающим БАР, а высокие баллы – шизофрении. В получившемся распределении, 45% выборки находились в среднем диапазоне несмотря на то, что многие случаи были распределены по верхним и нижним границам. Т.е. было получено мультимодальное распределение со значительным перекрытием между шизофренией и БАР [21].
Генетическая связь шизофрении и БАР рассматривается как один из важных аспектов связи этих заболеваний. Так, вопрос о дискретности или непрерывности психоза может решиться нахождением биологической основы, генетических ассоциаций, учитывая, что оба расстройства имеют оценочную наследуемость 0,7-0,8 и рассматриваются как сложные расстройства с полигенной архитектурой. Феноменологический «перекрест» наблюдается и в наследственности: ряд семейных исследований показал, что среди членов семьи больного шизофренией выше вероятность обнаружения БАР, и наоборот, существуют примеры близнецовых исследований, в которых описываются однояйцевые близнецы, где у одного диагностирована шизофрения, а у второго БАР [30, 26]. Полногеномные ассоциативные исследования (GWAS) показали наличие общих полиморфизмов одного нуклеотида в ДНК, оказывающих влияние на вероятность возникновения как шизофрении, так и БАР [29].
Исследования генетического сцепления выявили области хромосом, где пересекаются гены, связанные с шизофренией и БАР, такие как 13q, 22q, 6q и 18. Однако сложности возникают из-за неоднозначности результатов и трудностей в оценке статистической значимости. Гипотеза о наличии локусов, влияющих на восприимчивость к обоим расстройствам, получает поддержку от сканирования генома с использованием семей, где преобладает ШАР биполярного типа. Наблюдения показывают общегеномную ассоциацию в 1q42 и предположительное сцепление в 22q11 как у семей с шизофренией, так и у семей с БАР [2]. Вариации одних и тех же генов также были найдены у пациентов с шизофренией и БАР, например: NRG1, ген белка дисбиндина (DTNBP1), DAOA, DISC1, COMT, BDNF [34, 38, 19, 43]. Таким образом, семейные, близнецовые исследования и найденные генетические ассоциации говорят о некоторой связи между заболеваниями.
Цель исследования: провести анализ генетической взаимосвязи шизофрении, биполярного аффективного расстройства, шизоаффективного и шизотипического расстройств с помощью методики сетевого анализа.
Задачи исследования:
1. Провести обзор существующих данных о генах, связанных с шизофренией, биполярным аффективным расстройством (БАР), шизоаффективным расстройством (ШАР) и шизотипическим расстройством (ШТР) для создания базы данных для дальнейшего анализа.
2. Применить методику сетевого анализа для визуализации взаимосвязей между идентифицированными генами и их локусами, связанными с психическими расстройствами.
3. Выявить и классифицировать локусы, связанные с шизофренией, БАР, ШАР и ШТР с целью определения их значимости и степени взаимосвязи между расстройствами.
4. Исследовать пересечения аллелей между различными расстройствами для выявления общих генетических факторов, способствующих развитию этих заболеваний.
5. Оценить степень генетической близости между шизофренией, БАР, ШАР и ШТР на основе полученных данных о локусах и аллелях.
Материалы и методы
Данные о генах и локусах получены из базы Online Mendelian Inheritance in Man (OMIM) по поисковым терминам «schizophrenia», «bipolar affliction disorder», «schizotypical disorder», «schizoaffective disorder». В анализ были включены 155 аллелей для шизофрении, 29 аллелей для БАР, 28 аллелей для ШАР, 11 аллелей для ШТР. Обработка данных была проведена с использованием Microsoft Excel. Работа выполнена при использовании программного обеспечения для сетевого анализа, визуализации и исследования всех видов графиков и сетей, Gephi.Результаты
В результате проведенного сетевого анализа методом графов было выявлено (рис. 1): 1 (0,5%) генетическое совпадение для всех четырех нозологий, 2 (0,9%) генетическое совпадение для БАР, ШАР и шизофрении, 20 (11%) общих аллелей для шизофрении и ШАР, 4 (7%) для ШАР и БАР, 5 (13%) для ШАР и ШТР, 7 (4%) для шизофрении и БАР, 5 (3,1%) для шизофрении и ШТР, 2 (5,3%) для ШТР и БАР. Статистические характеристики полученного графа: средняя степень 1,116; средняя взвешенная степень 1,481; модулярность 3, statistical inference 695,265; Eigenvector Centrality 0.003; узлов 187; ребер 277.
COMT – единственный аллель, найденный у всех четырех расстройств, находится на 22q11.21, кодирует катехол-О-метилтрансфераза, которая катализирует перенос метильной группы от S-аденозилметионина к катехоламинам, включая нейромедиаторы дофамин, адреналин и норадреналин. О-метилирование приводит к одному из основных путей деградации катехоламинов. Низкая активность фермента, вызванная мутацией, вероятно, связана с развитием психотических расстройств вследствие нарушения деградации дофамина [6].
BDNF с локусом 11p14.1 – общий аллель для шизофрении, БАР и ШАР, является фактором выживания, индуцируемым кортикальными нейронами и необходимым для выживания нейронов полосатого тела в головном мозге [4].
К общим найденным аллелям БАР и шизофрении относятся: GPR50, DRD3, DRD4, ADGRL1, SLC6A4.
GPR50 находится на Xq28, кодирует рецептор 50, связанный с G-белком, ингибирует функцию рецептора мелатонина 1А посредством гетеродимеризации, играет роль во многих процессах, включая регуляцию метаболизма, рост нейронов или миграцию клеток, дифференцировке нейрональных клеток-предшественников посредством активации сигнальных путей NOTCH и WNT/бета-катенин [18].
DRD3 находится на 3q13.31. Этот ген кодирует подтип D3 из пяти (D1-D5) дофаминовых рецепторов. Этот рецептор локализован в лимбических областях мозга, которые связаны с передачей дофамина [14].
DRD4 находится на 11p15.5, кодирует рецептор дофамина 4 типа [15].
ADGRL1 (рецептор L1, связанный с белком адгезии G) с локусом 19p13.12, кодирует члена семейства адгезивных трансмембранных рецепторов, связанных с G-белком [1].
SLC6A4 (член 4 семейства растворенных носителей 6) с локусом 17q11.2. Этот ген кодирует интегральный мембранный белок, который транспортирует серотонин из синаптических пространств в пресинаптические нейроны [45].
Общие аллели для шизофрении и ШАР: TAAR6, RBM12, SCZD1, HTR2A, DRD2, NRG3, RTN4R, SLC1A1, SHANK3, DAOA, NPY, SCZD2, SCZD8, RELN.
TAAR6 с локусом 6q23.2. Этот ген кодирует семитрансмембранный рецептор, связанный с G-белком, который, вероятно, функционирует как рецептор для эндогенных следовых аминов [46].
RBM12 с локусом 20q11.22. Этот ген кодирует белок, который содержит несколько РНК-связывающих мотивов, потенциальные трансмембранные домены и богатые пролином области. Связан с шизофренией 19 (SCZD19) [35].
SCZD1 с локусом 5q23-q35. Функция неизвестна [39].
HTR2A с локусом 13q14.2. Кодирует один из рецепторов серотонина [20].
DRD2 с локусом 11q23.2. Этот ген кодирует подтип D2 рецептора дофамина [13].
NRG3 с локусом 10q23.1. Этот ген кодирует нейрегулин 3 (NRG3) [28].
RTN4R с локусом 22q11.21. Этот ген кодирует рецептор ретикулона 4, олигодендроцитарного миелинового гликопротеина и миелин-ассоциированного гликопротеина. Этот рецептор опосредует ингибирование роста аксонов и может играть роль в регуляции регенерации и пластичности аксонов в центральной нервной системе взрослого человека [37].
SLC1A1 с локусом 9p24.2. Этот ген кодирует часть высокоаффинных переносчиков глутамата, которые играют важную роль в транспортировке глутамата через плазматические мембраны. В мозге эти транспортеры играют решающую роль в прекращении постсинаптического действия нейромедиатора глутамата и в поддержании его внеклеточных концентраций ниже нейротоксических уровней. Этот транспортер также транспортирует аспартат, и считается, что мутации в этом гене вызывают дикарбоксиликаминоацидурию, также известную как дефект транспорта глутамат-аспартат. Связан с шизофренией 18 (SCZD18) [44].
SHANK3 с локусом 22q13.33. Белки Shank представляют собой многодоменные каркасные белки постсинаптической мембраны, которые соединяют рецепторы нейромедиаторов, ионные каналы и другие мембранные белки с актиновым цитоскелетом и сигнальными путями, связанными с G-белком. Белки Shank также играют роль в формировании синапсов и созревании дендритных отростков. Мутации в этом гене являются причиной расстройства аутистического спектра (РАС), также вызывают шизофрению 15 (SCZD15) [42].
DAOA с локусом 13q22-q34. Этот ген кодирует белок, который может функционировать как активатор оксидазы D-аминокислот, которая разрушает глиотрансмиттер D-серин, мощный активатор глутаматных рецепторов N-метил-D-аспартатного (NMDA) типа. Исследования также показывают, что одна кодируемая изоформа может играть роль в функции митохондрий и ветвления дендритов [10].
NPY с локусом 7p15.3. Кодирует нейропептид Y [27].
SCZD2 с локусом 11q14-q21. Функция неизвестна. Связан с шизофренией 2 (SCZD2) [40].
SCZD8 с локусом 18p. Функция неизвестна. Связан с шизофренией 8 (SCZD8) [41].
RELN с локусом 7q22.1 Ген RELN кодирует рилин, большой секретируемый гликопротеин, который продуцируется определенными типами клеток развивающегося мозга и активирует сигнальный путь в постмитотически мигрирующих нейронах, необходимый для правильного позиционирования нейронов в слоистой паренхиме нервной системы [36].
Общие аллели для БАР и ШАР: MAFD1, MAFD2.
MAFD1 с локусом 18p. Функция неизвестна [23].
MAFD2 с локусом Xq28. Функция неизвестна [24].
К общим найденным аллелям ШТР, ШАР и шизофрении относятся: DISC1, ZNF804A, PRODH, DTNBP1.
DISC1 («Нарушенный при шизофрении-1») с локусом 1q42.2. Кодирует одноименный белок, который участвует в росте нейронов и развитии коры головного мозга посредством взаимодействия с другими белками, напрямую регулирует внутриклеточные сигнальные пути, синаптическую передачу, экспрессируется на мембранах митохондрий, участвует в регуляции транскрипции, внутриклеточного транспорта [11].
ZNF804A (белок цинковых пальцев 804A) с локусом 2q32.1. Белок, кодируемый этим геном, представляет собой белок, связывающий цинковые пальцы [49].
PRODH (пролиндегидрогеназа 1) с локусом 22q11.21. Этот ген кодирует митохондриальный белок, пролиноксидазу, который катализирует первый этап деградации пролина [33].
DTNBP1 (дистробревин-связывающий белок 1) с локусом 6p22.3. Кодирует дисбиндин, ключевой компонент биогенеза комплекса органелл-1, связанного с лизосомами (BLOC-1), который регулирует транспорт белков по лизосомальному пути [16].
К общим найденным аллелям ШТР и БАР относится: CACNA1C (субъединица кальциевого потенциалзависимого канала альфа1 C) с локусом 12p13.3. Опосредует приток ионов кальция в цитоплазму и тем самым запускает высвобождение кальция из саркоплазмы [5].
Заключение
В проведенном исследовании были проанализированы генетические взаимосвязи шизофрении, БАР, ШАР и ШТР с помощью методики сетевого анализа. Особенностью данной методики является наглядность и возможность мгновенной статистической оценки. Было идентифицировано в общей сложности 155 локусов при шизофрении и 29 при БАР, 28 при ШАР, 11 локусов при ШТР, из них 28 аллелей пересечений. Результаты исследования свидетельствуют о возможной генетической связи проанализированных расстройств. Степень генетической близости оказалась достаточно велика, даже несмотря на то, что не были учтены промежуточные фенотипы, так как генетические исследования в основном ориентированы на пациентов, у которых диагноз не вызывает сомнений. Кроме того, большинство генетических вариантов имеют малую мощность эффекта, поэтому их трудно определить в полногеномных исследованиях, в которых существует порог значимой мощности, а дороговизна полногеномных исследований не позволяет значимо увеличивать выборку, что снижает возможность выявления редких генетических вариантов. Поскольку множество генетических вариантов остались непроанализированными, можно было бы ожидать снижения точности исследования, чего, как уже было отмечено ранее, не произошло.Полученные данные представляют собой теоретическую отправную точку для последующих исследований влияния генетических факторов на этиологию данных заболеваний и для возможности применения нового формата оценки архитектуры генома.
Дата поступления:26.03.2025
Received: 26.03.2025
Принята к печати: 01.09.2025
Accepted: 01.09.2025
Автор заявляет об отсутствии конфликта интересов.
Author declares no conflicts of interest.
Список исп. литературыСкрыть список1. ADGRL1 Gene - GeneCards | AGRL1 Protein | AGRL1 Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl? gene=ADGRL1&keywords=ADGRL1 (дата обращения: 11.04.2024).
2. Badner J. A., Gershon E. S. Meta-analysis of whole-genome linkage scans of bipolar disorder and schizophrenia // Molecular Psychiatry. 2002. № 4 (7). C. 405-411.
3. Bauer I. E. [и др.]. The Link between Refractoriness and Neuroprogression in Treatment-Resistant Bipolar Disorder // Modern Trends in Pharmacopsychiatry. 2017. (31). C. 10-26.
4. BDNF Gene - GeneCards | BDNF Protein | BDNF Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl?gene=BDNF (дата обращения: 14.03.2024).
5. CACNA1C Gene - GeneCards | CAC1C Protein | CAC1C Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl? gene=CACNA1C&keywords=CACNA1C (дата обращения: 01.04.2024).
6. COMT Gene - GeneCards | COMT Protein | COMT Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl? gene=COMTkeywords=COMT (дата обращения: 14.03.2024).
7. Coryell W. [и др.]. The significance of psychotic features in manic episodes: a report from the NIMH collaborative study // Journal of Affective Disorders. 2001. № 1-3 (67). C. 79-88.
8. Craddock N., O’Donovan M. C., Owen M. J. The genetics of schizophrenia and bipolar disorder: dissecting psychosis // Journal of Medical Genetics. 2005. № 3 (42). C. 193-204.
9. Cuthbert B. N., Morris S. E. Evolving Concepts of the Schizophrenia Spectrum: A Research Domain Criteria Perspective // Frontiers in Psychiatry. 2021. (12). C. 641319.
10. DAOA Gene - GeneCards | DAOA Protein | DAOA Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl? gene=DAOA&keywords=DAOA (дата обращения:10.04.2024).
11. DISC1 Gene - GeneCards | DISC1 Protein | DISC1 Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl? gene=DISC1&keywords=disc1 (дата обращения: 14.04.2024).
12. Dobri M. L. [и др.]. The Limits between Schizophrenia and Bipolar Disorder: What Do Magnetic Resonance Findings Tell Us? // Behavioral Sciences (Basel, Switzerland). 2022. № 3 (12). C. 78.
13. DRD2 Gene - GeneCards | DRD2 Protein | DRD2 Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl?gene= §DRD2&keywords=DRD2 (дата обращения:10.04.2024).
14. DRD3 Gene - GeneCards | DRD3 Protein | DRD3 Antibody [Электронный ресурс]. URL:https://www.genecards.org/cgi-bin/carddisp.pl?gene=DRD3& amp;keywords=DRD3 (дата обращения:10.04.2024).
15. DRD4 Gene - GeneCards | DRD4 Protein | DRD4 Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl?gene= DRD4&keywords=drd4 (дата обращения:10.04.2024).
16. DTNBP1 Gene - GeneCards | DTBP1 Protein | DTBP1 Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl? gene=DTNBP1&keywords=DTNBP1 (дата обраще-ния: 10.04.2024).
17. Dunayevich E, Keck PE Jr. Prevalence and description of psychotic features in bipolar mania. Curr Psychiatry Rep. 2000 Aug;2(4):286-90. doi: 10.1007/s11920-000-0069-4. PMID: 11122970.
18. GPR50 Gene - GeneCards | MTR1L Protein | MTR1L Antibody [Электронный ресурс]. URL:https://www.genecards.org/cgi-bin/carddisp.pl? gene=GPR50&keywords=GPR50 (дата обращения:10.04.2024).
19. Hodgkinson C. A. [и др.]. Disrupted in Schizophrenia 1 (DISC1): Association with Schizophrenia, Schizoaffective Disorder, and Bipolar Disorder // American Journal of Human Genetics. 2004. № 5 (75). C. 862–872.
20. HTR2A Gene - GeneCards | HTR2A Protein | HTR2A Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl? gene=HTR2A&keywords=HTR2A (дата обращения:10.04.2024).
21. Keshavan M. S. [и др.]. A dimensional approach to the psychosis spectrum between bipolar disorder and schizophrenia: The Schizo-Bipolar Scale // Schizophrenia Research. 2011. № 1-3 (133). C. 250-254.
22. Kretschmer E (1914) Wahnbildung und manisch-depressiver Symptomenkomplex. Druck von Georg Reimer, Berlin.
23. MAFD1 Gene - GeneCards | MAFD1 Protein | MAFD1 Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl? gene=MAFD1&keywords=MAFD1 (дата обращения: 10.04.2024).
24. MAFD2 Gene - GeneCards | MAFD2 Protein | MAFD2 Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl? gene=MAFD2&keywords=MAFD2 (дата обращения: 10.04.2024).
25. Majadas S. [и др.]. Prevalence of depression and its relationship with other clinical characteristics in a sample of patients with stable schizophrenia // Comprehensive Psychiatry. 2012. № 2 (53). C. 145-151.
26. McGuffin P., Reveley A., Holland A. Identical triplets: non-identical psychosis? British Journal of Psychiatry, 1982, 140, 1-6.
27. NPY Gene - GeneCards | NPY Protein | NPY Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl?gene=NPY& amp;keywords=NPY (дата обращения:10.04.2024).
28. NRG3 Gene - GeneCards | NRG3 Protein | NRG3 Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl?gene= NRG3&keywords=NRG3 (дата обращения:10.04.2024).
29. O’Donovan M. C. [и др.]. Identification of loci associated with schizophrenia by genome-wide association and follow-up // Nature Genetics. 2008. № 9 (40). C. 1053-1055.
30. Os J. van, Guloksuz S. A critique of the “ultra‐high risk” and “transition” paradigm // World Psychiatry. 2017. № 2 (16). C. 200-206.
31. Pearlson G. D., [и др.] In Vivo D2 Dopamine Receptor Density in Psychotic and Nonpsychotic Patients with Bipolar Disorder // Archives of General Psychiatry. 1995. № 6 (52). C. 471-477.
32. Pearlson G. D., Etiologic, phenomenologic, and endophenotypic overlap of schizophrenia and bipolar disorder // Annual Review of Clinical Psychology, 2015, (11), C. 251-281.
33. PRODH Gene - GeneCards | PROD Protein | PROD Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl?
gene=PRODH&keywords=PRODH#publications (дата обращения: 14.02.2024).
34. Raybould R., [и др.] Bipolar disorder and polymorphisms in the dysbindin gene (DTNBP1) // Biological Psychiatry, 2005, № 7 (57), C. 696-701.
35. RBM12 Gene - GeneCards | RBM12 Protein | RBM12 Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl?gene= RBM12&keywords=RBM12 (дата обращения:10.04.2024).
36. RELN Gene - GeneCards | RELN Protein | RELN Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl?gene= RELN&keywords=RELN (дата обращения:10.04.2024).
37. RTN4R Gene - GeneCards | RTN4R Protein | RTN4R Antibody [Электронный ресурс]. URL:https://www.genecards.org/cgi-bin/carddisp.pl?gene= RTN4R&keywords=RTN4R (дата обращения:10.04.2024).
38. Schumacher J., [и др.] Examination of G72 and D-amino-acid oxidase as genetic risk factors for schizophrenia and bipolar affective disorder // Molecular Psychiatry, 2004, № 2 (9), C. 203–207.
39. SCZD1 Gene - GeneCards | SCZD1 Protein | SCZD1 Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl?gene= SCZD1&keywords=SCZD1 (дата обращения:10.04.2024).
40. SCZD2 Gene - GeneCards | SCZD2 Protein | SCZD2 Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl?gene= SCZD2&keywords=SCZD2 (дата обращения:10.04.2024).
41. SCZD8 Gene - GeneCards | SCZD8 Protein | SCZD8 Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl?gene= SCZD8&keywords=SCZD8 (дата обращения:10.04.2024).
42. SHANK3 Gene - GeneCards | SHANK3 Protein | SHANK3 Antibody [Электронный ресурс]. URL:https://www.genecards.org/cgibin/
carddisp.pl?gene=SHANK3&keywords=SHANK3 (дата обращения: 10.04.2024).
43. Shifman S., [и др.] COMT: a common susceptibility gene in bipolar disorder and schizophrenia // American Journal of Medical Genetics Part B, Neuropsychiatric Genetics: The Official Publication of the International Society of Psychiatric Genetics, 2004, № 1 (128B), C. 61-64.
44. SLC1A1 Gene - GeneCards | SLC1A1 Protein | SLC1A1 Antibody
[Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/ carddisp.pl?gene=SLC1A1&keywords=SLC1A1 (дата обращения: 10.04.2024).
45. SLC6A4 Gene - GeneCards | SC6A4 Protein | SC6A4 Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl?gene= SLC6A4&keywords=SLC6A4 (дата обращения: 04.04.2024).
46. TAAR6 Gene - GeneCards | TAAR6 Protein | TAAR6 Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl?gene= TAAR6 (дата обращения: 10.04.2024).
47. Yamada Y., [и др.] Specificity and continuity of schizophrenia and bipolar disorder: relation to biomarkers // Current Pharmaceutical Design. 2020. Т. 26, № 2. С. 191-200.
48. Zhang Z.F., [и др.] Clinicodemographic correlates of psychotic features in bipolar disorder: a multicenter study in China // BMC Psychiatry. 2023. Т. 23, № 1. С. 365.
49. ZNF804A Gene - GeneCards | Z804A Protein | Z804A Antibody [Электронный ресурс]. URL: https://www.genecards.org/cgi-bin/carddisp.pl? gene=ZNF804A&keywords=ZNF804A (дата обращения: 14.04.2024).

