Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
I.N. Rozochkin1, T.V. Agibalova1, S.A. Pozdniakov1, V.A. Ivanchenko1, A.E. Petukhov1, V.V. Smirnov2, A.V. Masyakin1
1 Moscow Research & Practical Centre on Addictions of The Moscow Department of Healthcare, Moscow, 109390, Russian Federation
2 National Research Center “Institute of Immunology of the Federal Medical-Biological Agency”, 115522, Moscow, Russian Federation
Abstract
The treatment of alcohol withdrawal syndrome (AWS) is a socially significant problem. However, the development of new methods such as pharmacogenetics opens new perspectives for therapy. This paper describes the results of clinical application of the determination of some polymorphic gene variants for predicting the effectiveness of benzodiazepine therapy and making an individual dosage of the active substance in comparison with patients of the control group, who were prescribed a standard dosage of benzodiazepine regardless of the results of the genetic study. The obtained positive results open great opportunities for further application in the therapy of SOA.
Keywords: alcohol withdrawal syndrome, alcoholism, pharmacogenetics, evaluation of pharmocodynamics, benzodiazepines, bromodihydrochlorophenylbenzodiazepine.
For citations: I.N. Rozochkin, T.V. Agibalova, S.A. Pozdniakov, V.A. Ivanchenko, A.E. Petukhov, V.V. Smirnov, A.V. Masyakin. A personalized approach to the therapy of patients with alcohol withdrawal syndrome based on the assessment of the influence of polymorphic variants of the CYP gene on the metabolism of benzodiazepines. Psychiatry and psychopharmacotherapy. 2025; 5: 35–39. DOI: 10.62202/2075-1761-2025-27-5-35-39
Введение
Вероятность возникновения абстинентных симптомов увеличивается с ростом потребления алкоголя. Во многих странах алкоголизм стоит на первом месте по сравнению с другими видами зависимости [1]. Для России злоупотребление алкоголем также является существенной проблемой. Несмотря на снижение потребления алкоголя в России за последнее десятилетие по данным официальной статистики, некоторые авторы предполагают, что алкоголь перешел в область нелегального производства и сбыта [2]. Это заключение сделано на основании данных официальной статистики, регистрирующей случаи, совершенные в состоянии алкогольного опьянения, которые возросли на пропорциональное значение (примерно 50%). Экономический ущерб вследствие смертности и инвалидности от негативных последствий алкоголя в РФ в три раза выше среднемировых значений [3].
При регулярном употреблении алкоголя и формировании зависимости развивается синдром отмены алкоголя (СОА), который приводит к трудностям в терапии алкоголизма. Лечение СОА направлено на снижение выраженности абстинентных симптомов и облегчение отказа от алкоголя. В настоящее время препаратами первой линии являются бензодиазепины.
Однако, как показывают исследования, фармакодинамика этих препаратов существенно отличается в зависимости от активности цитохромных ферментов [4, 5].
В данном исследовании было принято решение ограничиться следующими генами: CYP2C19*2, CYP2C19*17, CYP3A5*3, полиморфизмы которых могут отвечать как за ускоренный метаболизм бензодиазепинов в организме, так и способствовать замедлению элиминации [6].
Цель исследования – изучить влияние полиморфных вариантов CYP2C19*2, CYP2C19*17, CYP3A5*3 на равновесную концентрацию бензодиазепинов в рамках когортного рандомизированного контролируемого исследования.
Материалы и методы
Исследование проводилось на базе наркологического отделения №8 государственного бюджетного учреждения здравоохранения КФ «Московский научно-практический центр наркологии Департамента здравоохранения города Москвы».
Пациенты были отобраны в соответствии со следующими критериями.
Критерии включения:
1. Наличие письменного добровольного информированного согласия на участие в исследовании (от дееспособных пациентов);
2. Возраст пациентов старше 18 лет;
3. Мужской пол;
4. Установленный в соответствии с критериями Международной классификации болезней Десятого пересмотра (МКБ-10) диагноз «F10.30. Абстинентное состояние (синдром отмены) неосложненное, вызванное употреблением алкоголя»;
5. Начальные проявления СОА (длительность воздержания от употребления алкоголя, по крайней мере, в течение 8 часов, но не более 48 часов до включения в исследование);
6. Балл по международной шкале для оценки тяжести синдрома отмены алкоголя CIWA-Ar более 10.
Критерии исключения:
1. Наличие острых или декомпенсированных хронических соматических и неврологических заболеваний;
2. Проведение экстренных хирургических вмешательств в течение 30 дней, предшествующих включению в исследование;
3. Наличие в анамнезе других зависимостей, кроме зависимости от алкоголя и никотина;
4. Клиренс креатинина менее 50 мл/мин, концентрация креатинина в плазме крови более 1,5 мг/дл (133 мкмоль/л);
5. Масса тела менее 60 кг или более 100 кг;
6. Возраст 60 лет и более;
7. Наличие в рационе пациентов продуктов, ингибирующих или индуцирующих СYP3A5, и отказ от исключения их из рациона на момент участия в исследовании (грейпфрутовый сок, соя, зеленый чай, кофе, лимонник);
8. Наличие противопоказаний к применению бензодиазепиновых транквилизаторов.
Методы:
1. В ходе работы с пациентами был применен ряд шкал: международная шкала оценки тяжести состояния отмены алкоголя Клинического института фонда исследования зависимостей [7]; клиническая шкала оценки патологического влечения к алкоголю, визуально-аналоговая шкала патологического влечения, адаптированная Е.М. Крупицким (2012), шкала оценки побочного действия «Udvalg for Kliniske Undersogelser Scale» (UKU – 1987 год).
2. Оценка равновесных концентраций лекарственных средств в плазме будет осуществляться с помощью терапевтического лекарственного мониторинга с применением высокоэффективной жидкостной хроматографии с масс-спектрометрией с квадрупольным анализатором (ВЭЖХ МС/МС) ВЭЖХ МС/МС Agilent G1978B Multimode Sourcefor 6410 Triple Quad LC/MS.
3. ПЦР в режиме реального времени (real-timePCR) применялся для определения полиморфизмов CYP3A5*3 (6986A>G, rs77646), CYP2C19*2 (681G>A, rs4244285), CYP2C19*17 (-806C>T, rs12248560) и проводился на приборе Applied Biosystems StepOne Real-Time PCR System.
Результаты и обсуждение
В соответствии с критериями отбора в исследование было выбрано 100 человек, от 18 до 60 лет, находящиеся на стационарном лечении в государственном бюджетном учреждении здравоохранения КФ «Московский научно-практический центр наркологии Департамента здравоохранения города Москвы» в наркологическом отделении №8 с диагнозом «психические и поведенческие расстройства, вызванные употреблением алкоголя. Синдром отмены неосложненный (F 10.30)», имеющие следующие показания к применению бензодиазепиновых транквилизаторов: выраженная тревога, раздражительность, нарушения ночного сна, тремор, потливость, страдающих зависимостью от алкоголя. Эти пациенты в соответствии с рандомизацией методом конвертов были разделены на две группы: экспериментальную и контрольную, по 50 человек в каждой. В экспериментальной группе пациентам была назначена терапия, подобранная после анализа клинических и фармакогенетических данных; в контрольной пациенты получали стандартную терапию.
В таблицах 1 и 2 представлена социальная и клиническая характеристики пациентов.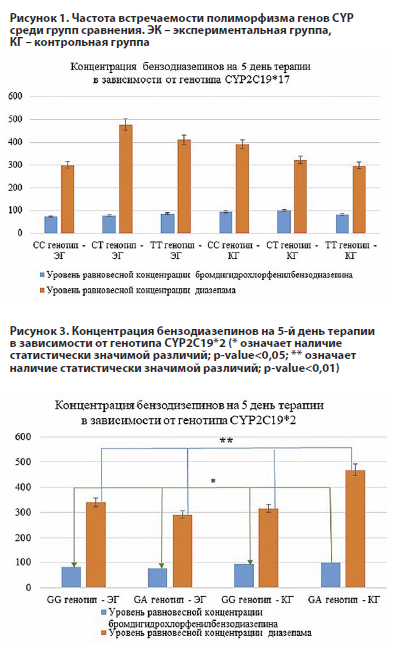
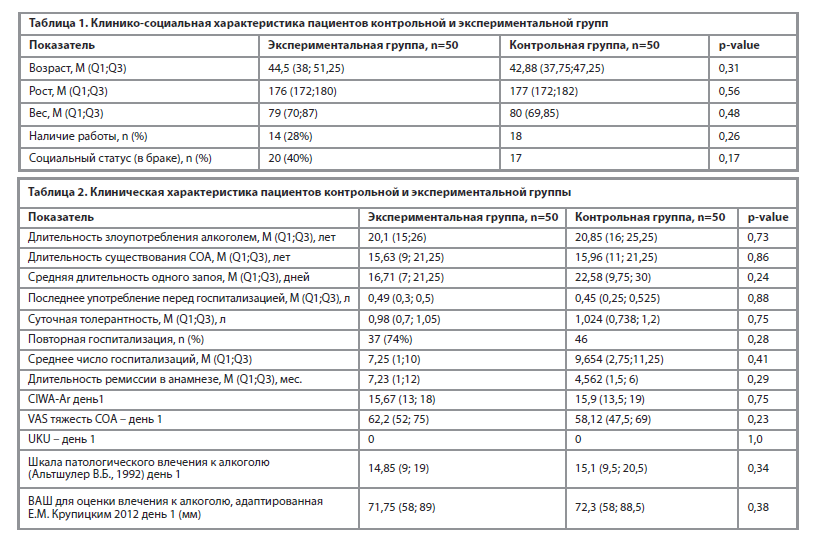
Всем пациентам было проведено real-timePCR для оценки полиморфизма выбранных генов CYP (см. рисунок 2).
Распределение генотипов соответствовало закону Харди-Вайнберга для европейской популяции (χ2=0,656, p=0,418).
• Число носителей немутантного генотипа CYP2C19*2 (генотип GG) составило – 35 (70%) и 36 (72%) для ЭК и КГ соответственно;
• Число гетерозиготных носителей полиморфизма 681G>A гена CYP2C19 (генотип GA) составило – 13 (26%) и 11 (22%);
• Число гомозиготных носителей полиморфизма 681G>A гена CYP2C19 (генотип AA) – 2 (4%) и 3 (6%).
Генотипирование CYP2C19 по полиморфизму -806C>T (rs12248560) у 50 пациентов с СОА показало следующий результат:
• Число гомозиготных носителей немутантного генотипа CYP2C19*17 (генотип CC) составило – 27 (54%) и 28 (56%);
• Число гетерозиготных носителей полиморфизма – 806C>T гена CYP2C19 (генотип CT) составило – 18 (36%) и 16 (32%);
• Число гомозиготных носителей полиморфизма – 806C>T гена CYP2C19 (генотип TT) – 5 (10%) и 6 (12%).
Результаты генотипирования CYP3A5*3 (6986A>G, rs77646):
• Число гомозиготных носителей немутантного генотипа GG составило – 3 (6%) и 1 (2%) пациента;
• Число гетерозиготных носителей генотипа GA составило – 8 и 1 (2%);
• Число носителей с генотипом АА – 39 (78%) и 48 (96%).
Как видно из таблицы 1 и рисунка 1, статистически значимых отличий между пациентами групп нет, что позволяет провести дальнейшее сравнение эффективности подбора терапии СОА бензодиазепинами на основании генетических особенностей пациентов.
Теоретически терапия бромдигидрохлорфенилбензодиазепином у носителей аллеля A должна сопровождаться ускорением наступления терапевтического эффекта и дальнейшим быстрым снижением ввиду высокой активности фермента [8]. Данное утверждение подтверждается при наблюдении за уровнем концентрации бензодиазепинов в контрольной группе. У пациентов этой группы уровень бромдигидрохлорфенилбензодиазепина на 5-й день терапии оказался статистически значимо выше (p<0,05) по сравнению с экспериментальной группой (ЭГ) (см. рисунок 3). В ЭГ пациентам была проведена предварительная корректировка дозировки в сторону снижения действующего вещества. Кроме того, выявлено статистически значимое различие (p<0,01) в уровне диазепама у пациентов контрольной группы с генотипом GA. Вероятно, это связано с высокой активностью ферментов CYP3A4 и CYP3A5, которые участвуют в фармакодинамике данного препарата.
Известно, что носители генотипа СС являются более медленными метаболизаторами бромдигидрохлорфенилбензодиазепина, чем носители генотипов СТ и ТТ [6, 9-11]. Данное утверждение подтверждается полученными данными: в экспериментальной группе концентрация действующего вещества в целом ниже, чем в контрольной, а уровень бромдигидрохлорфенилбензодиазепина в контрольной группе пациентов с генотипом СТ имеет тенденцию к повышению по сравнению с СС-генотипом (см. рисунок 4).
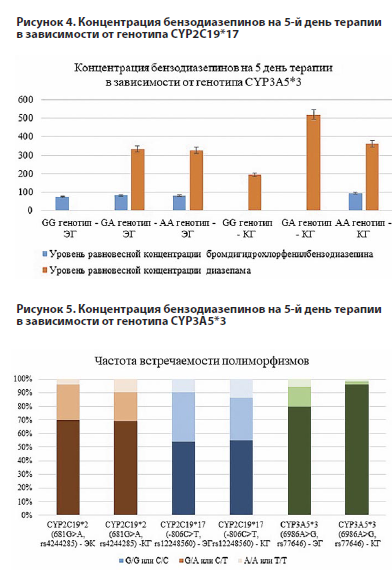 Однако получены данные по статистически значимому повышению концентрации диазепама на 5-й день лечения в экспериментальной группе пациентов с генотипом СТ, однозначного объяснения нет: вероятнее всего, это связано с синергизмом ферментов семейства цитохром и возможным формированием множественных полиморфизмов, а именно полиморфным вариантам с аллелью А в гене CYP3А5*3.
Однако получены данные по статистически значимому повышению концентрации диазепама на 5-й день лечения в экспериментальной группе пациентов с генотипом СТ, однозначного объяснения нет: вероятнее всего, это связано с синергизмом ферментов семейства цитохром и возможным формированием множественных полиморфизмов, а именно полиморфным вариантам с аллелью А в гене CYP3А5*3.
Далее на рисунке 5 приведены данные по концентрации действующих веществ в зависимости от генотипа CYP3А5*3.
Цитохром CYP3A отвечает за метаболизм бензодиазепинов из организма. Генотип GG ассоциирован с замедленной элиминацией действующего вещества и более выраженной терапевтической активностью, однако и повышенным риском развития побочных эффектов. Наличие аллели А в теории должно повышать скорость элиминации [12]. Однако подтверждающих данных не было получено, в том числе из-за малой частоты встречаемости некоторых генотипов в исследовательской популяции.
Заключение
Учет всех полиморфизмов цитохромных генов является довольно трудо- и финансово затратным при подборе терапии для пациентов с СОА. Однако выбор некоторых наиболее важных с фармокогенетической точки зрения позволит спрогнозировать эффективность фармакотерапии СОА и риск развития нежелательных побочных эффектов при назначении бензодиазепинов. Так, по данным проведенного исследования, получение данных за носительство А аллели в гене CYP2C19*2 может требовать снижения дозировки действующего вещества для повышения эффективности терапии. Несмотря на отсутствие статистически значимых различий, в отношении генотипа CYP2C19*17 отмечается тенденция к повышению концентрации при наличии Т аллели, что также требует индивидуального подбора начальной дозировки лекарственного препарата. В отношении элиминации бензодиазепинов в рамках проведенного исследования не получилось получить статистически значимые результаты по равновесной концентрации препаратов в группах сравнения из-за малой частоты встречаемости некоторых генотипов.
Фармакогенетический метод позволяет персонифицировать подход к лечению каждого пациента: на основании полученных данных у врача появляется возможность корректировать начальную дозировку препарата, приближаясь к идеальным значениям на основании активности индивидуальных метаболических путей.
Принята к печати: 02.09.2025
Accepted: 02.09.2025
Финансирование: Работа выполнена за счет финансирования государственного задания по выполнению программных мероприятий «Персонализированный подход к профилактике, диагностике, лечению и реабилитации пациентов с болезнями зависимости с целью совершенствования наркологической помощи» Программы Департамента здравоохранения г. Москвы «Научное обеспечение столичного здравоохранения» на 2023-2025 гг.
КОНФЛИКТ ИНТЕРЕСОВ: Автор заявляет об отсутствии конфликта интересов.
CONFLICT OF INTEREST: Author declares no conflicts of interest.
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№05 2025
Персонифицированный подход к терапии пациентов с синдромом отмены алкоголя на основе оценки влияния полиморфных вариантов гена CYP на метаболизм бензодиазепинов №05 2025
Номера страниц в выпуске:35-39
Резюме
Лечение синдрома отмены алкоголя (СОА) является социально значимой проблемой. Однако развитие новых методов, например фармакогенетики, открывает новые перспективы для терапии. В данной работе описываются результаты клинического применения определения некоторых полиморфных вариантов гена для прогнозирования эффективности терапии бензодиазепинами и составления индивидуальной дозировки действующего вещества в сравнении с пациентами контрольной группы, которым вне зависимости от результатов генетического исследования была назначена стандартная дозировка бензодиазепина. Полученные положительные результаты открывают большие возможности для дальнейшего применения в терапии СОА.
Ключевые слова: синдром отмены алкоголя, алкоголизм, фармакогенетика, оценка фармокадинамики, бензодиазепины, бромдигидрохлорфенилбензодиазепин.
Для цитирования: И.Н. Розочкин, Т.В. Агибалова, С.А. Поздняков, В.А. Иванченко, А.Е. Петухов, В.В.Смирнов, А.В. Масякин. Персонифицированный подход к терапии пациентов с синдромом отмены алкоголя на основе оценки влияния полиморфных вариантов гена CYP на метаболизм бензодиазепинов. Психиатрия и психофармакотерапия. 2025; 5: 35–39. DOI: 10.62202/2075-1761-2025-27-5-35-39
Лечение синдрома отмены алкоголя (СОА) является социально значимой проблемой. Однако развитие новых методов, например фармакогенетики, открывает новые перспективы для терапии. В данной работе описываются результаты клинического применения определения некоторых полиморфных вариантов гена для прогнозирования эффективности терапии бензодиазепинами и составления индивидуальной дозировки действующего вещества в сравнении с пациентами контрольной группы, которым вне зависимости от результатов генетического исследования была назначена стандартная дозировка бензодиазепина. Полученные положительные результаты открывают большие возможности для дальнейшего применения в терапии СОА.
Ключевые слова: синдром отмены алкоголя, алкоголизм, фармакогенетика, оценка фармокадинамики, бензодиазепины, бромдигидрохлорфенилбензодиазепин.
Для цитирования: И.Н. Розочкин, Т.В. Агибалова, С.А. Поздняков, В.А. Иванченко, А.Е. Петухов, В.В.Смирнов, А.В. Масякин. Персонифицированный подход к терапии пациентов с синдромом отмены алкоголя на основе оценки влияния полиморфных вариантов гена CYP на метаболизм бензодиазепинов. Психиатрия и психофармакотерапия. 2025; 5: 35–39. DOI: 10.62202/2075-1761-2025-27-5-35-39
A personalized approach to the therapy of patients with alcohol withdrawal syndrome based on the assessment of the influence of polymorphic variants of the CYP gene on the metabolism of benzodiazepines
I.N. Rozochkin1, T.V. Agibalova1, S.A. Pozdniakov1, V.A. Ivanchenko1, A.E. Petukhov1, V.V. Smirnov2, A.V. Masyakin1
1 Moscow Research & Practical Centre on Addictions of The Moscow Department of Healthcare, Moscow, 109390, Russian Federation
2 National Research Center “Institute of Immunology of the Federal Medical-Biological Agency”, 115522, Moscow, Russian Federation
Abstract
The treatment of alcohol withdrawal syndrome (AWS) is a socially significant problem. However, the development of new methods such as pharmacogenetics opens new perspectives for therapy. This paper describes the results of clinical application of the determination of some polymorphic gene variants for predicting the effectiveness of benzodiazepine therapy and making an individual dosage of the active substance in comparison with patients of the control group, who were prescribed a standard dosage of benzodiazepine regardless of the results of the genetic study. The obtained positive results open great opportunities for further application in the therapy of SOA.
Keywords: alcohol withdrawal syndrome, alcoholism, pharmacogenetics, evaluation of pharmocodynamics, benzodiazepines, bromodihydrochlorophenylbenzodiazepine.
For citations: I.N. Rozochkin, T.V. Agibalova, S.A. Pozdniakov, V.A. Ivanchenko, A.E. Petukhov, V.V. Smirnov, A.V. Masyakin. A personalized approach to the therapy of patients with alcohol withdrawal syndrome based on the assessment of the influence of polymorphic variants of the CYP gene on the metabolism of benzodiazepines. Psychiatry and psychopharmacotherapy. 2025; 5: 35–39. DOI: 10.62202/2075-1761-2025-27-5-35-39
Введение
Вероятность возникновения абстинентных симптомов увеличивается с ростом потребления алкоголя. Во многих странах алкоголизм стоит на первом месте по сравнению с другими видами зависимости [1]. Для России злоупотребление алкоголем также является существенной проблемой. Несмотря на снижение потребления алкоголя в России за последнее десятилетие по данным официальной статистики, некоторые авторы предполагают, что алкоголь перешел в область нелегального производства и сбыта [2]. Это заключение сделано на основании данных официальной статистики, регистрирующей случаи, совершенные в состоянии алкогольного опьянения, которые возросли на пропорциональное значение (примерно 50%). Экономический ущерб вследствие смертности и инвалидности от негативных последствий алкоголя в РФ в три раза выше среднемировых значений [3].
При регулярном употреблении алкоголя и формировании зависимости развивается синдром отмены алкоголя (СОА), который приводит к трудностям в терапии алкоголизма. Лечение СОА направлено на снижение выраженности абстинентных симптомов и облегчение отказа от алкоголя. В настоящее время препаратами первой линии являются бензодиазепины.
Однако, как показывают исследования, фармакодинамика этих препаратов существенно отличается в зависимости от активности цитохромных ферментов [4, 5].
В данном исследовании было принято решение ограничиться следующими генами: CYP2C19*2, CYP2C19*17, CYP3A5*3, полиморфизмы которых могут отвечать как за ускоренный метаболизм бензодиазепинов в организме, так и способствовать замедлению элиминации [6].
Цель исследования – изучить влияние полиморфных вариантов CYP2C19*2, CYP2C19*17, CYP3A5*3 на равновесную концентрацию бензодиазепинов в рамках когортного рандомизированного контролируемого исследования.
Материалы и методы
Исследование проводилось на базе наркологического отделения №8 государственного бюджетного учреждения здравоохранения КФ «Московский научно-практический центр наркологии Департамента здравоохранения города Москвы».
Пациенты были отобраны в соответствии со следующими критериями.
Критерии включения:
1. Наличие письменного добровольного информированного согласия на участие в исследовании (от дееспособных пациентов);
2. Возраст пациентов старше 18 лет;
3. Мужской пол;
4. Установленный в соответствии с критериями Международной классификации болезней Десятого пересмотра (МКБ-10) диагноз «F10.30. Абстинентное состояние (синдром отмены) неосложненное, вызванное употреблением алкоголя»;
5. Начальные проявления СОА (длительность воздержания от употребления алкоголя, по крайней мере, в течение 8 часов, но не более 48 часов до включения в исследование);
6. Балл по международной шкале для оценки тяжести синдрома отмены алкоголя CIWA-Ar более 10.
Критерии исключения:
1. Наличие острых или декомпенсированных хронических соматических и неврологических заболеваний;
2. Проведение экстренных хирургических вмешательств в течение 30 дней, предшествующих включению в исследование;
3. Наличие в анамнезе других зависимостей, кроме зависимости от алкоголя и никотина;
4. Клиренс креатинина менее 50 мл/мин, концентрация креатинина в плазме крови более 1,5 мг/дл (133 мкмоль/л);
5. Масса тела менее 60 кг или более 100 кг;
6. Возраст 60 лет и более;
7. Наличие в рационе пациентов продуктов, ингибирующих или индуцирующих СYP3A5, и отказ от исключения их из рациона на момент участия в исследовании (грейпфрутовый сок, соя, зеленый чай, кофе, лимонник);
8. Наличие противопоказаний к применению бензодиазепиновых транквилизаторов.

Методы:
1. В ходе работы с пациентами был применен ряд шкал: международная шкала оценки тяжести состояния отмены алкоголя Клинического института фонда исследования зависимостей [7]; клиническая шкала оценки патологического влечения к алкоголю, визуально-аналоговая шкала патологического влечения, адаптированная Е.М. Крупицким (2012), шкала оценки побочного действия «Udvalg for Kliniske Undersogelser Scale» (UKU – 1987 год).
2. Оценка равновесных концентраций лекарственных средств в плазме будет осуществляться с помощью терапевтического лекарственного мониторинга с применением высокоэффективной жидкостной хроматографии с масс-спектрометрией с квадрупольным анализатором (ВЭЖХ МС/МС) ВЭЖХ МС/МС Agilent G1978B Multimode Sourcefor 6410 Triple Quad LC/MS.
3. ПЦР в режиме реального времени (real-timePCR) применялся для определения полиморфизмов CYP3A5*3 (6986A>G, rs77646), CYP2C19*2 (681G>A, rs4244285), CYP2C19*17 (-806C>T, rs12248560) и проводился на приборе Applied Biosystems StepOne Real-Time PCR System.
Результаты и обсуждение
В соответствии с критериями отбора в исследование было выбрано 100 человек, от 18 до 60 лет, находящиеся на стационарном лечении в государственном бюджетном учреждении здравоохранения КФ «Московский научно-практический центр наркологии Департамента здравоохранения города Москвы» в наркологическом отделении №8 с диагнозом «психические и поведенческие расстройства, вызванные употреблением алкоголя. Синдром отмены неосложненный (F 10.30)», имеющие следующие показания к применению бензодиазепиновых транквилизаторов: выраженная тревога, раздражительность, нарушения ночного сна, тремор, потливость, страдающих зависимостью от алкоголя. Эти пациенты в соответствии с рандомизацией методом конвертов были разделены на две группы: экспериментальную и контрольную, по 50 человек в каждой. В экспериментальной группе пациентам была назначена терапия, подобранная после анализа клинических и фармакогенетических данных; в контрольной пациенты получали стандартную терапию.
В таблицах 1 и 2 представлена социальная и клиническая характеристики пациентов.

Всем пациентам было проведено real-timePCR для оценки полиморфизма выбранных генов CYP (см. рисунок 2).
Распределение генотипов соответствовало закону Харди-Вайнберга для европейской популяции (χ2=0,656, p=0,418).
• Число носителей немутантного генотипа CYP2C19*2 (генотип GG) составило – 35 (70%) и 36 (72%) для ЭК и КГ соответственно;
• Число гетерозиготных носителей полиморфизма 681G>A гена CYP2C19 (генотип GA) составило – 13 (26%) и 11 (22%);
• Число гомозиготных носителей полиморфизма 681G>A гена CYP2C19 (генотип AA) – 2 (4%) и 3 (6%).
Генотипирование CYP2C19 по полиморфизму -806C>T (rs12248560) у 50 пациентов с СОА показало следующий результат:
• Число гомозиготных носителей немутантного генотипа CYP2C19*17 (генотип CC) составило – 27 (54%) и 28 (56%);
• Число гетерозиготных носителей полиморфизма – 806C>T гена CYP2C19 (генотип CT) составило – 18 (36%) и 16 (32%);
• Число гомозиготных носителей полиморфизма – 806C>T гена CYP2C19 (генотип TT) – 5 (10%) и 6 (12%).
Результаты генотипирования CYP3A5*3 (6986A>G, rs77646):
• Число гомозиготных носителей немутантного генотипа GG составило – 3 (6%) и 1 (2%) пациента;
• Число гетерозиготных носителей генотипа GA составило – 8 и 1 (2%);
• Число носителей с генотипом АА – 39 (78%) и 48 (96%).
Как видно из таблицы 1 и рисунка 1, статистически значимых отличий между пациентами групп нет, что позволяет провести дальнейшее сравнение эффективности подбора терапии СОА бензодиазепинами на основании генетических особенностей пациентов.
Теоретически терапия бромдигидрохлорфенилбензодиазепином у носителей аллеля A должна сопровождаться ускорением наступления терапевтического эффекта и дальнейшим быстрым снижением ввиду высокой активности фермента [8]. Данное утверждение подтверждается при наблюдении за уровнем концентрации бензодиазепинов в контрольной группе. У пациентов этой группы уровень бромдигидрохлорфенилбензодиазепина на 5-й день терапии оказался статистически значимо выше (p<0,05) по сравнению с экспериментальной группой (ЭГ) (см. рисунок 3). В ЭГ пациентам была проведена предварительная корректировка дозировки в сторону снижения действующего вещества. Кроме того, выявлено статистически значимое различие (p<0,01) в уровне диазепама у пациентов контрольной группы с генотипом GA. Вероятно, это связано с высокой активностью ферментов CYP3A4 и CYP3A5, которые участвуют в фармакодинамике данного препарата.
Известно, что носители генотипа СС являются более медленными метаболизаторами бромдигидрохлорфенилбензодиазепина, чем носители генотипов СТ и ТТ [6, 9-11]. Данное утверждение подтверждается полученными данными: в экспериментальной группе концентрация действующего вещества в целом ниже, чем в контрольной, а уровень бромдигидрохлорфенилбензодиазепина в контрольной группе пациентов с генотипом СТ имеет тенденцию к повышению по сравнению с СС-генотипом (см. рисунок 4).
 Однако получены данные по статистически значимому повышению концентрации диазепама на 5-й день лечения в экспериментальной группе пациентов с генотипом СТ, однозначного объяснения нет: вероятнее всего, это связано с синергизмом ферментов семейства цитохром и возможным формированием множественных полиморфизмов, а именно полиморфным вариантам с аллелью А в гене CYP3А5*3.
Однако получены данные по статистически значимому повышению концентрации диазепама на 5-й день лечения в экспериментальной группе пациентов с генотипом СТ, однозначного объяснения нет: вероятнее всего, это связано с синергизмом ферментов семейства цитохром и возможным формированием множественных полиморфизмов, а именно полиморфным вариантам с аллелью А в гене CYP3А5*3.Далее на рисунке 5 приведены данные по концентрации действующих веществ в зависимости от генотипа CYP3А5*3.
Цитохром CYP3A отвечает за метаболизм бензодиазепинов из организма. Генотип GG ассоциирован с замедленной элиминацией действующего вещества и более выраженной терапевтической активностью, однако и повышенным риском развития побочных эффектов. Наличие аллели А в теории должно повышать скорость элиминации [12]. Однако подтверждающих данных не было получено, в том числе из-за малой частоты встречаемости некоторых генотипов в исследовательской популяции.
Заключение
Учет всех полиморфизмов цитохромных генов является довольно трудо- и финансово затратным при подборе терапии для пациентов с СОА. Однако выбор некоторых наиболее важных с фармокогенетической точки зрения позволит спрогнозировать эффективность фармакотерапии СОА и риск развития нежелательных побочных эффектов при назначении бензодиазепинов. Так, по данным проведенного исследования, получение данных за носительство А аллели в гене CYP2C19*2 может требовать снижения дозировки действующего вещества для повышения эффективности терапии. Несмотря на отсутствие статистически значимых различий, в отношении генотипа CYP2C19*17 отмечается тенденция к повышению концентрации при наличии Т аллели, что также требует индивидуального подбора начальной дозировки лекарственного препарата. В отношении элиминации бензодиазепинов в рамках проведенного исследования не получилось получить статистически значимые результаты по равновесной концентрации препаратов в группах сравнения из-за малой частоты встречаемости некоторых генотипов.
Фармакогенетический метод позволяет персонифицировать подход к лечению каждого пациента: на основании полученных данных у врача появляется возможность корректировать начальную дозировку препарата, приближаясь к идеальным значениям на основании активности индивидуальных метаболических путей.
Принята к печати: 02.09.2025
Accepted: 02.09.2025
Финансирование: Работа выполнена за счет финансирования государственного задания по выполнению программных мероприятий «Персонализированный подход к профилактике, диагностике, лечению и реабилитации пациентов с болезнями зависимости с целью совершенствования наркологической помощи» Программы Департамента здравоохранения г. Москвы «Научное обеспечение столичного здравоохранения» на 2023-2025 гг.
КОНФЛИКТ ИНТЕРЕСОВ: Автор заявляет об отсутствии конфликта интересов.
CONFLICT OF INTEREST: Author declares no conflicts of interest.
Список исп. литературыСкрыть список1. Cohen S.M., Alexander R.S., Holt S.R. The Spectrum of Alcohol Use: Epidemiology, Diagnosis, and Treatment. Med Clin North Am. 2022;106(1):43-60. doi:10.1016/j.mcna.2021.08.003
2. Гладкий Ю.Н., Байкова Е.В. "Гуманитарно-географические аспекты алкоголизма в России: внешние причины смерти и культура потребления спиртного" Гуманитарный вектор, vol. 13, no. 2, 2018, pp. 142-151.
3. Шматова Ю.Е. "Экономическая и статистическая оценка проблемы алкогольной зависимости в России (региональный аспект)" SocietyandSecurityInsights, vol. 2, no. 3, 2019, pp. 64-79.
4. Kember R.L., Vickers-Smith R., Zhou H. et al. Genetic Underpinnings of the Transition From Alcohol Consumption to Alcohol Use Disorder: Shared and Unique Genetic Architectures in a Cross-Ancestry Sample. Am J Psychiatry. 2023;180(8):584-593. doi:10.1176/appi.ajp.21090892
5. Liu X., Li Y. Genetic correlation for alcohol consumption between Europeans and East Asians. BMC Genomics. 2023;24(1):652. Published 2023 Oct 30. doi:10.1186/s12864-023-09766-8
6. Застрожин М.С., Сорокин А.С., Агибалова Т.В. и др. Имплементация системы поддержки принятия решений персонализации режима дозирования бромдигидрохлорфенилбензодиазепина у пациентов с синдромом отмены алкоголя, основанной на фармакогенетических биомаркерах. Медицинская генетика 2019; 18(1): 13-24.
7. Sullivan J.T., Sykora K., Schneiderman J., Naranjo C.A., Sellers E.M. Assessment of alcohol withdrawal: the revised clinical institute withdrawal assessment for alcohol scale (CIWA-Ar). Br J Addict. 1989;84(11):1353-1357. doi:10.1111/j.1360-0443.1989.tb00737.x
8. Skryabin V.Y., Zastrozhin M.S., Torrado M.V. et al. How do CYP2C19*2 and CYP2C19*17 genetic polymorphisms affect the efficacy and safety of diazepam in patients with alcohol withdrawal syndrome?. Drug MetabPersTher. 2020;35(1):/j/dmdi.2020.35.issue-1/dmpt-2019-0026/dmpt-2019- 0026.xml. Published 2020 Mar 5. doi:10.1515/dmpt-2019-0026
9. Скрябин В.Ю., Застрожин М.С., Гришина Е.А. и др. е"ВЗАИМОСВЯЗЬ ПОЛИМОРФИЗМА CYP2C19*17 С ПОКАЗАТЕЛЯМИ ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ ДИАЗЕПАМА У ПАЦИЕНТОВ С СИНДРОМОМ ОТМЕНЫ АЛКОГОЛЯ" Бюллетень сибирской медицины, vol. 18, no. 4, 2019, pp. 119-126.
10. Dean L. Diazepam Therapy and CYP2C19 Genotype. In: Pratt VM, Scott SA, Pirmohamed M, Esquivel B, Kattman BL, Malheiro AJ, eds. Medical Genetics Summaries. Bethesda (MD): National Center for Biotechnology Information (US); December 10, 2018.
11. Skryabin V.Y., Franck J., Lauschke V.M. et al. CYP3A4*22 and CYP3A5*3 impact efficacy and safety of diazepam in patients with alcohol withdrawal syndrome. Nord J Psychiatry. 2023;77(1):73-76. doi:10.1080/08039488. 2022.2065531
28 ноября 2025
Количество просмотров: 127

