Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
E.N. Morozov1, E.A. Smolarchuk1, S.A. Apollonova1, M.A. Kinkulkina1, N.N. Ivanets1, A.V. Ivashchenko2,
A.A. Ivashchenko3, A.A. Ivashchenko4, O.E. Morozova1, V.V. Tarasov1
1 Sechenov University of the Ministry of Health of Russia, Moscow, Russian Federation
2 KemDiv Inc., San Diego, USA
3 KhimRar Pharma LLC, Moscow, Russian Federation
4 Lomonosov Moscow State University, Moscow, Russian Federation
Abstract
The problem of pharmacotherapy safety is relevant in all areas of medicine for practitioners of any specialty, especially when several medications are prescribed simultaneously, and the frequency of adverse drug reactions increases significantly due to possible drug interactions, including at the metabolic level. During preclinical studies of the drug Aviandr (the name for the period of development CD-008-0045, INN maritupirdine), it was noted that the drug interacts with cytochromes P450 1A2, 2C19 and 2D6, and can probably be metabolized by these isoenzymes, as well as the fact that it can uncompetitively and reversibly inhibit cytochrome P450 2D6. A detailed study of the metabolism of Aviandr at the level of the cytochrome P450 system in the liver, as well as the possibility of its influence on the activity of this system, determined the design of this study. The study included 24 healthy volunteers aged 18 to 45 years. Taking into account the possible 40% non-inclusion of subjects based on the screening results and the need to involve 10 understudies, it was planned to screen up to 44 people in the study. The data obtained during the study allow us to conclude that Aviandr has a favorable safety profile and there is no significant drug interaction when taken together with Duloxetine, Metoprolol, Ciprofloxacin and Fluconazole, which are simultaneously not only substrates for the cytochrome P450 metabolizing system in the liver, but also drugs that can alter the metabolic activity of this system.
Keywords: aviandr, maritupirdine, research, safety, drug interactions, P-450.
For citations: E.N. Morozov, E.A. Smolarchuk, S.A. Apollonova, M.A. Kinkulkina, N.N. Ivanets, A.V. Ivashchenko, A.A. Ivashchenko, A.A. Ivashchenko,
O.E. Morozova, V.V. Tarasov. An open randomized clinical trial of the pharmacokinetics, drug interactions, and safety of co-administration of Aviandr and other medications in healthy volunteers. Psychiatry and psychopharmacotherapy. 2025; 5: 40–49. DOI: 10.62202/2075-1761-2025-27-5-40-49
Введение
Проблема безопасности комбинированной фармакотерапии актуальна во всех сферах медицины для практикующих врачей любых специальностей, особенно когда одномоментно назначаются несколько лекарственных препаратов – и частота неблагоприятных лекарственных реакций значительно возрастает в силу возможного межлекарственного взаимодействия, в том числе на уровне метаболизма. Однако клиническое мышление врача, как правило, в большей степени направлено на выбор наиболее эффективной комбинации лекарственных средств для усиления терапевтического эффекта или воздействия сразу на несколько клинических проявлений, нежели оценку безопасности такой комбинации. При проведении доклинических исследований лекарственного препарата Авиандр (название на период разработки CD-008-0045, МНН – маритупирдин) было отмечено, что препарат взаимодействует с цитохромами Р450 – 1А2, 2С19 и 2D6, и, вероятно, может метаболизироваться данными изоферментами [1]. Также на этапе доклинических исследований было выяснено, что маритупирдин неконкурентно и обратимо ингибирует цитохром Р450 2D6, что, теоретически, может привести к снижению активности данного изофермента и возрастанию концентраций других лекарственных препаратов, которые метаболизируются данным изоферментом (межлекарственное взаимодействие на уровне метаболизма). Далее в исследованиях фазы I и II было выявлено влияние полиморфизма цитохрома Р450 2D6 на фармакокинетические параметры препарата маритупирдинa: снижение активности изофермента CYP2D6 приводило к увеличению Cthrough и Cmax маритупирдинa и его метаболита от 2 до 5 раз. Учитывая данный профиль метаболизма препарата, было принято решение провести исследование межлекарственного взаимодействия с основными субстратами и ингибиторами изоферментов системы цитохромов Р450 – 1А2, 2С19 и 2D6 [2-5].
Новый лекарственный препарат Авиандр обладает мультитаргетной активностью, в частности способностью ингибировать адренергические, дофаминовые, серотониновые и гистаминовые рецепторы, что позволяет предполагать у препарата Авиандр наличие широкого терапевтического потенциала. Препарат Авиандр обладает очень высоким сродством к 5НТ7 рецепторам и меньшим сродством к 5-НТ6, 5-HT2A и 5-HT2C рецепторам, ингибирует рецепторы гистамина Н1 и альфа-адренорецепторы (α2A, α2B и α2C). Рецепторный профиль препарата Авиандр, характеризующийся высокой степенью ингибирования α2-адренорецепторов и 5-HT7,
5-HT2A и 5-HT2C рецепторов, демонстрирует сходство с рецепторным профилем препаратов группы норадренергических и специфических серотонинергических антидепрессантов (НаССА), что позволяет предположить наличие антидепрессивной активности. В проведенных ранее доклинических исследованиях было продемонстрировано, что препарат положительным образом влияет на когнитивные функции, имеет анксиолитический, антипсихотический, а также антидепрессивный потенциал, что дает обоснование его дальнейшему исследованию в качестве средства для лечения депрессии и тревожно-депрессивных расстройств [1].
Безопасность, переносимость и фармакокинетику препарата маритупирдин при однократном приеме в дозах
2 мг, 4 мг, 10 мг и 20 мг у здоровых добровольцев-мужчин изучали в рамках двух клинических исследований Фазы I. При однократном приеме его экспозиция линейно зависела от дозы препарата. Время достижения максимальной концентрации (Тmax) составило 1 час, период полувыведения (Т1/2) – около 8 часов.
В 2017 г. было проведено клиническое исследование фазы I с целью оценки безопасности возрастающих доз препарата маритупирдин при однократном и многократном дозировании. В исследовании изучались суточные дозы препарата маритупирдин 40 мг (20 мг два раза в день) и 60 мг
(20 мг три раза в день); длительность многократного приема составила 4 дня. Была отмечена связь уровня экспозиции препарата маритупирдин в крови с полиморфизмом CYP2D6. В каждой дозовой когорте из 4 добровольцев, принимавших маритупирдин, было выявлено по одному добровольцу, которого можно отнести к медленным метаболизаторам по CYP2D6, и чьи фармакокинетические (ФК) параметры значительно отличались от остальных добровольцев. Остаточная концентрация маритупирдинa стабилизировалась через 1-2 суток после начала регулярного приема препарата. Фактор накопления (Fc) составил 2,5 в когорте 40 мг и 2,1 в когорте 60 мг. При многократном приеме медиана Тmax CD-008-0045 составляла 0,4 часа в когорте 40 мг и 1,0 час в когорте 60 мг. Средний T1/2 составил 15,0±3,5 часа в когорте 40 мг и 9,9±3,2 часа в когорте 60 мг [1].
В 2018-2019 гг. было проведено клиническое исследование фазы II с целью оценки эффективности, безопасности, фармакокинетики, фармакогенетики и подбора дозы препарата маритупирдинa у пациентов с генерализованным тревожным расстройством (ГТР) в течение 8 недель терапии. В исследовании изучались суточные дозы препарата маритупирдинa мг (20 мг два раза в день) и 60 мг (20 мг три раза в день). Количество пациентов, достигших 50% снижения общего балла по шкале HARS на Неделе 8, составило 20/44 (45,5%) пациентов для группы маритупирдин 60 мг, 22 /41 (53,7%) пациента для группы маритупирдин 40 мг и 5/43 (11,6%) пациентов для группы Плацебо, что соответствует ожидаемой доле пациентов, ответивших на терапию для исследуемого препарата, а именно ≥17/39 (43,6%) [6].
В 2021-2022 гг. было проведено клиническое исследование фазы III «Эффективность и безопасность нового препарата Авиандр в лечении тревоги у пациентов с расстройством адаптации после перенесенной острой короновирусной инфекции».
Исследование показало эффективность маритупирдина в снижении интенсивности тревоги, продемонстрированы анксиолитический, антиастенический, антидепрессивный и прокогнитивный эффекты, а также повышение социальной активности пациентов. Ответили на терапию маритупирдином (снижение общего балла по шкале HAM-A ≥50%) 83,49% пациентов. Достигли ремиссии (сумма баллов по HAM-A ≤7) к 28 дню терапии 68,81% пациентов, по результатам отсроченного наблюдения (через 1 неделю после окончания терапии) – 79,8% пациентов [7].
Также в 2022 г. было завершено клиническое исследование фазы III по оценке эффективности и безопасности препарата Авиандр у пациентов с генерализованным тревожным расстройством. В ходе исследования препарат Авиандр продемонстрировал благоприятный профиль безопасности и эффективность по данным первичной и вторичным конечным точкам, что дает основания рассматривать его в качестве перспективного лекарственного препарата для лечения ГТР в инициальный и продолженный (противорецидивный) период терапии [8].
В связи с тем, что по данным доклинических и клинических исследований можно предположить, что препарат Авиандр является субстратом CYP1A2 и CYP2C19, а также субстратом и неконкурентным обратимым ингибитором CYP2D6 [1], было принято решение провести настоящее исследование с целью оценки межлекарственного взаимодействия препарата Авиандр с лекарственными препаратами, которые являются значимыми ингибиторами и субстратами для изоферментов системы цитохромов Р450 печени: дулоксетин (на уровне CYP2D6), метопролол (на уровне CYP2D6), ципрофлоксацин (на уровне CYP1A2) и флуконазол (на уровне CYP2C19). При этом, учитывая то, что в клинических исследованиях уже было показано влияние полиморфизма CYP2D6 на фармакокинетические параметры препарата Авиандр, – согласно рекомендациям по изучению межлекарственного взаимодействия, было принято решение не использовать сильный ингибитор CYP2D6. Для оценки межлекарственного взаимодействия с участием этого фермента был выбран умеренный ингибитор CYP2D6 – дулоксетин.
Материалы и методы
Клинические исследования были выполнены в соответствии с действующими правилами, стандартами и нормативными актами Российской Федерации.
Дизайн исследования
Настоящее исследование являлось открытым исследованием фармакокинетики, межлекарственных взаимодействий и безопасности совместного приема препарата Авиандр и других лекарственных препаратов у здоровых добровольцев.
Исследование было проведено в 1 российском исследовательском центре. Добровольцы были распределены в одну из следующих групп:
Группа 1. Авиандр/ Дулоксетин (Симбалта®) + Авиандр – 6 добровольцев;
Группа 2. Метопролол (Эгилок®)/ Метопролол (Эгилок®) + Авиандр – 6 добровольцев;
Группа 3. Авиандр/ Ципрофлоксацин (Ципролет®) + Авиандр – 6 добровольцев;
Группа 4. Авиандр/ Флуконазол (Дифлюкан®) + Авиандр – 6 добровольцев.
С учетом возможного 40%-го невключения по результатам скрининга и необходимости привлечения 10 дублеров, в исследовании планировалось провести скрининг до 44 человек. Субъекты, досрочно завершившие исследование в первые часы после приема исследуемого препарата, когда происходит процесс всасывания лекарственного препарата из желудочно-кишечного тракта (например, при возникновении рвоты), могли быть заменены по согласованию со Спонсором.
На этапе скрининга у всех добровольцев были получены образцы крови для оценки фармакогенетического анализа полиморфизма CYP2D6. В исследование включались добровольцы, относящиеся к группе «нормальных метаболизаторов» или «промежуточных метаболизаторов» по активности CYP2D6 по результатам фармакогенетического исследования.
Добровольцы, успешно прошедшие все процедуры скрининга и соответствующие критериям включения/невключения, были распределены в одну из четырех групп методом блочной рандомизации без стратификации в соотношении 1:1.
Для каждой группы добровольцев исследование состояло из следующих периодов: скрининга, периодов приема исследуемой терапии (Период 1 и Период 2), а также периода последующего наблюдения. В Период 1 добровольцы, в зависимости от группы, приняли исследуемый препарат однократно для последующей оценки исходных показателей фармакокинетики. Затем, в Период 2 добровольцы приняли комбинацию из двух исследуемых препаратов (в зависимости от группы терапии) для последующей оценки фармакокинетических параметров при совместном приеме исследуемых препаратов. Периоды 1 и 2 были разделены отмывочным интервалом.
Скрининг
После подписания Информационного листка и формы информированного согласия каждому добровольцу были проведены процедуры скрининга, включая сбор демографических данных и анамнеза, физикальный осмотр, измерение роста, массы тела, определение индекса массы тела (ИМТ), оценку жизненно важных показателей, электрокардиографию (ЭКГ), взятие биологического материала для серологического, биохимического и клинического анализов крови, фармакогенетического анализа, общего анализа мочи, теста на котинин, алкоголь и наркотики, теста на беременность у лиц женского пола, оценку сопутствующей терапии. По результатам данных, полученных на этапе скрининга, была проведена предварительная оценка соответствия критериям включения/ невключения.
Период исследуемой терапии, Период 1
Добровольцы, успешно прошедшие скрининг, были приглашены в День 0 для повторной оценки соответствия критериям включения/невключения по данным опроса, осмотра и проведенного лабораторно-инструментального обследования. Добровольцы, удовлетворяющие критериям включения и не имеющие критериев невключения, были рандомизированы и включены в исследование. Непосредственно до приема исследуемого препарата в День 1 была проведена оценка нежелательных явлений, сопутствующей терапии, жизненно важных показателей и результатов ЭКГ, а также произведен забор крови и мочи для лабораторного исследования безопасности, а также образца крови для ФК анализа.
Добровольцы приняли исследуемый препарат, соответствующий группе, в которую они распределены (Авиандр, 20 мг, 1 таблетка однократно – для группы 1, 3 и 4; и
Эгилок®, 50 мг, 1 таблетка однократно – для группы 2).
Добровольцы приняли исследуемые препараты перорально внутрь по 1 таблетке (за 30 минут до еды), запивая его необходимым количеством питьевой воды комнатной температуры (100 мл).
Для фармакокинетического анализа была получена серия образцов крови:
• в Группах 1, 3 и 4 (прием препарата Авиандр, 20 мг) – перед приемом исследуемого препарата, через 15 и 30 минут, через 1 час, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 6, 8, 8.5, 9, 9.5, 10, 12, 24 и 48 часов после приема исследуемого препарата;
• в Группе 2 (прием препарата Эгилок®, 50 мг) – перед приемом исследуемого препарата и через 15 и 30 минут, через 1 час, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 6, 8, 8.5, 9, 9.5, 10, 12, 24 и 48 часов после приема исследуемого препарата.
Добровольцы всех групп оставались под врачебным наблюдением в течение как минимум 24 часов после дозирования для отслеживания параметров безопасности и взятия крови для ФК анализа.
Через 24 часа (в День 2) во всех группах была проведена оценка нежелательных явлений, сопутствующей терапии, жизненно важных показателей, параметров ЭКГ и произведен забор образцов крови для ФК. Отмывочный период составил 7 дней после приема исследуемого препарата, что составляет более 20 периодов полувыведения для препарата Авиандр (T½ 8 часов), метаболита препарата Авиандр – М1 (T½ 4,7 часов) и метопролола (T½ 3-4 часа).
В День 3 добровольцам была проведена оценка нежелательных явлений, сопутствующей терапии, жизненно важных показателей, а также был выполнен забор биообразцов для ФК анализа через 48 часов после приема препарата.
Период исследуемой терапии, Период 2
Добровольцам для прохождения Периода 2 вечером в День 6 была проведена оценка нежелательных явлений, сопутствующей терапии, жизненно важных показателей, физикальный осмотр. Во время Периода 2 добровольцы также находились под врачебным наблюдением.
В День 7 добровольцы совместно с препаратом Авиандр приняли один из исследуемых препаратов, в соответствии с группой, в которую они были распределены. Непосредственно до приема препаратов была проведена оценка нежелательных явлений, сопутствующей терапии, жизненно важных показателей, параметров ЭКГ, произведен забор образцов крови и мочи для лабораторного исследования безопасности, тест на котинин, наркотики и алкоголь, тест на беременность, а также образца крови для ФК анализа.
В Периоде 2 добровольцы приняли комбинацию двух исследуемых препаратов, в соответствии с группой, в которую они были распределены:
Группа 1. Добровольцы приняли препарат Авиандр,
20 мг (1 таблетка) совместно с препаратом Симбалта®,
60 мг (1 капсула) однократно, за 30 минут до еды
Группа 2. Добровольцы приняли препарат Авиандр,
20 мг (1 таблетка) совместно с препаратом Эгилок®, 50 мг (1 таблетка) однократно, за 30 минут до еды
Группа 3. Добровольцы приняли препарат Авиандр,
20 мг (1 таблетка) совместно с препаратом Ципролет®,
500 мг (1 таблетка) однократно, за 30 минут до еды
Группа 4. Добровольцы приняли препарат Авиандр,
20 мг (1 таблетка) совместно с препаратом Дифлюкан®,
150 мг (1 капсула) однократно, за 30 минут до еды
Добровольцы принимали исследуемые препараты перорально внутрь по 1 таблетке или капсуле (за 30 минут до еды), запивая его необходимым количеством питьевой воды комнатной температуры (100 мл).
Для фармакокинетического анализа была получена серия образцов крови:
• в Группе 1 (совместный прием Симбалта®, 60 мг + Авиандр, 20 мг) – за 15 минут перед приемом исследуемого препарата , через 15 и 30 минут, через 1 час, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 6, 8, 8.5, 9, 9.5, 10, 12, 24 и 48 часов после приема исследуемого препарата;
• в Группе 2 (совместный прием Эгилок®, 50 мг + Авиандр, 20 мг) – за 15 минут перед приемом исследуемого препарата, через 15 и 30 минут, через 1 час, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 6, 8, 8.5, 9, 9.5, 10, 12, 24 и 48 часов после приема исследуемого препарата;
• в Группе 3 (Ципролет®, 500 мг + Авиандр, 20 мг) – за 15 минут перед приемом исследуемого препарата , через 15 и 30 минут, через 1 час, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 6, 8, 8.5, 9, 9.5, 10, 12, 24 и 48 часов после приема исследуемого препарата;
• в Группе 4 (Дифлюкан®, 150 мг + Авиандр, 20 мг) – за 15 минут перед приемом исследуемого препарата, через 15 и 30 минут, через 1 час, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 6, 8, 8.5, 9, 9.5, 10, 12, 24 и 48 часов после приема исследуемого препарата.
Добровольцы оставались под врачебным наблюдением в течение как минимум 24 часов после дозирования для отслеживания параметров безопасности и взятия крови для ФК анализа. В День 8 была проведена оценка нежелательных явлений, сопутствующей терапии, жизненно важных показателей, параметров ЭКГ и произведен забор крови для ФК анализа через 24 часа после приема исследуемого препарата.
В День 9 была проведена оценка нежелательных явлений, сопутствующей терапии, жизненно важных показателей, а также был произведен забор крови для ФК анализа через 48 часов после приема препарата и биообразцов для клинического и биохимического анализа крови, общего анализа мочи.
Период наблюдения
Период последующего наблюдения продлился до Дня 14, после которого исследование завершалось. На визите была проведена оценка нежелательных явлений, сопутствующей терапии, жизненно важных показателей, был выполнен тест на беременность для лиц женского пола.
Данные о нежелательных явлениях собирались до
30 дней после приема последней дозы исследуемого препарата или проведения последней процедуры по исследованию по возможным спонтанным сообщениям от добровольцев.
1.1. Продолжительность исследования
Каждый доброволец принимал участие в исследовании приблизительно 5 недель: Скрининг – 3 недели, Прием исследуемого препарата (Период 1, отмывка и Период 2) – 2 недели, и последующее наблюдение – 1 неделя.
1.2. Статистические методы
Анализ результатов исследования был проведен в соответствии с Планом статистического анализа. Для анализа данных безопасности и фармакокинетики были использованы методы описательной статистики.
Анализ фармакокинетики
Популяции для оценки фармакокинетики соответствуют все субъекты, получившие хотя бы одну дозу исследуемых препаратов, и для которых получен объем данных о концентрации исследуемых аналитов достаточный для оценки фармакокинетических параметров. ФК параметры были описаны с помощью методов описательной статистики. Оценка межлекарственных взаимодействий была проведена путем попарных сравнений ФК параметров для изучаемых аналитов.
С целью сравнения фармакокинетические параметры (в том числе AUC0-72, AUC0-inf, Cmax) были логарифмированы и оценены с использованием дисперсионного анализа (ANOVA) с фиксированными эффектами. Модель дисперсионного анализа включала следующие факторы: Последовательность, Испытуемые (фактор будет представлен в пределах данной последовательности), Период исследования и Препарат как источники вариации. Был проведен расчет 90% ДИ для отношения средних геометрических анализируемых ФК параметров (AUC0-72, AUC0-inf, Cmax), также для всех показателей, включая T1/2, были применены точечные критерии (парный t-тест), различие считалось статистически значимым при p<0,05.
Анализ конечных точек безопасности
Все добровольцы, которые получили хотя бы одну дозу исследуемого препарата, были включены в популяцию для анализа безопасности. Параметры безопасности были проанализированы при помощи описательной статистики. Все результаты статистической обработки данных были представлены в виде таблиц.
Все нежелательные явления были классифицированы в соответствии с терминологией MedDRA.
Число нежелательных явлений и серьезных нежелательных явлений, а также число и процент добровольцев с нежелательными явлениями и серьезными нежелательными явлениями были представлены в виде таблиц по классу систем органов и предпочтительному термину, по связи с препаратом и степени тяжести.
Были проанализированы результаты лабораторных исследований, включая любые изменения по сравнению с исходными. Отклонения от нормальных значений были обобщены в виде частотных таблиц. Сводные таблицы динамики лабораторных показателей были представлены по группам в соответствии с результатами, полученными на визитах, и сдвигом относительно исходного значения.
Были проанализированы жизненно важные показатели, включая клинически значимые изменения по сравнению с исходными. Отклонения от нормы были обобщены в виде частотных таблиц.
Непрерывные показатели были представлены средним значением, стандартным отклонением, медианой, минимальным и максимальным значением, 95% ДИ. Дискретные показатели – числом и процентом добровольцев.
Анализ результатов исследования был проведен в соответствии с Планом статистического анализа, который был разработан и утвержден до закрытия базы данных.
РЕЗУЛЬТАТЫ
Мониторинг данных по безопасности
Мониторинг данных по безопасности в ходе проведения исследования проводился в соответствии с требованиями протокола и Плана по безопасности и фармаконадзору в клиническом исследовании, версия 1.0 от 01 августа 2023 г.
Все нежелательные явления, выявленные в ходе проведения исследования по результатам физикального осмотра добровольцев, оценки жизненно важных показателей, проведения инструментальных (ЭКГ) и лабораторных обследований, по результатам жалоб добровольцев, были проанализированы врачами-исследователями, надлежащим образом зафиксированы в первичной документации и перенесены в электронную индивидуальную регистрационную карту.
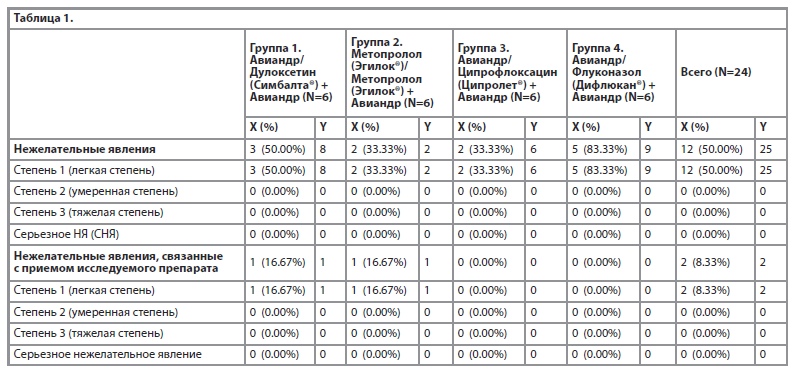
Общая статистика по развившимся нежелательным явлениям на фоне исследуемой терапии представлены в таблицах 1–4. Всего было выявлено 25 нежелательных явлений, развившихся у 12 добровольцев (50.00%). Было зарегистрировано 2 нежелательных явления у 2 (8.33%) добровольцев, которые имели возможную связь с исследуемым препаратом (таблица 1).
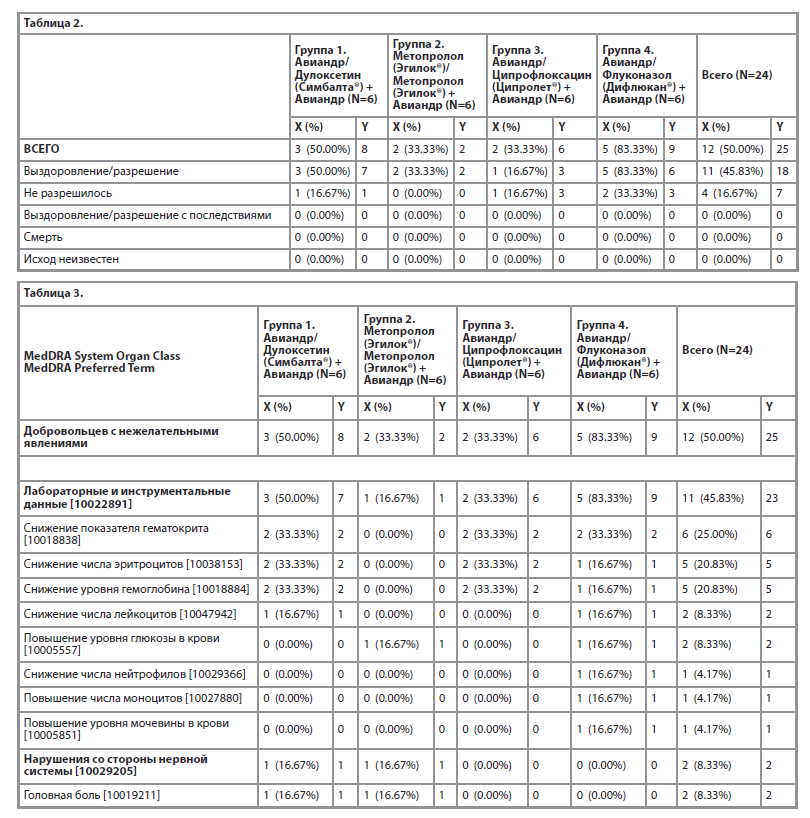
18 нежелательных явлений у 11 (45.83%) добровольцев разрешились, 7 нежелательных явлений у 4 (16.67%) остались неразрешенными, что представлено в таблице 2.
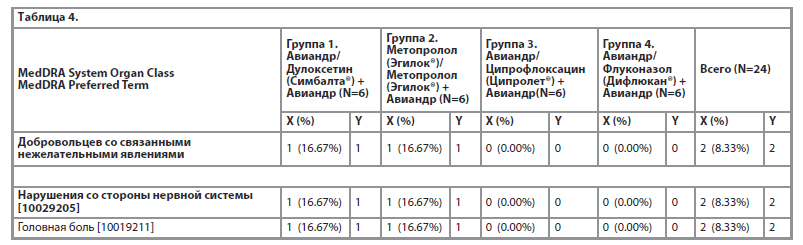
Все зарегистрированные на фоне исследуемой терапии нежелательные явления (TEAE) в течение основного периода исследования были представлены по системно-органному классу (MedDRA System Organ Class, SOC) и по предпочтительному термину (MedDRA Preferred Term, PT). Наибольшее число нежелательных явлений зафиксировано в категории лабораторные и инструментальные данные – 23 нежелательных явления у 11 (45.83%) добровольцев (таблица 3).
В таблице 4 представлены нежелательные явления, связанные с приемом исследуемого препарата, т.е. связанные или вероятно связанные с исследуемым препаратом.
Демографические данные и другие демографические
характеристики
В исследование были включены здоровые добровольцы мужского и женского пола в возрасте 18-45 лет включительно, соответствующие всем требованиям критериев включения и не имеющие критериев невключения. Средний возраст включенных в анализ добровольцев составил 27.38 ± 7.08 года, с минимальным значением 20 лет и максимальным значением 41 год, все добровольцы были европеоидной расы. В исследовании участвовали 9 (37.50%) мужчин и 15 (62.50%) женщин. Среднее значение индекса массы тела составило 22.79 ± 2.87 кг/м2.
Медицинский анамнез
В Группе 1 перенесенные заболевания отмечались у 3/6 (50.00%) добровольцев, в Группе 2 – у 2/6 (33.33%) добровольцев, в Группе 3 – у 5/6 (83.33%) добровольцев, в Группе 4 – у 3/6 (50.00%) добровольцев.
Анализ общемедицинского анамнеза составил 15 случаев перенесенных заболеваний у 13 (54.17%) добровольцев (перенесенные инфекции/инвазии).
Сопутствующие заболевания
У добровольцев не было зафиксировано активных сопутствующих заболеваний на момент включения в исследование.
Нежелательные явления, начавшиеся до приема
препарата
На момент скрининга у 3 (12.50%) добровольцев было зафиксировано 7 случаев нежелательных явлений. Эпизодов серьезных нежелательных явлений не зафиксировано.
ЭКГ в 12 отведениях
Данные о результатах оценки ЭКГ в 12 отведениях оценивались на протяжении всего исследования. Клинически значимых отклонений по параметрам ЭКГ не обнаружено.
Динамика лабораторных показателей за период
исследования
В общем анализе крови были обнаружены отклонения от нормы по параметрам Гемоглобин, Гематокрит, Эритроциты, Лейкоциты, Нейтрофилы (абс. знач.), Лимфоциты (абс. знач.), Моноциты (абс. знач.). Данные значения были зарегистрированы как нежелательные явления, развившиеся до начала приема исследуемого препарата, и нежелательные явления, развившиеся в период приема исследуемого препарата. Статистически значимые отклонения относительно временной точки Визита 0 (Скрининг, до приема исследуемого препарата) были выявлены для следующих клинико-лабораторных параметров:
• Гемоглобин в Период 2 / День 7 и Период 2 / День 9;
• Гематокрит в Период 1 / День 1 и Период 2 / День 7 и в Период 2 / День 9;
• Эритроциты в Период 1 / День 1, Период 2 / День 7 и в Период 2 / День 9;
• Нейтрофилы в Период 2 / День 7;
• Тромбоциты в Период 1 / День 1 и в Период 2 / День 7.
Данные отклонения могли быть связаны:
1. С общим снижением показателей в связи с заборами крови, которые приводят к незначительной кровопотере, которая, в свою очередь, отражается как раз в колебаниях показателей; не исключаются также и лабораторные погрешности. 2. С тем или иным влиянием исследуемых препаратов, что зафиксировано как нежелательные явления.
Необходимо отметить, что колебания уровня тромбоцитов не выходили за пределы референсных лабораторных норм и не были зафиксированы как нежелательные явления ни у одного из добровольцев.
Анализ данных фармакогенетики
В соответствии с критериями включения и по результатам проведенного фармакогенетического анализа в исследование были отобраны добровольцы, соответствующие группам «нормальные метаболизаторы» или «промежуточные метаболизаторы» по CYP2D6. При этом большинство добровольцев – 15 (62.50%) – соответствовало группе «нормальные метаболизаторы».
Анализ данных фармакокинетики
В исследовании была изучена фармакокинетика препаратов Авиандр и метопролола (Эгилок®) при однократном приеме (Период 1). В Периоде 2 было изучено влияние дулоксетина (Симбалта®), ципрофлоксацина (Ципролет®) и флуконазола (Дифлюкан®) на ФК параметры препарата Авиандр при их совместном приеме. Также в Периоде 2 было изучено влияние препарата Авиандр на ФК параметры метопролола при их совместном приеме.
В связи с фармакокинетическими профилями и периодами полувыведения, определение концентраций препарата Авиандр, его метаболита М1 и метопролола в Период 1 было выполнено в следующих точках: за 15 минут перед приемом исследуемого препарата через 15 и 30 минут, через 1, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 6, 8, 8.5, 9, 9.5, 10, 12, 24 и 48 часов после приема исследуемого препарата.
В Период 2 определение концентраций препарата Авиандр, его метаболита М1 и метопролола было выполнено в следующих точках: за 15 минут перед приемом исследуемого препарата, через 15 и 30 минут, через 1, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 6, 8, 8.5, 9, 9.5, 10, 12, 24 и 48 часов после приема исследуемого препарата.
Пробы были проанализированы с помощью валидированных методов ВЭЖХ-МС/МС с нижним пределом количественного определения (НПКО) 6.25 пг/мл для препарата Авиандр, 10.0 пг/мл для метаболита препарата Авиандр (М1), и 1.00 нг/мл для метопролола.
Фармакокинетический и статистический анализ проводился с помощью программного обеспечения Phoenix™ WinNonlin® (CERTARA, Pharsight, США) v. 8.2.
Статистический анализ включал в себя следующие процедуры: вычисление базовой и порядковой статистики, дисперсионный анализ, графические методы, вычисление доверительных интервалов.
Полученные данные были подвергнуты статистической обработке. Рассчитывали следующие описательные статистики: среднее арифметическое значение (Mean), среднее геометрическое (GMean), коэффициент вариации (CV%) и стандартное отклонение (SD).
С помощью дисперсионного анализа (ANOVA; параметрический метод) оценивали различия между средними значениями фармакокинетических параметров при 5% уровне значимости. В связи с тем, что в исследовании не проводилось рандомизации добровольцев по параметрам Последовательность и Период, а также в связи с невозможностью расчета неопределенности фактора Испытуемые (фактор в пределах последовательности) из-за отсутствия рандомизации добровольцев по фактору Последовательность, сравнение фармакокинетических параметров проводилось по единственному фактору, вносящему неопределенность в модель, – Препарат.
Полученная с помощью дисперсионного анализа оценка остаточной вариации использовалась для расчета доверительных интервалов для отношений средних значений соответствующих основных фармакокинетических параметров: AUC0-t и Сmax (максимальное значение концентрации препарата в крови).
Вычисляли параметрические двухсторонние 90% доверительные интервалы для отношений соответствующих средних значений изучаемых параметров фармакокинетики для исследуемого препарата и препарата сравнения.
Статистическая проверка состояла в сравнении средних значений основных фармакокинетических параметров, выбранных в качестве критерия отсутствия отличий между группами (AUC0-t, AUC0-∞ и Сmax).
В исследовании фармакокинетических параметров препарата Авиандр (равно как и метаболита препарата Авиандр М1, и препарата метопролол) нулевая гипотеза состояла в том, что сравниваемые параметры неравны, тогда соответствующая ей альтернативная гипотеза состояла в том, что параметры равны.
По результатам фармакокинетического исследования и проведенного дисперсионного анализа были сформулированы следующие выводы:
1. Совместный прием ингибитора CYP2D6 дулоксетина с препаратом Авиандр не привел к значимым изменениям важнейших фармакокинетических параметров препарата Авиандр – Cmax (p-value = 0.931318), AUC0→t (p-value = 0.872240), AUC0→∞ (p-value = 0.841821) и его метаболита – Cmax (p-value = 0.930911), AUC0→t (p-value = 0.896252), AUC0→∞ (p-value = 0.917490).
2. Совместный прием препарата Авиандр с метопрололом (субстрат CYP2D6) не привел к значимым изменениям важнейших фармакокинетических параметров метопролола – Cmax (p-value = 0.940793), AUC0→t (p-value = 0.396004), AUC0→∞ (p-value = 0.426238).
3. Совместный прием ингибитора CYP1A2 ципрофлоксацина с препаратом Авиандр не привел к значимым изменениям важнейших фармакокинетических параметров препарата Авиандр – Cmax (p-value = 0. 850976), AUC0→t (p-value = 0.632276), AUC0→∞ (p-value = 0.693135) и его метаболита – Cmax (p-value = 0.593208), AUC0→t (p-value = 0.477462), AUC0→∞ (p-value = 0.444838).
4. Совместный прием ингибитора CYP2C19 флуконазола с препаратом Авиандр не привел к значимым изменениям важнейших фармакокинетических параметров препарата Авиандр – Cmax (p-value = 0.197276), AUC0→t (p-value = 0.754190), AUC0→∞ (p-value = 0.763008) и его метаболита – Cmax (p-value = 0.324929), AUC0→t (p-value = 0.202006), AUC0→∞ (p-value = 0.435705).
Таким образом, совместный прием препарата Авиандр с ингибиторами системы цитохромов Р450 (CYP2D6, CYP1A2, CYP2C19) не изменяет показатели фармакокинетических параметров препарата Авиандр и его метаболита (М1). А совместный прием препарата Авиандр с метопрололом не изменяет показатели фармакокинетических параметров метопролола (который является субстратом цитохрома CYP2D6).
Анализ данных безопасности
В ходе данного исследования препарат Авиандр в дозе 20 мг продемонстрировал благоприятный профиль безопасности и хорошую переносимость во всех исследуемых группах.
Всего было выявлено 25 нежелательных явлений, развившихся у 12 добровольцев (50.00%). При этом в Группе 1 у 3 (50%) добровольцев было зарегистрировано 8 нежелательных явлений, в Группе 2 – у 2 (33.33%) добровольцев было зарегистрировано 2 нежелательных явления, в Группе 3 – у 2 (33.33%) добровольцев было зарегистрировано
6 нежелательных явлений, в Группе 4 – у 5 (83.33%) добровольцев было зарегистрировано 9 нежелательных явлений.
Наибольшее число нежелательных явлений зафиксировано в категории Лабораторные и инструментальные данные – 23 нежелательных явления у 11 (45.83%) добровольцев, которые были легкой степени тяжести, не сопровождались клиническими симптомами, маловероятно связанные с приемом исследуемого препарата. Следует отметить, что случаи снижения показателей «красной крови» наблюдались у добровольцев женского пола и, вероятно, могли быть связаны с менструальным циклом или невыявленными гинекологическими заболеваниями в анамнезе. Всего в исследовании было зарегистрировано 2 нежелательных явления у 2 (8.33%) добровольцев, которые имели возможную связь с исследуемым препаратом и оба представляли собой случаи головной боли. Так, головная боль была зарегистрирована в День 7 у добровольца 01-38 группы 1 (Авиандр/ Дулоксетин + Авиандр) и у добровольца 01-07 группы 2 (Метопролол/ Метопролол + Авиандр), эта головная боль была легкой степени тяжести, не потребовала какого-либо лечения и разрешилась в день возникновения.
Случаи возникновения головной боли регистрировались у добровольцев в день совместного приема препарата Авиандр с препаратом, затрагивающим норадренергическую передачу в центральной нервной системе, в одном случае, и препаратом, затрагивающим адренергическую систему и влияющим на сердечно-сосудистую систему, в другом случае. Необходимо отметить, что реакции в виде головной боли описаны в инструкциях по медицинскому применению как для препарата Авиандр, так и для препаратов Дулоксетин и Метопролол. Учитывая отсутствие межлекарственного взаимодействия препаратов на уровне метаболизма, что описано выше, можно предположить, что головная боль могла быть связана с приемом достаточно высоких разовых доз препаратов (60 мг для Дулоксетина и 50 мг для Метопролола) у здоровых добровольцев.
Жизнеугрожающих, серьезных нежелательных явлений, в ходе исследования зарегистрировано не было. Лабораторные показатели, кроме тех, которые были представлены и обсуждены выше, а также жизненно важные показатели и данные ЭКГ в течение исследования не продемонстрировали каких-либо системных тенденций.
ЗАКЛЮЧЕНИЕ
По результатам проведенного комплексного анализа можно сделать вывод, что совместный прием препарата Авиандр с ингибиторами цитохромов Р450 (CYP2D6, CYP1A2, CYP2C19) не изменяет показатели фармакокинетических параметров препарата Авиандр и его метаболита (М1).
Совместный прием препарата Авиандр с Метопрололом не изменяет показатели фармакокинетических параметров субстрата CYP2D6 (метопролола), что может свидетельствовать в пользу того, что препарат Авиандр не является значимым ингибитором/ индуктором изофермента 2D6 системы цитохромов Р450 в печени.
В ходе исследования был продемонстрирован благоприятный профиль безопасности препарата Авиандр при совместном приеме с препаратами Дулоксетин, Метопролол, Ципрофлоксацин и Флуконазол в силу отсутствия значимого межлекарственного взаимодействия, что может быть значимым для клинической практики при совместном назначении лекарственных препаратов, а именно:
1. Совместный прием препарата Авиандр не приводит к клинически значимым проявлениям межлекарственного взаимодействия (в том числе связанным с усилением серотонинергической передачи) при приеме с препаратом группы селективного захвата серотонина и норадреналина (дулоксетин).
2. Препарат Авиандр не приводит к значимому изменению фармакокинетических параметров Метопролола (препарата из группы бета-адреноблокаторов) при их совместном приеме, что может учитываться при подборе дозы препаратов из группы бета-блокаторов.
3. При приеме препарата Авиандр с препаратом Ципрофлоксацин также не возникали клинически значимые проявления межлекарственного взаимодействия или нежелательные реакции, в том числе удлинение интервала QT.
4. Учитывая тот факт, что Флуконазол, помимо ингибирования CYP2C19, также является и ингибитором P-гликопротеина кишечника [11], можно предположить, что параметры всасывания препарата Авиандр не зависят от снижения активности системы P-гликопротеина, что может наблюдаться у пациентов пожилого возраста.
Дата поступления:29.08.2025
Received: 29.08.2025
Принята к печати: 22.09.2025
Accepted: 29.09.2025
Автор заявляет об отсутствии конфликта интересов.
Author declares no conflicts of interest.
Автор, ответственный за переписку: Е.Н. Морозов
The author responsible for the correspondence: E.N. Morozov
КОНФЛИКТ ИНТЕРЕСОВ: Идея разработки препарата Авиандр и зарегистрированные права на этот препарат принадлежат авторам статьи А.В. Иващенко и А.А. Иващенко.
CONFLICT OF INTEREST: The idea of developing Aviander and the registered rights to this drug belong to the authors of the article A.V. Ivashchenko and A.A. Ivashchenko.
ФИНАНСИРОВАНИЕ: Результаты представленной работы достигнуты в ходе реализации проекта с использованием мер государственной поддержки развития кооперации российских образовательных организаций высшего образования, государственных научных учреждений и организаций реального сектора экономики, реализующих комплексные проекты по созданию высокотехнологичного производства, предусмотренных постановлением Правительства Российской Федерации от 9 апреля 2010 г. № 218. Работа выполнена в рамках соглашения с Минобрнауки России о предоставлении субсидии № 075-11-2023-016 от 28 февраля 2023 г. по теме «Создание высокотехнологичного производства активной фармацевтической субстанции инновационного лекарственного средства для комплексной терапии тревожных и депрессивных расстройств, в том числе ассоциированных с перенесенным COVID-19 и последствий участия в специальной военной операции».
FINANCING: The results of the presented work were achieved during the implementation of the project using measures of state support for the development of cooperation between Russian educational institutions of higher education, state scientific institutions and organizations of the real sector of the economy implementing complex projects to create high-tech production, provided for by Decree of the Government of the Russian Federation dated April 9, 2010 No. 218. The work was carried out within the framework of an agreement with the Ministry of Education and Science of the Russian Federation on Grant No. 075-11-2023-016 dated February 28, 2023 on the topic "Creation of a high-tech production of the active pharmaceutical substance of an innovative drug for the complex therapy of anxiety and depressive disorders, including those associated with COVID-19 and the consequences of participation in a special military operation."
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№05 2025
Открытое рандомизированное клиническое исследование фармакокинетики, межлекарственных взаимодействий и безопасности совместного приема препарата Авиандр и других лекарственных препаратов у здоровых добровольцев №05 2025
Номера страниц в выпуске:40-49
Резюме
Проблема безопасности фармакотерапии актуальна во всех сферах медицины для практикующих врачей любых специальностей, особенно когда одномоментно назначаются несколько лекарственных препаратов – и частота неблагоприятных лекарственных реакций значительно возрастает в силу возможного межлекарственного взаимодействия, в том числе на уровне метаболизма. При проведении доклинических исследований лекарственного препарата Авиандр (название на период разработки CD-008-0045, МНН – маритупирдин) было отмечено, что препарат взаимодействует с цитохромами Р450 1А2, 2С19 и 2D6, и, вероятно, может метаболизироваться данными изоферментами, а также тот факт, что он может неконкурентно и обратимо ингибировать цитохром Р450 2D6. Детальное изучение метаболизма препарата Авиандр на уровне системы цитохромов Р450 в печени, а также возможность его влияния на активность этой системы определило дизайн настоящего исследования. В исследование было включено 24 здоровых добровольцев в возрасте от 18 до 45 лет. С учетом возможного 40%-го невключения субъектов по результатам скрининга и необходимости привлечения 10 дублеров, в исследовании планировалось провести скрининг до 44 человек.
Полученные в ходе исследования данные позволяют сделать вывод о благоприятном профиле безопасности препарата Авиандр и отсутствии значимого межлекарственного взаимодействия при его совместном приеме с препаратами Дулоксетин, Метопролол, Ципрофлоксацин и Флуконазол, которые одновременно являются не только субстратами для метаболизирующей системы цитохромов Р450 в печени, но и лекарственными препаратами, которые могут изменять метаболическую активность этой системы.
Ключевые слова: авиандр, маритупирдин, исследование, безопасность, лекарственные взаимодействия, Р 450.
Для цитирования: Е.Н. Морозов, Е.А. Смолярчук, С.А. Апполонова, М.А. Кинкулькина, Н.Н. Иванец, А.В. Иващенко, А.А. Иващенко, А.А. Иващенко, О.Е. Морозова, В.В. Тарасов. Открытое рандомизированное клиническое исследование фармакокинетики, межлекарственных взаимодействий и безопасности совместного приема препарата Авиандр и других лекарственных препаратов у здоровых добровольцев. Психиатрия и психофармакотерапия. 2025; 5: 40–49. DOI: 10.62202/2075-1761-2025-27-5-40-49
Проблема безопасности фармакотерапии актуальна во всех сферах медицины для практикующих врачей любых специальностей, особенно когда одномоментно назначаются несколько лекарственных препаратов – и частота неблагоприятных лекарственных реакций значительно возрастает в силу возможного межлекарственного взаимодействия, в том числе на уровне метаболизма. При проведении доклинических исследований лекарственного препарата Авиандр (название на период разработки CD-008-0045, МНН – маритупирдин) было отмечено, что препарат взаимодействует с цитохромами Р450 1А2, 2С19 и 2D6, и, вероятно, может метаболизироваться данными изоферментами, а также тот факт, что он может неконкурентно и обратимо ингибировать цитохром Р450 2D6. Детальное изучение метаболизма препарата Авиандр на уровне системы цитохромов Р450 в печени, а также возможность его влияния на активность этой системы определило дизайн настоящего исследования. В исследование было включено 24 здоровых добровольцев в возрасте от 18 до 45 лет. С учетом возможного 40%-го невключения субъектов по результатам скрининга и необходимости привлечения 10 дублеров, в исследовании планировалось провести скрининг до 44 человек.
Полученные в ходе исследования данные позволяют сделать вывод о благоприятном профиле безопасности препарата Авиандр и отсутствии значимого межлекарственного взаимодействия при его совместном приеме с препаратами Дулоксетин, Метопролол, Ципрофлоксацин и Флуконазол, которые одновременно являются не только субстратами для метаболизирующей системы цитохромов Р450 в печени, но и лекарственными препаратами, которые могут изменять метаболическую активность этой системы.
Ключевые слова: авиандр, маритупирдин, исследование, безопасность, лекарственные взаимодействия, Р 450.
Для цитирования: Е.Н. Морозов, Е.А. Смолярчук, С.А. Апполонова, М.А. Кинкулькина, Н.Н. Иванец, А.В. Иващенко, А.А. Иващенко, А.А. Иващенко, О.Е. Морозова, В.В. Тарасов. Открытое рандомизированное клиническое исследование фармакокинетики, межлекарственных взаимодействий и безопасности совместного приема препарата Авиандр и других лекарственных препаратов у здоровых добровольцев. Психиатрия и психофармакотерапия. 2025; 5: 40–49. DOI: 10.62202/2075-1761-2025-27-5-40-49
An open randomized clinical trial of the pharmacokinetics, drug interactions, and safety of co-administration of Aviander and other medications in healthy volunteers
E.N. Morozov1, E.A. Smolarchuk1, S.A. Apollonova1, M.A. Kinkulkina1, N.N. Ivanets1, A.V. Ivashchenko2,
A.A. Ivashchenko3, A.A. Ivashchenko4, O.E. Morozova1, V.V. Tarasov1
1 Sechenov University of the Ministry of Health of Russia, Moscow, Russian Federation
2 KemDiv Inc., San Diego, USA
3 KhimRar Pharma LLC, Moscow, Russian Federation
4 Lomonosov Moscow State University, Moscow, Russian Federation
Abstract
The problem of pharmacotherapy safety is relevant in all areas of medicine for practitioners of any specialty, especially when several medications are prescribed simultaneously, and the frequency of adverse drug reactions increases significantly due to possible drug interactions, including at the metabolic level. During preclinical studies of the drug Aviandr (the name for the period of development CD-008-0045, INN maritupirdine), it was noted that the drug interacts with cytochromes P450 1A2, 2C19 and 2D6, and can probably be metabolized by these isoenzymes, as well as the fact that it can uncompetitively and reversibly inhibit cytochrome P450 2D6. A detailed study of the metabolism of Aviandr at the level of the cytochrome P450 system in the liver, as well as the possibility of its influence on the activity of this system, determined the design of this study. The study included 24 healthy volunteers aged 18 to 45 years. Taking into account the possible 40% non-inclusion of subjects based on the screening results and the need to involve 10 understudies, it was planned to screen up to 44 people in the study. The data obtained during the study allow us to conclude that Aviandr has a favorable safety profile and there is no significant drug interaction when taken together with Duloxetine, Metoprolol, Ciprofloxacin and Fluconazole, which are simultaneously not only substrates for the cytochrome P450 metabolizing system in the liver, but also drugs that can alter the metabolic activity of this system.
Keywords: aviandr, maritupirdine, research, safety, drug interactions, P-450.
For citations: E.N. Morozov, E.A. Smolarchuk, S.A. Apollonova, M.A. Kinkulkina, N.N. Ivanets, A.V. Ivashchenko, A.A. Ivashchenko, A.A. Ivashchenko,
O.E. Morozova, V.V. Tarasov. An open randomized clinical trial of the pharmacokinetics, drug interactions, and safety of co-administration of Aviandr and other medications in healthy volunteers. Psychiatry and psychopharmacotherapy. 2025; 5: 40–49. DOI: 10.62202/2075-1761-2025-27-5-40-49
Введение
Проблема безопасности комбинированной фармакотерапии актуальна во всех сферах медицины для практикующих врачей любых специальностей, особенно когда одномоментно назначаются несколько лекарственных препаратов – и частота неблагоприятных лекарственных реакций значительно возрастает в силу возможного межлекарственного взаимодействия, в том числе на уровне метаболизма. Однако клиническое мышление врача, как правило, в большей степени направлено на выбор наиболее эффективной комбинации лекарственных средств для усиления терапевтического эффекта или воздействия сразу на несколько клинических проявлений, нежели оценку безопасности такой комбинации. При проведении доклинических исследований лекарственного препарата Авиандр (название на период разработки CD-008-0045, МНН – маритупирдин) было отмечено, что препарат взаимодействует с цитохромами Р450 – 1А2, 2С19 и 2D6, и, вероятно, может метаболизироваться данными изоферментами [1]. Также на этапе доклинических исследований было выяснено, что маритупирдин неконкурентно и обратимо ингибирует цитохром Р450 2D6, что, теоретически, может привести к снижению активности данного изофермента и возрастанию концентраций других лекарственных препаратов, которые метаболизируются данным изоферментом (межлекарственное взаимодействие на уровне метаболизма). Далее в исследованиях фазы I и II было выявлено влияние полиморфизма цитохрома Р450 2D6 на фармакокинетические параметры препарата маритупирдинa: снижение активности изофермента CYP2D6 приводило к увеличению Cthrough и Cmax маритупирдинa и его метаболита от 2 до 5 раз. Учитывая данный профиль метаболизма препарата, было принято решение провести исследование межлекарственного взаимодействия с основными субстратами и ингибиторами изоферментов системы цитохромов Р450 – 1А2, 2С19 и 2D6 [2-5].
Новый лекарственный препарат Авиандр обладает мультитаргетной активностью, в частности способностью ингибировать адренергические, дофаминовые, серотониновые и гистаминовые рецепторы, что позволяет предполагать у препарата Авиандр наличие широкого терапевтического потенциала. Препарат Авиандр обладает очень высоким сродством к 5НТ7 рецепторам и меньшим сродством к 5-НТ6, 5-HT2A и 5-HT2C рецепторам, ингибирует рецепторы гистамина Н1 и альфа-адренорецепторы (α2A, α2B и α2C). Рецепторный профиль препарата Авиандр, характеризующийся высокой степенью ингибирования α2-адренорецепторов и 5-HT7,
5-HT2A и 5-HT2C рецепторов, демонстрирует сходство с рецепторным профилем препаратов группы норадренергических и специфических серотонинергических антидепрессантов (НаССА), что позволяет предположить наличие антидепрессивной активности. В проведенных ранее доклинических исследованиях было продемонстрировано, что препарат положительным образом влияет на когнитивные функции, имеет анксиолитический, антипсихотический, а также антидепрессивный потенциал, что дает обоснование его дальнейшему исследованию в качестве средства для лечения депрессии и тревожно-депрессивных расстройств [1].
Безопасность, переносимость и фармакокинетику препарата маритупирдин при однократном приеме в дозах
2 мг, 4 мг, 10 мг и 20 мг у здоровых добровольцев-мужчин изучали в рамках двух клинических исследований Фазы I. При однократном приеме его экспозиция линейно зависела от дозы препарата. Время достижения максимальной концентрации (Тmax) составило 1 час, период полувыведения (Т1/2) – около 8 часов.
В 2017 г. было проведено клиническое исследование фазы I с целью оценки безопасности возрастающих доз препарата маритупирдин при однократном и многократном дозировании. В исследовании изучались суточные дозы препарата маритупирдин 40 мг (20 мг два раза в день) и 60 мг
(20 мг три раза в день); длительность многократного приема составила 4 дня. Была отмечена связь уровня экспозиции препарата маритупирдин в крови с полиморфизмом CYP2D6. В каждой дозовой когорте из 4 добровольцев, принимавших маритупирдин, было выявлено по одному добровольцу, которого можно отнести к медленным метаболизаторам по CYP2D6, и чьи фармакокинетические (ФК) параметры значительно отличались от остальных добровольцев. Остаточная концентрация маритупирдинa стабилизировалась через 1-2 суток после начала регулярного приема препарата. Фактор накопления (Fc) составил 2,5 в когорте 40 мг и 2,1 в когорте 60 мг. При многократном приеме медиана Тmax CD-008-0045 составляла 0,4 часа в когорте 40 мг и 1,0 час в когорте 60 мг. Средний T1/2 составил 15,0±3,5 часа в когорте 40 мг и 9,9±3,2 часа в когорте 60 мг [1].
В 2018-2019 гг. было проведено клиническое исследование фазы II с целью оценки эффективности, безопасности, фармакокинетики, фармакогенетики и подбора дозы препарата маритупирдинa у пациентов с генерализованным тревожным расстройством (ГТР) в течение 8 недель терапии. В исследовании изучались суточные дозы препарата маритупирдинa мг (20 мг два раза в день) и 60 мг (20 мг три раза в день). Количество пациентов, достигших 50% снижения общего балла по шкале HARS на Неделе 8, составило 20/44 (45,5%) пациентов для группы маритупирдин 60 мг, 22 /41 (53,7%) пациента для группы маритупирдин 40 мг и 5/43 (11,6%) пациентов для группы Плацебо, что соответствует ожидаемой доле пациентов, ответивших на терапию для исследуемого препарата, а именно ≥17/39 (43,6%) [6].
В 2021-2022 гг. было проведено клиническое исследование фазы III «Эффективность и безопасность нового препарата Авиандр в лечении тревоги у пациентов с расстройством адаптации после перенесенной острой короновирусной инфекции».
Исследование показало эффективность маритупирдина в снижении интенсивности тревоги, продемонстрированы анксиолитический, антиастенический, антидепрессивный и прокогнитивный эффекты, а также повышение социальной активности пациентов. Ответили на терапию маритупирдином (снижение общего балла по шкале HAM-A ≥50%) 83,49% пациентов. Достигли ремиссии (сумма баллов по HAM-A ≤7) к 28 дню терапии 68,81% пациентов, по результатам отсроченного наблюдения (через 1 неделю после окончания терапии) – 79,8% пациентов [7].
Также в 2022 г. было завершено клиническое исследование фазы III по оценке эффективности и безопасности препарата Авиандр у пациентов с генерализованным тревожным расстройством. В ходе исследования препарат Авиандр продемонстрировал благоприятный профиль безопасности и эффективность по данным первичной и вторичным конечным точкам, что дает основания рассматривать его в качестве перспективного лекарственного препарата для лечения ГТР в инициальный и продолженный (противорецидивный) период терапии [8].
В связи с тем, что по данным доклинических и клинических исследований можно предположить, что препарат Авиандр является субстратом CYP1A2 и CYP2C19, а также субстратом и неконкурентным обратимым ингибитором CYP2D6 [1], было принято решение провести настоящее исследование с целью оценки межлекарственного взаимодействия препарата Авиандр с лекарственными препаратами, которые являются значимыми ингибиторами и субстратами для изоферментов системы цитохромов Р450 печени: дулоксетин (на уровне CYP2D6), метопролол (на уровне CYP2D6), ципрофлоксацин (на уровне CYP1A2) и флуконазол (на уровне CYP2C19). При этом, учитывая то, что в клинических исследованиях уже было показано влияние полиморфизма CYP2D6 на фармакокинетические параметры препарата Авиандр, – согласно рекомендациям по изучению межлекарственного взаимодействия, было принято решение не использовать сильный ингибитор CYP2D6. Для оценки межлекарственного взаимодействия с участием этого фермента был выбран умеренный ингибитор CYP2D6 – дулоксетин.
Материалы и методы
Клинические исследования были выполнены в соответствии с действующими правилами, стандартами и нормативными актами Российской Федерации.
Дизайн исследования
Настоящее исследование являлось открытым исследованием фармакокинетики, межлекарственных взаимодействий и безопасности совместного приема препарата Авиандр и других лекарственных препаратов у здоровых добровольцев.
Исследование было проведено в 1 российском исследовательском центре. Добровольцы были распределены в одну из следующих групп:
Группа 1. Авиандр/ Дулоксетин (Симбалта®) + Авиандр – 6 добровольцев;
Группа 2. Метопролол (Эгилок®)/ Метопролол (Эгилок®) + Авиандр – 6 добровольцев;
Группа 3. Авиандр/ Ципрофлоксацин (Ципролет®) + Авиандр – 6 добровольцев;
Группа 4. Авиандр/ Флуконазол (Дифлюкан®) + Авиандр – 6 добровольцев.
С учетом возможного 40%-го невключения по результатам скрининга и необходимости привлечения 10 дублеров, в исследовании планировалось провести скрининг до 44 человек. Субъекты, досрочно завершившие исследование в первые часы после приема исследуемого препарата, когда происходит процесс всасывания лекарственного препарата из желудочно-кишечного тракта (например, при возникновении рвоты), могли быть заменены по согласованию со Спонсором.
На этапе скрининга у всех добровольцев были получены образцы крови для оценки фармакогенетического анализа полиморфизма CYP2D6. В исследование включались добровольцы, относящиеся к группе «нормальных метаболизаторов» или «промежуточных метаболизаторов» по активности CYP2D6 по результатам фармакогенетического исследования.
Добровольцы, успешно прошедшие все процедуры скрининга и соответствующие критериям включения/невключения, были распределены в одну из четырех групп методом блочной рандомизации без стратификации в соотношении 1:1.
Для каждой группы добровольцев исследование состояло из следующих периодов: скрининга, периодов приема исследуемой терапии (Период 1 и Период 2), а также периода последующего наблюдения. В Период 1 добровольцы, в зависимости от группы, приняли исследуемый препарат однократно для последующей оценки исходных показателей фармакокинетики. Затем, в Период 2 добровольцы приняли комбинацию из двух исследуемых препаратов (в зависимости от группы терапии) для последующей оценки фармакокинетических параметров при совместном приеме исследуемых препаратов. Периоды 1 и 2 были разделены отмывочным интервалом.
Скрининг
После подписания Информационного листка и формы информированного согласия каждому добровольцу были проведены процедуры скрининга, включая сбор демографических данных и анамнеза, физикальный осмотр, измерение роста, массы тела, определение индекса массы тела (ИМТ), оценку жизненно важных показателей, электрокардиографию (ЭКГ), взятие биологического материала для серологического, биохимического и клинического анализов крови, фармакогенетического анализа, общего анализа мочи, теста на котинин, алкоголь и наркотики, теста на беременность у лиц женского пола, оценку сопутствующей терапии. По результатам данных, полученных на этапе скрининга, была проведена предварительная оценка соответствия критериям включения/ невключения.
Период исследуемой терапии, Период 1
Добровольцы, успешно прошедшие скрининг, были приглашены в День 0 для повторной оценки соответствия критериям включения/невключения по данным опроса, осмотра и проведенного лабораторно-инструментального обследования. Добровольцы, удовлетворяющие критериям включения и не имеющие критериев невключения, были рандомизированы и включены в исследование. Непосредственно до приема исследуемого препарата в День 1 была проведена оценка нежелательных явлений, сопутствующей терапии, жизненно важных показателей и результатов ЭКГ, а также произведен забор крови и мочи для лабораторного исследования безопасности, а также образца крови для ФК анализа.
Добровольцы приняли исследуемый препарат, соответствующий группе, в которую они распределены (Авиандр, 20 мг, 1 таблетка однократно – для группы 1, 3 и 4; и
Эгилок®, 50 мг, 1 таблетка однократно – для группы 2).
Добровольцы приняли исследуемые препараты перорально внутрь по 1 таблетке (за 30 минут до еды), запивая его необходимым количеством питьевой воды комнатной температуры (100 мл).
Для фармакокинетического анализа была получена серия образцов крови:
• в Группах 1, 3 и 4 (прием препарата Авиандр, 20 мг) – перед приемом исследуемого препарата, через 15 и 30 минут, через 1 час, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 6, 8, 8.5, 9, 9.5, 10, 12, 24 и 48 часов после приема исследуемого препарата;
• в Группе 2 (прием препарата Эгилок®, 50 мг) – перед приемом исследуемого препарата и через 15 и 30 минут, через 1 час, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 6, 8, 8.5, 9, 9.5, 10, 12, 24 и 48 часов после приема исследуемого препарата.
Добровольцы всех групп оставались под врачебным наблюдением в течение как минимум 24 часов после дозирования для отслеживания параметров безопасности и взятия крови для ФК анализа.
Через 24 часа (в День 2) во всех группах была проведена оценка нежелательных явлений, сопутствующей терапии, жизненно важных показателей, параметров ЭКГ и произведен забор образцов крови для ФК. Отмывочный период составил 7 дней после приема исследуемого препарата, что составляет более 20 периодов полувыведения для препарата Авиандр (T½ 8 часов), метаболита препарата Авиандр – М1 (T½ 4,7 часов) и метопролола (T½ 3-4 часа).
В День 3 добровольцам была проведена оценка нежелательных явлений, сопутствующей терапии, жизненно важных показателей, а также был выполнен забор биообразцов для ФК анализа через 48 часов после приема препарата.
Период исследуемой терапии, Период 2
Добровольцам для прохождения Периода 2 вечером в День 6 была проведена оценка нежелательных явлений, сопутствующей терапии, жизненно важных показателей, физикальный осмотр. Во время Периода 2 добровольцы также находились под врачебным наблюдением.
В День 7 добровольцы совместно с препаратом Авиандр приняли один из исследуемых препаратов, в соответствии с группой, в которую они были распределены. Непосредственно до приема препаратов была проведена оценка нежелательных явлений, сопутствующей терапии, жизненно важных показателей, параметров ЭКГ, произведен забор образцов крови и мочи для лабораторного исследования безопасности, тест на котинин, наркотики и алкоголь, тест на беременность, а также образца крови для ФК анализа.
В Периоде 2 добровольцы приняли комбинацию двух исследуемых препаратов, в соответствии с группой, в которую они были распределены:
Группа 1. Добровольцы приняли препарат Авиандр,
20 мг (1 таблетка) совместно с препаратом Симбалта®,
60 мг (1 капсула) однократно, за 30 минут до еды
Группа 2. Добровольцы приняли препарат Авиандр,
20 мг (1 таблетка) совместно с препаратом Эгилок®, 50 мг (1 таблетка) однократно, за 30 минут до еды
Группа 3. Добровольцы приняли препарат Авиандр,
20 мг (1 таблетка) совместно с препаратом Ципролет®,
500 мг (1 таблетка) однократно, за 30 минут до еды
Группа 4. Добровольцы приняли препарат Авиандр,
20 мг (1 таблетка) совместно с препаратом Дифлюкан®,
150 мг (1 капсула) однократно, за 30 минут до еды
Добровольцы принимали исследуемые препараты перорально внутрь по 1 таблетке или капсуле (за 30 минут до еды), запивая его необходимым количеством питьевой воды комнатной температуры (100 мл).
Для фармакокинетического анализа была получена серия образцов крови:
• в Группе 1 (совместный прием Симбалта®, 60 мг + Авиандр, 20 мг) – за 15 минут перед приемом исследуемого препарата , через 15 и 30 минут, через 1 час, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 6, 8, 8.5, 9, 9.5, 10, 12, 24 и 48 часов после приема исследуемого препарата;
• в Группе 2 (совместный прием Эгилок®, 50 мг + Авиандр, 20 мг) – за 15 минут перед приемом исследуемого препарата, через 15 и 30 минут, через 1 час, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 6, 8, 8.5, 9, 9.5, 10, 12, 24 и 48 часов после приема исследуемого препарата;
• в Группе 3 (Ципролет®, 500 мг + Авиандр, 20 мг) – за 15 минут перед приемом исследуемого препарата , через 15 и 30 минут, через 1 час, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 6, 8, 8.5, 9, 9.5, 10, 12, 24 и 48 часов после приема исследуемого препарата;
• в Группе 4 (Дифлюкан®, 150 мг + Авиандр, 20 мг) – за 15 минут перед приемом исследуемого препарата, через 15 и 30 минут, через 1 час, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 6, 8, 8.5, 9, 9.5, 10, 12, 24 и 48 часов после приема исследуемого препарата.
Добровольцы оставались под врачебным наблюдением в течение как минимум 24 часов после дозирования для отслеживания параметров безопасности и взятия крови для ФК анализа. В День 8 была проведена оценка нежелательных явлений, сопутствующей терапии, жизненно важных показателей, параметров ЭКГ и произведен забор крови для ФК анализа через 24 часа после приема исследуемого препарата.
В День 9 была проведена оценка нежелательных явлений, сопутствующей терапии, жизненно важных показателей, а также был произведен забор крови для ФК анализа через 48 часов после приема препарата и биообразцов для клинического и биохимического анализа крови, общего анализа мочи.
Период наблюдения
Период последующего наблюдения продлился до Дня 14, после которого исследование завершалось. На визите была проведена оценка нежелательных явлений, сопутствующей терапии, жизненно важных показателей, был выполнен тест на беременность для лиц женского пола.
Данные о нежелательных явлениях собирались до
30 дней после приема последней дозы исследуемого препарата или проведения последней процедуры по исследованию по возможным спонтанным сообщениям от добровольцев.
1.1. Продолжительность исследования
Каждый доброволец принимал участие в исследовании приблизительно 5 недель: Скрининг – 3 недели, Прием исследуемого препарата (Период 1, отмывка и Период 2) – 2 недели, и последующее наблюдение – 1 неделя.
1.2. Статистические методы
Анализ результатов исследования был проведен в соответствии с Планом статистического анализа. Для анализа данных безопасности и фармакокинетики были использованы методы описательной статистики.
Анализ фармакокинетики
Популяции для оценки фармакокинетики соответствуют все субъекты, получившие хотя бы одну дозу исследуемых препаратов, и для которых получен объем данных о концентрации исследуемых аналитов достаточный для оценки фармакокинетических параметров. ФК параметры были описаны с помощью методов описательной статистики. Оценка межлекарственных взаимодействий была проведена путем попарных сравнений ФК параметров для изучаемых аналитов.
С целью сравнения фармакокинетические параметры (в том числе AUC0-72, AUC0-inf, Cmax) были логарифмированы и оценены с использованием дисперсионного анализа (ANOVA) с фиксированными эффектами. Модель дисперсионного анализа включала следующие факторы: Последовательность, Испытуемые (фактор будет представлен в пределах данной последовательности), Период исследования и Препарат как источники вариации. Был проведен расчет 90% ДИ для отношения средних геометрических анализируемых ФК параметров (AUC0-72, AUC0-inf, Cmax), также для всех показателей, включая T1/2, были применены точечные критерии (парный t-тест), различие считалось статистически значимым при p<0,05.



Анализ конечных точек безопасности
Все добровольцы, которые получили хотя бы одну дозу исследуемого препарата, были включены в популяцию для анализа безопасности. Параметры безопасности были проанализированы при помощи описательной статистики. Все результаты статистической обработки данных были представлены в виде таблиц.
Все нежелательные явления были классифицированы в соответствии с терминологией MedDRA.
Число нежелательных явлений и серьезных нежелательных явлений, а также число и процент добровольцев с нежелательными явлениями и серьезными нежелательными явлениями были представлены в виде таблиц по классу систем органов и предпочтительному термину, по связи с препаратом и степени тяжести.
Были проанализированы результаты лабораторных исследований, включая любые изменения по сравнению с исходными. Отклонения от нормальных значений были обобщены в виде частотных таблиц. Сводные таблицы динамики лабораторных показателей были представлены по группам в соответствии с результатами, полученными на визитах, и сдвигом относительно исходного значения.
Были проанализированы жизненно важные показатели, включая клинически значимые изменения по сравнению с исходными. Отклонения от нормы были обобщены в виде частотных таблиц.
Непрерывные показатели были представлены средним значением, стандартным отклонением, медианой, минимальным и максимальным значением, 95% ДИ. Дискретные показатели – числом и процентом добровольцев.
Анализ результатов исследования был проведен в соответствии с Планом статистического анализа, который был разработан и утвержден до закрытия базы данных.
РЕЗУЛЬТАТЫ
Мониторинг данных по безопасности
Мониторинг данных по безопасности в ходе проведения исследования проводился в соответствии с требованиями протокола и Плана по безопасности и фармаконадзору в клиническом исследовании, версия 1.0 от 01 августа 2023 г.
Все нежелательные явления, выявленные в ходе проведения исследования по результатам физикального осмотра добровольцев, оценки жизненно важных показателей, проведения инструментальных (ЭКГ) и лабораторных обследований, по результатам жалоб добровольцев, были проанализированы врачами-исследователями, надлежащим образом зафиксированы в первичной документации и перенесены в электронную индивидуальную регистрационную карту.
Общая статистика по развившимся нежелательным явлениям на фоне исследуемой терапии представлены в таблицах 1–4. Всего было выявлено 25 нежелательных явлений, развившихся у 12 добровольцев (50.00%). Было зарегистрировано 2 нежелательных явления у 2 (8.33%) добровольцев, которые имели возможную связь с исследуемым препаратом (таблица 1).
18 нежелательных явлений у 11 (45.83%) добровольцев разрешились, 7 нежелательных явлений у 4 (16.67%) остались неразрешенными, что представлено в таблице 2.
Все зарегистрированные на фоне исследуемой терапии нежелательные явления (TEAE) в течение основного периода исследования были представлены по системно-органному классу (MedDRA System Organ Class, SOC) и по предпочтительному термину (MedDRA Preferred Term, PT). Наибольшее число нежелательных явлений зафиксировано в категории лабораторные и инструментальные данные – 23 нежелательных явления у 11 (45.83%) добровольцев (таблица 3).
В таблице 4 представлены нежелательные явления, связанные с приемом исследуемого препарата, т.е. связанные или вероятно связанные с исследуемым препаратом.
Демографические данные и другие демографические
характеристики
В исследование были включены здоровые добровольцы мужского и женского пола в возрасте 18-45 лет включительно, соответствующие всем требованиям критериев включения и не имеющие критериев невключения. Средний возраст включенных в анализ добровольцев составил 27.38 ± 7.08 года, с минимальным значением 20 лет и максимальным значением 41 год, все добровольцы были европеоидной расы. В исследовании участвовали 9 (37.50%) мужчин и 15 (62.50%) женщин. Среднее значение индекса массы тела составило 22.79 ± 2.87 кг/м2.
Медицинский анамнез
В Группе 1 перенесенные заболевания отмечались у 3/6 (50.00%) добровольцев, в Группе 2 – у 2/6 (33.33%) добровольцев, в Группе 3 – у 5/6 (83.33%) добровольцев, в Группе 4 – у 3/6 (50.00%) добровольцев.
Анализ общемедицинского анамнеза составил 15 случаев перенесенных заболеваний у 13 (54.17%) добровольцев (перенесенные инфекции/инвазии).
Сопутствующие заболевания
У добровольцев не было зафиксировано активных сопутствующих заболеваний на момент включения в исследование.
Нежелательные явления, начавшиеся до приема
препарата
На момент скрининга у 3 (12.50%) добровольцев было зафиксировано 7 случаев нежелательных явлений. Эпизодов серьезных нежелательных явлений не зафиксировано.
ЭКГ в 12 отведениях
Данные о результатах оценки ЭКГ в 12 отведениях оценивались на протяжении всего исследования. Клинически значимых отклонений по параметрам ЭКГ не обнаружено.
Динамика лабораторных показателей за период
исследования
В общем анализе крови были обнаружены отклонения от нормы по параметрам Гемоглобин, Гематокрит, Эритроциты, Лейкоциты, Нейтрофилы (абс. знач.), Лимфоциты (абс. знач.), Моноциты (абс. знач.). Данные значения были зарегистрированы как нежелательные явления, развившиеся до начала приема исследуемого препарата, и нежелательные явления, развившиеся в период приема исследуемого препарата. Статистически значимые отклонения относительно временной точки Визита 0 (Скрининг, до приема исследуемого препарата) были выявлены для следующих клинико-лабораторных параметров:
• Гемоглобин в Период 2 / День 7 и Период 2 / День 9;
• Гематокрит в Период 1 / День 1 и Период 2 / День 7 и в Период 2 / День 9;
• Эритроциты в Период 1 / День 1, Период 2 / День 7 и в Период 2 / День 9;
• Нейтрофилы в Период 2 / День 7;
• Тромбоциты в Период 1 / День 1 и в Период 2 / День 7.
Данные отклонения могли быть связаны:
1. С общим снижением показателей в связи с заборами крови, которые приводят к незначительной кровопотере, которая, в свою очередь, отражается как раз в колебаниях показателей; не исключаются также и лабораторные погрешности. 2. С тем или иным влиянием исследуемых препаратов, что зафиксировано как нежелательные явления.
Необходимо отметить, что колебания уровня тромбоцитов не выходили за пределы референсных лабораторных норм и не были зафиксированы как нежелательные явления ни у одного из добровольцев.
Анализ данных фармакогенетики
В соответствии с критериями включения и по результатам проведенного фармакогенетического анализа в исследование были отобраны добровольцы, соответствующие группам «нормальные метаболизаторы» или «промежуточные метаболизаторы» по CYP2D6. При этом большинство добровольцев – 15 (62.50%) – соответствовало группе «нормальные метаболизаторы».
Анализ данных фармакокинетики
В исследовании была изучена фармакокинетика препаратов Авиандр и метопролола (Эгилок®) при однократном приеме (Период 1). В Периоде 2 было изучено влияние дулоксетина (Симбалта®), ципрофлоксацина (Ципролет®) и флуконазола (Дифлюкан®) на ФК параметры препарата Авиандр при их совместном приеме. Также в Периоде 2 было изучено влияние препарата Авиандр на ФК параметры метопролола при их совместном приеме.
В связи с фармакокинетическими профилями и периодами полувыведения, определение концентраций препарата Авиандр, его метаболита М1 и метопролола в Период 1 было выполнено в следующих точках: за 15 минут перед приемом исследуемого препарата через 15 и 30 минут, через 1, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 6, 8, 8.5, 9, 9.5, 10, 12, 24 и 48 часов после приема исследуемого препарата.
В Период 2 определение концентраций препарата Авиандр, его метаболита М1 и метопролола было выполнено в следующих точках: за 15 минут перед приемом исследуемого препарата, через 15 и 30 минут, через 1, 1.5, 2, 2.5, 3, 3.5, 4, 4.5, 5, 6, 8, 8.5, 9, 9.5, 10, 12, 24 и 48 часов после приема исследуемого препарата.
Пробы были проанализированы с помощью валидированных методов ВЭЖХ-МС/МС с нижним пределом количественного определения (НПКО) 6.25 пг/мл для препарата Авиандр, 10.0 пг/мл для метаболита препарата Авиандр (М1), и 1.00 нг/мл для метопролола.
Фармакокинетический и статистический анализ проводился с помощью программного обеспечения Phoenix™ WinNonlin® (CERTARA, Pharsight, США) v. 8.2.
Статистический анализ включал в себя следующие процедуры: вычисление базовой и порядковой статистики, дисперсионный анализ, графические методы, вычисление доверительных интервалов.
Полученные данные были подвергнуты статистической обработке. Рассчитывали следующие описательные статистики: среднее арифметическое значение (Mean), среднее геометрическое (GMean), коэффициент вариации (CV%) и стандартное отклонение (SD).
С помощью дисперсионного анализа (ANOVA; параметрический метод) оценивали различия между средними значениями фармакокинетических параметров при 5% уровне значимости. В связи с тем, что в исследовании не проводилось рандомизации добровольцев по параметрам Последовательность и Период, а также в связи с невозможностью расчета неопределенности фактора Испытуемые (фактор в пределах последовательности) из-за отсутствия рандомизации добровольцев по фактору Последовательность, сравнение фармакокинетических параметров проводилось по единственному фактору, вносящему неопределенность в модель, – Препарат.
Полученная с помощью дисперсионного анализа оценка остаточной вариации использовалась для расчета доверительных интервалов для отношений средних значений соответствующих основных фармакокинетических параметров: AUC0-t и Сmax (максимальное значение концентрации препарата в крови).
Вычисляли параметрические двухсторонние 90% доверительные интервалы для отношений соответствующих средних значений изучаемых параметров фармакокинетики для исследуемого препарата и препарата сравнения.
Статистическая проверка состояла в сравнении средних значений основных фармакокинетических параметров, выбранных в качестве критерия отсутствия отличий между группами (AUC0-t, AUC0-∞ и Сmax).
В исследовании фармакокинетических параметров препарата Авиандр (равно как и метаболита препарата Авиандр М1, и препарата метопролол) нулевая гипотеза состояла в том, что сравниваемые параметры неравны, тогда соответствующая ей альтернативная гипотеза состояла в том, что параметры равны.
По результатам фармакокинетического исследования и проведенного дисперсионного анализа были сформулированы следующие выводы:
1. Совместный прием ингибитора CYP2D6 дулоксетина с препаратом Авиандр не привел к значимым изменениям важнейших фармакокинетических параметров препарата Авиандр – Cmax (p-value = 0.931318), AUC0→t (p-value = 0.872240), AUC0→∞ (p-value = 0.841821) и его метаболита – Cmax (p-value = 0.930911), AUC0→t (p-value = 0.896252), AUC0→∞ (p-value = 0.917490).
2. Совместный прием препарата Авиандр с метопрололом (субстрат CYP2D6) не привел к значимым изменениям важнейших фармакокинетических параметров метопролола – Cmax (p-value = 0.940793), AUC0→t (p-value = 0.396004), AUC0→∞ (p-value = 0.426238).
3. Совместный прием ингибитора CYP1A2 ципрофлоксацина с препаратом Авиандр не привел к значимым изменениям важнейших фармакокинетических параметров препарата Авиандр – Cmax (p-value = 0. 850976), AUC0→t (p-value = 0.632276), AUC0→∞ (p-value = 0.693135) и его метаболита – Cmax (p-value = 0.593208), AUC0→t (p-value = 0.477462), AUC0→∞ (p-value = 0.444838).
4. Совместный прием ингибитора CYP2C19 флуконазола с препаратом Авиандр не привел к значимым изменениям важнейших фармакокинетических параметров препарата Авиандр – Cmax (p-value = 0.197276), AUC0→t (p-value = 0.754190), AUC0→∞ (p-value = 0.763008) и его метаболита – Cmax (p-value = 0.324929), AUC0→t (p-value = 0.202006), AUC0→∞ (p-value = 0.435705).
Таким образом, совместный прием препарата Авиандр с ингибиторами системы цитохромов Р450 (CYP2D6, CYP1A2, CYP2C19) не изменяет показатели фармакокинетических параметров препарата Авиандр и его метаболита (М1). А совместный прием препарата Авиандр с метопрололом не изменяет показатели фармакокинетических параметров метопролола (который является субстратом цитохрома CYP2D6).
Анализ данных безопасности
В ходе данного исследования препарат Авиандр в дозе 20 мг продемонстрировал благоприятный профиль безопасности и хорошую переносимость во всех исследуемых группах.
Всего было выявлено 25 нежелательных явлений, развившихся у 12 добровольцев (50.00%). При этом в Группе 1 у 3 (50%) добровольцев было зарегистрировано 8 нежелательных явлений, в Группе 2 – у 2 (33.33%) добровольцев было зарегистрировано 2 нежелательных явления, в Группе 3 – у 2 (33.33%) добровольцев было зарегистрировано
6 нежелательных явлений, в Группе 4 – у 5 (83.33%) добровольцев было зарегистрировано 9 нежелательных явлений.
Наибольшее число нежелательных явлений зафиксировано в категории Лабораторные и инструментальные данные – 23 нежелательных явления у 11 (45.83%) добровольцев, которые были легкой степени тяжести, не сопровождались клиническими симптомами, маловероятно связанные с приемом исследуемого препарата. Следует отметить, что случаи снижения показателей «красной крови» наблюдались у добровольцев женского пола и, вероятно, могли быть связаны с менструальным циклом или невыявленными гинекологическими заболеваниями в анамнезе. Всего в исследовании было зарегистрировано 2 нежелательных явления у 2 (8.33%) добровольцев, которые имели возможную связь с исследуемым препаратом и оба представляли собой случаи головной боли. Так, головная боль была зарегистрирована в День 7 у добровольца 01-38 группы 1 (Авиандр/ Дулоксетин + Авиандр) и у добровольца 01-07 группы 2 (Метопролол/ Метопролол + Авиандр), эта головная боль была легкой степени тяжести, не потребовала какого-либо лечения и разрешилась в день возникновения.
Случаи возникновения головной боли регистрировались у добровольцев в день совместного приема препарата Авиандр с препаратом, затрагивающим норадренергическую передачу в центральной нервной системе, в одном случае, и препаратом, затрагивающим адренергическую систему и влияющим на сердечно-сосудистую систему, в другом случае. Необходимо отметить, что реакции в виде головной боли описаны в инструкциях по медицинскому применению как для препарата Авиандр, так и для препаратов Дулоксетин и Метопролол. Учитывая отсутствие межлекарственного взаимодействия препаратов на уровне метаболизма, что описано выше, можно предположить, что головная боль могла быть связана с приемом достаточно высоких разовых доз препаратов (60 мг для Дулоксетина и 50 мг для Метопролола) у здоровых добровольцев.
Жизнеугрожающих, серьезных нежелательных явлений, в ходе исследования зарегистрировано не было. Лабораторные показатели, кроме тех, которые были представлены и обсуждены выше, а также жизненно важные показатели и данные ЭКГ в течение исследования не продемонстрировали каких-либо системных тенденций.
ЗАКЛЮЧЕНИЕ
По результатам проведенного комплексного анализа можно сделать вывод, что совместный прием препарата Авиандр с ингибиторами цитохромов Р450 (CYP2D6, CYP1A2, CYP2C19) не изменяет показатели фармакокинетических параметров препарата Авиандр и его метаболита (М1).
Совместный прием препарата Авиандр с Метопрололом не изменяет показатели фармакокинетических параметров субстрата CYP2D6 (метопролола), что может свидетельствовать в пользу того, что препарат Авиандр не является значимым ингибитором/ индуктором изофермента 2D6 системы цитохромов Р450 в печени.
В ходе исследования был продемонстрирован благоприятный профиль безопасности препарата Авиандр при совместном приеме с препаратами Дулоксетин, Метопролол, Ципрофлоксацин и Флуконазол в силу отсутствия значимого межлекарственного взаимодействия, что может быть значимым для клинической практики при совместном назначении лекарственных препаратов, а именно:
1. Совместный прием препарата Авиандр не приводит к клинически значимым проявлениям межлекарственного взаимодействия (в том числе связанным с усилением серотонинергической передачи) при приеме с препаратом группы селективного захвата серотонина и норадреналина (дулоксетин).
2. Препарат Авиандр не приводит к значимому изменению фармакокинетических параметров Метопролола (препарата из группы бета-адреноблокаторов) при их совместном приеме, что может учитываться при подборе дозы препаратов из группы бета-блокаторов.
3. При приеме препарата Авиандр с препаратом Ципрофлоксацин также не возникали клинически значимые проявления межлекарственного взаимодействия или нежелательные реакции, в том числе удлинение интервала QT.
4. Учитывая тот факт, что Флуконазол, помимо ингибирования CYP2C19, также является и ингибитором P-гликопротеина кишечника [11], можно предположить, что параметры всасывания препарата Авиандр не зависят от снижения активности системы P-гликопротеина, что может наблюдаться у пациентов пожилого возраста.
Дата поступления:29.08.2025
Received: 29.08.2025
Принята к печати: 22.09.2025
Accepted: 29.09.2025
Автор заявляет об отсутствии конфликта интересов.
Author declares no conflicts of interest.
Автор, ответственный за переписку: Е.Н. Морозов
The author responsible for the correspondence: E.N. Morozov
КОНФЛИКТ ИНТЕРЕСОВ: Идея разработки препарата Авиандр и зарегистрированные права на этот препарат принадлежат авторам статьи А.В. Иващенко и А.А. Иващенко.
CONFLICT OF INTEREST: The idea of developing Aviander and the registered rights to this drug belong to the authors of the article A.V. Ivashchenko and A.A. Ivashchenko.
ФИНАНСИРОВАНИЕ: Результаты представленной работы достигнуты в ходе реализации проекта с использованием мер государственной поддержки развития кооперации российских образовательных организаций высшего образования, государственных научных учреждений и организаций реального сектора экономики, реализующих комплексные проекты по созданию высокотехнологичного производства, предусмотренных постановлением Правительства Российской Федерации от 9 апреля 2010 г. № 218. Работа выполнена в рамках соглашения с Минобрнауки России о предоставлении субсидии № 075-11-2023-016 от 28 февраля 2023 г. по теме «Создание высокотехнологичного производства активной фармацевтической субстанции инновационного лекарственного средства для комплексной терапии тревожных и депрессивных расстройств, в том числе ассоциированных с перенесенным COVID-19 и последствий участия в специальной военной операции».
FINANCING: The results of the presented work were achieved during the implementation of the project using measures of state support for the development of cooperation between Russian educational institutions of higher education, state scientific institutions and organizations of the real sector of the economy implementing complex projects to create high-tech production, provided for by Decree of the Government of the Russian Federation dated April 9, 2010 No. 218. The work was carried out within the framework of an agreement with the Ministry of Education and Science of the Russian Federation on Grant No. 075-11-2023-016 dated February 28, 2023 on the topic "Creation of a high-tech production of the active pharmaceutical substance of an innovative drug for the complex therapy of anxiety and depressive disorders, including those associated with COVID-19 and the consequences of participation in a special military operation."
Список исп. литературыСкрыть список1. Ivachtchenko AV, Lavrovsky Y, Okun I. AVN-101: A Multi-Target Drug Candidate for the Treatment of CNS Disorders. J Alzheimers Dis. 2016 May 25;53(2):583-620. doi: 10.3233/JAD-151146. PMID: 27232215; PMCID: PMC4969713.
2. In vitro drug interaction studies: cytochrome P-450 enzyme- and transporter-mediated drug interactions. Center for Drug Evaluation and Research, January 2020.
3. 21 June 2012 CPMP/EWP/560/95/Rev. 1 Corr. 2** Committee for Human Medicinal Products (CHMP) Guideline on the investigation of drug interactions.
4. Clinical Drug Interaction Studies — Study Design, Data Analysis, and Clinical Implications (DRAFT Guidance for Industry. Center for Drug Evaluation and Research - CDER at U.S. FDA): October 25, 2017. Электронный ресурс: <https://www.fda.gov/downloads/Drugs/GuidanceomplianceRegulatory Information/Guidan ces/UCM292362.pdf>
5. Cicali EJ, Smith DM, Duong BQ, Kovar LG, Cavallari LH, Johnson JA. A Scoping Review of the Evidence Behind Cytochrome P450 2D6 Isoenzyme Inhibitor Classifications. Clin Pharmacol Ther. 2020 Jul;108(1):116-125. doi: 10.1002/cpt.1768. Epub 2020 Feb 13. PMID: 31910286; PMCID: PMC7292748.
6. Ivashchenko AA, Morozova MA, Vostokova NV, Beniashvily AG, Bukhanovskaya OA, Burminskiy DS, Egorova AN, Gluskina LY, Gorchakov DS, Karapetian RN, Kasimova LN, Kravchenko DV, Lepilkina TA, Merkulova EA, Mitkin OD, Penchul NA, Potanin SS, Rupchev GE, Ivachtchenko AV. Safety and efficacy of aviandr in patients with generalized anxiety disorder: A multicenter, randomized, double-blind, placebo-controlled, dosefinding, pilot study. J Psychiatr Res. 2021 Nov;143:436-444. doi: 10.1016/j.jpsychires.2021.10.008
7. Попова В.Б., Антонова Е.А., Хлябова П.М., Родюкова И.С., Алпенидзе Д.Н., Дроздова Ю.В., Шамаева К.И., Крыжановский С.М., Тараканова А.С., Якубова Е.В., Иващенко А.В., Иващенко А.А. Эффективность и безопасность нового препарата Авиандр в лечении тревоги у пациентов с расстройством адаптации после перенесенной острой короновирусной инфекции. Журнал неврологии и психиатрии им. С.С. Корсакова. 2024;124(7):1–8. https://doi.org/10.17116/jnevro20241240711
8. Морозова М.А., Сафарова Т.П., Глускина Л.Я., Пенчул Н.А., Касимова Л.Н., Заярная И.И., Бойчевская Ю.О., Ширяев О.Ю., Резников М.К., Бухановская О.А., Мавани Д.Ч., Реутова М.А., Некрасов В.А., Горчаков Д.С., Балакин К.В., Тараканова А.С., Якубова Е .В. Двойное-слепое плацебо-контролируемое исследование эффективности и переносимости препарата Авиандр® при лечении генерализованного тревожного расстройства // Современная терапия психических расстройств. — 2024. — № 3. — С. 2–16. — DOI: 10.21265/PSYPH.2024.82.78.001

