Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
1 Stavropol State Medical University, Ministry of Health, Russian Federation, Stavropol, str. Mira, 310, PO 355017;
2 Independent researcher in the field of psychopharmacology, Israel, Azur 5801726, str. Ben-Gurion 26/7
3 Stavropol City Clinical Hospital No. 3, Russian Federation, Stavropol, str. Lenina, 417, PO 355029.
Abstract
Major depressive disorder (MDD) remains one of the most pressing challenges in psychiatry due to its high prevalence, clinical complexity, and significant social burden. Electroconvulsive therapy (ECT), which has been used for more than eighty years, is still considered the most effective treatment for severe and treatment-resistant forms of depression. Nevertheless, its mechanisms of action remain incompletely understood. Historical hypotheses, such as the amnesia and anticonvulsant models, proved insufficient to explain the clinical effects. Contemporary research focuses on multilevel neurobiological processes. It has been demonstrated that ECT stimulates neurogenesis and neuroplasticity, accompanied by increased expression of neurotrophic factors (BDNF, VEGF) and remodeling of neural networks. Significant roles are also played by changes in monoaminergic and GABAergic systems, normalization of the hypothalamic–pituitary–adrenal axis, and anti-inflammatory effects associated with cytokine reduction. In addition, receptor sensitivity modulation and epigenetic mechanisms contribute to the long-term therapeutic effect. These findings support the view of ECT as a treatment with complex and synergistic actions, explaining its unique clinical efficacy in MDD. A deeper understanding of these mechanisms opens perspectives for optimizing treatment protocols and developing personalized approaches.
Keywords: electroconvulsive therapy, major depressive disorder, neurogenesis, neuroplasticity, neurotransmitters, HPA axis, epigenetics.
For citation: Plieva A.M., Bykov Yu.V., Bekker R.A., Bykova A.Yu. Neurobiological Mechanisms of Electroconvulsive Therapy in Major Depressive Disorder: From Historical Hypotheses to Contemporary Concepts. Psychiatry and psychopharmacotherapy. 2025; 6: 4–12. DOI: 10.62202/2075-1761-2025-27-6-4-12
Введение
Большое депрессивное расстройство (БДР) остается одним из наиболее актуальных объектов современной психиатрии, сочетающим клиническую сложность, высокую распространенность и значительные социальные последствия [1-3]. В соответствии с современными диагностическими критериями, диагноз БДР устанавливается при наличии как минимум одного депрессивного эпизода продолжительностью не менее двух недель [2, 4]. Симптоматический спектр включает устойчивое снижение настроения или ангедонию, а также широкий круг нейрокогнитивных и нейровегетативных нарушений: от дефицита концентрации внимания до выраженных расстройств сна и регуляции базовых физиологических функций [2, 5].
Масштаб проблемы подтверждают эпидемиологические данные: более 280 миллионов человек в мире страдают депрессией, причем женщины демонстрируют большую уязвимость по сравнению с мужчинами [3, 6]. Уже в 2008 году Всемирная организация здравоохранения отнесла тяжелую депрессию к трем ведущим причинам глобального бремени болезней, учитывая ее вклад в смертность, заболеваемость и экономические потери [1, 4]. Согласно прогнозам, к 2030 году именно БДР может занять первое место по совокупному влиянию на общественное здоровье [2, 4].
Особое значение имеет терапевтическая перспектива. Несмотря на наличие широкого спектра фармакологических и психотерапевтических стратегий, доля пациентов с недостаточным ответом на терапию первой линии остается высокой, а риск рецидива при БДР стабильно превышает показатели большинства других психических расстройств [1, 7]. Именно поэтому поиск и использование методов, обладающих большей клинической эффективностью, остается ключевой задачей современной биологической психиатрии [1, 2].
На этом фоне электросудорожная терапия (ЭСТ) сохраняет свой уникальный статус. Будучи внедренной в клиническую практику более восьмидесяти лет назад, данная методика по-прежнему рассматривается как наиболее эффективное вмешательство при тяжелых и резистентных формах БДР [7, 8]. Ее преимущества заключаются не только в высоких показателях терапевтического ответа, но и в исключительной скорости наступления терапевтического эффекта, что имеет особое значение при клинических состояниях, сопряженных с высоким риском (например, при выраженной суицидальной симптоматике) [7, 8].
Тем не менее парадоксальная ситуация заключается в том, что, несмотря на многолетний клинический опыт и накопленный массив данных, механизмы действия ЭСТ остаются до конца не раскрытыми [9]. Эта неопределенность формирует пространство для интенсивных научных дискуссий и одновременно служит стимулом для поиска новых моделей патогенеза депрессии. Таким образом, исследование нейробиологических основ ЭСТ не только проясняет механизмы ее терапевтической эффективности, но и вносит вклад в понимание фундаментальных закономерностей функционирования головного мозга при аффективных расстройствах.
В настоящем обзоре основное внимание уделяется нейробиологическим механизмам ЭСТ, которые в настоящее время рассматриваются как наиболее значимые в объяснении ее клинической эффективности при БДР. Мы сознательно ограничились анализом основных и наиболее изученных концепций, не ставя задачей исчерпывающее рассмотрение всех гипотез. Кроме того, вопросы сравнительной эффективности ЭСТ с другими методами лечения и детальное обсуждение когнитивных побочных эффектов выходят за рамки целей данной работы.
Электросудорожная терапия: краткая характеристика метода
ЭСТ представляет собой метод индуцирования генерализованного тонико-клонического судорожного приступа посредством кратковременных электрических импульсов, подаваемых через электроды, фиксированные на коже головы [9, 12, 13]. Процедура проводится под общей анестезией с применением миорелаксантов, что обеспечивает безопасность и предотвращает соматические осложнения [1, 7, 10, 14, 15].
Современные протоколы ЭСТ используют прямоугольные импульсы длительностью от 0,25 до 1 мс, при этом данные клинических исследований подтверждают преимущество ультракоротких импульсов (<0,5 мс) по профилю переносимости при сопоставимой терапевтической эффективности [10, 12, 13, 16]. Стимуляция проводится с чередующейся полярностью, при частоте до 120 Гц и продолжительности серии до 8 секунд [10, 12, 13, 16]. Амплитуда импульсов фиксируется в диапазоне 800-900 мА, что обеспечивает достижение порога нейронной деполяризации [10]. Конфигурация электродов при ЭСТ играет критическую роль: битемпоральное размещение обеспечивает максимальную эффективность, но сопряжено с более выраженными когнитивными побочными эффектами, тогда как правостороннее одностороннее и бифронтальное варианты демонстрируют сопоставимый антидепрессивный эффект при меньшем риске амнестических нарушений [10, 11-13].
Клиническая эффективность ЭСТ при БДР подтверждена многочисленными исследованиями и метаанализами. Показатели ответа достигают 60-80%, при этом редукция симптоматики наступает быстрее, чем при психофармакотерапии [1, 4, 7, 17]. Более того, систематические обзоры указывают на превосходство ЭСТ над репетитивной транскраниальной магнитной стимуляцией (рТМС) и фармакотерапией, включая применение кетамина [17-19].
Профиль безопасности ЭСТ значительно улучшился за счет развития анестезиологического обеспечения, оптимизации параметров стимуляции и внедрения более фокальных конфигураций электродов [12-14]. Несмотря на сохраняющийся риск когнитивных нарушений – преимущественно транзиторной антероградной и ретроградной амнезии, – современные протоколы позволяют минимизировать их выраженность [10, 12, 13, 20]. Таким образом, ЭСТ в современных условиях сохраняет статус наиболее эффективного и быстродействующего метода терапии тяжелой и резистентной депрессии при приемлемом соотношении «эффективность–побочные эффекты» [4, 21-23].
Механизмы терапевтического действия ЭСТ
Точный механизм действия ЭСТ остается до конца неясным, несмотря на ее более чем восьмидесятилетнее применение в клинической практике. В последние годы был достигнут значительный прогресс в понимании ее эффектов, однако единая теория пока не сформирована [4, 7, 9]. Исторически антидепрессивное действие ЭСТ связывали преимущественно с самим фактом индуцированного судорожного припадка, тогда как нейрокогнитивные побочные эффекты объяснялись прямым воздействием электрической стимуляции на головной мозг [10]. Эти представления во многом определяли раннюю клиническую практику и способствовали формированию ряда гипотез, часть из которых впоследствии была пересмотрена.
С накоплением данных стало очевидно, что терапевтическое действие ЭСТ опосредуется более сложными нейробиологическими процессами [9]. На разных этапах изучения предлагались теории, акцентирующие внимание на нейрофизиологических, нейробиохимических и нейропластических изменениях. Ключевыми направлениями исследований стали: влияние на моноаминергические системы и баланс нейротрансмиттеров, регуляция нейротрофических факторов (в частности, Brain-Derived Neurotrophic Factor – BDNF), модуляция иммунного ответа и воспалительных цитокинов, перестройка активности гипоталамо-гипофизарно-надпочечниковой (ГГН) оси, нейропластические перестройки в структурах головного мозга, а также эпигенетические механизмы, обеспечивающие долговременную регуляцию экспрессии генов [24].
Современные представления позволяют выделить несколько ведущих концепций, каждая из которых объясняет определенные аспекты действия ЭСТ. На сегодняшний день наибольшее внимание уделяется четырем гипотезам: нейропластической, нейротрансмиттерной, рецепторной и цитокиновой [4, 9]. Эти модели не являются взаимоисключающими – напротив, все больше данных свидетельствует о том, что терапевтический эффект ЭСТ представляет собой результат взаимодействия множества биологических уровней: от молекулярных и клеточных изменений до перестройки функциональных нейрональных сетей.
Таким образом, исследование механизмов ЭСТ выходит за рамки узкоспециальной задачи. Оно имеет значение не только для объяснения высокой эффективности метода при тяжелой и резистентной депрессии, но и для более глубокого понимания патогенеза аффективных расстройств в целом. Этот раздел статьи посвящен как историческим гипотезам, которые определяли ранние подходы к объяснению действия ЭСТ, так и современным концепциям, основанным на данных нейровизуализации, молекулярной биологии и клинической нейропсихиатрии.
I. Исторические гипотезы
На ранних этапах применения ЭСТ объяснение ее эффективности во многом строилось на предположениях, которые сегодня утратили актуальность, но сыграли важную роль в формировании дальнейших исследовательских направлений. К числу таких представлений относятся гипотеза амнезии и противосудорожная гипотеза.
Гипотеза амнезии
Согласно этой гипотезе предполагалось, что терапевтический эффект ЭСТ обусловлен утратой воспоминаний о симптомах или травмирующих событиях, способствовавших развитию заболевания [4, 10]. В рамках этой концепции врачи нередко стремились усилить амнестический эффект за счет проведения множественных стимуляций в течение одного сеанса или даже нескольких процедур ЭСТ в день [10]. Несмотря на отсутствие убедительной доказательной базы, гипотеза амнезии долгое время определяла клиническую практику при лечении депрессивных расстройств. Однако последующие наблюдения показали, что методы ЭСТ с более щадящими параметрами – например, правостороннее одностороннее или бифронтальное размещение электродов и использование ультракоротких импульсов – вызывали значительно меньшую амнезию при сопоставимой клинической эффективности [10, 11]. Эти данные позволили сделать важный вывод: терапевтический эффект определяется самим судорожным припадком, тогда как выраженность когнитивных нарушений связана преимущественно с параметрами электрической стимуляции.
Подтверждением несостоятельности амнестической модели стали и результаты нейровизуализационных исследований. Так, динамические изменения в гиппокампе во время курса ЭСТ демонстрировали временное увеличение его объема с последующей нормализацией, что коррелировало с когнитивным восстановлением [4, 25]. Кроме того, регистрировалась повышенная тета-активность в медиальных височных структурах во время двусторонней ЭСТ, что связывали с транзиторной ретроградной амнезией [26]. Позже было показано также участие эндогенных опиоидных систем: высвобождение β-эндорфина и мет-энкефалина коррелировало с потерей памяти, а введение налоксона нивелировало этот эффект [4]. Все это в совокупности указывает на то, что ЭСТ действительно индуцирует обратимые структурные и функциональные изменения в зонах головного мозга, критически значимых для памяти [25]. Однако решающим стало то, что когнитивные побочные эффекты могут быть существенно минимизированы без потери терапевтического результата [11].
Противосудорожная гипотеза
Сформировалась на основе наблюдений, что при проведении серии ЭСТ возрастает порог судорожной готовности и сокращается продолжительность индуцированных припадков [4]. Согласно этой модели, антидепрессивный эффект обусловлен активацией постиктального тормозного каскада в префронтальной коре с усилением ГАМК-ергической нейротрансмиссии [10]. Теория согласуется с моделью дефицита γ-аминомасляной кислоты (ГАМК) при аффективных расстройствах и получила подтверждение в доклинических исследованиях: повышение порога судорожной готовности коррелировало с антидепрессивным ответом, причем у пациентов, ответивших на ЭСТ, динамика этого показателя была более выраженной [10, 27].
Дополнительные данные указывают на специфичность локализации при электровоздействии. Так, высокие дозы правосторонней односторонней и битемпоральной ЭСТ, инициирующие судороги в префронтальных отделах, обеспечивали сопоставимый клинический эффект, тогда как стимуляция моторной коры с низкой дозировкой не сопровождалась улучшением состояния [10, 27]. Электрофизиологические исследования, включая вызванные потенциалы при транскраниальной магнитной стимуляции (ТМС) и показатели длительного кортикального торможения, также подтвердили связь между активацией ГАМК-ергических интернейронов и редукцией суицидальных мыслей [28].
Тем не менее результаты магнитно-резонансной спектроскопии оказались менее однозначными: одни работы демонстрировали увеличение концентрации ГАМК в процессе лечения, другие не выявляли значимых изменений или не находили корреляции с клиническим исходом [29, 30]. Более того, исследование влияния ЭСТ на уровень нейроактивных стероидов, модулирующих ГАМК-рецепторы, также не выявило существенных различий до и после курса терапии [31]. Эти данные поставили под сомнение универсальность противосудорожной модели, а ее концептуальное ограничение заключается в том, что она не объясняет эффективность ЭСТ при расстройствах, отличных от депрессии [32].
Таким образом, обе исторические гипотезы – амнестическая и противосудорожная – сыграли значимую роль в становлении научных представлений об ЭСТ. Первая позволила дифференцировать терапевтический эффект и когнитивные побочные явления, а вторая – связала эффективность ЭСТ с постиктальными нейрофизиологическими изменениями. Несмотря на то, что в современной науке они не рассматриваются как ведущие модели, их вклад заключается в том, что именно от них начался переход к более комплексному пониманию многоуровневых нейробиологических механизмов действия ЭСТ [4, 10].
II. Современные гипотезы
Гипотеза нейрогенеза: структурная перестройка головного мозга
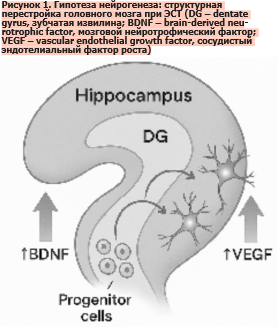 Данная гипотеза рассматривает антидепрессивный эффект ЭСТ как следствие активации процессов клеточной пролиферации и структурной перестройки в ключевых отделах головного мозга [33]. Первоначально эта концепция была сформирована на основании доклинических экспериментов: использование модели электросудорожных припадков у грызунов показало выраженные нейротрофические эффекты в гиппокампе, включая увеличение числа новых клеток в зубчатой извилине, прорастание моховидных волокон и повышение экспрессии синаптических белков, свидетельствующих о синаптогенезе [10, 34]. Дополнительно было продемонстрировано усиление продукции факторов роста, прежде всего мозгового нейротрофического фактора (BDNF) и сосудистого эндотелиального фактора роста (Vascular Endothelial Growth Factor – VEGF), что подтверждает многоуровневый характер индуцированных изменений (рис. 1) [10, 35].
Данная гипотеза рассматривает антидепрессивный эффект ЭСТ как следствие активации процессов клеточной пролиферации и структурной перестройки в ключевых отделах головного мозга [33]. Первоначально эта концепция была сформирована на основании доклинических экспериментов: использование модели электросудорожных припадков у грызунов показало выраженные нейротрофические эффекты в гиппокампе, включая увеличение числа новых клеток в зубчатой извилине, прорастание моховидных волокон и повышение экспрессии синаптических белков, свидетельствующих о синаптогенезе [10, 34]. Дополнительно было продемонстрировано усиление продукции факторов роста, прежде всего мозгового нейротрофического фактора (BDNF) и сосудистого эндотелиального фактора роста (Vascular Endothelial Growth Factor – VEGF), что подтверждает многоуровневый характер индуцированных изменений (рис. 1) [10, 35].
Интересно, что аналогичные эффекты нейрогенеза наблюдаются и при спонтанных эпилептических припадках, что позволяет предположить: именно судорожная активность, а не электрическое поле, играет ключевую роль в запуске данных процессов [10]. Это положение подчеркивает различие между терапевтическими и побочными эффектами ЭСТ: первые определяются припадком, вторые – характеристиками электрической стимуляции.
 Морфологические изменения при ЭСТ подтверждены и на моделях, приближенных к человеку. У взрослых нечеловекообразных приматов электросудорожные припадки индуцировали пролиферацию клеток-предшественников в субгранулярной зоне гиппокампа, причем большинство этих клеток дифференцировалось в нейроны или эндотелиальные клетки [36]. Кроме того, данные о клеточной пролиферации были получены и в лобной коре крыс, хотя новые клетки в этом регионе преимущественно дифференцировались в олигодендроциты
Морфологические изменения при ЭСТ подтверждены и на моделях, приближенных к человеку. У взрослых нечеловекообразных приматов электросудорожные припадки индуцировали пролиферацию клеток-предшественников в субгранулярной зоне гиппокампа, причем большинство этих клеток дифференцировалось в нейроны или эндотелиальные клетки [36]. Кроме того, данные о клеточной пролиферации были получены и в лобной коре крыс, хотя новые клетки в этом регионе преимущественно дифференцировались в олигодендроциты
и эндотелиальные клетки, а не в нейроны [34].
На клиническом уровне гипотеза нейрогенеза проверялась преимущественно косвенными методами – через измерение уровней BDNF в крови пациентов и данные нейровизуализации до и после курса ЭСТ. Два метаанализа показали повышение концентрации BDNF после лечения, однако результаты были гетерогенны, а связь между изменениями уровня фактора и клиническим ответом оставалась неустойчивой [10, 37, 38]. Более того, нейровизуализационные исследования фиксировали изменения объема гиппокампа на ранних этапах лечения, что, вероятно, связано с активацией нейрогенеза и ремоделированием нейрональных сетей [25].
Следовательно, гипотеза нейрогенеза подчеркивает, что ЭСТ индуцирует долговременные морфологические перестройки в головном мозге, выходящие за пределы функциональной нейромодуляции. Эти данные указывают на возможность существования прямой связи между структурным ремоделированием – увеличением числа нейронов, активацией нейротрофических факторов и изменением архитектуры гиппокампа – и клиническим улучшением состояния пациентов с БДР (рис. 1) [34-38]. Несмотря на то, что доказательства у людей остаются фрагментарными, а трансляция данных с животных моделей осложнена межвидовыми различиями, совокупность исследований позволяет рассматривать нейрогенез как важный компонент терапевтического действия ЭСТ [10].
Гипотеза нейропластичности: функциональная адаптация нейрональных сетей
Гипотеза нейропластичности рассматривает ЭСТ как стимул для глубоких перестроек нейрональных сетей, включающих ремоделирование синапсов, глиогенез и изменения в дендритной и аксональной архитектонике [4, 39]. В отличие от гипотезы нейрогенеза, фокусирующейся на формировании новых клеток, эта модель акцентирует внимание на изменении функционирования уже существующих нейронных ансамблей и их связей.
Доклинические исследования на животных показали, что электросудорожная стимуляция вызывает дозозависимое увеличение нейропластических процессов, включая усиление нейрогенеза в зубчатой извилине гиппокампа и активацию глиальных клеток [4]. В клинических условиях подтверждением служат данные о повышении уровней BDNF в плазме крови пациентов после курса ЭСТ, а также о вовлечении других нейротрофических факторов, которые регулируют выживание нейронов и укрепление синаптических контактов [40, 41].
Центральное место в реализации этих эффектов занимает глутаматергическая система. Глутамат как основной возбуждающий медиатор центральной неверной системы регулирует процессы синаптической пластичности, долговременной потенциации и формирования памяти [42]. Быстродействующие антидепрессанты, в частности кетамин, реализуют эффект через модуляцию NMDA- и AMPA-рецепторов: ингибирование NMDA-рецепторов на ГАМК-интернейронах вызывает растормаживание пирамидных клеток, всплеск внеклеточного глутамата и последующую активацию AMPA-рецепторов [43, 44]. Этот каскад сопровождается высвобождением BDNF и активацией mTOR-сигнализации, запускающей процессы синаптогенеза [44].
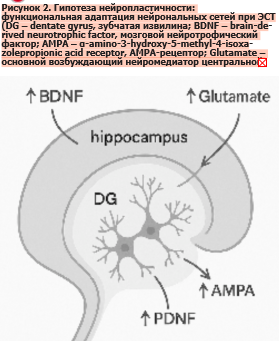
Сходные механизмы обнаружены и для ЭСТ (рис. 2). Показано, что повторные сеансы повышают экспрессию субъединиц AMPA-рецептора (например, GluR1) в зонах гиппокампа, включая зубчатую извилину и поля CA1/CA3, что усиливает передачу по глутаматергическим синапсам и способствует формированию новых сетевых паттернов [4, 29]. При этом результаты некоторых исследований указывают, что эффект ЭСТ может заключаться не столько в усилении возбуждающей передачи, сколько в восстановлении баланса между возбуждением и торможением в различных отделах головного мозга [4].
Таким образом, нейропластическая гипотеза расширяет рамки объяснения действия ЭСТ, показывая, что метод не ограничивается индуцированием припадка, а запускает каскад молекулярных и сетевых адаптаций (рис. 2). Она связывает быстрые клинические эффекты с долговременными изменениями в архитектуре и функциональной динамике нейрональных сетей.
Роль электрического поля
 Одним из ключевых факторов, определяющих антидепрессивные и когнитивные эффекты ЭСТ, является индуцированное электрическое поле. Его характеристики напрямую зависят от параметров стимуляции и конфигурации электродов, что делает эту тему важной для понимания как эффективности при лечении БДР, так и переносимости метода [10].
Одним из ключевых факторов, определяющих антидепрессивные и когнитивные эффекты ЭСТ, является индуцированное электрическое поле. Его характеристики напрямую зависят от параметров стимуляции и конфигурации электродов, что делает эту тему важной для понимания как эффективности при лечении БДР, так и переносимости метода [10].
Количественная оценка распределения электрического поля возможна с использованием различных моделей головы. Первые расчеты выполнялись на основе сферических аппроксимаций, что давало лишь приближенное представление о распределении тока [45]. В дальнейшем были разработаны более точные методы с использованием индивидуальных МРТ-снимков, позволившие моделировать анатомически реалистичные структуры и получать данные о локальных различиях стимуляции [46]. Такой подход открыл возможность сопоставлять электрические параметры с изменениями объема головного мозга, нейропластичностью и клиническими результатами [10].
Результаты вычислительных исследований показали, что при амплитуде 800-900 мА электрическое поле, создаваемое стандартными электродами ЭСТ, охватывает практически весь головной мозг, превышая порог нейронной деполяризации в большинстве его регионов [10]. Это объясняет как широкую терапевтическую эффективность метода при БДР, так и трудности в локализации специфических мишеней его действия.
Различные варианты расположения электродов демонстрируют отчетливые различия в профиле стимуляции [10]. Битемпоральная конфигурация характеризуется наиболее низким порогом судорожной готовности и высокой
клинической эффективностью, однако связана с более выраженными когнитивными нарушениями [10]. Правостороннее одностороннее расположение, напротив, снижает вероятность амнестических побочных эффектов, но требует более высокой дозы стимуляции для достижения терапевтического результата. Бифронтальное размещение рассматривается как компромиссный вариант с умеренными показателями эффективности и когнитивной безопасности [10].
 Сравнение этих конфигураций на основе моделирования показало, что все они имеют нефокальный характер: вне зависимости от расположения электродов, при стандартных параметрах стимуляции активируется практически 100% мозговых структур выше порога деполяризации [45, 46]. При этом региональные различия в распределении электрического поля и локальной возбудимости могут объяснять вариации в эффективности при лечении БДР и когнитивных эффектах между различными методами стимуляции.
Сравнение этих конфигураций на основе моделирования показало, что все они имеют нефокальный характер: вне зависимости от расположения электродов, при стандартных параметрах стимуляции активируется практически 100% мозговых структур выше порога деполяризации [45, 46]. При этом региональные различия в распределении электрического поля и локальной возбудимости могут объяснять вариации в эффективности при лечении БДР и когнитивных эффектах между различными методами стимуляции.
Следовательно, изучение характеристик электрического поля стало одним из направлений, позволяющих связать технические параметры ЭСТ с клиническими результатами. Эта линия исследований открывает возможности для дальнейшей оптимизации процедуры: от разработки более фокальных конфигураций электродов до индивидуализации параметров стимуляции на основе нейровизуализации [10, 45, 46].
Нейроэндокринная гипотеза: дисрегуляция и нормализация оси ГГН
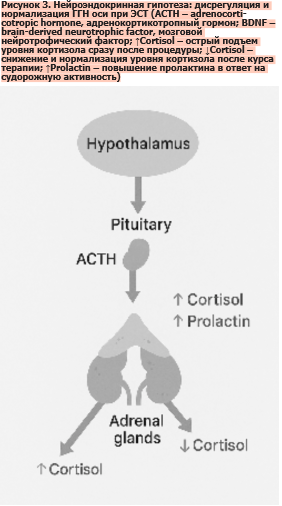
Нейроэндокринная гипотеза объясняет терапевтический эффект ЭСТ через влияние на ГГН ось, которая играет ключевую роль в регуляции стресс-ответа (рис. 3). Еще ранние наблюдения показали, что непосредственно после индуцированного припадка в крови пациентов фиксируется выраженное повышение концентрации адренокортикотропного гормона, кортизола и пролактина, что свидетельствует о мощной активации нейроэндокринных механизмов [4, 47]. Этот острый гормональный всплеск рассматривается как универсальный маркер системной реакции организма на ЭСТ.
Дальнейшие исследования показали, что характер эндокринных изменений носит не только транзиторный, но и регулирующий характер. Так, у части пациентов после завершения курса терапии отмечалось снижение исходно повышенного уровня кортизола, что указывает на восстановление функциональной активности оси ГГН [48]. Эти данные согласуются с клиническими наблюдениями, согласно которым нормализация гиперкортицизма ассоциируется с уменьшением выраженности депрессивных симптомов [4].
Особый интерес представляют результаты, показывающие двунаправленный характер эндокринной динамики: с одной стороны, острое усиление активности ГГН-оси сразу после процедуры, с другой – долгосрочная тенденция к ее стабилизации. Подобная двойственность может объяснять быстрый антидепрессивный эффект ЭСТ, сопровождаемый формированием стойкого терапевтического ответа при курсовом лечении [4].
Нейроэндокринная гипотеза не претендует на универсальное объяснение всех эффектов ЭСТ, но ее значение трудно переоценить (рис. 3). Она интегрирует данные о дисрегуляции стресс-системы при депрессии и демонстрирует, что восстановление ее работы может быть одним из ключевых путей достижения ремиссии. Именно этот аспект делает эндокринные маркеры перспективными кандидатами для прогнозирования ответа на ЭСТ и разработки персонализированных схем терапии [4, 47, 48].
Нейротрансмиттерная гипотеза: модуляция моноаминергических систем
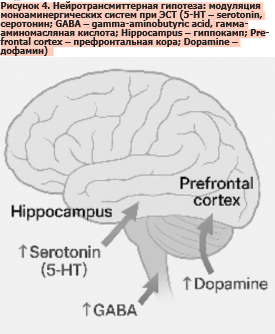
Нейротрансмиттерная гипотеза рассматривает антидепрессивный эффект ЭСТ как следствие комплексных изменений в работе моноаминергических систем головного мозга (рис. 4). Особое внимание уделяется серотонинергической, дофаминергической и ГАМК-ергической передаче, каждая из которых по-своему вносит вклад в клиническое действие метода [4, 49].
Доклинические исследования показали, что ЭСТ усиливает серотонинергическую нейротрансмиссию, повышая экспрессию и функциональную активность постсинаптических рецепторов серотонина 1А (5-HT1A) и 2А (5-HT2A) в гиппокампе и префронтальной коре [4]. У пациентов же в клинических исследованиях наблюдалось снижение связывания этих рецепторов после курса терапии, что может отражать их десенситизацию на фоне усиленной серотонинергической активности [50]. Такая динамика согласуется с современными представлениями о механизмах действия антидепрессантов и подтверждает сходство молекулярных мишеней ЭСТ и психофармакотерапии.
ГАМК-ергическая система также играет ключевую роль. ЭСТ повышает базовый уровень тормозной активности в коре, что связывают как с противосудорожным действием, так и с анксиолитическим эффектом метода [4]. Этот механизм рассматривается как дополнительный фактор стабилизации эмоциональных и когнитивных процессов.
Не менее важным является влияние на дофаминергическую нейротрансмиссию (рис. 4). Считается, что активация дофаминовых систем, вызванная ЭСТ, способствует редукции таких симптомов депрессии, как ангедония, снижение мотивации, когнитивная заторможенность [51]. Клинические наблюдения подтверждают, что после курса ЭСТ у пациентов улучшается концентрация, повышается инициатива и восстанавливается способность к целенаправленной активности.
Совокупность этих данных подчеркивает, что нейротрансмиттерная гипотеза объясняет антидепрессивное действие ЭСТ не изолированно, а через комплексное воздействие на несколько ключевых медиаторных систем. Именно мультифакторность позволяет этой модели хорошо согласовываться с клинической картиной БДР, которая редко ограничивается нарушением одной нейрохимической системы [4, 49-51].
Рецепторная гипотеза: перестройка чувствительности адренергических и дофаминовых рецепторов
Рецепторная гипотеза тесно связана с нейротрансмиттерной моделью, но фокусируется не столько на уровне медиаторов, сколько на изменении чувствительности и экспрессии постсинаптических рецепторов. Согласно этой концепции, депрессия сопровождается нарушением регуляции адренергических и дофаминовых систем, тогда как ЭСТ способна восстанавливать их баланс [4].
Исследования показали, что у пациентов с депрессией наблюдается повышение сродства α2-адренорецепторов в префронтальной коре и гиппокампе. Это состояние ассоциируется с избыточным торможением норадренергической передачи. После курса ЭСТ сродство α2-рецепторов снижается, что ведет к восстановлению нормальной нейротрансмиссии [52]. Таким образом, антидепрессивный эффект может объясняться частично через уменьшение патологической чувствительности этих рецепторов и нормализацию активности норадренергической системы.
Другая линия исследований касается дофаминергической системы. Экспериментальные работы показали, что ЭСТ индуцирует повышение экспрессии генов, кодирующих дофаминовые рецепторы, а также усиливает регуляцию рецепторов D1 в области СА3 гиппокампа [53]. Эти изменения коррелируют с улучшением мотивации и когнитивных функций, что имеет прямое клиническое значение при тяжелой депрессии, сопровождающейся выраженной апатией.
Интересно, что рецепторные перестройки под действием ЭСТ носят не только регионально-специфический, но и долговременный характер. Они обеспечивают адаптацию постсинаптических нейронов к измененным условиям нейротрансмиссии, формируя своего рода «новое равновесие» между медиаторными системами. Это позволяет рассматривать ЭСТ как метод, не просто усиливающий передачу сигнала, но и тонко регулирующий рецепторную чувствительность на уровне отдельных структур мозга [4, 52, 53].
Гипотеза цитокинов: противовоспалительные механизмы ЭСТ
Гипотеза цитокинов рассматривает ЭСТ как вмешательство, способное модулировать иммунную систему и снижать выраженность воспалительных процессов, которые в последние годы все чаще связываются с патогенезом депрессии. Известно, что у пациентов с БДР часто выявляется повышение уровня провоспалительных цитокинов, включая интерлейкин-6 (IL-6) и фактор некроза опухоли-α (TNF-α). Эти изменения коррелируют с тяжестью симптомов и устойчивостью к лечению антидепрессантами [4].
Исследования показали, что курс ЭСТ приводит к значительному снижению концентрации IL-6 и TNF-α, что может отражать противовоспалительный компонент ее терапевтического действия [4, 54]. В некоторых работах отмечено также снижение уровня других медиаторов воспаления, что указывает на системный характер иммунной перестройки под влиянием процедуры.
Особый интерес вызывает согласованность цитокиновой гипотезы с другими моделями действия ЭСТ. Снижение активности воспалительных маркеров может оказывать благоприятное воздействие на процессы нейропластичности, так как хроническое воспаление известно как фактор, подавляющий нейрогенез и способствующий дегенеративным изменениям в структурах головного мозга. Таким образом, уменьшение воспалительного ответа при ЭСТ может рассматриваться как условие для восстановления пластичности и функциональной активности нейрональных сетей [4].
Цитокиновая гипотеза сближает психиатрическую и соматическую медицину, показывая, что терапевтический эффект ЭСТ нельзя ограничить рамками только центральной нервной системы. Регуляция иммунного ответа расширяет понимание механизма ее действия и подчеркивает перспективу поиска биомаркеров ответа на лечение, основанных на изменении цитокинового профиля [4, 54].
Эпигенетические механизмы действия ЭСТ
Эпигенетическая гипотеза рассматривает ЭСТ как метод, способный запускать долговременные изменения экспрессии генов за счет модификаций, не затрагивающих последовательность ДНК. К числу таких процессов относятся метилирование ДНК, посттрансляционные модификации гистонов и регуляция экспрессии с участием некодирующих РНК [55, 56]. Эти механизмы обеспечивают гибкость генома, позволяя нервной системе адаптироваться к внешним и внутренним стрессовым воздействиям.
Важность эпигенетического подхода заключается в том, что он объединяет краткосрочные и долгосрочные эффекты ЭСТ. На молекулярном уровне показано, что электросудорожные припадки могут изменять паттерны метилирования генов, вовлеченных в регуляцию стресс-ответа и нейропластичности. Эти изменения способны сохраняться длительное время после завершения терапии, обеспечивая стойкость клинического эффекта [56, 57].
В доклинических исследованиях на животных было продемонстрировано, что электросудорожные стимуляции вызывают перестройку эпигенетического профиля нейронов, сопровождающуюся усилением экспрессии генов, связанных с факторами роста и формированием синаптических связей [56, 57]. Это подтверждает представление о том, что ЭСТ не ограничивается воздействием на уже существующие пути нейротрансмиссии, но может формировать новую программу функционирования клеток головного мозга.
Клинические данные в этой области пока ограничены. На сегодняшний день систематизированные обзоры фиксируют лишь начальные результаты: у пациентов, получавших ЭСТ, выявлялись изменения в эпигенетическом статусе ряда генов, однако объем выборок остается небольшим, а результаты – неоднородными [55]. Тем не менее даже эти предварительные наблюдения подчеркивают, что ЭСТ следует рассматривать как вмешательство, действующее на молекулярном уровне значительно шире, чем традиционные антидепрессанты.
Эпигенетическая гипотеза делает акцент на возможности «перепрограммирования» нейронов, при котором клинический эффект является следствием долговременной перенастройки экспрессии ключевых генов. Эта перспектива открывает широкие направления для исследований – от поиска эпигенетических биомаркеров ответа на терапию до разработки новых комбинированных подходов, способных усиливать и пролонгировать действие ЭСТ [55–57].
Заключение
ЭСТ остается уникальным методом в современной психиатрии, сочетающим высокую клиническую эффективность и быстрый терапевтический ответ при тяжелых формах депрессии. Современные данные убедительно свидетельствуют, что ее действие обусловлено не изолированным процессом, а сложным взаимодействием нейропластических, нейротрансмиттерных, эндокринных, иммунных и эпигенетических механизмов. Такой многоуровневый характер воздействия позволяет ЭСТ оказывать влияние на ключевые звенья патогенеза большого депрессивного расстройства. Важно отметить, что понимание этих процессов не только расширяет наше знание о самой ЭСТ, но и способствует развитию новых стратегий терапии аффективных расстройств. Дальнейшее изучение молекулярных и сетевых эффектов ЭСТ открывает возможности для оптимизации ее протоколов и индивидуализации лечения. Таким образом, ЭСТ следует рассматривать не только как «золотой стандарт» терапии резистентной депрессии, но и как модель для раскрытия фундаментальных закономерностей функционирования головного мозга.
Информация об авторах
Плиева Аминат Мурадовна, студентка, Ставропольский государственный медицинский университет
ORCID: amiplv13@gmail.com. E-mail: 0009-0008-3011-9543
Быков Юрий Витальевич, к.м.н., доцент кафедры анестезиологии и реаниматологии с курсом ДПО, Ставропольский государственный медицинский университет
ORCID: 0000-0003-4705-3823. E-mail: yubykov@gmail.com
Беккер Роман Александрович, независимый исследователь в области психофармакотерапии, Израиль
ORCID: 0000-0002-0773-3405. E-mail: romanbekker2022@gmail.com
Быкова Анастасия Юрьевна, врач-невролог, городская больница № 3, Ставрополь
ORCID: 0000-0001-9011-1887. E-mail: iambykovanastasia@yandex.ru
Дата поступления: 16.09.2025
Received: 16.09.2025
Принята к печати: 02.12.2025
Accepted: 02.12.2025
Автор заявляет об отсутствии конфликта интересов.
Author declares no conflicts of interest.
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№06 2025
Нейробиологические механизмы электросудорожной терапии при большом депрессивном расстройстве: от исторических гипотез к современным концепциям №06 2025
Номера страниц в выпуске:4-12
Резюме
Большое депрессивное расстройство (БДР) остается одной из наиболее актуальных проблем психиатрии из-за высокой распространенности, клинической сложности и значительного социального бремени. Электросудорожная терапия (ЭСТ), применяемая более восьмидесяти лет, по-прежнему считается наиболее эффективным методом лечения тяжелых и резистентных форм депрессии. Тем не менее механизмы ее действия до конца не изучены. Исторические гипотезы – амнестическая и противосудорожная – оказались недостаточными для объяснения клинического эффекта. Современные исследования фокусируются на многоуровневых нейробиологических процессах. Установлено, что ЭСТ стимулирует нейрогенез и нейропластичность, сопровождающиеся повышением экспрессии нейротрофических факторов (BDNF, VEGF) и перестройкой нейрональных сетей. Существенную роль играют изменения в работе моноаминергических и ГАМК-ергических систем, нормализация гипоталамо-гипофизарно-надпочечниковой оси и противовоспалительные эффекты, связанные со снижением уровня цитокинов. Кроме того, отмечается перестройка чувствительности рецепторов и вовлечение эпигенетических механизмов, обеспечивающих долговременный терапевтический эффект. Эти данные позволяют рассматривать ЭСТ как метод с комплексным и синергичным действием, что объясняет ее уникальную клиническую эффективность при БДР. Понимание механизмов ЭСТ открывает перспективы оптимизации протоколов и персонализации терапии.
Ключевые слова: электросудорожная терапия, большое депрессивное расстройство, нейрогенез, нейропластичность, нейротрансмиттеры, ось ГГН, эпигенетика.
Для цитирования: Плиева A.M., Быков Ю.В., Беккер Р.А., Быкова А.Ю. Нейробиологические механизмы электросудорожной терапии при большом депрессивном расстройстве: от исторических гипотез к современным концепциям. Психиатрия и психофармакотерапия. 2025; 6: 4–12. DOI: 10.62202/2075-1761-2025-27-6-4-12
Большое депрессивное расстройство (БДР) остается одной из наиболее актуальных проблем психиатрии из-за высокой распространенности, клинической сложности и значительного социального бремени. Электросудорожная терапия (ЭСТ), применяемая более восьмидесяти лет, по-прежнему считается наиболее эффективным методом лечения тяжелых и резистентных форм депрессии. Тем не менее механизмы ее действия до конца не изучены. Исторические гипотезы – амнестическая и противосудорожная – оказались недостаточными для объяснения клинического эффекта. Современные исследования фокусируются на многоуровневых нейробиологических процессах. Установлено, что ЭСТ стимулирует нейрогенез и нейропластичность, сопровождающиеся повышением экспрессии нейротрофических факторов (BDNF, VEGF) и перестройкой нейрональных сетей. Существенную роль играют изменения в работе моноаминергических и ГАМК-ергических систем, нормализация гипоталамо-гипофизарно-надпочечниковой оси и противовоспалительные эффекты, связанные со снижением уровня цитокинов. Кроме того, отмечается перестройка чувствительности рецепторов и вовлечение эпигенетических механизмов, обеспечивающих долговременный терапевтический эффект. Эти данные позволяют рассматривать ЭСТ как метод с комплексным и синергичным действием, что объясняет ее уникальную клиническую эффективность при БДР. Понимание механизмов ЭСТ открывает перспективы оптимизации протоколов и персонализации терапии.
Ключевые слова: электросудорожная терапия, большое депрессивное расстройство, нейрогенез, нейропластичность, нейротрансмиттеры, ось ГГН, эпигенетика.
Для цитирования: Плиева A.M., Быков Ю.В., Беккер Р.А., Быкова А.Ю. Нейробиологические механизмы электросудорожной терапии при большом депрессивном расстройстве: от исторических гипотез к современным концепциям. Психиатрия и психофармакотерапия. 2025; 6: 4–12. DOI: 10.62202/2075-1761-2025-27-6-4-12
Neurobiological Mechanisms of Electroconvulsive Therapy in Major Depressive Disorder: From Historical Hypotheses to Contemporary Concepts
Plieva A.M.1, Bykov Yu.V.1, Bekker R.A.2, Bykova A.Yu.31 Stavropol State Medical University, Ministry of Health, Russian Federation, Stavropol, str. Mira, 310, PO 355017;
2 Independent researcher in the field of psychopharmacology, Israel, Azur 5801726, str. Ben-Gurion 26/7
3 Stavropol City Clinical Hospital No. 3, Russian Federation, Stavropol, str. Lenina, 417, PO 355029.
Abstract
Major depressive disorder (MDD) remains one of the most pressing challenges in psychiatry due to its high prevalence, clinical complexity, and significant social burden. Electroconvulsive therapy (ECT), which has been used for more than eighty years, is still considered the most effective treatment for severe and treatment-resistant forms of depression. Nevertheless, its mechanisms of action remain incompletely understood. Historical hypotheses, such as the amnesia and anticonvulsant models, proved insufficient to explain the clinical effects. Contemporary research focuses on multilevel neurobiological processes. It has been demonstrated that ECT stimulates neurogenesis and neuroplasticity, accompanied by increased expression of neurotrophic factors (BDNF, VEGF) and remodeling of neural networks. Significant roles are also played by changes in monoaminergic and GABAergic systems, normalization of the hypothalamic–pituitary–adrenal axis, and anti-inflammatory effects associated with cytokine reduction. In addition, receptor sensitivity modulation and epigenetic mechanisms contribute to the long-term therapeutic effect. These findings support the view of ECT as a treatment with complex and synergistic actions, explaining its unique clinical efficacy in MDD. A deeper understanding of these mechanisms opens perspectives for optimizing treatment protocols and developing personalized approaches.
Keywords: electroconvulsive therapy, major depressive disorder, neurogenesis, neuroplasticity, neurotransmitters, HPA axis, epigenetics.
For citation: Plieva A.M., Bykov Yu.V., Bekker R.A., Bykova A.Yu. Neurobiological Mechanisms of Electroconvulsive Therapy in Major Depressive Disorder: From Historical Hypotheses to Contemporary Concepts. Psychiatry and psychopharmacotherapy. 2025; 6: 4–12. DOI: 10.62202/2075-1761-2025-27-6-4-12
Введение
Большое депрессивное расстройство (БДР) остается одним из наиболее актуальных объектов современной психиатрии, сочетающим клиническую сложность, высокую распространенность и значительные социальные последствия [1-3]. В соответствии с современными диагностическими критериями, диагноз БДР устанавливается при наличии как минимум одного депрессивного эпизода продолжительностью не менее двух недель [2, 4]. Симптоматический спектр включает устойчивое снижение настроения или ангедонию, а также широкий круг нейрокогнитивных и нейровегетативных нарушений: от дефицита концентрации внимания до выраженных расстройств сна и регуляции базовых физиологических функций [2, 5].
Масштаб проблемы подтверждают эпидемиологические данные: более 280 миллионов человек в мире страдают депрессией, причем женщины демонстрируют большую уязвимость по сравнению с мужчинами [3, 6]. Уже в 2008 году Всемирная организация здравоохранения отнесла тяжелую депрессию к трем ведущим причинам глобального бремени болезней, учитывая ее вклад в смертность, заболеваемость и экономические потери [1, 4]. Согласно прогнозам, к 2030 году именно БДР может занять первое место по совокупному влиянию на общественное здоровье [2, 4].
Особое значение имеет терапевтическая перспектива. Несмотря на наличие широкого спектра фармакологических и психотерапевтических стратегий, доля пациентов с недостаточным ответом на терапию первой линии остается высокой, а риск рецидива при БДР стабильно превышает показатели большинства других психических расстройств [1, 7]. Именно поэтому поиск и использование методов, обладающих большей клинической эффективностью, остается ключевой задачей современной биологической психиатрии [1, 2].
На этом фоне электросудорожная терапия (ЭСТ) сохраняет свой уникальный статус. Будучи внедренной в клиническую практику более восьмидесяти лет назад, данная методика по-прежнему рассматривается как наиболее эффективное вмешательство при тяжелых и резистентных формах БДР [7, 8]. Ее преимущества заключаются не только в высоких показателях терапевтического ответа, но и в исключительной скорости наступления терапевтического эффекта, что имеет особое значение при клинических состояниях, сопряженных с высоким риском (например, при выраженной суицидальной симптоматике) [7, 8].
Тем не менее парадоксальная ситуация заключается в том, что, несмотря на многолетний клинический опыт и накопленный массив данных, механизмы действия ЭСТ остаются до конца не раскрытыми [9]. Эта неопределенность формирует пространство для интенсивных научных дискуссий и одновременно служит стимулом для поиска новых моделей патогенеза депрессии. Таким образом, исследование нейробиологических основ ЭСТ не только проясняет механизмы ее терапевтической эффективности, но и вносит вклад в понимание фундаментальных закономерностей функционирования головного мозга при аффективных расстройствах.
В настоящем обзоре основное внимание уделяется нейробиологическим механизмам ЭСТ, которые в настоящее время рассматриваются как наиболее значимые в объяснении ее клинической эффективности при БДР. Мы сознательно ограничились анализом основных и наиболее изученных концепций, не ставя задачей исчерпывающее рассмотрение всех гипотез. Кроме того, вопросы сравнительной эффективности ЭСТ с другими методами лечения и детальное обсуждение когнитивных побочных эффектов выходят за рамки целей данной работы.
Электросудорожная терапия: краткая характеристика метода
ЭСТ представляет собой метод индуцирования генерализованного тонико-клонического судорожного приступа посредством кратковременных электрических импульсов, подаваемых через электроды, фиксированные на коже головы [9, 12, 13]. Процедура проводится под общей анестезией с применением миорелаксантов, что обеспечивает безопасность и предотвращает соматические осложнения [1, 7, 10, 14, 15].
Современные протоколы ЭСТ используют прямоугольные импульсы длительностью от 0,25 до 1 мс, при этом данные клинических исследований подтверждают преимущество ультракоротких импульсов (<0,5 мс) по профилю переносимости при сопоставимой терапевтической эффективности [10, 12, 13, 16]. Стимуляция проводится с чередующейся полярностью, при частоте до 120 Гц и продолжительности серии до 8 секунд [10, 12, 13, 16]. Амплитуда импульсов фиксируется в диапазоне 800-900 мА, что обеспечивает достижение порога нейронной деполяризации [10]. Конфигурация электродов при ЭСТ играет критическую роль: битемпоральное размещение обеспечивает максимальную эффективность, но сопряжено с более выраженными когнитивными побочными эффектами, тогда как правостороннее одностороннее и бифронтальное варианты демонстрируют сопоставимый антидепрессивный эффект при меньшем риске амнестических нарушений [10, 11-13].
Клиническая эффективность ЭСТ при БДР подтверждена многочисленными исследованиями и метаанализами. Показатели ответа достигают 60-80%, при этом редукция симптоматики наступает быстрее, чем при психофармакотерапии [1, 4, 7, 17]. Более того, систематические обзоры указывают на превосходство ЭСТ над репетитивной транскраниальной магнитной стимуляцией (рТМС) и фармакотерапией, включая применение кетамина [17-19].
Профиль безопасности ЭСТ значительно улучшился за счет развития анестезиологического обеспечения, оптимизации параметров стимуляции и внедрения более фокальных конфигураций электродов [12-14]. Несмотря на сохраняющийся риск когнитивных нарушений – преимущественно транзиторной антероградной и ретроградной амнезии, – современные протоколы позволяют минимизировать их выраженность [10, 12, 13, 20]. Таким образом, ЭСТ в современных условиях сохраняет статус наиболее эффективного и быстродействующего метода терапии тяжелой и резистентной депрессии при приемлемом соотношении «эффективность–побочные эффекты» [4, 21-23].
Механизмы терапевтического действия ЭСТ
Точный механизм действия ЭСТ остается до конца неясным, несмотря на ее более чем восьмидесятилетнее применение в клинической практике. В последние годы был достигнут значительный прогресс в понимании ее эффектов, однако единая теория пока не сформирована [4, 7, 9]. Исторически антидепрессивное действие ЭСТ связывали преимущественно с самим фактом индуцированного судорожного припадка, тогда как нейрокогнитивные побочные эффекты объяснялись прямым воздействием электрической стимуляции на головной мозг [10]. Эти представления во многом определяли раннюю клиническую практику и способствовали формированию ряда гипотез, часть из которых впоследствии была пересмотрена.
С накоплением данных стало очевидно, что терапевтическое действие ЭСТ опосредуется более сложными нейробиологическими процессами [9]. На разных этапах изучения предлагались теории, акцентирующие внимание на нейрофизиологических, нейробиохимических и нейропластических изменениях. Ключевыми направлениями исследований стали: влияние на моноаминергические системы и баланс нейротрансмиттеров, регуляция нейротрофических факторов (в частности, Brain-Derived Neurotrophic Factor – BDNF), модуляция иммунного ответа и воспалительных цитокинов, перестройка активности гипоталамо-гипофизарно-надпочечниковой (ГГН) оси, нейропластические перестройки в структурах головного мозга, а также эпигенетические механизмы, обеспечивающие долговременную регуляцию экспрессии генов [24].
Современные представления позволяют выделить несколько ведущих концепций, каждая из которых объясняет определенные аспекты действия ЭСТ. На сегодняшний день наибольшее внимание уделяется четырем гипотезам: нейропластической, нейротрансмиттерной, рецепторной и цитокиновой [4, 9]. Эти модели не являются взаимоисключающими – напротив, все больше данных свидетельствует о том, что терапевтический эффект ЭСТ представляет собой результат взаимодействия множества биологических уровней: от молекулярных и клеточных изменений до перестройки функциональных нейрональных сетей.
Таким образом, исследование механизмов ЭСТ выходит за рамки узкоспециальной задачи. Оно имеет значение не только для объяснения высокой эффективности метода при тяжелой и резистентной депрессии, но и для более глубокого понимания патогенеза аффективных расстройств в целом. Этот раздел статьи посвящен как историческим гипотезам, которые определяли ранние подходы к объяснению действия ЭСТ, так и современным концепциям, основанным на данных нейровизуализации, молекулярной биологии и клинической нейропсихиатрии.
I. Исторические гипотезы
На ранних этапах применения ЭСТ объяснение ее эффективности во многом строилось на предположениях, которые сегодня утратили актуальность, но сыграли важную роль в формировании дальнейших исследовательских направлений. К числу таких представлений относятся гипотеза амнезии и противосудорожная гипотеза.
Гипотеза амнезии
Согласно этой гипотезе предполагалось, что терапевтический эффект ЭСТ обусловлен утратой воспоминаний о симптомах или травмирующих событиях, способствовавших развитию заболевания [4, 10]. В рамках этой концепции врачи нередко стремились усилить амнестический эффект за счет проведения множественных стимуляций в течение одного сеанса или даже нескольких процедур ЭСТ в день [10]. Несмотря на отсутствие убедительной доказательной базы, гипотеза амнезии долгое время определяла клиническую практику при лечении депрессивных расстройств. Однако последующие наблюдения показали, что методы ЭСТ с более щадящими параметрами – например, правостороннее одностороннее или бифронтальное размещение электродов и использование ультракоротких импульсов – вызывали значительно меньшую амнезию при сопоставимой клинической эффективности [10, 11]. Эти данные позволили сделать важный вывод: терапевтический эффект определяется самим судорожным припадком, тогда как выраженность когнитивных нарушений связана преимущественно с параметрами электрической стимуляции.
Подтверждением несостоятельности амнестической модели стали и результаты нейровизуализационных исследований. Так, динамические изменения в гиппокампе во время курса ЭСТ демонстрировали временное увеличение его объема с последующей нормализацией, что коррелировало с когнитивным восстановлением [4, 25]. Кроме того, регистрировалась повышенная тета-активность в медиальных височных структурах во время двусторонней ЭСТ, что связывали с транзиторной ретроградной амнезией [26]. Позже было показано также участие эндогенных опиоидных систем: высвобождение β-эндорфина и мет-энкефалина коррелировало с потерей памяти, а введение налоксона нивелировало этот эффект [4]. Все это в совокупности указывает на то, что ЭСТ действительно индуцирует обратимые структурные и функциональные изменения в зонах головного мозга, критически значимых для памяти [25]. Однако решающим стало то, что когнитивные побочные эффекты могут быть существенно минимизированы без потери терапевтического результата [11].
Противосудорожная гипотеза
Сформировалась на основе наблюдений, что при проведении серии ЭСТ возрастает порог судорожной готовности и сокращается продолжительность индуцированных припадков [4]. Согласно этой модели, антидепрессивный эффект обусловлен активацией постиктального тормозного каскада в префронтальной коре с усилением ГАМК-ергической нейротрансмиссии [10]. Теория согласуется с моделью дефицита γ-аминомасляной кислоты (ГАМК) при аффективных расстройствах и получила подтверждение в доклинических исследованиях: повышение порога судорожной готовности коррелировало с антидепрессивным ответом, причем у пациентов, ответивших на ЭСТ, динамика этого показателя была более выраженной [10, 27].
Дополнительные данные указывают на специфичность локализации при электровоздействии. Так, высокие дозы правосторонней односторонней и битемпоральной ЭСТ, инициирующие судороги в префронтальных отделах, обеспечивали сопоставимый клинический эффект, тогда как стимуляция моторной коры с низкой дозировкой не сопровождалась улучшением состояния [10, 27]. Электрофизиологические исследования, включая вызванные потенциалы при транскраниальной магнитной стимуляции (ТМС) и показатели длительного кортикального торможения, также подтвердили связь между активацией ГАМК-ергических интернейронов и редукцией суицидальных мыслей [28].
Тем не менее результаты магнитно-резонансной спектроскопии оказались менее однозначными: одни работы демонстрировали увеличение концентрации ГАМК в процессе лечения, другие не выявляли значимых изменений или не находили корреляции с клиническим исходом [29, 30]. Более того, исследование влияния ЭСТ на уровень нейроактивных стероидов, модулирующих ГАМК-рецепторы, также не выявило существенных различий до и после курса терапии [31]. Эти данные поставили под сомнение универсальность противосудорожной модели, а ее концептуальное ограничение заключается в том, что она не объясняет эффективность ЭСТ при расстройствах, отличных от депрессии [32].
Таким образом, обе исторические гипотезы – амнестическая и противосудорожная – сыграли значимую роль в становлении научных представлений об ЭСТ. Первая позволила дифференцировать терапевтический эффект и когнитивные побочные явления, а вторая – связала эффективность ЭСТ с постиктальными нейрофизиологическими изменениями. Несмотря на то, что в современной науке они не рассматриваются как ведущие модели, их вклад заключается в том, что именно от них начался переход к более комплексному пониманию многоуровневых нейробиологических механизмов действия ЭСТ [4, 10].
II. Современные гипотезы
Гипотеза нейрогенеза: структурная перестройка головного мозга
 Данная гипотеза рассматривает антидепрессивный эффект ЭСТ как следствие активации процессов клеточной пролиферации и структурной перестройки в ключевых отделах головного мозга [33]. Первоначально эта концепция была сформирована на основании доклинических экспериментов: использование модели электросудорожных припадков у грызунов показало выраженные нейротрофические эффекты в гиппокампе, включая увеличение числа новых клеток в зубчатой извилине, прорастание моховидных волокон и повышение экспрессии синаптических белков, свидетельствующих о синаптогенезе [10, 34]. Дополнительно было продемонстрировано усиление продукции факторов роста, прежде всего мозгового нейротрофического фактора (BDNF) и сосудистого эндотелиального фактора роста (Vascular Endothelial Growth Factor – VEGF), что подтверждает многоуровневый характер индуцированных изменений (рис. 1) [10, 35].
Данная гипотеза рассматривает антидепрессивный эффект ЭСТ как следствие активации процессов клеточной пролиферации и структурной перестройки в ключевых отделах головного мозга [33]. Первоначально эта концепция была сформирована на основании доклинических экспериментов: использование модели электросудорожных припадков у грызунов показало выраженные нейротрофические эффекты в гиппокампе, включая увеличение числа новых клеток в зубчатой извилине, прорастание моховидных волокон и повышение экспрессии синаптических белков, свидетельствующих о синаптогенезе [10, 34]. Дополнительно было продемонстрировано усиление продукции факторов роста, прежде всего мозгового нейротрофического фактора (BDNF) и сосудистого эндотелиального фактора роста (Vascular Endothelial Growth Factor – VEGF), что подтверждает многоуровневый характер индуцированных изменений (рис. 1) [10, 35].Интересно, что аналогичные эффекты нейрогенеза наблюдаются и при спонтанных эпилептических припадках, что позволяет предположить: именно судорожная активность, а не электрическое поле, играет ключевую роль в запуске данных процессов [10]. Это положение подчеркивает различие между терапевтическими и побочными эффектами ЭСТ: первые определяются припадком, вторые – характеристиками электрической стимуляции.
 Морфологические изменения при ЭСТ подтверждены и на моделях, приближенных к человеку. У взрослых нечеловекообразных приматов электросудорожные припадки индуцировали пролиферацию клеток-предшественников в субгранулярной зоне гиппокампа, причем большинство этих клеток дифференцировалось в нейроны или эндотелиальные клетки [36]. Кроме того, данные о клеточной пролиферации были получены и в лобной коре крыс, хотя новые клетки в этом регионе преимущественно дифференцировались в олигодендроциты
Морфологические изменения при ЭСТ подтверждены и на моделях, приближенных к человеку. У взрослых нечеловекообразных приматов электросудорожные припадки индуцировали пролиферацию клеток-предшественников в субгранулярной зоне гиппокампа, причем большинство этих клеток дифференцировалось в нейроны или эндотелиальные клетки [36]. Кроме того, данные о клеточной пролиферации были получены и в лобной коре крыс, хотя новые клетки в этом регионе преимущественно дифференцировались в олигодендроциты и эндотелиальные клетки, а не в нейроны [34].
На клиническом уровне гипотеза нейрогенеза проверялась преимущественно косвенными методами – через измерение уровней BDNF в крови пациентов и данные нейровизуализации до и после курса ЭСТ. Два метаанализа показали повышение концентрации BDNF после лечения, однако результаты были гетерогенны, а связь между изменениями уровня фактора и клиническим ответом оставалась неустойчивой [10, 37, 38]. Более того, нейровизуализационные исследования фиксировали изменения объема гиппокампа на ранних этапах лечения, что, вероятно, связано с активацией нейрогенеза и ремоделированием нейрональных сетей [25].
Следовательно, гипотеза нейрогенеза подчеркивает, что ЭСТ индуцирует долговременные морфологические перестройки в головном мозге, выходящие за пределы функциональной нейромодуляции. Эти данные указывают на возможность существования прямой связи между структурным ремоделированием – увеличением числа нейронов, активацией нейротрофических факторов и изменением архитектуры гиппокампа – и клиническим улучшением состояния пациентов с БДР (рис. 1) [34-38]. Несмотря на то, что доказательства у людей остаются фрагментарными, а трансляция данных с животных моделей осложнена межвидовыми различиями, совокупность исследований позволяет рассматривать нейрогенез как важный компонент терапевтического действия ЭСТ [10].
Гипотеза нейропластичности: функциональная адаптация нейрональных сетей
Гипотеза нейропластичности рассматривает ЭСТ как стимул для глубоких перестроек нейрональных сетей, включающих ремоделирование синапсов, глиогенез и изменения в дендритной и аксональной архитектонике [4, 39]. В отличие от гипотезы нейрогенеза, фокусирующейся на формировании новых клеток, эта модель акцентирует внимание на изменении функционирования уже существующих нейронных ансамблей и их связей.
Доклинические исследования на животных показали, что электросудорожная стимуляция вызывает дозозависимое увеличение нейропластических процессов, включая усиление нейрогенеза в зубчатой извилине гиппокампа и активацию глиальных клеток [4]. В клинических условиях подтверждением служат данные о повышении уровней BDNF в плазме крови пациентов после курса ЭСТ, а также о вовлечении других нейротрофических факторов, которые регулируют выживание нейронов и укрепление синаптических контактов [40, 41].
Центральное место в реализации этих эффектов занимает глутаматергическая система. Глутамат как основной возбуждающий медиатор центральной неверной системы регулирует процессы синаптической пластичности, долговременной потенциации и формирования памяти [42]. Быстродействующие антидепрессанты, в частности кетамин, реализуют эффект через модуляцию NMDA- и AMPA-рецепторов: ингибирование NMDA-рецепторов на ГАМК-интернейронах вызывает растормаживание пирамидных клеток, всплеск внеклеточного глутамата и последующую активацию AMPA-рецепторов [43, 44]. Этот каскад сопровождается высвобождением BDNF и активацией mTOR-сигнализации, запускающей процессы синаптогенеза [44].
Сходные механизмы обнаружены и для ЭСТ (рис. 2). Показано, что повторные сеансы повышают экспрессию субъединиц AMPA-рецептора (например, GluR1) в зонах гиппокампа, включая зубчатую извилину и поля CA1/CA3, что усиливает передачу по глутаматергическим синапсам и способствует формированию новых сетевых паттернов [4, 29]. При этом результаты некоторых исследований указывают, что эффект ЭСТ может заключаться не столько в усилении возбуждающей передачи, сколько в восстановлении баланса между возбуждением и торможением в различных отделах головного мозга [4].
Таким образом, нейропластическая гипотеза расширяет рамки объяснения действия ЭСТ, показывая, что метод не ограничивается индуцированием припадка, а запускает каскад молекулярных и сетевых адаптаций (рис. 2). Она связывает быстрые клинические эффекты с долговременными изменениями в архитектуре и функциональной динамике нейрональных сетей.
Роль электрического поля
 Одним из ключевых факторов, определяющих антидепрессивные и когнитивные эффекты ЭСТ, является индуцированное электрическое поле. Его характеристики напрямую зависят от параметров стимуляции и конфигурации электродов, что делает эту тему важной для понимания как эффективности при лечении БДР, так и переносимости метода [10].
Одним из ключевых факторов, определяющих антидепрессивные и когнитивные эффекты ЭСТ, является индуцированное электрическое поле. Его характеристики напрямую зависят от параметров стимуляции и конфигурации электродов, что делает эту тему важной для понимания как эффективности при лечении БДР, так и переносимости метода [10].Количественная оценка распределения электрического поля возможна с использованием различных моделей головы. Первые расчеты выполнялись на основе сферических аппроксимаций, что давало лишь приближенное представление о распределении тока [45]. В дальнейшем были разработаны более точные методы с использованием индивидуальных МРТ-снимков, позволившие моделировать анатомически реалистичные структуры и получать данные о локальных различиях стимуляции [46]. Такой подход открыл возможность сопоставлять электрические параметры с изменениями объема головного мозга, нейропластичностью и клиническими результатами [10].
Результаты вычислительных исследований показали, что при амплитуде 800-900 мА электрическое поле, создаваемое стандартными электродами ЭСТ, охватывает практически весь головной мозг, превышая порог нейронной деполяризации в большинстве его регионов [10]. Это объясняет как широкую терапевтическую эффективность метода при БДР, так и трудности в локализации специфических мишеней его действия.
Различные варианты расположения электродов демонстрируют отчетливые различия в профиле стимуляции [10]. Битемпоральная конфигурация характеризуется наиболее низким порогом судорожной готовности и высокой
клинической эффективностью, однако связана с более выраженными когнитивными нарушениями [10]. Правостороннее одностороннее расположение, напротив, снижает вероятность амнестических побочных эффектов, но требует более высокой дозы стимуляции для достижения терапевтического результата. Бифронтальное размещение рассматривается как компромиссный вариант с умеренными показателями эффективности и когнитивной безопасности [10].
 Сравнение этих конфигураций на основе моделирования показало, что все они имеют нефокальный характер: вне зависимости от расположения электродов, при стандартных параметрах стимуляции активируется практически 100% мозговых структур выше порога деполяризации [45, 46]. При этом региональные различия в распределении электрического поля и локальной возбудимости могут объяснять вариации в эффективности при лечении БДР и когнитивных эффектах между различными методами стимуляции.
Сравнение этих конфигураций на основе моделирования показало, что все они имеют нефокальный характер: вне зависимости от расположения электродов, при стандартных параметрах стимуляции активируется практически 100% мозговых структур выше порога деполяризации [45, 46]. При этом региональные различия в распределении электрического поля и локальной возбудимости могут объяснять вариации в эффективности при лечении БДР и когнитивных эффектах между различными методами стимуляции.Следовательно, изучение характеристик электрического поля стало одним из направлений, позволяющих связать технические параметры ЭСТ с клиническими результатами. Эта линия исследований открывает возможности для дальнейшей оптимизации процедуры: от разработки более фокальных конфигураций электродов до индивидуализации параметров стимуляции на основе нейровизуализации [10, 45, 46].
Нейроэндокринная гипотеза: дисрегуляция и нормализация оси ГГН
Нейроэндокринная гипотеза объясняет терапевтический эффект ЭСТ через влияние на ГГН ось, которая играет ключевую роль в регуляции стресс-ответа (рис. 3). Еще ранние наблюдения показали, что непосредственно после индуцированного припадка в крови пациентов фиксируется выраженное повышение концентрации адренокортикотропного гормона, кортизола и пролактина, что свидетельствует о мощной активации нейроэндокринных механизмов [4, 47]. Этот острый гормональный всплеск рассматривается как универсальный маркер системной реакции организма на ЭСТ.
Дальнейшие исследования показали, что характер эндокринных изменений носит не только транзиторный, но и регулирующий характер. Так, у части пациентов после завершения курса терапии отмечалось снижение исходно повышенного уровня кортизола, что указывает на восстановление функциональной активности оси ГГН [48]. Эти данные согласуются с клиническими наблюдениями, согласно которым нормализация гиперкортицизма ассоциируется с уменьшением выраженности депрессивных симптомов [4].
Особый интерес представляют результаты, показывающие двунаправленный характер эндокринной динамики: с одной стороны, острое усиление активности ГГН-оси сразу после процедуры, с другой – долгосрочная тенденция к ее стабилизации. Подобная двойственность может объяснять быстрый антидепрессивный эффект ЭСТ, сопровождаемый формированием стойкого терапевтического ответа при курсовом лечении [4].
Нейроэндокринная гипотеза не претендует на универсальное объяснение всех эффектов ЭСТ, но ее значение трудно переоценить (рис. 3). Она интегрирует данные о дисрегуляции стресс-системы при депрессии и демонстрирует, что восстановление ее работы может быть одним из ключевых путей достижения ремиссии. Именно этот аспект делает эндокринные маркеры перспективными кандидатами для прогнозирования ответа на ЭСТ и разработки персонализированных схем терапии [4, 47, 48].
Нейротрансмиттерная гипотеза: модуляция моноаминергических систем
Нейротрансмиттерная гипотеза рассматривает антидепрессивный эффект ЭСТ как следствие комплексных изменений в работе моноаминергических систем головного мозга (рис. 4). Особое внимание уделяется серотонинергической, дофаминергической и ГАМК-ергической передаче, каждая из которых по-своему вносит вклад в клиническое действие метода [4, 49].
Доклинические исследования показали, что ЭСТ усиливает серотонинергическую нейротрансмиссию, повышая экспрессию и функциональную активность постсинаптических рецепторов серотонина 1А (5-HT1A) и 2А (5-HT2A) в гиппокампе и префронтальной коре [4]. У пациентов же в клинических исследованиях наблюдалось снижение связывания этих рецепторов после курса терапии, что может отражать их десенситизацию на фоне усиленной серотонинергической активности [50]. Такая динамика согласуется с современными представлениями о механизмах действия антидепрессантов и подтверждает сходство молекулярных мишеней ЭСТ и психофармакотерапии.
ГАМК-ергическая система также играет ключевую роль. ЭСТ повышает базовый уровень тормозной активности в коре, что связывают как с противосудорожным действием, так и с анксиолитическим эффектом метода [4]. Этот механизм рассматривается как дополнительный фактор стабилизации эмоциональных и когнитивных процессов.
Не менее важным является влияние на дофаминергическую нейротрансмиссию (рис. 4). Считается, что активация дофаминовых систем, вызванная ЭСТ, способствует редукции таких симптомов депрессии, как ангедония, снижение мотивации, когнитивная заторможенность [51]. Клинические наблюдения подтверждают, что после курса ЭСТ у пациентов улучшается концентрация, повышается инициатива и восстанавливается способность к целенаправленной активности.
Совокупность этих данных подчеркивает, что нейротрансмиттерная гипотеза объясняет антидепрессивное действие ЭСТ не изолированно, а через комплексное воздействие на несколько ключевых медиаторных систем. Именно мультифакторность позволяет этой модели хорошо согласовываться с клинической картиной БДР, которая редко ограничивается нарушением одной нейрохимической системы [4, 49-51].
Рецепторная гипотеза: перестройка чувствительности адренергических и дофаминовых рецепторов
Рецепторная гипотеза тесно связана с нейротрансмиттерной моделью, но фокусируется не столько на уровне медиаторов, сколько на изменении чувствительности и экспрессии постсинаптических рецепторов. Согласно этой концепции, депрессия сопровождается нарушением регуляции адренергических и дофаминовых систем, тогда как ЭСТ способна восстанавливать их баланс [4].
Исследования показали, что у пациентов с депрессией наблюдается повышение сродства α2-адренорецепторов в префронтальной коре и гиппокампе. Это состояние ассоциируется с избыточным торможением норадренергической передачи. После курса ЭСТ сродство α2-рецепторов снижается, что ведет к восстановлению нормальной нейротрансмиссии [52]. Таким образом, антидепрессивный эффект может объясняться частично через уменьшение патологической чувствительности этих рецепторов и нормализацию активности норадренергической системы.
Другая линия исследований касается дофаминергической системы. Экспериментальные работы показали, что ЭСТ индуцирует повышение экспрессии генов, кодирующих дофаминовые рецепторы, а также усиливает регуляцию рецепторов D1 в области СА3 гиппокампа [53]. Эти изменения коррелируют с улучшением мотивации и когнитивных функций, что имеет прямое клиническое значение при тяжелой депрессии, сопровождающейся выраженной апатией.
Интересно, что рецепторные перестройки под действием ЭСТ носят не только регионально-специфический, но и долговременный характер. Они обеспечивают адаптацию постсинаптических нейронов к измененным условиям нейротрансмиссии, формируя своего рода «новое равновесие» между медиаторными системами. Это позволяет рассматривать ЭСТ как метод, не просто усиливающий передачу сигнала, но и тонко регулирующий рецепторную чувствительность на уровне отдельных структур мозга [4, 52, 53].
Гипотеза цитокинов: противовоспалительные механизмы ЭСТ
Гипотеза цитокинов рассматривает ЭСТ как вмешательство, способное модулировать иммунную систему и снижать выраженность воспалительных процессов, которые в последние годы все чаще связываются с патогенезом депрессии. Известно, что у пациентов с БДР часто выявляется повышение уровня провоспалительных цитокинов, включая интерлейкин-6 (IL-6) и фактор некроза опухоли-α (TNF-α). Эти изменения коррелируют с тяжестью симптомов и устойчивостью к лечению антидепрессантами [4].
Исследования показали, что курс ЭСТ приводит к значительному снижению концентрации IL-6 и TNF-α, что может отражать противовоспалительный компонент ее терапевтического действия [4, 54]. В некоторых работах отмечено также снижение уровня других медиаторов воспаления, что указывает на системный характер иммунной перестройки под влиянием процедуры.
Особый интерес вызывает согласованность цитокиновой гипотезы с другими моделями действия ЭСТ. Снижение активности воспалительных маркеров может оказывать благоприятное воздействие на процессы нейропластичности, так как хроническое воспаление известно как фактор, подавляющий нейрогенез и способствующий дегенеративным изменениям в структурах головного мозга. Таким образом, уменьшение воспалительного ответа при ЭСТ может рассматриваться как условие для восстановления пластичности и функциональной активности нейрональных сетей [4].
Цитокиновая гипотеза сближает психиатрическую и соматическую медицину, показывая, что терапевтический эффект ЭСТ нельзя ограничить рамками только центральной нервной системы. Регуляция иммунного ответа расширяет понимание механизма ее действия и подчеркивает перспективу поиска биомаркеров ответа на лечение, основанных на изменении цитокинового профиля [4, 54].
Эпигенетические механизмы действия ЭСТ
Эпигенетическая гипотеза рассматривает ЭСТ как метод, способный запускать долговременные изменения экспрессии генов за счет модификаций, не затрагивающих последовательность ДНК. К числу таких процессов относятся метилирование ДНК, посттрансляционные модификации гистонов и регуляция экспрессии с участием некодирующих РНК [55, 56]. Эти механизмы обеспечивают гибкость генома, позволяя нервной системе адаптироваться к внешним и внутренним стрессовым воздействиям.
Важность эпигенетического подхода заключается в том, что он объединяет краткосрочные и долгосрочные эффекты ЭСТ. На молекулярном уровне показано, что электросудорожные припадки могут изменять паттерны метилирования генов, вовлеченных в регуляцию стресс-ответа и нейропластичности. Эти изменения способны сохраняться длительное время после завершения терапии, обеспечивая стойкость клинического эффекта [56, 57].
В доклинических исследованиях на животных было продемонстрировано, что электросудорожные стимуляции вызывают перестройку эпигенетического профиля нейронов, сопровождающуюся усилением экспрессии генов, связанных с факторами роста и формированием синаптических связей [56, 57]. Это подтверждает представление о том, что ЭСТ не ограничивается воздействием на уже существующие пути нейротрансмиссии, но может формировать новую программу функционирования клеток головного мозга.
Клинические данные в этой области пока ограничены. На сегодняшний день систематизированные обзоры фиксируют лишь начальные результаты: у пациентов, получавших ЭСТ, выявлялись изменения в эпигенетическом статусе ряда генов, однако объем выборок остается небольшим, а результаты – неоднородными [55]. Тем не менее даже эти предварительные наблюдения подчеркивают, что ЭСТ следует рассматривать как вмешательство, действующее на молекулярном уровне значительно шире, чем традиционные антидепрессанты.
Эпигенетическая гипотеза делает акцент на возможности «перепрограммирования» нейронов, при котором клинический эффект является следствием долговременной перенастройки экспрессии ключевых генов. Эта перспектива открывает широкие направления для исследований – от поиска эпигенетических биомаркеров ответа на терапию до разработки новых комбинированных подходов, способных усиливать и пролонгировать действие ЭСТ [55–57].
Заключение
ЭСТ остается уникальным методом в современной психиатрии, сочетающим высокую клиническую эффективность и быстрый терапевтический ответ при тяжелых формах депрессии. Современные данные убедительно свидетельствуют, что ее действие обусловлено не изолированным процессом, а сложным взаимодействием нейропластических, нейротрансмиттерных, эндокринных, иммунных и эпигенетических механизмов. Такой многоуровневый характер воздействия позволяет ЭСТ оказывать влияние на ключевые звенья патогенеза большого депрессивного расстройства. Важно отметить, что понимание этих процессов не только расширяет наше знание о самой ЭСТ, но и способствует развитию новых стратегий терапии аффективных расстройств. Дальнейшее изучение молекулярных и сетевых эффектов ЭСТ открывает возможности для оптимизации ее протоколов и индивидуализации лечения. Таким образом, ЭСТ следует рассматривать не только как «золотой стандарт» терапии резистентной депрессии, но и как модель для раскрытия фундаментальных закономерностей функционирования головного мозга.
Информация об авторах
Плиева Аминат Мурадовна, студентка, Ставропольский государственный медицинский университет
ORCID: amiplv13@gmail.com. E-mail: 0009-0008-3011-9543
Быков Юрий Витальевич, к.м.н., доцент кафедры анестезиологии и реаниматологии с курсом ДПО, Ставропольский государственный медицинский университет
ORCID: 0000-0003-4705-3823. E-mail: yubykov@gmail.com
Беккер Роман Александрович, независимый исследователь в области психофармакотерапии, Израиль
ORCID: 0000-0002-0773-3405. E-mail: romanbekker2022@gmail.com
Быкова Анастасия Юрьевна, врач-невролог, городская больница № 3, Ставрополь
ORCID: 0000-0001-9011-1887. E-mail: iambykovanastasia@yandex.ru
Дата поступления: 16.09.2025
Received: 16.09.2025
Принята к печати: 02.12.2025
Accepted: 02.12.2025
Автор заявляет об отсутствии конфликта интересов.
Author declares no conflicts of interest.
Список исп. литературыСкрыть список1. Быков Ю.В., Беккер Р.А., Резников М.К. Депрессия и резистентность. Москва.: Риор: инфра-м., 2013;374.
2. Suktas A, Ekalaksananan A, Aromseree S et al. Genetic polymorphism involved in major depressive disorder: a systemic review and meta-analysis. BMC Psychiatry. 2024;24(1):716. doi: 10.1186/s12888-024-06195-z.
3. de Campos Tibúrcio P, Maria Marcheti P, Miori Pascon D et al. Therapeutic Guidelines for the Self-Management of Major Depressive Disorder: Scoping Review. Interact J Med Res. 2025:14:e63959. doi: 10.2196/63959.
4. Fetahovic E, Janjic V, Muric M et al. Neurobiological Mechanisms of Electroconvulsive Therapy: Molecular Perspectives of Brain Stimulation. Int J Mol Sci. 2025;26(12):5905. doi: 10.3390/ijms26125905.
5. Marx W., Penninx B.W., Solmi M. et al. Major depressive disorder. Nat. Rev. Dis. Primers. 2023;9:44. doi: 10.1038/s41572-023-00454-1.
6. GBD 2019 Mental Disorders Collaborators Global, regional, and national burden of 12 mental disorders in 204 countries and territories, 1990–2019: A systematic analysis for the global burden of disease study 2019. Lancet Psychiatry. 2022;9:137–150. doi: 10.1016/S2215-0366(21)00395-3.
7. Ousdal OT, Brancati GE, Kessler U et al. The Neurobiological Effects of Electroconvulsive Therapy Studied Through Magnetic Resonance: What Have We Learned, and Where Do We Go? Biol Psychiatry. 2022;91(6):540-549. doi: 10.1016/j.biopsych.2021.05.023.
8. Baldinger-Melich P, Spies M, Bozic I et al. Perspectives in treatment-resistant depression: esketamine and electroconvulsive therapy. Wien Klin Wochenschr. 2025;137(5-6):134-147. doi: 10.1007/s00508-024-02358-w.
9. Ruiz AC, Haseeb A, Baumgartner W et al. New insights into the mechanisms of electroconvulsive therapy in treatment-resistant depression. Front Psychiatry. 2025:16:1614076. doi: 10.3389/fpsyt.2025.1614076.
10. Deng ZD, Robins PL, Regenold W et al. How electroconvulsive therapy works in the treatment of depression: is it the seizure, the electricity, or both? Neuropsychopharmacology. 2024;49(1):150-162. doi: 10.1038/s41386-023-01677-2.
11. Sienaert P, Vansteelandt K, Demyttenaere K, Peuskens J. Randomized comparison of ultra-brief bifrontal and unilateral electroconvulsive therapy for major depression: cognitive side-effects. J Affect Disord. 2010;122:60–7. doi: 10.1016/j.jad.2009.06.011.
12. Быков Ю.В., Беккер Р.А. Минимизация когнитивных нарушений при электросудорожной терапии: реалии и перспективы (обзор литературы с комментариями и рекомендациями) (I часть: теоретическая). В мире научных открытий. 2016;(82):54-92.
13. Быков Ю.В., Беккер Р.А. Минимизация когнитивных нарушений при электросудорожной терапии: реалии и перспективы (Обзор литературы с комментариями и рекомендациями) (II часть: практическая). В мире научных открытий. 2016;12(84):200-272.
14. Нельсон А.И. Электросудорожная терапия в психиатрии, наркологии и неврологии. Москва БИНОМ. Лаборатория знаний. 2005;368.
15. Быков Ю.В. Электросудорожная терапия в практике анестезиолога. Издательство РИОР, 2013;220.
16. Tor PC, Bautovich A, Wang MJ, Martin D, Harvey SB, Loo C. A systematic review and meta-analysis of brief versus ultrabrief right unilateral electroconvulsive therapy for depression. J Clin Psychiatry. 2015;76:e1092–8. doi: 10.4088/JCP.14r09145.
17. Chen J.J., Zhao L.B., Liu Y.Y. et al. Comparative efficacy and acceptability of electroconvulsive therapy versus repetitive transcranial magnetic stimulation for major depression: A systematic review and multiple-treatments meta-analysis. Behav. Brain Res. 2017;320:30–36. doi: 10.1016/j.bbr.2016.11.028.
18. Pagnin D, de Queiroz V, Pini S, Cassano GB. Efficacy of ECT in depression: a meta-analytic review. J ECT. 2004;20:13–20. doi: 10.1097/00124509-200403000-00004.
19. Kho KH, van Vreeswijk MF, Simpson S, Zwinderman AH. A meta-analysis of electroconvulsive therapy efficacy in depression. J ECT. 2003;19:139–47. doi: 10.1097/00124509-200309000-00005.
20. Semkovska M, McLoughlin DM. Objective cognitive performance associated with electroconvulsive therapy for depression: a systematic review and meta-analysis. Biol Psychiatry. 2010;68:568–77. doi: 10.1016/j.biopsych. 2010.06.009.
21. Kritzer M.D., Peterchev A.V., Camprodon J.A. Electroconvulsive therapy: Mechanisms of action, clinical considerations, and future directions. Harv. Rev. Psychiatry. 2023;31:101–113. doi: 10.1097/HRP.0000000000000365.
22. Trifu S., Sevcenco A., Stănescu M., et al. Efficacy of electroconvulsive therapy as a potential first-choice treatment in treatment-resistant depression. Exp. Ther. Med. 2021;22:1281. doi: 10.3892/etm.2021.10716.
23. Быков Ю.В., Беккер Р.А. Электросудорожная терапия как корректор некоторых побочных эффектов антипсихотической терапии. Acta Biomedica Scientifica. 2020;5(2):55-82. https://doi.org/10.29413/ABS.2020-5.2.9
24. Ryan K.M., McLoughlin D.M. From Molecules to Mind: Mechanisms of Action of Electroconvulsive Therapy. Focus Am. J. Psychiatry. 2019;17:73–75. doi: 10.1176/appi.focus.17104.
25. Bassa A., Sagués T., Porta-Casteràs D. et al. The neurobiological basis of cognitive side effects of electroconvulsive therapy: A systematic review. Brain Sci. 2021;11:1273. doi: 10.3390/brainsci11101273.
26. Neuhaus A.H., Gallinat J., Bajbouj M., Reischies F.M. Interictal slow-wave focus in left medial temporal lobe during bilateral electroconvulsive therapy. Neuropsychobiology. 2005;52:183–189. doi: 10.1159/000088861.
27. Sackeim HA. The anticonvulsant hypothesis of the mechanisms of action of ECT: current status. J ECT. 1999;15:5–26. doi: 10.1097/00124509-199903000-00003.
28. Sun Y, Farzan F, Mulsant BH, Rajji TK, Fitzgerald PB, Barr MS, et al. Indicators for remission of suicidal ideation following magnetic seizure therapy in patients with treatment-resistant depression. JAMA Psychiatry. 2016;73:337–45. doi: 10.1001/jamapsychiatry.2015.3097.
29. Sanacora G., Zarate C.A., Krystal J.H., Manji H.K. Targeting the glutamatergic system to develop novel, improved therapeutics for mood disorders. Nat. Rev. Drug Discov. 2008;7:426–437. doi: 10.1038/nrd2462.
30. Knudsen M.K., Near J., Blicher A.B. et al. Magnetic resonance (MR) spectroscopic measurement of γ-aminobutyric acid (GABA) in major depression before and after electroconvulsive therapy. Acta Neuropsychiatr. 2019;31:17–26. doi: 10.1017/neu.2018.22.
31. Baghai TC, di Michele F, Schüle C, Eser D, Zwanzger P, Pasini A, et al. Plasma concentrations of neuroactive steroids before and after electroconvulsive therapy in major depression. Neuropsychopharmacology. 2005;30:1181–6. doi: 10.1038/sj.npp.1300684.
32. Seymour J. Commentary and update on the contribution of the GABA hypothesis to understanding the mechanism of action of electroconvulsive therapy. J ECT. 2021;37:4–9. doi: 10.1097/YCT.0000000000000711.
33. Takamiya A, Kishimoto T, Mimura M. What Can We Tell About the Effect of Electroconvulsive Therapy on the Human Hippocampus? Clin EEG Neurosci. 2023;54(6):584-593. doi: 10.1177/15500594211044066.
34. Madsen TM, Treschow A, Bengzon J, Bolwig TG, Lindvall O, Tingström A. Increased neurogenesis in a model of electroconvulsive therapy. Biol Psychiatry. 2000;47:1043–9. doi: 10.1016/S0006-3223(00)00228-6.
35. Altar CA, Laeng P, Jurata LW, Brockman JA, Lemire A, Bullard J, et al. Electroconvulsive seizures regulate gene expression of distinct neurotrophic signaling pathways. J Neurosci. 2004;24:2667–77. doi: 10.1523/JNEUROSCI.5377-03.2004.
36. Perera T.D., Coplan J.D., Lisanby S.H. et al. Antidepressant-induced neurogenesis in the hippocampus of adult nonhuman primates. J. Neurosci. 2007;27:4894–4901. doi: 10.1523/JNEUROSCI.0237-07.2007.
37. Brunoni AR, Baeken C, Machado-Vieira R, Gattaz WF, Vanderhasselt MA. BDNF blood levels after electroconvulsive therapy in patients with mood disorders: a systematic review and meta-analysis. World J Biol Psychiatry. 2014;15:411–8. doi: 10.3109/15622975.2014.892633.
38. Pelosof R, Santos LAD, Farhat LC, Gattaz WF, Talib L, Brunoni AR. BDNF blood levels after electroconvulsive therapy in patients with mood disorders: An updated systematic review and meta-analysis. World J Biol Psychiatry. 2023;24:24–33. doi: 10.1080/15622975.2022.2058083.
39. Bouckaert F., Sienaert P., Obbels J. et al. ECT: Its brain enabling effects: A review of electroconvulsive therapy–induced structural brain plasticity. J. ECT. 2014;30:143–151. doi: 10.1097/YCT.0000000000000129.
40. Shahin O., Gohar S.M., Ibrahim W. et al Brain-Derived neurotrophic factor (BDNF) plasma level increases in patients with resistant schizophrenia treated with electroconvulsive therapy (ECT) Int. J. Psychiatry Clin. 2022;26:370–375. doi: 10.1080/13651501.2022.2035770.
41. Kato N. Neurophysiological mechanisms of electroconvulsive therapy for depression. Neurosci. Res. 2009;64:3–11. doi: 10.1016/j.neures.2009.01.014.
42. Willard S.S., Koochekpour S. Glutamate, glutamate receptors, and downstream signaling pathways. Int. J. Biol. Sci. 2013;9:948. doi: 10.7150/ijbs.6426.
43. Gilbert J.R., Yarrington J.S., Wills K.E. et al. Glutamatergic signaling drives ketamine-mediated response in depression: Evidence from dynamic causal modeling. Int. J. Neuropsychopharmacol. 2018;21:740–747. doi: 10.1093/ ijnp/pyy041.
44. Zhou W., Wang N., Yang C. et al. Ketamine-induced antidepressant effects are associated with AMPA receptors-mediated upregulation of mTOR and BDNF in rat hippocampus and prefrontal cortex. Eur. Psychiatry. 2014;29:419–423. doi: 10.1016/j.eurpsy.2013.10.005.
45. Deng Z-D, Lisanby SH, Peterchev AV. Electric field strength and focality in electroconvulsive therapy and magnetic seizure therapy: a finite element simulation study. J Neural Eng. 2011;8:016007. doi: 10.1088/1741-2560/8/1/016007.
46. Lee WH, Lisanby SH, Laine AF, Peterchev AV. Comparison of electric field strength and spatial distribution of electroconvulsive therapy and magnetic seizure therapy in a realistic human head model. Eur Psychiatry. 2016;36:55–64. doi: 10.1016/j.eurpsy.2016.03.003.
47. Haskett R.F. Electroconvulsive therapy’s mechanism of action: Neuroendocrine hypotheses. J. ECT. 2014;30:107–110. doi: 10.1097/YCT. 0000000000000143.
48. Burgese D.F., Bassitt D.P. Variation of plasma cortisol levels in patients with depression after treatment with bilateral electroconvulsive therapy. Trends Psychiatry Psychother. 2015;37:27–36. doi: 10.1590/2237-6089-2014-0031.
49. Baldinger P., Lotan A., Frey R., Kasper S. et al. Neurotransmitters and electroconvulsive therapy. J. ECT. 2014;30:116–121. doi: 10.1097/YCT. 0000000000000138.
50. Yatham L.N., Liddle P.F., Lam R.W. et al. Effect of electroconvulsive therapy on brain 5-HT2 receptors in major depression. Br. J. Psychiatry. 2010;196:474–479. doi: 10.1192/bjp.bp.109.069567.
51. Cojocaru A.M., Vasile A.I., Trifu S.C. Neurobiological mechanisms and therapeutic impact of electroconvulsive therapy (ECT) Rom. J. Morphol. Embryol. 2024;65:13. doi: 10.47162/RJME.65.1.02.
52. Lillethorup T.P., Iversen P., Wegener G., Doudet D.J.M., Landau A.M. α2-adrenoceptor binding in Flinders-sensitive line compared with Flinders-resistant line and Sprague-Dawley rats. Acta Neuropsyciatr. 2015;27:345–352. doi: 10.1017/neu.2015.24.
53. Kobayashi K., Imoto Y., Yamamoto F. et al. Rapid and lasting enhancement of dopaminergic modulation at the hippocampal mossy fiber synapse by electroconvulsive treatment. J. Neurophysiol. 2017;117:284–289. doi: 10.1152/jn.00740.2016.
54. Dai X., Zhang R., Deng N et al. Anesthetic Influence on Electroconvulsive Therapy: A Comprehensive Review. Neuropsychiatr. Dis. Treat. 2024;20:1491–1502. doi: 10.2147/NDT.S467695.
55. Coral Castro SC, Bicca C, Bicca B et al. A systematic mini-review of epigenetic mechanisms associated with electroconvulsive therapy in humans. Front Hum Neurosci. 2023:17:1143332. doi: 10.3389/fnhum.2023.1143332.
56. Baker-Andresen D., Ratnu V. S., Bredy T. W. Dynamic DNA methylation: a prime candidate for genomic metaplasticity and behavioral adaptation. Trends Neurosci. 2013;36:3–13. 10.1016/j.tins.2012.09.003
57. Jiang J., Wang J., Li C. Potential mechanisms underlying the therapeutic effects of electroconvulsive therapy. Neurosci. Bull. 2017;33:339–347. 10.1007/s12264-016-0094-x
30 декабря 2025
Количество просмотров: 170


