Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№04 2003
Возможности использования клопиксола (зуклопентиксола) при лечении больных героиновой зависимостью №04 2003
Проблема употребления наркотиков по темпам роста распространенности, медицинским и социальным последствиям в настоящее время выходит на первое место [1]. В связи с этим вопросы клиники и терапии зависимости от наркотиков приобретают приоритетное значение для медицины в целом.
Опыт последних десятилетий показывает, что успешность терапевтических мероприятий зависит от правильно выбранной “мишени” [2]. В случае с болезнями зависимостей такой мишенью является синдром патологического влечения [3–6]. Многими исследователями подчеркивается структурное сходство патологического влечения к психоактивным веществам и сверхценных образований [7]. В пользу этой трактовки свидетельствуют такие признаки, как “охваченность” больного своим пристрастием, отсутствие борьбы мотивов при актуализации патологического влечения, чрезвычайная целеустремленность больного при реализации своих болезненных побуждений, ригидная напряженность; эти эмоциональные проявления соответствуют описанному П.Б. Ганнушкиным (1933) “сверхценному аффекту” [7]. По мнению В.В. Чирко (2002), формирование сверхценной структуры патологического влечения осуществляется по кататимным механизмам бредообразования, в которых основная роль принадлежит аффекту тревоги.
В связи с изложенным, клинически оправданным является использование нейролептиков для купирования синдрома патологического влечения. Использование нейролептиков в наркологической практике позволяет быстро купировать острые состояния, сопровождающиеся психомоторным возбуждением, ажитацией, агрессивным поведением, не только при развитии абстинентного синдрома, но и на более отдаленных этапах заболевания, когда речь идет об актуализации патологического влечения. Несомненно, что назначение каждого нейролептика обусловлено терапевтическими показаниями с учетом особенностей спектра психотропного действия препарата и состояния пациента [8].
В наркологии традиционно использовались такие нейролептические препараты, как аминазин, тизерцин, трифтазин, галоперидол и др. Но все они помимо мощного антипсихотического эффекта обладают рядом существенных недостатков, связанных с побочными реакциями, местно-раздражающим действием, высокой частотой развития осложнений. Поэтому поиск средств, обладающих выраженным психолептическим действием, реализуемым в короткие сроки, и, по возможности, с минимальными побочными реакциями, свойственными “эталонным” нейролептикам, является актуальным.
В этом отношении представляется перспективным препарат "Клопиксол" (зуклопентиксол), производимый фирмой “Х. Лундбек” (Дания).
Клопиксол (зуклопентиксол) – нейролептик, производное тиоксантена. Хлорпромазиновый эквивалент клопиксола составляет 4 единицы. Механизм действия препарата основан на его способности блокировать центральные дофаминергические (D1, D2) рецепторы [9]. У клопиксола есть слабые холинолитические и a-адренолитические свойства [10]. По мнению многих исследователей, клопиксол проявляет определенный тропизм к проявлениям агрессии [6–9]. Помимо мощного антипсихотического действия, клопиксол обладает также специфическим тормозящим эффектом. Клопиксол может оказывать преходящий, быстро выявляющийся еще до проявления антипсихотического действия, зависимый от дозы седативный эффект, что также имеет свои преимущества при купировании острых психотических состояний [8].
Препарат представлен в трех различных лекарственных формах: таблетках (по 2, 10 и 25 мг), ретардированной форме – клопиксол-акуфаз (50мг/мл) и депо-инъекциях (по 200 и 500 мг/мл). Клопиксол-акуфаз используется на первом этапе терапии острых состояний. В психиатрической практике его применяют при острых психозах и состояниях возбуждения, развивающихся в структуре шизофрении и маниакальных фаз маниакально-депрессивного поведения (МДП). Данный препарат совмещает в себе свойства водной и масляной форм. По фармакокинетическим свойствам он занимает промежуточное положение между таблетками и депо-формой. Продолжительность действия одной инъекции составляет 72 ч; максимальная концентрация в плазме крови достигается через 24–48 ч. При необходимости и хорошей переносимости повторное введение препарата может осуществляться уже через 24 ч.
Клопиксол-депо обеспечивает общее антипсихотическое действие в течение 2–4 нед. Дозу этой формы препарата рассчитывают через коэффициент 8, т.е. пероральную суточную дозу клопиксола умножают на 8. Как и любая другая пролонгированная форма, она начинает действовать не сразу, а через 48–72 ч. Назначение этой формы недопустимо без предварительного протокола о хорошей переносимости обычных лекарственных форм.
Исследования клопиксола (зуклопентиксола) в наркологической практике пока еще очень малочисленны [5] но, по предварительным данным, препарат способен быстро купировать поведенческие расстройства с брутальностью и аутоагрессивным поведением. В связи с этим нами была сформулирована цель исследования: изучить терапевтическую эффективность клопиксола в сравнении с галоперидолом. Одной из главных задач исследования являлось оценить влияние препарата на патологическое влечение к наркотику (героину), связанную с ним психопатоподобную и аффективную симптоматику. Назначение препарата происходило после купирования опийного (героинового) абстинентного синдрома, в постабстинентном состоянии.
Всего в исследовании приняли участие 36 мужчин, проходивших стационарный курс лечения в отделении клинической психофармакологии ННЦ наркологии Минздрава РФ. В основную группу были включены 20 больных героиновой наркоманией, контрольную составили 16 пациентов; по основным социально-демографическим и клинико-динамическим показателям группы не отличались (табл. 1).
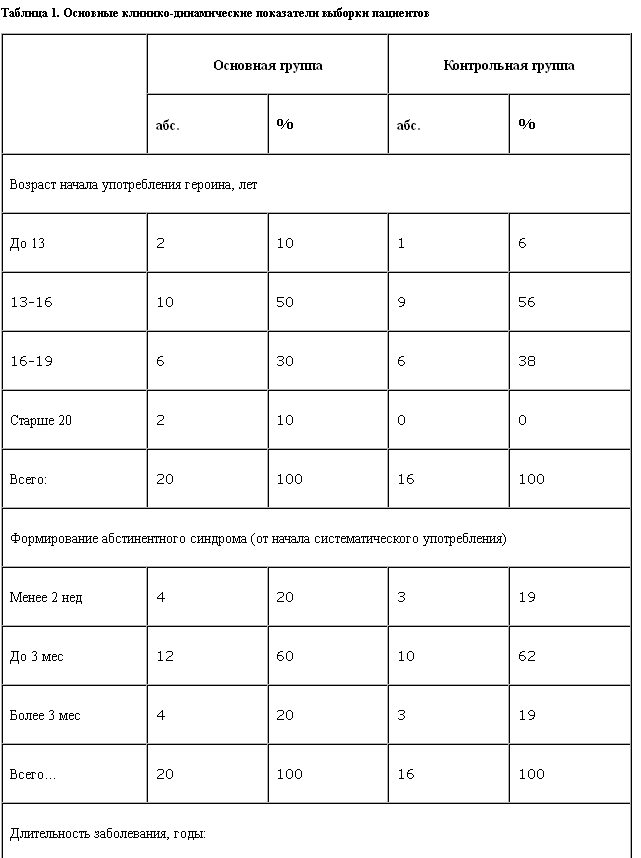
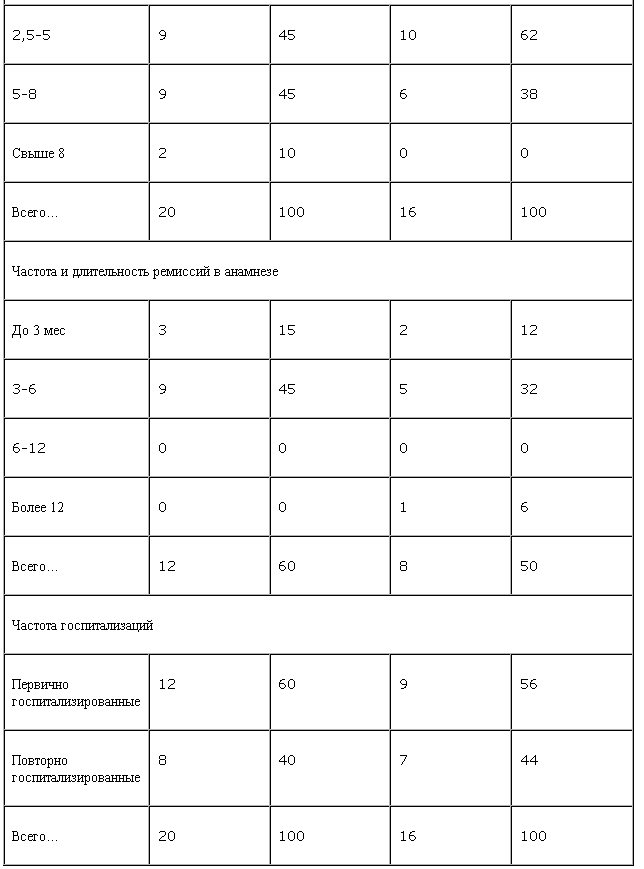
Возраст больных составлял от 18 до 35 лет, средний возраст 23±3,7 года. Диагностика осевых синдромов зависимости проводилась по МКБ-10. У всех больных была сформирована клиническая картина героиновой зависимости, включавшая психическую зависимость, развернутый опийный (героиновый) абстинентный синдром, высокую толерантность, соматические и социальные последствия заболевания. Длительность зависимости варьировала от 2,5 до 8,5 лет. Суточные дозы употребляемого наркотика составляли от 0,3 до 1,5 г героина.
Из исследования исключали лиц, у которых зависимость от героина сочеталась с зависимостью от других групп наркотиков, с хроническими соматическими заболеваниями в стадии обострения, с гиперчувствительностью к препарату, а также принимавших участие в клинических исследованиях в течение предшествующих 3 мес.
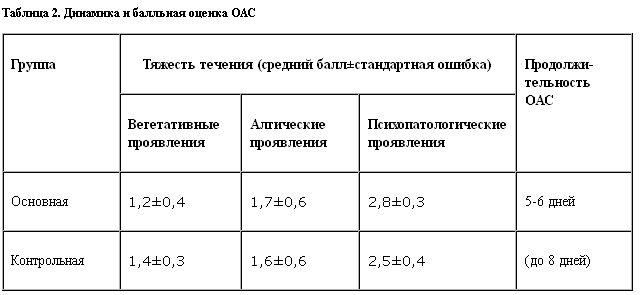
Пациенты поступали на лечение, как правило, с начальными проявлениями опийного (героинового) абстинентного синдрома (ОАС), высоту его развития наблюдали на 2–3-й дни лишения, а редукция основной симптоматики происходила к 5–6-му дню терапии (табл. 2).
Методика клинического испытания и терапевтические схемы
Лечение абстинентного синдрома было комплексным, не отличалось в двух группах, включало назначение антиконвульсантов (финлепсин 400–600 мг), агонистов a2-адренорецепторов (клофелин 0,045–0,06 мг), обезболивающих средств (ксефокам 8–16 мг, трамал до 400 мг), транквилизаторов (реланиум до 40 мг; феназепам до 6–8 мг). При выраженных нарушениях сна назначался тизерцин (50–75 мг внутримышечно или per os). При психомоторном возбуждении дополнительно применяли нейролептики: аминазин до 600–800 мг; тиапридал до 1000–1300 мг; неулептил до 40 мг и др. В зависимости от тяжести клинической картины назначали и другие средства. Применяли также общеукрепляющую, гепатотропную терапию.
На этом этапе в основной группе назначали клопиксол, в контрольной – галоперидол. Клопиксол назначали либо сразу в таблетированной форме в дозе до 100 мг (средняя доза 50–75 мг), либо в форме клопиксол-акуфаз. Начальная доза в таком случае составляла 50 мг (1 мл внутримышечно). В зависимости от клинического эффекта вторую инъекцию производили либо в той же дозе на следующий день (через 24 ч), либо через 3 дня (72 ч) в дозе до 150 мг (3 мл внутримышечно). Начиная с 7-го дня исследования, больных переводили на таблетированный аналог препарата. Суточную дозу препарата рассчитывали, исходя из дозы последней инъекции. Для расчета дозы использовали следующее соотношение: 100 мг клопиксол-акуфаз соответствовало 40 мг клопиксола.
При переходе на лечение клопиксолом-депо в ряде случаев использовали так называемую ко-инъекцию [11]. Одновременно с заключительной (второй или третьей) инъекцией клопиксол-акуфаз в одном шприце вводили 200–400 мг клопиксол-депо (1–2 мл). Последующие дозы клопиксола-депо и интервал между ними определяли в зависимости от психического состояния пациента.
В основной группе больных в постабстинентном состоянии и на этапе становления ремиссии клопиксол был единственным нейролептиком.
В контрольной группе галоперидол назначали по наиболее распространенной в наркологической практике схеме: сначала в течение первых 2–3 дней внутримышечно в дозе 5–10 мг. Как правило, имело место сочетанное применение галоперидола с аминазином (до 100–200 мг) и реланиумом (до 10–20 мг). В дальнейшем пациентов переводили на таблетированные аналоги галоперидола в дозе от 5 до 20 мг в сутки на 3 приема, аминазина в средней дозе 400–800 мг на 4 приема.
При развитии экстрапирамидной симптоматики назначали корректоры (акинетон, циклодол) в адекватных дозировках с соблюдением правил предосторожности.
Обследование больных осуществляли в день поступления (0-й день), в дальнейшем – на 3, 10, 20 и 30-й дни проведения терапии. Состояние больных оценивали клинико-психопатологическим методом. В исследовании использовали специально разработанную в отделении клинической психофармакологии шкалу оценки психопатологических проявлений в постабстинентном состоянии, а также шкалу общего клинического впечатления.
Эффект признавали хорошим, если: достигалась 70% редукция симптомов по шкале оценки психопатологических проявлений на 3-й день; показатели шкалы общего клинического впечатления не превышали 2 баллов на 7-й день исследования. Оценку результатов исследования проводили с использованием стандартных методов статистического анализа.
Результаты исследования
Проведенные клинические исследования позволили оценить терапевтическую эффективность клопиксола как высокую. Клопиксол быстро купировал психомоторное возбуждение, ко 2–3-му дню применения дезактуализировал патологическое влечение к наркотику, заметно снижал выраженность аффективной, дисфорической симптоматики (табл. 3). При применении формы клопиксол-акуфаз терапевтический эффект развивался через 1,5 – 2 ч после инъекции, он проявлялся в общей седации, успокоении и “смягчении” больного.
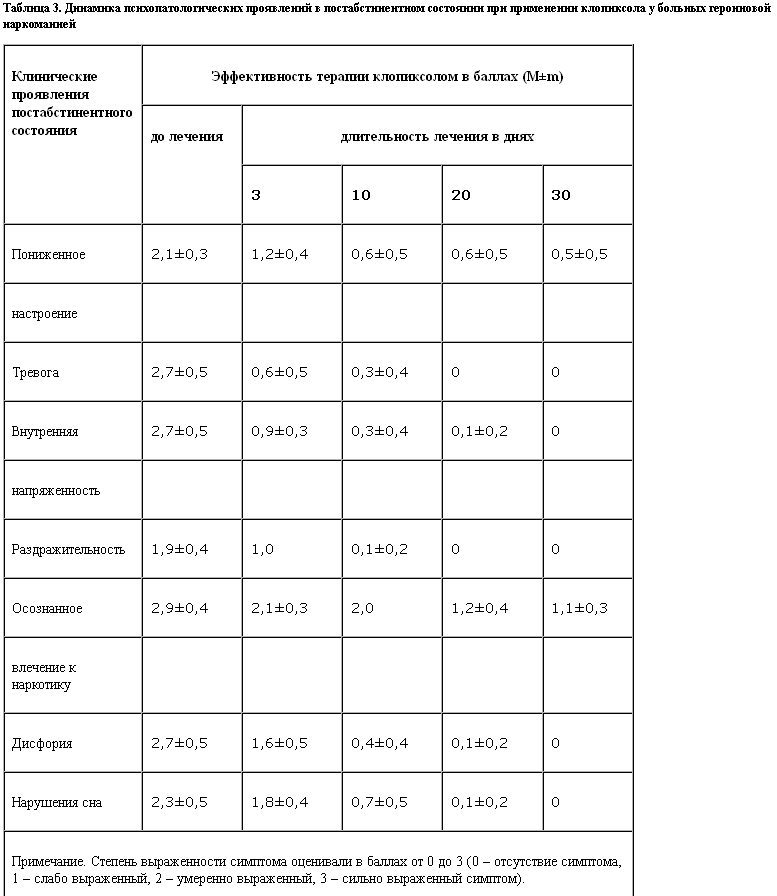
При сравнительном изучении терапевтической эффективности галоперидола и клопиксола в плане действия на отдельные клинические симптомы (напряженность, психомоторное возбуждение – рис. 1, 2) статистически значимых различий в контрольной и основной группе выявлено не было. Однако следует отметить, что клинический эффект галоперидола проявлялся значительно быстрее, максимум в течение 1 ч, в то время как после приема клопиксола заметное изменение состояния развивалось только в течение 2–3 ч.
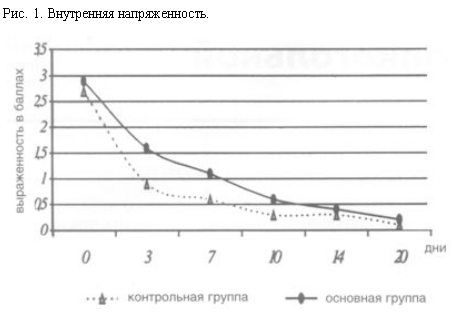
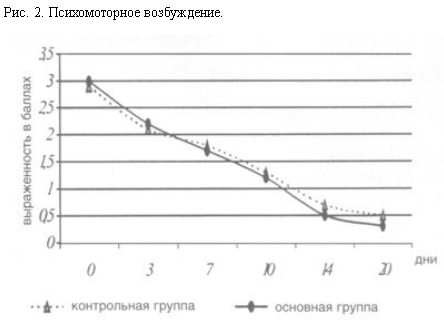
При терапии клопиксолом достоверно реже наблюдали и были менее интенсивными явления “нейролептической загруженности”. Двигательная и психическая заторможенность, эмоциональная индифферентность, отсутствие заинтересованности в происходящем вокруг если и наблюдались в первые дни терапии клопиксолом, то достаточно быстро, уже к 3–4-му дню, проходили. При лечении галоперидолом перечисленная симптоматика встречалась чаще и была более выражена.
Использование шкалы общего клинического впечатления позволило подтвердить значительный терапевтический эффект клопиксола (рис. 3).

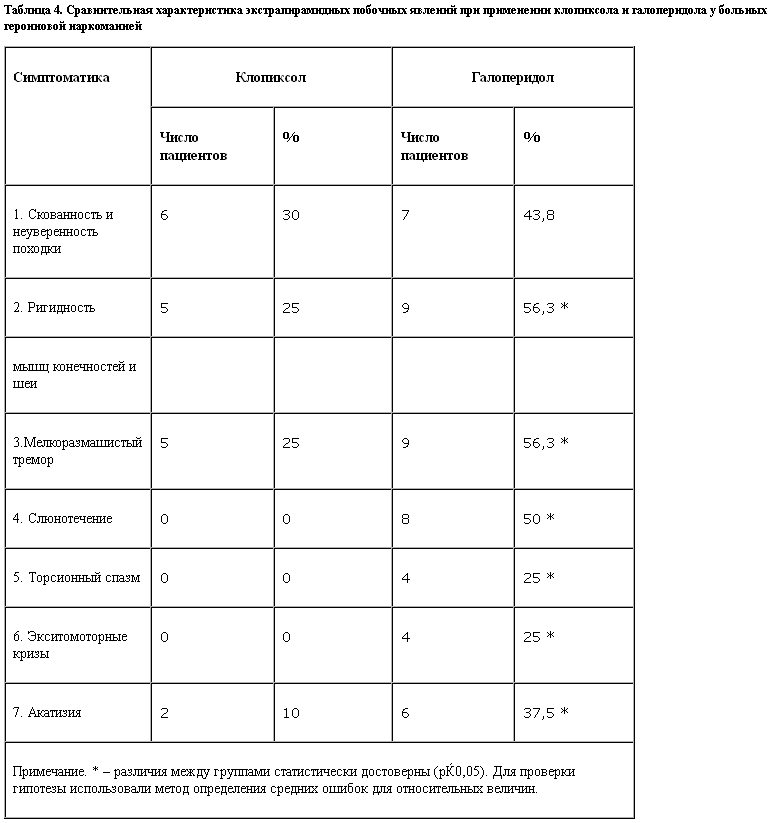
Клопиксол достоверно реже по сравнению с галоперидолом вызывал экстрапирамидные побочные явления. Экстрапирамидная симптоматика при использовании клопиксола проявлялась, как правило, на 3–4-й дни терапии, наиболее часто регистрировались скованность походки, ригидность мышц конечностей и шеи, мелкоразмашистый тремор, но нарастания ее в процессе дальнейшей терапии не было, побочные явления носили невыраженный характер, проходили после разовых назначений корректоров и повторно не возникали.
В контрольной группе экстрапирамидная симптоматика развивалась уже на следующий день после первой инъекции, она была выражена намного сильнее по сравнению с основной группой. Проявлялась слюнотечением, скованностью и неуверенностью походки, выраженной ригидностью мышц конечностей, западением языка и смазанностью речи, акатизией, в ряде случаев – торсионными спазмами. Частота возникновения основных побочных явлений отражена в табл. 4.
После 3 нед лечения с целью стабилизации состояния и профилактики обострения патологического влечения к наркотику больных переводили на пролонгированную форму клопиксола. Дозы препарата определяли клиническими проявлениями болезни, в большинстве случаев они составляли 200 мг – 1 мл. На этом этапе больные помимо клопиксола получали также антидепрессанты (леривон, амитриптилин, лудиомил, анафранил и некоторые другие), ноотропы (аминалон, инстенон, пикамилон), общеукрепляющую, гепатотропную терапию.
Обсуждение
Клиническое исследование препарата "Клопиксол" позволило сделать вывод о его высокой терапевтической эффективности, в ряде случаев не уступающей галоперидолу. Клопиксол, как и галоперидол, достаточно быстро купировал патологическое влечение к наркотику, психомоторное возбуждение. Наиболее выраженное влияние клопиксол оказывал на дисфорическую симптоматику, быстро купировал тревогу, психопатоподобную симптоматику. При использовании клопиксола явления “нейролептической загруженности” были значительно менее выражены по сравнению с галоперидолом. Это свойство, несомненно, является преимуществом препарата, так как позволяет на более ранних этапах включать пациента в психотерапевтическую работу.
При применении препарата не отмечено каких-либо серьезных побочных эффектов и осложнений. В процессе терапии отмечена более хорошая переносимость клопиксола по сравнению с галоперидолом.
Наличие разнообразных лекарственных форм клопиксола позволяет проводить длительную поддерживающую терапию и применять его не только в стационарных, но и в амбулаторных условиях.
Полученные результаты имеют большое значение для лечения больных героиновой зависимостью и позволяют рекомендовать включение клопиксола (зуклопентиксола) как достаточно эффективного и безопасного препарата в комплексные терапевтические программы при лечении данного контингента больных.


