Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№01 2009
Новый подход к терапии неврастении и соматогенной астении (результаты многоцентрового исследования эффективности и безопасности Ладастена) №01 2009
Номера страниц в выпуске:18-26
Распространенность астенических расстройств в населении составляет 1,2–5%, при этом в медицинской сети отмечена высокая обращаемость по поводу нарушений этого круга – от 16 до 64% (в основном к врачам общей практики). Согласно эпидемиологическим данным выраженные астенические расстройства имеют тенденцию к затяжному течению, что сопряжено с повышенной потребностью в обследовании и госпитализации, риском утяжеления соматического заболевания. Кроме того, наличие астенических расстройств приводит к снижению важных параметров качества жизни (трудоспособность, физическое и социальное функционирование) и увеличению дней нетрудоспособности. Анализ результатов клинико-эпидемиологических исследований показал необходимость улучшения распознавания расстройств астенического спектра на этапе первичного обращения и оптимизации лечения этой категории больных на основе современных рекомендаций.
Распространенность астенических расстройств в населении составляет 1,2–5%, при этом в медицинской сети отмечена высокая обращаемость по поводу нарушений этого круга – от 16 до 64% (в основном к врачам общей практики) [1, 2]. Согласно эпидемиологическим данным выраженные астенические расстройства имеют тенденцию к затяжному течению, что сопряжено с повышенной потребностью в обследовании и госпитализации, риском утяжеления соматического заболевания. Кроме того, наличие астенических расстройств приводит к снижению важных параметров качества жизни (трудоспособность, физическое и социальное функционирование) и увеличению дней нетрудоспособности [3, 4]. Анализ результатов клинико-эпидемиологических исследований показал необходимость улучшения распознавания расстройств астенического спектра на этапе первичного обращения и оптимизации лечения этой категории больных на основе современных рекомендаций [5].
Отсутствие стандартных терапевтических рекомендаций по лечению астении во многом связано с тем, что использование традиционных психостимуляторов затруднено из-за трудностей мониторинга, необходимого в связи с риском возникновения синдрома зависимости [6, 7]. Продолжается поиск безопасных психоактивирующих препаратов, позволяющих эффективно воздействовать на разные регистры астенической симптоматики при пограничной психической и соматической патологии. В практических целях нередко проводится терапия ноотропными препаратами или антидепрессантами со стимулирующими свойствами. При этом сугубо эмпирический (не подтвержденный методами доказательной медицины) выбор препаратов часто приводит к достижению парциальных эффектов при повышенном риске нежелательных явлений. Кроме того, такой подход сопровождается нонкомплаентными реакциями (несоблюдением режима и другими нарушениями терапии).
Введение в клиническую практику нового оригинального препарата Ладастен – N-(2-адамантил)-N-(n-бромфенил)-амина, производного адамантана, способствует оптимизации лечения расстройств астенического спектра. Следует отметить, что эффекты Ладастена изучались длительное время (ранее под названием «Бромантан») в лабораторных условиях и внедрение в практику требует валидных клинических исследований [8–10].
Результаты исследования механизмов действия и фармакологических свойств Ладастена показали, что основной эффект препарата связан с активацией высвобождения и биосинтеза дофамина. Привлечение анксиоселективной концепции позволило получить данные о наличии у препарата, помимо основных психостимулирующих эффектов, также селективных анксиолитических свойств [11, 12]. Авторы связывают наличие анксиолитического эффекта у Ладастена с мембранотропными свойствами. В соответствии с их выводами препарат улучшает связывание бензодиазепинового участка ГАМК и рецепторного комплекса, кроме того, он обладает проГАМКергическим действием, связанным со снижением экспрессии гена, который контролирует синтез ГАМК-транспортера, осуществляющего обратный захват ГАМК [13, 14]. Показано, что спектр действия Ладастена определяется дополнительными психотропными и соматотропными свойствами: регулирующими дисфункцию серотонинергической и норадренергической систем, а также элементами иммуностимулирующей (в частности, при вторичных иммунодефицитных расстройствах, вызванных лекарственными средствами) и актопротекторной активности, что делает его перспективным для широкого круга больных, в том числе и проходивших лечение по поводу соматических заболеваний в общемедицинской сети [15–17].
В предварительных исследованиях показано психостимулирующее действие Ладастена на основании значительного улучшения или полного восстановления показателей сниженной физической и умственной активности, общей работоспособности после курсовой коррекции состояний, связанных с пребыванием в экстремальных условиях. Показано, что основная терапевтическая активность Ладастена направлена на редукцию явлений истощаемости психической деятельности и гиперестетическую составляющую астенического синдрома при сочетании превалирующего психостимулирующего и дополнительного анксиолитического действия.
При сопоставлении Ладастена с типичными психостимуляторами (сиднокарб) и другими препаратами стимулирующего действия (ацефен, мефексамид) выявлено избирательное воздействие на нарушения концентрации внимания и системы сложного сенсомоторного реагирования [18].
Среди преимуществ препарата отмечено отсутствие аддиктивных, гипноседативных и миорелаксантных свойств, а также выраженных побочных проявлений гиперстимуляции. Установлен диапазон доз (от 50 до 200 мг), при котором наблюдается благоприятный профиль переносимости, что предполагает возможность его безопасного применения и при наличии соматической патологии. Эти данные также требуют проверки в клинических исследованиях.
Для разработки рекомендаций применения Ладастена было получено разрешение Федеральной службы по надзору в сфере здравоохранения и социального развития Российской Федерации на проведение клинического исследования.
Целью настоящего исследования являлось многоцентровое контролированное плацебо изучение клинических эффектов Ладастена (аспекты эффективности и переносимости) при лечении астенических расстройств: соматогенной астении (СА) и неврастении (НА)1.
Исследование предполагало разрешение следующих задач:
Дизайн исследования
В соответствии с целью и задачами исследования был разработан дизайн, учитывающий современные требования к репрезентативности выборок (число больных в группах сравнения, адекватность контроля), надежности инструмента, определению эффективности методики лечения и валидности статистических методов, используемых для получения достоверных результатов.
В исследовании приняли участие следующие центры Москвы и Санкт-Петербурга, работу в которых возглавили ведущие специалисты: ГУ НЦПЗ РАМН и ММА им. Сеченова, Москва (акад. РАМН А.Б.Смулевич), Московский НИИ психиатрии Росздрава (проф. В.Н.Краснов), НИ психоневрологический институт им. В.М.Бехтерева Росздрава, Санкт-Петербург (проф. Н.Г.Незнанов); ГУ НИИ фармакологии им. В.В.Закусова РАМН (проф. Г.Г.Незнамов); ГНЦ социальной и судебной психиатрии им. В.П.Сербского Росздрава, Москва (проф. А.С.Аведисова). В исследование были включены 180 больных, распределенных в 4 равноценные группы по 45 пациентов:
Критерии отбора
Критерии включения:
1. Соответствие астенических расстройств диагностическим критериям МКБ-10, определяющим рубрики «неврастения» (F48) и «соматогенная астения» [F06.6 – Органическое эмоционально лабильное (астеническое) расстройство, обусловленное соматической болезнью]. На клиническом уровне симптоматика астении в первую очередь определяется повышенной физической и/или психической утомляемостью со снижением уровня активности (дефицитом бодрости, энергии, мотивации) и характерными последствиями: потребностью в дополнительном отдыхе, снижением объема и эффективности привычной деятельности. В числе симптоматологических рядов астении также рассматриваются аффективная лабильность, отдельные соматовегетативные симптомы, субсиндромальные тревожные и депрессивные нарушения, участвующие в формировании и динамике астенических расстройств.
2. Выраженность астении по шкале самооценки астении (MFI-20) более 50 баллов.
3. Выраженность астении по визуальной аналоговой шкале астении (VAS-A) более 5 баллов.
4. Возраст больных в пределах от 18 до 60 лет.
5. Информированное согласие на участие в исследовании до его начала.
В процессе подготовки исследования были выделены базисные клинические критерии, которые, являясь общими для СА и НА, могут рассматриваться как значимые для оценки эффективности Ладастена (табл. 1).
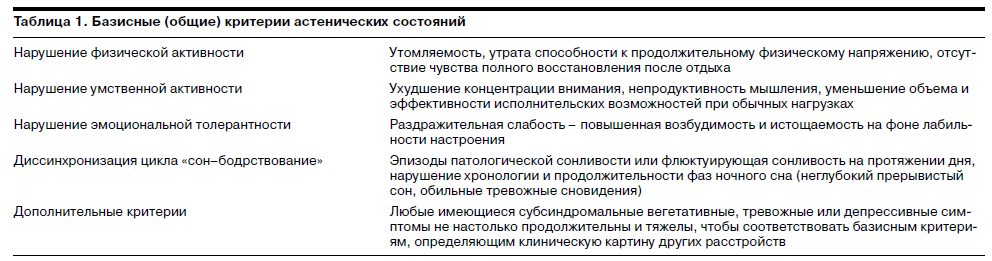
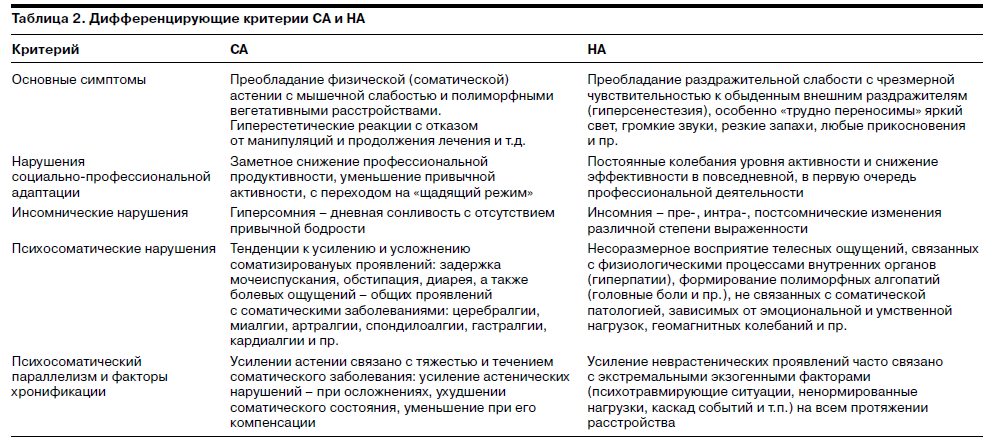
Соответственно при анализе результатов исследования возникает необходимость сопоставления оценок терапевтической динамики при СА и НА, а при определении суммарной эффективности Ладастена в общей выборке выделенные клинические критерии могут быть рассмотрены с точки зрения особенностей воздействия препарата.
Критерии исключения
1. Острый психоз (эндогенно-процессуальный, органический или соматогенный) или состояния, угрожающие жизни пациента.
2. Соматические и неврологические заболевания в острой стадии, наличие тяжелой сердечно-легочной, печеночной или почечной недостаточности.
3. Наличие признаков хронического алкоголизма, лекарственной и наркотической зависимости.
4. Беременность, период кормления ребенка грудью.
5. Индивидуальная непереносимость препарата.
6. Отказ больного от участия в испытаниях или его участие в других клинических испытаниях лекарственных средств. Повторное включение пациента в исследование.
В соответствии с критериями отбора в исследование не включены астенические расстройства, связанные с органическим поражением ЦНС травматического и алкогольного генеза; постэнцефалитический синдром; опухоли головного мозга; дегенеративные заболевания ЦНС, например рассеянный склероз, и т.д.; шизофрению на этапе манифестации или в рамках астенического дефекта; депрессии; генерализованное тревожное расстройство; синдромы алкогольной и/или наркотической зависимости; острые состояния при соматических или неврологических заболеваниях, требующих смены лекарственной терапии.
Методы исследования
Для формализованной оценки исходных и динамических показателей астенических нарушений использован набор стандартных шкал с данными врачей и самооценками пациентов: 1) шкала общего клинического впечатления (CGI), позволяющая количественно оценить терапевтическую эффективность препарата по данным о тяжести состояния (CGI-S) и его динамике (CGI-I); 2) шкала оценки выраженности психопатологической симптоматики, составленная на основе «Унифицированной системы оценки клинико-фармакологического действия психотропных препаратов у больных с пограничными нервно-психическими расстройствами»; 3) шкала субъективной оценки астении MFI-20, определяющая самооценку астенического состояния по сумме баллов 5 характерных субшкал астении; 4) визуальная аналоговая шкала астении (VAS-A), позволяющая получить количественный показатель самоценки тяжести состояния по 10-балльной шкале.
Для оценки безопасности и риска синдрома отмены были использованы шкала регистрации побочных эффектов (UKU) с учетом дат их возникновения и завершения, степень выраженности и врачебный тест по синдрому отмены (PWC), который позволяет по 20 пунктам учесть спектр и тяжесть (1–5 баллов) соответствующих симптомов.
Для оценки переносимости и безопасности Ладастена были сопоставлены общие анализы крови и мочи, а также данные ЭКГ, полученные до начала и после завершения исследования.
Длительность участия пациентов в исследовании составила 42 дня и соответствовала 3 основным периодам: 1) скрининг с обязательным «отмывочным» периодом (7 дней); 2) лекарственная терапия больных: Ладастен или плацебо, начальная доза 100 мг/сут, терапевтическая доза 100–150 мг/сут (28 дней: 2-й визит – начало терапии, 3-й визит – 3 дня, 4-й визит – 7 дней, 5-й визит – 14 дней, 6-й визит – 21 день, 7-й визит – 28 дней; 3) терапевтический плацебо-контроль (7 дней).
В качестве условий прерывания исследования были определены отказ пациента от продолжения терапии, ухудшение состояния с необходимостью смены схемы лечения или выраженные побочные эффекты, требующие прекращения терапии.
Характеристика исходных данных
Данные идентификации обследованных больных общей выборки, СА и НА, включенных в исследование, свидетельствуют о репрезентативности наблюдений (табл. 3).
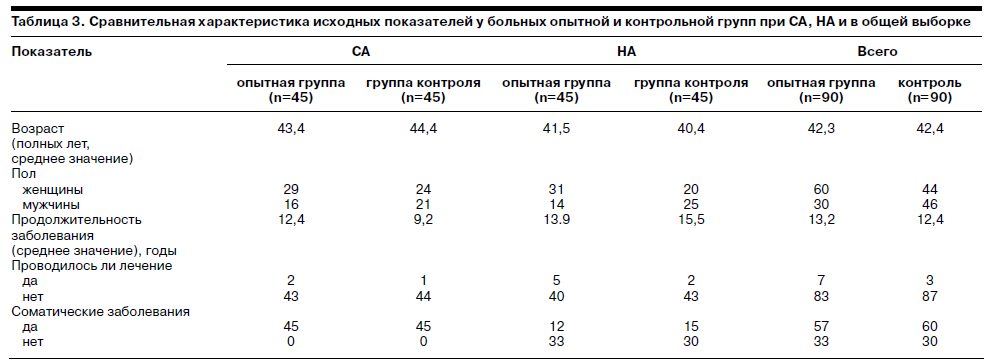
В исходной клинической характеристике существенных различий между опытными (Ладастен) и контрольными (плацебо) группами больных не выявлено, хотя имелись отличия в гендерном распределении при НА: в опытной группе преобладали женщины, в контрольной – мужчины. Средний возраст во всех выборках был сходным (определялся в диапазоне 40,4–44,4 года). Астенические состояния у большинства больных СА и НА отличались затяжным течением, при этом средние значения продолжительности заболевания в опытной и контрольной группах общей выборки были сходными (13,2 и 12,4 мес). Показатели длительности расстройства несколько меньше при СА по сравнению с НА (12,4 мес в опытной и 9,2 мес в контрольной группе против 13,9 и 15,5 мес соответственно). До исследования большинство больных не получали медикаментозного лечения по поводу астении: по данным общей выборки, получали ноотропы и поливитамины 7 больных опытной группы и 3 больных контрольной (<6%: 10 из 180), причем в случае назначения эффект терапии был недостаточным.
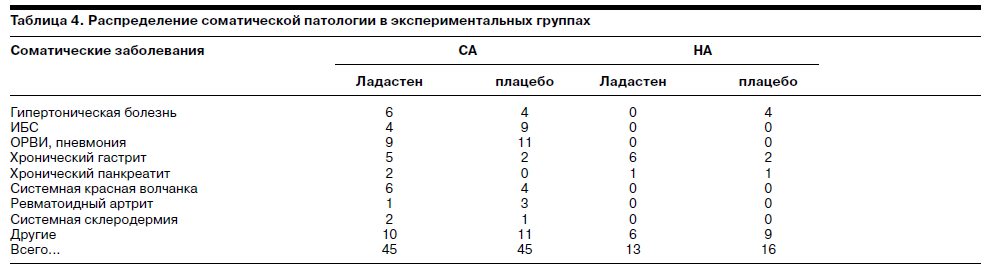
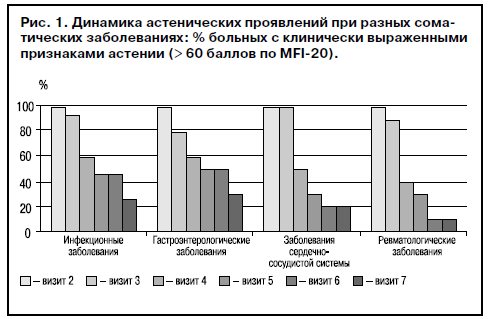
В рамках проверки экологической валидности проведен сравнительный анализ эффективности Ладастена на материале данных шкалы MFI-20 в клинических группах СА при инфекционных, гастроэнтерологических, кардиологических и ревматологических заболеваниях. Для проверки гипотезы о межгрупповых различиях эффективности Ладастена использован непараметрический критерий Крускала–Уоллиса (рис. 1). Сравнение результатов терапии при разных группах соматических заболеваний не выявило статистически достоверных различий в динамике состояния. На момент завершения терапии Ладастеном во всех группах доля больных с клинически выраженными признаками астении (>60 баллов по MFI-20) в группах больных СА не превышала 25%.
По данным общей выборки, до начала лечения с использованием шкал СGI-S, MFI-20, VAS-A обнаружено преобладание астенических нарушений легкой и средней степени тяжести.
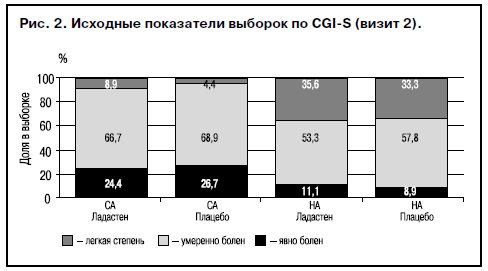
Сравнение показателей степени тяжести астенических состояний до начала лечения в группах СА и НА показало большую выраженность астении при СА. Хотя в обеих группах отмечено преобладание состояний средней тяжести (>53%), при этом у больных СА выраженные/тяжелые нарушения преобладают над легкими, а у больных НА больше легких нарушений, чем выраженных/тяжелых. Отмечены сходные показатели в опытных и контрольных группах, что также свидетельствует в пользу репрезентативности выборки (рис. 2).
При исследовании выборок с использованием шкалы MFI-20 обнаружено, что на скрининговом визите все 100% больных имели по шкале более 60 баллов, что соответствует критерию клинически выраженной астении.
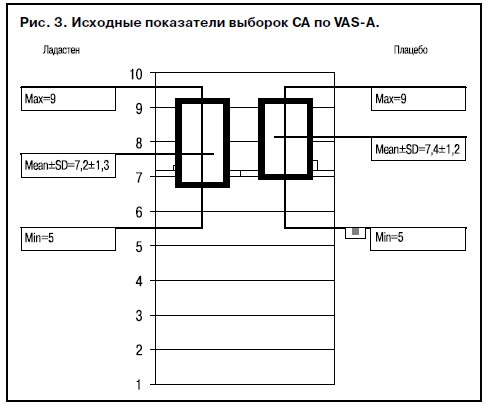
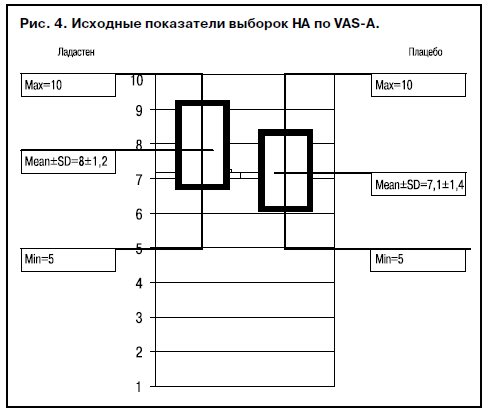
Критерии оценки результатов
Оценку эффективности лечения проводили с использованием данных оценочных шкал. Основными критериями были статистически достоверные изменения параметров CGI-S, CGI-I, шкалы оценки выраженности психопатологической симптоматики. Вторичным инструментом для оценки эффективности являлись данные самооценок по VAS-A, MFI-20.
Безопасность лечения оценивали по частоте нежелательных явлений (выраженность, степень тяжести, длительность и возможная связь с препаратом) и синдрома отмены (количество и степень тяжести отдельных симптомов).
Статистический анализ результатов исследования проведен в соответствии с протоколом. Поскольку объем выборок не позволяет обеспечить достоверно несмещенные параметры распределения (в частности, среднее и дисперсию распределения), то для проверки гипотез об отнесенности данных разных выборок к одной генеральной совокупности использованы непараметрические критерии. Для проверки гипотез об отнесенности данных разных выборок к одной генеральной совокупности применяли непараметрический U-тест Манна–Уитни для сравнения независимых выборок, для сравнения более двух независимых выборок – Н-критерий Крускала–Уоллиса (в качестве достоверного рассматривался уровень вероятности p<0,05). Также применяли процедуры факторного (метод главных компонент с последующим Varimax-вращением), корреляционного анализа (коэффициент корреляции Спирмена). Для повышения наглядности представления полученных результатов был применен метод построения профилей усредненных (среднее арифметическое) и частотных результатов исследований. Статистический анализ осуществляли с помощью статистического пакета SPSS 13.0 for Windows.
Результаты
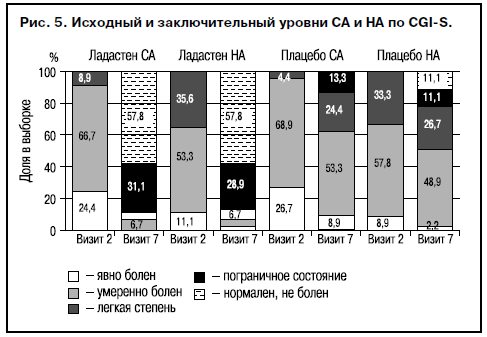
Результаты исследования основаны на анализе динамики состояния 180 больных, полностью завершивших курсовое лечение по программе. При сравнении исходных (визит 2) и заключительных (визит 7) показателей на фоне лечения Ладастеном отмечены различия опытных и контрольных групп по результатам обеих субшкал CGI (CGI-S, CGI-I), оценивающих степень тяжести СА и НА и динамику этих расстройств на фоне лечения (рис. 5). В опытных группах на заключительном визите доля больных, достигших состояния ремиссии («нормален, не болен») была идентична и составила 57,8% (больше половины), из числа оставшихся доля респондеров («пограничное состояние» по CGI-S) составила 31,1% для СА и 28,9% для НА, что значимо отличается от контрольных групп (p<0,05).
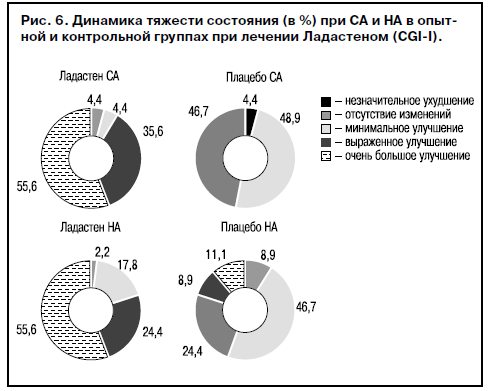
Исследование изменения тяжести состояния по CGI-I показало значимое улучшение к окончанию терапии Ладастеном: эффективная терапия, оцениваемая по критериям «очень большое улучшение» и «выраженное улучшение», была достигнута в 92% случаев в группе СА (следует отметить, что в этой группе исходное состояние зарегистрировано как более тяжелое) и в 80% случаев в группе НА, что также достоверно (p<0,05) отличается от контрольных групп, получавших плацебо (рис. 6).
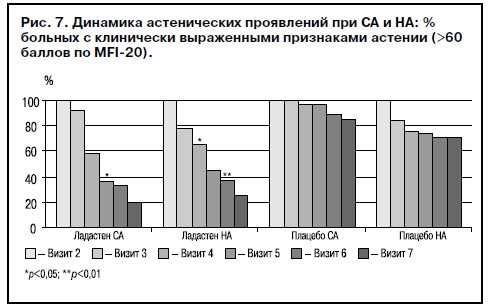
Самооценка динамики состояния по шкале MFI-20 показала, что доля больных с клинически выраженными признаками астении (>60 баллов по MFI-20) достоверно уменьшается на фоне лечения Ладастеном, причем в соответствии со средними значениями этот результат достигается уже на визите 4 в группах СА и НА. Профиль динамики результатов в контрольных группах больных, принимавших плацебо, совершенно иной, и значимого улучшения не обнаружено даже на заключительном визите (рис. 7).
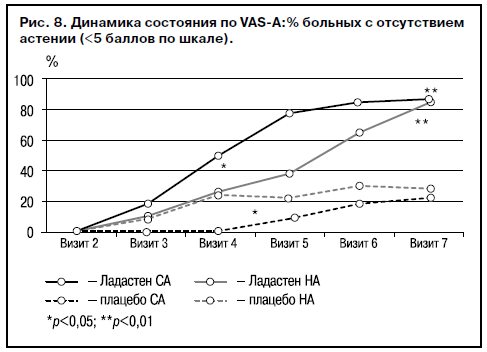
Анализ результатов VAS-A также выявил значимое снижение субъективной тяжести астенических проявлений при лечении Ладастеном в сравнении с плацебо (p<0,01), подтвердив выводы экспертной оценки (рис. 8). Обнаруженные в опытных группах различия: более быстрое снижение числа больных с оценками астении (>5 баллов) в группе СА на визите 4 и в группе НА на визите 5 могут быть связаны с клиническими вариантами самооценки. Оценка своего состояния как более тяжелого больными НА коррелировала с большим удельным весом преморбидных патохарактерологических черт.
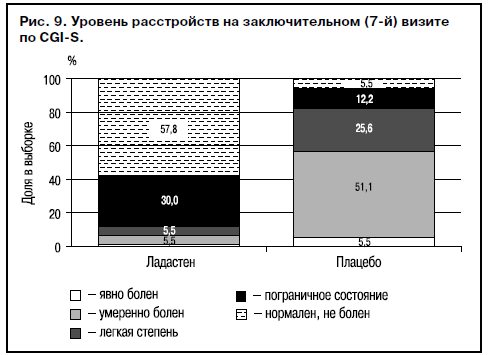
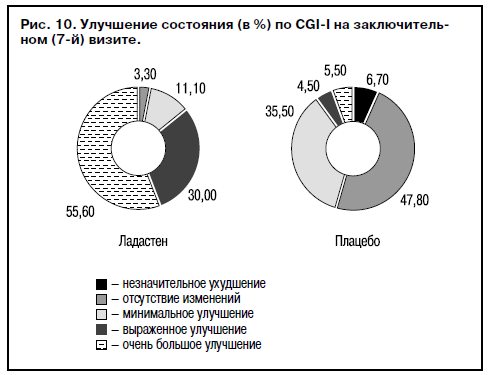
Проведена сравнительная оценка эффективности Ладастена и плацебо в двух общих группах (опытная и контрольная) с привлечением всех показателей совокупной выборки. Получено достоверное различие (p<0,05) между опытной и контрольной группами, причем общая доля респондеров достигала 87,8%, и 2/3 из них были больные, достигшие ремиссии или выздоровления («нормален, не болен») по CGI-S (рис. 9). «Очень большое улучшение» и «существенное улучшение» по CGI-I зарегистрировано у 85,6% больных общей выборки, получавших Ладастен (рис. 10).
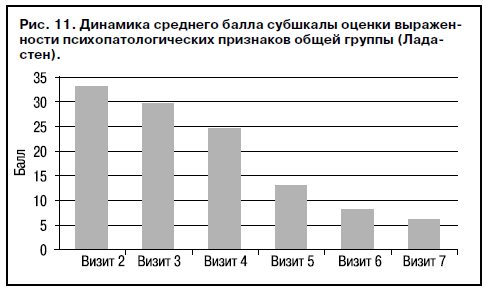
Изучение эффективности лечения по средним суммарным показателям субшкалы оценки выраженности психопатологических признаков общей группы больных (СА и НА), получавших Ладастен, показало, что исходный балл достоверно уменьшается (50% барьер) уже на визите 5 (рис. 11).
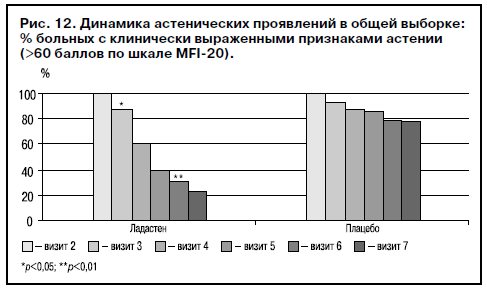
Данные экспертных оценок подтверждены показателями динамики самооценки астении по MFI-20 для общей выборки (рис. 12).
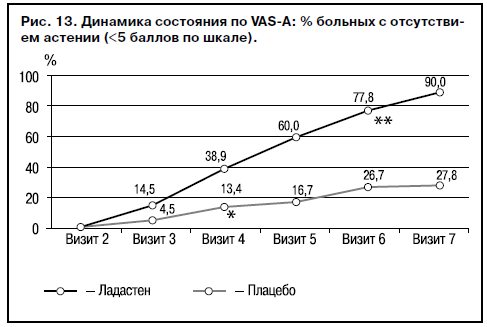
Сравнительная оценка субъективной динамики состояния по шкале VAS-А выявила значимые различия (p<0,05) между опытной и контрольной группами, которые были достигнуты на 4-м визите, причем достоверность различий увеличивалась к заключительному визиту (p<0,01) (рис. 13).
Полученные общие результаты нашли подтверждение при факторном анализе данных шкалы оценки выраженности психопатологической симптоматики, позволившем выделить симптоматологические ряды как статистические критерии и проследить их динамику на фоне терапии. Процедура факторного анализа, направленная на выявление кластеров симптомов, позволила выделить 4 значимых фактора, объясняющих 75% дисперсии и включивших основные проявления астенических расстройств.
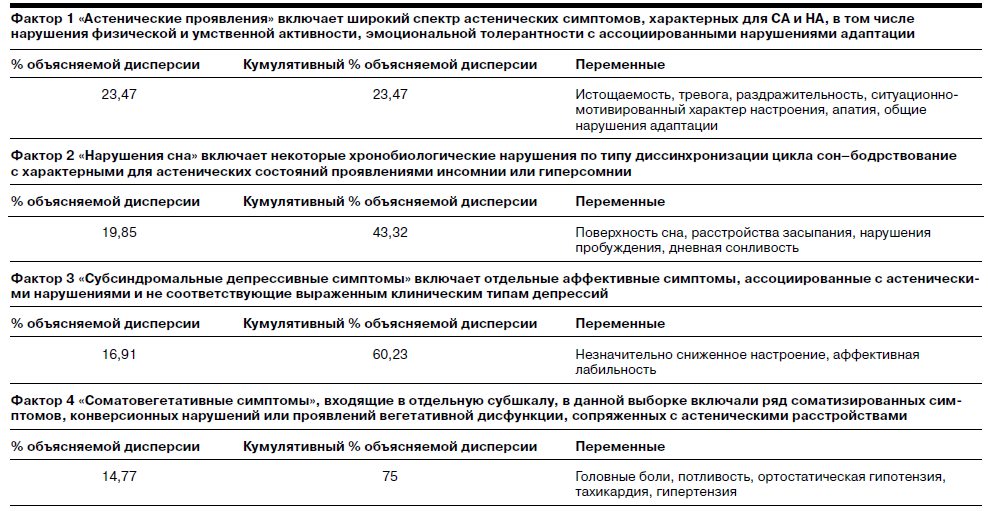
Переменные – симптомы, входящие в фактор, представлены в тексте в порядке убывания факторных нагрузок. По всем факторам отмечены значимые различия между динамикой состояния в группах Ладастена и плацебо (p<0,05). Наибольшая динамика достигается по фактору 1 «Астенические симптомы», включившему центральный симптомокомплекс.
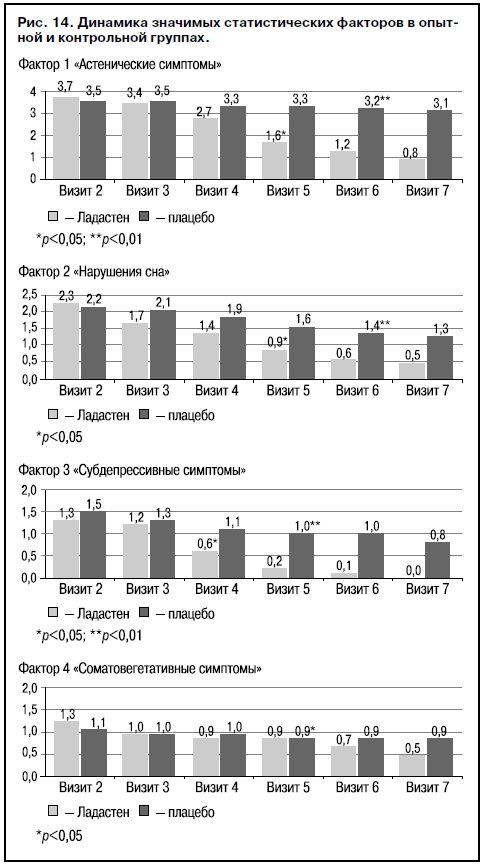
Динамика патологических состояний в соответствии со средними значениями выделенных факторов показывает их значимость для оценки направленности терапевтической активности Ладастена в сравнении с плацебо (рис. 14). К концу лечения (визит 7) эффективность лечения Ладастеном имела достоверные значения как по наиболее характерным для астенических расстройств признакам (повышенная истощаемость, апатия, тревога, повышенная раздражительность, аффективная лабильность, ситуационно-мотивированный характер настроения, расстройства засыпания, нарушение глубины и длительности ночного сна, головные боли, общая адаптация), так и по ряду других нарушений, выявляемых у набранной выборки (сниженное настроение, суточные колебания настроения, расстройства пробуждения, потливость, гипертензия, ортостатические нарушения). В группе пациентов, получавших плацебо, при применении статистических критериев не выявлено существенных изменений показателей, входящих в выделенные факторы. Таким образом, выделенные путем факторного анализа статистические диагностические критерии можно использовать для оценки эффективности терапии наряду со стандартными психометрическими критериями.
Нежелательные явления
У 16 пациентов, принимавших Ладастен, наблюдали нежелательные явления легкой степени (табл. 5). В конце терапии в обеих группах побочных явлений не выявлено.

Признаков синдрома отмены при прекращении лечения Ладастеном не возникало. Вместе с тем у некоторых больных отмечен ряд невыраженных проявлений: раздражительность, тревога, усталость, головокружение, головная боль, нарушения сна, оценка которых, по мнению исследователей, свидетельствовала о резидуальных симптомах астенических расстройств.
Выводы
Проблема расширения набора психотропных средств, эффективных при терапии астенических расстройств, при учете широкой распространенности последних среди контингента общесоматической и психиатрической сети, является одной из актуальных для современной психофармакологии.
В этом плане особое значение приобретает изучение клинических эффектов Ладастена. Ладастен – новый оригинальный отечественный препарат, обладающий выраженным психостимулирующим, а также анксиолитическим эффектом.
В результате изучения эффективности и безопасности Ладастена у больных СА и НА получены следующие данные:
Отсутствие стандартных терапевтических рекомендаций по лечению астении во многом связано с тем, что использование традиционных психостимуляторов затруднено из-за трудностей мониторинга, необходимого в связи с риском возникновения синдрома зависимости [6, 7]. Продолжается поиск безопасных психоактивирующих препаратов, позволяющих эффективно воздействовать на разные регистры астенической симптоматики при пограничной психической и соматической патологии. В практических целях нередко проводится терапия ноотропными препаратами или антидепрессантами со стимулирующими свойствами. При этом сугубо эмпирический (не подтвержденный методами доказательной медицины) выбор препаратов часто приводит к достижению парциальных эффектов при повышенном риске нежелательных явлений. Кроме того, такой подход сопровождается нонкомплаентными реакциями (несоблюдением режима и другими нарушениями терапии).
Введение в клиническую практику нового оригинального препарата Ладастен – N-(2-адамантил)-N-(n-бромфенил)-амина, производного адамантана, способствует оптимизации лечения расстройств астенического спектра. Следует отметить, что эффекты Ладастена изучались длительное время (ранее под названием «Бромантан») в лабораторных условиях и внедрение в практику требует валидных клинических исследований [8–10].
Результаты исследования механизмов действия и фармакологических свойств Ладастена показали, что основной эффект препарата связан с активацией высвобождения и биосинтеза дофамина. Привлечение анксиоселективной концепции позволило получить данные о наличии у препарата, помимо основных психостимулирующих эффектов, также селективных анксиолитических свойств [11, 12]. Авторы связывают наличие анксиолитического эффекта у Ладастена с мембранотропными свойствами. В соответствии с их выводами препарат улучшает связывание бензодиазепинового участка ГАМК и рецепторного комплекса, кроме того, он обладает проГАМКергическим действием, связанным со снижением экспрессии гена, который контролирует синтез ГАМК-транспортера, осуществляющего обратный захват ГАМК [13, 14]. Показано, что спектр действия Ладастена определяется дополнительными психотропными и соматотропными свойствами: регулирующими дисфункцию серотонинергической и норадренергической систем, а также элементами иммуностимулирующей (в частности, при вторичных иммунодефицитных расстройствах, вызванных лекарственными средствами) и актопротекторной активности, что делает его перспективным для широкого круга больных, в том числе и проходивших лечение по поводу соматических заболеваний в общемедицинской сети [15–17].
В предварительных исследованиях показано психостимулирующее действие Ладастена на основании значительного улучшения или полного восстановления показателей сниженной физической и умственной активности, общей работоспособности после курсовой коррекции состояний, связанных с пребыванием в экстремальных условиях. Показано, что основная терапевтическая активность Ладастена направлена на редукцию явлений истощаемости психической деятельности и гиперестетическую составляющую астенического синдрома при сочетании превалирующего психостимулирующего и дополнительного анксиолитического действия.
При сопоставлении Ладастена с типичными психостимуляторами (сиднокарб) и другими препаратами стимулирующего действия (ацефен, мефексамид) выявлено избирательное воздействие на нарушения концентрации внимания и системы сложного сенсомоторного реагирования [18].
Среди преимуществ препарата отмечено отсутствие аддиктивных, гипноседативных и миорелаксантных свойств, а также выраженных побочных проявлений гиперстимуляции. Установлен диапазон доз (от 50 до 200 мг), при котором наблюдается благоприятный профиль переносимости, что предполагает возможность его безопасного применения и при наличии соматической патологии. Эти данные также требуют проверки в клинических исследованиях.
Для разработки рекомендаций применения Ладастена было получено разрешение Федеральной службы по надзору в сфере здравоохранения и социального развития Российской Федерации на проведение клинического исследования.
Целью настоящего исследования являлось многоцентровое контролированное плацебо изучение клинических эффектов Ладастена (аспекты эффективности и переносимости) при лечении астенических расстройств: соматогенной астении (СА) и неврастении (НА)1.
Исследование предполагало разрешение следующих задач:
• определение эффективности Ладастена при астении и расстройствах астенического спектра (СА и НА) в сравнении с плацебо;
• определение переносимости Ладастена в сравнении с плацебо;
• определение степени вероятности синдрома отмены;
• разработку рекомендаций для применения Ладастена в амбулаторной и стационарной практике в условиях психиатрической или общемедицинской сети.
Дизайн исследования
В соответствии с целью и задачами исследования был разработан дизайн, учитывающий современные требования к репрезентативности выборок (число больных в группах сравнения, адекватность контроля), надежности инструмента, определению эффективности методики лечения и валидности статистических методов, используемых для получения достоверных результатов.
В исследовании приняли участие следующие центры Москвы и Санкт-Петербурга, работу в которых возглавили ведущие специалисты: ГУ НЦПЗ РАМН и ММА им. Сеченова, Москва (акад. РАМН А.Б.Смулевич), Московский НИИ психиатрии Росздрава (проф. В.Н.Краснов), НИ психоневрологический институт им. В.М.Бехтерева Росздрава, Санкт-Петербург (проф. Н.Г.Незнанов); ГУ НИИ фармакологии им. В.В.Закусова РАМН (проф. Г.Г.Незнамов); ГНЦ социальной и судебной психиатрии им. В.П.Сербского Росздрава, Москва (проф. А.С.Аведисова). В исследование были включены 180 больных, распределенных в 4 равноценные группы по 45 пациентов:
• основная (Ладастен) – диагноз СА;
• основная (Ладастен) – диагноз НА;
• группа сравнения (плацебо) – диагноз СА;
• группа сравнения (плацебо) – диагноз НА.
Критерии отбора
Критерии включения:
1. Соответствие астенических расстройств диагностическим критериям МКБ-10, определяющим рубрики «неврастения» (F48) и «соматогенная астения» [F06.6 – Органическое эмоционально лабильное (астеническое) расстройство, обусловленное соматической болезнью]. На клиническом уровне симптоматика астении в первую очередь определяется повышенной физической и/или психической утомляемостью со снижением уровня активности (дефицитом бодрости, энергии, мотивации) и характерными последствиями: потребностью в дополнительном отдыхе, снижением объема и эффективности привычной деятельности. В числе симптоматологических рядов астении также рассматриваются аффективная лабильность, отдельные соматовегетативные симптомы, субсиндромальные тревожные и депрессивные нарушения, участвующие в формировании и динамике астенических расстройств.
2. Выраженность астении по шкале самооценки астении (MFI-20) более 50 баллов.
3. Выраженность астении по визуальной аналоговой шкале астении (VAS-A) более 5 баллов.
4. Возраст больных в пределах от 18 до 60 лет.
5. Информированное согласие на участие в исследовании до его начала.
В процессе подготовки исследования были выделены базисные клинические критерии, которые, являясь общими для СА и НА, могут рассматриваться как значимые для оценки эффективности Ладастена (табл. 1).


Соответственно при анализе результатов исследования возникает необходимость сопоставления оценок терапевтической динамики при СА и НА, а при определении суммарной эффективности Ладастена в общей выборке выделенные клинические критерии могут быть рассмотрены с точки зрения особенностей воздействия препарата.
Критерии исключения
1. Острый психоз (эндогенно-процессуальный, органический или соматогенный) или состояния, угрожающие жизни пациента.
2. Соматические и неврологические заболевания в острой стадии, наличие тяжелой сердечно-легочной, печеночной или почечной недостаточности.
3. Наличие признаков хронического алкоголизма, лекарственной и наркотической зависимости.
4. Беременность, период кормления ребенка грудью.
5. Индивидуальная непереносимость препарата.
6. Отказ больного от участия в испытаниях или его участие в других клинических испытаниях лекарственных средств. Повторное включение пациента в исследование.
В соответствии с критериями отбора в исследование не включены астенические расстройства, связанные с органическим поражением ЦНС травматического и алкогольного генеза; постэнцефалитический синдром; опухоли головного мозга; дегенеративные заболевания ЦНС, например рассеянный склероз, и т.д.; шизофрению на этапе манифестации или в рамках астенического дефекта; депрессии; генерализованное тревожное расстройство; синдромы алкогольной и/или наркотической зависимости; острые состояния при соматических или неврологических заболеваниях, требующих смены лекарственной терапии.
Методы исследования
Для формализованной оценки исходных и динамических показателей астенических нарушений использован набор стандартных шкал с данными врачей и самооценками пациентов: 1) шкала общего клинического впечатления (CGI), позволяющая количественно оценить терапевтическую эффективность препарата по данным о тяжести состояния (CGI-S) и его динамике (CGI-I); 2) шкала оценки выраженности психопатологической симптоматики, составленная на основе «Унифицированной системы оценки клинико-фармакологического действия психотропных препаратов у больных с пограничными нервно-психическими расстройствами»; 3) шкала субъективной оценки астении MFI-20, определяющая самооценку астенического состояния по сумме баллов 5 характерных субшкал астении; 4) визуальная аналоговая шкала астении (VAS-A), позволяющая получить количественный показатель самоценки тяжести состояния по 10-балльной шкале.
Для оценки безопасности и риска синдрома отмены были использованы шкала регистрации побочных эффектов (UKU) с учетом дат их возникновения и завершения, степень выраженности и врачебный тест по синдрому отмены (PWC), который позволяет по 20 пунктам учесть спектр и тяжесть (1–5 баллов) соответствующих симптомов.
Для оценки переносимости и безопасности Ладастена были сопоставлены общие анализы крови и мочи, а также данные ЭКГ, полученные до начала и после завершения исследования.
Длительность участия пациентов в исследовании составила 42 дня и соответствовала 3 основным периодам: 1) скрининг с обязательным «отмывочным» периодом (7 дней); 2) лекарственная терапия больных: Ладастен или плацебо, начальная доза 100 мг/сут, терапевтическая доза 100–150 мг/сут (28 дней: 2-й визит – начало терапии, 3-й визит – 3 дня, 4-й визит – 7 дней, 5-й визит – 14 дней, 6-й визит – 21 день, 7-й визит – 28 дней; 3) терапевтический плацебо-контроль (7 дней).
В качестве условий прерывания исследования были определены отказ пациента от продолжения терапии, ухудшение состояния с необходимостью смены схемы лечения или выраженные побочные эффекты, требующие прекращения терапии.
Характеристика исходных данных
Данные идентификации обследованных больных общей выборки, СА и НА, включенных в исследование, свидетельствуют о репрезентативности наблюдений (табл. 3).

В исходной клинической характеристике существенных различий между опытными (Ладастен) и контрольными (плацебо) группами больных не выявлено, хотя имелись отличия в гендерном распределении при НА: в опытной группе преобладали женщины, в контрольной – мужчины. Средний возраст во всех выборках был сходным (определялся в диапазоне 40,4–44,4 года). Астенические состояния у большинства больных СА и НА отличались затяжным течением, при этом средние значения продолжительности заболевания в опытной и контрольной группах общей выборки были сходными (13,2 и 12,4 мес). Показатели длительности расстройства несколько меньше при СА по сравнению с НА (12,4 мес в опытной и 9,2 мес в контрольной группе против 13,9 и 15,5 мес соответственно). До исследования большинство больных не получали медикаментозного лечения по поводу астении: по данным общей выборки, получали ноотропы и поливитамины 7 больных опытной группы и 3 больных контрольной (<6%: 10 из 180), причем в случае назначения эффект терапии был недостаточным.


В рамках проверки экологической валидности проведен сравнительный анализ эффективности Ладастена на материале данных шкалы MFI-20 в клинических группах СА при инфекционных, гастроэнтерологических, кардиологических и ревматологических заболеваниях. Для проверки гипотезы о межгрупповых различиях эффективности Ладастена использован непараметрический критерий Крускала–Уоллиса (рис. 1). Сравнение результатов терапии при разных группах соматических заболеваний не выявило статистически достоверных различий в динамике состояния. На момент завершения терапии Ладастеном во всех группах доля больных с клинически выраженными признаками астении (>60 баллов по MFI-20) в группах больных СА не превышала 25%.
По данным общей выборки, до начала лечения с использованием шкал СGI-S, MFI-20, VAS-A обнаружено преобладание астенических нарушений легкой и средней степени тяжести.

Сравнение показателей степени тяжести астенических состояний до начала лечения в группах СА и НА показало большую выраженность астении при СА. Хотя в обеих группах отмечено преобладание состояний средней тяжести (>53%), при этом у больных СА выраженные/тяжелые нарушения преобладают над легкими, а у больных НА больше легких нарушений, чем выраженных/тяжелых. Отмечены сходные показатели в опытных и контрольных группах, что также свидетельствует в пользу репрезентативности выборки (рис. 2).
При исследовании выборок с использованием шкалы MFI-20 обнаружено, что на скрининговом визите все 100% больных имели по шкале более 60 баллов, что соответствует критерию клинически выраженной астении.


Критерии оценки результатов
Оценку эффективности лечения проводили с использованием данных оценочных шкал. Основными критериями были статистически достоверные изменения параметров CGI-S, CGI-I, шкалы оценки выраженности психопатологической симптоматики. Вторичным инструментом для оценки эффективности являлись данные самооценок по VAS-A, MFI-20.
Безопасность лечения оценивали по частоте нежелательных явлений (выраженность, степень тяжести, длительность и возможная связь с препаратом) и синдрома отмены (количество и степень тяжести отдельных симптомов).
Статистический анализ результатов исследования проведен в соответствии с протоколом. Поскольку объем выборок не позволяет обеспечить достоверно несмещенные параметры распределения (в частности, среднее и дисперсию распределения), то для проверки гипотез об отнесенности данных разных выборок к одной генеральной совокупности использованы непараметрические критерии. Для проверки гипотез об отнесенности данных разных выборок к одной генеральной совокупности применяли непараметрический U-тест Манна–Уитни для сравнения независимых выборок, для сравнения более двух независимых выборок – Н-критерий Крускала–Уоллиса (в качестве достоверного рассматривался уровень вероятности p<0,05). Также применяли процедуры факторного (метод главных компонент с последующим Varimax-вращением), корреляционного анализа (коэффициент корреляции Спирмена). Для повышения наглядности представления полученных результатов был применен метод построения профилей усредненных (среднее арифметическое) и частотных результатов исследований. Статистический анализ осуществляли с помощью статистического пакета SPSS 13.0 for Windows.
Результаты

Результаты исследования основаны на анализе динамики состояния 180 больных, полностью завершивших курсовое лечение по программе. При сравнении исходных (визит 2) и заключительных (визит 7) показателей на фоне лечения Ладастеном отмечены различия опытных и контрольных групп по результатам обеих субшкал CGI (CGI-S, CGI-I), оценивающих степень тяжести СА и НА и динамику этих расстройств на фоне лечения (рис. 5). В опытных группах на заключительном визите доля больных, достигших состояния ремиссии («нормален, не болен») была идентична и составила 57,8% (больше половины), из числа оставшихся доля респондеров («пограничное состояние» по CGI-S) составила 31,1% для СА и 28,9% для НА, что значимо отличается от контрольных групп (p<0,05).

Исследование изменения тяжести состояния по CGI-I показало значимое улучшение к окончанию терапии Ладастеном: эффективная терапия, оцениваемая по критериям «очень большое улучшение» и «выраженное улучшение», была достигнута в 92% случаев в группе СА (следует отметить, что в этой группе исходное состояние зарегистрировано как более тяжелое) и в 80% случаев в группе НА, что также достоверно (p<0,05) отличается от контрольных групп, получавших плацебо (рис. 6).
Самооценка динамики состояния по шкале MFI-20 показала, что доля больных с клинически выраженными признаками астении (>60 баллов по MFI-20) достоверно уменьшается на фоне лечения Ладастеном, причем в соответствии со средними значениями этот результат достигается уже на визите 4 в группах СА и НА. Профиль динамики результатов в контрольных группах больных, принимавших плацебо, совершенно иной, и значимого улучшения не обнаружено даже на заключительном визите (рис. 7).
Анализ результатов VAS-A также выявил значимое снижение субъективной тяжести астенических проявлений при лечении Ладастеном в сравнении с плацебо (p<0,01), подтвердив выводы экспертной оценки (рис. 8). Обнаруженные в опытных группах различия: более быстрое снижение числа больных с оценками астении (>5 баллов) в группе СА на визите 4 и в группе НА на визите 5 могут быть связаны с клиническими вариантами самооценки. Оценка своего состояния как более тяжелого больными НА коррелировала с большим удельным весом преморбидных патохарактерологических черт.


Проведена сравнительная оценка эффективности Ладастена и плацебо в двух общих группах (опытная и контрольная) с привлечением всех показателей совокупной выборки. Получено достоверное различие (p<0,05) между опытной и контрольной группами, причем общая доля респондеров достигала 87,8%, и 2/3 из них были больные, достигшие ремиссии или выздоровления («нормален, не болен») по CGI-S (рис. 9). «Очень большое улучшение» и «существенное улучшение» по CGI-I зарегистрировано у 85,6% больных общей выборки, получавших Ладастен (рис. 10).


Изучение эффективности лечения по средним суммарным показателям субшкалы оценки выраженности психопатологических признаков общей группы больных (СА и НА), получавших Ладастен, показало, что исходный балл достоверно уменьшается (50% барьер) уже на визите 5 (рис. 11).

Данные экспертных оценок подтверждены показателями динамики самооценки астении по MFI-20 для общей выборки (рис. 12).


Сравнительная оценка субъективной динамики состояния по шкале VAS-А выявила значимые различия (p<0,05) между опытной и контрольной группами, которые были достигнуты на 4-м визите, причем достоверность различий увеличивалась к заключительному визиту (p<0,01) (рис. 13).
Полученные общие результаты нашли подтверждение при факторном анализе данных шкалы оценки выраженности психопатологической симптоматики, позволившем выделить симптоматологические ряды как статистические критерии и проследить их динамику на фоне терапии. Процедура факторного анализа, направленная на выявление кластеров симптомов, позволила выделить 4 значимых фактора, объясняющих 75% дисперсии и включивших основные проявления астенических расстройств.


Переменные – симптомы, входящие в фактор, представлены в тексте в порядке убывания факторных нагрузок. По всем факторам отмечены значимые различия между динамикой состояния в группах Ладастена и плацебо (p<0,05). Наибольшая динамика достигается по фактору 1 «Астенические симптомы», включившему центральный симптомокомплекс.
Динамика патологических состояний в соответствии со средними значениями выделенных факторов показывает их значимость для оценки направленности терапевтической активности Ладастена в сравнении с плацебо (рис. 14). К концу лечения (визит 7) эффективность лечения Ладастеном имела достоверные значения как по наиболее характерным для астенических расстройств признакам (повышенная истощаемость, апатия, тревога, повышенная раздражительность, аффективная лабильность, ситуационно-мотивированный характер настроения, расстройства засыпания, нарушение глубины и длительности ночного сна, головные боли, общая адаптация), так и по ряду других нарушений, выявляемых у набранной выборки (сниженное настроение, суточные колебания настроения, расстройства пробуждения, потливость, гипертензия, ортостатические нарушения). В группе пациентов, получавших плацебо, при применении статистических критериев не выявлено существенных изменений показателей, входящих в выделенные факторы. Таким образом, выделенные путем факторного анализа статистические диагностические критерии можно использовать для оценки эффективности терапии наряду со стандартными психометрическими критериями.
Нежелательные явления
У 16 пациентов, принимавших Ладастен, наблюдали нежелательные явления легкой степени (табл. 5). В конце терапии в обеих группах побочных явлений не выявлено.

Признаков синдрома отмены при прекращении лечения Ладастеном не возникало. Вместе с тем у некоторых больных отмечен ряд невыраженных проявлений: раздражительность, тревога, усталость, головокружение, головная боль, нарушения сна, оценка которых, по мнению исследователей, свидетельствовала о резидуальных симптомах астенических расстройств.
Выводы
Проблема расширения набора психотропных средств, эффективных при терапии астенических расстройств, при учете широкой распространенности последних среди контингента общесоматической и психиатрической сети, является одной из актуальных для современной психофармакологии.
В этом плане особое значение приобретает изучение клинических эффектов Ладастена. Ладастен – новый оригинальный отечественный препарат, обладающий выраженным психостимулирующим, а также анксиолитическим эффектом.
В результате изучения эффективности и безопасности Ладастена у больных СА и НА получены следующие данные:
• препарат эффективен при лечении широкого спектра астенических расстройств, включающих состояния НА и СА, формирующихся при разных соматических заболеваниях;В соответствии с результатами исследования Ладастен эффективен при курсовом лечении больных СА и НА (доза 100–150 мг/сут). Следует отметить, что сочетание в спектре действия препарата психостимулирующих и анксиолитических свойств способствует быстрому купированию расстройств сна, соматовегетативных и субдепрессивных нарушений, связанных с астенией. Применение Ладастена повышает качество жизни больных с астеническими и астеноневротическими расстройствами, приводит к увеличению адаптационных ресурсов, что способствует поддержанию гомеостатического равновесия. Препарат хорошо переносится. Представленные данные позволяют рекомендовать Ладастен при терапии астеноневротических, субсиндромальных гипотимических расстройств, невротической ипохондрии, широкого круга астенических состояний, наблюдающихся у контингента пациентов общемедицинской сети.
• эффективность Ладастена статистически достоверно превосходит плацебо;
• побочные эффекты не выражены (у всех испытуемых они были легкой степени) и не требуют отмены и дополнительной терапии.
Список исп. литературыСкрыть список1. Васильев П.В., Глод Г.Д., Сытник С.И. Фармакология в авиационной медицине. Справочник авиационного врача. М.: Воздушный транспорт. 1993; Кн. II: 148–60.
2. Смулевич А.Б., Сыркин А.Л. Психокардиология. М., 2005.
3. Лукичева Т.А., Седов А.В., Морозов И.С., Суровцев Н.А. Фармакологическая коррекция неблагоприятного воздействия на человека токсичных веществ и нагревающего микроклимата. V Рос. нац. конгр. «Человек и лекарство». Тез. докл. М., 1998; 448.
4. Морозов И.С., Барчуков В.Г., Седов А.В. и др. Фармакологическая коррекция снижения работоспособности человека при гипоксиях различного генеза. Человек и лекарство: Тез. докл. II Рос. нац. конгр. М., 1995.
5. Аведисова А.С. Антиастенические препараты как терапия первого выбора при астенических расстройствах. РМЖ. 2004; 12 (22).
6. Вальдман А.В., Козловская М.М., Медведев О.С. Фармакологическая регуляция эмоционального стресса. М.: Медицина, 1979.
7. Сафарова Т.П. Клинико-фармакологическое обоснование дифференцированной психофармакотерапии больных с астеническими расстройствами. Автореф. дис. ... канд. мед. наук. М., 1997.
8. Морозов И.С., Климова Н.В., Карпова Т.Д., Шестопалов С.С. Характеристика нейропсихотропной активности бромантана у лабораторных животных. Эксперим. и клин. фармакол. 1999; 2: 3–6.
9. Сюняков С.А., Гришин С.А., Телешова Е.С. и др. Результаты пилотного клинического исследования Ладастена. Эксперим. и клин. фармакол. 2006; 69 (4): 10–5.
10. Neznamov GG, Bochcarev VK, Seredenin SB. Individual variability in the effects of singl-dose tranquilisers in neurotic patients: clinical, electroencepha-lographic and prognostic aspects. Biological Basis of Individual Sensivity to Psichotropic Drugs (Ed. Seredenin SB, Longo V, Gavigraghi G). Edinburgh 1994; 151–9.
11. Середенин С.Б., Воронина Т.А., Незнамов Г.Г. и др. Фармакогенетическая концепция анксиоселективного эффекта. Вестник РАМН. 1998; 11: 3–10.
12. Яркова М.А. Изучение анксиолитических свойств производных 2-меркаптобензимидазола. Дис. ... канд. мед. наук. М., 1996.
13. Воронин М.В. Изучение механизмов психотропного действия Ладастена® в зависимости от фенотипа реакции на эмоциональный стресс. Автореф. дис. ... канд. мед. наук. М., 2004.
14. Морозов И.С., Климова Н.В., Авдюнина Н.И. и др. Фармакология нового психостимулятора бромантана при стрессе. Перспективы развития и практического применения каркасных соединений: Тез. докл. VII научн.-практ. конференции стран СНГ. Волгоград, 1995; 166–7.
15. Галушина Т.С., Фадеева Т.А., Арцимович Н.Г. Исследование роли нейротропного препарата бромантан в регуляции гуморального иммунитета. Иммунол. 1996; 4: 31–4.
16. Морозов И.С., Клейменова Н.Н. Влияние бромантана на физическую работоспособность лабораторных животных. Эксперим. и клин. фармакол. 1998; 6: 51–3.
17. Морозов И.С., Петров В.И., Сергеева С.А. Фармакология адамантанов. Волгоград: Волгоград. мед. акад., 2001.
18. Незнамов Г.Г., Сюняков С.А., Гришин С.А. и др. Ладастен – перспективное средство коррекции астенических нарушений, развивающихся в экстремальных условиях. Симпозиум, посвящ. 75-летию ГосНИИИ ВМ «Боевой стресс: механизмы стресса в экстремальных условиях». М., 2005; 142–4.

