Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№04 2014
Расширение дофаминовой гипотезы: современные тенденции в биологической терапии шизофрении. Обзор материалов 26-го Конгресса Европейской коллегии нейропсихофармакологии (5–9 октября 2013 г., Барселона, Испания) №04 2014
Номера страниц в выпуске:26-30
Понимание того, что дофамин играет важную роль в патофизиологии шизофрении, появилось в научной среде после работ J.Delay и P.Deniker о клиническом применении хлорпромазина, а также после программных публикаций A.Carlsson и M.Lindqvist, в которых показана способность антипсихотиков усиливать метаболизм дофамина в головном мозге животных, а также приведены сведения об антипсихотических свойствах резерпина, блокирующем обратный захват дофамина и других моноаминов.
Резюме. Настоящая публикация представляет собой обзор материалов 26-го Конгресса Европейской коллегии нейропсихофармакологии (5–9 октября 2013 г., Барселона, Испания). Приведены общие сведения об эволюции дофаминовой гипотезы и краткий обзор симпозиума «За пределами дофаминовой блокады – новые перспективы в терапии шизофрении», прошедшего под председательством M.Davidson (Израиль) и А.Meyer-Lindenberg (Германия) 7 октября 2013 г.
Ключевые слова: дофаминовая гипотеза, психофармакотерапия, новые лекарственные средства, шизофрения, 26-й Конгресс Европейской коллегии нейропсихофармакологии.
Expansion of the dopamine hypothesis: current trends in the biological treatment
of schizophrenia. A review of the materials of the 26th Congress of the European College
of Neuropsychopharmacology (October 5–9, 2013, Barcelona, Spain)
P.V.Alfimov1, V.G.Simonyan2
1Moscow Research Institute of Psychiatry, Department of Therapy of Mental Disorders;
2Psychiatric Medical Center, First Episode Clinic, Erevan, Armenia
Summary. This paper provides an overview of the materials of the 26th Congress of the European College of Neuropsychopharmacology (5–9 October 2013, Barcelona, Spain). Authors provide an overview of the evolution of the dopamine hypothesis and a brief description of the reports presented during symposium «Beyond dopamine blockade – new perspective in the treatment of schizophrenia» held under the chairmanship of prof. M.Davidson (Israel) and prof. A.Meyer-Lindenberg (Germany) on October 7, 2013.
Key words: dopamine hypothesis, psychopharmacotherapy, novel treatments, schizophrenia, 26th ECNP Congress.
Понимание того, что дофамин играет важную роль в патофизиологии шизофрении, появилось в научной среде после работ J.Delay и P.Deniker [1] о клиническом применении хлорпромазина, а также после программных публикаций A.Carlsson и M.Lindqvist [2, 3], в которых показана способность антипсихотиков усиливать метаболизм дофамина в головном мозге животных, а также приведены сведения об антипсихотических свойствах резерпина, блокирующем обратный захват дофамина и других моноаминов. В дальнейшем получены данные о способности психостимуляторов (в частности, амфетамина, который увеличивает концентрацию дофамина в синаптической щели) провоцировать психотическую симптоматику [4]. Окончательная «кристаллизация» дофаминовой гипотезы произошла в 1970-е годы после появления большого числа новых антипсихотиков и подтверждения связи между собственно антипсихотическим эффектом и их аффинитетом к дофаминовым рецепторам [5–7]. В то время усилия исследователей были ориентированы на практику – блокирование нейротрансмиссии на дофаминовых рецепторах [8] и соответствующий терапевтический эффект без какой-либо привязки к доменам симптоматики (позитивным и негативным симптомам), генетическим и нейровизуализационным данным, которых в то время еще не существовало.
В 1991 г. в своей программной статье K.Davis и соавт. [9] предприняли попытку пересмотра дофаминовой гипотезы. Авторы проанализировали имеющиеся на тот момент данные нейровизуализационных (в том числе радиоизотопных) исследований на животных, а также сведения о концентрации метаболитов дофамина в разных биологических средах и предложили следующее функциональное и симптоматическое разделение: негативная симптоматика обусловлена «гиподофаминергией» в префронтальной коре, а позитивная симптоматика – «гипердофаминергией» в подкорковых структурах, в частности в стриатуме и других образованиях лимбической системы. Обозначены терапевтические мишени: дофаминовые рецепторы в префронтальной коре и подкорковых структурах (в первую очередь D2-рецепторы). Кроме того, показано их реципрокное взаимодействие – повреждение терминалей дофаминовых нейронов в префронтальной коре приводит к увеличению концентрации дофамина и его метаболитов, а также плотности D2-рецепторов в стриатуме [10], а введение D1-агониста в префронтальные зоны, наоборот, приводит к уменьшению концентрации метаболитов дофамина в стриатуме [11]. В дальнейшем концепция «фронтальной гиподофаминергии» подверглась критике, так как по мере поступления новых данных стало очевидно, что патологические процессы в коре гораздо сложнее, чем простое редукционистское «ослабление дофаминовой трансмиссии» [12]. Основные терапевтические «мишени» при шизофрении в соответствии с предложенной K.Davis модернизированной дофаминовой гипотезой в упрощенном виде приведены на рис. 1.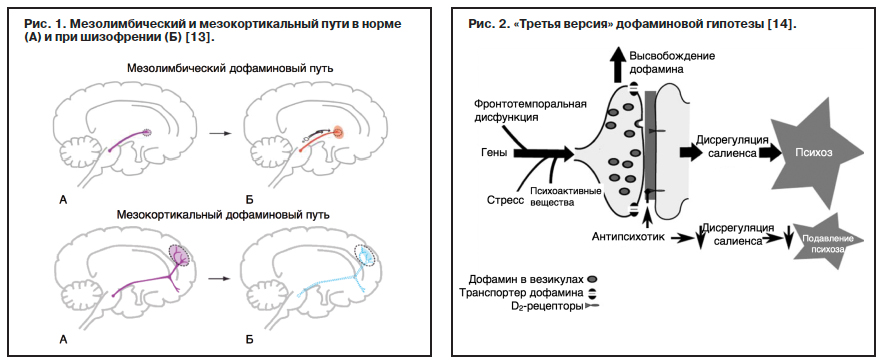
В верхней части рисунка представлен мезолимбический дофаминовый путь, берущий начало в вентральной покрышечной области ствола мозга и направляющийся к прилежащему ядру в вентральном стриатуме. Предполагается, что гиперактивность этого дофаминового пути приводит к развитию позитивной (галлюцинаторно-бредовой) симптоматики (обозначено красным в правой части рисунка).
В нижней части рисунка представлен мезокортикальный дофаминовый путь, направляющийся из вентральной покрышечной области ствола мозга в префронтальную кору (в частности, в ее дорсолатеральный отдел). Предполагается, что гипоактивность этого пути приводит к развитию негативных и когнитивных симптомов шизофрении (обозначено синим пунктиром в правой части рисунка).
Предполагается, что классические антипсихотики (полные антагонисты D2-рецепторов) блокируют дофаминовую нейротрансмиссию в мезолимбическом пути и этим подавляют позитивные симптомы. При этом соответствующий дофаминблокирующий эффект в корковых структурах может отвечать за развитие вторичных негативных симптомов. В настоящее время не получено обнадеживающих данных о способности каких-либо лекарственных средств (например, частичных D2/3-агонистов, D1-агонистов) редуцировать первичную негативную симптоматику. Тем не менее есть данные о дезингибирующем и прокогнитивном эффектах некоторых антипсихотиков II поколения – частичных агонистов D2/3-рецепторов, средств с серотонинергическим эффектом и др. Обзор данной тематики не входит в задачи настоящей публикации.
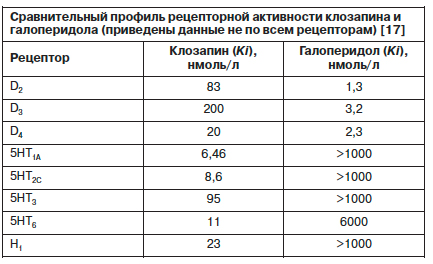
В 2000-х годах коллектив британских авторов под руководством O.Howes и S.Kapur [14] проанализировал большой объем клинических, нейровизуализационных, нейропсихологических, генетических и других данных, опубликованных за последние 15 лет, и представил обновленную (третью) версию дофаминовой гипотезы. В первую очередь переработке подверглась «гипердофаминергическая» часть гипотезы, связанная с продуктивными симптомами. Во-первых, фокус внимания сместился с постсинаптических D2-рецепторов на пресинаптические механизмы регуляции дофаминового обмена, а именно пресинаптические синтез, выброс и транспорт этого нейромедиатора. Предполагается, что антипсихотики не только блокируют постсинаптическую дофаминовую нейротрансмиссию, подавляя продуктивную симптоматику, но и парадоксальным образом усиливают способность к синтезу дофамина, блокируют пресинаптические D2-ауторецепторы. Вероятно, этим можно объяснить высокую тяжесть и скорость нарастания позитивной симптоматики после внезапной отмены терапии (по сравнению со спонтанной экзацербацией позитивных симптомов). Во-вторых, авторы связали описанную пресинаптическую дисрегуляцию в стриатуме с более узким понятием «психоз при шизофрении» (или «предрасположенность к психозу»), но не с шизофренией в целом как с комплексным нозологическим конструктом. Наконец, авторы интегрировали в свою модель концепцию «дисрегуляции салиенса» [15], т.е. феномен «нарушения избирательной фильтрации информации», или «синдром сверхвключаемости объектов восприятия» [16], который может лежать в основе развития продуктивной симптоматики. Кроме того, поставлена под сомнение прямая связь между «гиподофаминергией» в префронтальной коре и негативными и когнитивными симптомами. Предполагается, что когнитивные и негативные симптомы развиваются гораздо раньше психоза – они опосредуются разными медиаторными системами и нейроанатомическими областями
(в том числе префронтальной корой) и в совокупности с разными неблагоприятными факторами (генетическими, средовыми) приводят к стриарной дофаминовой дисрегуляции и манифестации психоза (рис. 2).
На рисунке схематически представлено синаптическое соединение дофаминергических нейронов в стриатуме. Предполагается, что факторы внешней среды, генетические дефекты, фронтотемпоральная дисфункция и другое приводят к усилению синтеза дофамина и его выброса в синаптическую щель. Гипердофаминергия способствует «дисрегуляции салиенса», что в свою очередь ведет к развитию психотических симптомов. Традиционные антипсихотики подавляют психоз, блокируя постсинаптические D2-рецепторы.
В 1990-х годах после начала широкого внедрения в практику антипсихотиков II поколения основополагающая роль дофаминовой нейротрансмиссии в патофизиологии шизофрении подверглась сомнению. Эталонный антипсихотик II поколения клозапин обладает мощным глобальным антипсихотическим эффектом и самым широким спектром рецепторной активности среди всех известных психотропных средств [13]. При этом клозапин и другие антипсихотики II поколения, в частности оланзапин и кветиапин, имеют достаточно слабый аффинитет к дофаминовым рецепторам. В качестве иллюстрации в таблице приведены сравнительные профили рецепторной активности клозапина (эталонного антипсихотика II поколения) и галоперидола (эталонного антипсихотика I поколения). Константа связывания Ki отражает аффинитет к рецептору (чем меньше Ki, тем выше аффинитет).
Эта особенность АПВП подтолкнула исследователей к изучению других рецепторных систем головного мозга, в частности серотониновой, каннабиноидной, системы вставочных нейронов g-аминомасляной кислоты (ГАМК), системы рецепторов N-метил-D-аспартата (НМДА), холинергической и др. В 2007 г. в ведущем научном журнале Nature Medicine была опубликована обзорная статья D.Weinberger [18] c провокационным названием «Антипсихотики прощаются с дофамином», которая была посвящена экспериментальному препарату LY2140023 – агонисту метаботропных рецепторов к глутамату mGlurR2/3. Этот препарат показал положительные результаты в пилотных исследованиях на малых группах больных, однако после получения отрицательных данных в отношении собственно антипсихотической активности в испытаниях III фазы программа по исследованию препарата была свернута компанией-изготовителем (2012 г.). При планировании новых исследований «недофаминовых антипсихотиков» многие исследователи стали делать упор на отдельных доменах симптоматики, использовать дизайн адъювантной (дополнительной) терапии и изучать ограниченные когорты пациентов (например, пациентов с преобладанием негативных симптомов).
На 26-м Конгрессе Европейской коллегии нейропсихофармакологии (European College of Neuropsychopharmacology – ECNP), прошедшем 5–9 октября 2013 г. в Барселоне (Испания), представлено большое число сообщений о преклинических и клинических исследованиях новых лекарственных средств с разным механизмом действия. В задачи настоящей публикации не входил подробный обзор результатов отдельных, подчас еще не завершенных терапевтических исследований. Ниже приведены краткое содержание основных докладов и ряд важных теоретических соображений, представленных на симпозиуме «За пределами дофаминовой блокады – новые перспективы в терапии шизофрении» под председательством M.Davidson (Израиль) и А.Meyer-Lindenberg (Германия) 7 октября 2013 г.
В обзорном докладе «Парадигма единого заболевания служит препятствием для разработки новых методов лечения шизофрении» (C.Arango, Испания) автор сконцентрировал внимание аудитории на современных диагностических концепциях шизофрении. В современных диагностических критериях среди всех доменов психопатологической симптоматики особое внимание уделяется продуктивным симптомам. При этом показано, что негативные и когнитивные нарушения имеют сложные (в том числе недофаминовые) нейробиологические механизмы, не имеют очевидной связи с психозом и имеют большую прогностическую ценность в отношении социального и клинического исхода. В течение последних 60 лет разработано большое число антипсихотиков (в первую очередь традиционных дофаминовых антагонистов – антипсихотиков I поколения), эффективно подавляющих психотические симптомы. Антипсихотики II поколения имеют более благоприятный профиль безопасности и переносимости, однако не имеют преимуществ в отношении позитивных симптомов, а их эффективность в других сферах симптоматики неочевидна. Автор утверждает, что для разработки эффективных терапевтических инструментов нужны новые диагностические парадигмы, стоящие на стыке клинических и фундаментальных нейронаук. Лишь в последнее десятилетие стали появляться данные об эффективных недофаминовых средствах с прицельным воздействием на негативные и когнитивные симптомы. Наиболее перспективными для изучения представляются следующие лекарственные средства: глутаматергические препараты (метаботропные агонисты глутамата, ингибиторы транспортера глицина, средства, влияющие на синтез и высвобождение D-серина и глутатиона, и др.), холинергические средства, нейростероиды, окситоцин, миноциклин (тетрациклиновый антибиотик, способный подавлять неспецифическое воспаление в головном мозге) и парциальные дофаминовые агонисты. Автор полагает, что психиатрам нужно взять пример с «соматической» медицины, в которой многие лекарственные средства имеют таргетное (направленное) действие на отдельные звенья патогенеза, т.е. симптомы-мишени вне строгих рамок отдельных нозологических категорий. Кроме того, пристальное внимание стоит обратить на этапность лечения и изучить возможность лечения «уязвимости к психозу», т.е. состояний с высоким риском развития психоза (вторичная профилактика шизофрении).
Доклад «Новые механизмы лечения негативных симптомов – первоначальный успех и почва для дальнейших исследований» M.Berk (Австралия) был посвящен адъювантной терапии с помощью N-ацетилцистеина. Автор привел ряд доказательств «воспалительной гипотезы шизофрении», а именно сведения о том, что в патогенезе шизофрении (в первую очередь негативных симптомов) могут участвовать процессы свободнорадикального окисления, воспалительная митохондриальная дисфункция и нарушение функции нейтрофилов. N-ацетилцистеин является предшественником глутатиона, модулирует обмен глутамата, обладает противовоспалительными свойствами, предотвращает митохондриальную дисфункцию, усиливает нейрогенез и выживаемость нейронов при стрессе. В рандомизированных контролируемых исследованиях показана ограниченная эффективность N-ацетилцистеина при биполярном расстройстве, аутизме, никотиновой и других зависимостях, депрессии и навязчивостях. Автор привел результаты рандомизированного контролируемого исследования на относительно крупной популяции больных шизофренией (n=140), в котором N-ацетилцистеин в дозе 1 г/сут использовался в качестве адъювантного средства к имеющейся стабильной терапии антипсихотиком [19]. Умеренная эффективность показана по негативной подшкале Шкалы позитивных и негативных синдромов (Positive and Negative Syndrome Scale – PANSS), общему баллу PANSS и разным конечным точкам социального и личностного функционирования (социальное взаимодействие, мотивация, реактивность настроения, самообслуживание). В отношении стойких психопатологических феноменов, а именно слуховых галлюцинаций, бредовых идей величия, социальной изоляции и дистимии, не показано значимых межгрупповых различий. При этом показана хорошая переносимость терапии и некоторая редукция акатизии в группе N-ацетилцистеина. Имеющиеся данные о роли глутамата и N-ацетиласпартата в «воспалительной гипотезе шизофрении» позволяют предполагать, что N-ацетилцистеин является многообещающим терапевтическим инструментом, прицельно направленным на дефицитарную симптоматику.
В докладе упомянутого выше O.Howes (Великобритания), одного из соавторов обновленной дофаминовой гипотезы, «К вопросу о разработке новых средств лечения рефрактерной шизофрении – результаты исследований позитронно-эмиссионной томографии и магнитно-резонансной спектроскопии» подчеркивалось, что при терапевтической резистентности у больных шизофренией отсутствует очевидная пресинаптическая дофаминовая патология и дополнительная дофаминовая блокада неэффективна. Также приведены краткие сведения об усилении глутаматергической нейротрансмиссии в системе вставочных ГАМКергических нейронов (клеток-канделябров) и связанном ослаблении глутаматергической нейротрансмиссии в пирамидальных клетках. Подчеркивается, что в настоящее время неизвестно, является ли этот феномен компенсаторным механизмом или звеном патогенеза шизофрении. Кроме того, в настоящее время неизвестно, играет ли какую-либо роль в развитии психоза взаимосвязь между глутаматергическими и дофаминергическими системами. Предполагается, что глутаматергическая дисфункция может лежать в основе терапевтической резистентности и стойкой дефицитарной симптоматики. Автор представил результаты нейровизуализационного исследования в группах больных с хорошим реагированием на терапию (n=15), больных с рефрактерными (резистентными) симптомами (n=15) и здоровых добровольцев (n=15), а также результаты исследования больных с продромальными признаками психоза (n=16) с последующим 3-летним наблюдением. Все участники обследовались методами позитронно-эмиссионной томографии с использованием радиоизотопа [18F]-ДОФА (для определения Ki – в качестве показателя пресинаптической способности к синтезу дофамина) и магнитно-резонансной спектроскопии для регистрации глутаматергической активности. Обнаружено, что в группе резистентных больных имеет место значительно более низкая пресинаптическая способность к синтезу дофамина по сравнению с группой больных, хорошо реагирующих на терапию: средняя Ki (среднеквадратическое отклонение) = 0,013 (0,0013) и 0,014 (0,0014) соответственно; размер эффекта = 1,11; р=0,02. Кроме того, показано значительное увеличение соотношения Glu/Cr1 в группе резистентных больных. В исследовании пациентов с продромальными симптомами показано изменение интегрального показателя соотношения глутаматергической и дофаминергической активности между группой пациентов, у которых впоследствии развился психоз, и контрольной группой (r=-0,6; p=0,03 в сравнении с r=0,04; p=0,9 соответственно). Усиление способности к синтезу дофамина в этом исследовании коррелировало с более высокой тяжестью субклинических бредовых симптомов (F=4,0; p<0,05). Полученные данные свидетельствуют о наличии «двусторонней» связи между дофаминергическими и глутаматергическими нарушениями и являются почвой для будущих исследований, направленных на выявление разных нейробиологических подтипов шизофрении.
В докладе D.Hilt (сотрудница фармкомпании из США) «Агонисты никотиновых a7-рецепторов в качестве прокогнитивной терапии – доказательство концепции и будущие исследования» приведены сведения о прокогнитивных эффектах нового препарата EVP-6124, агониста a7-никотиновых рецепторов к ацетилхолину (N-A7A). В этом относительно крупном (n=319) рандомизированном контролируемом исследовании IIb фазы также использован дизайн адъювантной терапии – добавление двух разных доз (0,3 и 1 мг) прокогнитивного агента EVP-6124 к существующей стабильной терапии антипсихотиком. В качестве мер оценки использовался балл OCI по общему когнитивному индексу, нейропсихологическая батарея MATRICS Consensus Cognitive Battery (MCCB), подшкалы PANSS и шкала оценки функций, связанных с когнитивными нарушениями при шизофрении SCoRS. Представлены положительные результаты: в группе 0,3 мг EVP-6124 отмечалось значительное преимущество над плацебо по показателю OCI (р=0,05), в обеих группах активной терапии отмечалось небольшое преимущество по общему баллу MCCB (p=0,009). В группе 1 мг активного препарата также отмечалось преимущество над плацебо по негативной подшкале PANSS (р=0,028), а также по функциональному показателю SCoRS (p=0,065). Получив обнадеживающие результаты, авторы исследования запустили III фазу клинического испытания этого препарата.
На момент подготовки настоящей публикации на веб-сайте clinicaltrials.gov (база данных клинических исследований Национальных институтов здравоохранения США) зарегистрировано 146 продолжающихся терапевтических исследований шизофрении 0, I, II и III фазы, при этом 113 из них – это фармакотерапевтические исследования. Среди них 21 исследование посвящено уже зарегистрированным антипсихотикам II поколения (луразидон, азенапин, илоперидон, палиперидон, рисперидон, арипипразол), применяемым по новым показаниям. 92 исследования представляют собой преклинические и клинические исследования экспериментальных молекул с разным механизмом действия (ABT-126, 3-2,4-диметоксибензилиден, ALKS 9072, AQW051, DAR-100A, DMXB-A-SR, EVP-6124, LY500307, MP-214, NW-3509a, брексипразол, элтопразин и др.) в виде монотерапии и адъювантной терапии, а также известных лекарственных и психоактивных веществ и пищевых добавок (каннабидиол, D-серин, саркозин, окситоцин, симвастатин, фосфатидилхолин, инсулин и др.) в виде адъювантной терапии в разных клинических сценариях шизофрении. Эти данные являются приближенными (в поиск не вошли недавно завершенные и не зарегистрированные в США исследования), однако они дают представление об общей картине, которая является скорее оптимистической. В связи с высокой длительностью и стоимостью разработки и внедрения психотропных средств строгими требованиями контролирующих органов, а также низкой вероятностью регистрации молекул некоторые фармацевтические компании в течение последних 3–5 лет сворачивают свои «психотропные» направления. Это привело к тому, что многие специалисты стали говорить о глубоком упадке и стагнации в отрасли. Такого подхода придерживается, к примеру, бывший директор Национального института психического здоровья США (National Institute of Mental Health) S.Hyman [20]. Многочисленные сообщения 26-го Конгресса Европейской коллегии нейропсихофаркологии и приведенные выше данные показывают, что интерес исследователей и фармкомпаний к поиску новых средств лечения шизофрении отнюдь не угас. Некоторые изучаемые в настоящее время молекулы (например, брексипразол, карипразин) разработаны с учетом обновленной дофаминовой гипотезы шизофрении (парциальный агонизм в отношении D2/3-рецепторов, действие на пресинаптические дофаминовые рецепторы и др.). Предполагаемая эффективность других молекул опосредуется их серотонинергическим, глутаматергическим, холинергическим, ГАМКергическим и другими эффектами. Имеющиеся данные о новых лекарственных препаратах пока не имеют большого практического значения, и в настоящее время не зарегистрировано ни одного антипсихотика, имеющего полностью недофаминовый механизм действия. Однако можно ожидать, что в ближайшие 10–20 лет арсенал практикующего психиатра расширится и станет более «гибким» (т.е. появятся препараты, направленные на конкретные домены симптоматики), что в конечном счете повысит качество оказания помощи психически больным.
Симонян Ваган Гагикович – зав. клиникой первого психотического эпизода Психиатрического медицинского центра Минздрава Республики Армении. E-mail: simonyanvahan@yahoo.com
Ключевые слова: дофаминовая гипотеза, психофармакотерапия, новые лекарственные средства, шизофрения, 26-й Конгресс Европейской коллегии нейропсихофармакологии.
Expansion of the dopamine hypothesis: current trends in the biological treatment
of schizophrenia. A review of the materials of the 26th Congress of the European College
of Neuropsychopharmacology (October 5–9, 2013, Barcelona, Spain)
P.V.Alfimov1, V.G.Simonyan2
1Moscow Research Institute of Psychiatry, Department of Therapy of Mental Disorders;
2Psychiatric Medical Center, First Episode Clinic, Erevan, Armenia
Summary. This paper provides an overview of the materials of the 26th Congress of the European College of Neuropsychopharmacology (5–9 October 2013, Barcelona, Spain). Authors provide an overview of the evolution of the dopamine hypothesis and a brief description of the reports presented during symposium «Beyond dopamine blockade – new perspective in the treatment of schizophrenia» held under the chairmanship of prof. M.Davidson (Israel) and prof. A.Meyer-Lindenberg (Germany) on October 7, 2013.
Key words: dopamine hypothesis, psychopharmacotherapy, novel treatments, schizophrenia, 26th ECNP Congress.
Понимание того, что дофамин играет важную роль в патофизиологии шизофрении, появилось в научной среде после работ J.Delay и P.Deniker [1] о клиническом применении хлорпромазина, а также после программных публикаций A.Carlsson и M.Lindqvist [2, 3], в которых показана способность антипсихотиков усиливать метаболизм дофамина в головном мозге животных, а также приведены сведения об антипсихотических свойствах резерпина, блокирующем обратный захват дофамина и других моноаминов. В дальнейшем получены данные о способности психостимуляторов (в частности, амфетамина, который увеличивает концентрацию дофамина в синаптической щели) провоцировать психотическую симптоматику [4]. Окончательная «кристаллизация» дофаминовой гипотезы произошла в 1970-е годы после появления большого числа новых антипсихотиков и подтверждения связи между собственно антипсихотическим эффектом и их аффинитетом к дофаминовым рецепторам [5–7]. В то время усилия исследователей были ориентированы на практику – блокирование нейротрансмиссии на дофаминовых рецепторах [8] и соответствующий терапевтический эффект без какой-либо привязки к доменам симптоматики (позитивным и негативным симптомам), генетическим и нейровизуализационным данным, которых в то время еще не существовало.
В 1991 г. в своей программной статье K.Davis и соавт. [9] предприняли попытку пересмотра дофаминовой гипотезы. Авторы проанализировали имеющиеся на тот момент данные нейровизуализационных (в том числе радиоизотопных) исследований на животных, а также сведения о концентрации метаболитов дофамина в разных биологических средах и предложили следующее функциональное и симптоматическое разделение: негативная симптоматика обусловлена «гиподофаминергией» в префронтальной коре, а позитивная симптоматика – «гипердофаминергией» в подкорковых структурах, в частности в стриатуме и других образованиях лимбической системы. Обозначены терапевтические мишени: дофаминовые рецепторы в префронтальной коре и подкорковых структурах (в первую очередь D2-рецепторы). Кроме того, показано их реципрокное взаимодействие – повреждение терминалей дофаминовых нейронов в префронтальной коре приводит к увеличению концентрации дофамина и его метаболитов, а также плотности D2-рецепторов в стриатуме [10], а введение D1-агониста в префронтальные зоны, наоборот, приводит к уменьшению концентрации метаболитов дофамина в стриатуме [11]. В дальнейшем концепция «фронтальной гиподофаминергии» подверглась критике, так как по мере поступления новых данных стало очевидно, что патологические процессы в коре гораздо сложнее, чем простое редукционистское «ослабление дофаминовой трансмиссии» [12]. Основные терапевтические «мишени» при шизофрении в соответствии с предложенной K.Davis модернизированной дофаминовой гипотезой в упрощенном виде приведены на рис. 1.

В верхней части рисунка представлен мезолимбический дофаминовый путь, берущий начало в вентральной покрышечной области ствола мозга и направляющийся к прилежащему ядру в вентральном стриатуме. Предполагается, что гиперактивность этого дофаминового пути приводит к развитию позитивной (галлюцинаторно-бредовой) симптоматики (обозначено красным в правой части рисунка).
В нижней части рисунка представлен мезокортикальный дофаминовый путь, направляющийся из вентральной покрышечной области ствола мозга в префронтальную кору (в частности, в ее дорсолатеральный отдел). Предполагается, что гипоактивность этого пути приводит к развитию негативных и когнитивных симптомов шизофрении (обозначено синим пунктиром в правой части рисунка).
Предполагается, что классические антипсихотики (полные антагонисты D2-рецепторов) блокируют дофаминовую нейротрансмиссию в мезолимбическом пути и этим подавляют позитивные симптомы. При этом соответствующий дофаминблокирующий эффект в корковых структурах может отвечать за развитие вторичных негативных симптомов. В настоящее время не получено обнадеживающих данных о способности каких-либо лекарственных средств (например, частичных D2/3-агонистов, D1-агонистов) редуцировать первичную негативную симптоматику. Тем не менее есть данные о дезингибирующем и прокогнитивном эффектах некоторых антипсихотиков II поколения – частичных агонистов D2/3-рецепторов, средств с серотонинергическим эффектом и др. Обзор данной тематики не входит в задачи настоящей публикации.
В 2000-х годах коллектив британских авторов под руководством O.Howes и S.Kapur [14] проанализировал большой объем клинических, нейровизуализационных, нейропсихологических, генетических и других данных, опубликованных за последние 15 лет, и представил обновленную (третью) версию дофаминовой гипотезы. В первую очередь переработке подверглась «гипердофаминергическая» часть гипотезы, связанная с продуктивными симптомами. Во-первых, фокус внимания сместился с постсинаптических D2-рецепторов на пресинаптические механизмы регуляции дофаминового обмена, а именно пресинаптические синтез, выброс и транспорт этого нейромедиатора. Предполагается, что антипсихотики не только блокируют постсинаптическую дофаминовую нейротрансмиссию, подавляя продуктивную симптоматику, но и парадоксальным образом усиливают способность к синтезу дофамина, блокируют пресинаптические D2-ауторецепторы. Вероятно, этим можно объяснить высокую тяжесть и скорость нарастания позитивной симптоматики после внезапной отмены терапии (по сравнению со спонтанной экзацербацией позитивных симптомов). Во-вторых, авторы связали описанную пресинаптическую дисрегуляцию в стриатуме с более узким понятием «психоз при шизофрении» (или «предрасположенность к психозу»), но не с шизофренией в целом как с комплексным нозологическим конструктом. Наконец, авторы интегрировали в свою модель концепцию «дисрегуляции салиенса» [15], т.е. феномен «нарушения избирательной фильтрации информации», или «синдром сверхвключаемости объектов восприятия» [16], который может лежать в основе развития продуктивной симптоматики. Кроме того, поставлена под сомнение прямая связь между «гиподофаминергией» в префронтальной коре и негативными и когнитивными симптомами. Предполагается, что когнитивные и негативные симптомы развиваются гораздо раньше психоза – они опосредуются разными медиаторными системами и нейроанатомическими областями
(в том числе префронтальной корой) и в совокупности с разными неблагоприятными факторами (генетическими, средовыми) приводят к стриарной дофаминовой дисрегуляции и манифестации психоза (рис. 2).
На рисунке схематически представлено синаптическое соединение дофаминергических нейронов в стриатуме. Предполагается, что факторы внешней среды, генетические дефекты, фронтотемпоральная дисфункция и другое приводят к усилению синтеза дофамина и его выброса в синаптическую щель. Гипердофаминергия способствует «дисрегуляции салиенса», что в свою очередь ведет к развитию психотических симптомов. Традиционные антипсихотики подавляют психоз, блокируя постсинаптические D2-рецепторы.
В 1990-х годах после начала широкого внедрения в практику антипсихотиков II поколения основополагающая роль дофаминовой нейротрансмиссии в патофизиологии шизофрении подверглась сомнению. Эталонный антипсихотик II поколения клозапин обладает мощным глобальным антипсихотическим эффектом и самым широким спектром рецепторной активности среди всех известных психотропных средств [13]. При этом клозапин и другие антипсихотики II поколения, в частности оланзапин и кветиапин, имеют достаточно слабый аффинитет к дофаминовым рецепторам. В качестве иллюстрации в таблице приведены сравнительные профили рецепторной активности клозапина (эталонного антипсихотика II поколения) и галоперидола (эталонного антипсихотика I поколения). Константа связывания Ki отражает аффинитет к рецептору (чем меньше Ki, тем выше аффинитет).

Эта особенность АПВП подтолкнула исследователей к изучению других рецепторных систем головного мозга, в частности серотониновой, каннабиноидной, системы вставочных нейронов g-аминомасляной кислоты (ГАМК), системы рецепторов N-метил-D-аспартата (НМДА), холинергической и др. В 2007 г. в ведущем научном журнале Nature Medicine была опубликована обзорная статья D.Weinberger [18] c провокационным названием «Антипсихотики прощаются с дофамином», которая была посвящена экспериментальному препарату LY2140023 – агонисту метаботропных рецепторов к глутамату mGlurR2/3. Этот препарат показал положительные результаты в пилотных исследованиях на малых группах больных, однако после получения отрицательных данных в отношении собственно антипсихотической активности в испытаниях III фазы программа по исследованию препарата была свернута компанией-изготовителем (2012 г.). При планировании новых исследований «недофаминовых антипсихотиков» многие исследователи стали делать упор на отдельных доменах симптоматики, использовать дизайн адъювантной (дополнительной) терапии и изучать ограниченные когорты пациентов (например, пациентов с преобладанием негативных симптомов).
На 26-м Конгрессе Европейской коллегии нейропсихофармакологии (European College of Neuropsychopharmacology – ECNP), прошедшем 5–9 октября 2013 г. в Барселоне (Испания), представлено большое число сообщений о преклинических и клинических исследованиях новых лекарственных средств с разным механизмом действия. В задачи настоящей публикации не входил подробный обзор результатов отдельных, подчас еще не завершенных терапевтических исследований. Ниже приведены краткое содержание основных докладов и ряд важных теоретических соображений, представленных на симпозиуме «За пределами дофаминовой блокады – новые перспективы в терапии шизофрении» под председательством M.Davidson (Израиль) и А.Meyer-Lindenberg (Германия) 7 октября 2013 г.
В обзорном докладе «Парадигма единого заболевания служит препятствием для разработки новых методов лечения шизофрении» (C.Arango, Испания) автор сконцентрировал внимание аудитории на современных диагностических концепциях шизофрении. В современных диагностических критериях среди всех доменов психопатологической симптоматики особое внимание уделяется продуктивным симптомам. При этом показано, что негативные и когнитивные нарушения имеют сложные (в том числе недофаминовые) нейробиологические механизмы, не имеют очевидной связи с психозом и имеют большую прогностическую ценность в отношении социального и клинического исхода. В течение последних 60 лет разработано большое число антипсихотиков (в первую очередь традиционных дофаминовых антагонистов – антипсихотиков I поколения), эффективно подавляющих психотические симптомы. Антипсихотики II поколения имеют более благоприятный профиль безопасности и переносимости, однако не имеют преимуществ в отношении позитивных симптомов, а их эффективность в других сферах симптоматики неочевидна. Автор утверждает, что для разработки эффективных терапевтических инструментов нужны новые диагностические парадигмы, стоящие на стыке клинических и фундаментальных нейронаук. Лишь в последнее десятилетие стали появляться данные об эффективных недофаминовых средствах с прицельным воздействием на негативные и когнитивные симптомы. Наиболее перспективными для изучения представляются следующие лекарственные средства: глутаматергические препараты (метаботропные агонисты глутамата, ингибиторы транспортера глицина, средства, влияющие на синтез и высвобождение D-серина и глутатиона, и др.), холинергические средства, нейростероиды, окситоцин, миноциклин (тетрациклиновый антибиотик, способный подавлять неспецифическое воспаление в головном мозге) и парциальные дофаминовые агонисты. Автор полагает, что психиатрам нужно взять пример с «соматической» медицины, в которой многие лекарственные средства имеют таргетное (направленное) действие на отдельные звенья патогенеза, т.е. симптомы-мишени вне строгих рамок отдельных нозологических категорий. Кроме того, пристальное внимание стоит обратить на этапность лечения и изучить возможность лечения «уязвимости к психозу», т.е. состояний с высоким риском развития психоза (вторичная профилактика шизофрении).
Доклад «Новые механизмы лечения негативных симптомов – первоначальный успех и почва для дальнейших исследований» M.Berk (Австралия) был посвящен адъювантной терапии с помощью N-ацетилцистеина. Автор привел ряд доказательств «воспалительной гипотезы шизофрении», а именно сведения о том, что в патогенезе шизофрении (в первую очередь негативных симптомов) могут участвовать процессы свободнорадикального окисления, воспалительная митохондриальная дисфункция и нарушение функции нейтрофилов. N-ацетилцистеин является предшественником глутатиона, модулирует обмен глутамата, обладает противовоспалительными свойствами, предотвращает митохондриальную дисфункцию, усиливает нейрогенез и выживаемость нейронов при стрессе. В рандомизированных контролируемых исследованиях показана ограниченная эффективность N-ацетилцистеина при биполярном расстройстве, аутизме, никотиновой и других зависимостях, депрессии и навязчивостях. Автор привел результаты рандомизированного контролируемого исследования на относительно крупной популяции больных шизофренией (n=140), в котором N-ацетилцистеин в дозе 1 г/сут использовался в качестве адъювантного средства к имеющейся стабильной терапии антипсихотиком [19]. Умеренная эффективность показана по негативной подшкале Шкалы позитивных и негативных синдромов (Positive and Negative Syndrome Scale – PANSS), общему баллу PANSS и разным конечным точкам социального и личностного функционирования (социальное взаимодействие, мотивация, реактивность настроения, самообслуживание). В отношении стойких психопатологических феноменов, а именно слуховых галлюцинаций, бредовых идей величия, социальной изоляции и дистимии, не показано значимых межгрупповых различий. При этом показана хорошая переносимость терапии и некоторая редукция акатизии в группе N-ацетилцистеина. Имеющиеся данные о роли глутамата и N-ацетиласпартата в «воспалительной гипотезе шизофрении» позволяют предполагать, что N-ацетилцистеин является многообещающим терапевтическим инструментом, прицельно направленным на дефицитарную симптоматику.
В докладе упомянутого выше O.Howes (Великобритания), одного из соавторов обновленной дофаминовой гипотезы, «К вопросу о разработке новых средств лечения рефрактерной шизофрении – результаты исследований позитронно-эмиссионной томографии и магнитно-резонансной спектроскопии» подчеркивалось, что при терапевтической резистентности у больных шизофренией отсутствует очевидная пресинаптическая дофаминовая патология и дополнительная дофаминовая блокада неэффективна. Также приведены краткие сведения об усилении глутаматергической нейротрансмиссии в системе вставочных ГАМКергических нейронов (клеток-канделябров) и связанном ослаблении глутаматергической нейротрансмиссии в пирамидальных клетках. Подчеркивается, что в настоящее время неизвестно, является ли этот феномен компенсаторным механизмом или звеном патогенеза шизофрении. Кроме того, в настоящее время неизвестно, играет ли какую-либо роль в развитии психоза взаимосвязь между глутаматергическими и дофаминергическими системами. Предполагается, что глутаматергическая дисфункция может лежать в основе терапевтической резистентности и стойкой дефицитарной симптоматики. Автор представил результаты нейровизуализационного исследования в группах больных с хорошим реагированием на терапию (n=15), больных с рефрактерными (резистентными) симптомами (n=15) и здоровых добровольцев (n=15), а также результаты исследования больных с продромальными признаками психоза (n=16) с последующим 3-летним наблюдением. Все участники обследовались методами позитронно-эмиссионной томографии с использованием радиоизотопа [18F]-ДОФА (для определения Ki – в качестве показателя пресинаптической способности к синтезу дофамина) и магнитно-резонансной спектроскопии для регистрации глутаматергической активности. Обнаружено, что в группе резистентных больных имеет место значительно более низкая пресинаптическая способность к синтезу дофамина по сравнению с группой больных, хорошо реагирующих на терапию: средняя Ki (среднеквадратическое отклонение) = 0,013 (0,0013) и 0,014 (0,0014) соответственно; размер эффекта = 1,11; р=0,02. Кроме того, показано значительное увеличение соотношения Glu/Cr1 в группе резистентных больных. В исследовании пациентов с продромальными симптомами показано изменение интегрального показателя соотношения глутаматергической и дофаминергической активности между группой пациентов, у которых впоследствии развился психоз, и контрольной группой (r=-0,6; p=0,03 в сравнении с r=0,04; p=0,9 соответственно). Усиление способности к синтезу дофамина в этом исследовании коррелировало с более высокой тяжестью субклинических бредовых симптомов (F=4,0; p<0,05). Полученные данные свидетельствуют о наличии «двусторонней» связи между дофаминергическими и глутаматергическими нарушениями и являются почвой для будущих исследований, направленных на выявление разных нейробиологических подтипов шизофрении.
В докладе D.Hilt (сотрудница фармкомпании из США) «Агонисты никотиновых a7-рецепторов в качестве прокогнитивной терапии – доказательство концепции и будущие исследования» приведены сведения о прокогнитивных эффектах нового препарата EVP-6124, агониста a7-никотиновых рецепторов к ацетилхолину (N-A7A). В этом относительно крупном (n=319) рандомизированном контролируемом исследовании IIb фазы также использован дизайн адъювантной терапии – добавление двух разных доз (0,3 и 1 мг) прокогнитивного агента EVP-6124 к существующей стабильной терапии антипсихотиком. В качестве мер оценки использовался балл OCI по общему когнитивному индексу, нейропсихологическая батарея MATRICS Consensus Cognitive Battery (MCCB), подшкалы PANSS и шкала оценки функций, связанных с когнитивными нарушениями при шизофрении SCoRS. Представлены положительные результаты: в группе 0,3 мг EVP-6124 отмечалось значительное преимущество над плацебо по показателю OCI (р=0,05), в обеих группах активной терапии отмечалось небольшое преимущество по общему баллу MCCB (p=0,009). В группе 1 мг активного препарата также отмечалось преимущество над плацебо по негативной подшкале PANSS (р=0,028), а также по функциональному показателю SCoRS (p=0,065). Получив обнадеживающие результаты, авторы исследования запустили III фазу клинического испытания этого препарата.
На момент подготовки настоящей публикации на веб-сайте clinicaltrials.gov (база данных клинических исследований Национальных институтов здравоохранения США) зарегистрировано 146 продолжающихся терапевтических исследований шизофрении 0, I, II и III фазы, при этом 113 из них – это фармакотерапевтические исследования. Среди них 21 исследование посвящено уже зарегистрированным антипсихотикам II поколения (луразидон, азенапин, илоперидон, палиперидон, рисперидон, арипипразол), применяемым по новым показаниям. 92 исследования представляют собой преклинические и клинические исследования экспериментальных молекул с разным механизмом действия (ABT-126, 3-2,4-диметоксибензилиден, ALKS 9072, AQW051, DAR-100A, DMXB-A-SR, EVP-6124, LY500307, MP-214, NW-3509a, брексипразол, элтопразин и др.) в виде монотерапии и адъювантной терапии, а также известных лекарственных и психоактивных веществ и пищевых добавок (каннабидиол, D-серин, саркозин, окситоцин, симвастатин, фосфатидилхолин, инсулин и др.) в виде адъювантной терапии в разных клинических сценариях шизофрении. Эти данные являются приближенными (в поиск не вошли недавно завершенные и не зарегистрированные в США исследования), однако они дают представление об общей картине, которая является скорее оптимистической. В связи с высокой длительностью и стоимостью разработки и внедрения психотропных средств строгими требованиями контролирующих органов, а также низкой вероятностью регистрации молекул некоторые фармацевтические компании в течение последних 3–5 лет сворачивают свои «психотропные» направления. Это привело к тому, что многие специалисты стали говорить о глубоком упадке и стагнации в отрасли. Такого подхода придерживается, к примеру, бывший директор Национального института психического здоровья США (National Institute of Mental Health) S.Hyman [20]. Многочисленные сообщения 26-го Конгресса Европейской коллегии нейропсихофаркологии и приведенные выше данные показывают, что интерес исследователей и фармкомпаний к поиску новых средств лечения шизофрении отнюдь не угас. Некоторые изучаемые в настоящее время молекулы (например, брексипразол, карипразин) разработаны с учетом обновленной дофаминовой гипотезы шизофрении (парциальный агонизм в отношении D2/3-рецепторов, действие на пресинаптические дофаминовые рецепторы и др.). Предполагаемая эффективность других молекул опосредуется их серотонинергическим, глутаматергическим, холинергическим, ГАМКергическим и другими эффектами. Имеющиеся данные о новых лекарственных препаратах пока не имеют большого практического значения, и в настоящее время не зарегистрировано ни одного антипсихотика, имеющего полностью недофаминовый механизм действия. Однако можно ожидать, что в ближайшие 10–20 лет арсенал практикующего психиатра расширится и станет более «гибким» (т.е. появятся препараты, направленные на конкретные домены симптоматики), что в конечном счете повысит качество оказания помощи психически больным.
Благодарности
Авторы выражают благодарность компании «Сервье» в лице доктора F.Camus, секретаря V.Ribeaux и главного менеджера Д.П.Морозова, а также куратору образовательного проекта WPA-Servier, региональному представителю Всемирной психиатрической ассоциации в Зоне 10 «Восточная Европа» – профессору П.В.Морозову за возможность посещения 26-го Конгресса Европейской коллегии нейропсихофармакологии.Сведения об авторах
Алфимов Павел Викторович – мл. науч. сотр. отд. терапии психических заболеваний ФГБУ Московский научно-исследовательский институт психиатрии Минздрава России. E-mail: pavelalfimov@yandex.ruСимонян Ваган Гагикович – зав. клиникой первого психотического эпизода Психиатрического медицинского центра Минздрава Республики Армении. E-mail: simonyanvahan@yahoo.com
Список исп. литературыСкрыть список1. Delay J, Deniker P, Harl JM. Therapeutic use in psychiatry of phenothiazine of central elective action (4560 RP). Ann Med Psychol (Paris) 1952; 110: 112–7.
2. Carlsson A, Lindqvist M, Magnusson T. 3,4-Dihydroxyphenylalanine and 5-hydroxytryptophan as reserpine antagonists. Nature 1957; 180: 1200.
3. Carlsson A, Lindqvist M. Effect of chlorpromazine or haloperidol on the formation of 3-methoxytyramine and normetanephrine in mouse brain. Acta Pharmacol Toxicol (Copenh) 1963; 20: 140–4.
4. Lieberman JA, Kane JM, Alvir J. Provocative tests with psychostimulant drugs in schizophrenia. Psychopharmacology (Berl) 1987; 91: 415–33.
5. Seeman P, Lee T, Chau-Wong M, Wong K. Antipsychotic drug doses and neuroleptic/dopamine receptors. Nature 1976; 261: 717–9.
6. Seeman P, Lee T. Antipsychotic drugs: direct correlation between clinical potency and presynaptic action on dopamine neurons. Science 1975; 188: 1217–9.
7. Creese I, Burt DR, Snyder SH. Dopamine receptor binding predicts clinical and pharmacological potencies of antischizophrenic drugs. Science 1976; 192: 481–3.
8. Snyder SH. The dopamine hypothesis of schizophrenia: focus on the dopamine receptor. Am J Psychiatry 1976; 133: 197–202.
9. Davis KL, Kahn RS, Ko G, Davidson M. Dopamine in schizophrenia: a review and reconceptualization. Am J Psychiatry 1991; 148: 1474–86.
10. Pycock CJ, Kerwin RW, Carter CJ. Effect of lesion of cortical dopamine terminals on subcortical dopamine receptors in rats. Nature 1980; 286: 74–6.
11. Scatton B, Worms P, Lloyd KG, Bartholini G. Cortical modulation of striatal function. Brain Res 1982; 232: 331–43.
12. Davidson LL, Heinrichs RW. Quantification of frontal and temporal lobe brain-imaging findings in schizophrenia: a meta-analysis. Psychiatry Res 2003; 122: 69–87.
13. Stahl SM. Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. Cambridge University Press, 2008.
14. Howes OD, Kapur S. The Dopamine Hypothesis of Schizophrenia: Version III – The Final Common Pathway. Schizophr Bull 2009; 35 (9): 549–62.
15. van Os J. A salience dysregulation syndrome. Br J Psychiatry 2009; 2 (194): 101–3.
16. Мосолов С.Н. Некоторые актуальные теоретические проблемы диагностики, классификации, нейробиологии и терапии шизофрении: сравнение зарубежного и отечественного подходов. Журн. неврологии и психиатрии им. С.С.Корсакова. 2010; 6: 4–11.
17. Collier DA, Arranz MJ, Osborne S et al. Clozapine response and genetic variation in neurotransmitter receptor targets. In: Pharmacogenetics of Psychotropic Drugs. Ed. by B.Lerer. Cambridge University Press, 2004.
18. Weinberger DR. Schizophrenia drug says goodbye to dopamine. Nat Med 2007; 13 (9): 1018–9.
19. Berk M, Copolov D, Dean O et al. N-acetyl cysteine as a glutathione precursor for schizophrenia – a double-blind, randomized, placebo-controlled trial. Biol Psychiatry 2008; 64 (5): 361–8.
20. Hyman SE. Revolution stalled. Sci Transl Med 2012; 4 (155).
21. Matthysse S. Antipsychotic drug actions: a clue to the neuropathology of schizophrenia? Fed Proc 1973; 32: 200–5.
25 сентября 2014
Количество просмотров: 4114

